使用连续生理信号预测六分钟步行试验过程中的不良事件的方法及其装置
文献发布时间:2024-04-18 19:53:33
技术领域
本申请涉及机器学习,尤其涉及使用连续生理信号预测六分钟步行试验过程中的不良事件的方法及其装置。
背景技术
六分钟步行试验(6MWT)是一种次极限的、简单的、低成本的、行之有效的运动测试,用于获取中度至重度心肺疾病患者的功能能力(American Thoracic Society,2002,Solway et al.,2001)。六分钟步行距离(6MWD)是临床试验的关键观察指标之一,并可以作为心肺疾病患者诊断、预后和生存的预测指标,如慢性阻塞性肺疾病(COPD)(Meena etal.,2020,Dajczman et al.,2015,Casanova et al.,2008)、间质性肺疾病(Brown andNathan,2018)、肺动脉高压(Gadre et al.,2017,Farber et al.,2015)和肺移植(Castleberry et al.,2017)。
尽管6MWT已被作为心肺功能评估标准程序的一部分,并被认为对大多数病人是安全的,但是,鉴于呼吸系统疾病的复杂性和疾病的严重性,6MWT期间的不良事件仍有潜在的危险性,应引起关注。一些研究关注了6MWT期间的不良事件。
Jenkins and Cecins(2011)建议修改美国胸科协会(ATS)6MWT指南,在6MWT期间连续监测SpO2,因为氧饱和度可能会增加发生心脏或其他并发症的可能性。3.9%的急性心肌梗死(AMI)患者发生心绞痛、血压下降或室性心动过速(Diniz et al.,2017)。Roberts等人(2015)报告说,与没有发生不良事件的病人相比,发生不良事件的病人的生活质量和情绪评分较低。严重的不良事件可能导致住院患者死亡等危及生命的事件发生,或延长现有的住院时间(Morris et al.,2015)。因此,能够简单、快速地预测不良事件尤为重要。
然而,传统上,不良事件的发生主要是通过医务人员对病人表现的观察和病人的主诉来判断的。即使是在6MWT期间监测血氧饱和度,ATS指南(2002)和一些研究(Douwes etal.,2016,Roberts et al.,2015)也只是间断性地使用血氧仪进行测量。这种主观的判断和短暂的生理参数数据监测对快速识别不良事件的帮助不大。生理参数的变化可以反映人体状态的变化,甚至在不良事件发生前几个小时(Yilmaz et sl.,2020,Leenen et al.,2020,Brekke et al.,2019)。Rodríguez(2017)报道称,6MWT后1分钟心率恢复(HRR1)是COPD急性加重(AECOPD)的独立预测因素。Morita et al.(2018)报道,HRR1可能反映患者的运动能力、生活方式和功能状态。Mazzuco et al.(2017)报告称,心率变异性(HRV)可用于COPD的功能评估。
可穿戴式生理参数监测系统的出现为6MWT过程中生理参数的连续、无创动态监测提供了技术手段。
发明内容
为了减少患者在6MWT期间的风险,并提醒临床医生注意高危人群,本研究旨在通过可穿戴设备监测的连续动态生理参数预测6MWT期间不良事件的发生。
本申请的使用连续生理信号预测六分钟步行试验过程中的不良事件的方法,其包括:机器学习模型;所述机器学习模型为经过训练的模型,其通过自受试者的连续生理信号获得的输入特征计算,预测六分钟步行试验过程中的不良事件的发生概率;所述不良事件包括:呼吸困难、心悸、头晕、胸痛或胸闷、疲劳和低血氧。
优选地,所述机器学习模型选自:LightGBM、Logistic Regression、SVC linear、SVC poly、XGBoost、Random forest、SVC rbf。
优选地,所述机器学习模型为LightGBM,该机器学习模型的输入特征包括:
Spo2一分钟血氧下降值(SpO2_decrease1)、信号向量幅度(SVM)、SpO2一分钟的均值(SpO2 mean)、心率斜率(HR intercept)、6MWT开始后一分钟内心率最大值(HR peak)、SpO2下降面积(SpO2 DA)、6MWT前两分钟静息阶段的呼吸率(RR rest)、6MWT前两分钟静息阶段的心率(HR rest)、6MWT前两分钟静息阶段的高频功率(HF)、6MWT开始后一分钟内最低心率(HR min)、6MWT前两分钟静息阶段逐心搏的标准差(HR rest std)、正常R峰之间间隔的中值(NNI median)、6MWT开始后一分钟内心率增长值(HR increase 1)、6MWT前两分钟静息阶段的总功率(Total power)、6MWT前两分钟静息阶段的心脏迷走神经指数(CVI)、正常R峰之间间隔的均值(NNI mean)。
优选地,所述输入特征的重要性由高到低的次序为:Spo2一分钟血氧下降值(SpO2_decrease1)、信号向量幅度(SVM)、SpO2一分钟的均值(SpO2mean)、心率斜率(HRintercept)、6MWT开始后一分钟内心率最大值(HR peak)、SpO2下降面积(SpO2 DA)、6MWT前两分钟静息阶段的呼吸率(RR rest)、6MWT前两分钟静息阶段的心率(HR rest)、6MWT前两分钟静息阶段的高频功率(HF)、6MWT开始后一分钟内最低心率(HR min)、6MWT前两分钟静息阶段逐心搏的标准差(HR rest std)、正常R峰之间间隔的中值(NNI median)、6MWT开始后一分钟内心率增长值(HR increase 1)、6MWT前两分钟静息阶段的总功率(Totalpower)、6MWT前两分钟静息阶段的心脏迷走神经指数(CVI)、正常R峰之间间隔的均值(NNImean)。
本申请的使用连续生理信号预测六分钟步行试验过程中的不良事件的装置,其包括计算单元,所述计算单元执行上述所述的方法来预测六分钟步行试验过程中的不良事件。
优选地,所述连续生理信号通过穿戴式生理采集设备获得。
优选地,所述生理采集设备为柔性背心;所述柔性背心包括心电电极,用于采集受试者的心电信号;所述柔性背心包括两个弹性带,分别设置在受试者的胸部和腹部,使用呼吸诱导体积描记技术记录胸部和腹部的呼吸运动;所述柔性背心上还设置有三轴加速度传感器。
优选地,所述计算单元为PAD;
所述柔性背心包括数据盒;心电电极、弹性带、三轴加速度传感器的测量信号送至数据盒,由数据盒发送至PAD。
优选地,所述柔性背心的数据盒通过蓝牙连接有血氧仪和血压计,血氧仪和血压计的测量数据通过数据盒发送至PAD。
优选地,所述PAD用于实时显示生理信号,并提供基于连续生理信号预测六分钟步行试验过程中的不良事件的预警。
本申请基于穿戴式设备,利用连续的生理信号和机器学习模型预测6MWT中不良事件的发生,使得不良事件的发生的预测基于多种参数或特征,且不依赖医护人员的主观判断或经验,为患者提供了更多的安全性,为6MWT期间的患者监护提供了新的方法和思路。
附图说明
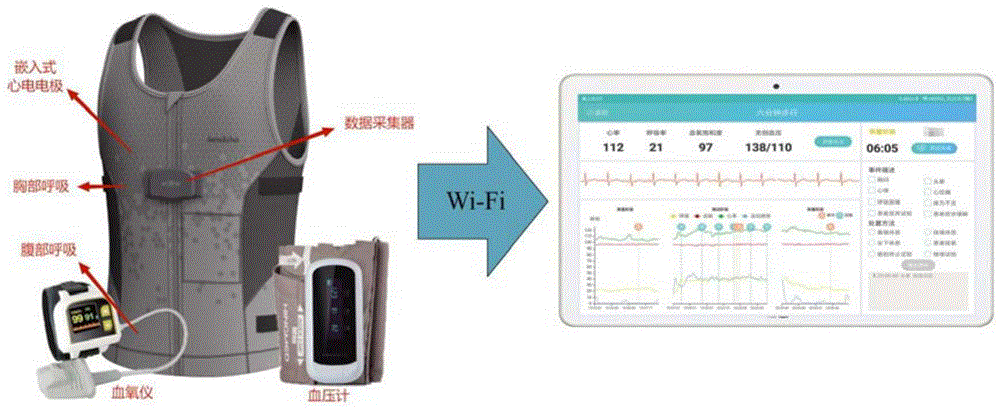
图1为数字化6MWT系统构成图;
图2为第一次不良事件发生的时间分布图;
图3为一例6MWT前、中、后患者生理参数的变化;
图4为不同机器学习模型和评分尺度下的ROC曲线;
图5为lightGBM模型中的特征重要性排名。
具体实施方式
下面,结合附图对本申请进行详细说明。
数据集构建
患者
这项多中心研究在解放军总医院、解放军总医院海南医院和中南大学湘雅第二医院进行。纳入2019年6月至2020年9月期间使用可穿戴设备进行6MWT的呼吸系统疾病患者。排除标准:(1)合并神经肌肉疾病或日常活动受限的患者。(2)信号缺失或质量差的患者以及未按方案要求完成6MWT的患者。(3)1个月内有不稳定型心绞痛或心肌梗死患者。
这项研究由医学伦理委员会批准(伦理学编号:S2018-095-01,临床试验编号:ChiCTR-POC-17010431)。本研究共纳入578例患者。患者特征如表1所示。平均年龄62.2±11.1岁。平均体重指数为23.1±3.9。有39.4%的患者患有COPD,是患者中最常见的疾病。合并高血压81例。合并冠心病38例。合并糖尿病31例。Borg疲劳评分平均为0.6±1.0分。改良医学研究委员会(MMRC)呼吸困难评分平均1.2±1.3分。
上述数据公众可以向院方申请使用。
数字化六分钟步行系统
本研究采用基于传感器的数据采集系统,实现了对6MWT生理信号的全程监测和记录。该系统由两个关键组件组成,如图1所示:柔性背心和智能终端设备(即手持PAD)。柔性背心是北京海思瑞格科技有限公司的可穿戴设备SensEcho,能够监测心电、呼吸波、三轴加速度、血氧饱和度和血压。生理信号可以通过Wi-Fi传输到PAD并实时显示,能够提供心电、呼吸波和三轴加速度信号,并可以与血压监测仪、血氧仪等第三方设备进行通信。柔性背心与心电信号电极相连,可采集单导联心电信号,在胸部和腹部位置分别嵌入两个弹性带,使用呼吸诱导体积描记(RIP)技术记录胸部和腹部的呼吸运动。数据采集器中内置了三轴加速度传感器。分别用血氧仪和血压计测量血氧饱和度和血压。
可在终端设备上实时显示生理信号,并提供基于生理信号监测的预警和手动记录缺氧、呼吸困难等不良事件的功能。此外,系统还能够通过对生理参数的综合分析,生成总结患者在6MWT中表现的报告,并将6MWT过程的整体数据上传到云端服务器。
6MWT规范流程
所有医院均采用相同的6MWT方案。大约在6MWT前10分钟,患者戴上SensEcho设备休息。医护人员打开PAD上的应用程序,连接终端,远程测量心率、呼吸频率、血压和血氧饱和度等基本生理参数。同时,指导患者在PAD上完成Borg疲劳评分、MMRC呼吸困难评分。
6MWT是按照建议的ATS方案在一条30米长的平坦走廊内进行的。一旦患者开始在起跑线上行走,计时器就会被激活,患者应该尽可能走六分钟。每隔1分钟,PAD上的应用程序就会以标准化的方式鼓励患者。医护人员在PAD上实时观察患者的心电、呼吸和血氧饱和度,并记录圈数。如果在6MWT期间发生不良事件,事件和治疗将及时记录在PAD上。患者可以随时休息或停止测试。在6MWT结束时,要求患者停下来靠墙休息2min,然后取下装置,记录6MWD。
不良事件
根据ATS指南和以前的研究,在6MWT期间,诸如无法忍受的呼吸困难、心悸、头晕、胸痛或胸闷、疲劳和低血氧等症状被视为不良事件(Roberts et al.,2015,Jenkins andCecins,2011,ATS,2002)。73例患者(占总队列的12.6%)发生了不良事件。10名患者因无法忍受的呼吸困难或氧疗而提前终止了测试。如表1所示,最常见的不良事件是无法忍受的呼吸困难(66例患者)。所有患者的平均步行距离为(413.3±101.3)m,发生不良事件患者的平均步行距离为(278.1±132.1)m,无不良事件患者的平均步行距离为(444.0±90.9)m。不良事件在患者中的时间分布如图2所示。可以看到,大约95%的不良事件发生在6MWT开始后1分钟。仅有4例患者在1分钟内发生不良事件,不良事件为无法忍受的呼吸困难。
图3展示了一个病人在6mwt过程中生理信号的趋势和不良事件的发生。在步行开始后,病人的心率和呼吸频率上升,而氧饱和度迅速下降。患者共发生了2次不良事件,且在第二次不良事件中出现了严重的呼吸困难,并接受了氧气治疗。
数据预处理和特征提取
首先,对原始信号进行了平滑、过滤和去除异常值。然后,用汉密尔顿(Hamiltomand Tompkins,1986)的方法来检测心电信号的R峰。Khodadad的方法(Khodadad et al.,2018)被用来检测呼吸信号的峰值和谷值。
55个特征共包括5类,分别是心电信号特征、呼吸信号特征、SpO2特征、运动幅度特征和人口统计特征。我们选取6MWT前两分钟的静息段数据,计算平均静息心率(HR rest)、呼吸频率(RR rest)和SpO2(SpO2 rest)。计算了不良事件发生的时间分布。根据这一分布,选择适当的时间长度来计算6MWT期间的特征。我们计算了所选时间段内的最大心率(HRpeak)、最大呼吸频率(RR peak)、最小SpO2(SpO2 min)以及平均心率(HR avg)、呼吸频率(RR avg)和SpO2(SpO2 avg)。然后,我们计算静息和6WMT过程中的相应特征的差值。
此外,心率斜率和心率截距分别定义为用最小二乘法拟合所选的6MWT过程的心率的直线的斜率和截距。氧饱和度下降面积被定义为氧饱和度的基线和6MWT过程中血氧之差的总和(Flaherty et al.,2006)。6MWT前的心率变异性特征也被计算出来。人口统计学特征包括年龄、性别和BMI。运动幅度特征是通过三轴加速度信号计算的,将原始x、y和z加速度数据转换为信号向量幅度(SVM)数据(Bidargaddi et al.,2007)。
/>
n是采样率和记录时间的乘积。x
模型构建与评估
首先,基于逻辑回归的递归特征消除法(通过L1和L2正则化)被用来选择最佳特征以防止过拟合。从所有特征开始构建逻辑回归模型,通过模型的系数来计算特征的重要性,按照重要程度对特征进行排序,并删除得分最低的特征,在剩余的特征集上重新训练模型,并重新计算每个特征的重要性得分。重复以上步骤,选择使得模型性能最佳的特征组合。特征筛选算法反复训练模型并删除不必要的特征,可以减少特征的维度,并提高模型的准确性和泛化能力。
结合静止期和运动期的特点,当选择16个特征时,AUC达到最大值0.874。该16个特征为重要性排名前16的特征,如图5所示,它们是:
Spo2一分钟血氧下降值(SpO2_decrease1)、信号向量幅度(SVM)、SpO2一分钟的均值(SpO2 mean)、心率斜率(HR intercept)、6MWT开始后一分钟内心率最大值(HR peak)、SpO2下降面积(SpO2 DA)、6MWT前两分钟静息阶段的呼吸率(RR rest)、6MWT前两分钟静息阶段的心率(HR rest)、6MWT前两分钟静息阶段的高频功率(HF)、6MWT开始后一分钟内最低心率(HR min)、6MWT前两分钟静息阶段逐心搏的标准差(HR rest std)、正常R峰之间间隔的中值(NNI median)、6MWT开始后一分钟内心率增长值(HR increase 1)、6MWT前两分钟静息阶段的总功率(Total power)、6MWT前两分钟静息阶段的心脏迷走神经指数(CVI)、正常R峰之间间隔的均值(NNI mean)。
6MWT前两分钟静息阶段的高频功率(HF)、6MWT前两分钟静息阶段的总功率(Totalpower)和6MWT前两分钟静息阶段的心脏迷走神经指数(CVI)为心率变异性参数,具体计算方法参见Python-hrvanalysis库。
信号向量幅度(SVM)(Bidargaddi et al.,2007)计算公式如下:
其中,n是采样率和记录时间的乘积。x
心率斜率(HR intercept),定义为用最小二乘法拟合所选的6MWT过程的心率的直线的斜率;
SpO2下降面积(SpO2 DA),定义为氧饱和度的基线和6MWT过程中血氧之差的总和(Flaherty et al.,2006);
基于Light Gradient Boosting Machine(LightGBM)算法来训练模型。Light GBM是基于梯度提升树(Gradient Boosting Decision Tree,GBDT)框架的算法。与其他基于GBDT框架的算法相比,具有速度快、内存占用少且泛化能力强等优点。该类算法属于集成学习,其工作机制为:通过多轮迭代生成多个弱学习器,每一轮的弱学习器都在拟合上一轮弱学习器的残差,逐步的完成任务。最终将全部弱学习器集成为一个强学习器,其中弱学习器通常采用分类回归树。
设训练具有T棵子树的Light GBM模型,给定数据集D={(x
L(y,f
用损失函数求解各个样本的负梯度,将该梯度作为样本的新标签。然后,由新的弱学习器去拟合新标签。第t轮第i个样本的负梯度r
利用第t轮的弱学习器去拟合(x
其中,Rtj表示第t个弱学习器对应的叶子节点区域,j=1,2,…,J,J为叶子节点的个数;c是使损失函数最小化的常数值。本轮的弱学习器拟合函数如下式所示:
其中I(x∈Rtj)为指示函数,当x∈Rtj时,该函数的值为1,反之,该函数的值为0。最终对强学习器进行更新,完成本轮的迭代,其表达式如下式所示:
通过5折交叉验证提高模型的泛化性能,首先将数据划分为大致相等的5部分,接下来训练一系列模型。使用第1折作为测试集,第2-5折作为训练集来训练第一个模型,然后在1折上评估精度,之后构建另一个模型,使用2、3、4、5折作为测试集,其他折作为训练集继续重复这一过程,最后我们得到5个精度值,取5次结果的平均值作为模型的精度。5折交叉验证中每个样例都会刚好在测试集中出现1次,因此模型需要对数据集中的所有样本都很好才能让所有交叉验证得分及其平均值都很高,比单次划分训练集和测试集的方法更加稳定、全面。通过计算ROC曲线下的面积(AUC)、敏感性(SN)、特异性(SP)、正似然比(+LR)、负似然比(-LR)等5个指标来评估模型的预测能力。作为比较,我们还计算了其他机器学习模型以及量表对不良事件的预测能力,包括Logistic回归、支持向量分类(SVCs)、随机森林、eXtreme Gradient Boosting(XGBoost)、mMRC、6MWT前的Borg。通过ROC曲线和AUC评估了模型和量表的预测能力。同时还提供了机器学习模型之间的比较。图4显示了使用Logistic回归、SVCS、随机森林、LightGBM和XGBoost的机器学习模型与使用MMRC和Borg的Scale进行比较的ROC曲线。ROC曲线是5次交叉验证的平均结果。如图4所示,机器学习模型的表现优于传统规模。在模型中,性能最好的机器学习模型是LightGBM,平均AUC值为0.874,而MMRC量表和Borg量表的AUC值最低,分别为0.733和0.656。表2给出了不同机器学习模型的5重交叉验证分类结果。LightGBM的性能稳定,是机器学习模型中最好的,具有最高的AUC和最小的标准差。正似然比最高的模型是SVC(线性核),负似然比最低的模型是LightGBM。
疾病和人体的多因素复杂性使得预测6MWT期间的不良事件具有挑战性。据我们所知,许多研究都集中在6MWD的预测以及6MWD与疾病的关系上。然而,很少有研究将连续的生理参数与易于测量的人口统计学变量相结合来预测不良事件,这可能是由于缺乏强大的工具。可穿戴的生理参数监测设备和可解释的人工智能相结合,可以帮助解决这些问题。机器学习使用算法来识别数据中的模式,然后使用这些模式来创建可以进行预测的数据模型。随着数据和经验的增加,机器学习的结果更准确—就像人类如何通过更多的练习来提高一样。这项研究为患者在6MWT期间是否需要额外的医疗帮助提供了一个辅助决策支持工具。同时,本研究也为评估患者在6MWT期间的安全性提供了新的思路和方法。
在这项研究的大样本中发现,第一分钟后开始就有高比例的不良事件发生是一个客观事实,如图2所示,超过95%的患者在1分钟后发生不良事件。至于原因,六分钟步行测试(6MWT)是一种次极量运动测试,通过测量六分钟步行的总距离来评估功能能力。第一分钟的活动水平可能不足以引起不良事件。另一方面,生理参数的变化可能先于症状的出现(Brekke et al,2019)。
量表是评估患者身体状况最常用的方法。然而,量表方法容易受到个体主观性的影响。生理参数可以用来客观、定量地评价身体状态。如图3所示,生理参数在6MWT和不良事件前后发生了显著变化。如图4所示,机器学习和生理参数相结合的预测能力明显好于量表的预测能力。为了进一步完善6MWT评估,可以建立一个类似于NEWS评分(国家预警评分,用于识别急性不稳定疾病的高危患者)的基于生理参数的评估量表,作为以后的研究方向。
在选择的特征中,最常见的是与心率有关的特征和心率变异特征。心率和心率变异受交感神经和副交感神经的调节,受身体的自主控制较少,因此能更准确地反映身体状态的变化(Acharya et al.,2006)。而且静息心率在心肺功能良好的人中比较低,所以静息心率也是预测不良事件的重要指标。一分钟内心率的增加代表了心脏对运动的反应能力(Cannière et al.,2020)。心率截距是静息心率的另一种表现形式,其优点是受异常值的影响较小。至于心率变异,总功率密度谱是一个重要的预测指标,高频率的心率变异反映了由于副交感神经(迷走神经)活动引起的逐心跳的快速变化(Ziemssen and Siepmann,2019)。慢性呼吸道疾病患者,尤其是COPD和特发性肺纤维化(IPF)患者,呼吸频率增加(McKinstry et al.,2018,Schertel et al.,2017)。因此,RRrest也是心肺功能的一个反映。然而,令我们惊讶的是,行走过程中呼吸频率的变化不是一个重要的预测因素。尽管有研究表明,无症状的运动性低氧血症与6MWT期间并发症或不良事件的发生率增加无关(Afzal et al.,2018,Roberts et al.,2015),但在我们的研究中,氧饱和度下降值和氧饱和度下降面积仍然是不良事件的重要预测因素。
目前,6MWT已广泛应用于临床。然而,整个6MWT过程呈现出以下风险和缺陷。首先,6MWT大多是在手术后或患有严重心肺疾病的患者中进行的,这给测试带来了一定的风险。由于在整个测试过程中缺乏客观监测,这种风险将增加(Morris et al.,2015)。其次,随着信息技术的高度发展,用单一指标(6MWD)来评估患者的心肺功能,不可避免地会遗漏大量高价值的信息。此外,6MWD对方法极其敏感(Agarwala and Salzman,2020),并且相同的6MWD评估方法和评级标准可能不适用于不同的地区和人群(Dourado,2011)。据报道,巴西国内和国外在6MWT上的个人表现仍然存在差异,有必要为每个人口和种族群体提供具体的计算和评估方法(Dourado,2011)。因此,基于数字化6MWT系统尤为重要。可穿戴式生理监测系统的出现,极大地方便了6MWT的应用,保证了测试的安全性,充分利用了数据。此外,基于传感器的6MWT为患者提供了一种个性化的心肺功能评估方法。
可穿戴设备的一个优势是可以在日常生活中提供移动的、无处不在的健康监测。本文提出的模型可以应用于日常生活监测,特别是识别不良事件的高危人群,因为他们的生活质量和情绪得分更差(Roberts et al.,2015)。除了6MWT期间的不良事件外,关于6MWT期间的生理参数与其他情景下不良事件的相关性的研究很少。例如,术后肺部并发症(PPC)是心脏瓣膜手术患者住院时间延长、医疗费用增加、预后不良和死亡的重要原因。尽管6MWT的结果已被证明与不良预后事件和死亡风险有关(Casanova et al.,2008),但其在预测PPC方面的应用尚未见报道。本研究对这一方向具有较高的参考价值。
总而言之,6MWT期间的不良事件可能是危险的。我们的研究使用基于传感器的6MWT系统在6MWT期间从多中心患者收集的连续生理参数来预测不良事件的发生,为患者提供了更多的安全性,为6MWT期间的患者监护提供了新的方法和思路。
表1基线特征
/>
表2基于5折交叉验证的不同机器学习模型的比较
除非另有定义,本申请中使用的所有技术和/或科学术语具有与由本发明所涉及的领域的普通技术人员通常理解的相同含义。本申请中提到的材料、方法和实施例仅为说明性的,而非限制性的。
虽然已结合具体实施方式对本发明进行了描述,在本申请的发明主旨下,本领域的技术人员可以进行适当的替换、修改和变化,这种替换、修改和变化仍属于本申请的保护范围。
参考文献
Acharya,U.R.,Joseph,K.P.,Kannathal,N.,Lim,C.M.and Suri,J.S.(2006).Heart rate variability:a review.Med Biol Eng Comput,44,1031-1051.doi:10.1007/s11517-006-0119-0
Afzal,S.,Burge,A.T.,Lee,A.L.,Bondarenko,J.and Holland,A.E.(2018).Should the 6-Minute Walk Test Be Stopped If Oxyhemoglobin Saturation FallsBelow 80%?Arch Phys Med Rehabil,99,2370-2372.doi:10.1016/j.apmr.2018.07.426
Agarwala,P.and Salzman,S.H.(2020).Six-Minute Walk Test:Clinical Role,Technique,Coding,and Reimbursement.Chest,157,603-611.doi:10.1016/j.chest.2019.10.014
American Thoracic Society.(2002).ATS Statement:Guidelines for theSix-Minute Walk Test.Am J Respir Crit Care Med,166,111-117.doi:10.1164/ajrccm.166.1.at1102
Bidargaddi,N.,Sarela,A.,Klingbeil,L.and Karunanithi,M.(2007).Detecting walking activity in cardiac rehabilitation by usingaccelerometer.2007 3rd International Conference on Intelligent Sensors,SensorNetworks and Information,555-560.doi:10.1109/ISSNIP.2007.4496903
Brekke,I.J.,Puntervoll,L.H.,Pedersen,P.B.,Kellett,J.,Brabrand,M.andPatman,S.(2019).The value of vital sign trends in predicting and monitoringclinical deterioration:Asystematic review.PLoS ONE,14,e0210875.doi:10.1371/journal.pone.0210875
Brown,A.W.and Nathan,S.D.(2018).The Value and Application of the SixMinute Walk Test in Idiopathic Pulmonary Fibrosis Ann Am Thorac Soc,12,3-10.doi:10.1513/AnnalsATS.201703-244FR
Cannière,H.D.,Corradi,F.,Smeets,C.J.P.,Schoutteten,M.,Varon,C.,Hoof,C.V.,Huffel,S.V.,Groenendaal,W.and Vandervoort,P.(2020).WearableMonitoringand Interpretable Machine Learning Can Objectively Track ProgressioninPatients during Cardiac Rehabilitation.Sensors(Basel),20,3601.doi:10.3390/s20123601
Casanova,C.,Cote,C.,Marin,J.M.,Pinto-Plata,V.,De Torres,J.P.,Aguirre-Jaime,A.,Vassaux,C.and Celli,B.R.(2008).Distance and oxygendesaturationduring the 6-min walk test as predictors of long-term mortality inpatientswith COPD.Chest,134,746-752.doi:10.1378/chest.08-0520
Castleberry,A.,Mulvihill,M.S.,Yerokun,B.A.,Gulack,B.C.,Englum,B.,Snyder,L.,Worni,M.,Osho,A.,Palmer,S.,Davis,R.D.and Hartwig,M.G.(2017).Theutility of 6-minute walk distance in predicting waitlist mortality forlungtransplant candidates.J Heart Lung Transpl,36,780-786.doi:10.1016/j.healun.2016.12.015
Dajczman,E.,Wardini,R.,Kasymjanova,G.,Préfontaine,D.,Baltzan,M.A.andWolkove,N.(2015).Six minute walk distance is a predictor of survivalinpatients with chronic obstructive pulmonary disease undergoingpulmonaryrehabilitation.Can Respir J,22,225-229.doi:10.1155/2015/280187
Diniz,L.S.,Neves,V.R.,Starke,A.C.,Barbosa,M.P.T.,Britto,R.R.andRibeiro,A.L.P.(2017).Safety of early performance of the six-minutewalk testfollowing acute myocardial infarction:a cross-sectional study.Braz JPhys Ther,21,167-174.doi:10.1016/j.bjpt.2017.03.013
Dourado,V.Z.(2011).Reference Equations for the 6-Minute Walk TestinHealthy Individuals.Arq Bras Cardiol,96,e128-138.doi:
Douwes,J.M.,Hegeman,A.K.,Van Der Krieke,M.B.,Roofthooft,M.T.,Hillege,H.L.and Berger,R.M.(2016).Six-minute walking distance and decreasein oxygensaturation during the six-minute walk test in pediatric pulmonaryarterialhypertension.Int J Cardiol,202,34-39.doi:10.1016/j.ijcard.2015.08.155
Farber,H.W.,Miller,D.P.,Mcgoon,M.D.,Frost,A.E.,Benton,W.W.andBenza,R.L.(2015).Predicting outcomes in pulmonary arterial hypertension basedon the6-minute walk distance.J Heart Lung Transplant,34,362-368.doi:10.1016/j.healun.2014.08.020
Flaherty,K.R.,Andrei,A.C.,Murray,S.,Fraley,C.,Colby,T.V.,Travis,W.D.,Lama,V.,Kazerooni,E.A.,Gross,B.H.,Toews,G.B.and Martinez,F.J.(2006).Idiopathic pulmonary fibrosis:prognostic value of changes in physiologyandsix-minute-walk test.Am J Respir Crit Care Med,174,803-809.doi:10.1164/rccm.200604-488OC
Gadre,A.,Ghattas,C.,Han,X.,Wang,X.,Minai,O.and Highland,K.B.(2017).Six-Minute Walk Test as a Predictor of Diagnosis,Disease Severity,andClinical Outcomes in Scleroderma-Associated Pulmonary Hypertension:TheDIBOSAStudy.Lung,195,529-536.doi:10.1007/s00408-017-0034-1
Hamiltom,P.S.and Tompkins,W.J.(1986).Quantitative Investigation ofQRSDetection Rules Using the MIT/BIH Arrhythmia Database.IEEE Trans BiomedEng,33,1157-1165.doi:10.1109/tbme.1986.325695
Jenkins,S.and Cecins,N.(2011).Six-minute walk test:observedadverseevents and oxygen desaturation in a large cohort of patients withchronic lungdisease.Intern Med J,41,416-422.doi:10.1111/j.1445-5994.2010.02169.x
Khodadad,D.,Nordebo,S.,Muller,B.,Waldmann,A.,Yerworth,R.,Becher,T.,Frerichs,I.,Sophocleous,L.,Van Kaam,A.,Miedema,M.,Seifnaraghi,N.andBayford,R.(2018).Optimized breath detection algorithm in electricalimpedancetomography.Physiol Meas,39,094001.doi:10.1088/1361-6579/aad7e6
Leenen,J.P.L.,Leerentveld,C.,Van Dijk,J.D.,Van Westreenen,H.L.,Schoonhoven,L.and Patijn,G.A.(2020).Current Evidence for ContinuousVitalSigns Monitoring by Wearable Wireless Devices in Hospitalized Adults:SystematicReview.J Med Internet Res,22,e18636.doi:10.2196/18636
Mazzuco,A.,Medeiros,W.M.,Souza,A.S.,Alencar,M.C.N.,Neder,J.A.andBorghi-Silva,A.(2017).Are heart rate dynamics in the transition from resttosubmaximal exercise related to maximal cardiorespiratory responses in COPD?BrazJ Phys Ther,21,251-258.doi:10.1016/j.bjpt.2017.05.002
McKinstry,S.,Pilcher,J.,Bardsley,G.,Berry,J.,Van De Hei,S.,Braithwaite,I.,Fingleton,J.,Weatherall,M.and Beasley,R.(2018).Nasal high flowtherapy andPtCO2 in stable COPD:Arandomized controlled cross-overtrial.Respirology,23,378-384.doi:10.1111/resp.13185
Meena,M.,Singh,R.,Singh,A.and Motapothula,U.(2020).Correlation of6-Minute-Walk Test with Functional Profile in Stable Patients with Copd.Chest,158,A1765.doi:10.1016/j.chest.2020.08.1543
Morita,A.A.,Silva,L.K.O.,Bisca,G.W.,Oliveira,J.M.,Hernandes,N.A.,Pitta,F.and Furlanetto,K.C.(2018).Heart Rate Recovery,Physical ActivityLevel,and Functional Status in Subjects With COPD.Respir Care,63,1002-1008.doi:10.4187/respcare.05918
Morris,N.R.,Seale,H.,Harris,J.,Hall,K.,Hopkins,P.and Kermeen,F.(2015).Serious adverse events during a 6-min walk test in patients withpulmonary hypertension.Eur Respir J,45,1179-1182.doi:10.1183/09031936.00146914
Roberts,M.M.,Cho,J.G.,Sandoz,J.S.and Wheatley,J.R.(2015).Oxygendesaturation and adverse events during 6-min walk testing in patients withCOPD.Respirology,20,419-425.doi:10.1111/resp.12471
Rodríguez,D.A.,Kortianou,E.A.,Alison,J.A.,Casas,A.,Giavedoni,S.,Barberan-Garcia,A.,Arbillaga,A.,Vilaro,J.,Gimeno-Santos,E.,Vogiatzis,I.,Rabinovich,R.and Roca,J.(2017).Heart Rate Recovery After 6-min Walking TestPredicts Acute Exacerbation in COPD.Lung,195,463-467.doi:10.1007/s00408-017-0027-0
Schertel,A.,Funke-Chambour,M.,Geiser,T.and Brill,A.K.(2017).Novelinsights in cough and breathing patterns of patients with idiopathicpulmonary fibrosis performing repeated 24-hour-respiratorypolygraphies.Respir Res,18,190.doi:10.1186/s12931-017-0674-y
Solway,S.,Brooks,D.,Lacasse,Y.and Thomas,S.(2001).Aqualitativesystematic overview of the measurement properties of functional walk testsused in the cardiorespiratory domain.Chest,119,256-270.doi:10.1378/chest.119.1.256
Yilmaz,C.K.,
Ziemssen,T.and Siepmann,T.(2019).The Investigation of theCardiovascular and Sudomotor Autonomic Nervous System—AReview.Front Neurol,10,53.doi:10.3389/fneur.2019.00053。
