抗沉默功能1A抑制剂在组蛋白乳酸化修饰介导的动脉粥样硬化中的应用
文献发布时间:2024-04-18 19:59:31
技术领域
本发明属于生物医药技术领域,具体涉及抑制抗沉默功能1A(anti-silencingfunction 1A,ASF1A)活性的物质在制备动脉粥样硬化相关血管疾病防治药物中的应用。
背景技术
随着人口老龄化愈发严重,心血管疾病(Cardiovascular diseases,CVDs)的患病率、发病率和死亡率也不断上升,对全世界人类构成巨大的健康威胁和经济负担。近年来我国每年因疾病死亡的人口中,死于CVDs的人数占全部死亡人数的40%,CVDs已成为导致中国居民疾病和死亡的首位原因。
动脉粥样硬化(Atherosclerosis,AS)是CVDs的主要原因,据统计,CVDs中导致全球死亡率最高的主要是冠状动脉疾病(动脉粥样硬化累及给心脏供血的动脉)和中风(动脉粥样硬化累及给脑部供血的动脉),使动脉粥样硬化成为全球主要致死病因。
动脉粥样硬化是一种典型的由多种因素引起的慢性炎症性血管病变。主动脉血管由内而外分为内膜、中膜和外膜,主要由内皮细胞(Endothleial cells,ECs)形成的单层细胞覆盖在血管内壁,构成血管内膜,调节血液和组织间氧气和营养物质的交换。因此,ECs在维持血管的屏障功能方面起着关键作用。人们早已认识到,内皮细胞功能紊乱是AS的初始过程,其主要特征是趋化因子和粘附分子的上调,病灶渗透,招募循环单核细胞进入内膜成为泡沫细胞,最终导致斑块的形成。AS易发部位内皮的激活和损伤是AS发展的主要起始因素之一,主要发生在动脉血管中的易损伤区域。当内皮功能失调时,血管内膜通透性增加,引起内皮层的渗漏,导致大量的脂质渗入以及巨噬细胞侵润,由此启动动脉硬化病理过程。因此,保持ECs的完整性是保护血管功能的第一道屏障,是开发预防及治疗AS新策略的关键。
内皮-间充质转化(endothelial-to-mesenchymal transition,EndMT)是一种ECs在高脂等多种刺激因素作用下细胞转化的特殊过程,在这种过程中,ECs在多种刺激下转化为间质细胞,并逐渐失去内皮特异性标记,获得间充质表型,使ECs的屏障功能和分泌功能都受到损伤。经常发生在动脉粥样硬化易发区的EndMT的异常发生已被确定可以诱导新内膜增生和内皮细胞功能紊乱,从而促进内皮功能障碍和动脉粥样硬化的发生。有研究表明,EndMT可以通过减少ECs特征性标志物表达,增加细胞外基质成分如纤连蛋白和粘附分子的表达促进AS。然而,内皮细胞发生EndMT从而导致AS的具体分子机制仍不清楚。
表观基因组学和表观遗传学研究已经为由非解决性炎症引起的各种疾病,如癌症、肺纤维化和动脉粥样硬化提供了一些新的见解。越来越多的证据表明,表观遗传学在心血管疾病中发挥了极其重要的作用,包括DNA甲基化、组蛋白翻译后修饰、染色质重塑、非编码RNA等。组蛋白是核小体的核心结构,可通过多种方式影响染色质的可及性。组蛋白的尾部受到多种翻译后修饰的限制,如甲基化、乙酰化、磷酸化、糖基化、SUMO化、泛素化等。这些组蛋白修饰可通过改变染色质微环境来显著调控染色质结构和基因表达,在动脉粥样硬化等许多疾病的发生发展中发挥着至关重要的作用。新的研究发现,糖酵解产生的乳酸可作为前体物质,使乳酰基添加到组蛋白的赖氨酸残基上,作为组蛋白翻译后的一种修饰,发挥着基因转录调控的功能,称为组蛋白乳酸化。这种组蛋白修饰通过改变DNA分子对参与DNA转录的蛋白质的物理可及性而影响基因表达。此外,最近的研究表明,组蛋白乳酸化与各种疾病的发生和发展密切相关,如肿瘤、神经退行性疾病和心血管疾病。
越来越多的证据表明,有氧糖酵解可以刺激巨噬细胞中的组蛋白乳酸化。即使在氧气存在的情况下也依然消耗葡萄糖并伴随着乳酸的产生的供能方式,被称为Warburg效应。虽然Warburg效应被描述为与肿瘤相关的代谢特征,但现在被认为是一种生理现象,ECs的代谢方式也与Warburg效应类似,即使在有氧条件下也依然采取有氧糖酵解。糖酵解是正常生理状态下ECs的主要能量代谢方式,满足ECs 85%的ATP需求。糖酵解可保证AS易发区域ECs的正常代谢和增殖,维持ECs稳态和血管内皮完整性,保护血管并减转AS发生发展。但一些研究表明,虽然糖酵解是ECs的保护机制,但过高糖酵解反而会加重内皮功能障碍。大量研究显示,粥样硬化斑块好发于动脉开口、分叉和弯曲部位,血流低切应力与动脉粥样硬化的发生密切相关。暴露于AS易发区域扰动血流下的血管内皮细胞受层流剪切应力的影响,会导致糖酵解增加,发生过高的糖酵解,导致乳酸及组蛋白乳酸化异常升高。过高糖酵解会诱发ECs过度增殖,触发血管内皮通透性,损害内皮单层屏障,进而加速AS进程,使炎症反应上调。目前认为,血管内皮细胞在动脉粥样硬化易发区的有氧糖酵解增加是导致炎症和动脉粥样硬化病变的原因。以前的研究表明,Warburg效应也参与了肺动脉高压的EndMT。然而,有氧糖酵解对动脉粥样硬化中EndMT的影响目前仍不清楚。
HATP300,组蛋白乙酰转移酶,是一个潜在的组蛋白乳酸化的“writer”蛋白。P300可以催化乳酸酰基基团从乳酰辅酶A转移到组蛋白上。P300依赖的组蛋白乳酸化是否需要一个辅助因子来精确调节特定的目标基因仍然未知。ASF1A是一种进化上保存良好的组蛋白H3/H4伴侣,也是基因转录的重要调节因子。人类中的组蛋白伴侣ASF1A可以调节体内CBP介导的细胞中组蛋白H3K56乙酰化,据报道,ASF1A可以在果蝇和HeLa细胞中与P300相互作用,形成调节组蛋白修饰的复合物。以往的研究表明,ASF1A在肿瘤的发生和发展、复制偶联核糖体在贫血中的组装,以及通过激活Notch信号加速慢性骨髓性白血病的发生中发挥着关键作用,但在心血管领域尚未有报道。组蛋白表观遗传修饰与各种疾病的发生和发展密切相关,但是ASF1A介导的表观遗传修饰是否参与EndMT的过程是未知的。
目前,组蛋白乳酸化在动脉粥样硬化中的作用及其机制尚未有任何相关的研究和报道。组蛋白伴侣ASF1A与组蛋白乳酸化修饰是否参与EndMT和动脉粥样硬化也有待探索。
发明内容
针对上述问题,本申请提供一种基于抑制组蛋白乳酸化H3K18la产生的组蛋白伴侣ASF1A抑制剂的制药用途。
具体而言,本申请首先提供了ASF1A抑制剂在制备防治心血管疾病药物中的应用;特别是在制备防治动脉粥样硬化药物中的应用。
进一步而言,上述ASF1A抑制剂可以作为影响组蛋白H3K18乳酸化修饰的关键。
本发明的目的可通过以下技术方案实现:
ASF1A抑制剂在制备治疗和/或预防动脉粥样硬化的药物中的应用。
ASF1A基因序列如下:
https://www.ncbi.nlm.nih.gov/nuccore/NC_000006.12?report=fasta&from
ASF1A氨基酸序列如下:
https://rest.uniprot.org/uniprotkb/Q9Y294.fasta
作为本发明的一种优选,所述ASF1A抑制剂为抑制或敲除ASF1A表达的物质,选自ASF1A的siRNA、特异性敲除ASF1A的基因编辑系统或其他能够特异性抑制ASF1A的小分子化合物。
作为本发明的一种优选,所述的ASF1A的siRNA序列如下:
5’→3’GAGCAGUAAUCCAAAUCUATT(SEQ ID NO.1),
3’→5’UAGAUUUGGAUUACUGCUCTT(SEQ ID NO.2)。
检测ASF1A的试剂在制备动脉粥样硬化辅助诊断试剂盒中的应用。
ASF1A作为检测靶点在筛选动脉粥样硬化治疗药物中的应用。
一种筛选动脉粥样硬化治疗药物的方法,检测给药前、后血浆中ASF1A含量,通过ASF1A含量的降低程度评估治疗动脉粥样硬化候选药物的疗效。
内皮细胞特异性敲除Asf1a的Apoe
本发明的有益效果:
发明人通过Western Blot等实验发现Apoe
附图说明
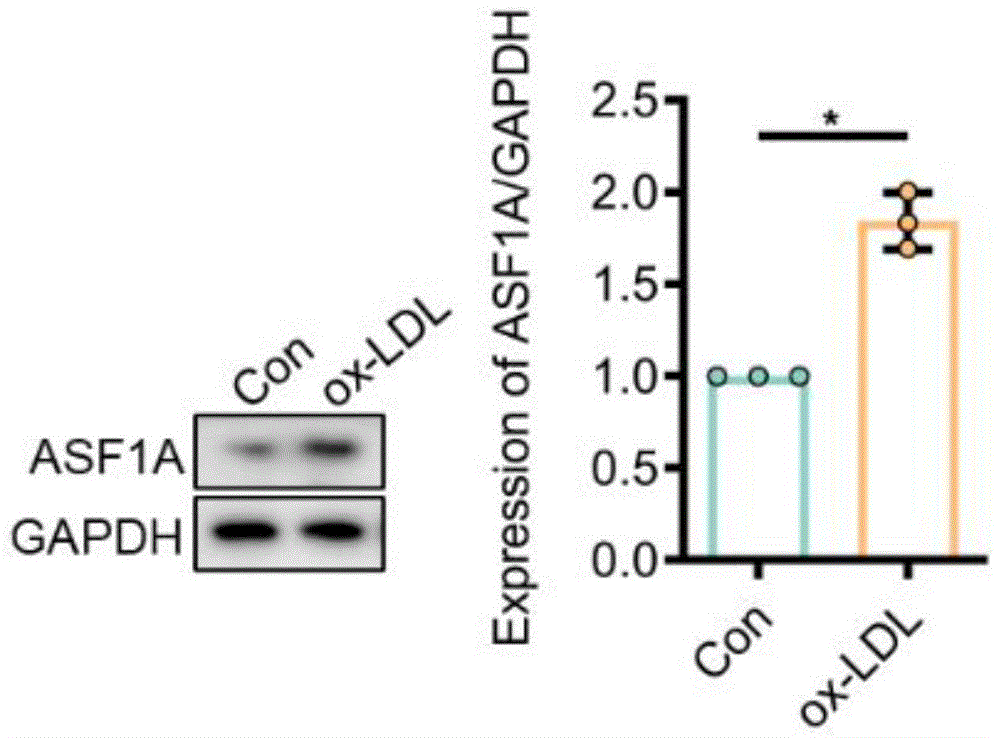
图1为ASF1A在ox-LDL诱导HCAECs后表达水平情况:如图1所示,使用50μg/mL的ox-LDL处理HCAECs诱导损伤建立AS疾病模型,24h后收集细胞,Western Blot检测ASF1A蛋白表达水平。(n=3;*p<0.05)
图2为敲除ASF1A对ox-LDL诱导HCAECs后Pan Kla、H3K18la、H3K9la和Snail蛋白表达水平的影响:将小干扰RNA(siRNA)转染到HCAECs敲除ASF1A,再给予50μg/mL的ox-LDL处理HCAECs诱导损伤,24h后收集细胞,提取HCAECs全蛋白,Western Blot检测Pan Kla、H3K18la、H3K9la和Snail蛋白表达水平。(n=3;**p<0.01,***p<0.001;ns,nosignificance)
图3为敲除ASF1A对ox-LDL诱导HCAECs后EndMT相关标志物表达水平的影响:如图3所示,HCAECs给予siRNA敲除ASF1A,再给予50μg/mL的ox-LDL刺激HCAECs诱导损伤,收集样本RNA,定量实时PCR(quantitative real-time polymerase chain reaction,RT-qPCR)检测EndMT相关标志物表达水平。结果以热图和柱形图形式呈现,蓝色(低值),红色(高值)。热图中每个方框的颜色对应于相应的3个独立实验数据的平均值。(n=3;*p<0.05,**p<0.01,***p<0.001)
图4为内皮细胞特异性敲除Asf1a对AS形成的影响:如图4所示,Apoe
图5为内皮细胞特异性敲除Asf1a对AS形成及EndMT的影响:如图5所示,Apoe
图6为内皮细胞特异性敲除Asf1a对EndMT的影响:如图6所示,Apoe
图7为内皮细胞特异性敲除Asf1a对EndMT形态学的影响:如图7所示,Apoe
图8为内皮细胞特异性敲除Asf1a对组蛋白乳酸化修饰的影响:如图8所示,Apoe
具体实施方式
下面的实施例可使本专业技术人员全面地理解本发明,但不以任何方式限制本发明。
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的描述。所描述的实施例不是全部的实施例,而仅是本发明的一部分实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
实施例1
1.1人冠状动脉内皮细胞诱导:
人冠状动脉内皮细胞给予50μg/mL的ox-LDL刺激24h诱导损伤建立AS内皮损伤细胞模型。
为了探索AS中组蛋白伴侣ASF1A的变化,申请人从ScienCell研究实验室购买人冠状动脉内皮细胞并培养于含有10%胎牛血清的ECM培养基中,当融合度达到80%-90%后进行传代。HCAECs给予50μg/mL的ox-LDL刺激24h建立AS模型,同时以加入等量PBS组作为对照组;再提取细胞总蛋白,利用Western Blot方法检测ASF1A蛋白表达水平。检测结果如图1所示,ox-LDL刺激诱导损伤后HCAECs的ASF1A蛋白表达水平明显增加(图1)。以上实验结果提示:AS过程中内皮细胞ASF1A上调。
实施例2
2.1小干扰RNA(siRNA)转染人冠状动脉内皮细胞
(1)将HCAECs种到小皿中进行转染,转染体系如下:
A:ECM 125μL+siRNA6.25μL
B:ECM 125μL+lipo30003μL
(2)配制上述A液、B液,分别用移液器轻轻混匀,室温静置5min。将两液体混合,用移液器轻轻混匀,室温静置15-20min后立即转染。
(3)转染前给细胞更换预热的新鲜完全培养基,将第(2)步的混合物加入孔中,轻轻晃动板使复合物均匀分布。
(4)37℃静置培养细胞,4-6h后换成新的预热的完全培养基。
本发明中,根据ASF1A基因序列进行设计siRNA,siRNA的序列为:
5’→3’GAGCAGUAAUCCAAAUCUATT,
3’→5’UAGAUUUGGAUUACUGCUCTT。
2.2给予HCAECs ox-LDL刺激
HCAECs给予50μg/mL的ox-LDL刺激24h诱导损伤。
2.3 RT-qPCR
(1)收集处理过的样品并按照Trizol试剂盒中的说明提取总RNA。戴口罩以避免RNA酶以防止RNA降解、用去RNA酶枪头、DEPC水;
(2)用预冷的PBS洗涤六孔板中的细胞,并向每个孔中加入1mLTrizol;
(3)10s后,将细胞裂解液转移至EP管中在冰上静置10min裂解;
(4)每管加200μL氯仿,颠倒混匀后置于冰上裂解10min;
(5)4℃,12000rpm,离心15min;
(6)小心吸取上清液至新EP管,加入等体积异丙醇,颠倒混匀后置于冰上10min;
(7)4℃,12000rpm,离心15min,弃去上清液;
(8)倒置于纸上吸干余液,可见白色羽毛状沉淀,加入DEPC水稀释的75%乙醇,颠倒混匀。
(9)4℃,12000rpm,离心15min,弃去上清乙醇;
(10)吸去残留乙醇,置于细胞房超净台通风孔5-10min处风干。
(11)加入20μL DEPC水溶解RNA,NanoDrop测RNA浓度,置于-80℃冰箱备用。
(12)使用
RNase free ddH
Total RNA1μg
ⅡBuffer plus 4μL
(13)混合均匀后用PCR仪进行逆转录:
25℃ 5min
42℃ 30min
85℃ 5min
(14)逆转录结束后,将cDNA,加入80μLDEPC水按1:4比例稀释,-20℃储存备用。
(15)用
(16)进行分组,计算体系(最后加cDNA);
(17)封膜,384孔板离心后放入荧光定量PCR仪中;
(18)反应在Bio-Rad 480ΙΙ型定量PCR仪上进行。
引物序列如下:
siASF1A Forward:GAGCAGUAAUCCAAAUCUATT
Reverse:UAGAUUUGGAUUACUGCUCTT
为了进一步确认组蛋白伴侣ASF1A对HCAECs组蛋白乳酸化的影响,申请人培养HCAECs,在对数生长阶段将ASF1A的小干扰RNA转染到细胞48h后,再给予50μg/mL的ox-LDL刺激,24h后收集细胞,采用Western Blot检测Pan Kla、H3K18la、H3K9la和EndMT经典转录因子Snail蛋白表达水平。结果如图2所示,发现ASF1A的缺乏明显抑制了由ox-LDL诱导的H3K18la和Snail蛋白水平的增加以及EndMT过程(图2)。
为了进一步明确在ASF1A在EndMT和AS中的作用,申请人培养HCAECs,在对数生长阶段将ASF1A的小干扰RNA转染到细胞,再给予50μg/mL的ox-LDL刺激,24h后收集细胞,采用RT-qPCR检测EndMT标志物表达水平。在EndMT过程中,内皮标志物血小板-内皮细胞粘附分子(platelet endothelial cell adhesion molecule-1,CD31)、血管内皮钙黏蛋白(vascular endothelial cadherin,VE-cadherin)、内皮型一氧化氮合酶(endothelialnitric oxide synthases,eNOS)和闭合蛋白(Occludin)表达水平降低,VSMCs或间充质干细胞样标志物如N-钙粘蛋白(neural cadherin,N-cadherin)、钙调蛋白(Calponin)、α-平滑肌肌动蛋白(alpha-Smooth Muscle Actin,α-SMA)、纤维连接蛋白(Fibronectin 1)、I型胶原蛋白a(Collagen 1A)和波形蛋白(Vimentin)在内皮细胞中表达水平增加。结果如图3所示,ASF1A的缺乏明显抑制了由ox-LDL诱导的内皮细胞特异性标志物表达水平的降低,同时抑制了ox-LDL诱导的间充质标记物表达水平的升高(图3)。以上结果表明,ASF1A缺乏显著抑制了ox-LDL诱导的EndMT过程。
实施例3
3.1构建内皮细胞Asf1a特异性敲除的Apoe
Asf1a基因有6个转录本,根据Asf1a基因的结构,Asf1a-201(ENSMUST00000020004.8)的第2外显子被推荐为基因敲除区。该区域包含116bp的编码序列。敲除该区域将导致基因功能的破坏。在本项目中,我们使用CRISPR-Cas9技术来改造Asf1a基因。简要过程如下:将CRISPR-Cas9系统和Donor显微注射到C57BL/6JGpt小鼠的受精卵中。受精卵移植后获得阳性F0小鼠,并通过PCR和靶向扩增子测序进行确认基因型。将阳性F0代小鼠与C57BL/6JGpt小鼠交配,获得稳定的F1代小鼠品系,并通过PCR和靶向扩增子测序确认所需的突变等位基因。由此获得Asf1a
3.2大体油红染色
高脂喂养3.1中12周建立的AS小鼠模型,通过大体油红O染色检测小鼠主动脉血管整体斑块的面积。
大体油红O染色步骤:将小鼠主动脉血管分离取下,用镊子去除血管周围脂肪组织,将血管用4%多聚甲醛固定10min,再用PBS浸洗10min。将剖开的血管用油红O染色工作液染色1h后取出,用60%异丙醇漂洗3次,管腔内脂肪斑块呈橘红色或鲜红色,其它部位近无色,最后用蒸馏水漂洗2次。将染好的大体组织在载玻片上展开固定,于良好的光线条件下进行拍照。
检测结果如图4所示,比较用NC或HFD喂养的Apoe
3.3血管免疫荧光
此外,为了进一步明确Asf1a在内皮功能障碍和AS中的作用,申请人分离NC或HFD喂养的Apoe
申请人首先分离不同分组的小鼠的升主动脉的近端部分,然后嵌入OCT冰冻切片包埋剂。将PBS置于4℃冰箱预冷。主动脉在-80℃下速冻,并切成8μm的冷冻切片。冷冻切片在55℃下烘烤15min,然后在4%多聚甲醛中固定20min,接着滴入0.1%Triton X-10020min以破膜。随后,用10%的BSA封闭样品1小时,并在4℃下与特异性一抗孵育过夜。第二天,用PBS清洗样品,然后与二抗在37℃下孵育1h。最后,用DAPI以1:1000的比例对细胞核进行染色10min。使用激光共聚焦扫描显微镜观察并拍照获取图像。
结果如图5所示,HFD喂养的Apoe
实施例4
为了确认Asf1a是否影响内皮功能障碍的EndMT的发生,申请人提取了NC或HFD喂养的Apoe
为了确定内皮细胞特异性Asf1a敲除在细胞水平的影响,申请人提取并培养了来自NC喂养或HFD喂养的Apoe
为了验证内皮细胞特异性Asf1a敲除对组蛋白乳酸化的影响,申请人提取并培养了来自NC喂养或HFD喂养的Apoe
以上实验结果提示:Asf1a参与了组蛋白H3K18乳酸化介导的EndMT,从而促进了小鼠内皮细胞向EndMT表型的转变。
以上实验结果充分证明,ASF1A依赖的H3K18乳酸化修饰参与AS的进程。通过ASF1A抑制剂使H3K18la生成受阻,下调组蛋白H3K18乳酸化修饰,可以有效抑制AS的发生和发展。因此,我们认为ASF1A可以作为临床上治疗AS的一个新的重要靶标,在AS的防治中具有潜在的临床应用价值。
上述具体实例对本发明进行了详细说明,只是为了说明本发明的技术构思及特点,目的在于让熟悉此项技术的人士可以据此了解本发明的内容并实施,并不能够以此限制本发明的保护范围。本发明不限于上述实例,还可在不脱离本发明精神实质的情况下作出变化,凡根据本发明宗旨所作出的等效变换或修饰,都应涵盖在本发明的保护范围之内。
- 具有振动阻尼装置的机加工装置和方法
- 一种具有减振阻尼及密封结构的向心透平装置
- 具有阻尼特征的处置装置
- 具有渐进的阻尼力特征曲线的阻尼阀装置
