一种表达α-L-鼠李糖苷酶的毕赤酵母及其制备方法和应用
文献发布时间:2023-06-19 09:32:16
技术领域
本发明涉及生物医药技术领域,具体涉及一种α-L-鼠李糖苷酶在毕赤酵母细胞中的制备方法。
背景技术
α-L-鼠李糖苷酶(α-L-rhamnosidase,EC 3.2.1.40)是一类糖苷水解酶,主要属于GH13、GH28、GH78和GH106家族,能高效水解许多天然糖苷酶类化合物末端的鼠李糖基,如水解橙皮苷(hesperidin)、柚皮苷(naringin)、芦丁(rutin)、槲皮苷(quercitrin)、朝藿定C(Epimedin C)和淫羊藿苷(Icarrin)等天然黄酮类糖苷化合物为橙皮素单葡萄糖苷(hesperetin 7-O-glucoside)、普鲁宁(prunin)、异槲皮苷(isoquercitrin)、槲皮素(quercetin)、淫羊藿苷(Icarrin)和淫羊藿次苷I(Icariside I)等。在动物组织、植物、酵母、真菌和细菌中均有发现α-L-鼠李糖苷酶,然而不同来源的α-L-鼠李糖苷酶其酶学性质也存在较大差异。不同来源的α-L-鼠李糖苷酶具有底物特异性,主要是对于α-1、α-1,2、α-1,3、α-1,4、α-1,6糖苷键,其中大部分鼠李糖苷酶对α-1,2糖苷键具有活性,其次是α-1,6糖苷键。对底物特异性及活性的原因主要是底物鼠李糖基的连接类型和结构的影响。如芦丁和橙皮苷都是α-1,6连接的鼠李糖基,但相同的α-L-鼠李糖苷酶的水解活性也存在差异,原因在于二糖苷的连接类型不一样,形成了不同的空间位阻。由于物种来源的差异,不同来源的α-L-鼠李糖苷酶水解反应的最适温度和pH也不一样,分子量和等电点也存在较大差异。
α-L-鼠李糖苷酶能应用于食品业中柑桔类果汁的去苦,饮料风味改善以及食品添加剂的生产等。除了在食品领域的应用,α-L-鼠李糖苷酶还能应用于医药行业,如用于生产药物或者药物中间体以及对药物进行改性提高药效等。由于该酶具有良好的应用前景,因此国内外越来越多的研究者对其进行研究开发。
黄酮类化合物在人体中被吸收的难易程度不同,主要是不同糖苷的存在影响黄酮类化合物的溶解性和生物活性,研究发现黄酮化合物在小肠中的吸收受到其带有糖苷的抑制,将黄酮类化合物中部分糖苷或者全部糖苷水解后,能被小肠更好的吸收,以此来提高黄酮类化合物在人体的生物利用率。酶法水解对鼠李糖苷类黄酮化合物的水解具有高效、专一、温和等特点,对黄酮鼠李糖苷的生物催化转化具有巨大的应用潜力和开发前景。
目前商业化来源的α-L-鼠李糖苷酶制剂一般是来源于黑曲霉和青霉菌,原始菌株来源的α-L-鼠李糖苷酶制剂中含有葡萄糖苷酶、半乳糖糖苷酶等其它水解酶,在应用生产中容易产生副产物,不利用产物的纯化和生产。利用基因工程手段,将α-L-鼠李糖苷酶基因进行克隆得到基因重组菌,将其进行表达,分离纯化得到α-L-鼠李糖苷酶,能有效的将α-L-鼠李糖苷酶应用于工业的生物转化生产中。但是原始菌株发酵得到α-L-鼠李糖苷酶活力不高,且专一性低,酶制剂中含有其它杂酶,容易生产副产物,影响了主产物的收率和纯化。
发明内容
为了克服现有技术的不足,本发明的目的之一在于提供一种α-L-鼠李糖苷酶,可以高效专一的水解柚苷二氢查耳酮、柚苷、芦丁、新橙皮苷、朝藿定C等含鼠李糖基的化合物,没有其它副产物的产生,有效的提高了产物的收率。
本发明的目的之二在于提供一种α-L-鼠李糖苷酶的核苷酸,用于编码高效专一的α-L-鼠李糖苷酶。
本发明的目的之三在于提供一种α-L-鼠李糖苷酶表达载体。
本发明的目的之四在于提供一种α-L-鼠李糖苷酶的制备方法,得到的α-L-鼠李糖苷酶活力高且专一性高,酶制剂不含有其它杂酶,无副产物,主产物的收率和纯度高。
本发明的目的之五在于提供一种α-L-鼠李糖苷酶的在黄酮类化合物或萜类香气前体化合物生物催化转化的应用。
本发明的目的采用如下技术方案实现:
一种α-L-鼠李糖苷酶,选自:糖苷酶(a)、糖苷酶(b)或糖苷酶(c),
所述糖苷酶(a)氨基酸序列如SEQ ID NO:1所示;
所述糖苷酶(b)为将SEQ ID NO:1氨基酸序列经过一个或多个氨基酸残基的取代、缺失或添加而形成的,且具有糖苷酶(a)水解活性的由糖苷酶(a)衍生的蛋白质;
所述糖苷酶(c)为与SEQ ID NO:1氨基酸序列有至少85%序列相同性,且具有糖苷酶(a)水解活性的由糖苷酶(a)衍生的蛋白质。
进一步地,所述糖苷酶(c)还包括:由糖苷酶(a)或糖苷酶(b)添加了标签序列、信号序列或分泌信号序列后所形成的融合蛋白。
一种α-L-鼠李糖苷酶的核苷酸,用于编码所述的糖苷酶(a),核苷酸序列如SEQ IDNO:2所示。
一种α-L-鼠李糖苷酶表达载体,含有所述的编码α-L-鼠李糖苷酶的核苷酸片段插入表达载体pPIC9K获得重组质粒pPIC9K-RhaE。
一种α-L-鼠李糖苷酶的制备方法,用于制备所述的一种α-L-鼠李糖苷酶,将SEQID NO.2所示的α-L-鼠李糖苷酶基因片段插入表达载体pPIC9K获得重组质粒pPIC9K-RhaE,将重组质粒转化宿主细胞后诱导表达,并通过后续分离而得。
进一步地,所述宿主细胞为毕赤酵母GS115细胞或毕赤酵母KM71H细胞。
进一步地,α-L-鼠李糖苷酶的制备方法包括步骤如下:
S1:合成经过密码子优化后的α-L-鼠李糖苷酶基因;
S2:将α-L-鼠李糖苷酶基因与表达载体pPIC9K连接,获得重组质粒pPIC9K-RhaE;
S3:将重组质粒pPIC9K-RhaE用Sal I酶线性化后电转化至毕赤酵母细胞中,筛选阳性克隆得到重组毕赤酵母细胞GS115-pPIC9K-RhaE或KM71H-pPIC9K-RhaE。
S4:取步骤S3得到的重组毕赤酵母细胞添加适量浓度的诱导剂,于26℃-30℃下诱导表达,离心弃菌体,上清液经进一步纯化得到α-L-鼠李糖苷酶RhaE酶液。
进一步地,所述诱导剂为甲醇。
进一步地,所获得的α-L-鼠李糖苷酶RhaE酶液催化的温度范围为40℃-60℃,pH范围为3.5-6。
所述α-L-鼠李糖苷酶在黄酮类化合物或萜类香气前体化合物生物催化转化的应用,具体在柚苷二氢查耳酮、柚苷、芦丁、新橙皮苷、橙皮苷、朝藿定C、淫羊藿苷提取物催化转化的应用。
相比现有技术,本发明的有益效果在于:本发明首次将来源于Aspergillusnidulans FGSC A4菌株的α-L-鼠李糖苷酶RhaE在毕赤酵母细胞中进行表达,重组酶具有高效稳定水解α-1、α-1,2、α-1,6糖苷键的性能,能专一性水解柚苷二氢查耳酮为三叶苷、柚苷为普鲁宁、芦丁为异槲皮素、橙皮苷为橙皮素单葡萄糖苷、新橙皮苷为橙皮素单葡萄糖苷、朝藿定C为淫羊藿苷,没有其它副产物的产生,有效的提高了产物的收率。
附图说明
图1为重组质粒pPIC9K-RhaE的琼脂糖凝胶电泳图。
图2为重组GS115-pPIC9K-AnRhaE阳性克隆鉴定图。
图3为重组KM71H-pPIC9K-AnRhaE阳性克隆鉴定图。
图4为α-L-鼠李糖苷酶RhaE电泳图。
图5为重组α-L-鼠李糖苷酶RhaE水解柚苷二氢查耳酮的HPLC图谱。
图6为重组α-L-鼠李糖苷酶RhaE水解柚苷的HPLC图谱。
图7为重组α-L-鼠李糖苷酶RhaE水解芦丁的HPLC图谱。
图8为重组α-L-鼠李糖苷酶RhaE水解新橙皮苷的HPLC图谱。
图9为重组α-L-鼠李糖苷酶RhaE水解橙皮苷的HPLC图谱。
图10为重组α-L-鼠李糖苷酶RhaE水解朝藿定C的HPLC图谱。
具体实施方式
下面,结合附图以及具体实施方式,对本发明做进一步描述,需要说明的是,在不相冲突的前提下,以下描述的各实施例之间或各技术特征之间可以任意组合形成新的实施例。
一种α-L-鼠李糖苷酶,选自:糖苷酶(a)、糖苷酶(b)或糖苷酶(c),
所述糖苷酶(a)氨基酸序列如SEQ ID NO:1所示;
所述糖苷酶(b)为将SEQ ID NO:1氨基酸序列经过一个或多个氨基酸残基的取代、缺失或添加而形成的,且具有糖苷酶(a)水解活性的由糖苷酶(a)衍生的蛋白质;
所述糖苷酶(c)为与SEQ ID NO:1氨基酸序列有至少85%序列相同性,且具有糖苷酶(a)水解活性的由糖苷酶(a)衍生的蛋白质。
作为优选的实施方式,所述糖苷酶(c)还包括:由糖苷酶(a)或糖苷酶(b)添加了标签序列、信号序列或分泌信号序列后所形成的融合蛋白。
一种α-L-鼠李糖苷酶的核苷酸,用于编码所述的糖苷酶(a),核苷酸序列如SEQ IDNO:2所示。
一种α-L-鼠李糖苷酶表达载体,含有所述的编码α-L-鼠李糖苷酶的核苷酸片段插入表达载体pPIC9K获得重组质粒pPIC9K-RhaE。
一种α-L-鼠李糖苷酶的制备方法,用于制备所述的一种α-L-鼠李糖苷酶,将SEQID NO.2所示的α-L-鼠李糖苷酶基因片段插入表达载体pPIC9K获得重组质粒pPIC9K-RhaE,将重组质粒转化宿主细胞后诱导表达,并通过后续分离而得。
作为优选的实施方式,所述宿主细胞为毕赤酵母GS115细胞或毕赤酵母KM71H细胞。
作为优选的实施方式,α-L-鼠李糖苷酶的制备方法包括步骤如下:
S1:合成经过密码子优化后的α-L-鼠李糖苷酶基因;
S2:将α-L-鼠李糖苷酶基因与表达载体pPIC9K连接,获得重组质粒pPIC9K-RhaE;
S3:将重组质粒pPIC9K-RhaE用Sal I酶线性化后电转化至毕赤酵母细胞中,筛选阳性克隆得到重组毕赤酵母细胞GS115-pPIC9K-RhaE或KM71H-pPIC9K-RhaE。
S4:取步骤S3得到的重组毕赤酵母细胞添加适量浓度的诱导剂,于26℃-30℃下诱导表达,离心弃菌体,上清液经进一步纯化得到α-L-鼠李糖苷酶RhaE酶液。
作为优选的实施方式,所述诱导剂为甲醇。
作为优选的实施方式,所获得的α-L-鼠李糖苷酶RhaE酶液催化的温度范围为40℃-60℃,pH范围为3.5-6。
所述α-L-鼠李糖苷酶在黄酮类化合物或萜类香气前体化合物生物催化转化的应用,具体在柚苷二氢查耳酮、柚苷、芦丁、新橙皮苷、橙皮苷、朝藿定C、淫羊藿苷提取物催化转化的应用。
实施例1,
α-L-鼠李糖苷酶基因的获得及重组质粒pPIC9K-RhaE的构建:
根据α-L-鼠李糖苷酶RhaE在NCBI数据库中公布的GenBank序列信息,利用密码子偏好性对α-L-鼠李糖苷酶RhaE基因在毕赤酵母细胞中密码子的偏好性进行分析,对其DNA序列进行密码子优化,依据优化结果交由通用生物系统(安徽)有限公司进行合成α-L-鼠李糖苷酶RhaE基因,最终基因序列如SEQ ID NO:2所示。
引物R-f:CTGAAGCTTACGTAGAATTCATGTCGCTGTCAATTTCTGGC;R-r:GCGAATTAATTCGCGGCCGCTCAACCGAGCGTACTCTCAAA由生工生物(上海)有限公司合成。以合成的α-L-鼠李糖苷酶RhaE基因为模板,以R-f和R-r为引物进行PCR扩增α-L-鼠李糖苷酶RhaE基因片段。DNA聚合酶选用宝生物工程有限公司的
实施例2,
α-L-鼠李糖苷酶在摇瓶上的制备:
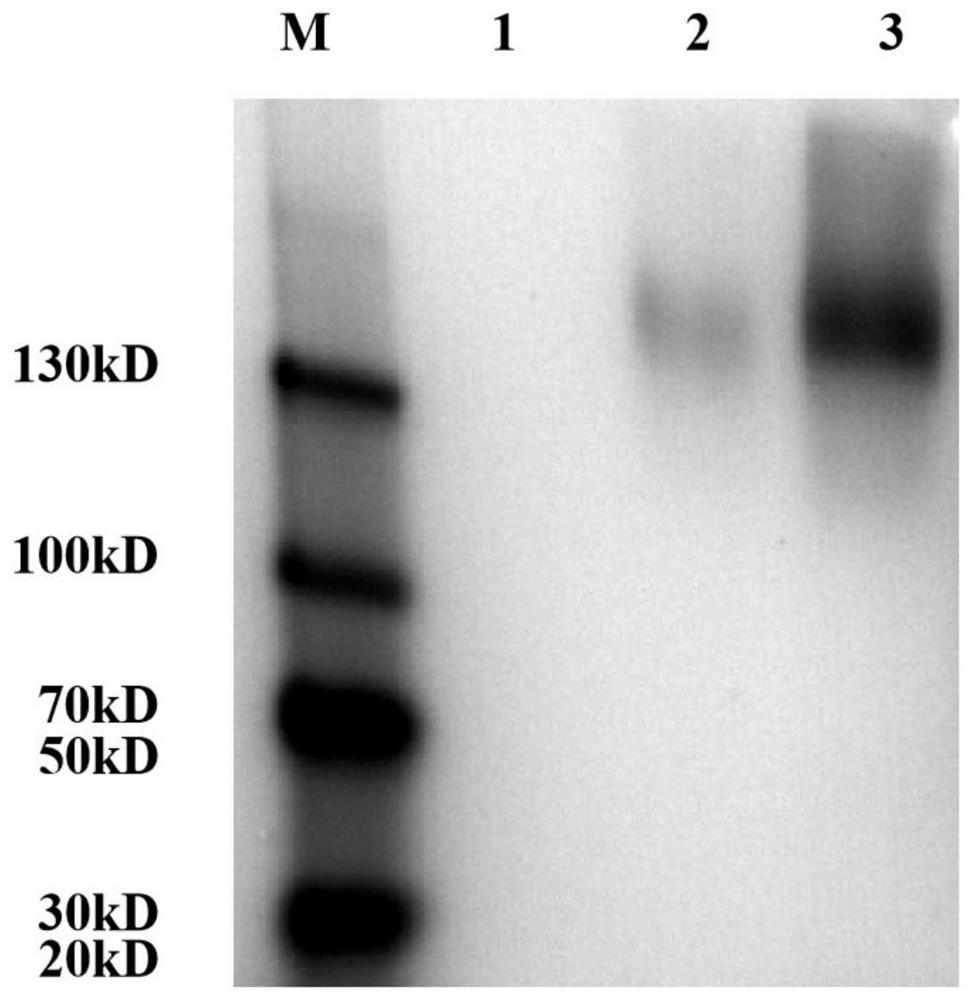
提取重组质粒pPIC9K-RhaE,采用Sal I线性化重组质粒pPIC9K-RhaE和空载质粒pPIC9K后,采用电转化法将其转入毕赤酵母GS115细胞或毕赤酵母KM71H细胞,筛选阳性克隆,挑选克隆子用TaKaRa公司的Lysis buffer进行裂解,以裂解液为模板,进行PCR鉴定,结果如图2和图3所示,阳性重组克隆子分别命名为GS115-pPIC9K-RhaE和KM71H-pPIC9K-RhaE。
分别接种GS115-pPIC9K-RhaE或KM71H-pPIC9K-RhaE到分别用YPD液体培养基活化20h,按照1%的接种量接种于装有50mL BMGY培养基中,30℃200r/min培养OD600到2~6。室温条件下3000g离心5min,收集菌体,用50ml BMMY(pH 6.0)重悬菌体,30℃200r/min诱导表达,每24h向培养基中添加终浓度为0.5%的甲醇,维持诱导条件。诱导表达5day,4℃12000g离心收集菌体,上清液即为重组α-L-鼠李糖苷酶RhaE酶液,取样品进行Western blot分析,结果如图4,图中M:Mark;1:毕赤酵母空白对照;2:KM71H-pPIC9K-RhaE表达酶液;3:GS115-pPIC9K-RhaE表达酶液。结果表明成功表达了重组α-L-鼠李糖苷酶RhaE酶液,条带单一,得到比较纯的酶液,分子量大小为130kD左右,较预测的大,存在蛋白的糖基化,重组毕赤酵母GS115细胞表达量较高于重组毕赤酵母KM71H细胞,产酶量更多。
实施例3,
α-L-鼠李糖苷酶在发酵罐上的制备:
接种GS115-pPIC9K-RhaE到YPD培养基中30℃,200rpm活化培养20h,按照1%接种量接种至种子液培养基中,30℃,200rpm培养20h。将培养好的种子液接种至发酵罐中进行30℃发酵培养,溶氧下降回升后,补加甘油,发酵培养至生物量达到一定值后,补加甲醇,28℃进行诱导培养,培养至酶活或者生物量不再增加时,停止发酵,高速离心去除菌体,将上清为重组α-L-鼠李糖苷酶RhaE酶液,保存待用。
实施例4,
α-L-鼠李糖苷酶RhaE对水解柚苷二氢查耳酮的应用:
以实施例3获得重组α-L-鼠李糖苷酶RhaE酶液,配置如下反应体系(2mL):
磷酸盐缓冲液pH 4.6 800μL
柚苷二氢查耳酮(2g/L) 1mL
α-L-鼠李糖苷酶RhaE酶液 200μL
在50℃水浴下反应2h。反应结束后加入等体积的甲醇抽提,离心后取上清,经0.22μm滤膜过滤,用HPLC检测,结果如附图5,图中,柚苷二氢查耳酮(保留时间为8.760),三叶苷(保留时间为10.916)。
从图5中结果可以看出α-L-鼠李糖苷酶RhaE酶液可以催化柚苷二氢查耳酮水解脱去鼠李糖苷生成产物三叶苷,而对照组没有该产物生成。结果表明,本发明中α-L-鼠李糖苷酶RhaE酶液能催化柚苷二氢查耳酮的水解生成三叶苷。
三叶苷甜度为蔗糖的300倍,作为甜味剂被世界卫生组织和联合国粮农组织收录,具有天然及安全性。三叶苷具有抗氧化活性、清除自由基、抗炎以及活血的作用,在抗癌、抗病毒、心血管和神经保护领域中的潜在应用前景。但是三叶苷在自然界中含量低,通过传统的提取方法获取成本高,产率低,通过生物催化转化可以提高三叶苷的产率,可以真正将三叶苷实现产业化,对三叶苷在食品和生物医药的应用开发具有极大的意义。
实施例5,
α-L-鼠李糖苷酶RhaE对水解柚苷的应用:
以实施例3获得重组α-L-鼠李糖苷酶RhaE酶液,配置如下反应体系(2mL):
磷酸盐缓冲液pH 4.6 800μL
柚苷(3g/L) 1mL
α-L-鼠李糖苷酶RhaE酶液 200μL
在50℃水浴下反应2h。反应结束后加入等体积的甲醇抽提,离心后取上清,经0.22μm滤膜过滤,用HPLC检测,结果如附图6,其中,柚苷(保留时间为12.797),普鲁宁(保留时间为15.215)。
从图6中结果可以看出α-L-鼠李糖苷酶RhaE酶液可以催化柚苷水解脱去鼠李糖苷生成产物普鲁宁,而对照组没有该产物生成。结果表明,本发明中α-L-鼠李糖苷酶RhaE酶液能催化柚苷的水解生成普鲁宁。
α-L-鼠李糖苷酶RhaE酶液水解柚皮苷的获得高纯度的普鲁宁,普鲁宁具有抗RNA/DNA病毒的作用,还具有抗炎活性并且可以作为糖尿病患者的甜味剂。
实施例6,
α-L-鼠李糖苷酶RhaE对水解芦丁的应用:
以实施例3获得重组α-L-鼠李糖苷酶RhaE酶液,配置如下反应体系(2mL):
磷酸盐缓冲液pH 4.6 800μL
芦丁(1g/L) 1mL
α-L-鼠李糖苷酶RhaE酶液 200μL
在50℃水浴下反应2h。反应结束后加入等体积的甲醇抽提,离心后取上清,经0.22μm滤膜过滤,用HPLC检测,结果如附图7,其中,芦丁(保留时间为7.673),异槲皮素(保留时间为9.945)。
从图7中结果可以看出α-L-鼠李糖苷酶RhaE酶液可以催化芦丁水解脱去鼠李糖苷生成产物异槲皮素,而对照组没有该产物生成。结果表明,本发明中α-L-鼠李糖苷酶RhaE酶液能催化芦丁的水解生成异槲皮素。
异槲皮素广泛分布于天然产物中,与芦丁和槲皮素相比,具有较好的生物利用度和安全性,也是合成EMIQC的重要前体。EMIQC的潜在活性包括抗氧化、抗炎(过敏)、肿瘤防治和心脑血管疾病防治等,已经获得FDA的批准可用于食品添加。异槲皮素的生物活性包括抗氧化、免疫调节、抗病菌、抗肿瘤、调节脂代谢、神经保护、改善糖尿病、心肌保护、对抗心血管疾病和防治老年痴呆等。
异槲皮素虽然在天然界中分布广泛,但含量很低,通过提取分离手段制备难度大、产率低、成本高,从而限制了异槲皮素的活性及其应用的研究;另一方面,芦丁在天然界中不仅分布广泛而且含量远高于其他黄酮类化合物,应用生物催化方法由芦丁制备异槲皮素对食品和医药行业具有重要的应用意义。
通过α-L-鼠李糖苷酶RhaE可以实现异槲皮素纯品的高效制备,为推进异槲皮素在食品、药品、保健品中的研究和应用提供技术基础。
实施例7,
α-L-鼠李糖苷酶RhaE对水解新橙皮苷的应用:
以实施例3获得重组α-L-鼠李糖苷酶RhaE酶液,配置如下反应体系(2mL):
磷酸盐缓冲液pH 4.6 800μL
新橙皮苷(2g/L) 1mL
α-L-鼠李糖苷酶RhaE酶液 200μL
在50℃水浴下反应2h。反应结束后加入等体积的甲醇抽提,离心后取上清,经0.22μm滤膜过滤,用HPLC检测,结果如附图8,其中,新橙皮苷(保留时间为7.330),橙皮素单葡萄糖苷(保留时间为8.377)。
从图8中结果可以看出α-L-鼠李糖苷酶RhaE酶液可以催化新橙皮苷水解脱去鼠李糖苷生成产物橙皮素单葡萄糖苷,而对照组没有该产物生成。结果表明,本发明中α-L-鼠李糖苷酶RhaE酶液能催化新橙皮苷的水解生成橙皮素单葡萄糖苷。
实施例8,
α-L-鼠李糖苷酶RhaE对水解橙皮苷的应用:
以实施例3获得重组α-L-鼠李糖苷酶RhaE酶液,配置如下反应体系(2mL):
磷酸盐缓冲液pH 4.6 800μL
橙皮苷(2g/L) 1mL
α-L-鼠李糖苷酶RhaE酶液 200μL
在50℃水浴下反应2h。反应结束后加入等体积的甲醇抽提,离心后取上清,经0.22μm滤膜过滤,用HPLC检测,结果如附图9,其中,橙皮苷(保留时间为6.878),橙皮素单葡萄糖苷(保留时间为8.377)
从图9中结果可以看出α-L-鼠李糖苷酶RhaE酶液可以催化橙皮苷水解脱去鼠李糖苷生成产物橙皮素单葡萄糖苷,而对照组没有该产物生成。结果表明,本发明中α-L-鼠李糖苷酶RhaE酶液能催化橙皮苷的水解生成橙皮素单葡萄糖苷,但活性较低。
橙皮苷在柑桔属(Cirtus)的果皮中含量丰富,橙皮苷包含有多种生物活性,包括消除自由基抗氧化、抗菌消炎镇痛、调节免疫、抗肿瘤等其它活性。橙皮苷溶解性极低,人体较难吸收,生物利用率低,表现出相对较弱的药理作用。利用α-L-鼠李糖苷酶RhaE将橙皮苷水解为橙皮素单葡萄糖苷,改善其溶解性,提高其生物利用率,加大其在食品和医药行业的应用具有重要意义。
实施例9,
α-L-鼠李糖苷酶RhaE对水解朝藿定C的应用:
以实施例3获得重组α-L-鼠李糖苷酶RhaE酶液,配置如下反应体系(2mL):
磷酸盐缓冲液pH 4.6 800μL
朝藿定C(2g/L) 1mL
α-L-鼠李糖苷酶RhaE酶液 200μL
在50℃水浴下反应2h。反应结束后加入等体积的甲醇抽提,离心后取上清,经0.22μm滤膜过滤,用HPLC检测,结果如附图10,其中朝藿定C(保留时间为6.627),淫羊藿苷(保留时间为7.511)。
从图10中结果可以看出α-L-鼠李糖苷酶RhaE酶液可以催化朝藿定C水解脱去一分子鼠李糖苷生成产物淫羊藿苷,而对照组没有该产物生成。结果表明,本发明中α-L-鼠李糖苷酶RhaE酶液能催化朝藿定C的水解生成淫羊藿苷。
在中药淫羊藿提取物中的朝藿定C是具有强细胞毒性的,而通过α-L-鼠李糖苷酶RhaE水解脱去一分子鼠李糖苷后转化成弱或无细胞毒性的淫羊藿苷,同时可以提升中药淫羊藿的生物利用度,因此利用α-L-鼠李糖苷酶RhaE可以大大提升中药淫羊藿提取物的应用和提升其药效能力,在中医药中具有良好的应用前景。
上述实施方式仅为本发明的优选实施方式,不能以此来限定本发明保护的范围,本领域的技术人员在本发明的基础上所做的任何非实质性的变化及替换均属于本发明所要求保护的范围。
SEQUENCE LISTING
<110> 佛山市汇腾生物技术有限公司
<120> 一种表达α-L-鼠李糖苷酶的毕赤酵母及其制备方法和应用
<130> SEQ ID NO:1
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 861
<212> PRT
<213> Aspergillus nidulans FGSC A4
<400> 1
Met Ser Leu Ser Ile Ser Gly Val Thr Phe Glu His His Arg Ser Ala
1 5 10 15
Leu Gly Ile Gly Glu Pro Ser Pro Arg Ile Ser Trp Arg Phe Asp Gly
20 25 30
Thr Val Ser Asn Trp Thr Gln Ser Ala Tyr Glu Ile Glu Ile Asn Arg
35 40 45
Ala Gly Gln Ala Asn Thr Phe Arg Val Asn Ser Ser Asp Ser Val Leu
50 55 60
Val Pro Trp Pro Ser Asp Pro Leu Gln Ser Gly Glu Glu Ala Thr Val
65 70 75 80
Arg Val Arg Ser Phe Gly Arg Ala Asn Gln Pro Asp Ala Pro Trp Ser
85 90 95
Asp Pro Val Thr Val Glu Pro Gly Leu Leu Asp Glu Asp Asp Trp Gln
100 105 110
Ser Ala Val Ala Ile Val Ser Asp Arg Glu Thr Glu Val Asn Ala Thr
115 120 125
His Arg Pro Ile Tyr Phe Arg Lys Asp Phe Asp Val Asp Glu Glu Ile
130 135 140
Leu Ser Ala Arg Leu Tyr Ile Thr Ala Leu Gly Val Tyr Glu Ala Glu
145 150 155 160
Ile Asn Gly Gln Pro Val Gly Asp His Val Leu Ala Pro Gly Trp Gln
165 170 175
Ala Tyr Ser His Arg His Glu Tyr Asn Thr Tyr Asp Val Thr Asp Leu
180 185 190
Leu Gln Thr Gly Asp Asn Thr Ile Gly Val Thr Val Gly Glu Gly Trp
195 200 205
Tyr Ala Gly Ala Leu Thr Trp Ser Met Thr Arg Asn Ile Tyr Gly Asp
210 215 220
Thr Leu Gly Leu Leu Ser Leu Leu Ser Ile Ala Thr Ala Asp Gly Lys
225 230 235 240
Thr Ile Tyr Val Pro Ser Asp Glu Thr Trp Gln Ser Ser Thr Gly Pro
245 250 255
Ile Ile Ala Ser Glu Ile Tyr Asn Gly Glu Thr Tyr Asp Ser Thr Gln
260 265 270
Ala Ile Glu Gly Trp Ser Gln Pro Gly Phe Asp Ala Ser Gly Trp Leu
275 280 285
Gly Thr His Glu Val Thr Phe Asp Lys Ser Val Leu Ala Ala Pro Asp
290 295 300
Ala Pro Ala Val Arg Arg Val Glu Glu Arg Arg Leu Glu Ser Val Phe
305 310 315 320
Lys Ser Ala Ser Gly Lys Thr Val Leu Asp Phe Gly Gln Asn Leu Val
325 330 335
Gly Trp Leu Arg Val Arg Val Lys Gly Pro Arg Gly Ser Thr Ile Ser
340 345 350
Phe Val His Thr Glu Val Met Glu Asn Gly Glu Val Ala Thr Arg Pro
355 360 365
Leu Arg Asn Ala Lys Ala Thr Asp Asn Leu Thr Leu Ser Gly Glu Glu
370 375 380
Gln Glu Trp Glu Pro Ser Phe Thr Phe His Gly Phe Arg Tyr Val Gln
385 390 395 400
Val Thr Gly Trp Pro Glu Glu Thr Glu Leu Asn Ala Asp Ser Val Thr
405 410 415
Ala Ile Val Ile Asn Ser Asp Met Glu Gln Thr Gly Phe Phe Ser Cys
420 425 430
Ser Asn Pro Leu Leu Asn Lys Leu His Glu Asn Ile Ile Trp Ser Met
435 440 445
Arg Gly Asn Phe Leu Ser Ile Pro Thr Asp Cys Pro Gln Arg Asp Glu
450 455 460
Arg Leu Gly Trp Thr Gly Asp Ile His Ala Phe Ala Arg Thr Ala Asn
465 470 475 480
Phe Ile Tyr Asp Thr Ser Gly Phe Leu Arg Gly Trp Leu Arg Asp Ala
485 490 495
Tyr Ser Glu Gln Leu Glu Asn Asn Tyr Ala Pro Pro Tyr Val Ile Pro
500 505 510
Asn Val Leu Gly Pro Gly Ser Pro Thr Ser Ile Trp Gly Asp Ala Ile
515 520 525
Val Ser Val Pro Trp Asp Leu Phe Gln Thr Tyr Gly Asp Lys Ala Met
530 535 540
Leu Ser Glu Gln Tyr Ala Gly Ala Thr Ala Trp Leu Asp Lys Gly Ile
545 550 555 560
Leu Arg Asn Glu Ala Gly Leu Trp Asn Arg Ser Thr Phe Gln Tyr Ala
565 570 575
Asp Trp Leu Asp Pro Leu Ala Pro Pro Asp Asp Pro Gly Ala Ala Thr
580 585 590
Thr Asn Lys Tyr Leu Val Ser Asp Ala Tyr Leu Ile His Ser Thr Glu
595 600 605
Leu Val Ala Asn Ile Ser Ala Tyr Leu Asp Arg Pro Asp Asp Ala Glu
610 615 620
Arg Tyr Ala Ala Asp Arg Ala Asp Leu Thr Arg Ala Phe Gln Lys Ala
625 630 635 640
Trp Ile Ser Ala Asn Gly Thr Val Ala Asn Glu Thr Gln Thr Gly Leu
645 650 655
Thr Leu Pro Leu Tyr Phe Lys Leu Phe Glu Arg Pro Glu His Tyr Thr
660 665 670
Asp Ala Val Ser Arg Leu Val Asp Ile Ile Lys Glu Asn Glu Tyr Lys
675 680 685
Val Gly Thr Gly Phe Ala Gly Thr His Leu Leu Gly His Thr Leu Ser
690 695 700
Ala Tyr Asn Ala Ser Ser Thr Phe Tyr Asn Thr Leu Leu Gln Glu Asp
705 710 715 720
Val Pro Gly Trp Leu Phe Gln Val Leu Met Asn Gly Thr Thr Thr Trp
725 730 735
Glu Arg Trp Asp Ser Met Leu Ala Asn Gly Ser Val Asn Pro Gly Glu
740 745 750
Met Thr Ser Phe Asn His Tyr Ala Val Gly Ser Val Gly Ala Trp Met
755 760 765
His Glu Asn Ile Gly Gly Leu Arg Pro Ile Glu Pro Gly Trp Arg Arg
770 775 780
Phe Ala Val Asp Val Lys Val Gly Gly Gly Leu Ser Ser Ala Gln Glu
785 790 795 800
Arg Phe Leu Ser Pro Tyr Gly Ser Ala Glu Ser Ser Trp Glu Val Arg
805 810 815
Asp Gly Lys Phe Met Leu Gly Val Lys Val Pro Pro Asn Ser Glu Ala
820 825 830
Val Val Ser Leu Pro Gly Ala Pro Thr Arg Gly Lys Lys Glu Val Ile
835 840 845
Val Gly Ser Gly Met His Arg Phe Glu Ser Thr Leu Gly
850 855 860
<110> 佛山市汇腾生物技术有限公司
<120> 一种表达α-L-鼠李糖苷酶的毕赤酵母及其制备方法和应用
<130> SEQ ID No 2
<160> 2
<170> PatentIn version 3.3
<210> 2
<211> 2586
<212> DNA
<213> Aspergillus nidulans FGSC A4
<400> 2
atgtcgctgt caatttctgg cgtcactttt gagcaccacc gctctgcctt ggggattgga 60
gagccctctc cgcgtatctc ctggcggttt gacggcaccg tctcgaactg gacgcaatct 120
gcgtacgaga tcgagatcaa ccgcgctgga caagcgaaca ccttccgcgt caattcatcc 180
gactctgttc tcgtgccctg gccgagcgac ccgctgcaat ctggcgagga ggccactgtc 240
cgtgtgcgtt cattcggacg cgctaaccag cccgatgcgc cgtggtcgga ccctgttact 300
gttgagccgg ggctgctgga cgaagacgat tggcagagcg ctgtagcgat tgtctctgac 360
cgggagacag aggtcaatgc tacccatcga ccgatctact tccgcaagga cttcgatgta 420
gatgaggaga tcctctccgc cagactctat ataacggcct tgggtgtcta cgaggctgag 480
atcaatggcc agcccgttgg cgaccatgtc ctggcgcctg gatggcaagc atacagccat 540
cgccacgaat acaataccta cgacgtcacg gatctgctgc aaaccggcga caacacgatc 600
ggagtcaccg tgggcgaggg ctggtacgcc ggcgcgctga cctggtcgat gacgaggaat 660
atctacgggg acactctcgg tctcctctca ctactctcta tagccaccgc tgatggcaaa 720
acgatctacg tgcccagcga tgagacctgg cagtcttcta caggcccgat aattgcgtcc 780
gagatctata acggcgagac gtacgactcc acacaggcaa tcgaggggtg gtctcagccg 840
ggattcgatg catctggctg gctgggaact cacgaggtta ccttcgacaa gagcgtcctc 900
gctgcgccag atgcacccgc cgtgcgccgg gtggaagagc ggcggctgga gagtgtcttc 960
aagagcgcat ctggcaagac ggtcctcgac tttggccaga acctcgtcgg ctggctacgt 1020
gtgcgtgtca aggggccgag aggaagcaca atcagctttg ttcatactga agtgatggaa 1080
aacggcgaag tcgcaacgcg ccctctccgc aacgccaaag caaccgacaa cctgacgctc 1140
tctggcgaag agcaagaatg ggagccctcc ttcaccttcc acggcttccg ctacgtgcag 1200
gtgaccggct ggcccgagga aaccgagctc aacgccgaca gcgtcacggc catcgtgatc 1260
aacagcgaca tggaacagac cgggttcttc agctgctcga accctcttct gaacaagctc 1320
cacgagaaca tcatctggtc gatgcgtgga aacttcctct ccattccgac agattgtccc 1380
cagcgagacg agcgactcgg ctggacgggc gatatccatg cttttgcgcg gaccgcaaac 1440
ttcatctacg atacttcagg cttcttgcgt gggtggctga gggatgcata ctctgagcag 1500
ctggagaata attacgcacc cccttatgtt atacccaacg tgctcggccc cggctcaccg 1560
acctctatct ggggcgacgc catcgtcagc gtcccatggg acctcttcca aacctacggc 1620
gacaaggcca tgctgtccga gcaatacgct ggcgccacag cctggctaga taaaggcatc 1680
ctgcgcaacg aagctgggct ctggaaccgt tcgaccttcc agtacgcaga ctggctagac 1740
cccctcgcac caccagacga cccgggtgct gccacaacga acaagtatct cgtttcggac 1800
gcctacttaa tccacagcac cgagctggtc gccaacattt cagcgtatct ggaccgcccc 1860
gacgacgcag agaggtatgc tgcggatagg gcggatctca cgcgcgcctt tcagaaagcc 1920
tggatctcgg ccaatgggac ggttgcaaac gaaacgcaaa cagggctcac actgccgctg 1980
tacttcaagc tcttcgagcg acctgagcat tatacggatg cggtatcgag gctcgtcgat 2040
atcatcaaag agaacgagta caaagttggc accggctttg ctggaacaca cctcctcggc 2100
catacattat ccgcctacaa cgcctcatca acattctaca acacccttct gcaggaggat 2160
gtccctggat ggctgtttca agtcctcatg aacgggacca cgacctggga gcgctgggat 2220
agcatgctgg ccaacgggtc cgtgaatccc ggcgagatga cgagcttcaa tcactacgct 2280
gtcggaagcg tcggcgcttg gatgcacgag aacattggcg gactgagacc gatagagccg 2340
ggctggagac ggttcgcggt ggatgtaaag gttggcgggg ggttgagcag tgcgcaggag 2400
aggtttctga gtccgtacgg ttctgccgag agtagctggg aggtcagaga tggcaagttc 2460
atgctgggtg tgaaggtgcc tccaaatagt gaggctgttg tcagtcttcc tggagcccct 2520
acccgtggaa agaaggaggt tattgtagga tcagggatgc atcggtttga gagtacgctc 2580
ggttga 2586
