根管填充材料及牙组织再生试剂盒
文献发布时间:2023-06-19 13:51:08
本申请为申请号:201780021649.3、申请日:2017年3月31日、发明名称:“牙科用前处理材料及牙组织再生试剂盒”的中国发明专利申请的分案申请。所述中国发明专利申请为申请号:PCT/JP2017/013572的PCT国际申请的中国国家阶段申请,主张日本专利申请特愿2016-072306的优先权,优先权日为2016年3月31日。
技术领域
本发明涉及一种根管填充材料、以及含有该根管填充材料的牙组织再生试剂盒。
背景技术
使用了牙髄干细胞的利用牙髄、牙本质再生进行的蛀牙、牙髄疾病治疗法,由本发明人等明确了其安全性及有效性(专利文献1、2、3)。
牙的平均寿命目前据说是57岁,如果考虑一生用自己的牙咀嚼,则牙的寿命有必要提高20年以上。虽然有8020运动(即使达到80岁也残留自己的牙20颗以上的运动),但是目前80岁的人的牙的平均颗数约为8颗,高龄者的残存牙数几乎不增加,因此,期望利用高龄牙髄干细胞进行牙髄等再生。
高龄牙髄干细胞,干细胞形质与幼龄没有变化,但在高龄的狗的根管中自体移植高龄牙髄干细胞时,虽然再生牙髄、牙本质,但是,与幼龄相比,可看到再生的延迟(非专利文献1)。另外,关于牙髄再生的机制已知,移植牙髄干细胞没有直接进行分化,分泌营养因子(trophic因子),使干细胞从牙周围组织的微环境(niche)向牙内游走,通过增殖、抗细胞凋亡、血管新生、神经再生的促进而再生牙髄(非专利文献2)。进而,在高龄牙髄再生延迟的原因认为是牙周围组织的微环境(niche)的干细胞的游走能力、增殖能及细胞凋亡抑制能力的降低引起的,暗示微环境(niche)的老化(非专利文献1)。
一般而言,已知随着成为高龄,组织再生、维持能力急剧地降低,产生许多器官的功能缺陷。该现象认为是在肌肉中干细胞的微环境(niche)中的信号的变化引起的,暗示微环境(niche)的老化在全身组织中同样地产生。
近年来,明确了:作为促进微环境(niche)的老化的趋化因子通过动物实验鉴定了CCL11/Eotaxin,其从血中到全身周围带来中枢神经再生或认知功能的降低,但通过全身给药CCL11中和抗体,可以恢复神经再生(非专利文献3)。另外,得知:老化引起的心肌肥大是GDF11的血中水平减少引起的,可以通过GDF11的静脉注射而恢复(非专利文献4)。进而,有报道GDF11使老化的脑血管及神经再生亢进(非专利文献5)、提高老化的骨格肌的结构或功能(非专利文献6)。
但是,在医药品中,胰蛋白酶以使坏死组织或凝血、变性蛋白溶化、使创面正常化而使抗生物质的作用容易为目的被使用(非专利文献7)。另外,也有在根管的清扫中使用胰蛋白酶的文献(专利文献4)。但是,没有将胰蛋白酶应用于牙髄再生的文献。
另外,CCL11将CCR3作为受体传递信号(非专利文献8),但认为CCL11中和抗体具有抑制CCL11与CCR3结合的作用,CCR3拮抗剂也具有同样的作用。但是,没有将CCL11中和抗体或CCR3拮抗剂应用于牙髄再生的文献。
进而,GDF11与type I TGF-beta超家族受体ACVR1B(ALK4),TGFBR1(ALK5)及ACVR1C(ALK7)结合,但在ALK4及ALK5中进行信号传递(非专利文献9)。GDF11在牙中可看到在成牙本质细胞层中弱的表达((非专利文献10),在牙髄露出面上基因导入GDF11时,诱导牙本质形成(非专利文献11)。但是,对于在拔髄后的根管内的牙髄再生,GDF11及其受体ALK5的作用不清楚。
现有技术文献
专利文献
专利文献1:日本专利5621105号公报
专利文献2:日本专利5748194号公报
专利文献3:日本特开2014-168714号公报
专利文献4:日本特表2009-513227号公报
非专利文献
非专利文献1:Iohara K.,Murakami M.,Nakata K.,Nakashima M.:Age-dependent decline in dental pulp regeneration after pulpectomy indogs.Exp.Gerontol.52:39-45,2014.
非专利文献2:Iohara K.,Murakami M.,Takeuchi N.,Osako Y.,Ito M.,Ishizaka R.,Utunomiya S.,Nakamura H.,Matsushita K.,Nakashima M.:A novelcombinatorial therapy with pulp stem cells and granulocyte colony-stimulatingfactor for total pulp regeneration.Stem Cells Transl.Med.2(7):521-533,2013.
非专利文献3:Villeda S.A.,et al.,:The ageing systemic milieunegatively regulates neurogenesis and cognitive function.Nature.477(7362):90-94,2011.
非专利文献4:Loffredo F.S.,et al.,:Growth differentiation factor 11isa circulating factor that reverses age-related cardiac hypertrophy.Cell.153(4):828-839,2013.
非专利文献5:Katsimpardi L.,et al.,:Vascular and neurogenicrejuvenation of the aging mouse brain by young systemic factors.Science.344(6184):630-634,2014.
非专利文献6:Sinha M.,et al.,Restoring systemic GDF11 levels reversesage-related dysfunction in mouse skeletal muscle.Science.344(6184):649-52,2014.
非专利文献7:皮肤科性病科杂志64卷,野口义圀等,497-506页1954年
非专利文献8:Kitaura M.,et al.,Molecular cloning of human eotaxin,aneosinophil-selective CC chemokine,and identification of a specific eosinophileotaxin receptor,CC chemokine receptor 3.J Biol Chem.271(13):7725-30,1996.
非专利文献9:Andersson O.,et al.,Growth differentiation factor 11signals trough the transforming growth factor-βreceptor ALK5 to regionalizethe anterior-posterior axis.EMBO reports.7(8):831-7,2006.
非专利文献10:Nakashima M.,et al.,Expression of growth/differentiationfactor 11,a new member of the BMP/TGF beta superfamily during mouseembryogenesis.Mech Dev.80(2):185-9,1999.
非专利文献11:Nakashima M.,et al.,Induction of dental pulp stem celldifferentiation into odontoblasts by electroporation-mediated gene deliveryof growth/differentiation factor 11(Gdf11).Gene Ther.9(12):814-8,2002.
发明内容
发明要解决的技术问题
本发明是鉴于涉及的问题点而完成的,其目的在于,提供一种利用牙髄干细胞进行牙组织再生时的牙科用前处理材料、尤其是提供即使在中高龄个体中将自体或同种牙髄干细胞进行移植的情况下,也能够有效地进行牙组织再生的牙科用前处理材料。另外,其目的在于,提供一种使用该牙科用前处理材料的牙组织再生试剂盒。进而,其目的在于,提供一种即使在将源自中高龄个体的牙髄干细胞进行移植的情况下,也能够有效地进行牙组织再生的根管填充材料。
用于解决问题的技术方案
本发明涉及的用于牙组织再生的牙科用前处理材料的特征在于,含有丝氨酸蛋白酶。
本发明涉及的牙组织再生试剂盒的特征在于,含有本发明涉及的牙科用前处理材料和要插入于根管的具备牙髄干细胞及细胞外基质的根管填充材料。
本发明涉及的根管填充材料含有自体或同种的牙髄干细胞、细胞外基质、及ALK5抑制剂。
另外,本发明涉及的根管填充材料,含有自体或同种的牙髄干细胞、细胞外基质、及CCR3拮抗剂。
另外,本发明涉及的根管填充材料含有自体或同种的牙髄干细胞、细胞外基质、及CCL11中和抗体。
发明效果
根据本发明,即使在中高龄个体中将自体牙髄干细胞进行移植的情况下,也可以有效地进行牙组织再生。
附图说明
图1是表示使用了膜游走分取法的狗牙髄干细胞的形态学的观察的照片图,其中A是牙髄细胞培养第2天,B是牙髄细胞培养第7天,C是膜分取后第2天,D是第7代膜分取牙髄干细胞第3天。
图2是将狗中高龄正常牙与幼龄正常牙进行比较的图,其中A、C及E是幼龄牙,B、D及F是中高龄牙。A及B是Masson三色染色像,C及D是波形蛋白(Vimentin)免疫染色像,E及F是多功能蛋白聚糖(Versican)免疫染色像。
图3是使用了含有狗中高龄牙髄干细胞及胶原(aterocollagen)的根管填充材料的拔髄后根管内自体移植后14天的根尖部牙周组织像,其中A及C是未进行前处理的情况,B及D是使用了10分钟包含胰蛋白酶0.05%的前处理材料的情况。A及B是Masson三色染色像,C及D是波形蛋白(Vimentin)免疫染色像。
图4是使用了含有狗中高龄牙髄干细胞及胶原的根管填充材料的利用拔髄后根管内自体移植进行的牙髄再生的照片图(移植后第14天H-E染色),其中A是未进行前处理的情况的根管内像,B是使用了10分钟含50μg/ml(0.05%)胰蛋白酶的前处理材料的情况的牙髄再生,C是使用了10分钟含500μg/ml(0.5%)胰蛋白酶的前处理材料的情况的牙髄再生。D是进行了牙髄再生量的统计学的分析的图。
图5是使用了含有狗中高龄牙髄干细胞及胶原的根管填充材料的利用拔髄后根管内自体移植进行的牙髄再生的照片图(移植后14天H-E染色),其中A是未进行前处理的情况的牙髄再生第14天,B是使用了10分钟含胰蛋白酶的前处理材料的情况的牙髄再生第14天,C是使用了30分钟含胰蛋白酶的前处理材料的情况的牙髄再生第14天,D是使用了10分钟含胰蛋白酶及纳米泡的前处理材料的情况的牙髄再生第14天。E是进行了牙髄再生量的统计学的分析的图。
图6是表示再生牙髄中的血管新生的照片图(BS-1lectin染色),其中A是未进行前处理的情况的牙髄再生第14天,B是使用了10分钟含胰蛋白酶的前处理材料的情况的牙髄再生第14天,C是使用了30分钟含胰蛋白酶的前处理材料的情况的牙髄再生第14天,D是使用了10分钟含胰蛋白酶及纳米泡的前处理材料的情况的牙髄再生第14天。
图7是在狗的牙拔髄后的根管内进行胰蛋白酶处理、没有将牙髄干细胞移植到根管内的情况的根管内的照片图。
图8是表示使用进行了胰蛋白酶处理的细粒化牙本质的情况的、牙髄干细胞向牙髄、牙本质组织的诱导的照片图,(i)表示进行了10分钟0.05%胰蛋白酶处理的情况、(ii)表示进行了10分钟0.05%胰蛋白酶和1mM EDTA处理的情况、(iii)表示进行了10分钟1mMEDTA处理的情况、(iv)表示进行了10分钟0.05%胰凝乳蛋白酶处理的情况、(v)表示进行了10分钟0.1mg/mL MMP3处理的情况、(vi)表示未处理的情况。
图9是表示中高龄狗同种牙髄干细胞移植14天后的形态学的观察的照片图。其中A是将ALK5抑制剂(SB431542、200ng)与牙髄干细胞、G-CSF及胶原蛋白一起移植的牙,B是将CCR3拮抗剂(SB328437、200ng)与牙髄干细胞、G-CSF及胶原蛋白一起移植的牙。C是仅将牙髄干细胞、G-CSF及胶原蛋白如通用方法那样移植的对照。
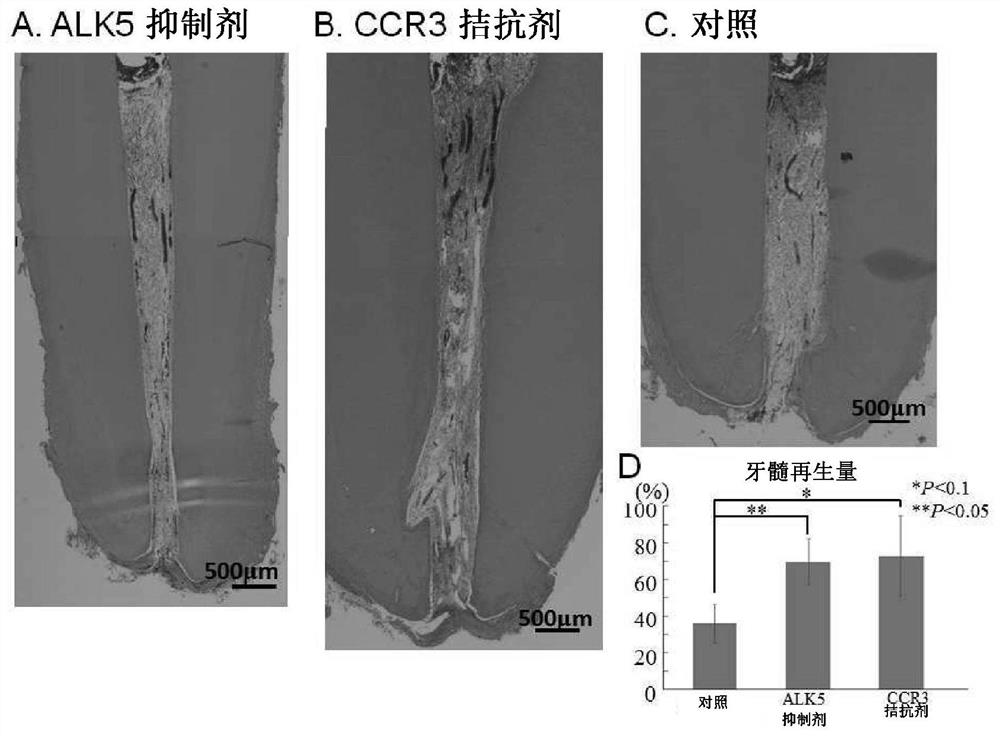
图10是表示中高龄狗自体牙髄干细胞移植60天后的形态学的观察的照片图。其中A是将ALK5抑制剂(SB431542、200ng)与牙髄干细胞、G-CSF及胶原蛋白一起移植的牙,B是将CCR3拮抗剂(SB328437、200ng)与牙髄干细胞、G-CSF及胶原蛋白一起移植的牙。C是仅将牙髄干细胞、G-CSF及胶原蛋白如通用方法那样移植的对照。D是将牙髄再生量进行统计学上比较的图。*P<0.1、**P<0.05
图11是表示中高龄狗同种牙髄干细胞移植60天后的血管新生的照片图。其中A是将ALK5抑制剂(SB431542、200ng)与牙髄干细胞、G-CSF及胶原蛋白一起移植的牙,B是将CCR3拮抗剂(SB328437、200ng)与牙髄干细胞、G-CSF及胶原蛋白一起移植的牙。C是仅将牙髄干细胞、G-CSF及胶原蛋白如通用方法那样移植的对照。D是将血管新生量进行统计学上比较的图。*P<0.1
图12是表示中高龄狗同种牙髄干细胞移植60天后的神经突起伸长再生(re-innervation)的照片图。其中A是将ALK5抑制剂(SB431542、200ng)与牙髄干细胞、G-CSF及胶原蛋白一起移植的牙,B是将CCR3拮抗剂(SB328437、200ng)与牙髄干细胞、G-CSF及胶原蛋白一起移植的牙。C是仅将牙髄干细胞、G-CSF及胶原蛋白如通用方法那样移植的对照。D是将神经再生量进行统计学上比较的图。**P<0.01
图13是表示幼龄狗同种牙髄干细胞移植14天后的形态学的观察的照片图。其中A是将CCR3拮抗剂(SB328437、200ng)与牙髄干细胞、G-CSF及胶原蛋白一起移植的牙。B是仅将牙髄干细胞、G-CSF及胶原蛋白如通用方法那样移植的对照。C是将牙髄再生量进行统计学上比较的图。
图14是表示中高龄狗同种牙髄干细胞移植14天后的形态学的观察的照片图。其中A是用胰蛋白酶前处理后,将CCR3拮抗剂(SB328437、200ng)与牙髄干细胞、G-CSF及胶原蛋白一起移植的牙,B是未用胰蛋白酶进行前处理而将CCR3拮抗剂(SB328437、200ng)与牙髄干细胞、G-CSF及胶原蛋白一起移植的牙。C是用胰蛋白酶前处理后,仅将牙髄干细胞、G-CSF及胶原蛋白如通用方法那样移植的对照。D是将牙髄再生量进行统计学上比较的图。
图15是表示人牙髄干细胞中的细胞老化和CCL11及CCR3的表达的关系的图。关于A,与幼龄及中高龄的人牙髄干细胞一起长期继代时,也可看到p16的mRNA表达上升、CCL11的mRNA表达上升。即,伴随老化,暗示CCL11表达上升的可能性。关于B,就作为CCL11的受体的CCR3的mRNA表达而言,将中高龄的人牙髄干细胞长期继代时,可看到上升,但在幼龄中没有看到变化。予以说明,图中的说明中,高龄的表述是中高龄的表述省略后的记载。以下相同。
图16A通过在表达CCL11的牙髄干细胞中添加CCL11中和抗体可看到CCL11的表达的消失。B是表示相对于长期继代的人幼龄牙髄干细胞的游走能力的CCL11中和抗体的效果的图。长期继代时,游走能力下降,但添加CCL11中和抗体时,游走能力上升。
图17是表示幼龄及中高龄小鼠中的血中CCL11浓度的图。在中高龄小鼠中,通过CCL11中和抗体给药,血中CCL11浓度显著地减少。*P<0.05、**P<0.01
图18是表示CCL11中和抗体给药导致的中高龄小鼠异位牙根移植后再生牙髄的再生量促进效果的图。(A、B、F、G)是对幼龄小鼠进行异位牙根移植21天后的再生牙髄的HE像,(C-E、H-J)是对中高龄小鼠进行异位牙根移植21天后的再生牙髄的HE像。在异位移植时,与牙髄干细胞一起,(B、G、D、I)表示进行了CCL11中和抗体的持续给药的结果,(E、J)表示进行了海藻糖的持续给药的结果。(A、F、C、H)仅表示牙髄干细胞的对照的移植。(K)是再生量(再生牙髄面积/根管内总面积)比较的图表。*P<0.05、**P<0.01
图19是表示CCL11中和抗体给药导致的中高龄小鼠异位牙根移植后再生牙髄的新生血管密度增加及基质化量减少的图。(A、B、E、F)表示幼龄小鼠的异位牙根移植后再生牙髄的结果,(C、D、G、H)表示中高龄小鼠的异位牙根移植后再生牙髄的结果。在异位移植时,(B、F、D、H)表示进行了CCL11中和抗体的持续给药的结果。(A-D)是lectin染色像。(E-H)是Masson trichrome(MT)染色像。I是幼龄小鼠和中高龄小鼠的新生血管面积的比较图,J是幼龄小鼠和中高龄小鼠的基质化面积的比较图。*P<0.05、**P<0.01
图20是表示CCL11中和抗体给药导致的小鼠异位牙根移植后再生牙髄中的M1及M2巨噬细胞细胞数及M1/M2比的变化的图。在中高龄小鼠异位牙根移植后再生牙髄中,可看到通过CCL11中和抗体给药而M1巨噬细胞细胞数及M1/M2比的显著的减少。(A、B、E、F)表示幼龄小鼠、(C、D、G、H)是中高龄小鼠的异位牙根移植后再生牙髄的结果。(B、D、F、H)是CCL11中和抗体持续给药组。A-D:再生牙髄的CD68及CD11c形成的二重免疫组织染色像(绿:CD68红:CD11c)E-H:再生牙髄的CD68及CD206形成的二重免疫组织染色像(绿:CD68红:CD206)I:再生牙髄中的M1巨噬细胞细胞数J:再生牙髄中的M2巨噬细胞细胞数K:M1/M2比。*P<0.05、**P<0.01数据表示4次的实验的平均±标准偏差。
图21表示在活体内,在相对于HUVEC(人脐带静脉内皮细胞)继代至22代并老化的牙髄干细胞(DPSCs)的培养上清液中添加ALK5抑制剂(SB431542、10ng/μl)及CCR3拮抗剂(SB328437、5ng/μl)、在基底胶上进行了培养的情况的血管新生能力的变化。A是仅对照的培养上清液的相位差显微镜像,B是在培养上清液中添加了ALK5抑制剂的物质的相位差显微镜像,C是在培养上清液中添加了CCR3拮抗剂的物质的相位差显微镜像。D是将新生的血管的长度进行统计学上比较的图。*P<0.05
图22表示在活体内,在相对于TGW细胞(神经芽细胞瘤细胞株、humanneuroblastoma cell)继代至22代并老化的牙髄干细胞(DPSCs)的培养上清液中添加ALK5抑制剂(SB431542、10ng/μl)及CCR3拮抗剂(SB328437、5ng/μl),诱导了神经突起伸长的情况的变化。A是仅培养上清液的相位差显微镜像,B是在培养上清液中添加了ALK5抑制剂的物质的相位差显微镜像,C是在培养上清液中添加了CCR3拮抗剂的物质的相位差显微镜像,D是添加了阳性对照的GDNF的物质的相位差显微镜像。E是将神经突起的长度进行统计学上比较的图。*P<0.1、**P<0.05
图23表示在活体内,在相对于5代人牙髄细胞继代至22代并老化的牙髄干细胞(DPSCs)的培养上清液中添加ALK5抑制剂(SB431542、10ng/μl)及CCR3拮抗剂(SB328437、5ng/μl)的情况下,游走能力促进效果的变化。
具体实施方式
以下,参照附上的附图,对本发明的实施方式具体地进行说明,但该实施方式用于容易理解本发明的原理,本发明的范围并不限于下述的实施方式,本领域技术人员适当置换了以下的实施方式的构成得到的其它实施方式也包含在本发明的范围中。
本实施方式涉及的用于牙组织再生的牙科用前处理材料,含有丝氨酸蛋白酶。本实施方式涉及的用于牙组织再生的牙组织再生试剂盒含有抑制CCL11的CCL11中和抗体或CCR3拮抗剂、或抑制GDF11的信号传递的ALK5抑制剂。
牙组织再生是指包含牙髄、牙本质、及根尖牙周组织的至少任一个的组织的再生。
伴随年龄增长,在牙或牙周组织上产生变化。具体而言,伴随年龄增长,牙骨质肥厚,特别是根尖部的牙骨质的肥厚化显著。另外,伴随年龄增长,牙周膜发生牙周膜纤维的石灰化。牙科用前处理材料是在将具备牙髄干细胞及细胞外基质的根管填充材料插入于根管之前使用的材料。前处理为将含有丝氨酸蛋白酶的液体注入于根管内。通过使用牙科用前处理材料,可以进行将肥厚化的牙骨质或石灰化的牙周膜进行分解的处理。另外,通过使用牙科用前处理材料,可以进行将抑制牙或牙周组织中的组织再生的抑制剂进行分解、或将再生促进因子进行活化的处理。
丝氨酸蛋白酶是具有进行亲核攻击的丝氨酸残基作为催化剂残基的蛋白酶(蛋白质分解酶)。丝氨酸蛋白酶,从氨基酸序列或立体结构的类似性可分类为类枯草杆菌蛋白酶(subtilisin-like)丝氨酸蛋白酶和类胰凝乳蛋白酶(chymotrypsin-like)丝氨酸蛋白酶。前者有枯草杆菌蛋白酶BPN'(subtilisin BPN')、耐热蛋白酶(thermitase)、蛋白酶K(proteinase K)、抗生肽酶(lantibiotic peptidase)、克新(kexin)、黄瓜素(cucumisin)等,后者有胰蛋白酶、胰凝乳蛋白酶、凝血酶(thrombin)、Xa因子、弹性蛋白酶(elastase)等。优选丝氨酸蛋白酶为类胰凝乳蛋白酶(chymotrypsin-like)丝氨酸蛋白酶,更优选为胰蛋白酶。
牙科用前处理材料优选在将在中高龄个体中使用牙髄干细胞的根管填充材料插入于根管之前使用,但即使在使用幼年个体的牙髄干细胞的情况下,也可以使用。予以说明,中龄个体没有特别限定,例如,其为人的情况下,为年龄30岁以上49岁以下,其为大鼠的情况下,为生后30周龄以上39周龄以下,其为狗的情况下,为生后3年龄以上4年龄以下。高龄个体没有特别限定,例如,其为人的情况下,为年龄50岁以上,其为大鼠的情况下,为生后40周龄以上,其为狗的情况下,为生后5年龄以上。因而,本说明书中人中高龄个体规定为30岁以上的个体,大鼠中高龄个体规定为生后30周龄以上的个体,狗中高龄个体规定为生后3年以上的个体。
对于包含于牙科用前处理材料的丝氨酸蛋白酶的浓度而言,只要可以进行将肥厚化的牙骨质或石灰化的牙周膜进行分解的处理,就没有特别限定,例如为50μg/ml(0.05%)~500μg/ml(0.5%),优选为100μg/ml(0.1%)~300μg/ml(0.3%)。
对于将牙科用前处理材料注入于根管内的时间而言,只要可以进行将肥厚化的牙骨质或石灰化的牙周膜进行分解的处理,就没有特别限定,例如为3分钟~30分钟,优选为5分钟~20分钟,更优选为10分钟。
在本实施方式涉及的牙科用前处理材料中,除丝氨酸蛋白酶之外,也可以包含纳米泡。纳米泡含有由脂质形成的小胞和填充该小胞内的气体或气体前体。纳米泡的直径没有特别限定,例如为10~500nm,优选为100~400nm。予以说明,纳米泡的直径利用例如纳米粒子分布测定装置(SALD-7100、岛津制作所)进行测定。纳米泡的脂质组成、带电状态、密度、重量、粒径等可以适当设计。为了制备小胞而使用的脂质没有特别限定,由含有脂质类的膜构成成分构成。脂质类例如除了磷脂质、甘油糖脂质及神经鞘糖脂质之外,为在这些脂质中导入有伯氨基、仲氨基、叔氨基或季铵基的阳离子性脂质。
在牙科用前处理材料中含有纳米泡时,纳米泡浓度用牙科用前处理材料中的纳米泡的个数表示。纳米泡浓度没有特别限定,例如可以设为1000个/cm
牙组织再生试剂盒含有前述的牙科用前处理材料、和要插入于根管的具备牙髄干细胞及细胞外基质的根管填充材料。
根管填充材料例如含有自体或同种牙髄干细胞、细胞外基质、及ALK5抑制剂。
根管填充材料例如含有自体或同种牙髄干细胞、细胞外基质、及CCR3拮抗剂。
根管填充材料例如含有自体或同种牙髄干细胞、细胞外基质、及CCL11中和抗体。
另外,根管填充材料含有:自体或同种牙髄干细胞、细胞外基质、和从ALK5抑制剂、CCR3拮抗剂、及CCL11中和抗体这3个中包含至少2个的混合物。在后述的实施例中示出具有如下特征:ALK5抑制剂及CCR3拮抗剂均在牙髄再生中是有效的,但ALK5抑制剂与CCR3拮抗剂相比在血管新生中是有效的,另一方面,CCR3拮抗剂与ALK5抑制剂相比在神经新生中是有效的。因此,例如根管填充材料可以设为含有自体或同种牙髄干细胞、细胞外基质、和ALK5抑制剂及CCR3拮抗剂的混合物的材料。在使用ALK5抑制剂及CCR3拮抗剂的混合物的情况下,其混合比例没有特别限定,例如可以设为10重量%:90重量%~90重量%:10重量%。
ALK5抑制剂没有特别限定,例如为下述化合物。
[化学式1]
[化学式2]
[化学式3]
另外,CCR3拮抗剂没有特别限定,例如为下述化合物。
[化学式4]
[化学式5]
这里,A为CH
CCL11将CCR3作为受体传递信号,但抗CCL11中和抗体具有抑制CCL11与CCR3结合的作用,CCR3拮抗剂也具有同样的作用。抗CCL11中和抗体可以使用市售的物质。
本实施方式涉及的抑制CCL11的CCL11中和抗体或CCR3拮抗剂、或抑制GDF11的信号传递的ALK5抑制剂例如为50ng/ml~50μg/ml,优选为10μg/ml~30μg/ml。
牙髄干细胞没有特别限定,例如是包含CD105阳性细胞、CXCR4阳性细胞、SSEA-4阳性细胞、FLK-1阳性细胞、CD31阴性且CD146阴性细胞、CD24阳性细胞、CD150阳性细胞、CD29阳性细胞、CD34阳性细胞、CD44阳性细胞、CD73阳性细胞、CD90阳性细胞、FLK-1阳性细胞、G-CSFR阳性、及SP细胞中的至少任一个的细胞。SP细胞例如为CXCR4阳性、SSEA-4阳性、FLK-1阳性、CD31阴性且CD146阴性、CD24阳性、CD105阳性、CD150阳性、CD29阳性细胞、CD34阳性细胞、CD44阳性细胞、CD73阳性细胞、CD90阳性细胞、FLK-1阳性或G-CSFR阳性的任一种。
细胞外基质没有特别限定,例如包含胶原蛋白、人工蛋白聚糖、明胶、水凝胶、纤维蛋白、磷胆碱、硫酸类肝素、肝素、层粘连蛋白、纤维连接蛋白、海藻酸、透明质酸、壳多糖、PLA、PLGA、PEG、PGA、PDLLA、PCL、羟基磷灰石、β-TCP、碳酸钙、钛及金中的至少任一个。
在根管填充材料中,除牙髄干细胞及细胞外基质之外,还可以包含细胞游走因子。细胞游走因子例如是包含G-CSF、SDF-1、bFGF、TGF-β、NGF、PDGF、BDNF、GDNF、EGF、VEGF、SCF、MMP3、Slit、GM-CSF、LIF及HGF中的至少任一个的游走因子。
牙髄干细胞的分取方法没有特别限定。例如,SP细胞用Hoechst33342标记,将较强地排出该色素的组分用流式细胞仪,在Hoechst Blue和Hoechst Red中进行分取。另外,例如也可以通过在干细胞中使用对特异性的膜表面抗原的抗体而进行分取,具体而言,为使用磁珠的分取。另外,例如,也可以为使用膜分取培养器的分取。膜分取培养器含有上部结构体和下部结构体而构成,上部结构体由在底面的至少一部分用具有干细胞透过用的孔隙的分离膜形成的容器构成,下部结构体由保持使上部结构体的膜浸渍的培养基的容器构成(作为本发明人等的公报,日本再表2012/133803记载的内容被引用于本发明。)。分离膜具备由疏水性聚合物构成的基材膜和在基材膜的表面通过共价键结合亲水性聚合物而成的功能层。孔隙的尺寸例如为3μm~10μm,密度例如为1×10
实施例
[实施例1]
(狗中高龄牙髄干细胞的特性)
在狗5岁龄的雌体(体重10kg)中实施全身麻醉之后,拔去上鄂犬牙,从牙冠至牙根部用涡轮棒在纵方向放入未达到牙髄的程度的割线,将含有20μg/ml庆大霉素(ゲンタロール(注册商标)、株式会社日本点眼药研究所)及0.25μg/ml两性霉素B(ファンギゾン(注册商标)、Bristol-Myers株式会社)的Hanks液作为输送液,使用特殊的运输容器在温度控制下在1小时以内输送牙。在超净工作台内将牙髄摘除、细切,加入0.04mg/ml释放酶溶液5ml并进行颠倒混合后,在恒温混匀器(ThermoMixer comfort)(Eppendorf株式会社)上于37℃以500rpm振荡30分钟。振荡后,悬浮30次之后,用隔离器内置型冷却离心机(株式会社トミー精工)以200rpm离心1分钟,采取离心管内的上清液。将该上清液以2000rpm离心5分钟,在沉淀的细胞中加入含10%狗自身血清的DMEM,悬浮后,以2,000rpm离心5分钟。再在离心沉淀的细胞中加入含10%狗血清的DMEM5 ml,悬浮30次。将细胞悬浮液与台盼蓝(0.4%,SIGMA)等量混合,悬浮10次,计数活细胞数。向T25烧瓶均匀地播种剩余的悬浮液之后,在CO
关于细胞表面抗原,在第5代,以1×10
从中高龄狗牙髄组织中分离的第2代的牙髄细胞(图1A、B)播种于膜游走分取器的上部结构体时,约3%根据G-CSF浓度梯度在下部结构体中游走,并附着于孔。2天后,可看到具有短突起的星状的细胞(图1C),逐渐形成菌落,在10天左右达到70%汇合。将该细胞继代至第7代时(图1D),可得到8×10
将冻结保存过的第7代细胞进行解冻,利用流式细胞计观察表面抗原的表达时,CD29、CD44、CD73、CD90及CD105阳性率为95%以上,CD31为阴性,认为较多地含有干细胞、前体细胞。另外,CXCR4及G-CSFR阳性率分别为7.4%、60.0%(表1)。
[表1]
(狗中高龄的牙及牙周组织的微小环境)
实施全身麻醉之后,屠杀中高龄及幼龄的狗,其后,对上鄂2号在含有根尖部牙周组织的状态下采取牙。采取后,按照通用方法制作纵截面的5μm石蜡切片,进行了H-E染色后形态观察。另外,进行了Masson三色染色及波形蛋白(Vimentin)或多功能蛋白聚糖(versican)(Vcan)的免疫组织学的染色。即,脱石蜡后,在3%过氧化氢水/乙醇中反应10分钟而抑制内因性过氧化酶。通过10%兔血清60分钟处理阻滞后,作为一次抗体,使小鼠抗人波形蛋白(vimentin)(Abcam,1:100)、小鼠抗人多功能蛋白聚糖(versican)(Millipore,1:100)在4℃下反应一夜。第二天,使用DAKO LSABII试剂盒利用DAB进行了抗原的检测。作为核染色,进行了苏木精染色。关于基质形成,对脱石蜡的5μm标本切片评价Masson三色染色。
在Masson三色染色中,在中高龄中显著地看到牙骨质的肥厚、骨化,确认牙周膜的狭窄(图2A、B)。在根尖部牙周组织中,波形蛋白(vimentin)的表达在中高龄中较强地看到,在幼龄中没怎么看到(图2C、D)。另一方面,幼龄的多功能蛋白聚糖(versican)的表达与中高龄相比,较强地表达(图2E、F)。
(使用了狗中高龄牙髄干细胞的拔髄后牙髄再生)
实施全身麻醉之后,在中高龄及幼龄的狗上下鄂前牙部进行拔髄处置,以#50~55放大至根尖部之后,用5%次氯酸钠溶液和3%过氧化氢水交替清洗后,进一步用生理食盐水清洗,用纸捻将根管内完全干燥,止血后,用粘结剂和树脂完全临时密封。拔髄处置7-14天后,解开临时密封,再次交替清洗,用生理食盐水清洗后,使スメアクリーン(SmearClean)反应20秒,进一步用生理食盐水清洗、干燥。其后,使FRANCETIN·T·POWDER(每10mg结晶胰蛋白酶(Trypsin)2500USP)(持田制药株式会社)50μg/ml(0.05%)或500μg/ml(0.5%)从根尖作用10分钟或30分钟后,用生理食盐水清洗。作为对照的相反侧的牙未进行处置。另外,将FRANCETIN·T·POWDER用纳米泡液调整为50μg/ml(0.05%),同样地作用10分钟,用生理食盐水清洗。将自体的膜分取牙髄干细胞1×10
使用含有作为支架(scaffold)的胶原、作为游走因子的G-CSF和牙髄干细胞的根管填充材料,将该根管填充材料注入于5岁的狗的牙的拔髄后的根管内,结果在第14天没有看到炎症性细胞浸润或内部吸收,可看到少量牙髄组织的再生。适应胰蛋白酶时,通过Masson三色染色或波形蛋白(vimentin)免疫染色确认了根尖部牙周组织的基质的溶化(图3A-D)。在根管填充材料的注入前在根管内进行10分钟50μg/ml(0.05%)胰蛋白酶适应时,牙髄再生量增大到2.5倍(图4A、B、D),进而,使胰蛋白酶浓度增加到500μg/ml(0.5%),在根管内作用10分钟的情况下,与50μg/ml(0.05%)相比,在牙髄再生量上没有看到显著差异(图4C、D)。进行30分钟50μg/ml(0.05%)胰蛋白酶适应时,与适应10分钟相比,牙髄再生量增大到2倍(图5B、C、E)。另外,进行10分钟以成为50%的方式添加有纳米泡的50μg/ml(0.05%)胰蛋白酶的适应时,牙髄再生量增大到4倍(图5D、E)。另外,在根尖的状态下没有看到炎症等的异常。在各自的再生牙髄中可看到血管新生(图6B-D)。对于用胰蛋白酶作用之后形成的牙髄而言,特别是没有看到炎症性细胞的增大或坏死层的形成等。由此,暗示:使胰蛋白酶作用时,牙髄再生量更显著地增大。可认为是因为,年龄增长导致的肥厚的牙骨质或基质化的牙周膜被胰蛋白酶分解,牙周膜中的干细胞容易游走。进而,在牙本质、牙骨质中,较多地分泌成长因子、游走因子(Miki Y,1987),也可以考虑利用胰蛋白酶而被放出的生物体中的干细胞更容易游走的可能性。另外,没有看到添加胰蛋白酶导致的根尖周围的异常,因此,认为对生物体的伤害是轻微的。
在5岁的狗的牙的拔髄后的根管内进行50μg/ml(0.05%)胰蛋白酶处理,没有将牙髄干细胞移植到根管内的情况下,在根尖周围没有看到炎症,但几乎没有看到牙髄再生(图7)。
[实施例2]
(使用进行了胰蛋白酶处理的细粒化牙本质时,牙髄干细胞向牙髄、牙本质组织的诱导)
将狗的牙拔牙后,机械地除去牙骨质和牙髄,用3小时流水清洗后,进行破碎,用筛子将直径500-1000μm的牙本质的细粒(细粒化牙本质)分开。接着,用氯仿·甲醇混合液在室温下进行4℃的处理6小时,用LiCl(8.0M)进行4℃的处理24小时后,在蒸馏水中进行55℃的钝化处理24小时。其后,对细粒化牙本质,分成6个组进行处理:(i)0.05%胰蛋白酶处理10分钟、(ii)0.05%胰蛋白酶和1mM EDTA处理10分钟、(iii)1mM EDTA处理10分钟、(iv)0.05%胰凝乳蛋白酶处理10分钟、(v)0.1mg/mL MMP3处理10分钟、(vi)未处理。将狗牙髄干细胞2×10
该结果,(i)的胰蛋白酶处理牙本质及(ii)的胰蛋白酶和EDTA处理牙本质与(vi)的未处理牙本质相比,细胞更容易粘接,更加促进牙髄、牙本质组织的诱导(图8)。(iii)的仅EDTA处理,虽然附着细胞数差,但是,进行了牙本质诱导。另外,(iv)的胰凝乳蛋白酶处理、或(v)的MMP3处理牙本质与(i)的胰蛋白酶处理或(ii)的胰蛋白酶和EDTA处理牙本质相比,虽然细胞粘接性差,但是,可看到一些细胞粘接。在(vi)的未处理中,几乎没有看到向牙本质表面的细胞粘接(图8)。由此,暗示了胰蛋白酶及胰蛋白酶·EDTA使在发生期从牙髄干细胞/前体细胞或成牙本质细胞分泌并蓄积于牙本质基质中的各种成长、分化因子等开放、活化而促进牙髄的再生的可能性。
即,对于使用本发明人等的根管填充材料的牙髄及牙本质再生的机制而言,插入于根管的根管填充材料的牙髄干细胞分泌营养因子(trophic因子),使干细胞从牙周围组织的微环境(niche)向根管内游走,通过增殖、抗细胞凋亡、血管新生、神经再生的促进,再生牙髄及牙本质。这里,成为治疗对象的根管例如为老龄个体时,发生根尖部的牙骨质的肥厚化或牙周膜纤维的石灰化,因此,来自牙周围组织的向根管内的干细胞的游走有可能被抑制。但是,通过使用本申请发明的牙科用前处理材料,可以进行将肥厚化的牙骨质或石灰化的牙周膜进行分解的处理,来自牙周围组织向根管内的干细胞的游走很难被抑制。另外,通过使用本申请发明的牙科用前处理材料,蓄积于牙本质基质中的各种成长、分化因子等被放出,因此,容易促进牙髄及牙本质再生。
[实施例3]
(在狗幼龄及中高龄个体中同种移植了牙髄干细胞的拔髄后牙髄再生)
实施全身麻醉之后,在中高龄(5岁)及幼龄的狗上下鄂前牙部进行拔髄处置,以#50~55放大至根尖部后,用5%次氯酸钠溶液和3%过氧化氢水交替清洗后,进一步用生理食盐水清洗,用纸捻将根管内完全干燥并止血后,用粘结剂和树脂完全临时密封。拔髄处置7-14天后,解开临时密封。再次交替清洗,用生理食盐水清洗后,使スメアクリーン(SmearClean)反应2分钟,进一步用生理食盐水清洗并进行干燥。将同种的膜分取牙髄干细胞1×10
将含有ALK5抑制剂或CCR3拮抗剂的根管填充材料注入于中高龄狗的牙的拔髄后的根管内,结果,在14天后及60天后,与不含有这些物质的根管填充材料相比,看到显著地牙髄组织再生量的增加(图9、图10)。适应ALK5抑制剂或CCR3拮抗剂时,在60天后,注入了含有ALK5抑制剂的根管填充材料一方与注入不含有ALK5抑制剂的根管填充材料相比,对于血管新生密度(图11)而言,显著地高(参照表示图11D的血管新生量的图表)。在60天后,注入了含有CCR3拮抗剂的根管填充材料一方与注入不含有CCR3拮抗剂的根管填充材料相比,对于神经突起伸长(图12)而言,显著地高(参照表示图12D的神经新生量的坐标图)。
将含有CCR3拮抗剂的根管填充材料注入于幼龄狗的牙的拔髄后的根管内,结果,在14天后,与不含有CCR3拮抗剂的根管填充材料相比,在牙髄组织再生量上没有看到显著的差异(图13)。即,明确了:CCR3拮抗剂对中高龄个体(是含有中龄个体及高龄个体这两者的概念。)是特别有效的(参照表示图13C的牙髄组织再生量的图表)。另外,明确了:ALK5抑制剂对中高龄个体是特别有效的。在下述实施例中进一步明确了:CCR3拮抗剂、ALK5抑制剂、及CCL11中和抗体对中高龄个体是特别有效的。
[实施例4]
(在狗中高龄个体中将胰蛋白酶前处理后牙髄干细胞与含有ALK5抑制剂或CCR3拮抗剂的根管填充材料与同种牙髄干细胞一起移植的拔髄后牙髄再生)
拔髄处置7-14天后,再次交替清洗,用生理食盐水清洗后,使スメアクリーン(Smear Clean)反应20秒,用生理食盐水清洗并进行干燥。进而,将FRANCETIN·T·POWDER(每10mg结晶胰蛋白酶(Trypsin)2500USP)(持田制药株式会社)用纳米泡液调整为50μg/ml(0.05%),并作用10分钟,用生理食盐水清洗并进行干燥。与实施例3同样地,将同种的膜分取牙髄干细胞1×10
在胰蛋白酶前处理后进一步将含有CCR3拮抗剂的根管填充材料注入于中高龄狗的牙的拔髄后的根管内,结果,在14天后,与没有进行前处理的情况相比,在牙髄组织再生量上可看到显著的差异(图14)。即,认为ALK5抑制剂或CCR3拮抗剂与胰蛋白酶具有协同效果。
[实施例5]
(人中高龄牙髄干细胞中的CCL11中和抗体及CCR3拮抗剂的效果)
1.牙髄干细胞培养
在得到同意后,从高龄者(60、70岁)及幼龄者(19、26岁)的第3大臼牙中取出牙髄,在Hanks液中细切后,于37℃用0.04mg/ml释放酶溶液(Roche diagnostics,Pleasanton,CA,USA)进行酶消化1小时,将牙髄细胞进行分离,在含10%人血清的DMEM(D6429)(Sigma-Aldrich,St.Louis,MO,USA)中以2~4×10
2.Real-time RT-PCR
使用Trizol(Life Technologies),从各种细胞中提取总RNA,DNase(Rochediagnostics)处理后,用ReverTra Aceα(TOYOBO,Tokyo,Japan)合成First-strand cDNA。对于Real-time RT-PCR而言,关于CCL11mRNA,使用PowerUp
[表2]
表 人Real-time RT-PCR引物
3.CCL11中和抗体处理引起的牙髓干细胞的CCL11蛋白表达变化的分析
除去细胞的上清液,用PBS(-)清洗数次后,在不存在血清条件下,在含CCL11中和抗体(抗-CCL11/Eotaxin抗体)(MAB320,R&D systems,Minneapolis,MN,USA)(溶解于5%Trehalose-PBS,储备浓度500μg/ml)的DMEM中交换(以终浓度成为10μg/ml的方式添加)后,培养48小时。作为vehicle对照,用含0.1%海藻糖-PBS的DMEM(CCL11中和抗体的储备浓度为500μg/ml。以终浓度成为10μg/ml的方式添加时,在培养液中添加0.1%Trehalose,因此,以成为0.1%的方式添加海藻糖-PBS。)培养48小时。其后,除去培养液,用PBS(-)清洗,在非还原的1×Sample Buffer(不含有β-巯基乙醇)中溶解细胞,在95℃下加热5分钟,制作样品。用BCA法测定蛋白浓度之后,使用。
使用12%TGX
可知:伴随继代数的增加而p16 mRNA表达增加时,CCL11 mRNA表达也增加(图15A)。由此,暗示CCL11与细胞老化关联。进而,报道有对于源自中高龄个体的细胞而言,通过作为CCL11的受体的CCR3表达增加,其感受性升高(Wang H et al.Invest OphthalmolVis Sci.2011),因此,对伴随长期继代的CCR3 mRNA表达变化,也通过Real-time RT-PCR进行分析。其结果,在短期继代(6~10代)中,在供体的年龄和CCR3 mRNA表达之间没有看到相关(data not shown),通过在任一年龄也进行长期继代(19~21代),则CCR3 mRNA表达增加(图15B)。
4.CCL11中和抗体的前处理导致的牙髄干细胞的活体内的游走能力的变化的研究
研究了通过在长期继代的牙髄干细胞中在不存在血清的条件下添加CCL11中和抗体并进行培养,在对牙髄干细胞培养上清液的游走能力上是否可看到变化。
对于牙髄干细胞培养上清液而言,除去人幼龄(30岁)牙髄干细胞的培养液,用PBS(-)清洗数次后,在不含有血清的DMEM中进行交换,培养24小时后,回收培养上清液,通过离心而除去细胞成分后,用Amicon Ultra-15 Centrifugal Filter Unit)(Millipore)离心浓缩至约50倍,用Bradford法测定蛋白浓度并使用。
在长期继代的幼龄牙髄干细胞(hpt009 DPSCs 19th)中,在血清非存在下,用CCL11中和抗体(终浓度10μg/ml)、或作为vehicle的0.1%海藻糖-PBS含有DMEM培养48小时。其后,将细胞进行剥离,使用TAXIScan-FL(Effector Cell Institute,东京)分析对牙髄干细胞培养上清液的游走能力。即,在6μm的孔的silicon及玻璃板之间,在最适于细胞的大小(8mm)的通道内的一端注入细胞(1μl的10
其结果,可知:通过将牙髄干细胞用CCL11中和抗体进行前处理,CCL11蛋白表达降低(图16A)。
接着,在不存在血清条件下,用CCL11中和抗体进行48小时前处理之后,分析游走能力。使用长期继代的源自人中高龄的牙髄干细胞,结果,游走的细胞本身少且分析困难,因此,使用长期继代的源自幼龄的牙髄干细胞。其结果,用CCL11中和抗体进行了前培养的细胞与用Trehalose进行了前培养的细胞相比,游走能力增加(图16B)。
[实施例6]
(使用有中高龄小鼠异位牙髄再生模型的CCL11中和抗体效果)
1.利用对小鼠牙根异位移植模型的浸透压泵进行的CCL11中和抗体的持续注入
将拔牙的猪前牙(下鄂侧切牙)切成6mm宽度,将根管放大至2mm。其后,将一方用磷酸锌粘结剂封锁,制作移植片。对移植片注入胶原蛋白TE(新田胶原蛋白)和5×10
在移植后21天,将小鼠在深麻醉下用4%对甲醛(PFA进行回流固定,回收移植片。对于移植片,用PFA浸渍固定24小时,用カルキトックス(Kalkitox)(WAKO)脱灰7天后,制成5μm厚度的石蜡切片。首先,为了比较再生组织量,将切片进行HE染色,用光学显微镜观察,计测根管面积中的牙髄再生量。进而,为了比较再生组织的石灰化面积,将切片进行Masson三色染色,用光学显微镜观察,计测再生牙髄中的石灰化面积。为了比较再生组织的血管新生密度,将切片用lectin(Vector)进行荧光免疫组织染色,用荧光显微镜观察,计测再生组织面积和新生血管面积。
2.血中CCL11浓度比较
从术前、后的中高龄小鼠及幼龄小鼠中用动物刺血针(バイオリサーチ)采取血液500μl。其后,用ELISA法测定血中CCL11浓度并进行比较。
将血中CCL11浓度比较的结果示于图17。中高龄小鼠与幼龄小鼠相比,术前的CCL11的血中浓度显著地高,但在术后21天的时刻,与幼龄没有差异。
相对于小鼠牙根异位移植模型利用浸透压泵进行CCL11中和抗体的持续注入,并研究再生量的变化,结果示于图18。与幼龄小鼠相比,中高龄小鼠的牙髄再生量显著地低(图18A,C)。另外,在中高龄小鼠的再生牙髄中可看到石灰化像或炎症像,这些所见在幼龄小鼠的再生牙髄中没有看到。通过持续给药CCL11中和抗体,与未给药组相比,中高龄小鼠的牙髄再生量显著地增多(图18C,D,K)。对于幼龄小鼠中的比较而言,与未给药组相比,给药组的牙髄再生量显著地减少(图18A,B,K)。另外,即使进行作为抗体的缓冲剂的海藻糖的利用浸透压泵的持续给药,也与幼龄、中高龄小鼠同样,在牙髄再生量上没有变化(图18E)。
将给药前后的血管新生密度、基质化面积的变化的研究的结果示于图19。在对中高龄小鼠利用移植进行的再生牙髄中,对于CCL11中和抗体持续给药组而言,与未给药组相比,新生血管密度显著地增多,与幼龄小鼠的密度没有显著的差异(图19A-D、I)。进而,虽然抑制未给药组中所看到的基质化像或炎症像,但是,与对幼龄小鼠利用移植进行的再生牙髄的基质化面积相比有显著的差异(图19E-H、J)。另一方面,对于幼龄小鼠中的给药前后的比较而言,在血管新生密度及基质化面积上没有看到显著的差异。
3.再生牙髄中的M1及M2巨噬细胞细胞数及M1/M2比
将拔牙的猪前牙(下鄂侧切牙)切成6mm宽度,将根管放大至2mm。其后,将一方用磷酸锌粘结剂封锁,制作移植片。对移植片注入胶原蛋白TE(新田コラーゲン)和猪牙髄膜分取细胞。在37℃下进行孵化之后,在深麻醉下分别在4只幼龄(5周龄)及中高龄(40~50周龄)的SCID小鼠(日本クレア)腹部皮下进行移植。另外,同时在背部皮下,每一天用浸透压泵(ALZET)持续给药50μg/kg的CCL11中和抗体(R&D systems)或20μg/ml的海藻糖。
在移植后7天回收移植片,用PFA固定,脱灰后,制作5μm的厚度的石蜡切片。对各切片,作为M1巨噬细胞的标记物,将CD68(abcam)及CD11c(abcam)进行免疫染色,另外,作为相对于M2巨噬细胞的标记物,将CD68及CD206(abcam)进行免疫染色。进一步算出M1/M2比并进行比较。
其结果,在异位牙根移植牙髄再生模型中,在中高龄小鼠的再生牙髄中,看到许多CD68/CD11c阳性的M1巨噬细胞细胞,但在CCL11中和抗体的持续给药组的再生牙髄中,可抑制其阳性细胞数(图20C,D,I)。另外,CD68/CD206(mannose receptor)阳性的M2巨噬细胞阳性细胞数在未给药组、给药组中没有很大差异(图20G,H,J)。另一方面看到,在幼龄小鼠中,未给药组、给药组与中高龄相比,M1巨噬细胞均少,M2巨噬细胞细胞数均多(图20A,B,E,F,I,J)。接着,测定CCL11中和持续给药后的再生牙髄和未给药的再生牙髄的M1/M2比并进行比较。其结果判明:在给药后的中高龄小鼠的再生牙髄中减少(图20K)。因而,可以说:通过CCL11中和抗体的给药,在中高龄小鼠的再生牙髄中抑制炎症反应,相对而言成为容易促进再生、修复反应的环境。
[实施例7]
(人老化牙周膜细胞中的ALK5抑制剂及CCR3拮抗剂的效果)
1.人牙周膜细胞中的ALK5抑制剂及CCR3拮抗剂添加导致的CCL11,CCR3,GDF11mRNA表达的变化
将人牙周膜细胞第5代在含10%FBS的DMEM中以2×10
[表3]
表 人Real-time RT-PCR引物
其结果,通过ALK5抑制剂(SB431542)及CCR3拮抗剂(SB328437),CCL11的mRNA表达完全得到抑制。另外,通过CCR3拮抗剂(SB328437),CCR3的mRNA表达完全得到抑制。进而,通过ALK5抑制剂,GDF11mRNA的5倍表达上升。
2.人老化牙周膜细胞中的ALK5抑制剂及CCR3拮抗剂添加导致的老化标记物表达的变化
将人牙周膜细胞第11代在含10%FBS的DMEM中以2×10
[表4]
表 人Real-timeRT-PCR引物
其结果,通过ALK5抑制剂及CCR3拮抗剂,老化标记物的p16,IL6,IL1b,及IL 8,mRNA表达显著地得到抑制。另外,通过ALK5抑制剂,TNFamRNA表达显著地得到抑制(表5)。因此,暗示ALK5抑制剂及CCR3拮抗剂抑制老化的细胞的老化,恢复细胞的免疫调整能力。
[表5]
表 标记物表达
3.人老化牙周膜细胞中的ALK5抑制剂及CCR3拮抗剂添加导致的Trophic因子表达的变化
使用与2同样的mRNA,进行了营养因子(Trophic因子)VEGF、BDNF、NGF,MCP1(下表)的real-time RT-PCR。
[表6]
表 人Real-time RT-PCR引物
其结果,通过ALK5抑制剂及CCR3拮抗剂,营养因子(trophic因子)表达几乎没有看到显著的变化(表6)。因此暗示,ALK5抑制剂及CCR3拮抗剂相对于老化的细胞,对血管新生、神经营养因子表达不产生影响的可能性。
[表7]
表 trophic标记物表达
4.人老化牙周膜细胞中的ALK5抑制剂及CCR3拮抗剂添加导致的游走能力关联因子表达的变化
使用与2同样的mRNA,进行了游走能力关联因子表达MMP9、MMP3、及MMP2(表8)的real-time RT-PCR。
[表8]
表 人Real-time RT-PCR引物
其结果,通过ALK5抑制剂及CCR3拮抗剂,可看到游走关联因子MMP9的表达的减少(表9)。因此暗示,ALK5抑制剂及CCR3拮抗剂相对于老化的细胞,抑制游走能力的可能性。
[表9]
表 营养因子表达
5.人老化牙周膜细胞中的ALK5抑制剂及CCR3拮抗剂添加导致的游走能力的变化
将人牙周膜细胞第11代在含10%FBS的DMEM中以2×10
其结果,对于老化牙周膜细胞而言,添加ALK5抑制剂或CCR3拮抗剂的情况下,看到显著地游走能力的减少(表10)。
[表10]
人老化牙根膜细胞中的ALK5抑制剂及CCR3拮抗剂添加导致的游走能力变化
[实施例8]
(在人老化牙髓干细胞培养上清液中添加ALK5抑制剂及CCR3拮抗剂时的trophic效果的变化)
1.人牙髓干细胞的培养上清液的浓缩
将人未分取牙髓干细胞第22代形成50%汇合的状态,并变为无血清培养基,在24小时后回收培养上清液。使用3-kDa分子切割的AmiconUltra-15Centrifugal Filter Unitwith Ultracel-3 membrane(Millipore,Billerica,MA),将该上清液浓缩成约40倍,放入蛋白酶抑制剂(Halt
2.在人老化牙髓干细胞培养上清液中添加了ALK5抑制剂及CCR3拮抗剂的情况的血管诱导能的变化
将HUVEC(Human UmbilicalVein Endothelial Cells,人脐带静脉内皮细胞)(clone7F3415)(Lonza)在含10%FBS的EGM2(Lonza)中进行培养。其后,作为血管诱导培养基,相对于含有2%FBS,5μg/ml肝素(Lonza),5μg/ml抗坏血酸(ascorbic acid)(Lonza),5μg/ml氢化可的松(hydrocortisone)(Lonza)的DMEM,添加1中制作的培养上清液(5μg/ml蛋白质),进一步准备ALK5抑制剂(SB431542、10ng/μl)或CCR3拮抗剂(SB328437、5ng/μl)。在该培养基中以成为1×10
其结果,对于老化牙髄干细胞的培养上清液而言,在添加了ALK5抑制剂的情况下,显著地促进血管新生诱导(图21、表11)。
[表11]
3.在人老化牙髄干细胞培养上清液中添加了ALK5抑制剂及CCR3拮抗剂的情况的神经突起伸长作用的变化
相对于TGW细胞(神经芽细胞瘤细胞株、human neuroblastoma cell),添加1中制作的培养上清液(5μg/ml蛋白质),进一步添加ALK5抑制剂(SB431542、10ng/μl)及CCR3拮抗剂(SB328437、5ng/μl)。作为阴性对照,使用仅添加培养上清液的物质,作为阳性对照,使用添加了50ng/mlGDNF(Peproteck)的物质。用倒立显微镜(Leica)观察48小时后的神经突起伸长,并进行测定。
其结果,对于老化牙髄干细胞的培养上清液而言,在添加了ALK5抑制剂或CCR3拮抗剂的情况下,显著地促进神经突起伸长(图22、表12)。
[表12]
4.在人老化牙髄干细胞培养上清液中添加了ALK5抑制剂及CCR3拮抗剂的情况的游走促进作用的变化
将人牙髄细胞第4代在含10%FBS的DMEM中以2×10
其结果,对于牙髄细胞而言,在G-CSF中添加了CCR3拮抗剂的情况下,看到显著地游走能力的增加(图23、表13)。
[表13]
本发明涉及以下的技术方案:
1、一种用于牙组织再生的牙科用前处理材料,其特征在于,含有丝氨酸蛋白酶。
2、根据项1所述的牙科用前处理材料,其特征在于,所述丝氨酸蛋白酶为类胰凝乳蛋白酶(chymotrypsin-like)丝氨酸蛋白酶。
3、根据项2所述的牙科用前处理材料,其特征在于,所述类胰凝乳蛋白酶(chymotrypsin-like)丝氨酸蛋白酶为胰蛋白酶。
4、根据项1~3中任一项所述的牙科用前处理材料,其特征在于,还具有纳米泡。
5、根据项4所述的牙科用前处理材料,其特征在于,
所述纳米泡的直径为10nm以上500nm以下。
6、根据项1~5中任一项所述的牙科用前处理材料,其特征在于,所述牙组织再生在中高龄个体中是使用自体或同种牙髄干细胞的牙组织再生。
7、一种根管填充材料,其含有自体或同种牙髄干细胞、细胞外基质、及ALK5抑制剂。
8、一种根管填充材料,其含有自体或同种牙髄干细胞、细胞外基质、及CCR3拮抗剂。
9、一种根管填充材料,其含有自体或同种牙髄干细胞、细胞外基质、及CCL11中和抗体。
10、一种牙组织再生试剂盒,其特征在于,含有:
项1~6中任一项所述的牙科用前处理材料、和
要插入于根管的具备牙髄干细胞及细胞外基质的根管填充材料。
11、一种牙组织再生试剂盒,其中,
所述根管填充材料为项7~9中任一项所述的根管填充材料。
工业上的可利用性
本发明可利用于牙组织再生。
序列号1~40:引物
SEQUENCE LISTING
<110>国立研究开发法人国立长寿医疗研究中心
<120>根管填充材料及牙组织再生试剂盒
<130>FB182218JPDIV
<150>JP2016-072306
<151>2016-03-31
<160>40
<210>1
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>1
GGACT TCGAG CAAGA GATGG
<210>2
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>2
AGCAC TGTGT TGGCG TACAG
<210>3
<211>21
<212>DNA
<213>人工序列
<220>
<223>引物
<400>3
GAAGG TCCCT CAGAC ATCCC C
<210>4
<211>21
<212>DNA
<213>人工序列
<220>
<223>引物
<400>4
CCCTG TAGGA CCTTC GGTGA C
<210>5
<211>21
<212>DNA
<213>人工序列
<220>
<223>引物
<400>5
TTCTG TGGCT GCTGC TCATA G
<210>6
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>6
GCTCT CTAGT CGCTG AAGGG
<210>7
<211>22
<212>DNA
<213>人工序列
<220>
<223>引物
<400>7
CTGTA CTCCC TGGTG TTCAC TG
<210>8
<211>21
<212>DNA
<213>人工序列
<220>
<223>引物
<400>8
GGTTG AGCAG GTAGA TGTTG G
<210>9
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>9
CAAGT CGCAG ATCTT GAGCA
<210>10
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>10
CACTT GCTTG AAGTC GATGC
<210>11
<211>21
<212>DNA
<213>人工序列
<220>
<223>引物
<400>11
TTCTG TGGCT GCTGC TCATA G
<210>12
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>12
GCTCT CTAGT CGCTG AAGGG
<210>13
<211>22
<212>DNA
<213>人工序列
<220>
<223>引物
<400>13
CTGTA CTCCC TGGTG TTCAC TG
<210>14
<211>21
<212>DNA
<213>人工序列
<220>
<223>引物
<400>14
GGTTG AGCAG GTAGA TGTTG G
<210>15
<211>21
<212>DNA
<213>人工序列
<220>
<223>引物
<400>15
GAAGG TCCCT CAGAC ATCCC C
<210>16
<211>21
<212>DNA
<213>人工序列
<220>
<223>引物
<400>16
CCCTG TAGGA CCTTC GGTGA C
<210>17
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>17
AGGCC TTGGA ACTCA AGGAT
<210>18
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>18
CCCTT TTTGG ACTTC AGGTG
<210>19
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>19
CCAGG AGCCC AGCTA TGAAC
<210>20
<211>19
<212>DNA
<213>人工序列
<220>
<223>引物
<400>20
CCCAG GGAGA AGGCA ACTG
<210>21
<211>22
<212>DNA
<213>人工序列
<220>
<223>引物
<400>21
GGCCC TAAAC AGATG AAGTG CT
<210>22
<211>16
<212>DNA
<213>人工序列
<220>
<223>引物
<400>22
TGCCG CCATC CAGAG G
<210>23
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>23
TTGGC AGCCT TCCTG ATTTC
<210>24
<211>16
<212>DNA
<213>人工序列
<220>
<223>引物
<400>24
TGCCG CCATC CAGAG G
<210>25
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>25
ACCAG GCCGT GATCT CTATG
<210>26
<211>19
<212>DNA
<213>人工序列
<220>
<223>引物
<400>26
TCCCT TTGTC CCTGG TCTC
<210>27
<211>21
<212>DNA
<213>人工序列
<220>
<223>引物
<400>27
GAAGG TCCCT CAGAC ATCCC C
<210>28
<211>21
<212>DNA
<213>人工序列
<220>
<223>引物
<400>28
CCCTG TAGGA CCTTC GGTGA C
<210>29
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>29
AAACA TCCGA GGACA AGGTG
<210>30
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>30
CGTGT ACAAG TCTGC GTCCT
<210>31
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>31
ATACA GGCGG AACCA CACTC
<210>32
<211>19
<212>DNA
<213>人工序列
<220>
<223>引物
<400>32
GCCTG GGGTC CACAG TAAT
<210>33
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>33
GCCCC AGTCA CCTGC TGTTA
<210>34
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>34
TCCAG GTGGT CCATG GAATC
<210>35
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>35
TGGTG GTGAT GGGCG TATCT
<210>36
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>36
CTGGC CATCA CTGCT CAAAG
<210>37
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>37
CCTCA GGAAG CTTGA ACCTG
<210>38
<211>20
<212>DNA
<213>人工序列
<220>
<223>引物
<400>38
GGGAA ACCTA GGGTG TGGAT
<210>39
<211>19
<212>DNA
<213>人工序列
<220>
<223>引物
<400>39
GACGG AAAGA TGTGG TGTG
<210>40
<211>22
<212>DNA
<213>人工序列
<220>
<223>引物
<400>40
AGACG GAAGT TCTTG GTGTA GG
