一种定量检测25-羟基维生素D的试剂盒、方法及其应用
文献发布时间:2023-06-19 19:30:30
技术领域
本发明涉及生物检测技术领域,具体涉及一种定量检测25-羟基维生素D的试剂盒、方法及其应用。
背景技术
维生素D是一种脂溶性维生素,是维持人类身体健康必需的一种化合物。维生素D包括5种化合物,与健康密切相关的是维生素D2和维生素D3。维生素D2和维生素D3经肝脏的单氧化酶(25-羟基氧化酶)氧化形成25-羟基维生素D2和25-羟基维生素D3,在肾脏中进一步代谢形成1,25-二羟基维生素D。在血液中,维生素D的最主要存在形式为25-羟基维生素D,约占维生素D总量的95%,且半衰期最长,性质非常稳定。因此,25-羟基维生素D成为维生素D在人体内的浓度指示剂,是人体维生素D营养状况的评价指标。
目前,人体中25-羟基维生素D的检测方法主要有电化学发光免疫法、放射免疫法、高效液相色谱法、液相色谱-串联质谱法等。免疫法普遍存在特异性低、对基质效应敏感、无法区分25-羟基维生素D2和25-羟基维生素D3等缺点。高效液相色谱法也存在前处理复杂、灵敏度低、容易受到干扰等缺点。液相色谱串联质谱法具有高选择性、特异性和灵敏度等优点,越来越广泛地用于临床检验,是目前公认的25-羟基维生素D定量检测的金标准方法。目前,采用液相色谱-串联质谱法检测25-羟基维生素D浓度的血液样本类型有干血片、全血、血清、血浆等,然而至今还没有一款试剂盒可以同时定量检测干血片和微量的全血、血清、血浆中的25-羟基维生素D,不同类型的样本检测需要购买不同的试剂盒,这不仅增加了检测成本,也降低了检测效率。因此,迫切需要开发一种可定量检测干血片和微量的全血、血清、血浆等多种类型血液样本中25-羟基维生素D的检测试剂盒及方法,使其可以克服现有试剂盒和方法的不足。
发明内容
有鉴于此,本发明的目的在于提供一种定量检测25-羟基维生素D的试剂盒,可同时定量检测干血片和微量的全血、血清、血浆中25-羟基维生素D浓度。
为解决上述技术问题,本发明提供了以下技术方案:
本发明提供了一种定量检测25-羟基维生素D的试剂盒,所述试剂盒包括校准品、质控品、样本提取液、衍生剂溶液、终止液、复溶液和流动相添加剂;所述样本提取液为含有25-羟基维生素D2-d6和25-羟基维生素D3-d3的甲醇乙腈溶液,所述甲醇和乙腈的体积比为(1~9.5):1。
优选的,所述校准品为系列标准浓度的干血片,分别为S0:25-羟基维生素D2和25-羟基维生素D3浓度均为0ng/mL,S1:25-羟基维生素D2和25-羟基维生素D3浓度均为2ng/mL,S2:25-羟基维生素D2和25-羟基维生素D3浓度均为12ng/mL,S3:25-羟基维生素D2和25-羟基维生素D3浓度均为20ng/mL,S4:25-羟基维生素D2和25-羟基维生素D3浓度均为40ng/mL,S5:25-羟基维生素D2和25-羟基维生素D3浓度均为120ng/mL,S6:25-羟基维生素D2和25-羟基维生素D3浓度均为200ng/mL。
更优选的,所述校准品的制备方法包括如下步骤:
配置含25-羟基维生素D2和25-羟基维生素D3的5%BSA缓冲溶液,所述25-羟基维生素D2和25-羟基维生素D3的浓度均分别为0、4、24、40、80、240、400ng/mL;
处理全血得到不含25-羟基维生素D2和25-羟基维生素D3的红细胞;将所述红细胞与不同浓度的BSA缓冲溶液等体积混合,滴于滤纸片上晾干即得系列标准浓度的干血片校准品。
优选的,所述质控品为三个不同浓度的干血片,分别为QC1:25-羟基维生素D2和25-羟基维生素D3的浓度均为10ng/mL,QC2:25-羟基维生素D2和25-羟基维生素D3的浓度均为20ng/mL,QC3:25-羟基维生素D2和25-羟基维生素D3的浓度均为40ng/mL。
更优选的,所述质控品的制备方法包括如下步骤:
检测全血样本25-羟基维生素D2和25-羟基维生素D3浓度,用5%BSA缓冲溶液将其稀释至QC1对应的浓度,加标至QC2和QC3对应的浓度,滴于滤纸片上晾干,即得三个不同浓度的干血片质控品。
优选的,所述衍生剂溶液为0.2mg/mL的PTDA乙酸乙酯溶液;所述终止液为无水乙醇;所述复溶液为0.1%甲酸-80%甲醇水溶液;所述的流动相添加剂为50%甲酸水溶液。
本发明还提供了一种定量检测25-羟基维生素D的方法,所述方法包括如下步骤:
将校准品干血片和质控品干血片与待测样本混合,加入样本提取液后震荡离心,所得上清液与衍生剂溶液混合进行衍生反应,然后依次加入终止液和复溶液,所得溶液过滤后进行检测分析即可计算待测样本中的25-羟基维生素D浓度。
优选的,所述检测分析采用液相色谱串联质谱,所述质谱条件为:正离子模式,扫描方式为多反应监测离子扫描;所述正离子模式中,目标定量离子对包括:25基羟维生素D2衍生化产物570.4→298.1,25-羟基维生素D2-d6衍生化产物576.4→298.1,25-羟基维生素D3衍生化产物558.4→298.1,25-羟基维生素D3-d3衍生化产物561.4→301.2。
更优选的,所述液相色谱的色谱柱为C18,所述液相色谱的流动相A为含0.1-0.3%的甲酸水,流动相B为含0.1-0.3%甲酸的甲醇;所述液相色谱的流速为0.2-1.0mL/min,柱温为30-45℃,进样体积为20-40µL。
本发明还提供了上述的试剂盒或上述的方法在定量检测微量的全血、血清、血浆和/或干血片中25-羟基维生素D的应用。
本发明提供了一种定量检测25-羟基维生素D的试剂盒,所述试剂盒的样本提取液为含有25-羟基维生素D2和25-羟基维生素D3同位素内标的甲醇乙腈溶液,使用稳定同位素内标消除基质效应的影响,实现多种微量样本类型的同时测定,可直接高效地萃取干血纸片/全血/血清/血浆中25-羟基维生素D;前处理采用96孔板提高了自动化水平和分析通量;使用液相色谱-串联质谱同时检测25-羟基维生素D2和25-羟基维生素D3,且通过衍生化反应增强分析物的离子化效率,进一步提高了检测的灵敏,降低了样本用量。经试验可知,本发明所述试剂盒检测只需要两片3/6mm血斑、20µL全血、10µL血清样本或10µL血浆,样本使用量少且样本类型多,适合多种采样方法和多种人群的检测筛查尤其是新生儿以及儿童,实现了一个试剂盒可同时检测多种样本类型。
附图说明
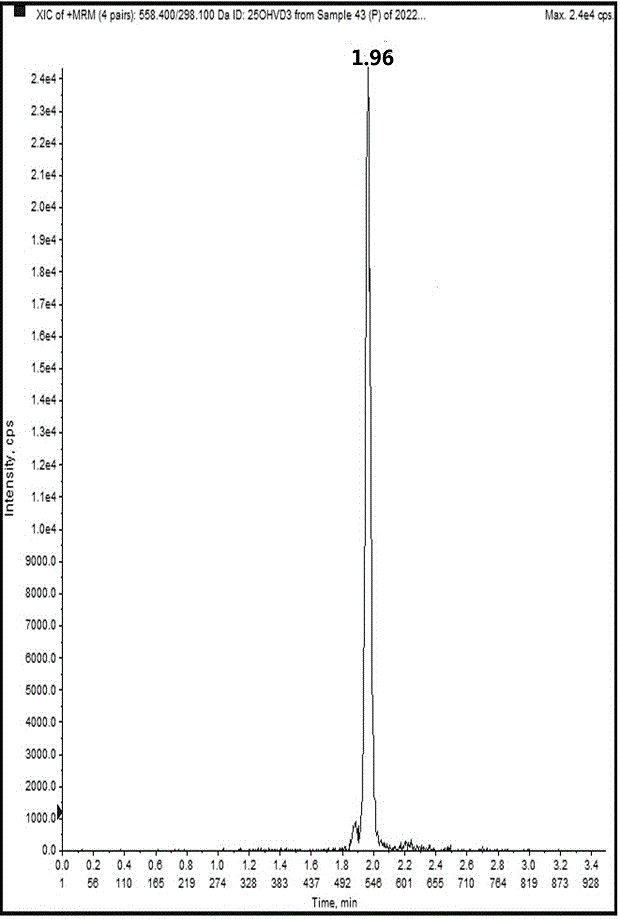
图1为25-羟基维生素D2校准品S5的色谱图。
图2为25-羟基维生素D3校准品S5的色谱图。
图3为25-羟基维生素D2校准品S0的色谱图。
图4为25-羟基维生素D3校准品S0的色谱图
图5为25-羟基维生素D2干血纸片样本的色谱图。
图6为25-羟基维生素D3干血纸片样本的色谱图。
图7为25-羟基维生素D2全血样本的色谱图。
图8为25-羟基维生素D3全血样本的色谱图。
图9为25-羟基维生素D2血浆样本的色谱图。
图10为25-羟基维生素D3血浆样本的色谱图。
图11为25-羟基维生素D2血清样本的色谱图。
图12为25-羟基维生素D3血清样本的色谱图。
图13为定量下限为2ng/mL的25-羟基维生素D2的色谱图。
图14为定量下限为2ng/mL的25-羟基维生素D3的色谱图。
图15是25-羟基维生素D2在2ng/mL~200ng/mL范围内的标准曲线图。
图16是25-羟基维生素D3在2ng/mL~200ng/mL范围内的标准曲线图。
具体实施方式
本发明提供了一种定量检测25-羟基维生素D的试剂盒,所述试剂盒包括校准品、质控品、样本提取液、衍生剂溶液、终止液、复溶液和流动相添加剂;所述样本提取液为含有25-羟基维生素D2-d6和25-羟基维生素D3-d3的甲醇乙腈溶液,所述甲醇和乙腈的体积比为(1~9.5):1。
本发明中,所述样本提取液中25-羟基维生素D2-d6的浓度优选为10~100ng/mL,更优选为20ng/mL;所述25-羟基维生素D3-d3的浓度优选为10~100ng/mL,更优选为20ng/mL。本发明样本提取液采用含有25-羟基维生素D2和25-羟基维生素D3同位素内标的甲醇乙腈溶液,使用稳定同位素内标消除基质效应的影响,实现多种微量样本类型的同时测定,可直接高效地萃取干血纸片/全血/血清/血浆中25-羟基维生素D,从而同时实现干血片和微量的全血、血清、血浆等多种样本类型中25-羟基维生素D的检测。
本发明中,所述校准品为系列标准浓度的干血片,分别为S0:25-羟基维生素D2和25-羟基维生素D3浓度均为0ng/mL,S1:25-羟基维生素D2和25-羟基维生素D3浓度均为2ng/mL,S2:25-羟基维生素D2和25-羟基维生素D3浓度均为12ng/mL,S3:25-羟基维生素D2和25-羟基维生素D3浓度均为20ng/mL,S4:25-羟基维生素D2和25-羟基维生素D3浓度均为40ng/mL,S5:25-羟基维生素D2和25-羟基维生素D3浓度均为120ng/mL,S6:25-羟基维生素D2和25-羟基维生素D3浓度均为200ng/mL。本发明中,所述校准品的制备方法优选的包括如下步骤:配置含25-羟基维生素D2和25-羟基维生素D3的5%BSA缓冲溶液,所述25-羟基维生素D2和25-羟基维生素D3的浓度均分别为0、4、24、40、80、240、400ng/mL;处理全血得到不含25-羟基维生素D2和25-羟基维生素D3的红细胞;将所述红细胞与不同浓度的BSA缓冲溶液等体积混合,滴于滤纸片上晾干即得系列标准浓度的干血片校准品。本发明中,所述滴于滤纸片上的混合液的优选为50~100µL,更优选为75µL。
本发明中,所述质控品为三个不同浓度的干血片,分别为QC1:25-羟基维生素D2和25-羟基维生素D3的浓度均为10ng/mL,QC2:25-羟基维生素D2和25-羟基维生素D3的浓度均为20ng/mL,QC3:25-羟基维生素D2和25-羟基维生素D3的浓度均为40ng/mL。本发明中,所述质控品的制备方法优选的包括如下步骤:检测全血样本25-羟基维生素D2和25-羟基维生素D3浓度,用5%BSA缓冲溶液将其稀释至QC1对应的浓度,加标至QC2和QC3对应的浓度,滴于滤纸片上晾干,即得三个不同浓度的干血片质控品。本发明中,所述5%BSA缓冲溶液优选为含25-羟基维生素D2和25-羟基维生素D3的5%BSA缓冲溶液,所述缓冲溶液中25-羟基维生素D2和25-羟基维生素D3的浓度均分别为0、4、24、40、80、240、400ng/mL。本发明中,所述滴于滤纸片上的混合液的优选为50~100µL,更优选为75µL。
本发明中,所述衍生剂溶液优选为0.2mg/mL的PTDA(4-苯基-1,2,4-三唑林-3,5-二酮)乙酸乙酯溶液;所述终止液优选为无水乙醇;所述复溶液优选为0.1%甲酸-80%甲醇水溶液;所述的流动相添加剂优选为50%甲酸水溶液。
本发明中,所述试剂盒优选的还包括耗材,所述耗材优选的包括96孔板、96孔过滤板、96孔锥底收集板、96孔板硅胶盖、操作说明书。
本发明还提供了一种定量检测25-羟基维生素D的方法,所述方法包括如下步骤:
将校准品干血片和质控品干血片与待测样本混合,加入样本提取液后震荡离心,所得上清液与衍生剂溶液混合进行衍生反应,然后依次加入终止液和复溶液,所得溶液过滤后进行检测分析即可计算待测样本中的25-羟基维生素D浓度。
本发明中,所述校准品、质控品、样本提取液、衍生剂溶液、复溶液、流动相添加剂和耗材在使用前优选的平衡至室温。本发明中,所述校准品干血片和质控品干血片均优选为2片。本发明中,所述待测样本优选为干血片、全血、血清或血浆。所述待测样本为干血片时,待测样本的添加量优选为2张3mm血斑;所述待测样本为全血时,待测样本的添加量优选为20µL;所述待测样本为血清时,待测样本的添加量优选为10µL,所述待测样本为血浆时,待测样本的添加量优选为10µL。本发明中,样本提取液的添加量优选为150-300µL,衍生剂溶液的添加量优选为50-250µL,终止液的添加量优选为10-50µL,复溶液的添加量优选为50-150µL。本发明中,所述衍生反应的时间优选为20~60min,更优选为30min;所述过滤优选的在96孔过滤板中进行。
本发明中,所述检测分析优选为液相色谱串联质谱,所述质谱条件优选为:正离子模式,扫描方式为多反应监测离子扫描;所述正离子模式中,目标定量离子对包括:25基羟维生素D2衍生化产物570.4→298.1,25-羟基维生素D2-d6衍生化产物576.4→298.1,25-羟基维生素D3衍生化产物558.4→298.1,25-羟基维生素D3-d3衍生化产物561.4→301.2。所述液相色谱的色谱柱优选为C18,所述液相色谱的条件优选为:流动相A为含0.1-0.3%的甲酸水,流动相B为含0.1-0.3%甲酸的甲醇;所述液相色谱的流速为0.2-1.0mL/min,柱温为30-45℃,进样体积为20-40µL。本发明中,所述计算待测样本中的25-羟基维生素D浓度的方法优选为:采用校准品中的25-羟基维生素D及其内标的峰面积的比值与理论浓度构建的标准曲线,即可计算出样品或质控品中的25-羟基维生素D的浓度。
本发明还提供了上述的试剂盒或上述的方法在定量检测微量的全血、血清、血浆和/或干血片中25-羟基维生素D的应用。
本发明提供了一种可同时定量检测干血片和微量的全血、血清、血浆中25-羟基维生素D的试剂盒,检测只需要两片3/6mm血斑、20μL全血、10μL血清样本或10μL血浆,样本使用量少且样本类型多,适合多种采样方法和多种人群的检测筛查尤其是新生儿以及儿童,实现了一个试剂盒可同时检测多种样本类型,极大地提高了检测效率,降低了检测成本。
为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例对本发明进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
下述实施例中,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
本发明提供的一种定量检测25-羟基维生素D的试剂盒的检测指标包括:25-羟基维生素D2、25-羟基维生素D3、25-羟基维生素D(25-羟基维生素D2与25-羟基维生素D3之和)。
本实施例提供的一种定量检测25-羟基维生素D的试剂盒组成如表1所示。
表1 一种定量检测25-羟基维生素D的试剂盒组成
表1中校准品为干血片,分别为S0:25-羟基维生素D2和25-羟基维生素D3浓度为0ng/mL,S1:25-羟基维生素D2和25-羟基维生素D3浓度为2ng/mL,S2:25-羟基维生素D2和25-羟基维生素D3浓度为12ng/mL,S3:25-羟基维生素D2和25-羟基维生素D3浓度为20ng/mL,S4:25-羟基维生素D2和25-羟基维生素D3浓度为40ng/mL,S5:25-羟基维生素D2和25-羟基维生素D3浓度为120ng/mL,S6:25-羟基维生素D2和25-羟基维生素D3浓度为200ng/mL。
所述校准品制备方法为:配置一系列含25-羟基维生素D2和25-羟基维生素D3的5%BSA缓冲溶液,其浓度分别0、2、12、20、40、120、200ng/mL,同时处理全血得到不含25-羟基维生素D2和25-羟基维生素D3的红细胞,然后分别取等体积红细胞和的不同浓度25-羟基维生素D2和25-羟基维生素D3的BSA缓冲溶液进行混合,得到含有不同浓度25-羟基维生素D2和25-羟基维生素D3的全血校准品,取75μL滴于滤纸片上,自然晾干,得到一系列的干血片校准品。
表1中的质控品为低、中、高三个不同浓度的干血片,分别为QC1:25-羟基维生素D2和25-羟基维生素D3的浓度为10ng/mL,QC2:25-羟基维生素D2和25-羟基维生素D3的浓度为20ng/mL,QC3:25-羟基维生素D2和25-羟基维生素D3的浓度为40ng/mL。
所述质控品制备方法为:检测全血样本25-羟基维生素D2和25-羟基维生素D3浓度,用5%BSA缓冲溶液将其稀释至QC1对应的浓度,加标至QC2和QC3对应的浓度,得到低、中、高浓度的全血质控品,然后再取75μL滴于滤纸片上,自然晾干。
表1中的样本提取液为含浓度为30ng/mL的25-羟基维生素D2-d6和25-羟基维生素D3-d6的甲醇乙腈溶液,甲醇和乙腈体积比为90:10;样本提取液衍生剂溶液为0.2mg/mL的PTDA(4-苯基-1,2,4-三唑林-3,5-二酮)乙酸乙酯溶液;终止液为无水乙醇;复溶液为0.1%甲酸-80%甲醇水溶液;所述的流动相添加剂为50%甲酸水溶液。
实施例2
利用实施例1定量检测25-羟基维生素D试剂盒检测25-羟基维生素D的方法
主要步骤如下:
1.样本前处理
(1)取出实施例1所述的校准品、质控品、样本提取液、衍生剂溶液、复溶液、流动相添加剂,平衡至室温;
(2)分别取2张校准品、2张质控品和适量的样本加入到96孔板中(干血片样本为两张3/6 mm血斑,全血样本为20μL,血清样本为10μL,血浆样本为10μL);
(3)加入200μL样本提取液,室温下震荡30 min;
(4)取全部上清液至新的96孔板中,室温氮吹至干;
(5)加入100μL衍生剂溶液,室温下衍生反应30 min;
(6)加入20μL终止液,静置10 min,将反应液室温氮吹至干;
(7)加入80μL复溶液,室温下震荡5 min;
(8)将上述溶液全部转移至96孔过滤板中,盖上硅胶盖,并于室温下离心10 min(3000 r/min),溶液收集于96孔锥底收集板中,盖上硅胶盖。至此得到待上机的校准品、质控品和样品。
2.液相色谱串联质谱检测
(1)上机准备
配制流动相,A为1000 mL去离子水中加入2 mL流动相添加剂,B为1000 mL甲醇中加入2 mL流动相添加剂,混匀,过滤;将仪器的流动相更换成上述已配置的流动相,连接色谱柱Thermo C18色谱柱(50mm×2.1mm, 2.6μm);将待测96孔锥底样品板转移至LC-MS/MS进样系统中,采用对应的色谱质谱方法先平衡仪器,进行检测。
(2)色谱方法
超高效液相色谱:岛津LC-30液相系统。
色谱柱:Thermo C18色谱柱(50mm×2.1mm, 2.6μm);
柱温:40℃ ;
进样器温度:10℃ ;
进样体积:10μL ;
流动相:A相为0.1%甲酸水,B相为含0.1%甲酸的甲醇;
流速为0.4 mL/min;
洗脱梯度如表2所示:
表2 液相色谱洗脱梯度
上述色谱条件下,25-羟基维生素D2和25-羟基维生素D3的保留时间分别为1.99min和1.97 min。
(3)质谱方法
采用具有电喷雾离子源的串联质谱仪作为检测器进行分析。其中,气帘气压力为20.0psi,加热气压力为50 psi,辅助加热气压力为50psi,加热气温度为500℃,碰撞气为高纯氮气,压力为6 psi;电喷雾针电压为5500 V。采用正离子模式,扫描方式采用多反应监测离子扫描。待测物随流动相流出分析柱后,在压力的作用下进入质谱仪离子源,由六通阀控制进入离子源的样品通道。在离子源内液体样品被汽化并且电离为带电分子,带电分子在电压和真空作用下,进入Q1、Q2和Q3,其中,Q1和Q3为质量过滤器,只允许根据25-羟基维生素D及其内标物衍生化产物的质荷比选择的母离子和子离子通过,Q2为碰撞单元,母离子在此处与惰性气体原子碰撞,产生特定的碎片离子。质谱仪的第一个四极(Q1)选择具有25羟维生素D及其内标物衍生化产物的特定质荷比m/z的母离子,具有这些m/z比的母离子被允许进入Q2,Q2产生的碎片离子进入到Q3,其中25羟维生素D及其内标物衍生化产物的碎片离子(子离子)被选择通过,而其它离子被除去。参数详见表3。
表3 多反应监测离子扫描参数
随着离子与检测器碰撞,它们将捕获到的离子数转化成数字信号的电子脉冲。所获得的数据被传递到计算机,其将所收集的离子数对时间作图,即得总离子流图(TIC图)(如图1和图2所示)。
从图1-图4、图13可以看出,25-羟基维生素D2峰型对称,无干扰,其含量在2.0 ng/mL时,仍具有很好的峰高、峰形,具有10倍以上的信噪比,2.0 ng/mL的含量值可被定量;从图1-图4、图14可以看出,25-羟基维生素D3峰型对称,无干扰,其含量在2.0 ng/mL时,仍具有很好的峰高、峰形,具有10倍以上的信噪比,2.0 ng/mL的含量值可被定量,方法灵敏度高。
采用内标法建立标准曲线,如图15、图16和表4所示,25羟基维生素D2在2 ng/mL~200 ng/mL线性范围内,25-羟基维生素D3在2 ng/mL~200 ng/mL线性范围内线性相关性良好,相关系数r分别为0.99548和0.99762。
表4 标准曲线结果
采集志愿者的血液样本,分别制备得到干血片、微量全血、微量血清、微量血浆,平行测定三次,结果如表5可知,25-羟基维生素D2的检出浓度为0.5101 ng/mL,相对标准偏差为4.37%,25-羟基维生素D3的检出浓度为13.28 ng/mL,相对标准偏差为5.73%,重复性可靠、检测误差小。
表5 重复性测定结果
由以上实施例可以看出,本发明试剂盒可同时定量检测干血片和微量的全血、血清、血浆中25-羟基维生素D的浓度,实现了一个试剂盒可同时检测多种样本类型,极大地提高了检测效率;而且本发明试剂盒降低了样本的用量,检测灵敏度高,重复性好,具有良好的应用前景。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围内。
