一种病原菌超高灵敏检测的侧向流试纸条及其应用
文献发布时间:2024-01-17 01:16:56
技术领域
本发明属于医学检测技术领域,具体涉及一种病原菌超高灵敏检测的侧向流试纸条及其应用。
背景技术
侧向流试纸条(LFIAs)是一种可靠的、即时的、低成本的早期检测方法,可用于快速检测病原体,而无需训练有素的人员和基本的基础设施。然而,当前有关病原体的商品化LFIAs的灵敏度往往无法达到100CFU/mL,无法满足国家标准的检测需要,限制了其在食品致病菌检测中的应用。这是因为当前的商品化LFIAs主要以胶体金为信号源,而胶体金的消光系数较低,低浓度下无法被肉眼所观察。同时,检测线的捕获效率低也严重的影响了LFIAs的检测灵敏度。
现有的提高LFIAs灵敏度的方法主要集中在改变其输出信号,如结合表面增强拉曼、荧光等技术。这种方法虽然能够有效提高灵敏度,但同时还需要额外的仪器设备,这违背了LFIAs不依赖其它专业仪器的初衷。而胶体金免疫层析试纸条以其快速简便、不需特殊仪器、结果可肉眼判读、灵敏度高、特异性强等优点,已成为当今快速敏感的免疫检测技术之一,并被广泛应用于病原菌的检测中。
胶体金免疫层析试纸条是宽度为0.3cm的试纸条,有底板,在底板上从一端依次由上至下呈阶梯状地粘有样品垫、金标垫、硝酸纤维素膜及吸水垫,各部分之间重叠相接。通常在金标垫上喷涂有抗体标记的胶体金,硝酸纤维素膜上有包被抗体的检测线a和有羊抗鼠IgG构成的质控线b。其检测原理是利用吸水垫形成的毛细作用,置于样品垫上的被检测抗原首先与金标垫上的胶体金标记的抗体结合,并沿着硝酸纤维素膜(NC膜)继续向前移动,当到达固着有抗体的检测线a时,抗体将其捕获,随着反应进行,不断富集达到肉眼可见水平;过量的胶体金标记的抗体继续向前移动,到达固着有羊抗鼠IgG的质控线b时,被捕获并不断富集。因此若样品为阳性,则在检测线和质控线上均出现色条带,若样品为阴性,则仅在质控线上出现同样色彩的色条带。然而,胶体金免疫层析试纸条仍然存在检测灵敏度较低问题,特别是对于体积较大的细菌,检测限较高,使其应用受到了一定的制约。因此,开发对病原菌具有高灵敏检测效果的LFIAs具有重要的应用前景。
发明内容
为了克服上述现有技术的不足,本发明提供了一种基于聚多巴胺纳米颗粒的多检测线侧向流试纸条,聚多巴胺对细菌具有高亲和力,能够有效的提高结合效率,同时聚多巴胺具备高消光系数,进而最终提高了检测灵敏度;此外,多检测线的引入有效提高了致病菌的捕获效率,结合Image J软件分析,进一步提高检测灵敏度。
为实现上述目的,本发明是通过以下技术方案来实现的:
本发明第一方面提供了一种侧向流试纸条,所述侧向流试纸条以0.2-4mg/mL修饰有细菌抗体的聚多巴胺纳米颗粒溶液作为信号探针,试纸条的NC膜上设置有3-7条检测线,所述检测线为以0.2-4mg/mL细菌抗体的溶液为墨水经划线而得到的。
聚多巴胺纳米颗粒(PDA NPs)是一种无毒、生物相容性好的黑色纳米颗粒,具有广泛的应用前景。PDA NPs具备多种官能团(如羟基,氨基等),能够用于抗体修饰。同时,PDANPs具有良好的生物亲和力,具备一定的细菌识别能力,能够有效提高探针对靶标物的捕捉能力。更重要的是,与胶体金(Au NPs)相比,PDA NPs具有更高的消光系数,能够更容易的被肉眼所观察到。因此,以PDA NPs为信号源替代Au NPs,不仅可以将抗体更稳定的修饰,同时依靠该材料本身对细菌的亲和力,可以有效的提高信号探针与靶标的结合效率。此外,多条线的引入有助于提高靶标的结合效率,通过Image J软件的辅助,可以将肉眼无法观察的信号输出,进而提高检测灵敏度。
高消光系数材料与多检测线的结合,实现侧向流试纸条的超高灵敏检测。本发明经研究发现,经典胶体金在低浓度时,其灰度值无法被Image J软件所捕获。而在更换为具有高消光系数的材料聚多巴胺纳米颗粒时,虽然肉眼无法观察到低浓度的聚多巴胺纳米颗粒,但Image J能够捕获其信号。结合多检测线提高致病菌的捕获效率,最终通过灰度值分析实现了致病菌的超高灵敏检测。
优选地,所述侧向流试纸条的NC膜上设置有5条检测线,所述检测线为以0.5-2mg/mL细菌抗体的溶液为墨水经划线而得到的。
优选地,所述修饰有细菌抗体的聚多巴胺纳米颗粒的制备方法包括以下步骤:
S1、用Tris-HCl缓冲液配制1-4mM的盐酸多巴胺溶液,在20-45℃摇床(100-200rpm/min)下合成6-48h后制得聚多巴胺纳米颗粒;
S2、用PBS缓冲液溶解1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS),再加入PDA NPs和细菌抗体,制备得到修饰有细菌抗体的PDA NPs(PDA-AbNPs)。
本发明采用多巴胺自聚的方法制备了PDA NPs,PDA NPs上含有丰富的氨基官能团,通过EDC/NHS反应能够将抗体共价修饰到PDA NPs上,用于捕获靶标物。将修饰后的PDANPs取代传统的胶体金用于细菌的LFIAs检测,PDA NPs的高消光系数能够有效的提高LFIAs技术对细菌的检测灵敏度。
更优选地,步骤S1的聚多巴胺纳米颗粒在使用前,先离心去除上清,再用水重新悬浮。
更优选地,步骤S1的Tris-HCl缓冲液的浓度为0.01-0.1M,pH为8.5;步骤S2的PBS缓冲液的浓度为0.01-0.1M,pH为6.0。
更优选地,所述1-乙基-(3-二甲基氨基丙基)碳酰二亚胺、N-羟基琥珀酰亚胺、聚多巴胺纳米颗粒和细菌抗体的用量比为100:140:26:4-6。
本发明第二方面提供了第一方面所述的侧向流试纸条在细菌检测中的应用。
本发明提供的LFIAs以PDA NPs取代经典LFIAs中的Au NPs,PDA NPs具备高消光系数,且对细菌具有高亲和力,能够有效的提高结合效率,提高检测灵敏度。同时,该LFIAs为具有多条测试线的LFIAs,细菌因具有过大的体积,导致其在LFIAs的检测线上捕获效率过低,而多测试线的应用能够有效的保障靶标物的捕获效率,进而保证所有的靶标物能够被捕获。多测试线的试纸条与传统单条测试线的试纸条相比,因其能够捕获更多的靶标物,在Image J软件的分析下具有更高的信号,能够有效的提高检测灵敏度。同时,具有高消光系的PDANPs在肉眼无法观察到颜色变化的浓度下仍然能够被Image J所识别,突破了不借助额外仪器设备时LFIAs的检测限。
优选地,所述细菌包括大肠杆菌。
将修饰后的PDA NPs取代传统的胶体金用于大肠杆菌的LFIAs检测,PDA NPs的高消光系数能够有效的提高LFIAs技术对大肠杆菌的检测灵敏度,可视化检测范围在10
本发明第三方面提供了一种用于检测细菌的方法,具体为:利用第一方面所述的侧向流试纸条,先在样品垫上滴加样品,反应10分钟以上后使测试线充分的捕获靶标物,然后加入修饰有细菌抗体的聚多巴胺纳米颗粒(PDA-Ab NPs)并反应5分钟以上,再添加PBS缓冲液使得所有的聚多巴胺纳米颗粒都流通NC膜并与靶标物相结合,然后观察检测结果。
优选地,通过Image J软件对检测结果的灰度值进行分析,计算细菌的浓度。对于肉眼不可见的检测结果,借助Image J软件可以进一步提高检测限,且能对细菌进行定量分析。
更优选地,所述方法对细菌的检测限为10CFU/mL。
本发明提供的基于聚多巴胺纳米颗粒的多检测线侧向流试纸条,使用聚多巴胺纳米颗粒替代胶体金,有效的提高了与靶标致病菌的结合能力,且信号更容易被肉眼观察,因而提高了可视化的检测灵敏度(10
与现有技术相比,本发明的有益效果是:
本发明公开了一种侧向流试纸条,所述侧向流试纸条以修饰有细菌抗体的聚多巴胺纳米颗粒作为信号探针,其NC膜上设置有多条检测线,所述检测线是以细菌抗体的溶液为墨水经划线而得到的。本发明以PDA NPs取代经典LFIAs中的Au NPs,依靠PDA NPs具备的高消光系数特性以及对细菌的亲和性,及其与抗体结合的稳定性,实现了利用LFIAs检测细菌时两个数量级灵敏度的提高。同时,利用PDA NPs具备高消光系数的特性,其信号能够在肉眼不可见的情况下被Image J软件所识别与统计,同时联合多测试条带提高靶标的捕获效率,从而实现了对病原细菌的高灵敏检测。
附图说明
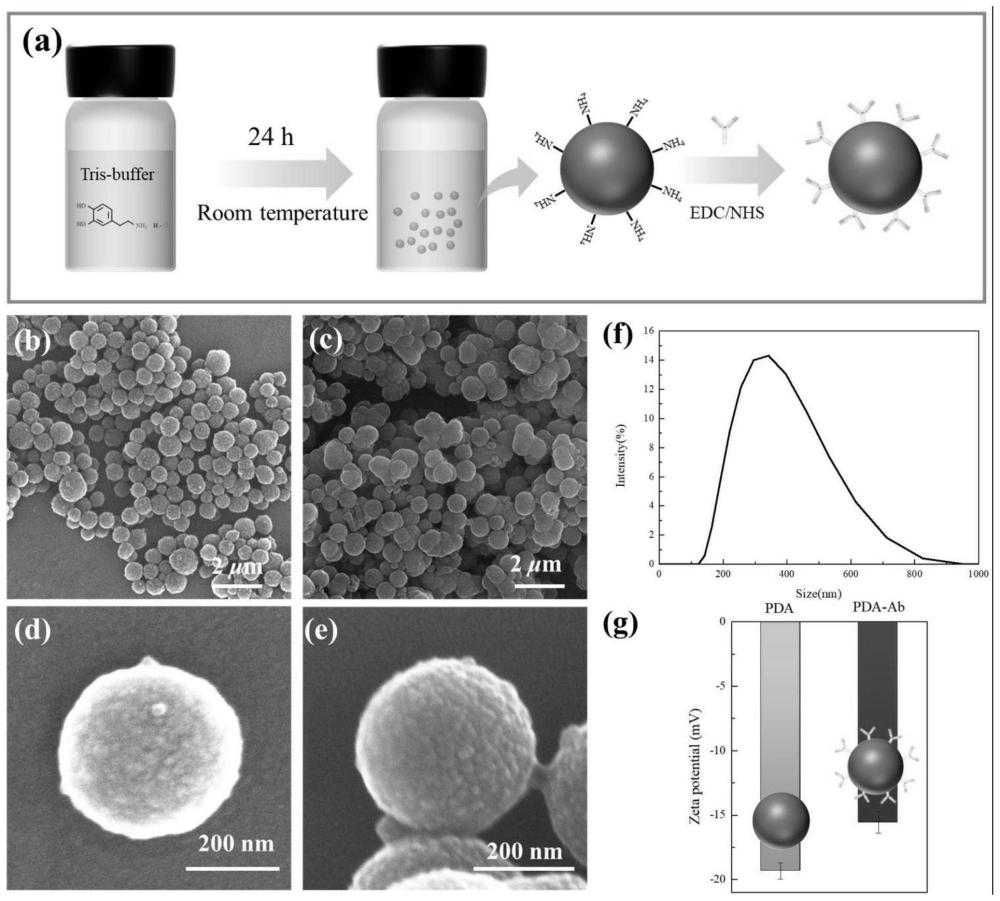
图1为合成PDA NPs及其修饰抗体的过程(a);PDANPs(b,d)和PDA-Ab(c,e)的扫描电镜图;PDA NPs的粒径分布情况(f);PDA NPs和PDA-Ab的Zeta电位检测结果(g)。
图2为PDA基多条带侧向流试纸条的制备过程(a),检测原理(b)和阴阳对比图(c)。
图3为PDA NPs和Au NPs的可见光吸收情况(a),常温下的储存稳定性(b);PDA NPs浓度与吸光值的关系图(c);Au NPs浓度与吸光值的关系图(d);不同浓度的PDA NPs和AuNPs分别滴加在NC膜上时的照片(f)和Image J统计的灰度值(e)。
图4为PDA NPs基LFIAs和Au NPs基LFIAs对大肠杆菌的检测结果:(a)为灰度值统计;(b)为检测曲线;(c、d)为检测各个浓度大肠杆菌的示意图:PDA NPs基LFIAs(c)和AuNPs基LFIAs(d)的灰度值检测结果。
图5为以灰度值为输出信号检测10CFU/mL大肠杆菌所需要的检测线数量。
图6为PDA基LFIAs对实际样品的检测结果:(a-b)为牛奶样品;(c-d)为橙汁样品;(e-f)为番茄汁样品。
具体实施方式
下面对本发明的具体实施方式作进一步说明。在此需要说明的是,对于这些实施方式的说明用于帮助理解本发明,但并不构成对本发明的限定。此外,下面所描述的本发明各个实施方式中所涉及的技术特征只要彼此之间未构成冲突就可以相互组合。
下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的试验材料,如无特殊说明,均为可通过常规的商业途径购买得到。
实施例1多检测线PDA NPs基LFIAs的制备及检测效果验证
该LFIAs的制备包含以下步骤:
(1)先配备0.05M的Tris-HCl(pH 8.5)缓冲液,然后将其用于配制2mM的盐酸多巴胺溶液,并放置在20-45℃摇床(100-200rpm/min)下合成24h(亦可在室温下放置),制得聚多巴胺纳米颗粒;
(2)将步骤(1)的混合液通过在8000rpm下离心去除上清,然后用水重新悬浮聚多巴胺纳米颗粒(0.13mg/mL),并储存于4℃冰箱中备用。
(3)用pH为6.0的PBS缓冲液(0.01M)溶解1-乙基-(3-二甲基氨基丙基)碳酰二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS),再加入PDA NPs和大肠杆菌抗体【E.coli O157:H7抗体,购买自Fitzgerald Co.,Ltd(North Acton,MA,USA)】,其中,EDC的浓度为0.5mg/mL,NHS的浓度为0.7mg/mL,PDA NPs的浓度为0.13mg/mL,大肠杆菌抗体的浓度为5mg/mL,制备得到修饰有大肠杆菌抗体的PDA NPs(PDA-Ab NPs)。PDA NPs的制备和修饰过程如图1a所示。对PDANPs进行表征,证明抗体成功修饰到PDA NPs上(图1g),且不会影响PDA NPs的形貌(图1b-f)。
(4)以1mg/mL大肠杆菌抗体的溶液为墨水,通过钢笔划线的方式在NC膜上划5条检测线,每条检测线的间隔为1mm。随后用该NC膜组装LFIAs,以步骤(3)制备的PDA-Ab NPs作为信号探针,获得PDA基的大肠杆菌LFIAs。
图2a为LFIAs的组成情况,其中检测线的数量为5条。图2b阐述了利用所制备的LFIAs检测大肠杆菌的机理以及检测步骤。第一步为在样品垫上滴加样品(一般为20μL),反应10分钟后使测试线充分的捕获靶标物,接着加入PDA-Ab NPs(15μL,1mg/mL)并反应5分钟,最终添加PBS缓冲液(一般为20μL),使得所有的PDA-Ab NPs都流通NC膜并与靶标物相结合。整个检测流程可在30分钟内完成,检测结果不仅肉眼可见,同时可通过Image J软件对其灰度值进行分析,计算大肠杆菌的浓度,并提高检测限。图2c为LFIAs的检测结果。
首次,比较了PDA NPs与Au NPs的消光系数,制备两种纳米颗粒(PDA NPs和AuNPs)的浓度-吸光值标准曲线,再根据Beer–Lambert′s law:A=log I0/I=εC l。(其中A是吸光值,ε是消光系数,C是浓度,l是光路长度)计算消光系数。根据图3c-d可分别计算出PDANPs的消光系数为37715L/(g·cm),Au NPs的消光系数为4685L/(g·cm),说明PDA NPs与AuNPs相比,更容易被肉眼所观察到。为了进一步验证上述的说法,对相同浓度(0.13mg/mL)的PDA NPs和Au NPs混合液进行了紫外全谱检测,结果如图3a所示,在可见光区域下,PDA NPs的吸收值远大于Au NPs,这与消光系数的结果检测相互印证。同时,通过比较二者的稳定性发现,PDA NPs在常温下更加稳定,更有利于长途运输,结果如图3b所示。最终,分析比较了PDA NPs和Au NPs在NC膜上的可视化浓度,结果如图3f所示,可见PDA NPs的浓度在0.01mg/mL时仍然能够在NC膜上观察到颜色变化,而Au NPs的浓度低于0.5mg/mL时已经无法观察到,这表明PDA NPs因其具有高消光系数的特性,在NC膜上比Au NPs更容易被观察到。因此以PDA NPs代替Au NPs能够有效的提高LFIAs的灵敏度。同时,对图3f的数据用Image J软件进行了灰度值分析,结果如图3e所示,即使PDA NPs的浓度低至0.01mg/mL导致肉眼无法观察到变化时,Image J软件仍然能有效捕获其灰度值信息,实现信号的输出,这有利于进一步提高LFIAs的检测灵敏度。而低浓度的Au NPs的灰度值信号无法被有效捕获,因而无法采用Image J来提高其灵敏度。
其次,比较了PDA NPs基LFIAs与Au NPs基LFIAs检测大肠杆菌的灵敏度,结果如图4所示。从图4可以观察到,经典Au NPs基LFIAs的检测限仅能达到10
最后,将PDA基LFIAs用于检测实际样品(牛奶,橙汁,番茄汁),结果如图6所示。其中图6a-b为牛奶中大肠杆菌的检测结果,从结果可以看到,该检测方法能够有效的检测牛奶中10
综上可见,聚多巴胺与胶体金相比具有更高的消光系数,能够更容易的被肉眼所观察,替代胶体金能够有效的提高LFIAs的灵敏度。同时,低浓度的聚多巴胺信号能够被电脑软件Image J所捕获,结合多条带可以进一步的提高LFIAs的灵敏度。因此,基于聚多巴胺纳米颗粒为信号的多条线LFIAs能够实现病原菌的超高灵敏检测。
以上对本发明的实施方式作了详细说明,但本发明不限于所描述的实施方式。对于本领域的技术人员而言,在不脱离本发明原理和精神的情况下,对这些实施方式进行多种变化、修改、替换和变型,仍落入本发明的保护范围内。
