一种基于铜死亡相关基因的胃癌预后评估系统及其应用
文献发布时间:2024-07-23 01:35:21
技术领域
本发明属于计算医学和肿瘤医学技术领域,具体涉及一种基于铜死亡相关基因的胃癌预后评估系统及其应用。
背景技术
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
胃癌(GC)是全球最重要的癌症之一,其发病率居全球第五,死亡率居全球第四。东亚和东欧的发病率最高。胃癌预后的风险因素包括幽门螺杆菌感染、年龄、肿瘤分期、亚型等。随着人口老龄化的加剧,在可预见的未来,胃癌的新发病例数量将继续增加。近年来,人们尝试将胃癌的分子类型与组织学表型和临床特征相结合,以了解胃癌的发生和发展机制,并探索指导临床决策的重要指标。新生物标志物的开发和鉴定推动了系统治疗和靶向治疗的发展。目前,胃癌的主要治疗方案是手术切除结合围手术期辅助治疗。人们越来越认识到,程序性死亡配体1(PD-L1)阳性的胃癌患者将受益于免疫检查点抑制剂治疗。此外,最近的研究报告称,血管内皮生长因子(VEGF)受体抑制剂作为单一药物或与化疗联合使用已改善了患者的生存结果。目前,胃癌的早期预测筛查和术后监测标志物尚不清楚。应开发和利用预后生物标志物对胃癌高危人群进行分层,以指导胃癌的治疗和干预。利用大数据技术和标准化统计模型为患者提供个性化精准医疗服务。
铜是人体不可或缺的微量元素,但当其含量过多时,会产生细胞毒性作用并触发程序性细胞死亡。先前的研究表明,铜离子载体(如DSF等)和铜螯合剂(如TTM等)都具有抗癌作用。最近的研究表明,铜离子载体触发一种特殊类型的受控细胞死亡,其机制与其他形式的程序性细胞死亡(如凋亡、焦亡、坏死和铁死亡)不同。铜依赖性细胞死亡源于铜与三羧酸(TCA)循环的脂酰化组分的直接相互作用。这种相互作用导致脂酰化蛋白的聚集和随后铁硫簇蛋白的耗竭,最终导致蛋白质毒性应激和细胞死亡的诱导。目前,关于铜死亡在肝癌、肺癌、三阴性乳腺癌等肿瘤中的研究已逐步开展。基于各种肿瘤中铜死亡特征的预后模型大多从单一方面构建,很少结合临床特征、分子景观和基因突变特征来构建模型,并且缺乏通过分子生物学实验的验证。肝癌领域的研究进展迅速,有研究构建了预后模型并验证了铜死亡相关基因LIPT1可能促进肝癌细胞的增殖、侵袭和迁移能力。其他研究表明,铜可以通过介导铜依赖性细胞死亡来抑制乳腺癌细胞的增殖,并通过开发水凝胶系统在乳腺癌手术前减小肿瘤体积。在乳腺癌领域,最新研究发现铜敏化系统治疗可以靶向诱导肿瘤内外细胞的铜中毒程序,并显著抑制乳腺癌的肺转移。然而在胃癌中,与铜死亡特征相关的预后模型构建尚不完善,缺乏基于胃癌患者临床特征和详细分子景观特征的预后模型。然而,这在胃癌分子靶向治疗的发展中仍有待探索。
发明内容
针对上述现有技术的不足,本发明提供一种基于铜死亡相关基因的胃癌预后评估系统及其构建方法和应用。本发明选取铜死亡基因的表达模式,确定了四种不同的胃癌(GC)集群,这些集群展现出不同的临床结果、生物途径,并与独特的肿瘤免疫环境紧密相关。通过铜死亡特征风险评分(CSRS),本发明发现CSRS较高的GC患者生存时间较短,与肿瘤粘附状态和较低的肿瘤突变负荷相关。此外,本发明设计的药物敏感性分析揭示了针对CSRS较高GC患者的潜在治疗药物,并通过分子生物学实验进行了验证。基于上述研究成果,从而完成本发明。
本发明是通过如下技术方案实现的:
本发明的第一个方面,提供检测铜死亡相关基因的试剂在制备胃癌预后评估产品中的应用。
其中,所述铜死亡相关基因为CDKN2A、ATP7B、ATP7A、DLD、MTF1、LIPT1、DLST、DLAT、GLS、LIAS、PDHB、DBT、FDX1、SLC31A1、GCSH、PDHA1所组成的组。
所述产品可以是检测试剂盒、检测装置或设备,在此不做具体限定。
本发明的第二个方面,提供一种基于铜死亡相关基因的胃癌预后评估系统,所述胃癌预后评估系统包括:
获取模块,其被配置为:获取受试者铜死亡相关基因的表达水平;
评估模块,其被配置为:根据获取单元获得的铜死亡相关基因的表达水平评估受试者胃癌预后情况。
其中,所述获取模块中,铜死亡相关基因为CDKN2A、ATP7B、ATP7A、DLD、MTF1、LIPT1、DLST、DLAT、GLS、LIAS、PDHB、DBT、FDX1、SLC31A1、GCSH、PDHA1所组成的组。
所述评估模块至少包含一个铜死亡特征风险(CSRS)评分模型,所述铜死亡特征风险评分(CSRS)模型采用如下方法构建获得:
S1、获取铜死亡相关基因的相关系数矩阵的特征值和特征向量,评估各特征值的方差贡献率,并构造矩阵乘积(主成分得分);
S2、将特征值作为加权系数来计算前五个主成分的加权得分作为铜死亡特征得分,即CSRS=∑(Ei*PCi)/E1:5,其中E表示特征值,PC表示主成分,i表示从1到5的数字。
进一步的,使用surv-cutpoint函数来确定CSRS评分模型中高风险和低风险的最佳分层点(截断点),具体的,所述surv-cutpoint函数是基于标准化的最大选择对数秩统计量来对CSRS评分模型中高风险和低风险的最佳分层点(截断点)进行确定。
所述步骤S1中,铜死亡相关基因为CDKN2A、ATP7B、ATP7A、DLD、MTF1、LIPT1、DLST、DLAT、GLS、LIAS、PDHB、DBT、FDX1、SLC31A1、GCSH、PDHA1所组成的组。
本发明的第三个方面,提供上述胃癌预后评估系统在如下任意一种或多种中的应用:
(a)胃癌相关生物学机制研究;
(b)胃癌分子亚型相关研究;
(c)制备胃癌患者预后评估的产品;
(d)胃癌相关基因组突变研究;
(e)抗肿瘤药物敏感性研究。
其中,所述(b)中,所述胃癌分子亚型为基于上述16个铜死亡相关基因的无监督聚类分析后所获得的四个铜死亡特征簇。
所述(c)中,所述胃癌患者预后评估至少包括对胃癌患者生存期的评估。
如上所示,高风险组的受试者预后较差,生存期较短,与肿瘤粘附状态和较低的肿瘤突变负荷相关;而低风险组的受试者预后较好,生存期较长。
所述(e)中,所述药物包括但不限于NSC319726、talazoparib和thapsigargin。上述三种药物对低CSRS评分(AGS)和高CSRS评分(HGC-27)亚型的胃癌细胞均具有良好的抑制作用。
上述一个或多个技术方案的有益技术效果:
上述技术方案获取16个与铜死亡相关的基因特征,确定了四种不同的胃癌(GC)集群,这些集群展现出不同的临床结果、生物途径,并与独特的肿瘤免疫环境紧密相关。通过铜死亡特征风险评分(CSRS),上述技术方案发现CSRS较高的GC患者生存时间较短,与肿瘤粘附状态和较低的肿瘤突变负荷相关。具体来说,在CSRS-高的亚型中,DBT、MTF1或ATP7A显著上调,而在CSRS-低的亚型中,ATP7B、SLC31A1、GCSH、LIAS、DLAT、FDX1、DLD和PDHA1显著富集。此外,上述技术方案的药物敏感性分析揭示了针对CSRS较高GC患者的潜在治疗药物,并通过分子生物学实验进行了验证。
总之,上述技术方案能够有效增强本领域对胃癌中铜死亡发生、发展和治疗进展的理解,具有良好的实际应用之价值。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。图1为本发明实施例1胃癌与铜死亡相关基因的综合特性。(A)Metascape富集网络可视化展示了16个铜死亡相关基因的富集术语的簇内和簇间相似性。不同的簇用不同的颜色编码。(B)在408名胃癌(GC)患者中,81名存在16个与铜死亡相关基因的遗传变异,变异频率为19.85%,主要包括错义突变、无义突变和插入突变。右侧面板上的数字表示每个铜死亡相关基因的突变频率。图表下方的分布显示了单个碱基组的突变频率。每一列代表一个患者。(C)铜死亡相关基因的拷贝数变异(CNV)在染色体上的位置。(D)在GC中16个铜死亡相关基因的CNV扩增和删失。CNV删失用粉色圆点标注,CNV扩增用蓝色圆点标注。(E)GC中16个铜死亡相关基因的相关性与预后。不同功能的铜死亡相关基因用不同颜色的圆圈表示。连接铜死亡相关基因的线表示它们之间的相互作用。每个圆圈的大小表示每个基因的预后效果,其按照经过缩放的对数p值进行调整。患者生存的保护因素由圆圈中心的绿点表示,风险因素由圆圈中心的黑点表示。(F)敲除16个铜死亡相关基因对胃癌细胞系增殖的影响。CERES得分越低,基因敲除后的效果越大。(G)16个铜死亡相关基因在正常和GC样本中mRNA表达水平的差异。星号表示统计p值(p<0.05;p<0.01;**p<0.001)。图2为本发明实施例1中由特定临床特征和分子亚型特征表征的铜死亡亚型。(A)热图展示了从亚洲癌症研究组织(ACRG)收集的代表性16个铜死亡相关基因的相对表达情况,分为不同的铜死亡特征簇。不同临床特征和亚型特征,包括年龄、性别、分期、分子亚型、Epstein-Barr病毒(EBV)和微卫星不稳定性(MSI)等,用不同颜色进行标注。(B,C)将ACRG(B)和The Cancer Genome Atlas(TCGA)(C)队列中不同分子亚型的铜死亡特征簇进行比较。(D-F)不同铜死亡特征簇的298名ACRG队列(D),405名TCGA队列(E)和433名Yonsei队列(F)胃癌(GC)患者的总生存期(OS)的Kaplan-Meier曲线分析结果。(对数秩检验)。
图3为本发明实施例1中以独特的功能信号富集和免疫景观为特征的铜死亡特征簇。(A)热图展示了在三个数据集中四个不同的铜死亡特征簇中的KEGG富集信号通路。(B)在亚洲癌症研究组织(ACRG)队列中,来自Zeng等人研究的分子特征,包括柠檬酸循环、铁死亡、硫辛酸代谢和丙酮酸代谢在CSC1、CSC2、CSC3和CSC4亚型之间的分布。(C)The CancerGenome Atlas(TCGA)胃癌中显著突变基因(SMGs)的突变谱在四个铜死亡特征簇中的情况。瀑布图展示了SMGs在四个簇中的突变频率,并且在右上方用星号突出显示具有统计显著差异分布的基因。(D)在ACRG队列中,CSC1、CSC2、CSC3和CSC4亚型之间的肿瘤突变负荷和非整倍体得分进行了比较。(E)比较了四个铜死亡特征簇中单样本基因集富集分析(ssGSEA)算法标注的细胞亚群的比例。在每个组中,粗线表示中位数值。底部和顶部分别是第25个和第75个百分位数(四分位距)。须包含1.5倍的四分位距。通过Kruskal-Wallis H检验比较了四个簇之间的统计差异。p<0.05;p<0.01;**p<0.001。
图4为本发明实施例1中构建铜死亡特征风险评分并探索其临床相关性。(A)使用标准化的最大选择对数秩统计方法确定铜死亡特征风险评分的截断点。(B)使用Spearman分析,评估铜死亡特征风险评分(CSRS)与已知生物基因特征之间的相关性。负相关用蓝色标注,正相关用红色标注。圆圈中的数字表示相关系数。(C)热图展示了四个CSC亚型和两个CSRS亚型中的铜死亡相关基因和CSRS的标准化表达水平。每一列代表单个患者。(D-F)铜死亡特征风险评分三个独立数据集中的四组铜介导的细胞死亡特征簇中的分布情况。这包括亚洲癌症研究组织(ACRG)数据集(D)、The Cancer Genome Atlas(TCGA)数据集(E)和延世队列数据集(F)中的分布情况。(G)铜死亡特征簇在不同分子亚型(MSS/TP53-、MSS/TP53+、微卫星不稳定性[MSI]、上皮间质转化[EMT])、铜介导的细胞死亡特征风险评分亚型(低和高)中的分布。(H-J)ACRG(H)、TCGA(I)和Yonsei(J)中高和低铜死亡特征风险评分患者组的Kaplan-Meier曲线分析。对数秩检验,p<0.05。
图5为本发明实施例1中胃癌不同铜死亡特征风险评分(CSRS)亚型的肿瘤基因组景观。(A)The Cancer Genome Atlas(TCGA)-胃腺癌(STAD)中显著突变基因(SMGs)的突变谱,按低(左侧)和高(右侧)CSRS亚型分层。每一列代表一个患者。中央显示了在不同CSRS亚型中每个基因的突变频率。年龄、性别、分期、分子亚型、免疫亚型、MFP和CSC显示为上部面板的患者注释。(B)CSRS高和低亚型的肿瘤突变负荷的比较。(C)对应提取的突变签名(Catalog of Somatic Mutations in Cancer[COSMIC]10、17、1、3和26,即COSMIC数据库)的突变活性。(D)高和低CSRS亚型中对应的突变签名的突变活性的比较。(E)CSRS高和低亚型中染色体水平的体细胞拷贝数变异(SCNA)事件。红色表示扩增,蓝色表示缺失。(F)显示具有显著体细胞拷贝数扩增(红色)和缺失(蓝色)的局部峰值(Q值<0.1)。标记了前20个扩增和缺失的细胞色带。这些局部峰值编码的代表性基因在基因组中的大致位置上突出显示。
图6为本发明实施例1中探索在高铜死亡特征风险评分(CSRS)得分的胃癌(GC)患者治疗中的潜在药物。(A)在GC细胞系中,药物与CSRS得分之间的关联和敏感性分析示意图。(B-I)CSRS与转化生长因子β(TGF-β)受体拮抗剂、GSK1904529A(IGF1R/IR),5Z.7.Oxozeanol(TAK1),thapsigargin(SERCA),CAP232/TT232/TLN232,NSC319726(P53Mut Specific)and TANK1366(Tankyrase1/2PARP5a/PARP5b)之间的相关分析。(J-N)在GC中,比较低和高铜死亡特征风险评分亚型之间A832234,SB505124,thapsigargin,NSC319726,talazoparib的药物效力。
图7为本发明实施例1中铜死亡特征风险评分(CSRS)低(AGS)和高(HGC-27)亚型胃癌细胞中铜死亡相关蛋白的表达和药物敏感性差异。(A)WB分析显示CSRS低(AGS)和CSRS高(HGC-27)亚型中FDX1、LIAS、DLAT、DLST、GCSH、DLD、PDHB、PDHA1和β-actin的表达情况。(B-D)CSRS低(AGS)和CSRS高(HGC-27)亚型胃癌细胞对NSC319726、thapsigargin,talazoparib和药物的敏感性分析。(E-H)两个CSRS低(AGS)和CSRS高(HGC-27)亚型胃癌细胞系在二甲基亚砜(DMSO)或三种药物处理下的克隆形成能力。p<0.05;p<0.01;**p<0.001。
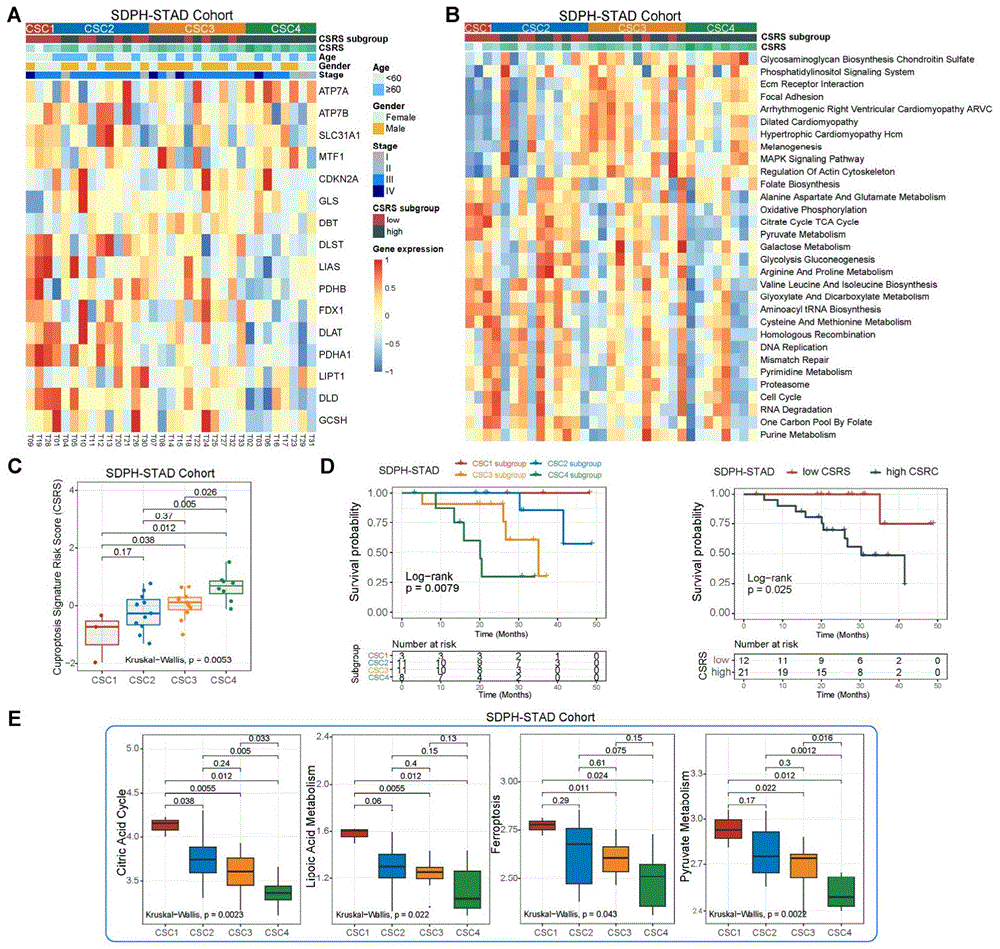
图8为本发明实施例1中基于山东省立医院胃癌队列对铜死亡特征风险评分。(A)热图展示了从山东省立医院胃癌队列(SDPH-STAD)收集的33例病例的16个铜死亡相关基因的相对表达情况,分为不同的铜死亡特征簇和铜死亡特征风险评分亚型。不同临床特征和亚型特征,包括年龄、性别、分期等用不同颜色进行标注。(B)热图展示了山东省立医院胃癌队列中四个不同的铜死亡特征簇中的KEGG富集信号通路。(C)铜死亡特征风险评分在的四个不同的铜死亡特征簇中的分布情况。(D)山东省立医院胃癌队列不同风险组患者生存分析。(E)柠檬酸循环、铁死亡、硫辛酸代谢和丙酮酸代谢得分在山东省立医院胃癌队列的CSC1、CSC2、CSC3和CSC4亚型之间的分布。
具体实施方式
应该指出,以下详细说明都是例示性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
本发明公开了可用于执行所公开的方法和系统的部件。本文公开了这些以及其他部件,并且应当理解,当公开这些部件的组合、子组、交互、组等时,尽管可能没有明确公开对这些部件的各种单独和集合组合和排列中每一者的特定引用,但对于所有的方法和系统,本文对每一者都进行了具体地设想和描述。这适用于本申请的所有方面,包括但不限于所公开的方法中的步骤。因此,如果存在可进行的各种另外的步骤,则应当理解,这些另外的步骤中的每一个步骤可利用所公开的方法的任何特定实施方案或实施方案的组合来进行。
以下通过实施例对本发明做进一步解释说明,但不构成对本发明的限制。应理解这些实施例仅用于说明本发明而不用于限制本发明的范围。
实施例1
1.方法
公共数据采集与数据清洗
我们进行了一项专注于铜死亡的文献回顾,并整理了一份包含16个铜死亡相关基因的列表。这些基因随后被仔细分析,以确定与铜死亡特征相关的不同集群。这16个铜死亡相关基因被分为两组,即阳性命中(FDX1、DLST、LIAS、LIPT1、DLD、DLAT、DBT、SLC31A1、PDHB、PDHA1、GCSH)和阴性命中(MTF1、GLS、CDKN2A、ATP7A、ATP7B)。我们从公共数据库中获取了具有可用转录组和临床数据的胃癌样本数据,包括ACRG数据集(亚洲癌症研究小组,2015年,N=298,https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE62254)、TCGA-STAD数据集(癌症基因组图谱-胃腺癌,2018年,N=408,https://portal.gdc.cancer.gov/)和延世大学数据集(延世大学队列,2018年,N=433,https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE84437)。在去除信息不完整的样本后,共有1139名胃癌患者被纳入研究进行后续分析。ACRG数据集用于模型建立,而TCGA和延世大学数据集则用于进一步验证。同时,本申请还利用了山东省立医院胃癌队列(SDPH-STAD)收集到的33例胃癌病例患者信息进行了验证。
功能富集、互作网络分析和通路注释
我们使用Metascape数据库(https://metascape.org)对铜死亡相关基因进行了功能富集分析。基于基因表达水平,我们使用STRING(https://string-db.org)绘制了16个铜死亡相关基因的蛋白质-蛋白质互作网络。所选基因的富集通路基于GO富集分析。
拷贝数变异(CNV)分析、高频突变基因和肿瘤突变特征
我们使用R包“oncoplot”进行基因突变景观描述。使用R包“RCircos”将16个铜死亡相关基因映射到染色体上。使用R包“maftools”进行CNV分析,以注释不同CSRS亚型中的扩增和缺失细胞带。使用非负矩阵因子反卷积模型的贝叶斯推断的Signature Enrichment函数来确定可以提取的最佳突变特征数量。在癌症体细胞突变目录中使用余弦相似性分析来比较和注释探索的胃癌突变特征。
16个铜死亡相关基因的无监督聚类分析
iClusterPlus包实现了一个正则化的潜在变量模型,用于聚类,该模型结合了不同数据类型的联合推断,以产生综合的聚类分配。这种方法利用多个来源的信息来提高聚类结果的准确性和稳健性。在这里,我们采用iClusterPlus包,根据胃癌中16个铜死亡相关基因的转录组特征,识别不同的铜死亡特征簇。根据iClusterPlus的指南,最佳簇数被确定为四个,这由代表解释变异百分比的曲线趋于平稳所指示。这表明,将簇数进一步增加到四个以上不会显著提高模型解释的变异量。我们使用iCluster2函数,设置K=4,lambda为0.1,方法设置为“lasso”来执行聚类分析。
通过ssGSEA建立铜死亡评分
我们利用由铜死亡基因组成的基因集,并应用ssGSEA方法为每个样本分配一个铜死亡评分。ssGSEA是一种基于基因集的方法,用于评估单个样本内基因集的富集程度。它通过计算每个基因集内基因的排序来量化基因集的富集程度,从而得出基因集富集评分。ssGSEA的关键优势在于其能够在单个样本内评估基因集的富集程度,无需进行样本间比较。这在处理有限数量的样本或缺乏对照组时特别有价值。ssGSEA可以应用于多种类型的基因表达数据,包括RNA-seq和微阵列数据。
使用ssGSEA估计免疫细胞浸润
通过ssGSEA量化了胃癌肿瘤微环境中28种免疫细胞类型的相对浸润情况。每种免疫细胞亚群的特殊特征基因面板均来自Charoentong等人的研究。在ssGSEA分析中,每种免疫细胞类型的相对丰度由富集评分表示。免疫细胞滤过的生物相似性通过多维尺度(MDS)和高斯拟合模型进行估计。
细胞系与药物敏感性分析
我们还利用癌症依赖性图谱项目(DepMap)的数据评估了胃癌中铜死亡相关蛋白的遗传脆弱性。在26个具有胃癌起源的细胞系中,计算了反映铜死亡基因依赖性的平均基因必需性评分(CRISPR-Cas9基因敲除评分[CERES])。利用癌症药物敏感性基因组学(GDSC1)数据集发布的药物IC50值,探讨了CSRS评分与潜在治疗方法的关联性。
构建CSRS评分系统
我们使用主成分分析(PCA)构建了一个CSRS方案,以量化个体患者的相对铜死亡风险水平。具体来说,我们推导了16个铜死亡基因表达谱的相关系数矩阵的特征值和特征向量,评估各特征值的方差贡献率,并构造矩阵乘积(主成分得分)。本研究发现PCA分析中约79.1%的变异(方差贡献率)可由前五个特征值解释,因此被视为要保留的主成分数量。然后,将特征值作为加权系数来计算前五个主成分的加权得分作为铜死亡特征得分。为方便使用,我们采用了一个公式来定义每个胃癌样本的CSRS得分:CSRS=∑(E
细胞培养
AGS细胞和HGC-27细胞由ATCC提供。AGS细胞和HGC-27细胞在补充有胎牛血清(FBS,10%,PAN;ST30-3302)和青霉素-链霉素-庆大霉素(1%,Solarbio;P1410)的RPMIMedium 1640基础培养基(Gibco;C11875500BT)中进行培养。细胞在37℃、95%空气和5%CO
Western blot分析
当观察到细胞密度达到约90%时,我们准备裂解细胞以提取蛋白质。使用BCA蛋白检测试剂盒(Solarbio;PC0020)通过BCA方法测定蛋白质浓度。在获得OD值后,根据标准曲线计算的浓度公式计算每个样品的最终浓度。制备浓度为12%的凝胶后,加载样品开始蛋白质电泳。首先,在50V的恒定压力下,将蛋白质压入浓缩胶中的均质带,然后以100V运行分离胶。电泳后,我们开始转印PVDF膜,使用220mA的恒定电流,并根据1min/kDa计算转印时间。选择脱脂牛奶进行封闭,并使用50rpm脱色摇床摇动1小时。用TBS-t溶液洗涤PVDF膜后,加入针对FDX1(Proteintech;12592-1-AP;19kDa)、LIAS(Proteintech;11577-1-AP,34-42kDa)、DLD(Proteintech;16431-1-AP;54kDa)、DLAT(Proteintech;13426-1-AP;70kDa)、DLST(CST;5556S;50kDa)、PDHA1(Proteintech;18068-1-AP;43kDa)、PDHB(Proteintech;14744-1-AP;39kDa)、GCSH(Proteintech;16726-1-AP;19kDa)和β-肌动蛋白(Proteintech;20536-1-AP;42kDa)的一抗进行孵育,并在4℃下用带冰盒的50rpm脱色摇床摇动14-16小时。用TBS-t溶液洗涤PVDF膜后,加入相应的二抗(Proteintech;SA00001-2)进行抗体孵育,并在50rpm下脱色摇床摇动1小时。用TBS-t溶液洗涤PVDF膜后,我们制备显影剂,向每条膜带中加入适量的显影剂,曝光并显影蛋白质膜带,并在储存后用ImageJ1.52v软件分析膜带。
CCK-8细胞增殖实验
胃癌细胞经消化处理后,以每孔5000个细胞的密度接种于96孔板中。当细胞密度达到90%-95%时,根据浓度梯度制备药物并添加到不同的孔中。具体的浓度梯度设置如下:NSC319726(0、1.0、10.0、100.0、300.0),毒胡萝卜素(thapsigargin)(0、0.1、1.0、10.0、50.0、100.0),他拉唑帕尼(talazoparib)(0、0.1、1.0、10.0、50.0、100.0)。经过24小时的药物处理后,使用CCK-8试剂盒(DojinDo;CK04)通过CCK-8方法在450nm波长处测定剩余细胞的OD值,并使用GraphPad prism 8软件计算不同浓度下的细胞存活率并绘制图表。
平板克隆实验
我们将胃癌细胞接种到六孔板中,每孔1000个细胞。细胞生长24小时后,我们更换为含有IC50浓度的药物溶液。处理24小时后,我们再次更换为完全培养基,并继续培养8-10天,直至细胞集落大小适中。用预冷的PBS洗涤后,我们用1mL 4%多聚甲醛固定30分钟,再用1mL结晶紫染色30分钟,之后用PBS洗涤。然后,我们使用相机拍照,并利用ImageJ1.52v软件计算细胞集落的数量。
统计分析
本研究中的统计分析使用R-4.0.2进行。对于定量数据,正态分布变量的统计显著性通过学生t检验进行估计,而非正态分布变量则通过Wilcoxon秩和检验进行分析。对于两组以上的比较,分别使用Kruskal-Wallis检验和单因素方差分析作为非参数和参数方法。根据特定的分组条件,使用卡方检验和Fisher精确检验来分析列联表。使用Kaplan-Meier生存分析和Cox比例风险模型来分析代谢转录组模式与预后之间的关联,其中使用了R包“Survminer”(0.4.6)。来自“survival”包的surv-cutpoint函数被应用于将ACRG队列中的样本分为高CSRS得分和低CSRS得分亚型。所有比较均为双侧,alpha水平为0.05,并且应用Benjamini-Hochberg方法来控制多重假设检验的假发现率(FDR)。
2.结果
胃癌中铜死亡相关基因的突变情况
本研究探讨了16个铜死亡相关基因在胃癌(GC)中的作用。对这16个铜死亡相关基因进行了GO富集和Metascape分析,揭示了显著富集的生物过程,如图1A所示。这些基因主要富集在乙醛酸代谢、甘氨酸降解、铜代谢等方面。在408个样本中,有81个(19.85%)铜死亡相关基因样本出现了遗传改变,主要是错义突变、插入突变和移码突变。最常见的碱基突变是C到T、T到C和C到A(图1B)。在铜死亡相关基因中,CDKN2A的突变频率最高,紧随其后的是ATP7B和ATP7A。我们进一步调查了所有铜死亡相关基因之间的突变共存情况,并确定了CDKN2A与ATP7A、ATP7B与LIPT1、ATP7A与ATP7B以及ATP7A与LIPT1之间存在显著的突变共存关系。对这16个铜死亡相关基因的进一步分析表明,CNV(拷贝数变异)突变很普遍。图1C展示了这些基因CNV改变的染色体位置。此外,我们的分析表明,这16个铜死亡相关基因的CNV频率并不一致,表明这组基因的突变率存在差异。CDKN2A和LIPT1普遍存在CNV缺失,而ATP7B、DLD、MTF1、GLS和ATP7A则显示出广泛的CNV扩增(图1D)。
为了进一步评估铜死亡相关基因之间的相互调控关系,我们进行了斯皮尔曼相关性分析。结果表明,DBT和ATP7A与其他铜死亡相关基因之间存在显著的负相关关系。相反,DLAT、FDX1和PDHA1则与其他与铜死亡相关的基因呈现出显著的正相关关系。我们采用Cox回归分析来确定铜死亡相关基因与胃癌(GC)患者预后之间的关系。由此分析生成的森林图显示,DBT、ATP7A、PDHB和CDKN2A可被视为与GC患者总生存期显著相关的风险因素。此外,我们还以关系网络的形式可视化了16个铜死亡相关基因之间的相互作用关系,其中线条代表两个基因之间的相关性,圆圈大小代表预后值(图1E)。这一复杂的网络突显了16个铜死亡相关基因共同影响胃癌的发展和进程,并为基于铜死亡特征的亚型划分提供了依据。我们计算了26个源自胃腺癌(STAD)的细胞系的平均基因必需性得分,特别是CRISPR-Cas9基因敲除得分(CERES)。这些得分作为评估这些细胞系中基因依赖程度的指标。在大多数细胞系中,FDX1、LIAS、DLST、GCSH和DLD的得分低于-0.25,可能对细胞增殖产生潜在影响(图1F)。铜死亡相关基因在肿瘤样本和相邻正常样本中的表达模式存在显著差异。具体而言,LIPT1、ATP7A、LIAS、DBT和PDHB等基因在肿瘤组织中显著下调。相反,CDKN2A、GLS、MTF1和SLC31A1等基因在肿瘤中显著上调,提示它们在疾病的病理生理过程中发挥不同的作用(图1G)。铜死亡特征模式以特定的临床特征和分子亚型为特征
我们进一步探讨了胃癌肿瘤中铜死亡相关基因的表达模式与临床特征以及分子亚型之间的关系。基于16个铜死亡相关特征基因,我们通过无监督聚类分析获得了四个稳定的转录组簇。我们观察到不同簇中铜死亡相关基因的表达模式存在显著差异,这表明在不同亚群的胃癌中,与这些基因相关的潜在生物过程和机制可能存在变化。LIAS、DLAT、PDHA1和SLC31A1在CSC1亚型中显著升高;CDKN2A和GLS在CSC2亚型中明显增加;MTF1、DBT和SLC31A1在CSC3亚型中明显增加;ATP7A和LIPT1在CSC4亚型中明显增加(图2A,ACRG队列)。在癌症基因组图谱(TCGA)和延世队列中也观察到了类似的铜死亡相关基因表达分布。有趣的是,大多数微卫星不稳定(MSI)阳性肿瘤聚集在CSC1亚型内,最终形成了高突变表型、MSI和免疫富集亚型的融合。相反,CSC4亚型与晚期肿瘤分期、间质表型、弥漫组织学亚型和纤维化肿瘤微环境(TME)亚型密切相关。这些观察结果强调了遗传不稳定性、肿瘤微环境与胃癌进展之间的复杂关系(图2B,C),这表明基质侵袭和预后不良。进一步的生存分析揭示了胃癌(GC)样本中由铜死亡特征定义的四个簇之间显著的预后差异。值得注意的是,CSC1特征显示出良好的预后相关性,而CSC4特征与不良生存结果相关(图2D-F)。多变量Cox比例风险回归分析进一步证实,该分层模型与患者生存结果存在独立相关性(ACRG队列:CSC1vs.CSC4,风险比[HR],2.24[95% CI,1.43-3.50],p<0.001;TCGA队列:CSC1 vs.CSC4,HR,2.31[95% CI,1.32-4.02],p=0.003;延世队列:CSC1 vs.CSC4,HR,1.85[95% CI,1.08-3.19],p=0.026)。此外,我们检查了通过单样本基因集富集分析(ssGSEA)获得的不同簇中铜死亡得分的分布。我们的分析显示,在所有三个数据集中,不同簇之间铜死亡得分的分布存在显著差异。具体而言,与CSC1和CSC2相比,CSC3和CSC4的得分显著降低。
以不同分子过程和基因组改变为特征的铜死亡特征簇
为了研究基于铜死亡特征的四个簇的潜在生物分子变化,我们使用了京都基因与基因组百科全书(KEGG)基因集进行了基因集变异分析(GSVA)富集分析。GSVA的结果显示,CSC1在物质合成、代谢和能量代谢相关的过程中表现出显著的富集,包括氨基酰-tRNA生物合成、叶酸一碳库、乙二酸和二羧酸代谢、精氨酸和脯氨酸代谢、柠檬酸循环(TCA循环)和氧化磷酸化。相反,CSC4主要在与细胞粘附和基质通路相关的通路中表现出富集,如糖胺聚糖生物合成(硫酸软骨素)、肌动蛋白细胞骨架的调节、粘着斑和ECM-受体相互作用。这些发现揭示了胃癌中不同簇的独特生物学特性和潜在功能作用。有趣的是,所有这些相关的生物过程在CSC2亚型中都是中位数富集(图3A)。此外,我们利用了从Zeng等人的研究中整理的免疫肿瘤学特征来评估四种CSC亚型中的生物过程和通路。CSC1和CSC2在3个数据库中的柠檬酸循环评分较高(图3B);CSC1在3个数据库中的脂酸代谢较高(图3B);CSC4在ACRG队列中的铁死亡评分较低(图3B),而CSC1在TCGA队列中的铁死亡评分较高;CSC1和CSC2的丙酮酸代谢评分较高;乙二酸和二羧酸代谢评分在从CSC1到CSC4的延世队列中逐渐降低。为了更深入地了解不同CSC亚型之间的突变情况,我们在TCGA队列中进行了SMG分析,比较了CSC1、CSC2、CSC3和CSC4亚群之间的基因突变频率。我们的分析显示,在CSC1亚型中,ARID1A、PIK3CA、COL11A1和APC的突变率高于TCGA队列中的其他亚型。这些发现提示了潜在的亚型特异性突变模式,可能有助于CSC1在胃癌中的独特特征和行为(调整后的卡方检验,p<0.05;图3C)。
我们还探讨了不同CSC亚型中肿瘤微环境的变化。基因组分析显示,CSC1的突变负荷最高,而CSC3的非整倍体评分较高(图3D)。抗肿瘤淋巴细胞亚群,如活化的CD4+/CD8+T细胞主要在CSC1亚型中富集。然而,在CSC4亚型中,效应记忆CD4+/CD8+T细胞、肥大细胞、嗜酸性粒细胞、1型辅助细胞和2型辅助T细胞显著升高(图3E)。
构建铜死亡特征风险评分并探索其临床意义
尽管我们的研究强调了基于铜死亡特征的簇的预后意义,但这些分析仅限于患者群体水平,缺乏预测个体肿瘤内铜死亡特征模式的精确性。为了解决这一局限性,我们设计了一个评分系统,即铜死亡特征风险评分(详见方法部分),旨在量化个体胃癌患者的铜死亡特征。这一评分方案能够更个性化地评估与铜死亡相关的风险,有助于胃癌管理中的针对性治疗。在主成分分析和16个与铜死亡相关的基因中,贡献最大的前5个主成分中,排名靠前的基因包括DLAT、FDX1、DBT、DLD等。我们进一步将胃癌患者分为CSRS-Low和CSRS-High两种亚型。截断点是通过在ACRG队列中使用标准化的最大选择log-rank统计量来确定的(图4A)。我们通过Spearman分析检查了已知生物学特征与铜死亡特征风险评分之间的关系。相关矩阵的热图显示了显著的相关性。具体来说,铜死亡特征风险评分与脂酸、丙酮酸代谢和柠檬酸循环呈明显负相关。相反,它与癌症成纤维细胞、肿瘤相关巨噬细胞、糖原和糖胺聚糖生物合成以及细胞因子受体相关的特征呈正相关。这些发现表明胃癌中与铜死亡相关的风险与各种生物学过程之间存在复杂的相互作用,指出了进一步调查和治疗的潜在目标(图4B)。我们的观察结果表明,CSRS-Low和CSRS-High亚型之间铜死亡相关基因的表达水平存在显著差异。在CSRS-High亚型中,DBT、MTF1和ATP7A显著升高;在三个数据库的CSRS-Low亚型中,ATP7B、SLC31A1、GCSH、LIAS、DLAT、FDX1、DLD和PDHA1明显增加(图4C)。我们还探讨了铜死亡特征风险评分与CSC簇之间的分布,并发现铜死亡特征风险评分在三个数据库的CSC4亚型中明显高于其他三个亚型(图4D-F)。考虑到量化铜死亡特征的复杂性,我们采用了流图来说明构建铜死亡特征风险评分的工作流程(图4G)。通过清晰简洁地展示这一工作流程,流图有助于理解铜死亡特征风险评分的方法论,并为未来研究中的方法复制提供了便利。为了进一步验证铜死亡特征风险评分的预后价值,我们将患者分为两个亚型:CSRS-Low和CSRS-High。正如假设的那样,被归类为CSRS-Low的患者在所有三个研究队列中都表现出明显更好的预后。这一发现突显了铜死亡特征风险评分作为胃癌患者生存结果预测指标的潜力(图4H-J)。对三个队列的多变量分析确实证实,铜死亡特征风险评分可以作为胃癌的独立预后生物标志物(ACRG队列的HR为1.61[95% CI,1.16-2.25],p=0.005;TCGA队列的HR为1.73[95% CI,1.19-2.50],p=0.004;Yonsei队列的HR为1.49[95% CI,1.12-2.00],p=0.007)。具有铜死亡特征突变的胃癌肿瘤基因组图谱
为了更深入地理解胃癌患者中与铜死亡特征风险评分相关的基因组改变,我们分析了通过全外显子测序(WES-seq)和单核苷酸多态性(SNP)阵列分析获得的体细胞突变数据。具体来说,我们在TCGA队列中进行了显著突变基因(SMG)分析,比较了CSRS-Low和CSRS-High亚型之间基因突变的频率。这种综合方法使我们能够确定可能导致不同风险评分的遗传异常,并可能有助于胃癌的发病和进展。TCGA队列中的突变谱显示,ARID1A、PIK3CA、APC、ERBB3、COL11A1、RNF43、BCOR、PTEN和PTPN23在CSRS-Low亚型中的突变率高于CSRS-High亚型(经调整的卡方检验,p<0.05,图5A)。在TCGA队列中也观察到了一致的结果,即患者的铜死亡特征风险评分较低与肿瘤突变负荷较高显著相关。
在解析了来自全外显子测序(WES-seq)和单核苷酸多态性(SNP)阵列分析的体细胞突变数据后,我们继续分析胃癌(GC)肿瘤中的单核苷酸变异(SNVs)。具体来说,我们比较了CSRS-Low和CSRS-High亚型在96种可能突变矩阵中的SNV谱。饼图显示,CSRS-Low亚型中C>T转换略有减少,而CSRS-Low亚型中T>G转换略有增加。Lego图分析揭示了胃癌(GC)中独特的突变模式,其中C>T转换主要发生在ApCpN三核苷酸位点。值得注意的是,在CSRS-Low亚型中突出了一个特定的突变,即GpTpG位点的T>G转换。随后,我们从基因组数据中提取了五个突变特征,包括聚合物POLE缺陷(COSMIC 10)、5-甲基胞嘧啶的自发或酶促脱氨基作用(COSMIC 1)、HR介导的DNA-DSB修复缺陷(COSMIC 3)、缺陷性DNA错配修复(COSMIC 26)和一个未知特征(COSMIC 17)(图5C)。我们发现CSRS-High亚型在特征1和特征26中具有更高的突变计数;然而,在特征3和特征10中的突变计数较低(p<0.005,图5B,D)。臂级体细胞拷贝数改变(SCNA)结果表明,特定染色体区域,包括chr1p、chr3、chr7q、chr8q、chr11q、chr18q和chr20p,包含GC中最常见的扩增或缺失区域。这些发现具有重要意义,因为它们暗示了这些染色体区域在GC的发病和进展中的作用。这些区域的扩增和缺失可能导致癌基因或肿瘤抑制基因的失调,从而驱动肿瘤的生长和转移(图5E)。两个CSRS亚型中排名最高的CNV位点为8q、9p、20q等。焦点水平SCNAs显示,CSRS-Low亚型中的1p36.23(PARK7)和cuproptosis特征风险高评分亚型中的3q27.1(PIK3CA)、11q13.3(CCND1)和12p12.1(KRAS)包含明显扩增的焦点区域;而cuproptosis特征风险高评分亚型中的1p36.11(ARID1A)和11q23.2(FDX1,DLAT,BACE1)包含频繁缺失的区域(FDR<0.05,图5F)。归因于COSMIC 1和COSMIC 26特征的突变计数在CSRS-Low亚型中表现出显著升高,而与COSMIC 3特征相关的突变计数在CSRS-High亚型中观察到显著降低。
CSRS评分与抗肿瘤药物之间的相关性和有效性分析
我们进一步联合分析了癌症细胞系百科全书(CCLE)和癌症药物敏感性基因组学(GDSC1)数据库,以确定CSRS评分与胃癌细胞系抗肿瘤药物敏感性之间的关联(图6A)。考虑到预后较差,我们特别关注于为高CSRS评分的胃癌(GC)样本确定潜在的治疗方案。有意义的是,CSRS评分与选定药物的IC50值之间存在显著的负相关,如SB505124(转化生长因子-β[TGF-β]受体拮抗剂,图6B,Spearman相关性检验)、GSK1904529A(IGF1R/IR抑制剂,图6C)、5Z.7.Oxozeanol(TAK1抑制剂,图6D)、thapsigargin(SERCA抑制剂,图6E)、CAP232/TT232/TLN232(糖酵解,SSTR1/SSTR4激活剂,图6F)、NSC319726(P53-R175突变激活剂,图6G)、TANK1366(Tankyrase1/2,PARP5a/PARP5b抑制剂,图6H)和LDN193189(BMP ALK2/ALK3抑制剂,图6I)。进一步的分析表明,这些药物在CSRS-High亚型患者中的IC50值较低(A832234(MetAP2抑制剂,图6J,Wilcoxon检验)、SB505124(图6K)、thapsigargin(图6L)、NSC319726(图6M)和talazoparib(PARP1/PARP2抑制剂,图6N)Q2。有趣的是,SB505124、thapsigargin和NSC319726在两次分析中均出现。
通过Western blot实验和药物敏感性实验验证CSRS-Low(AGS)和CSRS-High(HGC-27)亚型之间的差异
我们进行了分子实验以验证我们的发现,Western blot分析结果显示,在CSRS-Low(AGS)和CSRS-High(HGC-27)亚型的胃癌细胞中,FDX1、LIAS、DLAT、DLST、GCSH、PDHB、PDHA1和β-actin的表达水平存在显著差异。在CSRS-High亚型的胃癌细胞中,与铜死亡进程相关的蛋白质表达显著增加,而CSRS-Low亚型则相反(图7A)。在CSRS-Low和CSRS-High亚型中,铜死亡相关蛋白质的表达在药物刺激后的一些分子中显示出显著变化,具体机制需要进一步探索。所有这三种药物都可以有效抑制所测试的两种胃癌细胞系的增殖,并且这三种药物都具有良好的抑制作用。此外,NSC319726、talazoparib和thapsigargin在CSRS-Low亚型的胃癌细胞中具有相对较高的IC50值(图7B-D)。集落形成实验进一步证实了这些药物对胃癌细胞生长的抑制作用(图7E-H)。
省立医院胃癌队列铜死亡特征模式及铜死亡风险评分的验证
申请人随后在自有数据集-山东省立医院胃癌队列(SDPH-STAD)中进行了验证。热图展示了从山东省立医院胃癌队列收集的33例病例的16个铜死亡相关基因在不同铜死亡特征簇和铜死亡特征风险评分亚型的相对表达情况,从中发现铜死亡相关基因LIAS、DLAT、PDHA1、DLD等分子在CSC1亚型和CSRS-Low亚组中显著升高;ATP7A和MTF1在CSC4亚型和CSRS-High中明显增加(图8A)。进一步分析了山东省立医院胃癌队列中四个不同的铜死亡特征簇中的KEGG富集信号通路,发现与前述结果类似(图8B)。我们也同样发现构建的铜死亡特征风险评分在CSC1铜死亡特征簇中的得分最低,CSC4中得分最高(图8C)。生存分析表明,CSC1和CSRS-Low亚组的患者在山东省立医院研究队列中都表现出明显更好的预后(图8D)。多变量分析确实证实,铜死亡特征风险评分可以作为胃癌的独立预后生物标志物(SDPH队列的HR为10.12[95% CI,1.10-92.76],p=0.041)。此外,我们也分析了柠檬酸循环、铁死亡、硫辛酸代谢和丙酮酸代谢得分在山东省立医院胃癌队列的CSC1、CSC2、CSC3和CSC4亚型之间的分布,发现这些铜代谢相关通路富集得分在CSC1的表达明显高于其他亚型(图8E)。
应注意的是,以上实例仅用于说明本实施例的技术方案而非对其进行限制。尽管参照所给出的实例对本实施例进行了详细说明,但是本领域的普通技术人员可根据需要对本实施例的技术方案进行修改或者等同替换,而不脱离本实施例技术方案的精神和范围。
- 死亡相关蛋白激酶1在制备胃癌术后预后评估试剂盒中的应用
- 基于铁死亡-免疫相关基因的肺癌预后检测试剂及评估系统
