一种癫痫动物模型及其构建方法和应用
文献发布时间:2023-06-19 09:26:02
技术领域
本发明涉及医学和生物实验模型的制备技术领域,具体涉及一种癫痫动物模型及其构建方法和应用。
背景技术
癫痫(epilepsy,EP)是由于脑部神经元异常过度放电而引起的中枢神经系统功能失常的一组慢性脑部疾病。国内外流行病学资料显示癫痫的患病率约为0.5%~1.0%,目前全球约有6500万人罹患癫痫,其中我国约有1000万癫痫患者。认知功能是指人们通过认识客观事物而获取和应用知识的能力。认知功能障碍是指记忆力、计算力、语言能力和执行能力等认知域的受损。研究发现癫痫患者常伴有不同程度的认知功能障碍。认知功能障碍早期主要表现为记忆力减退、注意力以及精神运动速度下降,严重者会进展成痴呆,严重影响癫痫患者的生活质量,同时也给家庭和社会带来沉重的负担。然而,癫痫合并认知功能障碍的分子机制至今不清,因此,对癫痫引起认知功能障碍的机制研究对癫痫病的认识,靶向治疗认知损伤药物研发从而改善癫痫患者生活质量有着非常重要的临床意义。
癫痫动物模型在研究癫痫疾病中起着非常重要的作用。目前,应用比较广泛的癫痫模型为腹腔注射或者脑局部注射药物的持续癫痫模型。这种模型最大的缺点是脑内神经元损伤过严重,尤其是海马,同时不可控制的持续全身痉挛性癫痫发作会导致小鼠的死亡。海马是学习记忆的重要脑区,而海马神经元的严重丢失会造成癫痫模型本身的认知障碍。并且研究显示,癫痫患者早期就可出现认知功能的损伤,即在海马未见明显神经元丢失时,就开始出现认知功能下降。
因此,亟待提供一种新的技术方案,以规避以上缺点来研究癫痫认知障碍。
发明内容
本发明的目的是为了克服现有技术存在的问题,提供一种癫痫动物模型及其构建方法和应用,该模型可以长期定量控制癫痫的发作频率及严重程度。
为了实现上述目的,本发明一方面提供一种癫痫动物模型的构建方法,所述方法包括以下步骤:
(1)采用脑立体定位注射的方式对动物进行光遗传病毒注射;
(2)待步骤(1)注射的病毒表达后,对动物进行光纤插芯埋置;
(3)采用光刺激诱导动物癫痫,得到癫痫动物模型。
优选地,在步骤(1)中,所述脑立体定位注射使用脑立体注射系统进行实施,脑立体注射系统包括:脑定位仪、注射针、数显仪、微量注射泵和体视显微镜。
优选地,在步骤(1)中,所述病毒注射的速度为0.05-0.15μl/min,注射的区域为腹侧海马区。
优选地,所述动物为啮齿类动物。
进一步优选地,所述啮齿类动物为小鼠。
优选地,在步骤(2)中,所述光纤插芯埋置的具体步骤包括:待动物麻醉后,剪开头皮,暴露颅骨,坐标定位,将光纤埋入腹侧海马,接着调平、定位,将陶瓷插芯下端埋入距离病毒注射点上方0.4mm处,在陶瓷插芯附近的颅骨上埋置4个25μm直径的螺钉。
优选地,在步骤(3)中,所述光刺激的具体步骤包括:将小鼠麻醉,然后将激光发生器与光纤连接,并通过波形发生器调控激光输出。
优选地,在步骤(3)中,所述光刺激的参数包括:蓝光波长为450-480nm,频率为15-25Hz;波形发生器的波形为脉冲波,光纤的输出功率为2-3mW/mm
本发明第二方面提供上述方法构建得到的癫痫动物模型。
本发明第三方面提供上述癫痫动物模型在研究癫痫认知损伤和/或评估抗癫痫药物中的应用。
本发明所述的构建癫痫动物模型的方法,使用光遗传技术作为操纵神经元活性的方法,从而诱导动物癫痫发作,出现癫痫相关的行为学及病理学改变,可以作为一种研究癫痫认知损伤的理想模型,同时也是一种评估抗癫痫药物新的动物模型。
附图说明
图1是测试例1中癫痫小鼠模型示意图;
图2是测试例1中光纤位置与光遗传病毒表达区域示意图;
图3是测试例1中在体记录光遗传诱导癫痫发作前、中、后过程中M1的场电位变化的检测结果图;
图4是测试例2中实验组处理流程示意图;
图5是测试例2中实验过程中小鼠出现不同级别的癫痫发作的示意图;
图6是测试例2中实验过程中全身性癫痫发作的每天1次的潜伏时间的统计结果;
图7是测试例2中小鼠在模块1和模块2水迷宫实验小鼠学习阶段找到平台潜伏期时间的统计图;
图8是测试例2中模块1和模块2水迷宫实验小鼠检测阶段,撤去平台后癫痫小鼠穿越平台的有效次数统计图;
图9是测试例2中模块2水迷宫检测阶段,两组小鼠在60S运动距离的统计图;
图10是测试例3中模块2的旷场实验中两组小鼠在中心区域停留的时间及运动距离的统计图;
图11是测试例3中模块2的高架十字试验中,两组小鼠在开/闭壁时间比率的统计图;
图12是测试例4中实验组和对照组中皮质和海马中tau蛋白总量和磷酸化水平比较图;
图13是测试例4中免疫蛋白印迹实验灰度值统计图;
图14是测试例4中免疫荧光染色以及免疫组化染色结果图;
图15是测试例4中尼氏染色测试结果图。
具体实施方式
以下结合附图对本发明的具体实施方式进行详细说明。应当理解的是,此处所描述的具体实施方式仅用于说明和解释本发明,并不用于限制本发明。
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
本发明一方面提供一种癫痫动物模型的构建方法,所述方法包括以下步骤:
(1)采用脑立体定位注射的方式对动物进行光遗传病毒注射;
(2)待步骤(1)注射的病毒表达后,对动物进行光纤插芯埋置;
(3)采用光刺激诱导动物癫痫,得到癫痫动物模型。
在本发明所述的方法中,光遗传技术可以通过光激活光敏感蛋白来调控NA+或者CL-通道来兴奋或者抑制神经元活性,从而导致脑兴奋抑制失衡来诱导癫痫发作。因此,可以利用光遗传技术技术可控的诱发癫痫发作,并长期多次诱发模拟慢性癫痫发作。
在本发明所述的方法中,在步骤(1)中,所述脑立体定位注射使用脑立体注射系统进行实施,脑立体注射系统包括:脑定位仪、注射针、数显仪、微量注射泵和体视显微镜。
在本发明所述的方法中,在步骤(1)中,所述病毒注射的速度为0.05-0.15μl/min,注射的区域为腹侧海马区。
在本发明所述的方法中,所述动物为啮齿类动物;优选地,所述啮齿类动物为小鼠。
在本发明所述的方法中,在步骤(2)中,所述光纤插芯埋置的具体步骤包括:待动物麻醉后,剪开头皮,暴露颅骨,坐标定位,将光纤埋入腹侧海马,接着调平、定位,将陶瓷插芯下端埋入距离病毒注射点上方0.4mm处,在陶瓷插芯附近的颅骨上埋置4个25μm直径的螺钉。
在本发明所述的方法中,采用在体电生理技术记录癫痫发生。
在本发明所述的方法中,在步骤(3)中,所述光刺激的具体步骤包括:将小鼠麻醉,然后将激光发生器与光纤连接,并通过波形发生器调控激光输出。
在本发明所述的方法中,在步骤(3)中,所述光刺激的参数包括:蓝光波长为450-480nm,频率为15-25Hz;波形发生器的波形为脉冲波,光纤的输出功率为2-3mW/mm
在本发明所述的方法中,所述动物癫痫模型中,全身性癫痫发作潜伏时间、癫痫发作严重程度以及持续时间均可作为评价指标。
在本发明所述的方法中,小鼠癲痫发作严重程度评判标准依据改良版的拉辛量表进行的,在步骤(3)中,所述评判的标准为:1级,面部抽动,咀嚼明显;2级,咀嚼并点头;3级,单侧前肢阵挛;4级,双侧前肢阵挛和站立;5级,双侧前肢阵挛,站立以及失去平衡跌倒;6级,随意跳跃。其中,1-3级被认为是局灶性发作,4-6级被认为是全身性发作。
本发明第二方面提供上述方法构建得到的癫痫动物模型。
本发明第三方面提供上述癫痫动物模型在研究癫痫认知损伤和/或评估抗癫痫药物中的应用。
本发明所述的构建癫痫动物模型的方法,使用光遗传技术作为操纵神经元活性的方法,从而诱导动物癫痫发作,出现癫痫相关的行为学及病理学改变,可以作为一种研究癫痫认知损伤的理想模型,同时也是一种评估抗癫痫药物新的动物模型。本发明所述的癫痫动物模型,有效控制了癫痫小鼠海马因过度持续兴奋导致的神经元死亡及焦虑样行为表现,同时,癫痫诱发过程中零死亡率以及癫痫诱发的持续可重复性和成功率也是相对于经典的持续癫痫模型的极大优势。
以下将通过实施例对本发明进行详细描述。以下实施例中,实验动物为成年雄性C57BL/6小鼠(6-8周龄),购于北京维通利华。3-5只小鼠被安放在一个笼子里,确保自由饮水和取食。保持饲养房间12小时昼夜循环的正常节律(7:00PM开灯,7:00AM关灯),温度控制在23-25℃。实验过程中一切动物操作均经过华中科技大学动物管理委员会批准,一切动物实验完全严格遵守NIH动物操作指南进行。
光遗传病毒为pAAV-CaMKIIα-ChR2(H134R)-mCherry。
所有的数据表示为mean±SEM。使用Graph-Pad(prism6)软件进行数据统计分析。采用Two-wayANOVA、One-WayANOVA或者Student’s t-test方法被判断每个实验组之间的差异。当p<0.05,我们认为存在显著性统计学差异。
实施例1
(1)脑立体定位注射病毒
将手术器械(进样针、缝合针、眼科剪、刀片和缝合线)用75%酒精浸泡30分钟以上;将分装好的光遗传病毒-80℃长期保存,需要时取至冰盒里缓慢融化,实验期间放置4℃保存;将已经拉好的玻璃电极套在进样针上,用石蜡油赶出空气,接口处用AB胶封上,冷却;腹腔注射6%的水合氯醛麻醉(0.15ml/25g),待动物麻醉后拨开门齿并将舌头拉出防止因肌肉松弛导致的舌下坠阻塞呼吸,头顶局部备皮;将门齿套在固定孔中旋紧螺丝固定,调节门齿夹高度和深度使动物耳间线与定位仪耳杆连线保持一致,红霉素眼膏涂抹双眼(防止眼睑无法闭合所致的角膜干燥引发视力损伤);通过左右耳杆将小鼠头部固定,剪开头皮,用棉球去骨膜暴露前囟和后囟(若前囟不清楚可涂抹少量3%双氧水),将进样针并安装至脑定位仪上,用记号笔点出前囟和后囟;调节旋钮使前后囟和左右(前后,左右差距保持在0.03mm以内)位于同一水平线;调平后将玻璃电极调到设定的注射点,做好记号,用电钻钻穿颅骨(切勿伤及皮层脑白质);再用自动注射泵快速抽取500nl pAAV-CaMKIIα-ChR2(H134R)-mCherry病毒,用棉签擦净玻璃电极尖端,然后以0.1μl/min的速度注射入腹侧海马区域,其坐标为(-3.2mmAP,+3.2mm ML,-4.5mm DV)。注射完毕后留针10min,以先慢后快的退针速度退出玻璃电极,耗时1分钟;注射完后用棉签涂抹林可霉素于头皮,缝合,将动物放置在保暖垫等待小鼠苏醒。
(2)光纤插芯埋置
待病毒表达后3周后进行埋置光纤,具体过程包括:首先用6%水合氯醛麻醉小鼠,备皮,同时双眼涂上眼膏保护双眼。然后剪开头皮,暴露颅骨,将光纤埋入腹侧海马CA1(vCA1)(-3.2mmAP,+3.2mm ML,-4.1mm DV)。接着,调平,定位,将陶瓷插芯下端(Fibers,Shanghai,PRC)埋入距离病毒注射点上方0.4mm处,即右腹侧海马CA1(vCA1)(-3.2mmAP,+3.2mm ML,-4.1mm DV),在陶瓷插芯附近的颅骨上埋置4个25μm直径的螺钉。牙科水泥包埋陶瓷插芯和螺钉,待牙科水泥干燥后,将小鼠放回笼中苏醒。
(3)光刺激参数及诱发癫痫发作过程
用异氟烷麻醉小鼠,使小鼠颅骨表面的陶瓷插芯-光纤被两端均带有FC/PC接头的接插线连接,小鼠10秒后苏醒自由活动。手持接插线,防止接插线缠绕或被小鼠咬断,激光发生器与光纤连接,通过波形发生器调控激光输出。光刺激参数设置为:蓝光(472nm),频率20HZ,占空比10%,脉冲波,实际光纤出口输出功率2.8mW/mm
癫痫诱导成功后关闭激光,小鼠癫痫发作程度会逐渐减轻,直至恢复正常活动。这时再用异氟烷麻醉,取下小鼠头上的光纤。将小鼠放回笼中,10秒左右恢复自由活动。
表1
测试例
1、在建立动物模型的过程中,在光纤插芯埋置时,在部分小鼠进右侧运动皮层M1埋上多通道电极,在体记录皮层场电位,具体步骤如下:
(1)使用水合氯醛(3.6mg/10g体重,腹腔注射)麻醉小鼠,将之固定在脑立体定位仪上。分别找到右侧vCA1(-3.2mmAP,3.2mm ML,-4.1mm DV)和右侧运动皮层M1((+1.5mmAP,1.5mm ML,-1.5mm)的颅骨标记点,用黑色圆珠笔做上记号,用颅钻钻穿颅骨。在距离两个标记点附近安装4颗颅钉。按照同上所述装上光纤插芯,用牙托水泥包埋其中的两颗颅钉。在M1((+1.5mm AP,1.5mm ML,-1.5mm)植入16通道的电极(single stereotrode)。电极材料为绝缘镍铬合金(OD=17μm;CFW,California,USA),电极的地线接在另外两颗颅钉上,用牙托水泥包埋固定。
(2)打开神经信号采集系统及视频录制系统,激光打开前记录一段基线电信号,之后打开激光发生器给予蓝光刺激,打开波形发生器,记录整个过程中小鼠M1的场电位及癫痫发作行为;
(3)在体电生理记录结束后,注射致死剂量的水合氯醛,并在电极末端给予1mA持续20秒的电流烧焦局部脑组织,记录电极位置。
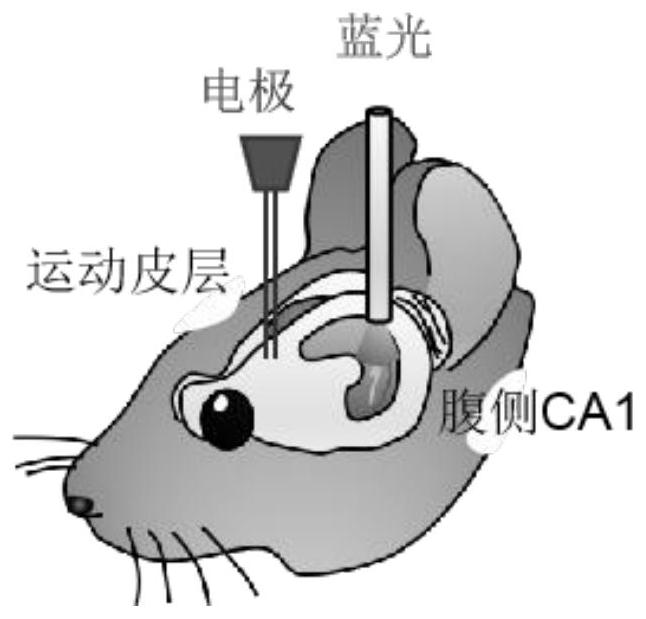
图1是癫痫小鼠模型示意图,表示小鼠腹侧海马注射光遗传病毒,3周后在病毒注射点上0.4cm埋置光纤,同侧M1埋置电极的过程;图2是光纤位置与光遗传病毒表达区域示意图,该示意图是使用免疫荧光染色进行表征。
图3在体记录光遗传诱导癫痫发作前、中、后过程中M1的场电位变化的检测结果图,其中,图3A是光遗传诱导癫痫小鼠发作前、中、后过程中M1的场电位图,图3B是的光遗传诱导癫痫小鼠发作前、中、后过程中M1的场电位对应的脑电能谱图,图3C是蓝光打开前和打开时,针对小鼠M1场电位的基线期,诱导期,癫痫发作期及癫痫发作后场电位进行统计分析。
由图3可以看出,小鼠皮层场电位振幅在诱导期及癫痫发作期较基线状态显著增加,而癫痫发作期出现典型的癫痫样电发放,能谱图分析也可看到诱导期及癫痫发作期较基线状态能量增高。并且可以同时,可以观测到小鼠从低到高不同级别的癫痫发作。关闭激光,小鼠癫痫发作程度逐渐降低,直至恢复正常运动。以上结果证实,利用光遗传技术,刺激腹侧海马,造成脑兴奋性增高,可以成功诱导小鼠癫痫发作,并能人为控制癫痫的发作时长,严重程度。
2、为了模拟癫痫病的慢性癫痫发作,同时验证长期癫痫发作对小鼠认知功能的影响,我们将进行脑立体定位注射病毒和光纤插芯埋置后的小鼠分成两组,实验组采用每天一次,连续14天诱导癫痫发作,每只小鼠诱发到4级癫痫发作(站立,双前肢抬起)记录为全身性癫痫发作的潜伏时间,且每只小鼠都诱发出5,6级癫痫发作(倒地,跳跃行为)后终止光刺激。对照组在相同环境下处理相同时间,通过阻隔激光进入小鼠插芯达到不诱导癫痫发作的目的。之后用Morris水迷宫实验检测小鼠的空间学习记忆能力。
水迷宫实验分为学习阶段与检测阶段。学习阶段每天下午2点-6点开始,每只小鼠三次训练,训练间隔为30分钟,持续训练5天。每次训练分别将动物从不同的象限放入水中,平台象限除外。每一次训练中,小鼠以背向平台的姿势放入水中,其后自由探索60秒,当它找到平台并让其再平台上停留30秒后移走小鼠。如果60秒内没有找到平台,小鼠被人工指引到平台的位置并停留30秒。小鼠找到平台并站立于上大于3秒即为逃离潜伏时间,反映小鼠的空间学习能力。在训练结束后24小时撤去平台,检测时将动物从平台相对的象限背向平台放入水中,任其自由探索60秒,记录动物首次到达平台位置的潜伏期,目标象限停留时间,平台区域穿越次数,游泳路径和游泳距离等指标,以反映空间记忆能力和运动能力。
图4上述实验组处理流程示意图。实验组小鼠右腹侧海马注射光遗传病毒3周后,埋置光纤插芯,1周后每日诱发一次癫痫发作,连续续2周,之后进行行为学检测,2周后又诱导癫痫发作,连续1周,再进行行为学检测,之后取小鼠脑组织。对照组不诱导癫痫发作,其余处理一样。
图5为实验过程中小鼠出现不同级别的癫痫发作的示意图。
图6为实验过程中全身性癫痫发作的每天1次的潜伏时间的统计结果。
从图6可以看出,全身性癫痫发作的潜伏时间,随着诱导的天数(每天一次,连续14天)增加,诱导时间逐渐缩短,后期基本稳定。表明长期光遗传所致癫痫发作的阈值逐日下降,后趋于稳定。
图7为小鼠在模块1和模块2水迷宫实验小鼠学习阶段找到平台潜伏期时间的统计图;图8为模块1和模块2水迷宫实验小鼠检测阶段,撤去平台后癫痫小鼠穿越平台的有效次数统计图;图9为模块2水迷宫检测阶段,两组小鼠在60S运动距离的统计图。
在模块1水迷宫的学习阶段,两组动物找到平台的潜伏期逐日减少,表现两组小鼠对平台的位置产生了学习的效果。但在学习的过程中,实验组小鼠找到目标平台的潜伏期较对照组延长,第三,四天出现显著差异,说明实验组小鼠空间学习能力下降。在水迷宫训练结束后24小时,我们移去目标平台对小鼠进行空间记忆能力检测,结果显示:与对照组相比,实验组小鼠穿越平台的有效次数明显减少。
接着,将实验组小鼠进行每天一次,连续7天的以上相同的癫痫发作后,进行以上相同的行为学检测。在此模型中模拟癫痫病程对认知的影响,是否更长时期的光遗传诱导的癫痫发作加剧认知损伤,同时影响已储存的空间记忆。
在模块2水迷宫实验中,Morris水迷宫逃离平台位置与模块1保持一致。在学习阶段的第一天就出现显著差异,实验组持续5天较对照组找到平台的潜伏期延长,并且检测阶段穿越平台的有效区域次数显著减少。为了排除运动能力对实验的干扰,我们检测了两组小鼠运动能力,结果如图9所示,两组小鼠在60S运动距离没有统计学差异,说明实验组小鼠没有运动功能障碍。
以上结果表明,光遗传长期多次诱导癫痫发作会引起小鼠的空间学习记忆障碍,并且随着“病程”的延长,这种损伤愈发明显。我们比较两组小鼠在两次相同水迷宫实验中前后的表现,对照组在模块1学习阶段相对模块2学习阶段逃离平台潜伏期明显缩短,说明对照组对平台方位的远期记忆使其在模块2逃离平台的潜伏时间缩短,而实验组却没有这种现象,说明实验组小鼠的远期记忆亦受损。
3、焦虑抑郁症也是癫痫病的一种常见共病,在癫痫病人和癫痫动物模型中均有出现,它与癫痫的严重程度,不良后果相关。同时,焦虑抑郁情绪对癫痫病人的认知功能有消极影响,而在动物模型中,这种因素还会干扰动物的真实认知水平的检测。因此实验中在检测认知功能的之前,也检测了实验组小鼠的焦虑样行为。
旷场实验利用小鼠喜欢沿着壁跑动以及对环境喜好探索的特性,检测动物在陌生环境中的探究行为与自主行为,进而评价动物自发活动以及焦虑程度。将小鼠放进25cm×25cm×50cm的方形盒子中,盒子底面为小鼠运动的区域,划分成九宫格,中间区间作为中心区域,中心区域的面积约为40%。
一般认为,当小鼠在中心区域停留较少时,认为小鼠出现焦虑样行为。每次实验前,抚摸小鼠1-2分钟,尽可能消除动物的情绪应激,将动物轻柔放入旷场中心;每次实验结束,用75%酒精擦拭小鼠运动区域,排除小鼠气味对下一只小鼠的影响。摄像头追踪小鼠运动轨迹,记录5分钟内动物在不同区域停留时间,运动距离。
高架十字迷宫是典型的焦虑模型评估实验,利用动物对新异环境的探究特性和对高悬敞开臂的恐惧形成矛盾冲突行为来考察动物的焦虑状态。高架十字迷宫具有一对开放臂和一对闭合臂,啮齿类动物会倾向于在闭合臂中活动,但出于好奇心和探究性又会在开放臂中活动,在面对新奇刺激时,动物同时产生探究的冲动与恐惧,这就造成了探究与回避的冲突行为,从而产生焦虑心理。将小鼠从中央格面向开臂放入迷宫,实验前后同上所述,摄像头自动追踪记录5分钟内的活动情况。检测指标包括闭合臂进入次数,开放臂进入次数,闭合臂停留时间,开放臂停留时间。
图10为模块2的旷场实验中两组小鼠在中心区域停留的时间及运动距离的统计图,图11为模块2的高架十字试验中,两组小鼠在开/闭壁时间比率的统计图。
在模块2旷场实验中,两组小鼠在中心区域探索的时间及运动距离无差异。高架十字实验中,两组小鼠在开/闭壁时间比率没有统计学差异。以上结果说明,光遗传诱导癫痫小鼠,在控制癫痫严重程度的前提下,没有表现出焦虑样行为。以往的癫痫模型中,癫痫小鼠在水迷宫实验中,会出现癫痫小鼠绕壁游动,反应长期癫痫导致的焦虑行为,干扰了对小鼠真实认知能力的检测。而此模型中癫痫小鼠在水迷宫检测时也无明显绕壁游行的行为,排除了焦虑样情绪对认知功能本身及检测的影响,这也更加充分的说明了光遗传诱导癫痫模型中实验组小鼠认知功能损伤。
4、为了探讨此模型中癫痫小鼠空间学习记忆障碍与Tau蛋白的病理性改变的关系,我们假设实验组小鼠脑中出现Tau病理性改变。将以上部分小鼠取脑组织,利用蛋白免疫印迹技术分别检测两组小鼠海马及皮层总Tau蛋白(tau5)及磷酸化Tau蛋白(AT8)水平。
免疫印迹实验的过程包括如下步骤:(1)样品的制备(动物样品);(2)样品蛋白质含量的测定(BCA法);(3)免疫印迹法,具体过程包括:装置搭建→制胶→处理样品→转膜→免疫印迹显色。并在Image J中,测量条带的灰度值,进行统计分析。
图12为实验组和对照组中皮质和海马中tau蛋白总量和磷酸化水平比较图。图13为免疫蛋白印迹实验灰度值统计图。图14为免疫荧光染色(14A)以及免疫组化染色(14B)结果图。
如图我们发现,实验组与对照组相比,实验组海马AT8/D1,tau5/D1,AT8/Tau5,皮层AT8/D1,AT8/Tau5较对照组显著增高。同时,利用免疫荧光染色,实验组小鼠海马及皮层可见明显的AT8绿色荧光阳性细胞增多。免疫组化染色也可见实验组小鼠Tau5着色密度加深。
进一步的,利用尼氏染色对实验组和对照组的同侧海马进行检测,结果如图15所示。其中,15A为腹侧海马示意图,15B为背侧海马示意图,15C为腹侧海马DG区颗粒细胞层厚度统计图。根据图15的结果可知,用光遗传技术在人为控制癫痫发作的严重程度的前提下,模型中实验组尚未没有出现显著的神经元丢失。
以上结果说明,光遗传诱导的长期癫痫发作可以导致小鼠脑内的Tau病理性改变—总Tau蛋白及磷酸化Tau蛋白水平增高,并且没有出现显著的神经元丢失现象。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
- 一种癫痫动物模型的构建方法及应用
- 一种癫痫动物模型的构建方法及应用
