MiR-29海绵在制备用于治疗2型糖尿病的药物中的应用
文献发布时间:2023-06-19 09:30:39
技术领域
本发明属于生物医药技术领域,具体的是涉及一种miR-29海绵在制备用于治疗2型糖尿病的药物中的应用。
背景技术
糖尿病(Diabetes mellitus,DM)是一种由于胰岛素的相对或者绝对不足所引起的以慢性高血糖为主要特征的全身性代谢紊乱综合征。根据最新报告,2019年全球约4.63亿20-79岁成人患糖尿病;预计到2030年,糖尿病患者会达到5.784亿;到2045年,糖尿病患者会达到7.002亿。糖尿病可以分为1型糖尿病,2型糖尿病,妊娠糖尿病和其他类型糖尿病,其中2型糖尿病占95%以上。2型糖尿病的主要特点是由于内源性胰岛素产生量低于胰岛素需求量引起的胰岛素相对不足,原因是由于β细胞功能障碍或者靶器官出现胰岛素抵抗。2型糖尿病(T2DM)的发病率在全球范围内迅速上升,现已成为一种全球流行疾病。所以围绕糖尿病展开的相关的预防、诊断、治疗是世界各国医药领域研发攻关的重大方向。
2型糖尿病的病因多样,最重要的因素包括年龄、性别、肥胖、低运动量和糖尿病家族史等。并且随着我国老龄化加重,饮食结构发生变化,2型糖尿病在我国发病率居高不下。血脂异常、糖代谢紊乱、胰岛功能未完全消失及肥胖是2型糖尿病的典型特点。目前针对2型糖尿病治疗暂无特效药物,传统治疗2型糖尿病药物虽可暂时缓解患者病情,降低患者血压,但长期服用易出现低血糖现象,严重危害患者的生命安全。
目前治疗T2DM的方式包括:降糖药物治疗和代谢手术治疗。其中,降糖药物包括二甲双胍、GLP-1受体激动剂、噻唑烷二酮类和DPP-4抑制剂等,这类药物需长期坚持使用,影响患者的生活质量,也会出现较大药物不良反应。胰岛素注射也可以有效的降低血糖水平,但是长期的使用并不能满足代谢的需求,反而加重胰岛素抵抗,并且会导致多种并发症,例如低血糖、视网膜病、心血管疾病等。减重手术虽然效果显著,但是由于创伤较大而仅在极度肥胖的2型糖尿病患者开展。因此,寻找一种治疗T2DM的新方法至关重要。
目前已经发现2500多种人类miRNAs,并且每一种的miRNA又能调控成百上千基因的表达。它是一类进化上高度保守的单链非编码小RNA,可通过靶基因mRNA特异性结合,导致靶基因的mRNA降解或翻译受到抑制,是转录后水平负性调控基因表达的主要执行分子。许多miRNA可与多个靶基因共同形成复杂的调控网络,进而影响细胞的分化、增殖、调亡、代谢等多种生物学过程。
其中miR-29家族是小鼠和人类代谢组织中表达最丰富的miRNA之一,该家族由4个具有相同种子序列(AGCACC)的物种组成,位于两个基因组簇中,miR-29a/b-1位于miR-29a簇中,miR-29b-2/c位于miR-29c簇中。miR-29家族在糖尿病患者肝脏、骨骼肌和脂肪组织中的表达水平增强,与纤维化、糖尿病、恶性肿瘤等多种疾病的发生、发展相关。文献报道,miR-29敲除小鼠模型提示,miR-29家族参与糖代谢调控,它可能通过影响胰岛素信号转导导致肥胖和胰岛素抵抗。
miRNA海绵(miRNAsponge)是麻省理工大学的Phillip Sharp及他的同事开发出一种长期抑制miRNA基因的高效方法。miRNA海绵是一条mRNA,其3’非翻译区(UTR)包含若干个miRNA靶定位点。更重要的是,这些靶定位点在RISC切割位点有一些错配。这样抑制剂mRNA就不会被降解,而与RISC稳定结合,让它远离天然的mRNA靶点。
发明内容
本发明提供一种miR-29sponge,其为miR-29的抑制剂,靶向结合内源性miR-29从而抑制其功能。该miR-29sponge封闭巨噬细胞或者β细胞中miR-29的表达,进一步将其应用于制备用于治疗2型糖尿病的药物中的应用,以解决2型糖尿病当前治疗方法匮乏以及治疗成本的问题。
具体地,所述miR-29海绵的核苷酸序列如SEQ No.1所示,具体为:
TAACCGATTTCAGATGGTGCTATATACTAACCGATTTCAGATGGTGCTAACATCAACACTGATTTCAAATGGTGCTATCTTCAAACACTGATTTCAAATGGTGCTATTTTTT。
进一步地,本发明揭示胰岛β细胞分泌的外泌体miR-29是巨噬细胞炎症因子分泌的始动因素,发现所述miR-29sponge可以抑制高脂饮食诱导的2型糖尿病发生。
具体在应用时,所述miR-29海绵与表达载体有效连接。所述“有效连接”是指本发明的miR-29海绵与表达载体的连接使所产生的核酸构建体能在细胞或动物体内转录本发明的miR-29海绵。
优选地,所述表达载体为慢病毒表达质粒,优选地,选用慢病毒表达质粒pHBLV-U6-MCS-CMV-ZsGreen。
miR-29核酸构建体可以通过在miR-29海绵序列的两端加上与表达载体相配的酶切位点,合成正向序列和反向序列,以与该表达载体有效连接。
在一种实施方式中,可以通过如下方法制备miR-29核酸构建体(亦称为miR-29海绵慢病毒):
1)选用慢病毒载体pHBLV-U6-MCS-CMV-ZsGreen;感受态细胞选用大肠杆菌菌株DH5α;抗性:Amp;
2)针对目的基因合成miR-29海绵,然后构建慢病毒表达载体,大量扩增慢病毒载体;在293T细胞内进行慢病毒载体的大量包装,进行慢病毒的浓缩及纯化,最后对慢病毒滴度测定(10^9TU/ml)。
上述构建方法也可以直接委托商业性合成公司完成。
本发明先对小鼠进行辐照清除骨髓,然后通过尾静脉注射HBLV-mmu-miR-29sponge或HBLV-mmu-NC-GFP感染的骨髓后,观察miR-29βTG小鼠代谢表型的改变,提供治疗2型糖尿病的新方法。
有益效果:本发明通过运用miR-29βTG小鼠模型,辐照后进行骨髓移植。通过对其代谢表型的监测,发现miR-29可以抑制β细胞的葡萄糖刺激的胰岛素分泌(glucose-stimulated insulin secretion,GSIS)功能,通过巨噬细胞诱导的局部炎症促进外泌体miR-29释放加重系统炎症,从而诱导外周组织胰岛素抵抗;而抑制单核细胞/巨噬细胞miR-29的作用可以逆转βTG小鼠的炎症和糖尿病症状。同时,本发明利用C57BL/6J小鼠,通过胰腺原位注射技术,导管内注射HBLV-mmu-miR-29sponge或HBLV-mmu-NC-GFP并联合高脂喂养,通过对其代谢表型的连续监测,发现miR-29sponge可以有效缓解高脂饮食诱导的糖耐量受损和GSIS功能缺陷。
附图说明
图1显示的是在糖尿病前期的胰岛来源外泌体miRNAs的表达,图1A是糖尿病前期胰岛中外泌体RNA测序中miR-29家族的TPM值,图1B,C,D分别显示的是qPCR分析显示正常饮食(normal chow diet,NCD)和高脂饮食(high-fat diet,HFD)喂养1个月的小鼠,1月龄db/db小鼠和T2DM病人胰岛中miR-29a的mRNA水平;
图2显示的是对7周的miR-29βTG小鼠进行正常饮食或者高脂喂养,小鼠血糖和体重随时间的变化示意图;
图3显示的在14周龄时,两组小鼠的IPGTT(腹腔注射葡萄糖耐量试验)结果示意图;在15周龄时,两组小鼠的IPITT(腹腔注射胰岛素耐量试验)结果示意图;
图4显示的对高脂喂养6周的小鼠进行高葡萄糖钳夹试验,胰岛素分泌的结果;
图5显示的免疫印迹分析正常喂养小鼠肝脏中P-IR、IR、P-AKT、AKT的表达量,GAPDH作内参;
图6显示的是腹腔注射氯膦酸清除巨噬细胞以后,高脂喂养3个月小鼠的IPGTT以及IPITT实验结果;
图7显示的是用HBLV-mmu-miR-29sponge或HBLV-mmu-NC-GFP感染的骨髓(bone-marrow,BM)移植给辐照的Ctrl和βTG小鼠,然后高脂喂养3个月;
图8显示的高脂喂养3个月骨髓移植的辐照小鼠体重变化,以及在高脂喂养3个月时骨髓移植的辐照小鼠随机血糖和空腹血糖的结果;
图9显示的骨髓移植的辐照小鼠经高脂喂养1个月后糖刺激后的胰岛素分泌量以及高脂喂养3个月空腹血清c肽的含量;
图10显示的是骨髓移植的辐照小鼠经高脂喂养2个月时IPITT的结果,并计算IPITT曲线下的面积的结果;
图11显示的是骨髓移植的辐照小鼠经用CBA试剂盒测定其胰腺淋巴结(pancreatic lymph node,PLN)分泌IL-1β的水平;
图12显示用Western blotting检测骨髓移植的辐照小鼠注射或不注射胰岛素的肝脏,脂肪组织和肌肉中P-AKT和AKT蛋白的表达情况,GAPDH作内参;
图13显示的是流式细胞术对骨髓移植的辐照小鼠白细胞(white blood cells,WBCs)中F4/80
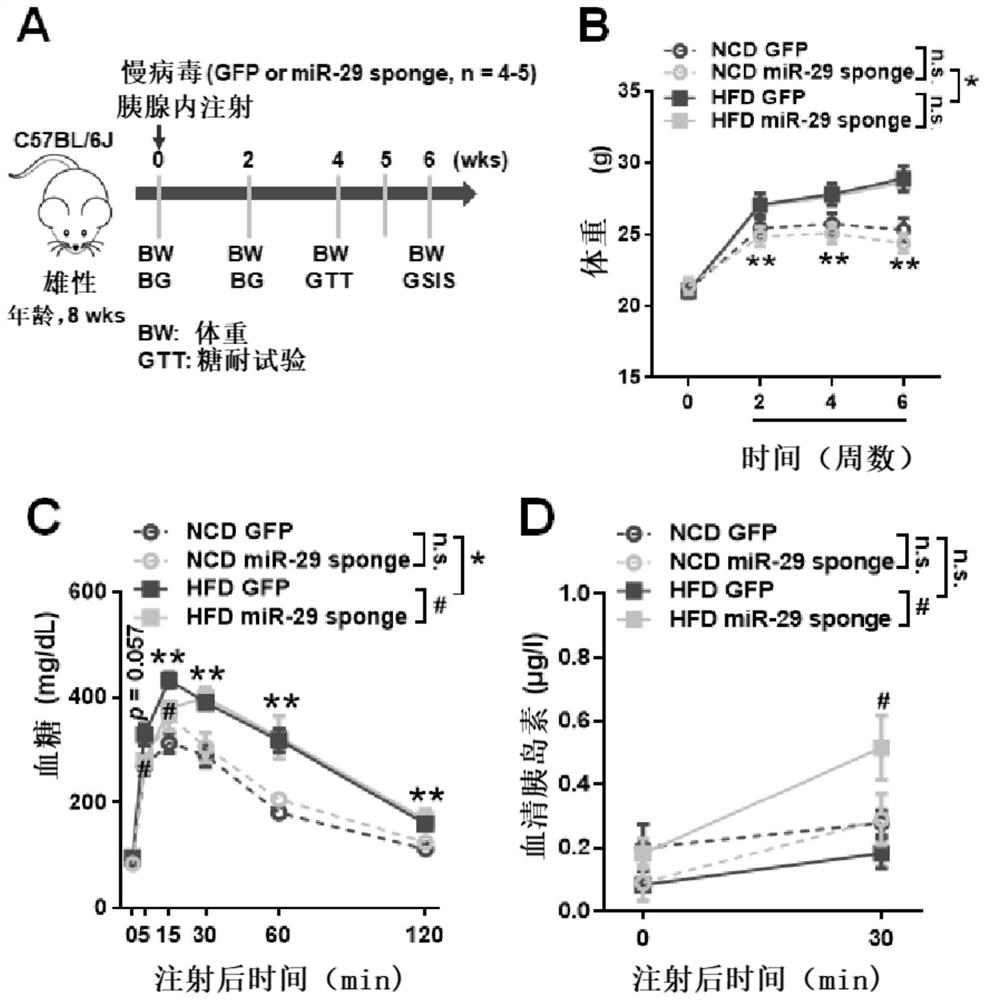
图14显示是8周龄的雄性C57BL/6J小鼠通过胰腺原位注射HBLV-mmu-miR-29sponge或HBLV-mmu-NC-GFP后,进行高脂喂养,并对其代谢表型的监测;其中图14A是实验各项指标收集的时间顺序;图14B是小鼠体重随时间的变化示意图;图14C是高脂喂养4周时小鼠的IPGTT的结果示意图;图14D是高脂喂养6周时,腹腔注射葡萄糖0、30min时的胰岛素分泌量。
具体实施方式
实施例1miR-29在2型糖尿发生发展中的作用。
实验动物:雄性C57BL/6J小鼠和lepr
如图1所示首先为了研究胰岛β细胞分泌的外泌体所包裹的miRNAs是否是疾病发展的源头。我们制备的糖尿病前期胰岛中miRNA的表达谱,具体条件为分离HFD喂养1个月的C57BL/6J小鼠和NCD喂养的对照小鼠的胰岛,收集其分泌的外泌体并提取外泌体核酸进行外泌体miRNA测序。通过测序共鉴定出2083个miRNAs,为了缩小数据集我们将TPM(每百万转录本)值超过50的表达水平的差异miRNA组合起来,将排名前20位的数据进一步进行了聚类。结果,如图1A所示,在HFD喂养的小鼠胰岛分泌的外泌体中,发现miR-29a-3p显著增加,而其他miR-29家族成员几乎未被检测到。经qRT-PCR证实,HFD小鼠胰岛来源的外泌体中miR-29a-3p的表达水平明显高于NCD组(图1B)。4周龄的db/db小鼠胰岛的外泌体以及T2DM的糖尿病人中也发现miR-29a-3p水平显著升高(图1C,D)。因此,我们确定了一组胰岛来源的外泌体miRNA可能参与了T2DM的发生发展过程。
实施例2 2型糖尿病发生过程中miR-29在体内作用。
实验方法:为了研究miR-29在糖尿病发生过程中的作用,我们使用了胰岛β细胞特异性表达miR-29a/b/c(miR-29βTG)的转基因小鼠。
1)小鼠随机分4组,每组7只。从7周龄开始正常饲料(NCD)喂养或高脂(HFD)喂养;
2)每周测定血糖体重,持续至18周。测量方法为:取尾静脉血1滴,用血糖试纸及快速血糖仪测定血糖;
3)在12周时,对HFD喂养小鼠进行高葡萄糖钳夹试验,评估葡萄糖刺激的胰岛素分泌能力;
4)在14周时,对小鼠进行葡萄糖耐量试验(GTT)实验。小鼠饥饿12-16小时后,腹腔注射1g/kg体重葡萄糖后,在第0、5、15、30、60、120分钟分别测血糖值;
5)在15周时,对小鼠进行胰岛素耐量试验(ITT)实验。小鼠饥饿4-6小时后,腹腔注射0.9U/kg体重胰岛素后,在第0、15、30、60、120分钟分别测血糖值;
6)在18周时,提取小鼠的肝脏,通过western blotting分析肝脏中P-IR,IR,P-AKT,AKT的表达量,GAPDH作内参。
统计学分析:本实验所有数据均采用均值±标准差(±s)表示,组间差异性分析采用t检验,以P<0.05作为统计学差异参考标准。
实验结果:
如图2所示,在7-18周期间,监测对照(control,Ctrl)和βTG组小鼠在NCD和HFD喂养后的随机血糖和体重。结果如图所示,在两种喂养方式下,Ctrl和βTG组的小鼠随机血糖和体重均没有明显差异。(P*<0.05)
如图3所示,HFD喂养7周后,小鼠进行GTT和ITT实验。在正常饲料喂养下,两组小鼠的GTT和ITT均没有明显差异。但是HFD喂养的下,腹腔注射葡萄糖60分钟和120分钟后,与Ctrl组的小鼠相比,βTG小鼠的葡萄糖清除率下降,糖耐量明显受损。ITT结果显示,βTG小鼠的胰岛素敏感性也出现降低。(P*<0.05)
如图4所示,为了进一步了解miR-29在体内的作用,对HFD喂养6周后的小鼠进行高葡萄糖钳夹试验。在40分钟葡萄糖输注后,血糖维持在相当高水平,在120分钟时血糖维持在400mg/dL左右。注射葡萄糖可以继续刺激Ctrl小鼠的胰岛素分泌,但不能增加βTG的胰岛素分泌(图4C)。βTG小鼠的1相和2相胰岛素分泌都明显受损(图4D)。为了进一步探究miR-29对于胰岛β细胞功能的影响,在人的原代胰岛上过表达miR-29后,进行胰岛灌注实验。结果显示,过表达miR-29后,胰岛β细胞的功能也是明显受损(图4A,B)。
如图5所示,在NCD的条件下,受到胰岛素刺激的βTG小鼠肝脏中p-IR
从以上实验结果可以看出,通过使用β细胞特异性miR-29转基因小鼠模型,我们发现过表达miR-29可以促进HFD诱导的2型糖尿病发生,表现为糖耐量受损、外周组织胰岛素抵抗和胰岛β细胞功能受损。
实施例3探究miR-29的作用机制
实验方法:
1)选择10周龄的小鼠,提取原代胰岛后,通过RNA测序比较Ctrl和βTG小鼠的基因表达。鉴定出两组间有显著差异(p值<0.05,>2倍变化)的基因346个。通过利用GO算法,对这些不同的基因进行了分析。结果发现,富集的通路与炎症反应、分泌囊泡和离子通道活性等相关。通过上调和下调基因联合评估,βTG小鼠的胰岛炎症反应增强,可能与吞噬作用(Ahsg)的正向调控和单核细胞趋化(Cxcl10/Cxcl17)有关,所有这些变化都暗示巨噬细胞介导的系统性炎症。因此,我们引入氯膦酸脂质体清除巨噬细胞,探究巨噬细胞对糖尿病发病影响。
2)高脂喂养后的Ctrl和βTG小鼠,腹腔注射0.01ml/g氯膦酸脂质体或对照脂质体,然后分别对其进行GTT和ITT实验。
从以上实验结果可以看出,氯膦酸脂质体治疗后,高脂喂养的βTG小鼠葡萄糖耐受不良和胰岛素抵抗得到了恢复(如图6)。
实施例4封闭单核细胞/巨噬细胞来源的miR-29的作用可以逆转βTG小鼠的炎症和糖尿病症状。
实验药品:HBLV-mmu-miR-29sponge,阴性对照为HBLV-mmu-NC-GFP对照,均委托汉恒科技(上海)公司制备,其中,HBLV-mmu-miR-29sponge采用的慢病毒表达载体为pHBLV-U6-MCS-CMV-ZsGreen;感受态细胞选用大肠杆菌菌株DH5α;抗性:Amp。
实验方法:
1)收集8-10周龄的C57BL6/J小鼠供体骨髓细胞,感染HBLV-mmu-miR-29sponge或HBLV-mmu-NC-GFP,12小时;
2)8-10周龄的Ctrl和βTG小鼠,在1000rads辐照剂量下,4个小时。然后每只小鼠尾静脉注射5*10
3)骨髓移植后的小鼠进入南京医科大学实验动物中心,在清洁环境中饲养,温度(21±2)℃,湿度(35±2)%,12h:12h昼夜间断照明,自由进食饮水,饮用水为实验动物中心制备的蒸馏水;
4)移植后的小鼠进行高脂3个月的造模,每周测定血糖和体重。测量方法为:取尾静脉血1滴,用血糖试纸及快速血糖仪测定随机血糖。以血糖浓度≥11.1mmol/L且持续一周以上诊断为糖尿病;
5)高脂喂养1个月后检测血清胰岛素分泌;
6)高脂喂养2个月时尾静脉取血进行ITT实验;
7)待小鼠高脂喂养3个月后,小鼠摘眼球法取血,一部分取全血,4℃,3000×g离心15min,血清置-30℃保存备做指标测定;一部分取外周血,EP管加入肝素钠抗凝剂;
8)小鼠死后立即取出胰腺淋巴结(PLN),肠系膜淋巴结(mesenteric lymphnodes,MLN),PBS清洗,待后续提取淋巴细胞;
9)取步骤7)的血清10ul,用ELISA试剂盒依说明书步骤分别检测血清中胰岛素和C肽的含量;
10)收集的血清样本,取50ul加入流式管中,加入CBA试剂盒中(美国BD公司)炎症因子磁珠混合物50ul,室温孵1小时,再加入50ul PE检测试剂混合物,室温孵育1小时,孵育结束后,加入1ml清洗液室温200g离心5min,弃上清后用300ul清洗液重悬,流式细胞仪上机检测;
11)提取小鼠的胰腺淋巴结制成单个核细胞悬液,加入荧光标记的抗小鼠F4/80抗体,取1×10
结果如图所示:因为照射会损害小鼠的食欲和活力,所以小鼠在移植后出现短暂的体重下降,高脂喂养3周后,小鼠体重呈逐渐上升趋势(如图8A)。HFD 3个月后,感染miR-29sponge慢病毒经过骨髓移植的βTG小鼠的随机血糖和空腹血糖明显低于对照组的小鼠(如图8B,C)。与GFP组相比,miR-29sponge组小鼠的基础胰岛素(0min)分泌降低,葡萄糖刺激后胰岛素分泌明显升高(如图9A)。两组间血清C肽水平没有明显差异(如图9B)。对高脂喂养2个月后的小鼠进行ITT实验,发现miR-29sponge组的βTG小鼠在注射胰岛素30分钟后的胰岛素反应较GFP的βTG组更好,ITT的AUC也证实了这一结论(如图10)。为进一步探讨其改善细胞功能和胰岛素敏感性的机制,我们将小鼠处死,收集其胰岛、胰腺淋巴结、血清,肝脏、肌肉和脂肪组织进一步检测。miR-29sponge组中胰腺淋巴结分泌的IL-1β也降低,提示胰腺局部炎症减弱(如图11)。为了验证胰岛β细胞能够通过miR-29-Exos重塑的M1巨噬细胞来抑制外周胰岛素的敏感性,结果证实经过miR-29sponge感染骨髓然后移植的小鼠,其肝脏和脂肪组织中对胰岛素表现出高反应性,但在肌肉中没有(图12)。因为巨噬细胞的寿命可以维持几个月或几年,所以GFP
实施例5探究miR-29sponge在治疗2型糖尿病中的作用。
实验动物:雄性C57BL/6J小鼠,8周龄,购自南京医科大学实验动物中心,所有实验动物均饲养于南京医科大学实验动物中心屏障设施内。
实验药品:详见实施例4。
实验方法:
1)雄性C57BL/6J小鼠,随机分为两组。通过胰腺原位注射的方式,将HBLV-mmu-miR-29sponge或HBLV-mmu-NC-GFP注射入小鼠体内,100ul/只,剂量2*10^8TU/ml;
2)待小鼠恢复后,检测小鼠的血糖以及体重。随机将miR-29sponge和GFP组的小鼠,再分为2组,分为正常饲料(NCD)和高脂饲料(HFD)喂养组;
3)高脂喂养4周后,对小鼠进行GTT试验;
4)高脂喂养6周后,检测小鼠腹腔注射葡萄糖后0,30min的胰岛素的分泌量。
结果如图所示:与正常喂养组相比,高脂喂养的小鼠体重明显增加。但是组内的GFP和miR-29sponge组的小鼠体重均没有明显差异(图14B)。正常喂养组的GFP和miR-29sponge小鼠的糖耐量没有明显差异;但是在高脂喂养下,与GFP组相比,miR-29sponge组的小鼠在5,15min时的糖耐量是明显改善的(图14C)。在高脂喂养的条件下与GFP组相比,miR-29sponge组小鼠的葡萄糖刺激后胰岛素分泌在30min时明显增加(如图14D)。
本发明发现,在2型糖尿病早期(1个月高脂饮食喂养的C57BL/6J小鼠和1月龄瘦素受体缺陷(db/db)小鼠)胰岛中miR-29家族主要以外泌体形式释放,被单核/巨噬细胞吞噬,诱导胰岛素抵抗和β细胞功能障碍,进而导致2型糖尿病。本发明者利用miR-29sponge封闭巨噬细胞或者β细胞中miR-29的表达,发现可以抑制高脂饮食诱导的2型糖尿病发生。本发明利用miR-29βTG小鼠,更好的了解miR-29sponge在2型糖尿病治疗中的作用。
本发明通过运用miR-29βTG小鼠模型,辐照后进行骨髓移植。通过对其代谢表型的监测,发现miR-29通过细胞诱导的局部和系统炎症损伤细胞GSIS功能和组织胰岛素敏感性,而抑制单核细胞/巨噬细胞miR-29的作用可以逆转βTG小鼠的炎症和糖尿病症状。同时,利用C57BL/6J小鼠,通过胰腺原位注射技术,注射HBLV-mmu-miR-29sponge或HBLV-mmu-NC-GFP并联合高脂喂养,通过对其代谢表型的连续监测,发现可以有效缓解高脂喂养诱导的糖耐量受损的症状。
序列表
<110> 南京医科大学
<120> MiR-29海绵在制备用于治疗2型糖尿病的药物中的应用
<160> 1
<170> SIPOSequenceListing 1.0
<210> 1
<211> 112
<212> DNA
<213> miR-29海绵(Artificial Sequence)
<400> 1
taaccgattt cagatggtgc tatatactaa ccgatttcag atggtgctaa catcaacact 60
gatttcaaat ggtgctatct tcaaacactg atttcaaatg gtgctatttt tt 112
- MiR-29海绵在制备用于治疗2型糖尿病的药物中的应用
- CGP 57380在制备用于预防或治疗2型糖尿病药物中的应用
