DLL3的嵌合受体及其使用方法
文献发布时间:2023-06-19 09:47:53
相关申请的交叉引用
本申请要求2018年4月10日提交的美国临时专利申请号62/655,725的权益,所述申请的全部内容通过援引并入本文。
序列表
本申请含有已经以ASCII格式电子递交的序列表并且该序列表特此通过引用以其全文并入。所述ASCII副本创建于2019年4月10日,名称为A-2249-WO-PCT_SL.txt并且大小为86,327字节。
背景技术
小细胞肺癌(SCLC)约占所有确诊肺癌病例的15%,且它是一种侵袭形式的肺癌(Enstone等人,(2017)Pharmacoecon Open[药物经济学公开]doi:10.1007/s41669-017-0045-0;Bunn等人(2016)J Thorac Oncol[胸部肿瘤学杂志];11:453-74;Siegel等人,(2016)CA Cancer J Clin[临床医师癌症杂志];66:7-30)。δ样3(DLL3)是Notch受体的δ/Serrate/Lag-2配体家族中的一员,被认为在Notch信号传导中发挥作用。DLL3是Notch信号传导途径的抑制性配体,通常只在细胞内膜上表达(Geffers等人(2007)J Cell Biol;178:465-76.)。代表性的DLL3蛋白直系同源物包括但不限于:人(登录号NP_058637和NP982353)、黑猩猩(登录号XP_003316395)、小鼠(登录号NP_031892)、和大鼠(登录号NP_446118)。在人类中,DLL3基因由位于染色体19q13上跨9.5kBp的8个外显子组成。在最后一个外显子内的替代性剪接产生两种加工的转录物,一种为2389个碱基(登录号NM_016941)并且一种为2052个碱基(登录号NM_203486)。前一转录物编码一种618个氨基酸的蛋白质(登录号NP 058637;SEQ ID NO:29),而后一者编码一种587个氨基酸的蛋白质(登录号NP982353;SEQ ID NO:30)。在某些癌症,诸如SCLC中,已经发现DLL3在细胞表面表达,使其成为一种高度肿瘤选择性的细胞表面蛋白(Saunders等人(2015)Sci Transl Med[科学转化医学];7:302ra136.)。
工程化的免疫细胞已显示在治疗性处理中特别是在肿瘤学中具有所希望的质量。两种主要类型的工程化的免疫细胞是含有嵌合抗原受体(称为“CAR”或“CAR-T”)和T-细胞受体(“TCR”)的细胞。这些工程化的细胞被设计用来赋予它们抗原特异性,同时保留或增强它们识别和杀伤靶细胞的能力。嵌合抗原受体可以包括,例如,(i)抗原特异性成分(“抗原结合分子”)、(ii)一个或多个共刺激结构域、以及(iii)一个或多个激活结构域。每个结构域可能是异源的,即由来自不同蛋白质链的序列构成。表达嵌合抗原受体的免疫细胞(诸如T细胞)可用于各种治疗,包括癌症治疗。应当认识到的是,如本文所定义的共刺激多肽可用于增强针对靶抗原的表达CAR的细胞的激活,从而提高过继性免疫疗法的效力。
T细胞可以被设计成对一个或多个所希望的靶标具有特异性。例如,T细胞可以用DNA或编码抗原结合分子的其他遗传物质(诸如抗体的一个或多个单链可变片段(“scFv”)联合一个或多个信号传导分子和/或一个或多个激活结构域(诸如CD3ξ)转导。
除了CAR-T细胞识别和破坏靶细胞的能力外,成功的T细胞疗法还得益于CAR-T细胞在对抗原的应答中坚持和维持增殖能力的能力。
存在对于鉴定治疗DLL3相关疾病和障碍的新颖疗法和改进疗法的需要。
发明内容
本发明涉及对DLL3具有特异性的工程化的免疫细胞(诸如CAR或TCR)、抗原结合分子(包括但不限于抗体、scFv、重链和/或轻链以及这些抗原结合分子的CDR)。
本发明的嵌合抗原受体通常包括:(i)DLL3特异性抗原结合分子、(ii)一个或多个共刺激结构域、以及(iii)一个或多个激活结构域。应当认识到的是,每个结构域可能是异源的,因此,其由来自不同蛋白质链的序列组成。
在一些实施例中,本发明涉及嵌合抗原受体,该嵌合抗原受体包含抗原结合分子,该抗原结合分子特异性结合到DLL3上,其中该抗原结合分子包含以下至少一种:(a)可变重链CDR1,其包含与SEQ ID NO:42或SEQ ID NO:52或SEQ ID NO:62的氨基酸序列区别不超过3、2、1或0个氨基酸残基的氨基酸序列;(b)可变重链CDR2,其包含与SEQ ID NO:43或SEQ IDNO:53或SEQ ID NO:63的氨基酸序列区别不超过3、2、1或0个氨基酸残基的氨基酸序列;(c)可变重链CDR3,其包含与44或SEQ ID NO:54或SEQ ID NO:64的氨基酸序列区别不超过3、2、1或0个氨基酸残基的氨基酸序列;(d)可变轻链CDR1,其包含与SEQ ID NO:47或SEQ ID NO:57或SEQ ID NO:67的氨基酸序列区别不超过3、2、1或0个氨基酸残基的氨基酸序列;(e)可变轻链CDR2,其包含与SEQ ID NO:48或SEQ ID NO:58或SEQ ID NO:68的氨基酸序列区别不超过3、2、1或0个氨基酸残基的氨基酸序列;(f)可变轻链CDR3,其包含与SEQ ID NO:49或SEQ ID NO:59或SEQ ID NO:69的氨基酸序列区别为不超过3、2、1或0个氨基酸残基的氨基酸序列。
在其他实施例中,该嵌合抗原受体进一步包括至少一个共刺激结构域。在另外的实施例中,该嵌合抗原受体进一步包括至少一个激活结构域。
在某些实施例中,该共刺激结构域是以下的信号传导区:CD28、CD28T、CD8、OX-40、4-1BB/CD137、CD2、CD7、CD27、CD30、CD40、程序性死亡-1(PD-1)、可诱导的T细胞共刺激因子(ICOS)、淋巴细胞功能相关抗原-1(LFA-1、CDl-la/CD18)、CD3γ、CD3δ、CD3ε、CD247、CD276(B7-H3)、LIGHT、(TNFSF14)、NKG2C、Igα(CD79a)、DAP-10、Fcγ受体、MHC 1类分子、TNF受体蛋白、免疫球蛋白、细胞因子受体、整合素、信号传导淋巴细胞活化分子(SLAM蛋白)、激活型NK细胞受体、BTLA、Toll配体受体、ICAM-1、B7-H3、CDS、ICAM-1、GITR、BAFFR、LIGHT、HVEM(LIGHTR)、KIRDS2、SLAMF7、NKp80(KLRF1)、NKp44、NKp30、NKp46、CD19、CD4、CD8α、CD8β、IL-2Rβ、IL-2Rγ、IL-7Rα、ITGA4、VLA1、CD49a、ITGA4、IA4、CD49D、ITGA6、VLA-6、CD49f、ITGAD、CDl ld、ITGAE、CD103、ITGAL、CDl la、LFA-1、ITGAM、CDl lb、ITGAX、CDl lc、ITGBl、CD29、ITGB2、CD18、LFA-1、ITGB7、NKG2D、TNFR2、TRANCE/RANKL、DNAM1(CD226)、SLAMF4(CD244、2B4)、CD84、CD96(Tactile)、CEACAM1、CRT AM、Ly9(CD229)、CD160(BY55)、PSGL1、CD100(SEMA4D)、CD69、SLAMF6(NTB-A、Lyl08)、SLAM(SLAMF1、CD150、IPO-3)、BLAME(SLAMF8)、SELPLG(CD162)、LTBR、LAT、GADS、SLP-76、PAG/Cbp、CD19a、与CD83特异性结合的配体、或其任何组合。
在一些实施例中,该共刺激结构域来自4-1BB。在其他实施例中,该共刺激结构域来自CD28或CD28T。在其他实施例中,该共刺激结构域来自CD8。在其他实施例中,该共刺激结构域来自OX40。还参见Hombach等人,Oncoimmunology.[肿瘤免疫学]2012年7月1日;1(4):458-466。在仍然其他实施例中,该共刺激结构域包含ICOS,如描述于Guedan等人,2014年8月14日;Blood[血液]:124(7)以及Shen等人,Journal of Hematology&Oncology[血液学与肿瘤学杂志](2013)6:33。在仍然其他实施例中,该共刺激结构域包含CD27,如描述于Song等人,Oncoimmunology.[肿瘤免疫学]2012年7月1日;1(4):547-549。
在某些实施例中,该CD28共刺激结构域包含SEQ ID NO:2、SEQ ID NO:4、SEQ IDNO:6或SEQ ID NO:8。在另外的实施例中,该CD8共刺激结构域包含SEQ ID NO:14。在另外的实施例中,该4-1BB共刺激结构域包含SEQ ID NO:16。在另外的实施例中,该激活结构域包含CD3、CD3ξ、或具有在SEQ ID NO:10中列出的序列的CD3ξ。
在其他实施例中,本发明涉及嵌合抗原受体,其中该共刺激结构域包含SEQ IDNO:2且激活结构域包含SEQ ID NO:10。
本发明进一步涉及编码嵌合抗原受体的多核苷酸以及包含该多核苷酸的载体。例如,该载体可以是逆转录病毒载体、DNA载体、质粒、RNA载体、腺病毒载体、腺病毒相关载体、慢病毒载体、或其任何组合。本发明进一步涉及包含该载体的免疫细胞。在一些实施例中,该慢病毒载体是pGAR载体。
示例性免疫细胞包括但不限于T细胞、肿瘤浸润淋巴细胞(TIL)、NK细胞、TCR-表达细胞、树突状细胞或NK-T细胞。所述T细胞可以是自体、同种异体或异源的。在其他实施例中,本发明涉及包含本文所述免疫细胞的药物组合物。
在某些实施例中,本发明涉及抗原结合分子(以及包含这些分子的嵌合抗原受体),该抗原结合分子包括以下中的至少一种:
(a)VH区,其与1H2.1的VH区的氨基酸序列的区别不超过10、9、8、7、6、5、4、3、2、1或0个氨基酸残基,和VL区,其与1H2.1的VL区的氨基酸序列的区别不超过10、9、8、7、6、5、4、3、2、1、或0个氨基酸残基;
(b)VH区,其与8D2的VH区的氨基酸序列的区别不超过10、9、8、7、6、5、4、3、2、1或0个氨基酸残基,和VL区,其与8D2的VL区的氨基酸序列的区别不超过10、9、8、7、6、5、4、3、2、1、或0个氨基酸残基;
(c)VH区,其与6B2的VH区的氨基酸序列的区别不超过10、9、8、7、6、5、4、3、2、1或0个氨基酸残基,和VL区,其与6B2的VL区的氨基酸序列的区别不超过10、9、8、7、6、5、4、3、2、1、或0个氨基酸残基;
并且其中该一个或多个VH和VL区通过至少一个接头连接。
在其他实施例中,本发明涉及抗原结合分子(以及包含这些分子的嵌合抗原受体),其中该接头包含scFv G4S接头和scFv惠特洛(Whitlow)接头中的至少一个。
在其他实施例中,本发明涉及编码本发明多肽的载体以及包含这些多肽的免疫细胞。优选的免疫细胞包括T细胞、肿瘤浸润淋巴细胞(TIL)、NK细胞、TCR-表达细胞、树突状细胞或NK-T细胞。所述T细胞可以是自体、同种异体或异源的。
在其他实施例中,本发明涉及编码包含特异性结合至DLL3的抗原结合分子的嵌合抗原受体(CAR)或T细胞受体(TCR)的分离的多核苷酸,其中该抗原结合分子包含可变重(V
在其他实施例中,本发明包括共刺激结构域,例如CD28、CD28T、OX40、CD8、4-1BB/CD137、CD2、CD3(α、β、δ、ε、γ、ξ)、CD4、CD5、CD7、CD9、CD16、CD22、CD27、CD30、CD 33、CD37、CD40、CD 45、CD64、CD80、CD86、CD134、CD137、CD154、PD-1、ICOS、淋巴细胞功能相关抗原-1(LFA-1(CDl la/CD18)、CD247、CD276(B7-H3)、LIGHT(肿瘤坏死因子超家族成员14;TNFSF14)、NKG2C、Igα(CD79a)、DAP-10、Fcγ受体、MHC I类分子、TNF、TNFr、整合素、信号传导淋巴细胞活化分子、BTLA、Toll配体受体、ICAM-1、B7-H3、CDS、ICAM-1、GITR、BAFFR、LIGHT、HVEM(LIGHTR)、KIRDS2、SLAMF7、NKp80(KLRF1)、NKp44、NKp30、NKp46、CD19、CD4、CD8α、CD8β、IL-2Rβ、IL-2Rγ、IL-7Rα、ITGA4、VLA1、CD49a、ITGA4、IA4、CD49D、ITGA6、VLA-6、CD49f、ITGAD、CDl-ld、ITGAE、CD103、ITGAL、CDl-la、LFA-1、ITGAM、CDl-lb、ITGAX、CDl-lc、ITGBl、CD29、ITGB2、CD18、LFA-1、ITGB7、NKG2D、TNFR2、TRANCE/RANKL、DNAM1(CD226)、SLAMF4(CD244、2B4)、CD84、CD96(Tactile)、CEACAM1、CRT AM、Ly9(CD229)、CD160(BY55)、PSGL1、CD100(SEMA4D)、CD69、SLAMF6(NTB-A、Lyl08)、SLAM(SLAMF1、CD150、IPO-3)、BLAME(SLAMF8)、SELPLG(CD162)、LTBR、LAT、GADS、SLP-76、PAG/Cbp、CD19a、CD83配体、或其片段或组合。优选的共刺激结构域是如下文所列举的。
在另外的实施例中,本发明涉及编码嵌合抗原受体(CAR)或T细胞受体(TCR)的分离的多核苷酸,其中所述CAR或TCR包含特异性结合至DLL3的抗原结合分子,并且其中该抗原结合分子包含可变轻(V
在其他实施例中,本发明涉及编码包含特异性结合至DLL3的抗原结合分子的嵌合抗原受体(CAR)或T细胞受体(TCR)的分离的多核苷酸,其中该抗原结合分子重链包含CDR1(SEQ ID NO:42)、CDR2(SEQ ID NO:43)、和CDR3(SEQ ID NO:44)并且该抗原结合分子轻链包含CDR1(SEQ ID NO:47)、CDR2(SEQ ID NO:48)、和CDR3(SEQ ID NO:49)。
在其他实施例中,本发明涉及编码包含特异性结合至DLL3的抗原结合分子的嵌合抗原受体(CAR)或T细胞受体(TCR)的分离的多核苷酸,其中该抗原结合分子重链包含CDR1(SEQ ID NO:52)、CDR2(SEQ ID NO:53)、和CDR3(SEQ ID NO:54)并且该抗原结合分子轻链包含CDR1(SEQ ID NO:57)、CDR2(SEQ ID NO:58)、和CDR3(SEQ ID NO:59)。
在其他实施例中,本发明涉及编码包含特异性结合至DLL3的抗原结合分子的嵌合抗原受体(CAR)或T细胞受体(TCR)的分离的多核苷酸,其中该抗原结合分子重链包含CDR1(SEQ ID NO:62)、CDR2(SEQ ID NO:63)、和CDR3(SEQ ID NO:64)并且该抗原结合分子轻链包含CDR1(SEQ ID NO:67)、CDR2(SEQ ID NO:68)、和CDR3(SEQ ID NO:69)。
本发明进一步涉及DLL3抗原结合分子,其包含如本文所陈述的至少一个可变重链CDR3或可变轻链CDR3序列。本发明进一步涉及DLL3抗原结合分子,其包含如本文所述的至少一个可变重链CDR1、CDR2、和CDR3序列。本发明进一步涉及DLL3抗原结合分子,其包含如本文所述的至少一个可变轻链CDR1、CDR2、和CDR3序列。本发明进一步涉及DLL3抗原结合分子,其包含如本文所述的可变重链CDR1、CDR2、CDR3,和可变轻链CDR1、CDR2、和CDR3序列。
根据本发明的适用于DLL3结合分子的另外的重链和轻链可变结构域以及CDR聚核苷酸和氨基酸序列可以发现于提交于2015年7月31日的美国临时申请号62/199,944。
本发明进一步涉及治疗有此需要的受试者中的疾病或障碍的方法,该方法包括给予该受试者根据本发明的抗原结合分子、CAR、TCR、多核苷酸、载体、细胞或组合物。适合治疗的疾病包括但不限于:肾上腺癌、肝癌、肾癌、膀胱癌、乳腺癌、胃癌、卵巢癌、宫颈癌、子宫癌、食管癌、结肠直肠癌、前列腺癌(例如,前列腺腺癌)、胰腺癌、肺癌(包括小细胞肺癌和非小细胞肺癌)、甲状腺、癌、肉瘤、胶质母细胞瘤、头颈部肿瘤、大细胞神经内分泌癌(LCNEC)、甲状腺髓样癌、胶质母细胞瘤、神经内分泌前列腺癌、(NEPC)、高等级胃肠胰癌(GEP)和恶性黑色素瘤。
附图说明
图1描绘了来自健康供体的T细胞中DLL3 CAR的表达。
图2描绘了来自健康供体的慢病毒转导的CAR T细胞的溶细胞活性。
图3描绘了通过来自健康供体的CAR T细胞的细胞因子产生。
图4描绘了响应于表达DLL3的靶细胞,T细胞增殖的流式细胞术分析。
图5描绘了DLL3 CAR T细胞在人SCLC的小鼠异源模型中的体内抗肿瘤活性。
图6描绘了DLL3 CAR T细胞治疗后小鼠SCLC异源模型的存活分析。
图7描绘了pGAR载体图谱。
具体实施方式
应当认识到的是,嵌合抗原受体(CAR或CAR-T)和T细胞受体(TCR)是基因工程化的受体。这些工程化受体可以根据本领域已知的技术很容易地插入免疫细胞并通过免疫细胞表达,所述免疫细胞包括T细胞。通过CAR,单一的受体可以被编程,使其既能识别特定的抗原,又能在与该抗原结合时激活免疫细胞,攻击并摧毁携带该抗原的细胞。当这些抗原存在于肿瘤细胞上时,表达CAR的免疫细胞可以靶向并杀伤肿瘤细胞。
通过掺入与靶抗原相互作用的抗原结合分子,CAR可以被工程化以结合抗原(诸如细胞表面抗原)。优选地,该抗原结合分子是其抗体片段,并且更优选地是一个或多个单链抗体片段(“scFv”)。scFv是单链抗体片段,它具有连接在一起的抗体重链和轻链的可变区。参见美国专利号7,741,465、和6,319,494以及Eshhar等人,Cancer ImmunolImmunotherapy[癌症免疫免疫疗法](1997)45:131-136。scFv保留了亲本抗体与靶抗原特异性相互作用的能力。scFv优选用于在嵌合抗原受体中使用,因为它们可以被工程化以作为单链的部分与其他CAR成分被表达。同上还参见Krause等人,J.Exp.Med.[实验医学杂志],第188卷,第4期,1998(619-626);Finney等人,Journal of Immunology[免疫学杂志],1998,161:2791-2797。应当认识到的是,抗原结合分子通常包含在CAR的细胞外部分中,这样它就能够识别和结合目的抗原。在本发明的范围内考虑到的是具有对多于一个目的靶标具有特异性的双特异性和多特异性CAR。
共刺激结构域。嵌合抗原受体可以掺入共刺激(信号传导)结构域来增强其效力。参见美国专利号7,741,465、和6,319,494,以及Krause等人和Finney等人(同上),Song等人,Blood[血液]119:696-706(2012);Kalos等人,Sci Transl.Med.[科学转化医学]3:95(2011);Porter等人,N.Engl.J.Med.[新英格兰医学杂志]365:725-33(2011),以及Gross等人,Annu.Rev.Pharmacol.Toxicol.[药理学与毒理学年评]56:59-83(2016)。例如,CD28是一种天然存在于T细胞上的共刺激蛋白。CD28的完整天然氨基酸序列描述于NCBI参考序列:NP_006130.1。完整的天然CD28核酸序列描述于NCBI参考序列:NM_006139.1。
某些CD28结构域已被用于嵌合抗原受体。根据本发明,现在已经发现新颖的CD28细胞外结构域,称为“CD28T”,在CAR构建体中使用时意外地提供了某些益处。
CD28T分子的核苷酸序列(包括细胞外CD28T结构域、CD28跨膜结构域和细胞内结构域)在SEQ ID NO:1中列出:
CTTGATAATGAAAAGTCAAACGGAACAATCATTCACGTGAAGGGCAAGCACCTCTGTCCGTCACCCTTGTTCCCTGGTCCATCCAAGCCATTCTGGGTGTTGGTCGTAGTGGGTGGAGTCCTCGCTTGTTACTCTCTGCTCGTCACCGTGGCTTTTATAATCTTCTGGGTTAGATCCAAAAGAAGCCGCCTGCTCCATAGCGATTACATGAATATGACTCCACGCCGCCCTGGCCCCACAAGGAAACACTACCAGCCTTACGCACCACCTAGAGATTTCGCTGCCTATCGGAGC
相应的氨基酸序列在SEQ ID NO:2中列出:
LDNEKSNGTIIHVKGKHLCPSPLFPGPSKPFWVLVVVGGVLACYSLLVTVAFIIFWVRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRS
CD28T的细胞外部分的核苷酸序列在SEQ ID NO:3中列出:
CTTGATAATGAAAAGTCAAACGGAACAATCATTCACGTGAAGGGCAAGCACCTCTGTCCGTCACCCTTGTTCCCTGGTCCATCCAAGCCA
CD28T细胞外结构域的相应的氨基酸序列在SEQ ID NO:4中列出:LDNEKSNGTIIHVKGKHLCP SPLFPGPSKP
CD28跨膜结构域的核苷酸序列在SEQ ID NO:5中列出:
TTCTGGGTGTTGGTCGTAGTGGGTGGAGTCCTCGCTTGTTACTCTCTGCTCGTCACCGTGGCTTTTATAATCTTCTGGGTT
CD28跨膜结构域的氨基酸序列在以下中列出
SEQ ID NO:6:FWVLVVVGGV LACYSLLVTV AFIIFWV
CD28细胞内信号传导结构域的核苷酸序列在SEQ ID NO:7中列出:
AGATCCAAAAGAAGCCGCCTGCTCCATAGCGATTACATGAATATGACTCCACGCCGCCCTGGCCCCACAAGGAAACACTACCAGCCTTACGCACCACCTAGAGATTTCGCTGCCTATCGGAGC
CD28细胞内信号传导结构域的氨基酸序列在SEQ ID NO:8中列出:RSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRS
适用于本发明的另外的CD28序列包括CD28核苷酸序列,其在SEQ ID NO:11中列出:
ATTGAGGTGATGTATCCACCGCCTTACCTGGATAACGAAAAGAGTAACGGTACCATCATTCACGTGAAAGGTAAACACCTGTGTCCTTCTCCCCTCTTCCCCGGGCCATCAAAGCCC
相应的氨基酸序列在SEQ ID NO:12中列出:
IEVMYPPPYLDNEKSNGTIIHVKGKHLCPSPLFPGPSKP
其他的适合的细胞外或跨膜序列可以来自CD8。适合的CD8细胞外和跨膜结构域的核苷酸序列在SEQ ID NO:13中列出:
GCTGCAGCATTGAGCAACTCAATAATGTATTTTAGTCACTTTGTACCAGTGTTCTTGCCGGCTAAGCCTACTACCACACCCGCTCCACGGCCACCTACCCCAGCTCCTACCATCGCTTCACAGCCTCTGTCCCTGCGCCCAGAGGCTTGCCGACCGGCCGCAGGGGGCGCTGTTCATACCAGAGGACTGGATTTCGCCTGCGATATCTATATCTGGGCACCCCTGGCCGGAACCTGCGGCGTACTCCTGCTGTCCCTGGTCATCACGCTCTATTGTAATCACAGGAAC
相应的氨基酸序列在SEQ ID NO:14中列出:
AAALSNSIMYFSHFVPVFLPAKPTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCNHRN
其他的适合的细胞内信号传导序列可以来自41-BB。适合的41-BB细胞内信号传导结构域的核苷酸序列在SEQ ID NO:15中列出:
CGCTTTTCCGTCGTTAAGCGGGGGAGAAAAAAGCTGCTGTACATTTTCAAACAGCCGTTTATGAGGCCGGTCCAAACGACTCAGGAAGAGGACGGCTGCTCCTGCCGCTTTCCTGAGGAGGAGGAGGGCGGGTGCGAACTG
相应的氨基酸序列在SEQ ID NO:16中列出:
RFSVVKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL
本发明范围内的适合的共刺激结构域可以来自(除其他来源外)CD28、CD28T、OX40、4-1BB/CD137、CD2、CD3(α、β、δ、ε、γ、ξ)、CD4、CD5、CD7、CD9、CD16、CD22、CD27、CD30、CD33、CD37、CD40、CD 45、CD64、CD80、CD86、CD134、CD137、CD154、PD-1、ICOS、淋巴细胞功能相关抗原-1(LFA-1(CDl la/CD18)、CD247、CD276(B7-H3)、LIGHT(肿瘤坏死因子超家族成员14;TNFSF14)、NKG2C、Igα(CD79a)、DAP-10、Fcγ受体、MHC I类分子、TNF、TNFr、整合素、信号传导淋巴细胞活化分子、BTLA、Toll配体受体、ICAM-1、B7-H3、CDS、ICAM-1、GITR、BAFFR、LIGHT、HVEM(LIGHTR)、KIRDS2、SLAMF7、NKp80(KLRF1)、NKp44、NKp30、NKp46、CD19、CD4、CD8α、CD8β、IL-2Rβ、IL-2Rγ、IL-7Rα、ITGA4、VLA1、CD49a、ITGA4、IA4、CD49D、ITGA6、VLA-6、CD49f、ITGAD、CDl-ld、ITGAE、CD103、ITGAL、CDl-la、LFA-1、ITGAM、CDl-lb、ITGAX、CDl-lc、ITGBl、CD29、ITGB2、CD18、LFA-1、ITGB7、NKG2D、TNFR2、TRANCE/RANKL、DNAM1(CD226)、SLAMF4(CD244、2B4)、CD84、CD96(Tactile)、CEACAM1、CRT AM、Ly9(CD229)、CD160(BY55)、PSGL1、CD100(SEMA4D)、CD69、SLAMF6(NTB-A、Lyl08)、SLAM(SLAMF1、CD150、IPO-3)、BLAME(SLAMF8)、SELPLG(CD162)、LTBR、LAT、GADS、SLP-76、PAG/Cbp、CD19a、CD83配体、或其片段或组合。
激活结构域。
CD3是天然T细胞上T细胞受体的元件,并且已显示是CAR内重要的细胞内激活元件。在优选的实施例中,CD3是CD3ξ,其核苷酸序列在SEQ ID NO:9中列出:
AGGGTGAAGTTTTCCAGATCTGCAGATGCACCAGCGTATCAGCAGGGCCAGAACCAACTGTATAACGAGCTCAACCTGGGACGCAGGGAAGAGTATGACGTTTTGGACAAGCGCAGAGGACGGGACCCTGAGATGGGTGGCAAACCAAGACGAAAAAACCCCCAGGAGGGTCTCTATAATGAGCTGCAGAAGGATAAGATGGCTGAAGCCTATTCTGAAATAGGCATGAAAGGAGAGCGGAGAAGGGGAAAAGGGCACGACGGTTTGTACCAGGGACTCAGCACTGCTACGAAGGATACTTATGACGCTCTCCACATGCAAGCCCTGCCACCTAGG
细胞内CD3ξ的相应的氨基酸在SEQ ID NO:10中列出:
RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
结构域取向
应当认识到的是在结构上,这些结构域对应于免疫细胞相关的位置。因此,这些结构域可以是(i)“铰链”或细胞外(EC)结构域(EC)、(ii)跨膜(TM)结构域、和/或(iii)细胞内(细胞质)结构域(IC)的部分。细胞内成分通常部分包含CD3家族的成员,优选为CD3ξ,该CD3ξ能够在抗原结合分子与其靶标结合后激活T细胞。在一个实施例中,该铰链结构域通常由如本文定义的至少一个共刺激结构域构成。
还应当认识到的是铰链区也可能包含免疫球蛋白家族的一些或全部成员,诸如IgG1、IgG2、IgG3、IgG4、IgA、IgD、IgE、IgM或其片段。
根据本发明的示例性CAR构建体在表1中列出。
与细胞相关的结构域
应当认识到的是,相对于携带受体的细胞,本发明的工程化的T细胞包括抗原结合分子(诸如scFv)、细胞外结构域(可能包括“铰链”结构域)、跨膜结构域和细胞内结构域。细胞内结构域至少部分地包含激活结构域,该激活结构域优选地由CD3家族成员(诸如CD3ξ、CD3ε、CD3γ、或其部分)构成。进一步应当认识到的是抗原结合分子(例如,一个或多个scFv)被工程化使其位于分子/构建体的细胞外部分,从而能够识别和结合到其一个或多个靶标上。
细胞外结构域。细胞外结构域有利于信号传导和淋巴细胞对抗原的有效应答。本发明中特别有用的细胞外结构域可以来自(即包括):CD28、CD28T、OX-40、4-1BB/CD137、CD2、CD7、CD27、CD30、CD40、程序性死亡-1(PD-1)、可诱导的T细胞共刺激因子(ICOS)、淋巴细胞功能相关抗原-1(LFA-1、CDl-la/CD18)、CD3γ、CD3δ、CD3ε、CD247、CD276(B7-H3)、LIGHT、(TNFSF14)、NKG2C、Igα(CD79a)、DAP-10、Fcγ受体、MHC 1类分子、TNF受体蛋白、免疫球蛋白、细胞因子受体、整合素、信号传导淋巴细胞活化分子(SLAM蛋白)、激活型NK细胞受体、BTLA、Toll配体受体、ICAM-1、B7-H3、CDS、ICAM-1、GITR、BAFFR、LIGHT、HVEM(LIGHTR)、KIRDS2、SLAMF7、NKp80(KLRF1)、NKp44、NKp30、NKp46、CD19、CD4、CD8α、CD8β、IL-2Rβ、IL-2Rγ、IL-7Rα、ITGA4、VLA1、CD49a、ITGA4、IA4、CD49D、ITGA6、VLA-6、CD49f、ITGAD、CDl ld、ITGAE、CD103、ITGAL、CDl la、LFA-1、ITGAM、CDl lb、ITGAX、CDl lc、ITGBl、CD29、ITGB2、CD18、LFA-1、ITGB7、NKG2D、TNFR2、TRANCE/RANKL、DNAM1(CD226)、SLAMF4(CD244、2B4)、CD84、CD96(Tactile)、CEACAM1、CRT AM、Ly9(CD229)、CD160(BY55)、PSGL1、CD100(SEMA4D)、CD69、SLAMF6(NTB-A、Lyl08)、SLAM(SLAMF1、CD150、IPO-3)、BLAME(SLAMF8)、SELPLG(CD162)、LTBR、LAT、GADS、SLP-76、PAG/Cbp、CD19a、与CD83特异性结合的配体、或其任何组合。细胞外结构域可来自天然来源或合成来源。
如本文所述,细胞外结构域通常包含铰链部分。这是细胞外结构域的一部分,有时称为“间隔子”区。根据本发明可以使用多种铰链,包括如上文所述的共刺激分子,以及免疫球蛋白(Ig)序列或其他适合的分子,以达到所希望的与靶细胞的特殊距离。在一些实施例中,整个细胞外区域包括铰链区。在一些实施例中,该铰链区包含CD28T或CD28的EC结构域。
跨膜结构域。CAR可被设计成包括融合到该CAR的细胞外结构域的跨膜结构域。它可以类似地融合到CAR的细胞内结构域。在一个实施例中,使用自然与CAR中的一个结构域相关的跨膜结构域。在一些情况下,可以通过氨基酸取代来选择或修饰跨膜结构域,以避免此类结构域与相同或不同表面膜蛋白的跨膜结构域的结合以最小化与受体复合物的其他成员的相互作用。跨膜结构域可来自天然来源或合成来源。在来源是天然的情况下,结构域可以衍生自任何膜结合或跨膜蛋白。本发明中特别有用的跨膜区可以来自(即包括):CD28、CD28T、OX-40、4-1BB/CD137、CD2、CD7、CD27、CD30、CD40、程序性死亡-1(PD-1)、可诱导的T细胞共刺激因子(ICOS)、淋巴细胞功能相关抗原-1(LFA-1、CDl-la/CD18)、CD3γ、CD3δ、CD3ε、CD247、CD276(B7-H3)、LIGHT、(TNFSF14)、NKG2C、Igα(CD79a)、DAP-10、Fcγ受体、MHC 1类分子、TNF受体蛋白、免疫球蛋白、细胞因子受体、整合素、信号传导淋巴细胞活化分子(SLAM蛋白)、激活型NK细胞受体、BTLA、Toll配体受体、ICAM-1、B7-H3、CDS、ICAM-1、GITR、BAFFR、LIGHT、HVEM(LIGHTR)、KIRDS2、SLAMF7、NKp80(KLRF1)、NKp44、NKp30、NKp46、CD19、CD4、CD8α、CD8β、IL-2Rβ、IL-2Rγ、IL-7Rα、ITGA4、VLA1、CD49a、ITGA4、IA4、CD49D、ITGA6、VLA-6、CD49f、ITGAD、CDl ld、ITGAE、CD103、ITGAL、CDl la、LFA-1、ITGAM、CDl lb、ITGAX、CDl lc、ITGBl、CD29、ITGB2、CD18、LFA-1、ITGB7、NKG2D、TNFR2、TRANCE/RANKL、DNAM1(CD226)、SLAMF4(CD244、2B4)、CD84、CD96(Tactile)、CEACAM1、CRT AM、Ly9(CD229)、CD160(BY55)、PSGL1、CD100(SEMA4D)、CD69、SLAMF6(NTB-A、Lyl08)、SLAM(SLAMF1、CD150、IPO-3)、BLAME(SLAMF8)、SELPLG(CD162)、LTBR、LAT、GADS、SLP-76、PAG/Cbp、CD19a、与CD83特异性结合的配体、或其任何组合。
任选地,短接头可以在CAR的任何或部分细胞外、跨膜和细胞内结构域之间形成连接。
在一个实施例中,本发明的CAR中的跨膜结构域为CD8跨膜结构域。在一个实施例中,该CD8跨膜结构域包含SEQ ID NO:13的核酸序列的跨膜部分。在另一个实施例中,该CD8跨膜结构域包含编码SEQ ID NO:14中包含的跨膜氨基酸序列的核酸序列。
在某些实施例中,本发明的CAR中的跨膜结构域为CD28跨膜结构域。在一个实施例中,该CD28跨膜结构域包含SEQ ID NO:5的核酸序列。在一个实施例中,该CD28跨膜结构域包含编码SEQ ID NO:6的氨基酸序列的核酸序列。在另一个实施例中,该CD28跨膜结构域包含SEQ ID NO:6的氨基酸序列。
应当认识到的是,适合的细胞内分子包括(即包含)但不限于CD28、CD28T、OX-40、4-1BB/CD137、CD2、CD7、CD27、CD30、CD40、程序性死亡-1(PD-1)、可诱导的T细胞共刺激因子(ICOS)、淋巴细胞功能相关抗原-1(LFA-1、CDl-la/CD18)、CD3γ、CD3δ、CD3ε、CD247、CD276(B7-H3)、LIGHT、(TNFSF14)、NKG2C、Igα(CD79a)、DAP-10、Fcγ受体、MHC 1类分子、TNF受体蛋白、免疫球蛋白、细胞因子受体、整合素、信号传导淋巴细胞活化分子(SLAM蛋白)、激活型NK细胞受体、BTLA、Toll配体受体、ICAM-1、B7-H3、CDS、ICAM-1、GITR、BAFFR、LIGHT、HVEM(LIGHTR)、KIRDS2、SLAMF7、NKp80(KLRF1)、NKp44、NKp30、NKp46、CD19、CD4、CD8α、CD8β、IL-2Rβ、IL-2Rγ、IL-7Rα、ITGA4、VLA1、CD49a、ITGA4、IA4、CD49D、ITGA6、VLA-6、CD49f、ITGAD、CDl ld、ITGAE、CD103、ITGAL、CDl la、LFA-1、ITGAM、CDl lb、ITGAX、CDl lc、ITGBl、CD29、ITGB2、CD18、LFA-1、ITGB7、NKG2D、TNFR2、TRANCE/RANKL、DNAM1(CD226)、SLAMF4(CD244、2B4)、CD84、CD96(Tactile)、CEACAM1、CRT AM、Ly9(CD229)、CD160(BY55)、PSGL1、CD100(SEMA4D)、CD69、SLAMF6(NTB-A、Lyl08)、SLAM(SLAMF1、CD150、IPO-3)、BLAME(SLAMF8)、SELPLG(CD162)、LTBR、LAT、GADS、SLP-76、PAG/Cbp、CD19a、与CD83特异性结合的配体、或其任何组合。
在优选的实施例中,所述CAR的细胞质结构域可被设计为包含CD3ξ信号传导结构域本身,或与在本发明的CAR上下文中有用的任何其他所希望的一个或多个细胞质结构域组合。例如,CAR的细胞质结构域可以包含CD3ξ链部分和共刺激信号传导区。
本发明的CAR的细胞质信号传导部分内的细胞质信号传导序列可以按随机或指定的顺序相互连接。
在一个优选的实施例中,该细胞质结构域被设计为包含CD3ξ的信号传导结构域和CD28的信号传导结构域。在另一个实施例中,该细胞质结构域被设计为包含CD3ξ的信号传导结构域和4-1BB的信号传导结构域,其中该细胞质CD28包含在SEQ ID NO:15中列出的核酸序列和在SEQ ID NO:16中列出的氨基酸序列。在另一个实施例中,本发明的CAR中的细胞质结构域被设计为包括CD28和CD3ξ的一部分,其中该细胞质CD28包含在SEQ ID NO:7中列出的核酸序列和在SEQ ID NO:8中列出的氨基酸序列。CD3ξ核酸序列在SEQ ID NO:9中列出,且氨基酸序列在SEQ ID NO:8中列出。
应当认识到的是,根据本发明的CAR的一个优选的取向包括抗原结合结构域(诸如scFv)与共刺激结构域和激活结构域串联。共刺激结构域可包含细胞外部分、跨膜部分和细胞内部分的一个或多个。进一步应当认识到的是可以串联使用多个共刺激结构域。
在一些实施例中,提供的核酸包括可操作地连接到编码抗原结合分子的第一多核苷酸的启动子、至少一个共刺激分子和激活结构域。
在一些实施例中,该核酸构建体包含在病毒载体中。在一些实施例中,该病毒载体选自下组,该组由以下组成:逆转录病毒载体、小鼠白血病病毒载体、SFG载体、腺病毒载体、慢病毒载体、腺相关病毒(AAV)载体、疱疹病毒载体和牛痘病毒载体。在一些实施例中,该核酸包含在质粒中。
本发明进一步涉及编码嵌合抗原受体的分离的多核苷酸以及包含该多核苷酸的载体。任何本领域已知的载体都适用于本发明。在一些实施例中,该载体是病毒载体。在一些实施例中,该载体是逆转录病毒载体(诸如pMSVG1)、DNA载体、小鼠白血病病毒载体、SFG载体、质粒、RNA载体、腺病毒载体、杆状病毒载体、Epstein Barr病毒载体、乳头多瘤空泡病毒载体、牛痘病毒载体、单纯疱疹病毒载体、腺病毒相关载体(AAV)、慢病毒载体(诸如pGAR)、或其任何组合。pGAR载体图谱如图7所示。pGAR序列如下:
适合的另外的示例性载体包括,例如pBABE-puro、pBABE-neo largeTcDNA、pBABE-hygro-hTERT、pMKO.1GFP、MSCV-IRES-GFP、pMSCV PIG(Puro IRES GFP空质粒)、pMSCV-loxp-dsRed-loxp-eGFP-Puro-WPRE、MSCV IRES荧光素酶、pMIG、MDH1-PGK-GFP_2.0、TtRMPVIR、pMSCV-IRES-mCherry FP、pRetroX GFP T2A Cre、pRXTN、pLncEXP、和pLXIN-Luc。
在一些实施例中,该工程化的细胞是T细胞、肿瘤浸润淋巴细胞(TIL)、NK细胞、TCR-表达细胞、树突状细胞或NK-T细胞。在一些实施例中,该细胞获得自外周血或由外周血制备。在一些实施例中,该细胞获得自外周血单核细胞(PBMC)或由外周血单核细胞(PBMC)制备。在一些实施例中,该细胞获得自骨髓或由骨髓制备。在一些实施例中,该细胞获得自脐带血或由脐带血制备。在一些实施例中,该细胞是人细胞。在一些实施例中,使用选自下组的方法用核酸载体转染或转导细胞,该组由以下组成:电穿孔、声孔效应、生物弹射(例如基因枪)、脂质转染、聚合物转染、纳米颗粒或复合物。
在一些实施例中,嵌合抗原受体在包含本申请的核酸的工程化的免疫细胞中表达。在一些实施例中,本应用的这些嵌合抗原受体可以包括,(i)抗原结合分子(诸如scFv)、(ii)跨膜区、和(iii)T细胞活化分子或区域。
抗原结合分子
抗原结合分子在本发明的范围内。
如本文所用的“抗原结合分子”意指任何结合特定靶抗原的蛋白质。在本申请中,指定的靶抗原是DLL3蛋白或其片段。抗原结合分子包括但不限于抗体及其结合部分,例如免疫功能片段。肽体(即,包含肽结合结构域的Fc融合分子)是合适的抗原结合分子的另一个实例。
在一些实施例中,该抗原结合分子结合至肿瘤细胞上的抗原。在一些实施例中,该抗原结合分子结合至与过度增殖性疾病有关的细胞上的抗原或结合至病毒或细菌抗原。在某些实施例中,该抗原结合分子结合至DLL3。在另外的实施例中,该抗原结合分子是抗体或其片段,包括其一个或多个互补决定区(CDR)。在另外的实施例中,该抗原结合分子是单链可变片段(scFv)。
术语抗原结合分子的“免疫功能片段”(或“片段”)是包含抗体的部分(无论该部分如何获得或合成)抗原结合分子的一种,所述抗体至少缺乏一些存在于全长链上的氨基酸,但仍有能力与抗原特异性结合。此类片段具有生物活性,因为它们与靶抗原结合,并可以与其他抗原结合分子(包括完整的抗体)竞争结合到给定的表位。在一些实施例中,该片段是中和片段。在一些实施例中,该片段可以阻断或降低DLL3的活性。在一个方面,此类片段将保留存在于全长轻链或重链中的至少一个CDR,并且在一些实施例中将包含单个重链和/或轻链或其部分。这些片段可以通过重组DNA技术产生,或可以通过抗原结合分子(包括完整的抗体)的酶促或化学裂解产生。
免疫功能免疫球蛋白片段包括,但不限于:scFv片段、Fab片段(Fab'、F(ab')
抗原结合分子的变体也在本发明的范围内,如可变轻链和/或可变重链,每条链与本文所述序列的氨基酸序列具有至少70%-80%、80%-85%、85%-90%、90%-95%、95%-97%、97%-99%或99%以上的同一性。在一些情况下,此类分子包括至少一个重链和一个轻链,而在其他情况下,这些变体形式含有两个相同的轻链和两个相同的重链(或其子部分)。本领域技术人员将能够使用熟知的技术如在此所陈述的确定抗原结合分子的合适的变体。在某些实施例中,本领域技术人员可以鉴定分子的合适的区域,这些区域通过靶向被认为对活性不重要的区域在不破坏活性的情况下被改变。
在某些实施例中,抗原结合分子的多肽结构基于抗体,包括但不限于:单克隆抗体、双特异性抗体、迷你抗体、结构域抗体、合成抗体(有时在本文中称为“抗体模拟物”)、嵌合抗体、人源化抗体、人抗体、抗体融合(有时在本文中称为“抗体缀合物”)、及分别地其片段。在一些实施例中,该抗原结合分子包含亲和多聚体(avimer)或由亲和多聚体组成。
在一些实施例中,单独给予DLL3的抗原结合分子。在其他实施例中,作为CAR、TCR、或其他免疫细胞的部分给予DLL3的抗原结合分子。在此类免疫细胞中,DLL3的抗原分子可以在相同启动子区域或单独的启动子的控制下。在某些实施例中,编码蛋白质制剂的基因和/或DLL3的抗原结合分子可以位于分开的载体中。
本发明进一步提供了包含DLL3的抗原结合分子以及药学上可接受的稀释剂、载体、增溶剂、乳化剂、防腐剂和/或佐剂的药物组合物。在某些实施例中,药物组合物将包括多于一种的不同的DLL3抗原结合分子。在某些实施例中,药物组合物将包括多于一种的DLL3的抗原结合分子,其中DLL3抗原结合分子结合多于一个表位。在一些实施例中,各抗原结合分子不会相互竞争结合DLL3。
在其他实施例中,可以选择用于胃肠外递送、用于吸入或用于通过消化道(如口服)递送的药物组合物。此类药物可接受的组合物的制备是在本领域技术人员的能力范围内的。在某些实施例中,使用缓冲液将组合物维持在生理pH值或稍低的pH值,通常pH值范围为从约5至约8。在某些实施例中,当考虑进行胃肠外给药时,治疗组合物可以采用无热原的、胃肠外可接受的水溶液的形式,该水溶液包含在药学上可接受的载体中(含有或不含有另外的治疗剂)的所希望的DLL3抗原结合分子。在某些实施例中,用于胃肠外注射的载体是无菌蒸馏水,DLL3的抗原结合分子处于其中,含有或不含有至少一种另外的治疗剂,配制为无菌、等渗溶液,适当保存。在某些实施例中,该制备可以涉及用可以提供用于产物(该产物可以经由储库注射来递送)的受控或持续释放的聚合物化合物(诸如聚乳酸或聚乙醇酸)、珠粒或脂质体配制所希望分子。在某些实施例中,可植入药物递送装置可用于引入所希望的分子。
在一些实施例中,该抗原结合分子用作诊断或验证工具。该抗原结合分子可用于测定样品和/或受试者中存在的DLL3的量。在一些实施例中,诊断性抗原结合分子不被中和。在一些实施例中,在测定试剂盒和/或用于检测哺乳动物组织或细胞中的DLL3的方法中使用或提供本文披露的抗原结合分子,以筛选/诊断与DLL3水平变化相关的疾病或障碍。所述试剂盒可包含结合DLL3的抗原结合分子,以及指示抗原结合分子与DLL3结合的手段和任选的DLL3蛋白(如果存在)水平。
鉴于下面的定义和描述,将进一步理解抗原结合分子。
“Fc”区包含两个重链片段,其包含抗体的CH1和CH2结构域。两个重链片段通过两个或更多个二硫键并通过CH3结构域的疏水相互作用保持在一起。
“Fab片段”包含一条轻链和一条重链的CH1和可变区。Fab分子的重链不能与另一个重链分子形成二硫键。“Fab'”片段”包含一条轻链和一条重链的一部分,该部分含有VH结构域和CH1结构域以及CH1和CH2结构域之间的区域,使得可以在两个Fab'片段的两个重链之间形成链间二硫键以形成F(ab’)
“Fv区”包含来自重链和轻链的可变区,但缺少恒定区。
“单链可变片段”(“scFv”,也称为“单链抗体”)是指Fv分子,其中重链和轻链可变区通过柔性接头连接形成单个多肽链,其形成抗原结合区。参见PCT申请WO 88/01649和美国专利号4,946,778和5,260,203,这些披露内容通过引用以其全文结合在此。
“二价抗原结合分子”包含两个抗原结合位点。在一些情况下,两个结合位点具有相同的抗原特异性。二价抗原结合分子可以是双特异性的。“多特异性抗原结合分子”是靶向多于一种抗原或表位的抗原结合分子。“双特异性”、“双重特异性”或“双功能性”抗原结合分子分别是具有两种不同抗原结合位点的杂合抗原结合分子或抗体。双特异性抗原结合分子的两个结合位点将结合两种不同的表位,其可以存在于相同或不同的蛋白质靶标上。
当解离常数(K
当抗原结合分子与一个靶标结合比与第二个靶标结合更紧密时,称其是“选择性的”。
术语“抗体”是指任何同种型的完整免疫球蛋白,或其可以与完整抗体竞争地特异性结合靶抗原的片段并且包括例如嵌合的、人源化的、完全人的和双特异性的抗体。“抗体”是如本文所定义的抗原结合分子的种类。完整抗体通常包含至少两条全长重链和两条全长轻链,但在一些情况下可包括更少的链,例如天然存在于骆驼科动物中的抗体,其可仅包含重链。抗体可以仅来自单一来源,或者可以是嵌合的,即,抗体的不同部分可以来自如下文进一步描述的两种不同的抗体。抗原结合分子、抗体或结合片段可以在杂交瘤中通过重组DNA技术或通过完整抗体的酶促或化学切割产生。除非另有说明,否则术语“抗体”除了包含两条全长重链和两条全长轻链的抗体外,还包括其衍生物、变体、片段和突变蛋白,其实例如下所述。此外,除非明确排除,抗体包括:单克隆抗体、双特异性抗体、迷你抗体、结构域抗体、合成抗体(有时在本文中称为“抗体模拟物”)、嵌合抗体、人源化抗体、人类抗体、抗体融合(有时在本文中称为“抗体缀合物”)、及分别地其片段。
可变区通常表现出通过3个高变区(即“CDR”)连接的相对保守的框架区(FR)的相同的一般结构。来自每对的两条链的CDR通常通过框架区对齐,这可以使得能够结合特定的表位。从N末端到C末端,轻链和重链可变区通常包含结构域FR1、CDR1、FR2、CDR2、FR3、CDR3和FR4。按照惯例,重链中的CDR区通常称为HC CDR1、CDR2和CDR3。轻链中的CDR区通常称为LC CDR1、CDR2和CDR3。每个结构域的氨基酸的分配通常根据Kabat的定义(Seqs ofProteins of Immunological Interest[感兴趣的免疫蛋白质的序列](NIH,Bethesda,MD(1987和1991)),或Chothia(J.Mol.Biol.[分子生物学杂志],196:901-917(1987);Chothia等人,Nature[自然],342:878-883(1989))。可以采用各种分析方法来鉴定或估计CDR区,不仅包括Kabat或Chothia,还包括AbM定义。
术语“轻链”包括全长轻链及其片段,该片段具有足够的可变区序列赋予结合特异性。全长轻链包括可变区结构域V
术语“重链”包括全长重链及其片段,该片段具有足够的可变区序列赋予结合特异性。全长重链包括可变区结构域V
术语“可变区”或“可变结构域”是指抗体的轻链和/或重链的一部分,通常包括重链中氨基末端大约120至130个氨基酸和轻链中大约100至110个氨基末端氨基酸。抗体的可变区通常确定特定抗体对其靶标的特异性。
可变性在整个抗体的可变结构域中并不均匀分布;它集中在重链可变区和轻链可变区中的每一个的子结构域中。这些子结构域称为“超变区”或“互补决定区”(CDR)。可变结构域的更保守的(即非超变)部分称为“框架”区(FRM或FR),并且为三维空间中的六个CDR提供支架以形成抗原结合表面。天然存在的重链和轻链的可变结构域各自包含四个FRM区(FR1、FR2、FR3和FR4),这四个FRM区主要采用β-片层构型,通过三个超变区连接,这三个超变区形成连接β-片层结构的环,并且在一些情况下形成β-片层结构的一部分。每条链中的超变区通过FRM紧密靠近在一起,并与来自另一条链的超变区一起有助于抗原结合位点的形成(参见Kabat等人,上述引文)。
术语“CDR”及其复数“CDR”是指其中三个构成轻链可变区(CDR-L1、CDR-L2和CDR-L3)的结合特征并且三个构成重链可变区(CDRH1、CDR-H2和CDR-H3)的结合特征的互补决定区。CDR含有大部分负责抗体与抗原特异性相互作用的残基,并且因此有助于抗体分子的功能活性:它们是抗原特异性的主要决定因素。
准确定义的CDR边界和长度受制于不同的分类和编号系统。因此,CDR可以通过Kabat、Chothia、contact或任何其他边界定义(包括本文所述的编号系统)来引用。尽管有不同的边界,但这些系统中的每一者在构成可变序列内所谓的“超变区”的方面具有一定程度的重叠。因此,根据这些系统的CDR定义可以在相对于相邻框架区的长度和边界区域中不同。参见,例如Kabat(一种基于跨物种序列变异性的方法)、Chothia(一种基于抗原-抗体复合物的晶体学研究的方法)和/或MacCallum(Kabat等人,上述引文;Chothia等人,J.MoI.Biol[分子生物学杂志],1987,196:901-917;和MacCallum等人,J.MoI.Biol[分子生物学杂志],1996,262:732)。表征抗原结合位点的还另一标准是由牛津大学分子公司(Oxfbrd Molecular)的AbM抗体建模软件使用的AbM定义。参见例如,Protein Sequenceand Structure Analysis of Antibody Variable Domains[抗体可变结构域的蛋白质序列和结构分析]在:Antibody Engineering Lab Manual[抗体工程实验室手册](编辑:Duebel,S.和Kontermann,R.,施普林格出版社(Springer-Verlag),海德尔堡)。就两种残基鉴定技术定义重叠区而非相同区而言,可以将它们组合以定义杂合CDR。然而,根据所谓的Kabat系统进行编号是优选的。
典型地,CDR形成可以分类为规范结构的环结构。术语“规范结构”是指由抗原结合(CDR)环所采用的主链构象。从比较结构研究中,已经发现六个抗原结合环中的五个仅具有有限的可用构象组库。每个规范结构可以通过多肽骨架的扭转角来表征。因此,抗体之间的对应环可能具有非常相似的三维结构,但环的大多数部分具有高的氨基酸序列可变性(Chothia和Lesk,J.MoI.Biol.[分子生物学杂志],1987,196:901;Chothia等人,Nature[自然],1989,342:877;Martin和Thornton,J.MoI.Biol[分子生物学杂志],1996,263:800)。此外,所采用的环结构与其周围的氨基酸序列之间存在关系。特定规范类别的构象由环的长度和位于环内关键位置以及保守框架内(即,环外)的氨基酸残基决定。因此,可以基于这些关键氨基酸残基的存在对特定的规范类别进行分配。
术语“规范结构”还可以包括关于抗体的线性序列的考虑因素,例如,如通过Kabat(Kabat等人,上述引文)编目的。Kabat编号方案(系统)是以一致方式对抗体可变结构域的氨基酸残基进行编号的广泛采用的标准,并且是本发明应用的优选方案,也如本文其他地方所提及。另外的结构考虑因素也可以用于确定抗体的规范结构。例如,Kabat编号未完全反映的那些差异可以通过Chothia等人的编号系统来描述,并且/或者通过其他技术(例如结晶学和二维或三维计算建模)来揭示。因此,可以将给定的抗体序列置于规范的类别中,该类别尤其允许鉴定适当的基础结构(chassis)序列(例如,基于在文库中包括多种规范结构的期望)。文献中描述了抗体氨基酸序列的Kabat编号和如由Chothia等人,上述引文所述的结构考虑因素以及其参与解释抗体结构的规范方面。不同类别免疫球蛋白的亚单位结构和三维构型在本领域中是熟知的。关于抗体结构的综述,参见Antibodies:A LaboratoryManual[抗体:实验室手册],Cold Spring Harbor Laboratory[冷泉港实验室],Harlow等人编辑,1988。
轻链的CDR3以及特别是重链的CDR3可以构成轻链可变区和重链可变区内抗原结合中最重要的决定簇。在一些抗体构建体中,重链CDR3似乎构成抗原与抗体之间主要的接触区域。其中单独改变CDR3的体外选择方案可以用于改变抗体的结合特性或确定哪些残基有助于抗原的结合。因此,CDR3典型地是抗体结合位点内分子多样性的最大来源。例如,H3可以短至两个氨基酸残基或多于26个氨基酸。
术语“中和”分别指抗原结合分子、scFv或抗体,其结合配体并防止或降低该配体的生物学效应。这可以通过例如直接阻断配体上的结合位点或通过结合配体并通过间接方式(例如配体中的结构或能量改变)改变配体结合的能力来完成。在一些实施例中,该术语还可以表示抗原结合分子,其阻止与其结合的蛋白质发挥生物学功能。
术语“靶标”或“抗原”是指能够被抗原结合分子结合的分子或分子的一部分。在某些实施例中,靶标可具有一个或多个表位。
当用于竞争相同表位的抗原结合分子的上下文中时,术语“竞争”意指抗原结合分子之间的竞争,该竞争通过其中待测试的抗原结合分子(例如,其抗体或免疫功能片段)阻止或抑制(例如,降低)参考抗原结合分子与抗原的特异性结合的测定而确定。许多类型的竞争性结合测定可用于确定一种抗原结合分子是否与另一种抗原结合分子竞争,例如:固相直接或间接放射免疫测定(RIA)、固相直接或间接酶免疫测定(EIA),夹心法竞争测定(Stahli等人,1983,Methods in Enzymology[酶学方法]9:242-253);固相直接生物素-抗生物素蛋白EIA(Kirkland等人,1986,J.Immunol.[免疫学杂志]137:3614-3619)、固相直接标记测定、固相直接标记夹心法测定(Harlow和Lane,1988,Antibodies,A LaboratoryManual,Cold Spring Harbor Press[抗体,实验室手册,冷泉港出版社]);使用1-125标记固相直接标记RIA(Morel等人,1988,Molec.Immunol.[分子免疫学]25:7-15);固相直接生物素-抗生物素蛋白EIA(Cheung,等人,1990,Virology[病毒学]176:546-552);和直接标记的RIA(Moldenhauer等人,1990,Scand.J.Immunol.[斯堪的纳维亚免疫学杂志]32:77-82)。术语“表位”包括能够被抗原结合分子结合的任何决定簇,例如本发明的scFv、抗体或免疫细胞。表位是靶向抗原的抗原结合分子结合的该抗原的区域,并且当该抗原是蛋白质时,其包括直接接触抗原结合分子的特定氨基酸。
如本文所用,术语“标记”或“标记的”是指掺入可检测标记物,例如通过掺入放射性标记的氨基酸或附着于生物素部分的多肽(其可以通过标记的抗生物素蛋白(例如含有荧光标志物或可通过光学或比色法检测的酶活性的链霉亲和素)检测)。在某些实施例中,标记或标志物也可以是治疗性的。标记多肽和糖蛋白的各种方法是本领域已知的并且可以使用。
根据本发明,本文可以包括开-关或其他类型的控制转换技术。这些技术可以使用二聚化结构域和此类结构域二聚化的任选的活化剂。这些技术包括例如Wu等人,Science[科学]2014350(6258)utilizing FKBP/Rapalog dimerization systems in certaincells[在某些细胞中使用FKBP/Rapalog二聚化系统]描述的那些技术,其内容通过引用以其整体结合在此。另外的二聚化技术描述于例如Fegan等人Chem.Rev.[化学评论]2010,110,3315-3336以及美国专利号5,830,462;5,834,266;5,869,337;和6,165,787,其内容也通过引用以其整体结合在此。另外的二聚化对可包括环孢菌素-A/亲环蛋白受体、雌激素/雌激素受体(任选使用他莫昔芬)、糖皮质激素/糖皮质激素受体、四环素/四环素受体、维生素D/维生素D受体。二聚化技术的其他实例可以在例如WO 2014/127261、WO 2015/090229、US 2014/0286987、US 2015/0266973、US 2016/0046700、美国专利号8,486,693、US 2014/0171649、和US 2012/0130076中找到,其内容通过引用以其整体进一步结合在此。
治疗方法
使用过继性免疫疗法,天然T细胞可以(i)从患者体内中移除、(ii)基因工程化以表达与至少一种肿瘤抗原结合的嵌合抗原受体(CAR)、(iii)离体扩增为更大的工程化T细胞群体、以及(iv)重新引入患者体内。参见例如美国专利号7,741,465、和6,319,494,Eshhar等人(Cancer Immunol[癌症免疫学],同上);Krause等人(同上);Finney等人(同上)。在将工程化的T细胞重新引入患者体内后,它们介导针对表达肿瘤抗原的细胞的免疫应答。参见例如Krause等人,J.Exp.Med.[实验医学杂志],第188卷,第4期,1998(619-626)。该免疫应答包括T细胞分泌IL-2和其他细胞因子,识别肿瘤抗原的T细胞的克隆扩增,以及T细胞介导的阳性靶细胞的特异性杀伤。参见Hombach等人,Journal of Immun.[免疫学杂志]167:6123-6131(2001)。
在一些方面,本发明因此包括治疗或预防与患者中不希望的和/或升高的DLL3水平相关的病症的方法,该方法包括给予有此需要的患者有效量的至少一种本文披露的分离的抗原结合分子、CAR、或TCR。
提供了用于治疗疾病或障碍(包括癌症)的方法。在一些实施例中,本发明涉及在受试者中产生T细胞介导的免疫应答,包括给予受试者有效量的本申请的工程化的免疫细胞。在一些实施例中,T细胞介导的免疫应答直接针对靶细胞或细胞。在一些实施例中,该工程化的免疫细胞包含嵌合抗原受体(CAR)、或T细胞受体(TCR)。在一些实施例中,该靶细胞是肿瘤细胞。在一些方面,本发明包括治疗或预防恶性肿瘤的方法,所述方法包括给予有此需要的受试者有效量的至少一种本文所述的分离的抗原结合分子。在一些方面,本发明包括治疗或预防恶性肿瘤的方法,所述方法包括给予有此需要的受试者有效量的至少一种免疫细胞,其中该免疫细胞包含至少一种如本文所述的嵌合抗原受体、T细胞受体和/或分离的抗原结合分子。
在一些方面,本发明包括药物组合物,其包含至少一种如本文所述的抗原结合分子和药学上可接受的赋形剂。在一些实施例中,该药物组合物进一步包含另外的活性剂。
本发明的抗原结合分子、CAR、TCR、免疫细胞等可用于治疗髓系疾病,包括但不限于肾上腺癌、肝癌、肾癌、膀胱癌、乳腺癌、胃癌、卵巢癌、宫颈癌、子宫癌、食管癌、结肠直肠癌、前列腺癌(例如,前列腺腺癌)、胰腺癌、肺癌(包括小细胞肺癌和非小细胞肺癌)、甲状腺、癌、肉瘤、胶质母细胞瘤、头颈部肿瘤、大细胞神经内分泌癌(LCNEC)、甲状腺髓样癌、胶质母细胞瘤、神经内分泌前列腺癌、(NEPC)、高等级胃肠胰癌(GEP)和恶性黑色素瘤。
应当认识到的是,CAR
还提供了用于减小受试者中肿瘤大小的方法,该方法包括给予受试者本发明的工程化的细胞,其中该细胞包含嵌合抗原受体、T细胞受体、或基于T细胞受体的嵌合抗原受体(其包含与肿瘤上的抗原结合的抗原结合分子)。在一些实施例中,该受试者患有实体瘤或血液恶性肿瘤,例如淋巴瘤或白血病。在一些实施例中,将该工程化的细胞递送至瘤床。在一些实施例中,该癌症存在于受试者的骨髓中。
在一些实施例中,该工程化的细胞是自体T细胞。在一些实施例中,该工程化的细胞是同种异体T细胞。在一些实施例中,该工程化的细胞是异源T细胞。在一些实施例中,本申请的工程化的细胞在体内转染或转导。在其他实施例中,该工程化的细胞离体转染或转导。
该方法可以进一步包括给予一种或多种化学治疗剂。在某些实施例中,该化学治疗剂是淋巴细胞耗尽(预调节)化学治疗剂。有益的预调节治疗方案以及相关的有益生物标志物描述于美国临时专利申请62/262,143和62/167,750中,其通过引用整体并入本文。这些描述了例如调节需要T细胞疗法的患者的方法,该方法包括给予患者指定的有益剂量的环磷酰胺(200mg/m
在其他实施例中,抗原结合分子、转导的(或以其他方式工程化的)细胞(例如CAR或TCR)和化学治疗剂各自以有效量给予以治疗受试者的疾病或病症。
在某些实施例中,本文披露的包含表达CAR的免疫效应细胞的组合物可与任意数量的化学治疗剂联合给予。化学治疗剂的实例包括烷基化剂,诸如噻替哌和环磷酰胺(CYTOXAN
在一些实施例中,该化学治疗剂在给予工程化的细胞或核酸的同一时间或一周内给予。在其他实施例中,该化学治疗剂在给予工程化的细胞或核酸后的1至4周或1周至1个月、1周至2个月、1周至3个月、1周至6个月、1周至9个月或1周至12个月给予。在其他实施例中,该化学治疗剂在给予细胞或核酸之前至少1个月给予。在一些实施例中,该方法进一步包括给予两种或更多种化学治疗剂。
多种另外的治疗剂可以与本文所述的组合物结合使用。例如,潜在有用的另外的治疗剂包括PD-1抑制剂,例如纳武单抗
艾卢替尼
在另外的实施例中,包含含有CAR的免疫的组合物可以与抗炎剂一起给予。抗炎剂或药物包括但不限于类固醇和糖皮质激素(包括倍他米松、布地奈德、地塞米松、醋酸氢化可的松、氢化可的松、氢化可的松、甲基强的松龙、泼尼松龙、泼尼松、曲安奈德)、非甾体类抗炎药(NSAIDS)(包括阿司匹林、布洛芬、萘普生、甲氨蝶呤、柳氮磺胺吡啶、来氟米特、抗TNF药物、环磷酰胺和霉酚酸酯。示例性NSAID包括布洛芬、萘普生、萘普生钠、Cox-2抑制剂和唾液酸盐。示例性镇痛药包括对乙酰氨基酚、羟考酮、盐酸丙氧芬的曲马多。示例性糖皮质激素包括可的松、地塞米松、氢化可的松、甲基强的松龙、泼尼松龙或泼尼松。示例性生物应答调节剂包括直接针对细胞表面标志物(例如,CD4、CD5等)的分子,细胞因子抑制剂例如TNF拮抗剂(例如依那西普
在某些实施例中,本文所述的组合物与细胞因子结合给药。如本文所用,“细胞因子”意指由一个细胞群释放的蛋白质,其作为细胞间介质作用于另外细胞。细胞因子的实例是淋巴因子、单核因子和传统的多肽激素。细胞因子中包括生长激素,如人生长激素,N-甲硫氨酰人生长激素和牛生长激素;甲状旁腺激素;甲状腺素;胰岛素;胰岛素原;松弛素;松弛素原;糖蛋白激素,如促卵泡激素(FSH)、促甲状腺激素(TSH)和促黄体激素(LH);肝脏生长因子(HGF);纤维母细胞生长因子(FGF);催乳素;胎盘催乳素;苗勒抑制物质;小鼠促性腺激素相关肽;抑制素;激活素;血管内皮生长因子;整合素;血小板生成素(TPO);神经生长因子(NGFs)如NGF-β;血小板生长因子;转化生长因子(TGFs)如TGF-α和TGF-β;胰岛素生长因子I和II;促红细胞生成素(EPO);骨诱导因子;干扰素如干扰素-α、β、和-γ;集落刺激因子(CSF)如巨噬细胞-CSF(M-CSF);粒细胞-巨噬细胞-CSF(GM-CSF);和粒细胞-CSF(G-CSF);白介素(IL)如IL-1、IL-1α、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、IL-9、IL-10、IL-11、IL-12;IL-15,肿瘤坏死因子如TNF-α或TNF-β;和其他多肽因子,包括LIF和kit配体(KL)。如本文所用,术语细胞因子包括来自天然来源或来自重组细胞培养物的蛋白质,以及天然序列细胞因子的生物活性等价物。
在一些方面,本发明包括以小于100pM的K
制备方法
可以使用多种已知技术制备根据本发明的多核苷酸、多肽、载体、抗原结合分子、免疫细胞、组合物等。
在本文所述的免疫细胞的体外操作或遗传修饰之前,可以从受试者获得细胞。在一些实施例中,免疫细胞包含T细胞。T细胞可以从许多来源获得,包括外周血单核细胞(PBMC)、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染部位的组织、腹水、胸腔积液、脾组织和肿瘤。在某些实施例中,T细胞可以使用本领域技术人员已知的任何数量的技术(例如FICOLL
在某些实施例中,通过裂解红细胞和耗尽单核细胞从PBMC分离T细胞,例如,使用通过PERCOLL
可以直接使用PBMC用于使用本文所述的方法在免疫细胞情况下的遗传修饰(如CAR或TCR)。在某些实施例中,在分离PBMC后,可以进一步分离T淋巴细胞,并且可以在遗传修饰和/或扩增之前或之后将细胞毒性和辅助性T淋巴细胞分选为初始、记忆和效应T细胞亚群。
在一些实施例中,通过鉴定与这些类型的CD8
免疫细胞,例如T细胞,可以在使用已知方法分离后进行遗传修饰,或者免疫细胞可以在进行遗传修饰之前在体外活化和扩增(或在祖细胞的情况下分化)。在另一个实施例中,免疫细胞,例如T细胞,用本文所述的嵌合抗原受体进行遗传修饰(例如,用包含一个或多个编码CAR的核苷酸序列的病毒载体转导),然后在体外活化和/或扩增。用于激活和扩增T细胞的方法是本领域已知的,并且描述于例如美国专利号6,905,874;和美国专利号6,867,041;美国专利号6,797,514;和PCT WO 2012/079000,其内容通过引用整体并入本文。通常,此类方法包括在具有适当细胞因子例如IL-2的培养基中使PBMC或分离的T细胞与刺激剂和共刺激剂接触,例如抗CD3和抗CD28抗体,通常附着于珠子或其他表面。附着于相同珠子的抗CD3和抗CD28抗体充当“替代”抗原呈递细胞(APC)。一个例子是
在其他实施例中,可以用饲养细胞和适当的抗体和细胞因子使用例如如下所述的那些的方法激活和刺激T细胞增殖:美国专利号6,040,177;美国专利号5,827,642;和WO2012129514,其内容通过引用整体并入本文。
用于制备本发明的构建体和工程化的免疫细胞的某些方法描述于PCT申请PCT/US15/14520中,其内容通过引用整体并入本文。制备构建体和细胞的另外的方法可以在美国临时专利申请号62/244036中发现,其内容通过引用整体并入本文。
应当认识到的是,PBMC可以进一步包括其他细胞毒性淋巴细胞,例如NK细胞或NKT细胞。携带如本文披露的嵌合受体的编码序列的表达载体可以引入人供体T细胞、NK细胞或NKT细胞的群。携带表达载体的成功转导的T细胞可以使用流式细胞术分选以分离CD3阳性T细胞,然后除了使用抗CD3抗体和IL-2或本文其他地方描述的本领域已知的其他方法的细胞激活外还进一步繁殖以增加这些表达CAR的T细胞的数量。使用标准程序用于冷藏保存表达CAR的T细胞,用于储存和/或制备用于在人受试者中使用。在一个实施例中,T细胞的体外转导、培养和/或扩增在不存在非人动物衍生产物(例如胎牛血清(fetal calf serum)和胎牛血清(fetal bovine serum))的情况下进行。
为了克隆多核苷酸,可以将载体导入宿主细胞(分离的宿主细胞)中以允许载体自身复制,从而扩增其中含有的多核苷酸的拷贝。克隆载体可含有序列组分,这些序列组分通常包括但不限于复制起点、启动子序列、转录起始序列、增强子序列和选择标志物。这些元件可以由本领域普通技术人员适当选择。例如,可以选择复制起点以促进载体在宿主细胞中的自主复制。
在某些实施例中,本披露提供了含有本文提供的载体的分离的宿主细胞。含有载体的宿主细胞可用于表达或克隆载体中含有的多核苷酸。合适的宿主细胞可包括但不限于原核细胞、真菌细胞、酵母细胞或更高等真核细胞,如哺乳动物细胞。用于此目的的合适的原核细胞包括但不限于真细菌,例如革兰氏阴性或革兰氏阳性生物,例如肠杆菌科(Enterobacteriaceae)像埃希氏杆菌属(Escherichia),例如大肠杆菌(E.coli)、肠杆菌属(Enterobacter)、欧文氏菌属(Erwinia)、克雷白氏杆菌属(Klebsiella)、变形杆菌属(Proteus)、沙门氏菌属(Salmonella),例如鼠伤寒沙门氏菌(Salmonella typhimurium)、沙雷氏菌属(Serratia),例如如粘质沙雷氏菌(Serratia marcescans)、和志贺氏杆菌(Shigella)、还有芽孢杆菌属(Bacillus),例如枯草芽孢杆菌(B.subtilis)和地衣芽孢杆菌(B.licheniformis)、假单胞菌属(Pseudomonas)(如铜绿假单胞菌)、和链霉菌属(Streptomyces)。
可以使用本领域已知的任何合适的方法将载体引入宿主细胞,这些方法包括但不限于DEAE-葡聚糖介导的递送、磷酸钙沉淀法、阳离子脂质介导的递送、脂质体介导的转染、电穿孔、基因枪法、受体介导的基因递送、由聚赖氨酸、组蛋白、壳聚糖和肽介导的递送。用于表达目的载体的细胞的转染和转化的标准方法是本领域熟知的。在另外的实施例中,不同表达载体的混合物可用于遗传修饰供体免疫效应细胞群,其中每个载体编码如本文披露的不同CAR。得到的转导的免疫效应细胞形成混合的工程化的细胞群,其中一部分工程化的细胞表达多于一种不同的CAR。
在一个实施例中,本发明提供了一种储存表达靶向DLL3蛋白的CAR或TCR的基因工程化的细胞的方法。这涉及冷藏保存免疫细胞,使细胞在解冻后保持活力。表达CAR的一部分免疫细胞可以通过本领域已知的方法冷藏保存,以提供此类细胞的永久来源,用于将来治疗患有恶性肿瘤的患者。需要时,冷藏保存的转化免疫细胞可以解冻、生长和扩增以获得更多此类细胞。
如本文所用,“冷藏保存”是指通过冷却至零下的温度来保存细胞,例如(通常)77开尔文或-196℃(液氮的沸点)。低温保护剂通常在零下的温度下使用,以保护细胞免受因低温冷冻或升温至室温而受到损坏。冷藏保存剂和最佳冷却速率可以防止细胞损伤。根据本发明可以使用的低温保护剂包括但不限于:二甲亚砜(DMSO)(Lovelock&Bishop,Nature[自然](1959);183:1394-1395;Ashwood-Smith,Nature[自然](1961);190:1204-1205)、甘油、聚乙烯吡咯烷酮(Rinfret,Ann.N.Y.Acad.Sci.[纽约科学院年报](1960);85:576)、和聚乙二醇(Sloviter&Ravdin,Nature[自然](1962);196:48)。优选冷却速度为1℃-3℃/分钟。
术语“基本上纯的”用于表示给定组分以高水平存在。该组分理想地是组合物中存在的主要组分。优选其以多于30%、多于50%、多于75%、多于90%、或甚至多于95%的水平存在,所述水平关于正在考虑的总组合物以干重/干重进行确定。以非常高的水平(例如,大于90%、大于95%或大于99%的水平)的该组分可被视为“纯的形式”。本发明的生物活性物质(包括多肽、核酸分子、抗原结合分子、部分)可以以基本上不含一种或多种污染物的形式提供,该物质可能以其他方式与之相关。当组合物实质上不含给定的污染物时,污染物将处于很低的水平(例如,以如上所述的干重/干重计小于10%、小于5%或小于1%的水平)。
在一些实施例中,通过首先从其培养基中收获细胞,然后将细胞洗涤并浓缩在适于给药的培养基和容器系统(“药学上可接受的”载体)中以治疗有效量来配制细胞。合适的输注介质可以是任何等渗培养基配制品,通常是生理盐水,Normosol
组合物中所希望的治疗量的细胞通常为至少2个细胞(例如,至少1个CD8
本发明的表达CAR的细胞群可以单独给予,或作为药物组合物与稀释剂和/或与其他组分如IL-2或其他细胞因子或细胞群组合给予。本发明的药物组合物可包含表达CAR或TCR的细胞群,如本文所述的T细胞,与一种或多种药学上或生理学上可接受的载体、稀释剂或赋形剂的组合。此类组合物可包含缓冲液,例如中性缓冲盐水、磷酸盐缓冲盐水等;碳水化合物,如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸,如甘氨酸;抗氧化剂;螯合剂,如EDTA或谷胱甘肽;佐剂(例如氢氧化铝);和防腐剂。优选将本发明的组合物配制为用于静脉内给药。
药物组合物(溶液、悬浮液等)可包括下列中的一种或多种:无菌稀释剂,例如注射用水、盐溶液,优选生理盐水、林格氏溶液、等渗氯化钠、固定油,例如可用作溶剂或悬浮介质的合成的单甘油酯或二甘油酯、聚乙二醇、甘油、丙二醇或其他溶剂;抗菌剂,如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,如抗坏血酸或亚硫酸氢钠;螯合剂,如乙二胺四乙酸;缓冲剂,如乙酸盐、柠檬酸盐或磷酸盐;以及用于调节张力的试剂,如氯化钠或葡萄糖。胃肠外制剂可以被封装在由玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。可注射药物组合物优选是无菌的。
应当认识到的是,通过用自杀基因转导免疫细胞(含有一种或多种CAR或TCR)可以使不良事件最小化。还可能需要将诱导型“开启”或“加速器”开关掺入免疫细胞中。合适的技术包括在用本发明的CAR构建体转导细胞之前、之后或同时使用诱导型胱天蛋白酶-9(美国申请2011/0286980)或胸苷激酶。用于引入自杀基因和/或“开启”开关的另外的方法包括TALENS、锌指、RNAi、siRNA、shRNA、反义技术和本领域已知的其他技术。
应理解的是,本文的描述都只是示例性和说明性的,并且不限制如所要求的本发明。在本申请中,除非另外特别说明,单数的使用包括复数。
在此使用的章节标题只是出于组织的目的,而不应解释为限制所描述的主题内容。在本申请中所引用的所有文件或文件的部分,包括但不局限于专利、专利申请、论文、书籍、和专著,都特此出于任何目的通过引用将其全部内容清楚地结合在此。如根据本披露使用的,除非另外指明,否则以下术语应当被理解为具有以下含义:
在本申请中,“或”的使用意指“和/或”,除非另外说明。此外,术语“包括(including)”、以及其他形式如“包括(includes)”和“包括(included)”的使用不是限制性的。同样,术语如“元件”或“组分”涵盖包含一个单位的元件和组分以及包含超过一个亚单位的元件和组分两者,除非另外明确说明。
术语“DLL3活性”包括DLL3的任何生物学效应。在某些实施例中,DLL3活性包括DLL3与底物或受体相互作用或结合的能力。
术语“多核苷酸”、“核苷酸”或“核酸”包括单链和双链核苷酸聚合物。包含多核苷酸的核苷酸可以是核糖核苷酸和脱氧核糖核苷酸或任一类型核苷酸的修饰形式。所述修饰包括碱基修饰(例如溴尿嘧啶核苷和肌苷衍生物)、核糖修饰(例如2',3'-双脱氧核糖)和核苷酸间连接修饰(例如硫代磷酸、二硫代磷酸、硒代磷酸、二硒代磷酸、阿尼洛硫代磷酸(phosphoro-anilothioate)、阿尼洛磷酸(phoshoraniladate)和磷酰胺)。
术语“寡核苷酸”是指包含200个或更少核苷酸的多核苷酸。寡核苷酸可以是单链或双链的,例如用于构建突变基因。寡核苷酸可以是正义或反义寡核苷酸。寡核苷酸可包括用于检测测定的标记,包括放射性标记、荧光标记、半抗原或抗原标记。寡核苷酸可用作例如PCR引物、克隆引物或杂交探针。
术语“控制序列”是指可以影响与其连接的编码序列的表达和加工的多核苷酸序列。此类控制序列的性质可取决于宿主生物体。在具体的实施例中,原核生物的控制序列可包括启动子、核糖体结合位点和转录终止序列。例如,真核生物的控制序列可包括启动子,其包含转录因子、转录增强子序列和转录终止序列的一个或多个识别位点。“控制序列”可包括前导序列(信号肽)和/或融合伴侣序列。
如本文所用,“可操作地连接”意指应用该术语的组分处于允许它们在合适条件下实现其固有功能的关系中。
术语“载体”意指用于将蛋白质编码信息转移到宿主细胞中的任何分子或实体(例如,核酸、质粒、噬菌体或病毒)。术语“表达载体”或“表达构建体”是指适合转化宿主细胞的载体,并含有指导和/或控制(与宿主细胞结合)一个或多个与其可操作地连接的异源编码区表达的核酸序列。表达构建体可包括但不限于影响或控制转录、翻译的序列,并且如果存在内含子,则影响与其可操作地连接的编码区的RNA剪接。
术语“宿主细胞”是指已经用核酸序列转化或能够被转化的细胞,从而表达目的基因。该术语包括亲本细胞的后代,无论后代是否与原始亲本细胞在形态上或遗传构成方面相同,只要存在目的基因即可。
术语“转化”是指细胞遗传特性的改变,当细胞被修饰以含有新的DNA或RNA时,则该细胞就被转化了。例如,细胞经由转染、转导或其他技术引入新的遗传材料,由其原始状态进行基因修饰,则该细胞就被转化了。转染或转导后,转化的DNA可以通过物理整合进入细胞染色体与细胞的DNA重组,或者可以作为一个不被复制的游离元件被暂时维持,或者可以作为质粒独立复制。当转化的DNA随着细胞的分裂而复制时,细胞被认为已经“稳定地转化”了。
术语“转染”是指通过细胞吸收外来或外源性DNA。许多转染技术在本领域中是熟知的,并在本文中披露。参见例如Graham等人,1973,Virology[病毒学]52:456;Sambrook等人,2001,Molecular Cloning:A Laboratory Manual[分子克隆:实验室手册],同上;Davis等人,1986,Basic Methods in Molecular Biology[分子生物学基本方法],思唯尔(Elsevier);Chu等人,1981,Gene[基因]13:197。
术语“转导”是指外来DNA经由病毒载体被引入细胞的过程。参见Jones等人,(1998).Genetics:principles and analysis.[遗传学:原理与分析。]波士顿:Jones&Bartlett Publ.[Jones&Bartlett出版社]。
术语“多肽”或“蛋白质”是指具有蛋白质的氨基酸序列的大分子,其包括天然序列的一个或多个氨基酸的缺失、添加和/或取代。术语“多肽”和“蛋白质”特别涵盖DLL3抗原结合分子、抗体或抗原结合蛋白的一个或多个氨基酸被缺失、添加和/或取代的序列。术语“多肽片段”是指与全长天然蛋白质相比具有氨基末端缺失、羧基末端缺失和/或内部缺失的多肽。与天然蛋白质相比,此类片段还可含有修饰的氨基酸。有用的多肽片段包括抗原结合分子的免疫功能片段。有用的片段包括但不限于一个或多个CDR区、重链和/或轻链的可变结构域、抗体链的其他部分的一部分等。
术语“分离的”是指(i)不含至少一些通常与其一起被发现的蛋白质,(ii)基本上不含来自相同来源的其他蛋白质,例如来自相同物种,(iii)与至少约50%的在自然界与其相关的多核苷酸、脂质、碳水化合物或其他物质分离,(iv)可操作地与在自然界与其不相关的多肽相关(通过共价或非共价相互作用),或(v)在自然界中不存在。
多肽的“变体”(如抗原结合分子或抗体)包含氨基酸序列,其中相对于另一个多肽序列,该氨基酸序列中插入、缺失和/或取代一个或多个氨基酸残基到。变体包括融合蛋白。
术语“同一性”意指两个或更多个多肽分子或两个或更多个核酸分子的序列之间的通过比对和比较序列来确定的关系。“百分比同一性”意指比较的分子中氨基酸或核苷酸之间相同残基的百分比,并且是基于比较的最小分子的大小来计算的。在这些计算中,优选通过特定的数学模型或计算机程序(即“算法”)解决的空位比对(如果有的话)。
为了计算百分比同一性,被比较的序列通常以给出序列之间最大匹配的方式比对。可用于确定百分比同一性的计算机程序的一个实例是GCG程序包,其包括GAP(Devereux等人,1984,Nucl.Acid Res.[核酸研究]12:387;Genetics Computer Group,Universityof Wisconsin,Madison,Wis.[遗传学计算机组,威斯康星大学,麦迪逊,威斯康星州])。计算机算法GAP是用来比对其百分比序列同一性待确定的两个多肽或多核苷酸。比对序列以使它们各自的氨基酸或核苷酸达到最佳匹配(提供算法确定的“匹配范围”)。在某些实施例中,本算法使用标准比较矩阵(参见Dayhoff等人,1978,Atlas ofProtein Sequence andStructure[蛋白质序列和结构图谱]5:345-352用于PAM 250比较矩阵;Henikoff等人,1992,Proc.Natl.Acad.Sci.U.S.A.[美国国家科学院院刊]89:10915-10919用于BLOSUM 62比较矩阵)。
如本文所用,二十种常规(如天然存在的)氨基酸及其缩写遵循常规用法。参见Immunology-A Synthesis[免疫学-合成](第2版,Golub和Gren编辑,席娜欧出版公司(Sinauer Assoc.),桑德兰,Mass.(1991)),出于任何目的将其通过引用结合在此。二十种常规氨基酸的立体异构体(如D-氨基酸)、α-,α-二取代氨基酸、N-烷基氨基酸、乳酸等非天然氨基酸以及其他非常规氨基酸也可作为本发明多肽的合适组分。非常规氨基酸的实例包括:4-羟基脯氨酸、γ-羧基谷氨酸、ε-N,N,N-三甲基赖氨酸、e-N-乙酰基赖氨酸、O-磷酸丝氨酸、N-乙酰丝氨酸、N-甲酰基甲硫氨酸、3-甲基组氨酸、5-羟基赖氨酸、σ-N-甲基精氨酸、和其他类似的氨基酸和亚氨基酸(例如,4-羟基脯氨酸)。本文使用的多肽表示法中,按照标准用法和惯例,左手方向是氨基末端方向,右手方向是羧基末端方向。
保守氨基酸取代可以涵盖非天然存在的氨基酸残基,这些残基通常是通过化学肽合成而非生物系统合成而掺入。这些包括肽模拟物和氨基酸部分的其他反向或逆向形式。基于共同的侧链特性可以将天然存在的残基分类:
a)疏水性:正亮氨酸、Met、Ala、Val、Leu、Ile;
b)中性亲水性:Cys、Ser、Thr、Asn、Gln;
c)酸性:Asp、Glu;
d)碱性:His、Lys、Arg;
e)影响链取向的残基:Gly、Pro;以及
f)芳香族:Trp、Tyr、Phe。
例如,非保守取代可以涉及到用这些类之一的成员交换另一个类中的成员。例如,此类被取代的残基可以被引入至与非人抗体同源的人抗体的区域,或者引入至分子的非同源区域。
在改变抗原结合分子、工程化的T细胞的共刺激结构域或激活结构域时,可根据某些实施例考虑氨基酸的亲水指数。根据每种氨基酸的疏水性和荷电特性,确定了其亲水指数。它们是:异亮氨酸(+4.5);缬氨酸(+4.2);亮氨酸(+3.8);苯丙氨酸(+2.8);半胱氨酸/胱氨酸(+2.5);蛋氨酸(+1.9);丙氨酸(+1.8);甘氨酸(-0.4);苏氨酸(-0.7);丝氨酸(-0.8);色氨酸(-0.9);酪氨酸(-1.3);脯氨酸(-1.6);组氨酸(-3.2);谷氨酸(-3.5);谷氨酰胺(-3.5);天冬氨酸(-3.5);天冬酰胺(-3.5);赖氨酸(-3.9);和精氨酸(-4.5)。参见Kyte等人,J.Mol.Biol.[分子生物学杂志],157:105-131(1982)。已知某些氨基酸可以取代具有相似的亲水指数或得分的其他氨基酸,并且仍然保留相似的生物活性。本领域还应理解,可以基于亲水性有效地进行相似氨基酸的取代,特别是在由此产生的生物学功能蛋白质或肽旨在用于如在本发明的情况中的免疫学实施例时。示例性氨基酸取代在表2中列出。
术语“衍生物”意指包括除了氨基酸(或核酸)的插入、缺失或置换以外的化学修饰的分子。在某些实施例中,衍生物包含共价修饰,包括但不限于与聚合物、脂类或其他有机或无机部分的化学键合。在某些实施例中,经化学修饰的抗原结合分子比未经化学修饰的抗原结合分子具有更大的循环半衰期。在一些实施例中,将衍生物抗原结合分子共价修饰使其包括一个或多个水溶性聚合物附着体,包括但不限于聚乙二醇、聚氧乙烯二醇或聚氧丙烯二醇。
肽类似物在医药工业中作为非肽类药物被广泛应用,其性质与模板肽类似。这些类型的非肽化合物被称为“肽的模拟物(peptide mimetics)”或“肽模拟物(peptidomimetics)”。Fauchere,J.,Adv.Drug Res.[药物研究前沿],15:29(1986);Veber&Freidinger,TINS[神经科学发展],第392页(1985);以及Evans等人,J.Med.Chem.[药物化学期刊],30:1229(1987),出于任何目的将其通过引用结合在此。
术语“治疗有效量”意指确定在哺乳动物体内产生治疗应答的DLL3抗原结合分子的量。此类治疗有效量是本领域普通技术人员很容易确定的。
术语“患者”和“受试者”可互换地使用,并包括人和非人动物受试者,以及那些具有正式诊断的障碍的受试者、那些没有正式确认的障碍的受试者、那些接受医疗救助的受试者、那些有发育障碍风险的受试者等。
术语“治疗”和“治疗”包括治疗性治疗、预防性治疗,以及应用于降低受试者罹患障碍或其他危险因素的风险。治疗不需要障碍的完全治愈,并涵盖减少症状或潜在危险因素的实施例。术语“预防”并不要求100%事件消除的可能性。相反,它表示在化合物或方法存在的情况下,事件发生的可能性已经降低。
标准技术可用于重组DNA、寡核苷酸合成、以及组织培养和转化(如电穿孔、脂质转染)。酶促反应和纯化技术可以根据制造商的说明书进行,或如本领域中通常所实现或如在此所描述进行的。前述技术和方法一般是根据本领域中众所周知的常规方法并且如本说明书全篇所引用并且论述的不同通用和更特定的参考文献中所描述来进行。参见例如,Sambrook等人,Molecular Cloning:A Laboratory Manual[分子克隆:实验室手册](第2版,冷泉港实验室出版社(Cold Spring Harbor Laboratory Press),冷泉港(Cold SpringHarbor),纽约州(1989)),出于任何目的将其通过引用结合在此。
如下序列将进一步说明本发明。
LDNEKSNGTI IHVKGKHLCP SPLFPGPSKP
FWVLVVVGGV LACYSLLVTV AFIIFWV
RSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRS
IEVMYPPPYL DNEKSNGTII HVKGKHLCPS PLFPGPSKP
克隆1H2.1 LC CDR1 AA:RASQSVSSSYLA(SEQ ID NO:47)
克隆1H2.1 LC CDR2 AA:GASTRAT(SEQ ID NO:48)
克隆1H2.1 LC CDR3 AA:QQYGTSPLT(SEQ ID NO:49)
克隆8D2 LC AA CDR1:QASQDIRNYLN(SEQ ID NO:57)
人DLL3同种型2NM_203486AA(587个氨基酸)
KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL(SEQ ID NO:38)
RRDQRLPPDAHKPPGGGSFRTPIQEEQADAHSTLAKI(SEQ ID NO:39)
通过引用结合
本说明书中提到的所有出版物、专利和专利申请都通过引入结合在此,如同每一单独的出版物、专利或专利申请具体且单独地通过引入结合在此。然而,在此的参考文献的引用不能理解为承认此类参考文献是本发明的现有技术。通过引用结合的参考文献中提供的任何定义或术语与本文提供的术语和讨论发生冲突的程度上,以为本术语和定义为准。
等效物
前述书面说明书被认为满足能使本领域技术人员实践本发明。本发明的某些优选实施例中详细描述了前述描述和实例并描述了诸位发明人考虑的最佳模式。然而,将领会到的是,不论前述事项可以在文中看起来如何详尽,本发明可以按多种方式进行实践,并且应该依据所附权利要求书及其任何等效物来解释。
以下实例,包括进行的实验和实现的结果,仅提供解释说明目的,并且不应被解释为限制本发明。
实例1
使用含有不同CAR构建体的第三代慢病毒转移载体,以及ViraPower慢病毒包装混合物(生命技术公司(Life Technologies)),来生成慢病毒上清液。简言之,通过混合15μg的DNA和22.5μl的聚乙烯亚胺(波利塞斯公司(Polysciences),1mg/ml)于600μl的OptiMEM培养基中来产生转染混合物。将混合物在室温下孵育5分钟。同时,将293T细胞(ATCC)蛋白酶化、计数,将共计10x 106个细胞以及转染混合物置于T75烧瓶中。转染后三天,收集上清液并通过0.45μm过滤器过滤并储存在-80℃下直到使用。根据制造商的说明书,使用ficoll-paque密度离心法从健康供体leukopaks(Hemacare)中分离出PBMC。使用OKT3(50ng/ml,美天旎生物技术公司(Miltenyi Biotec))于R10培养基+IL-2(300IU/ml,
实例2
为了检测慢病毒介导的DLL3 CAR T细胞的溶细胞活性,将效应细胞与靶细胞按1:1的E:T比在R10培养基中培养。共培养十六和四十小时后,通过Luminex(EMD密理博公司(EMD Millipore))分析上清液,并通过被CD3-阴性细胞吸收的碘化丙啶(PI)的流式细胞术评估靶细胞存活率。来自健康供体的慢病毒介导的CAR T细胞的平均溶细胞活性如图2所示(EoL1细胞为对照,H82和EoL1-DLL3在表面表达DLL3),并且来自健康供体的CAR T细胞的细胞因子产生如图3所示。
实例3
为了评估对表达DLL3的靶细胞应答的CAR T细胞增殖,在R10培养基中以1:1的E:T比与靶细胞共培养前,用CFSE标记T细胞。五天后,通过CFSE稀释的流式细胞术评估T细胞增殖情况(图4)。DLL3 CAR T细胞的增殖情况如图5所示。
实例4
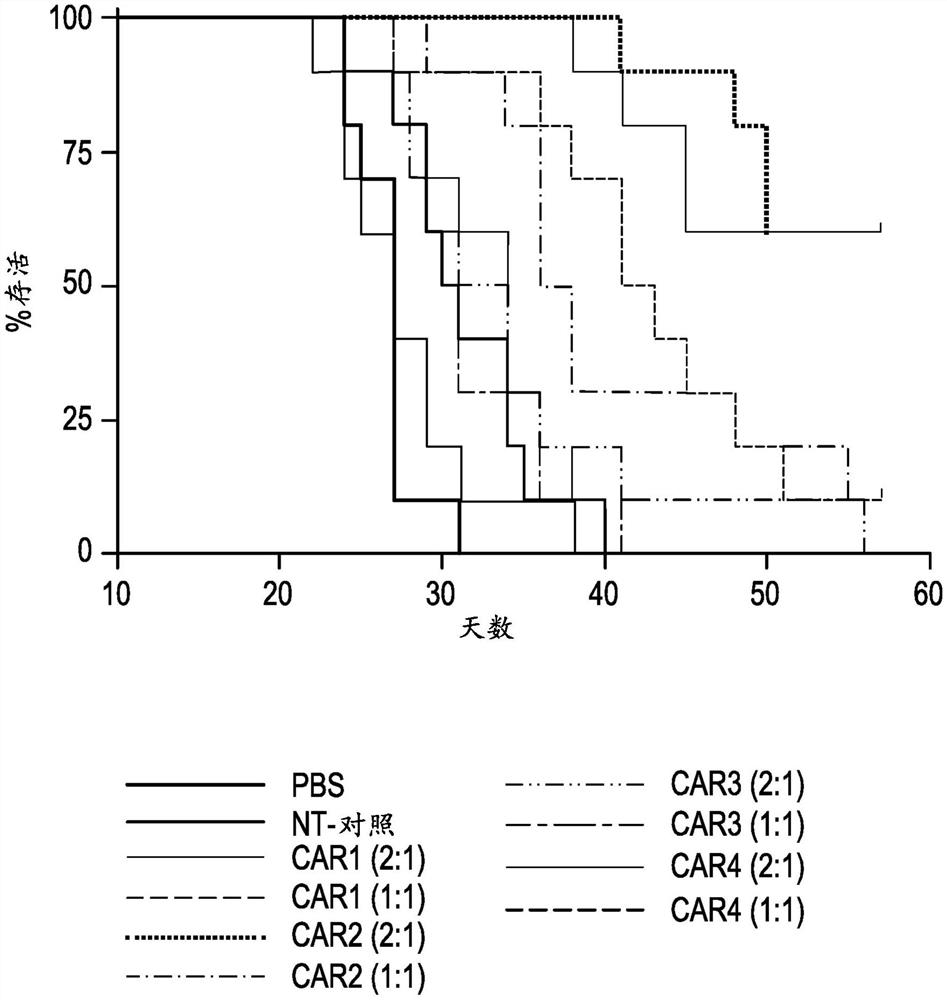
为了检测体内的抗肿瘤活性,产生了用于人SCLC的异源模型的DLL3 CAR T细胞。将荧光素酶标记的SHP-77细胞(2 x 106个/动物)静脉内注射到5至6周龄的NSG雌性小鼠体内。6天后,静脉内注射6x106 T细胞(约50%CAR+)于200μl PBS中的溶液并使用生物发光成像每周测量动物的肿瘤负荷。如图6所示,注射DLL3 CAR T细胞显著降低了所有检测时间点的肿瘤负荷(nt=未转染对照;CAR1=1H2.1-C28T-CD28-CD3ζ;CAR2=1H2.1-C28T-4-1BB-CD3ζ;CAR3=1H2.1-C8k-CD28-CD3ζ;CAR4=1H2.1-C8k-4-1BB-CD3ζ)。如图6所示,在存活分析(注射表达1H2-CD28T或1H2-4-1BB的CAR T细胞比接受模拟转导细胞的动物具有显著的存活优势)中进一步证实了这一点。
- DLL3的嵌合受体及其使用方法
- 抗DLL3嵌合抗原受体及其用途
