包括重构固氮微生物的农业组合物
文献发布时间:2023-06-19 10:46:31
本申请案主张2018年6月27日提交的第62/690,621号美国临时申请案和2019年2月21日提交的第62/808,693号美国临时申请案的优先权,这些申请的全文出于所有目的通过引用并入本文中。
与本申请一起以电子方式提交的文本文件的内容的全文通过引用并入本文中:序列表的计算机可读格式副本,文件名:PIVO_004_02WO_SeqList_ST25.txt,创建日期,2019年6月18日,文件大小约578千字节。
背景技术
联合国粮食与农业组织(United Nations'Food and AgricultureOrganization)预计,到2050年,粮食总产量必须提高70%以满足不断增长的人口的需求,这是一项挑战,因许多因素而更加严重,包含:淡水资源减少、对耕地的竞争加剧、能源价格上涨、投入成本提高以及作物可能需要适应更干、更热和更加极端的全球气候的压力。
当前农业实践未经很好地装备以满足对粮食生产的此增长的需求,同时平衡由增加的农业强度造成的环境影响。
满足全球粮食需求所需的主要农业输入之一是氮肥。然而,用于生产氮肥的当前工业标准是称为哈伯-博世法(Haber-Bosch process)的人工固氮方法,其通过在高温和高压下使用金属催化剂与氢气(H
与合成哈伯-博世法相比,某些生物系统已进化以固定大气氮。这些系统利用称为固氮酶的酶(所述固氮酶催化N
因此,绝大部分现代中耕作物农业利用经由资源密集型且对环境有害的哈伯-博世法产生的氮肥。举例来说,USDA指示平均美国玉米农民通常每英亩施用130与200lb之间的氮(146到224kg/ha)。此氮不仅在资源密集型合成方法中产生,而且通过繁重的机器穿过/冲击田地的土壤、燃烧石油且需要数小时的人力来施加。
此外,由工业哈伯-博世法产生的氮肥并未被目标作物很好地利用。降雨、径流、加热、挥发和土壤微生物组降解所施用的化肥。这不仅相当于浪费了金钱,而且还增加了污染而不是收获产量。为此目的,美国政府已计算出在作物可利用其之前几乎80%的肥料损失。因此,现代农业肥料的生产和输送不仅对环境有害,而且其效率极低。
为了满足世界增长的粮食供应需求,同时还平衡资源利用且对环境系统提供最小的影响,迫切需要更好的固氮和输送至植物的方法。
发明内容
在一些方面,本发明大体上涉及种子处理剂组合物,其包括:(a)多个非属间重塑细菌,其具有至少约1.0×10
在一些方面,农药是杀真菌剂。在一些方面,农药是选自由以下组成的群组的杀真菌剂:咯菌腈(fludioxonil)、甲霜灵(metalaxyl)、精甲霜灵(mefenoxam)、嘧菌酯(azoxystrobin)、噻菌灵(thiabendazole)、种菌唑(ipconazole)、戊唑醇(tebuconazole)、丙硫菌唑(prothioconazole)和其组合。
在一些方面,农药是杀虫剂。在一些方面,农药是新烟碱类杀虫剂。在一些方面,农药是选自由以下组成的群组的杀虫剂:吡虫啉(imidacloprid)、噻虫胺(clothianidin)、噻虫嗪(thiamethoxam)、氯虫苯甲酰胺(chlorantraniliprole)和其组合。
在一些方面,至少一种农药是杀真菌剂和杀虫剂组合。在一些方面,农药是杀线虫剂。在一些方面,农药是除草剂。在一些方面,农药是选自表13中的那些农药。
在一些方面,非属间重塑细菌和农药展现协同作用。
在一些方面,将种子处理剂安置到种子上。在一些方面,将种子处理剂安置到来自禾本科的种子上。在一些方面,将种子处理剂安置到谷物种子上。在一些方面,将种子处理剂安置到玉米、水稻、小麦、大麦、高粱、小米、燕麦、黑麦或黑小麦种子上。在一些方面,将种子处理剂安置到玉米种子上。在一些方面,将种子处理剂安置到遗传修饰的玉米种子上。
在一些方面,将种子处理剂安置到遗传修饰的玉米种子上,其中所述玉米包括除草剂耐受性性状。在一些方面,将种子处理剂安置到遗传修饰的玉米种子上,其中所述玉米包括昆虫抗性性状。在一些方面,将种子处理剂安置到遗传修饰的玉米种子上,其中所述玉米包括除草剂耐受性性状和昆虫抗性性状。在一些方面,将种子处理剂安置到遗传修饰的玉米种子上,其中所述玉米包括表19中列出的性状。
在一些方面,将种子处理剂安置到非遗传修饰的玉米种子上。在一些方面,将种子处理剂安置到甜玉米、硬质型玉米、爆米花、臼齿形玉米、有稃种玉米或粉质玉米上。
在一些方面,多个非属间重塑细菌在暴露到其的植物中产生1%或更多的固定氮。在一些方面,非属间重塑细菌能够在外源氮存在下固定大气氮。
在一些方面,多个非属间重塑细菌的每个成员包括引入到固氮或同化遗传调节网络的至少一种基因或非编码多核苷酸中的至少一个基因变异。在一些方面,多个非属间重塑细菌的每个成员包括可操作地连接到固氮或同化遗传调节网络的至少一个基因的引入的控制序列。在一些方面,多个非属间重塑细菌的每个成员包括可操作地连接到固氮或同化遗传调节网络的至少一个基因的异源启动子。
在一些方面,多个非属间重塑细菌的每个成员包括至少一个基因变异,其被引入到选自由以下组成的群组的成员中:nifA、nifL、ntrB、ntrC、编码谷氨酰胺合成酶的多核苷酸、glnA、glnB、glnK、drat、amtB、编码谷氨酰胺酶的多核苷酸、glnD、glnE、nifJ、nifH、nifD、nifK、nifY、nifE、nifN、nifU、nifS、nifV、nifW、nifZ、nifM、nifF、nifB、nifQ、与固氮酶生物合成相关的基因,或其组合。
在一些方面,多个非属间重塑细菌的每个成员包括引入到固氮或同化遗传调节网络的至少一种基因或非编码多核苷酸中的至少一个基因变异,所述基因或非编码多核苷酸产生以下各者中的一或多者:NifA或谷氨酰胺酶的增加的表达或活性;NifL、NtrB、谷氨酰胺合成酶、GlnB、GlnK、DraT、AmtB的减少的表达或活性;GlnE的减少的去腺苷酰基活性;或GlnD的减少的去尿苷酰基活性。
在一些方面,多个非属间重塑细菌的每个成员包括突变nifL基因,其已被更改以包括插入到所述nifL基因中的异源启动子。在一些方面,多个非属间重塑细菌的每个成员包括突变glnE基因,其产生缺乏去腺苷酰基(AR)结构域的截短GlnE蛋白质。在一些方面,多个非属间重塑细菌的每个成员包括突变amtB基因,其导致所述amtB基因缺乏表达。
在一些方面,多个非属间重塑细菌的每个成员包括以下各者中的至少一者:突变nifL基因,其已被更改以包括插入到所述nifL基因中的异源启动子;突变glnE基因,其产生缺乏去腺苷酰基(AR)结构域的截短GlnE蛋白质;突变amtB基因,其导致所述amtB基因缺乏表达;和其组合。在一些方面,多个非属间重塑细菌的每个成员包括突变nifL基因和突变glnE基因,所述突变nifL基因已被更改以包括插入到所述nifL基因中的异源启动子,所述突变glnE基因产生缺乏去腺苷酰基(AR)结构域的截短GlnE蛋白质。在一些方面,多个非属间重塑细菌的每个成员包括突变nifL基因、突变glnE基因和突变amtB基因,所述突变nifL基因已被更改以包括插入到所述nifL基因中的异源启动子;所述突变glnE基因产生缺乏去腺苷酰基(AR)结构域的截短GlnE蛋白质;所述突变amtB基因导致所述amtB基因缺乏表达。
在一些方面,多个非属间重塑细菌以每种子约1×10
在一些方面,多个非属间重塑细菌包括选自以下的细菌:水生拉恩氏菌(Rahnellaaquatilis)、变栖克雷伯菌(Klebsiella variicola)、精神无色杆菌(Achromobacterspiritinus)、马氏无色杆菌属(Achromobacter marplatensis)、壁微杆菌(Microbacterium murale)、中间克鲁瓦氏菌(Kluyvera intermedia)、假甘蔗科萨克氏菌(Kosakonia pseudosacchari)、肠杆菌属(Enterobacter sp.)、生脂固氮螺菌(Azospirillum lipoferum)、甘蔗科萨克氏菌(Kosakonia sacchari),和其组合。
在一些方面,多个非属间重塑细菌是内生的、附生的或根际的。
在一些方面,多个非属间重塑细菌包括选自以下的细菌:以NCMA 201701002形式沉积的细菌、以NCMA 201708004形式沉积的细菌、以NCMA 201708003形式沉积的细菌、以NCMA 201708002形式沉积的细菌、以NCMA 201712001形式沉积的细菌、以NCMA 201712002形式沉积的细菌,和其组合。
在一些方面,多个非属间重塑细菌包括具有与选自SEQ ID NO:177-260、296-303的核酸序列至少约90%序列一致性的核酸序列的细菌。在一些方面,多个非属间重塑细菌包括具有与选自SEQ ID NO:177-260、296-303的核酸序列至少约95%序列一致性的核酸序列的细菌。在一些方面,多个非属间重塑细菌包括具有与选自SEQ ID NO:177-260、296-303的核酸序列至少约99%序列一致性的核酸序列的细菌。在一些方面,多个非属间重塑细菌包括具有选自SEQ ID NO:177-260、296-303的核酸序列的细菌。
附图说明
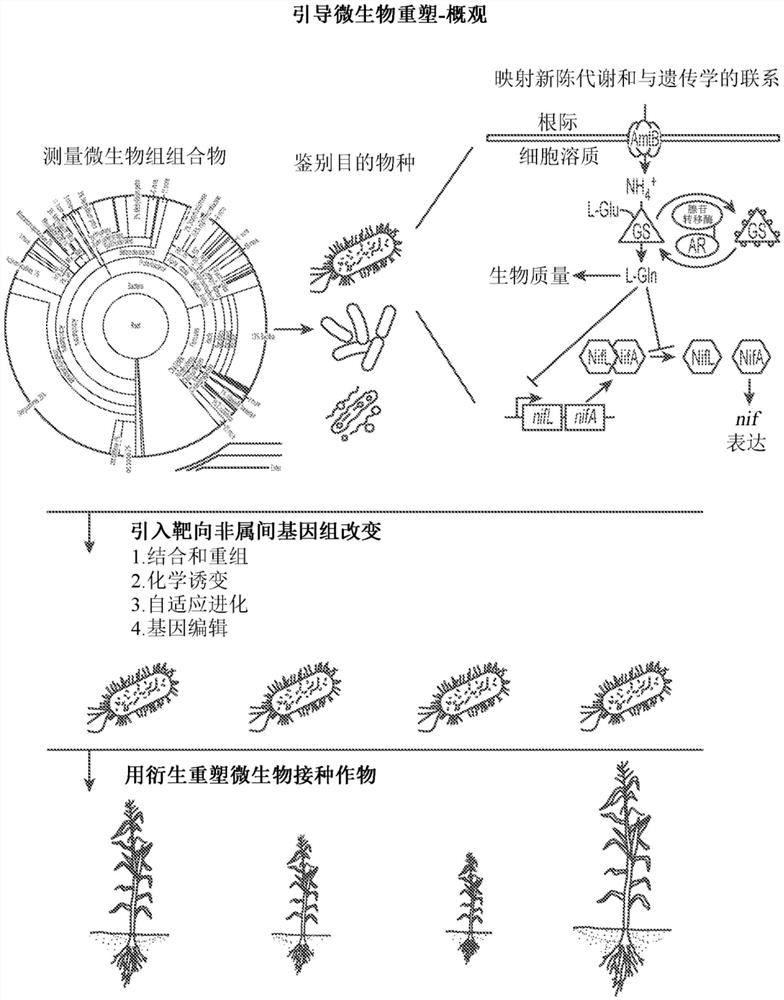
图1A描绘根据实施例的引导微生物重塑过程的概观。
图1B描绘如图1A中所示的微生物组组合物的测量的放大图。
图1C描绘有问题的“传统生物勘探”方法,其与所教示的引导微生物重塑(GMR)平台相比具有若干缺点。
图1D描绘有问题的“生物勘探的第一田地”系统,其与所教示的引导微生物重塑(GMR)平台相比具有若干缺点。
图1E描绘玉米生长循环中的时间段,其中植物需要大部分氮。
图1F描绘重塑微生物的田地开发过程的概观。
图1G描绘引导微生物重塑平台实施例的概观。
图1H描绘计算引导的微生物重塑平台的概观。
图1I描绘在引导微生物重塑平台的各方面中与建模组合的现场数据的使用。
图1J描绘可由本发明的重塑微生物拥有的五个特性。
图1K描绘用于微生物PBC6.1的重塑方法的示意图。
图1L描绘从重塑微生物中的内源性氮调节去耦的nifA表达。
图1M描绘通过重塑微生物改进的固定氮的同化和分泌。
图1N描绘可归因于重塑微生物的玉米产量改进。
图1O说明当前氮输送系统的低效,其导致施肥不足的田地、过度施肥的田地和对环境有害的氮流失
图2说明PBC6.1定殖到玉米根部中几乎21%丰度的与根部相关的微生物丛。丰度数据是基于用PBC6.1接种且在温室条件中生长的玉米植物的根际和内球的16S扩增子测序。
图3A-3E说明在类似于高硝酸盐农业土壤的条件下体外固定和分泌氮的衍生微生物。图3A说明示出了控制PBC6.1中的固氮和同化的调节网络,其包含描绘为双结构域ATase-AR酶的关键节点NifL、NifA、GS、GlnE,和AmtB。图3B说明示出了甘蔗科萨克氏菌分离物PBC6.1的基因组。限定基因组的三条途径分别传达来自PBC6.1、PBC6.38和菌株之间的差异表达的转录数据。图3C说明固氮基因簇,且为了更精细的描述而扩增了转录数据。图3D说明用乙炔还原分析测量在不同浓度的外源氮下的固氮酶活性。野生型菌株在谷氨酰胺浓度增加时展现固氮酶活性抑制,而衍生菌株显示不同程度的稳健性。在折线图中,三角形表示菌株PBC6.22;圆表示菌株PBC6.1;方形表示菌株PBC6.15;且菱形表示菌株PBC6.14。误差条表示至少三个生物复本的平均值的标准误差。图3E说明在mM浓度下观察到衍生菌株的氨的暂时分泌。未观察到野生型菌株分泌固定氮,且在培养基中累积的氨可忽略不计。误差条表示平均值的标准误差。
图4说明PBC6.1的衍生菌株中的nifA的转录速率与乙炔还原速率相关。如方法中所描述进行ARA分析,此后对培养物进行取样且进行qPCR分析以测定nifA转录水平。误差条显示每一测量中至少三个生物复本的平均值的标准误差。
图5A-5C说明显示玉米中的微生物固氮的温室实验。图5A说明在通过PBC6.1衍生菌株接种玉米植物之后六周的微生物定殖。误差条显示至少八个生物复本的平均值的标准误差。图5B说明在通过从根部提取总RNA且随后进行Nanostring分析(Nanostringanalysis)测量的nifH在植物中的转录。仅衍生菌株显示根部环境中的nifH转录。误差条显示至少三个生物复本的平均值的标准误差。图5C说明通过稀释植物组织中的同位素示踪剂测量的微生物固氮。衍生微生物展现固定氮向植物的大量转移。误差条显示至少十个生物复本的平均值的标准误差。
图6描绘衍生自菌株CI006的修饰菌株的谱系。
图7描绘衍生自菌株CI019的修饰菌株的谱系。
图8描绘由本发明的微生物每英亩季节输送的氮的磅的热图,其记录为以mmol氮/微生物-hr为单位的微生物每克鲜重的函数。在横穿较大图像的细线下方是每英亩季节输送小于一磅氮的微生物,且高于所述线的是每英亩季节输送大于一磅氮的微生物。在热图下方的表给出每一微生物每小时产生的mmol N的精确值(mmol N/微生物hr)以及在热图中显示的每一微生物的每克鲜重(CFU/g fw)的精确CFU。分析用于热图中的微生物在玉米中的N产生。对于WT菌株CI006和CI019,从单个田间位置取得玉米根部定殖数据。对于剩余菌株,假设定殖与WT田地水平相同。使用在5mM谷氨酰胺下的体外ARA分析测定固氮活性。
图9描绘已暴露到菌株CI006的植物的植物产量。圆的面积对应于相对产量,而阴影对应于特定MRTN处理。x轴是p值且y轴是获胜率。
图10描绘已暴露到菌株CM029的植物的植物产量。圆的面积对应于相对产量,而阴影对应于特定MRTN处理。x轴是p值且y轴是获胜率。
图11描绘已暴露到菌株CM038的植物的植物产量。圆的面积对应于相对产量,而阴影对应于特定MRTN处理。x轴是p值且y轴是获胜率。
图12描绘已暴露到菌株CI019的植物的植物产量。圆的面积对应于相对产量,而阴影对应于特定MRTN处理。x轴是p值且y轴是获胜率。
图13描绘已暴露到菌株CM081的植物的植物产量。圆的面积对应于相对产量,而阴影对应于特定MRTN处理。x轴是p值且y轴是获胜率。
图14描绘已暴露到菌株CM029和CM081的植物的植物产量。圆的面积对应于相对产量,而阴影对应于特定MRTN处理。x轴是p值且y轴是获胜率。
图15将植物的植物产量描绘为总计的蒲式耳(bushel)增益/损失。圆的面积对应于相对产量,而阴影对应于特定MRTN处理。x轴是p值且y轴是获胜率。
图16说明来自2017年夏季田地测试实验的结果。所获得的产量结果表明本发明的微生物可以充当潜在肥料替代品。举例来说,利用本发明的微生物(即,6-403)产生比野生型菌株(WT)更高的产量和比未经处理的对照(UTC)更高的产量。相比于所述区域的标准农业实践,“-25lbs N”处理剂每英亩使用更少的25lbs N。“100%N”UTC处理意图描绘所述区域的标准农业实践,其中由农民部署100%的N的标准利用率。微生物“6-403”以NCMA201708004形式沉积且可以发现于表1中。这是突变甘蔗科萨克氏菌(也称为CM037)且是来自CI006 WT的后代突变菌株。
图17说明来自2017年夏季田地测试实验的结果。所获得的产量结果表明本发明的微生物在多个位置上表现一致。此外,产量结果表明本发明的微生物在受氮气应力的环境以及具有足够氮气供应的环境两者中表现良好。微生物“6-881”(也称为CM094,PBC6.94)且其是来自CI006 WT的后代突变甘蔗科萨克氏菌菌株,以NCMA 201708002形式沉积且可以发现于表1中。微生物“137-1034”,其是来自CI137 WT的后代突变变栖克雷伯菌菌株,以NCMA201712001形式沉积且可以发现于表1中。微生物“137-1036”,其是来自CI137 WT的后代突变变栖克雷伯菌菌株,以NCMA 201712002形式沉积且可以发现于表1中微生物“6-404”(也称为CM38,PBC6.38),且其是来自CI006 WT的后代突变假甘蔗科萨克氏菌菌株,以NCMA201708003形式沉积且可以发现于表1中。“养分胁迫”条件对应于0%氮状况。“足够的肥料”条件对应于100%氮状况。
图18描绘衍生自菌株CI006(也称为“6”,假甘蔗科萨克氏菌WT)的修饰菌株的谱系。
图19描绘衍生自菌株CI019(也称为“19”,水生拉恩氏菌WT)的修饰菌株的谱系。
图20描绘衍生自菌株CI137(也称为“137”,变栖克雷伯菌WT)的修饰菌株的谱系。
图21描绘衍生自菌株1021(假甘蔗科萨克氏菌WT)的修饰菌株的谱系。
图22描绘衍生自菌株910(中间克鲁瓦氏菌WT)的修饰菌株的谱系。
图23描绘衍生自菌株63(水生拉恩氏菌WT)的修饰菌株的谱系。
图24描绘由本发明的微生物每英亩季节输送的氮的磅的热图,其记录为以mmol氮/微生物-hr为单位的微生物每克鲜重的函数。在横穿较大图像的细线下方是每英亩季节输送小于一磅氮的微生物,且高于所述线的是每英亩季节输送大于一磅氮的微生物。实例5中的表28给出每一微生物每小时产生的mmol N的精确值(mmol N/微生物hr)以及在热图中显示的每一微生物的每克鲜重(CFU/g fw)的精确CFU。图24中的数据来源于在田间条件下在玉米中分析N产生的微生物菌株。每一点表示由使用来自单个田间位置的玉米根部定殖数据的微生物产生的Ib N/英亩。使用在5mM N下呈谷氨酰胺或磷酸铵形式的体外ARA分析测定N固定活性。
图25描绘由本发明的微生物每英亩季节输送的氮的磅的热图,其记录为以mmol氮/微生物-hr为单位的微生物每克鲜重的函数。在横穿较大图像的细线下方是每英亩季节输送小于一磅氮的微生物,且高于所述线的是每英亩季节输送大于一磅氮的微生物。实例5中的表29给出每一微生物每小时产生的mmol N的精确值(mmol N/微生物hr)以及在热图中显示的每一微生物的每克鲜重(CFU/g fw)的精确CFU。图25中的数据来源于在实验室和温室条件下在玉米中分析N产生的微生物菌株。每一点表示由单个菌株产生的lb N/英亩。白点表示在温室条件下收集玉米根部定殖数据的菌株。黑点表示突变菌株,其玉米根部定殖水平来源于野生型亲本菌株的平均田地玉米根部定殖水平。阴影点表示在其平均田地玉米根部定殖水平下的野生型亲本菌株。在所有情况下,通过在5mM N下呈谷氨酰胺或磷酸铵形式的体外ARA分析测定N固定活性。
具体实施方式
虽然本文已示出且描述本发明的各种实施例,但所属领域的技术人员将显而易见的是,此类实施例仅借助于实例而提供。所属领域的技术人员可在不脱离本发明的情况下意识到大量变型、变化和取代。应理解,可采用本文所描述的本发明实施例的各种替代方案。
增加的肥料利用带来了环境问题,且也可能对于全球许多经济上有压力的区域是不可能的。此外,微生物领域中的许多行业参与者关注产生属间微生物。然而,对被表征/分类为属间的工程改造的微生物存在沉重的调节负担。这些属间微生物不仅面临较高调节负担,使其难以广泛采用和实施,而且其还面临大量的公众感知的审视。
目前,市场上不存在非属间的且能够增加非豆科作物中的固氮的工程改造的微生物。此类微生物的此缺陷是有助于形成真正环境友好且更可持续的21世纪农业系统的缺失要素。
本发明解决前述问题且提供已工程改造以易于固定作物中的氮的非属间微生物。这些微生物未被表征/分类为属间微生物,且因此将不会面对此类微生物的急剧调节负担。此外,所教示的非属间微生物将用以帮助21世纪农民变得不太依赖于利用不断增加量的外源氮肥。
定义
在描述本发明的上下文中(尤其在随附权利要求书的上下文中)使用术语“一个/种(a/an)”和“所述”以及类似的提及物应解释为涵盖单数和复数,除非本文中另外指明或与上下文明显相矛盾。除非另外指出,否则术语“包括”、“具有”、“包含”和“含有”应解释为开放式术语(即意指“包含但不限于,”)。除非在本文中另外指示,否则对本文中值范围的叙述仅意图充当个别提及属于所述范围的每一单独值的速记方法,且每一单独值并入本说明书中,如同在本文中个别地叙述一般。例如,如果揭示了范围10-15,则也揭示了11、12、13以及14。除非在本文另外指示或以其它方式与上下文明显相矛盾,否则本文所描述的所有方法可以按任何合适的顺序进行。除非另外要求,否则使用的任何和所有实例,或本文所提供的示例性语言(例如“如”)仅意图更好地说明本发明且并不对本发明的范围造成限制。本说明书中的任何语言都不应被解释为指示实践本发明所必需的任何未要求的要素。
术语“多核苷酸”、“核苷酸”、“核苷酸序列”、“核酸”以及“寡核苷酸”可互换使用。这些术语指任何长度的核苷酸的聚合形式,包含脱氧核糖核苷酸或核糖核苷酸或其类似物。多核苷酸可具有任何三维结构,且可以执行任何已知或未知的功能。以下是多核苷酸的非限制性实例:基因或基因片段的编码或非编码区、由连锁分析确定的基因座(loci/locus)、外显子、内含子、信使RNA(mRNA)、转移RNA(tRNA)、核糖体RNA(rRNA)、短干扰RNA(siRNA)、短夹层RNA(shRNA)、微小RNA(miRNA)、核酶、cDNA、重组多核苷酸、分支多核苷酸、质粒、载剂、分离的具有任何序列的DNA、分离的具有任何序列的RNA、核酸探针以及引物。多核苷酸可包括一或多个修饰的核苷酸,如甲基化核苷酸和核苷酸类似物。如果存在,则对核苷酸结构的修饰可在组装聚合物之前或之后进行。核苷酸序列可被非核苷酸组分间断。可在聚合后如通过与标记组分结合而进一步修饰多核苷酸。
“杂交”是指一或多个多核苷酸反应形成经由在核苷酸残基碱基之间进行氢键结合而稳定的复合物的反应。氢键键合可通过沃森克里克碱基配对(Watson Crick basepairing)、胡格斯坦结合(Hoogstein binding)或根据碱基互补以任何其它序列特异性方式发生。复合物可包括形成双链体结构的两条链、形成多链复合物的三条或更多条链、单个自杂交链或这些链的任何组合。杂交反应可构成更广泛过程中的一个步骤,所述过程如起始PCR或通过核酸内切酶对多核苷酸进行酶促切割。与第一序列互补的第二序列被称作第一序列的“互补序列”。如应用于多核苷酸的术语“可杂交”是指多核苷酸在杂交反应中形成通过核苷酸残基的碱基之间的氢键键合而稳定的复合物的能力。
“互补性”是指核酸通过传统的沃森-克里克或其它非传统类型与另一核酸序列形成(多个)氢键的能力。互补性百分比指示可以与第二核酸序列形成氢键(例如,沃森-克里克碱基配对)的核酸分子中的残基百分比(例如,10分之5、6、7、8、9、10分别是50%、60%、70%、80%、90%和100%互补)。“完全互补”是指核酸序列的所有连续残基将与第二核酸序列中相同数目的连续残基氢键键合。如本文所使用,“大体上互补”是指在8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、30、35、40、45、50个或更多个核苷酸的区上至少60%、65%、70%、75%、80%、85%、90%、95%、97%、98%、99%或100%的互补程度,或是指在严格条件下杂交的两个核酸。序列一致性(如出于评定互补性百分比的目的)可通过任何合适的比对算法进行测量,所述算法包含但不限于尼德曼-翁施(Needleman-Wunsch)算法(参见例如可在www.ebi.ac.uk/Tools/psa/emboss_needle/nucleotide.html获得的EMBOSS Needle比对器,任选地利用默认设置)、BLAST算法(参见例如可在blast.ncbi.nlm.nih.gov/Blast.cgi获得的BLAST比对工具,任选地利用默认设置)或史密斯-沃特曼(Smith-Waterman)算法(参见例如可在www.ebi.ac.uk/Tools/psa/emboss_water/nucleotide.html获得的EMBOSS Water比对器,任选地利用默认设置)。最佳比对可使用所选算法的任何合适的参数,包含默认参数进行评定。
一般来说,杂交的“严格条件”是指与靶序列具有互补性的核酸主要与靶序列杂交,并且基本上不与非靶序列杂交的条件。严格条件一般是序列依赖性的,且根据数个因素而不同。一般来说,序列越长,序列与其靶序列特异性杂交的温度越高。严格条件的非限制性实例在迪杰森(Tijssen)(1993),《生物化学和分子生物学实验室技术-用核酸探针杂交(Laboratory Techniques In Biochemistry And Molecular Biology-HybridizationWith Nucleic Acid Probes)》,第I部分,第二章“杂交原理概述和核酸探针分析策略(Overview of principles of hybridization and the strategy of nucleic acidprobe assay)”,纽约州爱思唯尔(Elsevier,N.Y)中详细描述。
如本文所使用,“表达”是指从DNA模板转录多核苷酸(如转录成mRNA或其它RNA转录物)的过程和/或将转录的mRNA随后翻译成肽、多肽、或蛋白质的过程。转录物和编码的多肽可统称为“基因产物”。如果多核苷酸源自基因组DNA,则表达可包含在真核细胞中剪接mRNA。
术语“多肽”和“肽”和“蛋白质”在本文中可互换使用以指任何长度的氨基酸聚合物。聚合物可以是直链或分支链的,其可包括修饰的氨基酸,且其可间杂有非氨基酸。所述术语还涵盖已修饰的氨基酸聚合物;例如,二硫键形成、糖基化、脂化、乙酰化、磷酸化或任何其它操纵,如与标记组分的结合。如本文所使用,术语“氨基酸”包含天然和/或非天然或合成氨基酸,包含甘氨酸和D或L旋光异构体两者,以及氨基酸类似物和肽模拟物。
如本文所使用,术语“约”与术语“大约”同义地使用。说明性地,关于某一量使用术语“约”指示稍微超出所列举的值(例如加或减0.1%到10%)。
术语“生物纯培养物”或“大体上纯培养物”是指本文所描述的细菌物种的培养物,其不含足以干扰培养物复制或由普通细菌学技术检测到的量的其它细菌物种。
“植物生产力”一般是指植物生长或发育的任何方面,这是植物生长的原因。对于粮食作物,如谷物或蔬菜,“植物生产力”可以指从特定作物收获的谷物或果实的产量。如本文所使用,植物生产力提高广泛地是指出于各种目的而收获的谷物、果实、花或其它植物部分的产量提高;植物部分,包含茎、叶和根部的生长改善;促进植物生长;维持叶片中的高叶绿素含量;增加果实或种子数目;增加果实或种子单位重量;由于减少的氮肥使用而减少NO
粮食作物中和粮食作物周围的微生物会影响那些作物的性状。可能受微生物影响的植物性状包含:产量(例如,谷物生产、生物质量生成、果实发育、花形成);营养(例如,氮、磷、钾、铁、微量营养素获取);非生物胁迫管理(例如,耐旱性、耐盐性、耐热性);和生物胁迫管理(例如,害虫、杂草、昆虫、真菌和细菌)。改变作物性状的策略包含:提高关键代谢物浓度;改变微生物对关键代谢物影响的时间动态;将微生物代谢物产生/降解与新的环境线索相联系;减少负面代谢物;和改善代谢物或底层蛋白质的平衡。
如本文所使用,“控制序列”是指操纵子、启动子、沉默子或终止子。
如本文所使用,取决于使用情况(例如内生、附生或根际缔合),“植物内”可指在植物中、在植物上或与植物紧密相关。植物可包含植物部分、组织、叶子、根部、根部毛发、根茎、茎、种子、胚珠、花粉、花、果实等。
在一些实施例中,本发明的基因的天然或内源控制序列由一或多个属内控制序列替换。
如本文所使用,“引入”是指通过现代生物技术引入,且不是自然发生的引入。
在一些实施例中,本发明的细菌已被修饰,使得其不是天然存在的细菌。
在一些实施例中,本发明的细菌以每克植物鲜重或干重至少10
本发明的肥料和外源氮可包括以下含氮分子:铵、硝酸盐、亚硝酸盐、氨、谷氨酰胺等。本发明的氮源可包含无水氨、硫酸氨、尿素、磷酸二铵、脲甲醛(urea-form)、磷酸一铵、硝酸铵、氮溶液、硝酸钙、硝酸钾、硝酸钠等。
如本文所使用,“外源氮”是指在非氮限制条件下存在的土壤、田地或生长介质中容易获得的非大气氮,包含氨、铵、硝酸盐、亚硝酸盐、尿素、尿酸、铵酸等。
如本文所使用,“非氮限制条件”是指在土壤、田地、介质中可获得的非大气氮,其浓度大于约4mM氮,如坎特(Kant)等人(2010.《实验生物学杂志(J.Exp.Biol.)》62(4):1499-1509)中所揭示的,其以引用的方式并入本文中。
如本文所使用,“属间微生物”是由最初从不同分类属的生物体分离的遗传物质的有意组合形成的微生物。“属间突变体”可以与“属间微生物”互换使用。示例性“属间微生物”包含含有可移动遗传要素的微生物,所述移动遗传要素首先在不同于接受者微生物的属中的微生物中鉴别。可尤其在40C.F.R.§725.3中发现进一步解释。
在各方面中,本文所教示的微生物是“非属间的”,其意指微生物不是属间的。
如本文所使用,“属内微生物”是由最初从相同分类属的生物体分离的遗传物质的有意组合形成的微生物。“属内突变体”可以与“属内微生物”互换使用。
如本文所使用,“引入的遗传物质”意指添加到接受者基因组且作为所述基因组的组分保留的遗传物质。
如本文所使用,在非属间微生物的情形下,术语“重塑”与术语“工程改造”同义地使用。因此,“非属间重塑微生物”具有与“非属间工程改造微生物”同义的含义,且将互换使用。此外,本发明可指“工程改造的菌株”或“工程改造的衍生物”或“工程改造的非属间微生物”,这些术语与“重塑菌株”或“重塑衍生物”或“重塑非属间微生物”同义地使用。
在一些实施例中,固氮和同化的基因调节网络包括多核苷酸编码基因和非编码序列,其引导、调整和/或调节微生物固氮和/或同化,且可以包括nif簇(例如,nifA、nifB、nifC、……nifZ)多核苷酸序列、编码氮调节蛋白C的多核苷酸、编码氮调节蛋白B的多核苷酸、gln簇(例如glnA和glnD)的多核苷酸序列、draT和氨转运蛋白/通透酶。在一些情况下,Nif簇可包括NifB、NifH、NifD、NifK、NifE、NifN、NifX、hesa和NifV。在一些情况下,Nif簇可包括NifB、NifH、NifD、NifK、NifE、NifN、NifX、hesa和NifV的子集。
在一些实施例中,本发明的肥料包括按重量计至少5%、6%、7%、8%、9%、10%、11%、12%、13%、14%、15%、16%、17%、18%、19%、20%、21%、22%、23%、24%、25%、26%、27%、28%、29%、30%、31%、32%、33%、34%、35%、36%、37%、38%、39%、40%、41%、42%、43%、44%、45%、46%、47%、48%、49%、50%、51%、52%、53%、54%、55%、56%、57%、58%、59%、60%、61%、62%、63%、64%、65%、66%、67%、68%、69%、70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%的氮。
在一些实施例中,本发明的肥料包括按重量计至少约5%、约6%、约7%、约8%、约9%、约10%、约11%、约12%、约13%、约14%、约15%、约16%、约17%、约18%、约19%、约20%、约21%、约22%、约23%、约24%、约25%、约26%、约27%、约28%、约29%、约30%、约31%、约32%、约33%、约34%、约35%、约36%、约37%、约38%、约39%、约40%、约41%、约42%、约43%、约44%、约45%、约46%、约47%、约48%、约49%、约50%、约51%、约52%、约53%、约54%、约55%、约56%、约57%、约58%、约59%、约60%、约61%、约62%、约63%、约64%、约65%、约66%、约67%、约68%、约69%、约70%、约71%、约72%、约73%、约74%、约75%、约76%、约77%、约78%、约79%、约80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约88%、约89%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%或约99%的氮。
在一些实施例中,本发明的肥料包括按重量计约5%到50%、约5%到75%、约10%到50%、约10%到75%、约15%到50%、约15%到75%、约20%到50%、约20%到75%、约25%到50%、约25%到75%、约30%到50%、约30%到75%、约35%到50%、约35%到75%、约40%到50%、约40%到75%、约45%到50%、约45%到75%或约50%到75%的氮。
在一些实施例中,相对于未暴露于本发明的细菌的对照植物,测量到植物中固氮增加和/或产生1%或更多的氮。细菌的所有增加或减少相对于对照细菌测量。植物的所有的增加或减少相对于对照植物测量。
如本文所使用,“组成型启动子”是在大部分条件下和/或在大部分发育阶段期间具有活性的启动子。在用于生物技术中的表达载剂中使用组成型启动子有几个优点,如:用于选择转基因细胞或生物体的蛋白质的高产生水平;报告蛋白或可评分标记物的高表达水平,使得易于检测和定量;作为调节转录系统一部分的转录因子的高产生水平;产生在生物体中需要普遍存在的活性的化合物;和产生在发育的所有阶段所需的化合物。非限制性示例性组成型启动子包含CaMV 35S启动子、冠瘿碱启动子、泛素启动子、醇脱氢酶启动子等。
如本文所使用,“非组成型启动子”是在某些条件下、在某些类型的细胞中和/或在某些发育阶段期间具有活性的启动子。例如,组织特异性、组织优先、细胞类型特异性、细胞类型优先、诱导型启动子和处于发育控制下的启动子是非组成型启动子。处于发育控制下的启动子的实例包含优先在某些组织中起始转录的启动子。
如本文所使用,“诱导型”或“阻抑型”启动子是处于化学或环境因素控制下的启动子。可能影响诱导型启动子转录的环境条件的实例包含厌氧条件、某些化学物质、光的存在、酸性或碱性条件等。
如本文所使用,“组织特异性”启动子是仅在某些组织中起始转录的启动子。不同于基因的组成型表达,组织特异性表达是若干相互作用水平的基因调节的结果。因此,在所属领域中,有时优选使用来自同源或紧密相关物种的启动子以实现转基因在特定组织中的有效和可靠表达。这是从特定组织分离的大量组织特异性启动子见于科学和专利文献中的主要原因之一。
如本文所使用,术语“可操作地连接”是指单个核酸片段上的核酸序列的缔合,使得一个核酸序列的功能由另一个调节。举例来说,启动子在其能够调节编码序列的表达时与所述编码序列可操作地连接(即,编码序列在启动子的转录控制下)。编码序列可以以正义或反义方向可操作地连接到调节序列。在另一实例中,本发明的互补RNA区可以直接或间接在5'端与靶mRNA可操作地连接(直接或间接),或在3'端与靶mRNA可操作地连接,或在靶mRNA内,或针对靶mRNA来说,第一互补区是5'且其补体是3'。
在各方面中,“向植物施用多种非属间细菌”包含使植物(包含植物部分,如种子、根部、茎、组织等)在植物生命周期的任何阶段与所述细菌接触(即暴露)的任何方式。因此,“向植物施用多种非属间细菌”包含以下方式中的任一者:将植物(包含植物部分,如种子、根部、茎、组织等)暴露到所述细菌:喷洒到植物上、滴落到植物上,作为种皮施用、施用到随后用种子种植的田地、施用到已经用种子种植的田地、施用到具有成株植物的田地等。
如本文所使用,“MRTN“是用于最大返回到氮的首字母缩写,且在实例中用作实验处理。MRTN是由爱荷华州立大学(Iowa State University)开发,且信息可发现于:http://cnrd.agron.iastate.edu/MRTN是其中使氮施用的经济净收益最大化的氮速率。计算MRTN的方法是用于在个别状态中开发玉米氮速率准则的区域方法。氮速率试验数据针对伊利诺伊州(Illinois)、爱荷华(Iowa)、密歇根(Michigan)、明尼苏达(Minnesota)、俄亥俄州(Ohio)和威斯康星(Wisconsin)进行评估,其中足够数目的研究试验可用于在大豆后进行的玉米种植和在玉米后进行的玉米种植。试验采用春季、侧装或分段预栽/侧装施用氮,且除对威斯康星州灌溉沙地之外,不灌溉沙地。MRTN由爱荷华州立大学开发,这归因于测定玉米生产所需的所建议氮速率的方法、关于氮速率准则的误解和关于施用速率的关注的表观差异。通过计算MRTN,从业者可以测定以下各者:(1)其中氮施用的经济净收益最大化的氮速率、(2)经济最佳氮速率,其是氮的上一次递增返回足够大以支付额外氮产量增加的点、(3)归因于氮施用的玉米谷粒增加的值和最大产量,其是其中施用更多氮不会导致玉米产量增加的产量。因此,MRTN计算向从业者提供使不同区域中的玉米作物最大化的同时使来自氮施用的财务收益最大化的手段。
术语mmol是毫摩尔的缩写,其是摩尔的千分之一(10
如本文所使用,术语“微生物体”或“微生物”应广泛考虑。这些可互换使用的术语包含(但不限于)两个原核结构域、细菌和古细菌。术语还可涵盖真核真菌和原生生物。
术语“微生物聚生体”或“微生物联合体”是指个别微生物物种的微生物群体的子集,或物种的菌株,其可以描述为发挥共同功能,或可以描述为参与或产生可识别的参数(如所关注的表现型性状)或与其相关。
术语“微生物群体”意指包括两种或更多种物种或菌株的微生物群组。不同于微生物聚生体,微生物群体不必执行共同功能,或不必参与或产生可识别参数,或与可识别参数相关,如所关注的表现型性状。
如本文所使用,“分离物”、“分离的”、“分离的微生物”和类似术语意图指从至少一种在具体环境(例如土壤、水、植物组织)中与其相关的材料分离的一或多种微生物体。因此,“分离的微生物”并不存在于其天然存在的环境中;实际上,通过本文所描述的多种技术从其天然环境移出微生物且将其置于非天然存在状态。因此,分离的菌株或分离的微生物可以例如生物纯培养物或孢子(或其它形式的菌株)形式存在。在各方面中,分离的微生物可与可接受的载剂结合,所述载剂可为农业上可接受的载剂。
在本发明的某些方面中,分离的微生物以“分离的和生物纯培养物”形式存在。所属领域的技术人员应了解,具体微生物的分离的和生物纯培养物表示所述培养物基本上不含其它活的生物体且仅含有所讨论的个别微生物。培养物可以含有不同浓度的所述微生物。本发明注意到分离的和生物纯微生物通常“必须不同于不太纯或不纯的材料”。参见例如贝格斯特罗姆(In re Bergstrom),427F.2d 1394,(CCPA 1970)(讨论纯化的前列腺素),还参见克鲁伊夫(In re Bergy),596F.2d 952(CCPA 1979)(讨论纯化的微生物),还参见帕克戴维(Parke-Davis)和马尔福德(Co.v.H.K.Mulford)和Co.,189F.95(S.D.N.Y.1911)(法官汉德(Learned Hand)讨论纯化的肾上腺素),部分aff'd,部分rev'd,196F.496(1912年第2期),其中每一个以引用的方式并入本文中。此外,在一些方面中,本发明提供必须在分离的和生物纯微生物培养物内发现的浓度或纯度界限的某些定量测量。在某些实施例中,存在这些纯度值是可区分本发明所揭示的微生物与以天然状态存在的微生物的另一种属性。参见例如默克公司和奥林马西森化学公司(Merck&Co.v.Olin Mathieson ChemicalCorp.),253F.2d 156(1958年第4期)(讨论由微生物产生的维生素B12的纯度界限),其以引用的方式并入本文中。
如本文所使用,“个别分离物”应视为意指在与一或多种其它微生物体分离之后,主要包括微生物体的单一属、物种或菌株的组合物或培养物。
本发明的微生物可包含孢子和/或营养细胞。在一些实施例中,本发明的微生物包含处于可行但不可培养(VBNC)状态的微生物。如本文所使用,“孢子(spore或spores)”是指由适于存活和分散的细菌和真菌产生的结构。孢子一般表征为休眠结构;然而,孢子能够在发芽过程中分化。发芽是孢子分化到能够代谢活性、生长和繁殖的营养细胞中。单一孢子的发芽产生单一真菌或细菌营养细胞。真菌孢子是无性繁殖的单位,且在一些情况下是真菌生命周期中的必要结构。细菌孢子是存活条件的结构,其通常对营养细胞的存活或生长无益。
如本文所使用,“微生物组合物”是指包括一或多种本发明的微生物的组合物。在一些实施例中,将微生物组合物施用到植物(包含各种植物部分)和/或农田中。
如本文所使用,“载剂”、“可接受的载剂”或“农业上可接受的载剂”是指可以与微生物一起施用的稀释剂、佐剂、赋形剂或媒剂,其不会对微生物造成不利影响。
固氮调节
在一些情况下,固氮路径可充当基因工程改造和优化的靶标。可由本文所描述的方法靶向调节的一个性状是固氮。氮肥是农场的最大运营费用,且是如玉米和小麦的中耕作物(row crop)更高产的最大驱动因素。本文描述了可以在非豆科作物中输送可再生形式的氮的微生物产品。尽管一些内生菌(endophyte)在纯培养物中具有固定氮所需的遗传物质,但根本的技术挑战是谷物和草的野生型内生菌在施肥田中停止固定氮。施用化肥和田地土壤中残留的氮水平标志微生物关闭固氮的生化路径。
对固氮调节网络的组分的转录和翻译后水平的改变对于开发能够在肥料存在下固定和转移氮到玉米的微生物可能是有益的。为此,本文描述了宿主-微生物进化(HoME)技术,以精确地进化调节网络且引出新的表型。本文还描述了从玉米中分离的固氮内生菌的独特专有库,其与围绕在不同环境条件(如氮胁迫和过量)下微生物与宿主植物相互作用的广泛的组学(omics)数据配对。在一些实施例中,这项技术使得内生菌的基因调节网络能够精确进化,以产生即使在田地存在肥料的情况下也活跃地固氮的微生物。本文还描述了对定殖于玉米根部组织且为施肥的植物产生氮的微生物的技术的潜力评估,和对内生菌与标准配制实践和不同土壤的相容性的评估,以确定将微生物整合到现代氮管理策略中的可行性。
为了利用元素氮(N)进行化学合成,生命形式将可在大气中获得的氮气(N
在变形菌门(Proteobacteria)中,固氮调节围绕σ54依赖性增强子结合蛋白NifA、nif簇的正转录调节子为中心。细胞内活性NifA的水平受两个关键因素控制:nifLA操纵子的转录,和通过与NifL的蛋白质-蛋白质相互作用对NifA活性的抑制。这两个过程均经由PII蛋白信号级联响应于细胞内谷氨酰胺水平。此级联由GlnD介导,GlnD直接感应谷氨酰胺且分别响应是否存在结合的谷氨酰胺,催化两种PII调节蛋白-GlnB和GlnK的尿苷酰化或去尿苷酰化。在氮过量的条件下,未修饰的GlnB标志nifLA启动子失活。然而,在氮限制的条件下,GlnB经翻译后修饰,这抑制了其活性且引起nifLA操纵子转录。以此方式,经由PII蛋白信号级联,响应于环境氮紧密控制nifLA转录。在NifA调节的翻译后水平上,GlnK依赖于细胞内游离GlnK的总体水平来抑制NifL/NifA相互作用。
NifA由nifLA操纵子转录,其启动子由磷酸化NtrC、另一σ54依赖性调节子活化。NtrC的磷酸化状态由组氨酸激酶NtrB介导,NtrB与去尿苷酰化的GlnB而非尿苷酰化的GlnB相互作用。在氮过量的条件下,细胞内的高谷氨酰胺水平引起GlnB的去尿苷酰化,随后GlnB与NtrB相互作用以使其磷酸化活性失活且活化其磷酸酶活性,引起NtrC去磷酸化和nifLA启动子失活。然而,在氮限制的条件下,低水平的细胞内谷氨酰胺引起GlnB尿苷酰化,这抑制GlnB与NtrB的相互作用,且允许NtrC磷酸化和nifLA操纵子转录。以此方式,经由PII蛋白信号级联,响应于环境氮紧密控制nifLA表达。nifA、ntrB、ntrC和glnB都是可以在本文所描述的方法中突变的所有基因。这些过程也可能响应于细胞内或细胞外的氨、尿素或硝酸盐水平。
NifA的活性也响应于环境氮经翻译后调节,最典型地是通过NifL介导的NifA活性抑制。一般来说,NilL和NifA的相互作用受经由GlnK的PII蛋白信号级联影响,但在固氮生物之间,GlnK与NifL/NifA之间的相互作用的性质差异显著。在肺炎克雷伯氏杆菌(Klebsiella pneumoniae)中,两种形式的GlnK均抑制NifL/NifA相互作用,且GlnK与NifL/NifA之间的相互作用由细胞内游离GlnK的总体水平决定。在氮过量的条件下,去尿苷酰化的GlnK与铵转运蛋白AmtB相互作用,这既用以阻断AmtB吸收铵,又将GlnK螯合到膜上,从而允许由NifL抑制NifA。另一方面,在棕色固氮菌(Azotobacter vinelandii)中,NifL/NifA相互作用和NifA抑制需要与去尿苷酰化的GlnK相互作用,而GlnK的尿苷酰化抑制其与NifL的相互作用。在缺乏nifL基因的固氮生物中,有证据表明NifA活性在氮过量的条件下直接由与GlnK和GlnB两者的去尿苷酰化形式相互作用抑制。在一些细菌中,Nif簇可能受glnR调节,且另外在一些情况下,这可能包括负调节。无论机制如何,NifA的翻译后抑制是大多数已知固氮生物中nif簇的重要调节子。另外,nifL、amtB、glnK和glnR是可以在本文所描述的方法中突变的基因。
除调节nif基因簇的转录之外,许多固氮生物进化出用于直接翻译后修饰和抑制固氮酶本身的机制,其被称为固氮酶关闭。这由在氮过量条件下Fe蛋白(NifH)的ADP-核糖基化介导,这破坏了Fe蛋白与MoFe蛋白复合物(NifDK)的相互作用且消除了固氮酶活性。DraT催化Fe蛋白的ADP-核糖基化和固氮酶的关闭,而DraG催化ADP-核糖的去除和固氮酶的再活化。与nifLA转录和NifA抑制一样,固氮酶关闭也经由PII蛋白信号级联调节。在氮过量条件下,去尿苷酰化的GlnB与DraT相互作用且活化DraT,而去尿苷酰化的GlnK与DraG和AmtB两者相互作用以形成复合物,将DraG螯合到膜。在氮限制条件下,GlnB和GlnK的尿苷酰化形式未分别与DraT和DraG相互作用,引起DraT失活和DraG向Fe蛋白的扩散,在Fe蛋白中,DraG去除ADP-核糖且活化固氮酶。本文所描述的方法还涵盖将基因变异引入到nifH、nifD、nifK和draT基因中。
虽然一些内生菌能够在体外固定氮,但通常遗传物质在田地中由高水平的外源性化肥抑制。可以将外源氮的感应与固氮酶的表达解除联系,以促进基于田地的固氮。提高固氮酶活性随时间的整体进一步用于增加氮产生,以供作物利用。使用本文所描述的方法促进基于田地的固氮的基因变异的特定靶标包含一或多种选自由以下组成的群组的基因:nifA、nifL、ntrB、ntrC、glnA、glnB、glnK、draT、amtB、glnD、glnE、nifJ、nifH、nifD、nifK、nifY、nifE、nifN、nifU、nifS、nifV、nifW、nifZ、nifM、nifF、nifB和nifQ。
使用本文所描述的方法促进基于田地的固氮的基因变异的另一靶标是NifA蛋白。NifA蛋白典型地是固氮基因表达的活化子。增加NifA产生(组成型地或在高氨条件期间)避开天然氨感测路径。另外,减少NifL蛋白(一种已知的NifA抑制剂)产生也引起游离活性NifA水平提高。另外,提高nifAL操纵子的转录水平(组成型地或在高氨条件期间)也引起NifA蛋白总体较高的水平。通过改变启动子本身或通过降低NtrB(原先会引起高氮条件期间nifAL操纵子关闭的ntrB和ntrC信号级联的一部分)表达来实现nifAL表达水平的提高。通过本文所描述的这些或任何其它方法实现的高水平的NifA提高内生菌的固氮活性。
使用本文所描述的方法促进基于田地的固氮的基因变异的另一靶标是GlnD/GlnB/GlnK PII信号级联。细胞内谷氨酰胺水平通过GlnD/GlnB/GlnK PII信号级联感测。消除GlnD的去尿苷酰基活性的GlnD中的活性位点突变破坏了氮感测级联。另外,降低GlnB浓度使谷氨酰胺感测级联短路。这些突变“欺骗”细胞感知氮限制状态,从而提高固氮水平活性。这些过程也可能响应于细胞内或细胞外的氨、尿素或硝酸盐水平。
amtB蛋白也是使用本文所描述的方法促进基于田地的固氮的基因变异的靶标。可以通过降低amtB蛋白的表达水平来减少从环境中吸收氨。没有细胞内的氨,内生菌就无法感测到高水平的氨,从而阻止固氮基因的下调。设法进入细胞内区室的任何氨都会转化成谷氨酰胺。细胞内谷氨酰胺水平是氮感测的主要通货。降低细胞内谷氨酰胺水平阻止细胞感测环境中的高铵水平。可以通过提高谷氨酰胺酶(一种将谷氨酰胺转化成谷氨酸的酶)的表达水平来实现这种效果。另外,还可以通过减少谷氨酰胺合成酶(一种将氨转化成谷氨酰胺的酶)来减少细胞内谷氨酰胺。在固氮生物中,固定的氨会迅速同化成谷氨酰胺和谷氨酸以用于细胞过程。破坏氨同化可使固定氮的转移能够以氨的形式从细胞中输出。固定的氨主要由glnA编码的谷氨酰胺合成酶(GS)同化成谷氨酰胺,且随后由谷氨酰胺酮戊二酸转氨酶(GOGAT)同化成谷氨酰胺。在一些实例中,glnS编码谷氨酰胺合成酶。GS受GS腺苷酰基转移酶(GlnE)翻译后调节,GlnE是由glnE编码的双功能酶,其分别通过其腺苷酰基转移酶(AT)和去腺苷酰基(AR)结构域的活性催化GS的腺苷酰化和去腺苷酰化两者。在氮限制条件下,glnA被表达,且GlnE的AR结构域使GS去腺苷酰化,从而使GS具有活性。在氮过量的条件下,glnA表达被关闭,且GlnE的AT结构域由谷氨酰胺变构活化,从而引起GS的腺苷酰化和失活。
此外,draT基因也可以是使用本文所描述的方法促进基于田地的固氮的基因变异的靶标。一旦固氮酶由细胞产生,则固氮酶关闭代表在高氮条件下细胞下调固定活性的另一水平。可以通过降低DraT的表达水平来去除这种关闭。
赋予新微生物表型的方法可以在转录、翻译和翻译后水平上进行。转录水平包含启动子处的改变(例如改变σ因子的亲和力或转录因子的结合位点,包含启动子的全部或部分删除)或改变转录终止子和衰减子。翻译水平包含核糖体结合位点处的变化和改变mRNA降解信号。翻译后水平包含使酶的活性位点突变和改变蛋白质-蛋白质相互作用。这些变化可以以多种方式实现。可以通过将天然核糖体结合位点(RBS)或启动子与强度/效率较低的另一个交换来实现表达水平的降低(或完全消除)。可以将ATG起始位点交换为GTG、TTG或CTG起始密码子,这引起编码区的翻译活性降低。完全消除表达可以通过敲除(删除)基因的编码区来完成。将开放阅读框(ORF)移码可能会引起沿ORF的过早终止密码子,从而产生非功能性截短产物。插入框内终止密码子也会类似地产生非功能性截短产物。也可以在N或C端添加降解标签以降低特定基因的有效浓度。
相反,本文所描述的基因的表达水平可以通过使用更强的启动子来实现。为了确保在高氮水平条件(或任何其它条件)期间具有高启动子活性,可以获得高氮水平条件下全基因组的转录谱,且可以从数据集中选出具有所需转录水平的活性启动子来替换弱启动子。弱起始密码子可以与ATG起始密码子交换,以获得更好的翻译起始效率。弱核糖体结合位点(RBS)也可以与翻译起始效率更高的不同RBS交换。另外,还可以进行位点特异性诱变以更改酶的活性。
提高植物中进行的固氮的水平可以引起作物生产所需的化肥的量减少,且减少温室气体排放(例如,氧化亚氮)。
细菌种群的产生
细菌的分离
可以通过从天然植物的表面或组织中提取微生物来获得适用于本文所揭示的方法和组合物的微生物。可以通过研磨种子以分离微生物来获得微生物。可以通过在不同土壤样品中种植种子且从组织中回收微生物来获得微生物。另外,可以通过用外源微生物接种植物且确定哪些微生物出现在植物组织中来获得微生物。植物组织的非限制性实例可包含种子、幼苗、叶、插条、植株、鳞茎或块茎。
获得微生物的方法可以是通过从土壤中分离细菌。细菌可从各种土壤类型中收集。在一些实例中,土壤的特征可以在于如高或低肥力、水分水平、矿物质水平和各种耕作实践的性状。例如,土壤可能参与轮作,在轮作中,在连续种植季节中在相同土壤中种植不同作物。不同作物在相同土壤上的依序生长可防止某些矿物质不成比例的耗乏。可以从在选定土壤中生长的植物中分离出细菌。可以在生长2-6周后收获幼苗植株。例如,在一轮收获中可以收集至少400个分离株。土壤和植物类型揭示植物表型以及条件,所述条件允许某些表型的下游富集。
可以从植物组织中分离出微生物以评定微生物性状。以改变用于加工组织样品的参数,以分离不同类型的缔合微生物,如根际细菌、附生菌或内生菌。分离株可以在无氮培养基中培养,以富集进行固氮的细菌。或者,可以从全球菌株库获得微生物。
进行植物内(In planta)分析以评定微生物性状。在一些实施例中,可以加工植物组织,以便通过高通量加工进行DNA和RNA筛选。另外,非侵入性测量可以用于评定植物特征,如定殖。可以逐株(plant-by-plant)获得对野生微生物的测量。还可以使用中等通量方法在田地获得对野生微生物的测量。测量可以随时间推移连续进行。可以使用模型植物系统,包含(但不限于)狗尾草属。
植物系统中的微生物可以经由进行植物系统中微生物的转录谱分析来筛选。通过转录谱分析筛选的实例是使用定量聚合酶链反应(qPCR)、用于转录物检测的分子条形码、下一代测序和用荧光标记物进行微生物标记的方法。可以测量影响因素以评定温室中的定殖,包含(但不限于)微生物组、非生物因素、土壤条件、氧气、水分、温度、接种物状况和根部定位。如本文所描述,可以通过用IRMS或NanoSIMS测量15N气体/肥料(稀释)来评定细菌中的固氮。NanoSIMS是高分辨率二次离子质谱分析。NanoSIMS技术是一种研究生物样品的化学活性的方式。可以在细胞、亚细胞、分子以及元素水平上研究驱动微生物体代谢的氧化反应的还原催化。NanoSIMS可以提供大于0.1μm的高空间分辨率。NanoSIMS可以检测同位素示踪剂,如
自动化温室可以用于植物分析。响应于微生物暴露的植物指标包含(但不限于)生物质量、叶绿体分析、CCD相机、体积断层摄影术测量。
富集微生物种群的一种方式是根据基因型。例如,利用靶向引物或特异性引物的聚合酶链反应(PCR)分析。为nifH基因设计的引物可以用于鉴别固氮生物,因为固氮生物在固氮过程中表达nifH基因。微生物种群也可以通过不依赖于单细胞培养的方法和趋化性引导的分离方法来富集。或者,可以通过在选择培养基上培养微生物来进行微生物的靶向分离。针对所需性状富集微生物种群的预先策划方法可以通过生物信息学数据引导,且在本文中描述。
使用生物信息学富集具有固氮能力的微生物
生物信息学工具可以用于鉴别和分离促进植物生长的根际细菌(plant growthpromoting rhizobacteria;PGPR),PGPR根据其进行固氮的能力而选择。具有高固氮能力的微生物可以促进植物的有利性状。用于鉴别PGPR的生物信息学分析模式包含(但不限于)基因组学、宏基因组学(metagenomics)、靶向分离、基因测序、转录组测序和建模。
利用如本文所描述的下一代测序和微生物版本控制方法,基因组学分析可以用于鉴别PGPR和确认突变的存在。
使用定殖预测算法,宏基因组学可以用于鉴别和分离PGPR。元数据(Metadata)也可以用于鉴别环境和温室样品中工程改造菌株的存在。
转录组学测序可以用于预测引起PGPR表型的基因型。另外,转录组学数据用于鉴别用于改变基因表达的启动子。转录组学数据可以结合全基因组序列(WGS)分析,以生成代谢和基因调节网络模型。
微生物驯化
从自然界中分离的微生物可以经历驯化过程,在驯化过程中微生物转化为可基因追踪和鉴别的形式。驯化微生物的一种方式是用抗生素抗性对微生物进行工程改造。工程改造抗生素抗性的过程可以通过确定野生型微生物菌株中的抗生素敏感性来开始。如果细菌对抗生素敏感,则抗生素可以作为抗生素抗性工程改造的良好候选物。随后,可以使用重组工程方法将抗生素抗性基因或反向可选择(counterselectable)自杀载剂并入到微生物的基因组中。反向可选择自杀载剂可由删除目的基因、可选择标记物和反向可选择标记物sacB组成。反向选择可以用于将天然微生物DNA序列与抗生素抗性基因交换。中等通量方法可以用于同时评估多个微生物,允许平行驯化。替代的驯化方法包含使用归巢核酸酶(homing nuclease)来防止自杀载剂序列环出或获得中间载剂序列。
可以通过几种方法将DNA载剂引入到细菌中,包含电穿孔和化学转化。可以使用标准载剂库进行转化。基因编辑方法的一个实例是CRISPR,前面存在Cas9测试,以确保Cas9在微生物中的活性。
微生物的非转基因工程改造
具有有利性状的微生物种群可以经由定向进化获得。定向进化是模仿自然选择过程以使蛋白质或核酸朝向自定义目标进化的方法。定向进化的实例是当将随机突变引入到微生物种群中时,选择具有最有利性状的微生物,且使所选微生物继续生长。促进生长的根际细菌(PGPR)中最有利的性状可以是固氮。基于每次迭代后的选择过程,定向进化的方法可以是迭代和自适应的。
可以生成具有高固氮能力的促进植物生长的根际细菌(PGPR)。PGPR的进化可以经由引入基因变异来进行。基因变异可以经由以下引入:聚合酶链反应诱变、寡核苷酸定向诱变、饱和诱变、片段改组诱变、同源重组、CRISPR/Cas9系统、化学诱变和其组合。这些方法可以将随机突变引入到微生物种群中。例如,可以经由寡核苷酸定向诱变使用合成DNA或RNA生成突变体。可以使用质粒上含有的工具生成突变体,稍后将质粒消除(cured)。可以使用来自具有改良的性状的其它物种的库来鉴别目的基因,所述性状包含(但不限于)改良的PGPR特性、改良的谷类定殖、提高的氧敏感性、增加的固氮和增加的氨排泄。可以使用如Geneious或Platypus设计软件的软件基于这些库设计属内基因。可以借助机器学习来设计突变。可以借助代谢模型来设计突变。可以使用a la Platypus完成突变的自动化设计,且将引导Cas定向诱变的RNA。
属内基因可以转移到宿主微生物中。另外,报告系统也可以转移到微生物中。报告系统表征启动子、确定转化成功、筛选突变体且充当阴性筛选工具。
携载突变的微生物可以经由连续传代培养。微生物菌落含有微生物的单一变异体。借助于自动菌落选择器和液体处理器来筛选微生物菌落。具有基因重复和拷贝数增加的突变体表达所需性状的更高基因型。
基于固氮的促进植物生长的微生物的选择
可以使用评定固氮的各种分析筛选微生物菌落。一种测量固氮的方法是通过测量氮排泄的单发酵分析。替代方法是乙炔还原分析(ARA),其随时间在线取样。ARA可以在微管阵列的高通量板中进行。ARA可以用活植物和植物组织进行。可以在ARA分析中改变培养基配方和培养基氧浓度。筛选微生物变异体的另一方法是通过使用生物传感器。NanoSIMS和拉曼显微光谱法(Raman microspectroscopy)的使用可以用于研究微生物的活性。在一些情况下,也可以使用在生物反应器中发酵的方法培养且扩增细菌。生物反应器被设计成提高细菌生长的稳健性且降低细菌对氧的敏感性。基于中到高TP板的微发酵罐用于评估氧敏感性、营养需求、固氮和氮排泄。细菌也可以与竞争性微生物或有益微生物共培养以阐明隐藏的路径。流式细胞仪可以用于使用化学、比色或荧光指示剂筛选产生高水平氮的细菌。可以在存在或不存在氮源的情况下培养细菌。例如,可将细菌与谷氨酰胺、氨、尿素或硝酸盐一起培养。
引导微生物重塑-概观
引导微生物重塑是一种系统地鉴别和改进作物微生物组内物种作用的方法。在一些方面,且根据分组/分类的特定方法,所述方法包括三个步骤:1)通过映射植物-微生物相互作用和预测连接到特定表现型的调节网络来选择候选物种、2)通过微生物基因组内调节网络和基因簇的物种内杂交对微生物表现型的实用和可预测改进,和3)筛选和选择产生所需作物表现型的新微生物基因型。
为了系统地评定菌株的改良,创建一个模型,所述模型将微生物群落的定殖动态与关键物种的基因活性联系起来。模型用于预测非属间基因重塑的基因靶标(即以非转基因方式工程改造微生物的遗传架构)。参见图1A用于所述过程的实施例的图形表示。
如图1A中所说明,作物微生物组的合理改进可用于增加土壤生物多样性、调节关键物种的影响,和/或改变重要代谢路径的计时和表达。
为此目的,本发明人已经开发了一种鉴别和改良作物微生物组体内的菌株的作用的平台。在一些方面,本发明人调用此过程微生物育种。
在实例(例如,在实例1中)中,将进一步详细描述前述“引导的微生物重塑”过程,标题为:“引导的微生物重塑-农业微生物物种合理改进的平台”。
连续传代
可以通过连续传代来实现生产用于改良植物性状(例如,固氮)的细菌。除了鉴别能够赋予一或多种植物一或多种改良性状的细菌和/或组合物外,还可以通过选择具有受微生物菌群影响的特定改良性状的植物来实现此细菌的生产。生产用于改良植物性状的细菌的一种方法包含以下步骤:(a)从第一植物的组织或土壤中分离细菌;(b)将基因变异引入到细菌中的一或多种中,以产生一或多种变异细菌;(c)使多种植物暴露到变异细菌;(d)从多种植物中的一种的组织或土壤中分离细菌,其中从中分离出细菌的植物相对于所述多种植物中的其它植物具有改良性状;(e)用从具有改良性状的植物中分离的细菌(步骤(d))重复步骤(b)到(d)。步骤(b)到(d)可以重复任何次数(例如,一次、两次、三次、四次、五次、十次或更多),直到植物中的改良性状达到所需水平。此外,多种植物可以是多于两种的植物,如10到20种植物,或20种或更多、50种或更多、100种或更多、300种或更多、500种或更多或1000种或更多的植物。
除了获得具有改良性状的植物外,还获得了细菌种群,所述细菌种群包括有包括引入到一或多种基因(例如,调节固氮的基因)中的一或多种基因变异的细菌。通过重复上文所描述的步骤,可以获得包含与目的植物性状相关的种群中最适当成员的细菌种群。可以如通过遗传和/或表型分析来鉴别此种群中的细菌且确定其有益特性。在步骤(a)中可能会对分离出的细菌进行遗传分析。可以使用包含以下的技术获得表型和/或基因型信息:植物源的化学组分的高通量筛选、包含遗传物质的高通量测序的测序技术、差异显示技术(包含DDRT-PCR和DD-PCR)、核酸微阵列技术、RNA测序(全转录组鸟枪法测序(WholeTranscriptome Shotgun Sequencing))和qRT-PCR(定量实时PCR)。所获得的信息可以用于获得有关所存在细菌的身份和活性的群落谱分析信息,如系统发育分析或基于微阵列的编码rRNA操纵子组分或其它分类学信息性基因座的核酸筛选。分类学信息性基因座的实例包含16S rRNA基因、23S rRNA基因、5S rRNA基因、5.8S rRNA基因、12S rRNA基因、18S rRNA基因、28S rRNA基因、gyrB基因、rpoB基因、fusA基因、recA基因、coxl基因、nifD基因。在US20140155283中描述了分类谱分析以确定种群中存在的分类单元的实例方法。细菌鉴别可包括表征一或多种基因或一或多种信号传导路径,如与固氮路径相关的基因的活性。细菌种群中也可能存在不同细菌物种之间的协同相互作用(其中两种成分由于其组合而使所需效果增加的程度超过累加量)。
基因变异-基因组改变的位置和来源
基因变异可以是选自由以下组成的群组的基因:nifA、nifL、ntrB、ntrC、glnA、glnB、glnK、draT、amtB、glnD、glnE、nifJ、nifH、nifD、nifK、nifY、nifE、nifN、nifU、nifS、nifV、nifW、nifZ、nifM、nifF、nifB和nifQ。基因变异可以是编码具有选自由以下组成的群组的功能的蛋白质的基因中的变异:谷氨酰胺合成酶、谷氨酰胺酶、谷氨酰胺合成酶腺苷酰基转移酶、转录活化子、抗转录活化子、丙酮酸黄素氧还蛋白氧化还原酶、黄素氧还蛋白或NAD+-二氮-还原酶aDP-D-核糖基转移酶。基因变异可以是引起以下中的一或多种的突变:NifA或谷氨酰胺酶的表达或活性提高;NifL、NtrB、谷氨酰胺合成酶、glnB、glnK、draT、amtB的表达或活性降低;GlnE的去腺苷酰基的活性降低;或GlnD的去尿苷酰基的活性降低。引入基因变异可包括在靶位点插入和/或删除一或多个核苷酸,如1、2、3、4、5、10、25、50、100、250、500或更多个核苷酸。引入到本文所揭示的方法的一或多种细菌中的基因变异可以是敲除突变(例如删除启动子、插入或删除以产生过早的终止密码子、删除整个基因),或可以是除去或消除蛋白质结构域的活性(例如影响活性位点的点突变,或删除编码蛋白质产物的相关部分的基因的一部分),或其可以改变或消除靶基因的调节序列。也可以插入一或多个调节序列,包含异源调节序列和在与引入基因变异的细菌相对应的细菌物种或属的基因组内发现的调节序列。此外,可以基于细菌培养物中或植物组织内的基因表达水平来选择调节序列。基因变异可以是特异性引入到靶位点的预定基因变异。基因变异可以是靶位点内的随机突变。基因变异可以是一或多个核苷酸的插入或删除。在一些情况下,在将细菌暴露到植物以评定性状改良之前,将多种不同的基因变异(例如,2、3、4、5、10种或更多)引入到一或多种分离的细菌中。多种基因变异可以是以上类型中的任一种、相同或不同类型和任何组合。在一些情况下,连续引入多种不同的基因变异,在第一分离步骤之后引入第一基因变异,在第二分离步骤之后引入第二基因变异,以此类推,以便在细菌中积累多种基因变异,赋予相关植物逐渐改良的性状。
基因变异-引入基因组改变的方法
一般来说,术语“基因变异”是指相对于参考多核苷酸,如参考基因组或其部分,或参考基因或其部分,而引入到多核苷酸序列中的任何变化。基因变异可以被称作“突变”,且包括基因变异的序列或生物体可被称作“基因变异体”或“突变体”。基因变异可以具有任何数目的效应,如一些生物活性,包含基因表达、代谢和细胞信号传导的提高或降低。基因变异可以特异性引入到靶位点,或随机引入。多种分子工具和方法可用于引入基因变异。例如,可以经由以下来引入基因变异:聚合酶链反应诱变、寡核苷酸定向诱变、饱和诱变、片段改组诱变、同源重组、重组工程、λ红介导的重组、CRISPR/Cas9系统、化学诱变和其组合。引入基因变异的化学方法包含使DNA暴露到化学诱变剂,例如甲磺酸乙酯(EMS)、甲磺酸甲酯(MMS)、N-亚硝基脲(EN U)、N-甲基-N-硝基-N'-亚硝基胍、4-硝基喹啉N-氧化物、硫酸二乙酯、安息香比林(benzopyrene)、环磷酰胺、博来霉素(bleomycin)、三乙基三聚氰胺、丙烯酰胺单体、氮芥、长春新碱、二环氧烷烃(例如,二环氧丁烷)、ICR-170、甲醛、盐酸丙卡巴肼、环氧乙烷、二甲基亚硝胺、7,12二甲基苯并(a)蒽、苯丁酸氮芥、六甲基磷酰胺、白消安等。辐射突变诱导剂包含紫外线辐射、γ辐射、X射线和快中子轰击。还可使用例如三甲基补骨脂素(trimethylpsoralen)伴随紫外线将基因变异引入到核酸中。移动DNA元件,例如转座因子(transposable element)的随机或靶向插入是生成基因变异的另一合适方法。可以在无细胞体外系统中在扩增期间将基因变异引入到核酸中,例如,使用如易错PCR的聚合酶链反应(PCR)技术。可以使用DNA改组技术(例如,外显子改组、结构域交换等)将基因变异体外引入到核酸中。由于细胞中缺乏DNA修复酶,也可以将基因变异引入到核酸中,例如,预期在细胞中存在编码突变DNA修复酶的突变基因会在细胞基因组中生成高频突变(即,约1个突变/100个基因到1个突变/10,000个基因)。编码DNA修复酶的基因的实例包含(但不限于)MutH、Mut S、Mut L和Mut U,和其在其它物种中的同源物(例如,MSH 1 6、PMS1 2、MLH 1、GTBP、ERCC-1等)。引入基因变异的各种方法的实例描述提供于例如Stemple(2004)《自然(Nature)》5:1-7;蒋(Chiang)等人(1993)《PCR方法应用(PCR Methods Appl)》2(3):210-217;Stemmer(1994)《美国国家科学院院刊》91:10747-10751;和美国专利第6,033,861号和第6,773,900号中。
引入到微生物中的基因变异可分类为转基因、同源转基因、基因组内、属内、属间、合成、进化、重排或SNP。
可以将基因变异引入到微生物内的许多代谢路径中,以诱发上文所描述的性状的改良。代表性路径包含硫吸收路径、糖原生物合成、谷氨酰胺调控路径、钼吸收路径、固氮路径、氨同化、氨排泄或分泌、氮吸收、谷氨酰胺生物合成、厌氧氨氧化(annamox)、磷酸盐溶解、有机酸转运、有机酸产生、凝集素产生、反应性氧自由基清除基因、吲哚乙酸生物合成、海藻糖生物合成、植物细胞壁降解酶或路径、根附着基因、胞外多糖分泌、谷氨酸合酶路径、铁吸收路径、铁载剂路径、几丁质酶路径、ACC脱氨酶、谷胱甘肽生物合成、磷信号传导基因、群体猝灭路径、细胞色素路径、血红蛋白路径、细菌血红蛋白样路径、小RNA rsmZ、根瘤菌毒素生物合成、lapA粘附蛋白、AHL群体感应路径、吩嗪生物合成、环脂肽生物合成和抗生素产生。
CRISPR/Cas9(规律成簇的间隔短回文重复序列)/CRISPR相关(Cas)系统可以用于引入所需突变。CRISPR/Cas9通过使用CRISPR RNA(crRNA)引导入侵核酸沉默,为细菌和古细菌提供针对病毒和质粒的适应性免疫。Cas9蛋白(或其功能等同物和/或变异体,即Cas9样蛋白)天然含有DNA核酸内切酶活性,其依赖于蛋白质与被称为crRNA和tracrRNA(也称为引导RNA)的两种天然存在的或合成的RNA分子缔合。在一些情况下,两个分子共价连接以形成单一分子(也称为单一引导RNA(“sgRNA”))。因此,Cas9或Cas9样蛋白与DNA靶向RNA(所述术语涵盖双分子指导RNA配置和单分子指导RNA配置)相关联,所述DNA靶向RNA激活Cas9或Cas9样蛋白并将蛋白质指导到靶核酸序列。如果Cas9或Cas9样蛋白保留其天然酶功能,则其将切割靶DNA以产生双链断裂,这可导致基因组改变(即编辑:删除、插入(当存在供体多核苷酸时)、替换等),从而改变基因表达。Cas9的一些变异体(其变异体被术语Cas9样涵盖)已被改变,使得它们具有降低的DNA切割活性(在一些情况下,它们切割单链而不是靶DNA的两条链,而在其它情况下,它们严重减少到没有DNA切割活性)。用于引入基因变异的CRISPR系统的其它示例性描述可见于例如US8795965。
作为一种循环扩增技术,聚合酶链反应(PCR)诱变使用诱变引物来引入所需突变。通过变性、粘接和延伸的循环进行PCR。通过PCR扩增后,可以通过以下实现突变DNA的选择和亲本质粒DNA的去除:1)在PCR期间用羟甲基化-dCTP替换dCTP,接着用限制酶消化以仅去除非羟甲基化的亲本DNA;2)同时对抗生素抗性基因和所研究的基因进行诱变,将质粒改变为不同的抗生素抗性,新的抗生素抗性有助于其后选择所需突变;3)引入所需突变后,用仅切割甲基化DNA的限制性酶Dpnl消化亲本甲基化模板DNA,从而回收诱变的未甲基化链;或4)在额外的连接反应中使突变的PCR产物环化,以提高突变DNA的转化效率。示例性方法的进一步描述可见于例如US7132265、US6713285、US6673610、US6391548、US5789166、US5780270、US5354670、US5071743和US20100267147。
寡核苷酸定向诱变,也称为定点诱变,典型地利用合成DNA引物。此合成引物含有所需突变,且与突变位点周围的模板DNA互补,因此其可以与目的基因中的DNA杂交。突变可以是单个碱基变化(点突变)、多个碱基变化、删除或插入或这些的组合。然后,使用复制基因的其余部分的DNA聚合酶延伸单链引物。如此复制的基因含有突变位点,且随后可将其作为载剂引入到宿主细胞中并克隆。最后,可以通过DNA测序选择突变体,以检查其含有所需突变。
可以使用易错PCR引入基因变异。在此技术中,在缺乏序列复制的保真度的条件下,使用DNA聚合酶扩增目的基因。结果是扩增产物在序列中含有至少一个错误。当基因被扩增且反应的所得(多种)产物在与模板分子相比时在序列上含有一或多种改变时,所得产物与模板相比发生诱变。引入随机突变的另一手段是使细胞暴露到化学诱变剂,如亚硝基胍或甲磺酸乙酯(内斯特曼(Nestmann),《突变研究(Mutat Res)》1975年6月;28(3):323-30),且随后从宿主中分离出含有基因的载剂。
饱和诱变是随机诱变的另一形式,其中人们试图在基因的特定位点或狭窄区域生成所有或几乎所有可能的突变。在广义上,饱和诱变包括诱变确定的待诱变的多核苷酸序列(其中待诱变的序列的长度是例如15到100,000个碱基)中的诱变盒的完整集合(其中每个盒的长度是例如1-500个碱基)。因此,将一组突变(例如在1到100个突变范围内)引入到每个待诱变的盒中。在应用一轮饱和诱变的过程中,待引入到一个盒中的突变的分组可以与待引入到第二盒中的突变的第二分组不同或相同。此类分组以删除、添加、特定密码子的分组和特定核苷酸盒的分组为例。
片段改组诱变,也称为DNA改组,是一种快速传播有益突变的方式。在改组过程的实例中,DNA酶用于将一组亲本基因片段化成长度例如约50-100bp的片段。这之后是不用引物的聚合酶链反应(PCR)-具有足够重叠的同源序列的DNA片段将彼此粘接,且然后通过DNA聚合酶延伸。在DNA分子中的一些达到亲本基因的大小后,允许进行几轮此PCR延伸。随后可以用另一PCR扩增这些基因,此添加了被设计成与链末端互补的引物。引物可以在其5'末端具有添加的额外序列,如连接到克隆载剂中所需的限制性酶识别位点的序列。US20050266541中提供了改组技术的其它实例。
同源重组诱变涉及外源DNA片段与靶向多核苷酸序列之间的重组。双链断裂发生后,在断裂的5'末端附近的DNA区段在被称为切除的过程中被切除。在随后的链入侵步骤中,断裂的DNA分子的突出3'端随后“侵入”未断裂的相似或相同的DNA分子。所述方法可以用于删除基因、去除外显子、添加基因和引入点突变。同源重组诱变可以是永久性或条件性的。典型地,还提供重组模板。重组模板可以是另一载剂的组分、含于单独的载剂中或作为单独的多核苷酸提供。在一些实施例中,重组模板被设计成充当同源重组中的模板,如在被位点特异性核酸酶切刻(nicked)或切割的靶序列内或附近。模板多核苷酸可具有任何合适的长度,如约或大于约10、15、20、25、50、75、100、150、200、500、1000或更多个核苷酸的长度。在一些实施例中,模板多核苷酸与包括靶序列的多核苷酸的一部分互补。当最佳比对时,模板多核苷酸可能与靶序列的一或多个核苷酸(例如,约或大于约1、5、10、15、20、25、30、35、40、45、50、60、70、80、90、100或更多个核苷酸)重叠。在一些实施例中,当模板序列和包括目标序列的多核苷酸最佳对准时,模板多核苷酸的最接近核苷酸在目标序列的约1、5、10、15、20、25、50、75、100、200、300、400、500、1000、5000、10000或更多个核苷酸内。在同源重组方法中适用的定点核酸酶的非限制性实例包含锌指核酸酶、CRISPR核酸酶、TALE核酸酶和大范围核酸酶(meganuclease)。关于此类核酸酶的用途的进一步描述,参见例如US8795965和US20140301990。
主要产生点突变和短删除、插入、颠换和/或转换的诱变剂,包含化学诱变剂或辐射可用于产生基因变异。诱变剂包含(但不限于)甲磺酸乙酯、甲磺酸甲酯、N-乙基-N-亚硝基脲、三乙基三聚氰胺、N-甲基-N-亚硝基脲、丙卡巴肼、苯丁酸氮芥、环磷酰胺、硫酸二乙酯、丙烯酰胺单体、美法仑、氮芥、长春新碱、二甲基亚硝胺、N-甲基-N'-硝基-亚硝基胍、亚硝基胍、2-氨基嘌呤、7,12二甲基-苯并(a)蒽、环氧乙烷、六甲基磷酰胺、白消安、二环氧烷烃(二环氧辛烷、二环氧丁烷等)、2-甲氧基-6-氯-9[3-(乙基-2-氯-乙基)氨基丙氨基]吖啶二盐酸盐和甲醛。
引入基因变异可能是一个不完全的过程,使得经过处理的细菌种群中的一些细菌携载所需突变,而其它细菌不会。在一些情况下,期望施加选择压力以便富集携载所需基因变异的细菌。传统上,成功基因变异体的选择涉及针对或反对基因变异赋予或消除的某些功能进行选择,如在插入抗生素抗性基因或废除能够将非致死化合物转化成致死代谢物的代谢活性的情况下。也有可能基于多核苷酸序列本身施加选择压力,使得仅需要引入所需基因变异(例如,不另外需要可选标记物)。在此情况下,选择压力可以包括切割缺乏引入到靶位点的基因变异的基因组,使得选择有效地针对寻求将基因变异引入其中的参考序列。典型地,切割发生在靶位点的100个核苷酸内(例如在距靶位点75、50、25、10或更少的核苷酸内,包含在靶位点处或靶位点内的切割)。切割可以由选自由以下组成的群组的位点特异性核酸酶引导:锌指核酸酶、CRISPR核酸酶、TALE核酸酶(TALEN)或大范围核酸酶。除了没有提供用于同源重组的模板之外,此类过程类似于用于在靶位点处增强同源重组的过程。结果,缺乏所需基因变异的细菌更有可能经历切割,所述切割如果不进行修复,则会导致细胞死亡。然后可以分离出经受住选择的细菌,以用于暴露到植物以评定改良性状的赋予。
CRISPR核酸酶可以用作位点特异性核酸酶以引导靶位点的切割。可以通过使用Cas9杀死未突变的细胞来获得改良的突变微生物选择。然后用突变微生物接种植物,以重新确认共生且产生进化压力以选择有效的共生体。随后可以从植物组织中重新分离出微生物。用于针对非变异体选择的CRISPR核酸酶系统可以采用与上文关于引入基因变异所描述的那些相似的元件,不同之处在于不提供用于同源重组的模板。因此,针对靶位点的切割促进受影响细胞的死亡。
可使用特异性诱导靶位点处切割的其它选项,如锌指核酸酶、TALE核酸酶(TALEN)系统和大范围核酸酶。锌指核酸酶(ZFN)是通过将锌指DNA结合结构域与DNA切割结构域融合而产生的人工DNA核酸内切酶。可以将ZFN工程改造成靶向所需DNA序列,且这使得锌指核酸酶能够切割独特的靶序列。当引入到细胞中时,ZFN可以用于通过诱导双链断裂来编辑细胞(例如,细胞基因组)中的靶DNA。转录活化子样效应物核酸酶(TALEN)是通过将TAL(转录活化子样)效应子DNA结合域融合到DNA切割域而生成的人工DNA核酸内切酶。TALEN可以被快速工程改造成结合几乎任何所需DNA序列,且当引入到细胞中时,TALEN可以用于通过诱导双链断裂来编辑细胞(例如,细胞的基因组)中的靶DNA。大范围核酸酶(归巢核酸内切酶)是内切脱氧核糖核酸酶,其特征在于大识别位点(12到40个碱基对的双链DNA序列。大范围核酸酶可以用于以高度靶向方式替换、除去或修饰序列。可以通过蛋白质工程改造修饰靶向序列的识别序列来改变靶向序列。大范围核酸酶可以用于修饰所有基因组类型,无论是细菌、植物还是动物,且通常分组为四个家族:LAGLIDADG家族(SEQ ID NO:1)、GIY-YIG家族、His-Cyst盒家族和HNH家族。示例性归巢核酸内切酶包含I-SceI、I-CeuI、PI-PspI、PI-Sce、I-SceIV、I-CsmI、I-PanI、I-SceII、I-PpoI、I-SceIII、I-CreI、I-TevI、I-TevII和I-TevIII。
基因变异-鉴别的方法
本发明的微生物可以通过已经引入到所述微生物中的一或多种基因修饰或改变来鉴别。可以鉴别所述基因修饰或改变的一种方法是经由参考含有足以鉴别基因修饰或改变的微生物的基因组序列的一部分的SEQ ID NO。
此外,在未具有引入到其基因组中的基因修饰或改变(例如野生型WT)的微生物的情况下,本发明可以利用16S核酸序列来鉴别所述微生物。16S核酸序列是“分子标记物”或“遗传标记物”的实例,其是指用于显现核酸序列的特征差异的方法中的指示符。此类指示物的实例是限制性片段长度多形现象(RFLP)标记物、经扩增的片段长度多形现象(AFLP)标记物、单核苷酸多态性(SNP)、插入突变、微卫星标记物(SSR)、经序列表征的扩增区域(SCAR)、经裂解的扩增多晶序列(CAPS)标记物或同工酶标记物或本文中所描述的标记物的组合(其定义特定基因和染色体位置)。标记物进一步包含编码16S或18S rRNA的多核苷酸序列,和内部转录间隔物(ITS)序列,其是在已经证实在彼此相比时尤其适用于阐明关系或区别的小亚基与大亚基rRNA基因之间发现的序列。此外,本发明利用目的基因(例如nif H、D、K、L、A、glnE、amtB等)中发现的独特序列来鉴别本文所揭示的微生物。
主要rRNA亚基16S的一级结构包含保守区、可变区和高变区的特定组合,所述保守区、可变区和高变区以不同的速率进化,且能够分辨非常古老的谱系(如结构域)和更现代的谱系(如属)两者。16S亚基的二级结构包含导致约67%残基的碱基配对的约50个螺旋。这些高度保守性二级结构特征具有极大功能重要性且可以用于确保多个序列比对和系统发生分析中的位置同源性。在过去的几十年中,16S rRNA基因已经成为最测序的分类标志物,且是当前细菌和古细菌系统分类的基石(亚尔萨(Yarza)等人,2014,《自然评论.微(NatureRev.Micro.)》12:635-45)。
因此,在某些方面,本发明提供序列,其与表23、24、30、31和32中的任何序列具有至少约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列一致性。
因此,在某些方面,本发明提供包括以下序列的微生物:其与SEQ ID NO:62-303具有至少约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列一致性。这些序列和其相关描述可见于表31和32。
在一些方面,本发明提供包括16S核酸序列的微生物,所述16S核酸序列与SEQ IDNO:85、96、111、121、122、123、124、136、149、157、167、261、262、269、277-283具有至少约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列一致性。这些序列和其相关描述可见于表32。
在一些方面,本发明提供包括核酸序列的微生物,所述核酸序列与SEQ ID NO:86-95、97-110、112-120、125-135、137-148、150-156、158-166、168-176、263-268、270-274、275、276、284-295具有至少约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列一致性。这些序列和其相关描述可见于表32。
在一些方面,本发明提供包括核酸序列的微生物,所述核酸序列与SEQ ID NO:177-260、296-303具有至少约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列一致性。这些序列和其相关描述可见于表32。
在一些方面,本发明提供包括核酸序列的微生物、或包括核酸序列的引物、或包括核酸序列的探针、或包括核酸序列的非天然接合序列,其与SEQ ID NO:304-424具有至少约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列一致性。这些序列和其相关描述可见于表30。
在一些方面,本发明提供包括非天然接合序列的微生物,所述非天然接合序列与SEQ ID NO:372-405具有至少约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列一致性。这些序列和其相关描述可见于表30。
在一些方面,本发明提供包括氨基酸序列的微生物,所述氨基酸序列与SEQ IDNO:77、78、81、82或83具有至少约70%、71%、72%、73%、74%、75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或100%序列一致性。这些序列和其相关描述可见于表31。
基因变异-检测方法:引物、探针和分析
本发明教示适用于检测本文所教示的微生物的引物、探针和分析。在一些方面,本发明提供检测WT亲本菌株的方法。在其它方面,本发明提供检测来源于WT菌株的非属间工程改造微生物的方法。在各方面中,本发明提供鉴别微生物中的非属间基因改变的方法。
在各方面中,本发明的基因组工程改造方法导致在衍生的非属间微生物中产生非天然核苷酸“接合”序列。这些非天然存在的核苷酸接合点可以用作指示本文所教示的微生物中特定基因改变的存在的诊断类型。
本发明技术能够经由利用特殊的定量PCR方法(包含独特设计的引物和探针)检测到这些非天然存在的核苷酸接合点。在一些方面中,本发明的探针结合到非天然存在的核苷酸接合序列。在一些方面中,利用传统PCR。在其它方面中,利用实时PCR。在一些方面中,利用定量PCR(qPCR)。
因此,本发明可以涵盖利用两种常见方法实时检测PCR产物:(1)插入任何双链DNA中的非特异性荧光染料,和(2)由寡核苷酸组成的序列特异性DNA探针,所述寡核苷酸经荧光报告基因标记,从而允许只在探针与其互补序列杂交之后检测到。在一些方面中,只有非天然存在的核苷酸接合点将经由所教示的引物扩增,且因此可以经由非特异性染料或经由利用特异性杂交探针检测。在其它方面,选择本发明的引物使得引物侧接接合序列的两侧,使得如果发生扩增反应,则存在所述接合序列。
本发明的方面涉及非天然存在的核苷酸接合序列分子本身,以及能够在轻度到严格杂交条件下结合到所述非天然存在的核苷酸接合序列的其它核苷酸分子。在一些方面中,能够在轻度到严格杂交条件下结合到所述非天然存在的核苷酸接合序列的核苷酸分子称为“核苷酸探针”。
在各方面中,基因组DNA可以从样品提取且用于通过使用qPCR定量本发明的微生物的存在。qPCR反应中所利用的引物可以是引物Blast设计的引物(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)以扩增野生型基因组的独特区域或工程改造的非属间突变菌株的独特区域。qPCR反应可以使用SYBR GreenER qPCR上清液通用(赛默飞世尔(Thermo Fisher)P/N 11762100)套组,仅使用正向和反向扩增引物;或者,卡帕探针力(Kapa Probe Force)套组(卡帕生物系统(Kapa Biosystems)P/N KK4301)可以与扩增引物和含有5'末端处的FAM染料标记的TaqMan探针、内部ZEN淬灭剂和3'末端处的微小凹槽粘合剂和微荧光猝灭剂(fluorescent quencher)一起使用。
某些引物、探针和非天然接合序列在表30中列出。qPCR反应效率可以使用由已知量的来自靶基因组的gDNA产生的标准曲线测量。可以使用组织重量和提取体积将数据标准化到每g新制重量的基因组复本。
定量聚合酶链反应(qPCR)是实时定量一或多种核酸序列的扩增的方法。PCR分析的实时定量允许通过比较目的扩增核酸与可充当校准标准的适当控制核酸序列来确定通过PCR扩增步骤产生的核酸的量。
TaqMan探针通常用于需要增加的特异性以用于定量靶核酸序列的qPCR分析中。TaqMan探针包含具有附接到5'末端的荧光团的寡核苷酸探针和附接到探针的3'末端的淬灭剂。当TaqMan探针保持与彼此紧密接触的探针的5'和3'末端相同时,淬灭剂阻止荧光团的荧光信号传输。TaqMan探针经设计以在由引物的特定集合扩增的核酸区域内退火。随着Taq聚合酶延伸引物且合成新生链,Taq聚合酶的5'到3'的核酸外切酶活性使已经退火到模板的探针降解。此探针降解释放荧光团,因此打破与淬灭剂的紧邻且允许荧光团的荧光。qPCR分析中检测到的荧光与所释放荧光团和存在于反应中的DNA模板的量成正比。
qPCR的特征允许从业者除去凝胶电泳制备的劳动密集型后扩增步骤,这通常需要用于观察传统PCR分析的扩增产物。qPCR优于常规PCR的益处是相当大的,且包含增加的速度、易用性、再现性和定量能力。
性状的改良
本发明的方法可用于引入或改良多种期望性状中的一或多种。可引入或改良的性状的实例包含:根部生物质量、根长、高度、芽长、叶数、水分利用效率、总生物质量、产量、果实大小、籽粒大小、光合作用速率、耐旱性、耐热性、耐盐性、对线虫胁迫的抗性、对真菌病原体的抗性、对细菌病原体的抗性、对病毒病原体的抗性、代谢物水平以及蛋白质组表达。期望的性状,包含高度、总生物质量、根部和/或芽生物质量、种子发芽、幼苗存活、光合效率、蒸腾速率、种子/果实数目或质量、植物籽粒或果实产量、叶片叶绿素含量、光合速率、根长或其任何组合可以用于测量生长,且与在相同条件下生长的参考农业植物(例如,无改良性状的植物)的生长速率进行比较。
如本文所描述,待引入或改良的优选性状是固氮。在一些情况下,与在相同条件下在土壤中生长的参考农业植物相比,由本文所描述的方法产生的植物展现性状差异大至少约5%,例如至少约5%、至少约8%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约40%、至少约50%、至少约60%、至少约75%、至少约80%、至少约80%、至少约90%或至少100%、至少约200%、至少约300%、至少约400%或更大。在其它实例中,与在相似条件下在土壤中生长的参考农业植物相比,由本文所描述的方法产生的植物展现性状差异大至少约5%,例如至少约5%、至少约8%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约40%、至少约50%、至少约60%、至少约75%、至少约80%、至少约80%、至少约90%或至少100%、至少约200%、至少约300%、至少约400%或更大。
可以在包含施加一或多种生物或非生物胁迫源的条件下评定待改良的性状。胁迫源的实例包含非生物胁迫(如热胁迫、盐胁迫、干旱胁迫、冷胁迫和低养分胁迫)和生物胁迫(如线虫胁迫、昆虫食草胁迫、真菌病原体胁迫、细菌病原体胁迫和病毒病原体胁迫)。
通过本发明的方法和组合物改良的性状可以是固氮,包含在先前不能进行固氮的植物中。在一些情况下,与引入任何基因变异之前从第一植物中分离出的细菌相比,根据本文所描述的方法分离的细菌产生1%或更多(例如2%、3%、4%、5%、6%、7%、8%、9%、10%、15%、20%或更多)的植物氮,这可以表示固氮能力提高至少2倍(例如3倍、4倍、5倍、6倍、7倍、8倍、9倍、10倍、20倍、50倍、100倍、1000倍或更多)。在一些情况下,细菌产生5%或更多的植物氮。在重复引入基因变异、暴露到多种植物且从具有改良性状的植物中分离细菌的步骤一或多次(例如1、2、3、4、5、10、15、25或更多次)后,可以实现所需水平的固氮。在一些情况下,在补充有谷氨酰胺、氨或其它化学氮源的肥料存在下实现提高的固氮水平。评定固氮程度的方法是已知的,其实例在本文中描述。
微生物育种是系统地鉴别和改进作物微生物组内物种作用的方法。方法包括三个步骤:1)通过绘制植物-微生物相互作用图谱且预测与特定表现型相关的调节网络来选择候选物种、2)通过调节网络和基因簇的种内杂交,对微生物表现型进行实用且可预测的改良,和3)筛选和选择产生所需作物表现型的新微生物基因型。为了系统地评定菌株的改良,创建一个模型,所述模型将微生物群落的定殖动态与关键物种的基因活性联系起来。所述模型用于预测遗传靶标育种,且提高选择微生物组编码的农艺相关性状改良的频率。
测量在农业相关的田地环境中所输送的氮
在所述田地中,所输送的氮的量可以通过定殖的函数乘以活性来确定。
以上等式需要(1)每单位植物组织的平均定殖,和(2)作为固定的氮的量或由每个微生物细胞排泄的氨的量的活性。为了转换成每英亩的氮气的磅数,在整个成熟期期间,随时间推移追踪玉米生长生理学,例如,植物的大小和相关联的根部系统。
可以通过以下等式计算每英亩季节输送到作物的氮的磅数:
所输送的氮=∫植物组织(t)×定殖(t)×活性(t)dt
植物组织(t)是随生长时间(t)的玉米植物组织的鲜重。用于合理地进行计算的值详细地描述于标题为根部、生长和养分吸收(门格尔农艺学公会部门(Mengel.Dept.ofAgronomy Pub).#AGRY-95-08(5月评论(Rev.May)-95.第1-8页))的出版物中。
定植(t)是在生长季节期间,在任何特定时间t下,在植物组织内每克植物组织鲜重发现的目的微生物的量。在仅可用的单个时间点的情况下,将单个时间点归一化为在季节上的峰值定殖速率,且相应地调整剩余时间点的定殖速率。
活性(t)是在生长季节期间,在任何特定时间t下,由每单位时间目的微生物固定的N的速率。在本文所揭示的实施例中,此活性速率通过在5mM谷氨酰胺存在下在ARA培养基中的体外乙炔还原分析(ARA)或在5mM铵离子存在下在ARA培养基中的铵排泄分析来近似。
随后通过对以上函数进行数值积分来计算氮输送量。在其中在设定时间点离散地测量上文所描述的变量的值的情况下,通过执行线性插值法来近似那些时间点之间的值。
固氮
本文描述增加植物中固氮的方法,其包括将植物暴露到细菌,所述细菌包括引入到一或多个调节固氮的基因中的一或多种基因变异,其中细菌在植物中产生1%或更多的氮(例如2%、5%、10%或更多),这可表示与在不存在细菌的情况下的植物相比,至少2倍的固氮能力。细菌可以在补充有谷氨酰胺、尿素、硝酸盐或氨的肥料的存在下产生氮。基因变异可以是任何数目且呈任何组合的本文(包含上文所提供的实例)中所描述的任何基因变异。可以将基因变异引入到选自由以下组成的群组的基因中:nifA、nifL、ntrB、ntrC、谷氨酰胺合成酶、glnA、glnB、glnK、draT、amtB、谷氨酰胺酶、glnD、glnE、nifJ、nifH、nifD、nifK、nifY、nifE、nifN、nifU、nifS、nifV、nifW、nifZ、nifM、nifF、nifB和nifQ。基因变异可以是引起以下中的一或多种的突变:nifA或谷氨酰胺酶的表达或活性提高;nifL、ntrB、谷氨酰胺合成酶、glnB、glnK、draT、amtB的表达或活性降低;GlnE的去腺苷酰基的活性降低;或GlnD的去尿苷酰基的活性降低。引入到本文所揭示的方法的一或多种细菌中的基因变异可以是敲除突变或其可以消除靶基因的调节序列,或其可以包括插入异源调节序列,例如,插入在相同细菌物种或属的基因组内发现的调节序列。可以基于细菌培养物中或植物组织内的基因表达水平来选择调节序列。基因变异可以通过化学诱变产生。步骤(c)中生长的植物可以暴露到生物或非生物胁迫源。
本文所描述的植物中发生的固氮的量可以几种方式测量,例如通过乙炔还原(AR)分析。乙炔还原分析可以在体外或体内进行。特定细菌向植物提供固定的氮的证据可以包含:1)接种后,植物总N显著增加,优选伴随植物中N浓度的提高;2)接种后,在N限制条件下氮缺乏症状减轻(其应包含干物质增加);3)通过使用
野生型固氮调节级联可以表示为数字逻辑电路,其中输入O
举例来说,可以从nif基因簇中除去nifL、nifA、nifT和nifX基因。可以通过对编码每个氨基酸序列的DNA进行密码子随机化来设计合成基因。进行密码子选择,指定密码子使用与天然基因中的密码子使用尽可能相异。扫描所提出的序列中任何不希望的特征,如限制酶识别位点、转座子识别位点、重复序列、σ54个σ70启动子、隐藏的核糖体结合位点和非依赖性终止子。选择合成核糖体结合位点以匹配每个对应的天然核糖体结合位点的强度,如通过构建荧光报告质粒,在所述质粒中基因起始密码子周围的150bp(-60到+90)与荧光基因融合。此嵌合体可以在Ptac启动子的控制下表达,且经由流式细胞术测量荧光。为了生成合成核糖体结合位点,生成使用合成表达盒的150bp(-60到+90)的报告质粒库。简单来说,合成表达盒可以由随机DNA间隔子、编码RBS库的简并序列和每个合成基因的编码序列组成。筛选多个克隆以鉴别与天然核糖体结合位点最佳匹配的合成核糖体结合位点。因此构建了由与天然操纵子相同的基因组成的合成操纵子,且对其功能互补进行了测试。US20140329326中提供了合成操纵子的进一步示例性描述。
细菌物种
可以从任何来源获得适用于本文所揭示的方法和组合物的微生物。在一些情况下,微生物可以是细菌、古细菌、原生动物或真菌。本发明的微生物可以是固氮微生物,例如固氮细菌、固氮古细菌、固氮真菌、固氮酵母或固氮原生动物。适用于本文所揭示的方法和组合物的微生物可以是产孢子(spore forming)微生物,例如产孢子细菌。在一些情况下,适用于本文所揭示的方法和组合物的细菌可以是革兰氏阳性细菌或革兰氏阴性细菌。在一些情况下,细菌可以是厚壁菌门(Firmicute phylum)的产内生孢子细菌。在一些情况下,细菌可以是固氮生物。在一些情况下,细菌可以不是固氮生物。
本发明的方法和组合物可以与古细菌(例如,嗜热自养甲烷热杆菌属(Methanothermobacter thermoautotrophicus))一起使用。
在一些情况下,可适用的细菌包含(但不限于)放射形土壤杆菌(Agrobacteriumradiobacter)、嗜酸热芽孢杆菌(Bacillus acidocaldarius)、嗜酸芽孢杆菌(Bacillusacidoterrestris)、土壤芽胞杆菌(Bacillus agri)、苏云金杆菌亚莎华亚种芽孢杆菌(Bacillus aizawai)、白色芽孢杆菌(Bacillus albolactis)、嗜碱芽孢杆菌(Bacillusalcalophilus)、蜂房芽孢杆菌(Bacillus alvei)、短小芽孢杆菌(Bacillusaminoglucosidicus)、噬胺芽胞杆菌(Bacillus aminovorans)、溶淀粉杆菌(Bacillusamylolyticus)(也称为溶淀粉类芽胞杆菌(Paenibacillus amylolyticus))解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、解硫胺素芽胞杆菌(Bacillus aneurinolyticus)、萎缩芽孢杆菌(Bacillus atrophaeus)、产氮芽胞杆菌(Bacillus azotoformans)、栗褐芽胞杆菌(Bacillus badius)、蜡样芽孢杆菌(Bacillus cereus)(同义词:内生藻芽孢杆菌(Bacillus endorhythmos)、水母芽孢杆菌(Bacillus medusa))、坚强芽孢杆菌(Bacilluschitinosporus)、环状芽孢杆菌(Bacillus circulans)、凝结芽孢杆菌(Bacilluscoagulans)、体内寄生虫芽孢杆菌(Bacillus endoparasiticus)、苛求芽孢杆菌(Bacillusfastidiosus)、坚强芽孢杆菌(Bacillus firmus)、库斯塔克芽孢杆菌(Bacilluskurstaki)、栖乳芽抱杆菌(Bacillus lacticola)、乳病杆菌(Bacillus lactimorbus)、乳杆菌(Bacillus lactis)、侧孢芽孢杆菌(Bacillus laterosporus)(也称为侧孢短芽孢杆菌(Brevibacillus laterosporus))、灿烂芽胞杆菌(Bacillus lautus)、缓死芽胞杆菌(Bacillus lentimorbus)、迟缓芽孢杆菌(Bacillus lentus)、地衣芽孢杆菌(Bacilluslicheniformis)、摩洛哥芽孢杆菌(Bacillus maroccanus)、巨大芽孢杆菌(Bacillusmegaterium)、metiens芽孢杆菌(Bacillus metiens)、蕈状芽孢杆菌(Bacillusmycoides)、纳豆芽孢杆菌(Bacillus natto)、食线虫芽孢杆菌(Bacillus nematocida)、黑曲霉芽孢杆菌(Bacillus nigrificans)、黑色芽孢杆菌(Bacillus nigrum)、泛酸芽孢杆菌(Bacillus pantothenticus)、金龟子芽孢杆菌(Bacillus popillae)、冷解糖芽胞杆菌(Bacillus psychrosaccharolyticus)、短小芽孢杆菌(Bacillus pumilus)、暹罗芽孢杆菌(Bacillus siamensis)、史氏芽胞杆菌(Bacillus smithii)、球形芽孢杆菌(Bacillussphaericus)、枯草芽孢杆菌(Bacillus subtilis)、苏云金芽胞杆菌(Bacillusthuringiensis)、均一芽孢杆菌(Bacillus uniflagellatus)、慢生大豆根瘤菌(Bradyrhizobium japonicum)、短短芽孢杆菌(Brevibacillus brevis)、侧孢短芽孢杆菌(Brevibacillus laterosporus)(以前称为侧孢芽孢杆菌(Bacillus laterosporus))、活性紫色细菌(Chromobacterium subtsugae)、食酸戴尔福特菌(Delftia acidovorans)、嗜酸乳酸杆菌(Lactobacillus acidophilus)、抗生素溶杆菌(Lysobacter antibioticus)、产酶溶杆菌(Lysobacter enzymogenes)、蜂房芽胞杆菌(Paenibacillus alvei)、多粘类芽孢杆菌(Paenibacillus polymyxa)、蒲黄类芽孢杆菌属(Paenibacillus popilliae)(以前称为乳状芽孢杆菌(Bacillus popilliae))、成团泛菌(Pantoea agglomerans)、巴斯德氏芽菌属(Pasteuria penetrans)(以前称为透明芽孢杆菌(Bacillus penetrans))、巴斯德氏芽菌属(Pasteuria usgae)、果胶杆菌属(Pectobacterium carotovorum)(以前称为胡萝卜软腐欧文氏菌(Erwinia carotovora))、铜绿假单胞菌(Pseudomonas aeruginosa)、致黄假单胞菌(Pseudomonas aureofaciens)、洋葱假单胞菌(Pseudomonas cepacia)(以前称为洋葱伯克霍尔德氏菌(Burkholderia cepacia))、绿针假单胞菌(Pseudomonaschlororaphis)、荧光假单胞菌(Pseudomonas fluorescens)、proradix假单胞菌(Pseudomonas proradix)、恶臭假单胞菌(Pseudomonas putida)、丁香假单胞菌(Pseudomonas syringae)、嗜虫沙雷氏菌(Serratia entomophila)、粘质沙雷氏菌(Serratia marcescens)、哥伦比亚链霉菌(Streptomyces colombiensis)、鲜黄链霉菌(Streptomyces galbus)、高氏链霉菌(Streptomyces goshikiensis)、灰绿链霉菌(Streptomyces griseoviridis)、淡紫灰链霉菌(Streptomyces lavendulae)、普拉斯链霉菌(Streptomyces prasinus)、萨腊赛链霉菌(Streptomyces saraceticus)、委内瑞拉链霉菌(Streptomyces venezuelae)、野油菜黄单胞菌(Xanthomonas campestris)、无色杆菌(Xenorhabdus luminescens)、嗜线虫致病杆菌(Xenorhabdus nematophila)、球形红球菌(Rhodococcus globerulus)、AQ719(NRRL保藏号B-21663)、芽孢杆菌属(Bacillus sp.)AQ175(ATCC保藏号55608)、芽孢杆菌属(Bacillus sp.)AQ 177(ATCC保藏号55609)、芽孢杆菌属(Bacillus sp.)AQ178(ATCC保藏号53522)和链霉菌属(Streptomyces sp.)菌株NRRL保藏号B-30145。在一些情况下,细菌可以是褐球固氮菌(Azotobacter chroococcum)、巴氏甲烷八叠球菌(Methanosarcina barkeri)、肺炎克雷伯氏菌、棕色固氮菌、红细菌(Rhodobacter spharoides)、荚膜红细菌(Rhodobacter capsulatus)、沼泽红细菌(Rhodobcter palustris)、深红红螺菌(Rhodosporillum rubrum)、豌豆根瘤菌(Rhizobiumleguminosarum)或菜豆根瘤菌(Rhizobium etli)。
在一些情况下,细菌可以是梭菌属物种,例如巴氏梭菌(Clostridiumpasteurianum)、拜氏梭菌(Clostridium beijerinckii)、产气荚膜梭菌(Clostridiumperfringens)、破伤风梭菌(Clostridium tetani)、丙酮丁醇梭菌(Clostridiumacetobutylicum)。
在一些情况下,与本发明的方法和组合物一起使用的细菌可以是蓝细菌。蓝细菌属的实例包含鱼腥藻属(Anabaena)(例如鱼腥藻属PCC7120)、念珠藻属(Nostoc)(例如点形念珠藻(Nostoc punctiforme))或集胞藻属(Synechochocystis)(例如集胞藻属PCC6803)。
在一些情况下,与本发明的方法和组合物一起使用的细菌可属于绿菌门(Chlorobi),例如绿硫菌(Chlorobium tepidum)。
在一些情况下,与本发明的方法和组合物一起使用的微生物可包括与已知NifH基因同源的基因。已知NifH基因的序列可见于例如Zehr实验室NifH数据库(Zehr lab NifHdatabase)(https://wwwzehr.pmc.ucsc.edu/nifH_Database_Public/,2014年4月4日),或巴克利实验室NifH数据库(Buckley lab NifH database)(http://www.css.cornell.edu/faculty/buckley/nifh.htm,和盖比(Gaby)、约翰·克里斯蒂安(John Christian)和丹尼尔H.巴克利(Daniel H.Buckley.)“综合比对nifH基因数据库:研究固氮细菌的多用途工具。”《数据库(Database)》2014(2014):bau001.)。在一些情况下,与本发明的方法和组合物一起使用的微生物可包括与来自Zehr实验室NifH数据库(https://wwwzehr.pmc.ucsc.edu/nifH_Database_Public/,2014年4月4日)的序列具有至少60%、70%、80%、85%、90%、95%、96%、96%、98%、99%或超过99%序列一致性的编码多肽的序列。在一些情况下,与本发明的方法和组合物一起使用的微生物可包括编码与来自巴克利实验室NifH数据库,(盖比、约翰·克里斯蒂安和丹尼尔H.巴克利“综合比对nifH基因数据库:研究固氮细菌的多用途工具。”《数据库》2014(2014):bau001.)的序列具有至少60%、70%、80%、85%、90%、95%、96%、96%、98%、99%或超过99%序列一致性的编码多肽的序列。
适用于本文所揭示的方法和组合物的微生物可以通过以下获得:从天然植物的表面或组织中提取微生物;研磨种子以分离微生物;在不同土壤样品中种植种子,且从组织中回收微生物;或用外源微生物接种植物,且确定哪些微生物出现在植物组织中。植物组织的非限制性实例包含种子、幼苗、叶、插条、植株、鳞茎、块茎、根部和根茎。在一些情况下,从种子中分离细菌。以改变用于加工样品的参数,以分离不同类型的缔合微生物,如根际菌、附生菌或内生菌。细菌也可以来源于如环境菌株收集物的储存库(repository),而不是最初从第一植物中分离。可以通过以下对微生物进行基因分型和表型分型:对分离的微生物的基因组进行测序;进行植物中群落组成谱分析;表征群落或分离的微生物的转录组学功能;或使用选择性或表型培养基筛选微生物特征(例如,固氮或磷酸盐溶解表型)。可以经由以下获得选定候选菌株或种群:序列数据;表型数据;植物数据(例如,基因组、表型和/或产量数据);土壤数据(例如,pH、N/P/K含量和/或非根际土壤(bulk soil)生物群落);或这些的任何组合。
本文所描述的细菌和产生细菌的方法可适用于能够在叶片表面、根部表面或植物组织内部有效地自我繁殖而不会诱导有害的植物防御反应的细菌,或对植物防御反应具有抗性的细菌。可通过在不添加氮的培养基中培养植物组织提取物或叶片表面洗涤液来分离本文所描述的细菌。然而,细菌可能是不可培养的,也就是说,尚未知晓可使用所属领域中已知的标准方法培养,或难以使用所属领域中已知的标准方法培养。本文所描述的细菌可以是内生菌或附生菌或栖居于植物根际的细菌(根际细菌)。重复引入基因变异、暴露于多种植物以及从具有改良性状的植物中分离细菌的步骤一或多次(例如1、2、3、4、5、10、15、25次或更多次)后获得的细菌可能是内生菌、附生菌或根际菌。内生菌是进入植物内部而不会引起疾病症状或诱发共生结构形成的生物,且受农艺学关注,因为其可以增强植物生长且改善植物的营养(例如,通过固氮)。细菌可以是种传(seed-borne)内生菌。种传内生菌包含与草或植物种子缔合或来源于其的细菌,如在成熟、干燥、未受损(例如,无裂缝、可见的真菌感染或过早发芽)的种子中发现的种传细菌内生菌。种传细菌内生菌可以与种子表面缔合或来源于种子表面;或者或另外,其可以与内部种子隔室(例如,表面除菌的种子)缔合或来源于内部种子隔室。在一些情况下,种传细菌内生菌能够在植物组织内,例如种子内部复制。此外,在一些情况下,种传细菌内生菌能够经受住脱水。
根据本发明的方法分离的细菌,或用于本发明的方法或组合物中的细菌,可以包括多种不同细菌分类群的组合。借助于实例,细菌可包含变形菌门(如假单胞菌属(Pseudomonas)、肠杆菌属(Enterobacter)、寡养单胞菌属(Stenotrophomonas)、伯克霍尔德氏菌属(Burkholderia)、根瘤菌属(Rhizobium)、草螺菌属(Herbaspirillum)、泛菌属(Pantoea)、沙雷氏菌属(Serratia)、拉恩氏菌属(Rahnella)、固氮螺菌属(Azospirillum)、固氮根瘤菌属(Azorhizobium)、固氮菌属(Azotobacter)、杜擀氏菌属(Duganella)、代尔夫特菌属(Delftia)、短根瘤菌属(Bradyrhizobiun)、中华根瘤菌属(Sinorhizobium)和盐单胞菌属(Halomonas))、厚壁菌门(如芽孢杆菌属、类芽孢杆菌属(Paenibacillus)、乳杆菌属(Lactobacillus)、支原体属(Mycoplasma)和醋酸杆菌属(Acetabacterium))和放线菌门(Actinobacteria)(如链霉菌属(Streptomyces)、红球菌属(Rhodacoccus)、微杆菌属(Microbacterium)和短小杆菌属(Curtobacterium))。在本发明的方法和组合物中使用的细菌可包含两种或更多种物种的固氮细菌聚生体(consortia)。在一些情况下,细菌聚生体的一或多种细菌可能能够固氮。在一些情况下,细菌聚生体的一或多种物种可促进或增强其它细菌固氮的能力。固氮的细菌和增强其它细菌固氮能力的细菌可相同或不同。在一些实例中,当与不同细菌菌株组合或在某一细菌聚生体中时,细菌菌株可能能够固氮,但在单一培养中可能无法固氮。可以在固氮细菌聚生体中找到细菌的属的实例包含(但不限于)草螺菌属、固氮螺菌属、肠杆菌属和芽孢杆菌属。
可以通过本文所揭示的方法产生的细菌包含固氮菌属种(Azotobacter sp.)、短根瘤菌属种(Bradyrhizobium sp.)、克雷伯菌种(Klebsiella sp.)和中华根瘤菌种(Sinorhizobium sp.)。在一些情况下,细菌可选自由以下组成的群组:棕色固氮菌、慢生大豆根瘤菌、肺炎克雷伯氏杆菌和苜蓿根瘤菌(Sinorhizobium meliloti)。在一些情况下,细菌可以是肠杆菌属或拉恩氏菌属。在一些情况下,细菌可以是弗兰克氏菌属(Frankia)或梭菌属。梭菌属的细菌的实例包含(但不限于)丙酮丁醇梭菌、巴氏梭菌、拜氏梭菌、产气荚膜梭菌和破伤风梭菌。在一些情况下,细菌可以是类芽孢杆菌属的细菌,例如固氮芽孢杆菌(Paenibacillus azotofixans)、灿烂类芽孢杆菌(Paenibacillus borealis)、圆孢生孢八叠球菌(Paenibacillus durus)、软化类芽孢杆菌(Paenibacillus macerans)、多粘类芽孢杆菌、蜂房芽胞杆菌、溶淀粉类芽胞杆菌、葡聚糖芽孢杆菌(Paenibacilluscampinasensis)、千叶类芽孢杆菌(Paenibacillus chibensis)、解葡糖类芽孢杆菌(Paenibacillus glucanolyticus)、伊利诺伊芽孢杆菌(Paenibacillus illinoisensis)、幼虫类芽孢杆菌(Paenibacillus larvae subsp)、幼虫(Larvae)、幼虫类芽孢杆菌、幼虫类芽孢杆菌、劳氏芽孢杆菌(Paenibacillus lautus)、软化类芽孢杆菌、马阔里芽孢杆菌(Paenibacillus macquariensis)、马阔里芽孢杆菌、碱性果胶酶生产菌(Paenibacilluspabuli)、皮尔瑞俄类芽孢杆菌(Paenibacillus peoriae)或多粘类芽孢杆菌。
在一些实例中,根据本发明的方法分离的细菌可以是以下分类群中的一或多种的成员:无色杆菌属(Achromobacter)、嗜酸硫杆菌属(Acidithiobacillus)、食酸菌属(Acidovorax)、食酸菌属(Acidovoraz)、不动杆菌属(Acinetobacter)、游动放线菌属(Actinoplanes)、阿德勒菌属(Adlercreutzia)、气球菌属(Aerococcus)、气单胞菌属(Aeromonas)、阿波菲菌属(Afipia)、壤霉菌属(Agromyces)、屈曲杆菌属(Arthrobacter)、奇杆菌属(Atopostipes)、固氮螺菌属、芽孢杆菌属、蛭弧菌属(Bdellovibrio)、拜叶林克氏菌属(Beijerinckia)、芽生杆菌属(Bosea)、短根瘤菌属、短芽孢杆菌属(Brevibacillus)、短波单胞菌属(Brevundimonas)、伯克霍尔德氏菌属、候选属盐重构菌属(CandidatusHaloredivivus)、柄杆菌属(Caulobacter)、纤维单胞菌属(Cellulomonas)、纤维弧菌属(Cellvibrio)、金黄杆菌属(Chryseobacterium)、柠檬酸杆菌属(Citrobacter)、梭菌属、珊瑚珍珠菌属(Coraliomargarita)、棒状杆菌属(Corynebacterium)、贪铜菌属(Cupriavidus)、短小杆菌属、弯曲杆菌属(Curvibacter)、异常球菌属(Deinococcus)、代尔夫特菌属、德库菌属(Desemzia)、德沃斯氏菌属(Devosia)、独岛菌属(Dokdonella)、戴氏菌属(Dyella)、栖水菌属(Enhydrobacter)、肠杆菌属、肠球菌属(Enterococcus)、欧文氏菌属(Erwinia)、埃希氏菌属(Escherichia)、志贺氏菌属(Shigella)、微小杆菌属(Exiguobacterium)、铁球菌属(Ferroglobus)、丝状单胞菌属(Filimonas)、芬戈尔德菌属(Finegoldia)、黄壤杆菌属(Flavisolibacter)、黄杆菌属(Flavobacterium)、冰冻小杆菌属(Frigoribacterium)、葡糖醋杆菌属(Gluconacetobacter)、哈夫尼菌属(Hafnia)、盐棒菌属(Halobaculum)、盐单胞菌属、盐简菌属(Halosimplex)、草螺菌属、薄层菌属(Hymenobacter)、克雷伯菌属、考克氏菌属(Kocuria)、科萨克氏菌属(Kosakonia)、乳杆菌属、勒克氏菌属(Leclercia)、伦茨氏菌属(Lentzea)、藤黄杆菌属(Luteibacter)、藤黄单胞菌属(Luteimonas)、马赛菌属(Massilia)、中间根瘤菌属(Mesorhizobium)、甲基杆菌属(Methylobacterium)、微杆菌、微球菌属(Micrococcus)、微枝形杆菌属(Microvirga)、分枝杆菌属(Mycobacterium)、奈瑟氏菌属(Neisseria)、诺卡氏菌属(Nocardia)、大洋杆菌属(Oceanibaculum)、苍白杆菌属(Ochrobactrum)、奥卡杆菌属(Okibacterium)、寡养菌属(Oligotropha)、稻土菌属(Oryzihumus)、食草酸菌属(Oxalophagus)、类芽孢杆菌属、泛菌属(Panteoa/Pantoea)、泥单胞菌属(Pelomonas)、透明球菌属(Perlucidibaca)、植物杆菌属(Plantibacter)、多核杆菌属(Polynucleobacter)、丙酸杆菌属(Propionibacterium)、产丙酸棒形菌属(Propioniciclava)、假棒形杆菌属(Pseudoclavibacter)、假单胞菌属、假诺卡氏菌属(Pseudonocardia)、假黄单胞菌属(Pseudoxanthomonas)、嗜冷杆菌属(Psychrobacter)、雷尔氏菌属(Ralstonia)、莱茵海默氏菌属(Rheinheimera)、根瘤菌属、红球菌属、红假单胞菌属(Rhodopseudomonas)、玫瑰色不完全光合菌属(Roseateles)、瘤胃球菌属(Ruminococcus)、塞巴鲁德氏菌属(Sebaldella)、沉积物杆菌属(Sediminibacillus)、沉积物杆状菌属(Sediminibacterium)、沙雷氏菌属、志贺氏菌属、申氏杆菌属(Shinella)、中华根瘤菌属、中华孢囊菌属(Sinosporangium)、鞘氨醇杆菌属(Sphingobacterium)、鞘氨醇单胞菌属(Sphingomonas)、鞘氨醇盒菌属(Sphingopyxis)、鞘氨醇细胞菌属(Sphingosinicella)、葡萄球菌属(Staphylococcus)、25寡养单胞菌属、寡养单胞菌属、链球菌属(Streptococcus)、链霉菌属、憎叶菌属(Stygiolobus)、硫磺球形菌属(Sulfurisphaera)、塔特姆氏菌属(Tatumella)、温单胞菌属(Tepidimonas)、热单胞菌属(Thermomonas)、硫杆菌属(Thiobacillus)、贪噬菌属(Variovorax)、WPS-2属地位未定(incertae sedis)、黄单胞菌属(Xanthomonas)和齐默尔曼氏菌属(Zimmermannella)。
在一些情况下,利用选自以下属中的至少一者的细菌物种:肠杆菌属、克雷伯菌属、科萨克氏菌属和拉恩氏菌属。在一些情况下,利用来自以下属的细菌物种的组合:肠杆菌属、克雷伯菌属、科萨克氏菌属和拉恩氏菌属。在一些情况下,所利用的物种可以是以下各者中的一或多者:甘蔗肠杆菌(Enterobacter sacchari)、变栖克雷伯菌、甘蔗科萨克氏菌和水生拉恩氏菌。
在一些情况下,革兰氏阳性微生物可具有钼-铁固氮酶系统,其包括:nifH、nifD、nifK、nifB、nifE、nifN、nifX、hesA、nifV、nifW、nifU、nifS、nifI1和nifI2。在一些情况下,革兰氏阳性微生物可具有钒固氮酶系统,其包括:vnfDG、vnfK、vnfE、vnfN、vupC、vupB、vupA、vnfV、vnfR1、vnfH、vnfR2、vnfA(转录调节子)。在一些情况下,革兰氏阳性微生物可具有仅含铁的固氮酶系统,其包括:anfK、anfG、anfD、anfH、anfA(转录调节子)。在一些情况下,革兰氏阳性微生物可具有固氮酶系统,其包括:glnB和glnK(氮信号传导蛋白)。在革兰氏阳性微生物中参与氮代谢的酶的一些实例包含glnA(谷氨酰胺合成酶)、gdh(谷氨酸脱氢酶)、bdh(3-羟基丁酸脱氢酶)、谷氨酰胺酶、gltAB/gltB/gltS(谷氨酸合成酶)、asnA/asnB(天冬氨酸氨连接酶/天冬酰胺合成酶)和ansA/ansZ(天冬酰胺酶)。在革兰氏阳性微生物中参与氮传输的蛋白质的一些实例包含amtB(铵转运蛋白)、glnK(铵转运的调节子)、glnPHQ/glnQHMP(ATP依赖性谷氨酰胺/谷氨酸转运蛋白)、glnT/alsT/yrbD/yflA(谷氨酰胺样质子整合转运蛋白)和gltP/gltT/yhc1/nqt(谷氨酸样质子整合转运蛋白)。
可能受特定关注的革兰氏阳性微生物的实例包含多粘类芽孢杆菌(Paenibacillus polymixa)、柚子类芽孢杆菌(Paenibacillus riograndensis)、类芽孢杆菌属种(Paenibacillus sp.)、弗兰克氏菌属种(Frankia sp.)、盐杆菌种(Heliobacteriumsp.)、氯螺旋杆菌属(Heliobacterium chlorum)、纤毛菌属种(Heliobacillus sp.)、嗜日菌属种(Heliophilum sp.)、菌属种(Heliorestis sp.)、丙酮丁醇梭杆菌(Clostridiumacetobutylicum)、梭菌属种(Clostridium sp.)、亚麻分枝杆菌属(Mycobacteriumflaum)、分枝杆菌种(Mycobacterium sp.)、节细菌属种(Arthrobacter sp.)、根霉属种(Agromyces sp.)、自养棒状杆菌属(Corynebacterium autitrophicum)、棒状杆菌种(Corynebacterium sp.)、小单孢菌属种(Micromonspora sp.)、丙酸杆菌种(Propionibacteria sp.)、链霉菌属种(Streptomyces sp.)和微杆菌属种(Microbacterium sp.)。
可在革兰氏阳性微生物中产生的基因改变的一些实例包含:在环境氮存在下删除glnR以去除BNF的负调节、在nif簇的上游直接插入不同的启动子以消除glnr响应于环境氮所做的的调节、突变glnA以降低GS-GOGAT路径的铵同化速率、删除amtB以降低培养基中铵的吸收、突变glnA以使其组成性地处于反馈抑制(FBI-GS)状态以降低GS-GOGAT路径的铵同化。
在一些情况下,glnR是类芽孢杆菌属种中N代谢和固定的主要调节子。在一些情况下,类芽孢杆菌属种的基因组可能不含有产生glnR的基因。在一些情况下,类芽孢杆菌属种的基因组可能不含有产生glnE或glnD的基因。在一些情况下,类芽孢杆菌属种的基因组可含有产生glnB或glnK的基因。例如,类芽孢杆菌属种WLY78不含有用于glnB的基因,或其在古细菌马氏甲烷球菌属(Methanococcus maripaludis)、nifI1和nifI2中发现的同源物。在一些情况下,类芽孢杆菌属种的基因组可为可变的。举例来说,多粘类芽孢杆菌E681不含glnK和gdh,具有数种氮化合物转运蛋白,但只有amtB表现为受GlnR控制。在另一实例中,类芽孢杆菌属种JDR2具有glnK、gdh和大多数其它中心氮代谢基因,具有更少的氮化合物转运体,但的确具有受GlnR控制的glnPHQ。柚子类芽孢杆菌属(Paenibacillus riograndensis)SBR5含有标准glnRA操纵子、fdx基因、主要nif操纵子、次要nif操纵子和anf操纵子(编码仅含铁的固氮酶)。假定的glnR/tnrA位点发现于这些操纵子中的每一个的上游。GlnR可调节所有上述操纵子,除anf操纵子以外。GlnR可结合到这些调节序列中的每一个作为二聚体。
类芽孢杆菌属N-固定菌株可属于两个子组:仅含有最小nif基因簇的子组I和含有最小簇的子组II,加上在nifX与hesA之间的未表征的基因,和通常复制nif基因中的一些(如nifH、nifHDK、nifBEN)的其它簇,或编码钒固氮酶(vnf)或仅含铁的固氮酶(anf)基因的簇。
在一些情况下,类芽孢杆菌属种的基因组可不含有产生glnB或glnK的基因。在一些情况下,类芽孢杆菌属种的基因组可含有具有9种从σ70启动子转录的基因的最小nif簇。在一些情况下,类芽孢杆菌属nif簇可由氮或氧不利地调节。在一些情况下,类芽孢杆菌属种的基因组可不含有产生σ54的基因。例如,类芽孢杆菌属种WLY78不含有σ54的基因。在一些情况下,可通过glnR和/或TnrA调节nif簇。在一些情况下,可通过更改glnR和/或TnrA的活性来更改nif簇的活性。
在杆菌(Bacilli)中,谷氨酰胺合成酶(GS)由高浓度的胞内谷氨酰胺反馈抑制,引起确认偏移(称为FBI-GS)。Nif簇在数个杆菌物种中含有用于调控子GlnR和TnrA的不同结合位点。GlnR结合且在过量胞内谷氨酰胺和AMP存在下抑制基因表达。GlnR的作用可以是在高氮可用性的条件下防止谷氨酰胺和铵的流入和胞内产生。TnrA可以在限制胞内谷氨酰胺存在下和/或在FBI-GS存在下结合和/或活化(或再抑制)基因表达。在一些情况下,可通过更改GlnR的活性来更改杆菌nif簇的活性。
反馈抑制的谷氨酰胺合成酶(FBI-GS)可结合GlnR且稳定GlnR与识别序列的结合。数个细菌物种具有nif簇上游的GlnR/TnrA结合位点。更改FBI-GS与GlnR的结合可更改nif路径的活性。
微生物的来源
细菌(或根据本发明的任何微生物)可从任何一般陆地环境中获得,包含其土壤、植物、真菌、动物(包含无脊椎动物)以及其它生物群,包含湖泊和河流的沉积物、水以及生物群;来自海洋环境,其生物群和沉积物(例如,海水、海泥、海洋植物、海洋无脊椎动物(例如,海绵)、海洋脊椎动物(例如,鱼));陆地和海洋岩石圈(表土和岩石,例如受挤压的地下岩、砂和粘土);低温层和其融水;大气(例如,经过滤的空气粉尘、云和雨滴);城市、工业和其它人造环境(例如,混凝土、路边沟槽、屋顶表面以及道路表面上积聚的有机物和矿物质)。
获得细菌(或根据本发明的任何微生物)的植物可以是具有一或多种所需特性的植物,例如在特定环境中或在所关注的某些条件下自然地生长的植物。借助于实例,某种植物可在沙土或高盐度砂中,或在极端温度下,或在具有极少的水的情况下自然生长,或其可抵抗存在于环境中的某些害虫或疾病,且可能需要经济作物在这类条件中生长,尤其在这是例如具体地理位置中仅有的条件时。作为另一实例,可以从在此类环境中生长的经济作物,或更具体地说,从在任何特定环境中生长的作物中最佳显示目的性状的个别作物植物收集细菌:例如在盐限制土壤中生长的作物中生长最快的植物,或暴露于严重昆虫损害或疾病流行的作物中受损度最低的植物,或具有所需量的某些代谢物和其它化合物(包含纤维含量、油含量等)的植物,或显示期望颜色、味道或气味的植物。细菌可以从所关注的植物或所关注的环境中出现的任何物质收集,包含真菌和其它动物和植物生物群、土壤、水、沉积物和如先前所提及的其它环境要素。
细菌(或根据本发明的任何微生物)可从植物组织中分离。此分离可以从植物中的任何适当组织发生,包含例如根部、茎和叶,和植物生殖组织。借助于实例,从植物中分离的常规方法通常包含对所关注的植物材料(例如根部或茎长、叶片)进行无菌切除,用适当溶液(例如2%次氯酸钠)进行表面灭菌,之后将植物材料放在营养物培养基上以进行微生物生长。或者,可以在无菌液体(通常水)中将经表面灭菌的植物材料压碎,且使液体悬浮液(包含压碎的植物材料的小片)散布在合适的一或多种固体琼脂培养基的表面上,所述培养基可或可不具有选择性(例如仅含有植酸作为磷源)。此方法尤其适用于形成分离菌落且可以分别选取到独立的营养物培养基的板,且通过众所周知的方法进一步纯化为单一物种的细菌。或者,可不对植物根部或簇叶样品进行表面灭菌,但仅对其进行温和洗涤,由此在分离过程中包含表面驻留的附生微生物,或可以通过压印和剥离植物的根部、茎或叶的片到琼脂培养基表面上,且随后如上分离个别菌落来分别地分离附生微生物。例如,此方法尤其适用于细菌。或者,可在不洗掉附着于根部的少量土壤的情况下加工根部,由此包含定殖植物根际的微生物。否则,粘附于根部的土壤可以被去除、稀释且散布到合适的选择性和非选择性培养基的琼脂上,以分离根际细菌的个别菌落。
国际承认用于专利程序的微生物保藏布达佩斯条约(BUDAPEST TREATY ON THEINTERNATIONAL RECOGNITION OF THE DEPOSIT OF MICROORGANISMS FOR THE PURPOSE OFPATENT PROCEDURES)
本发明的微生物保藏是根据《出于专利申请程序目的的微生物保藏取得国际承认的布达佩斯条约(Budapest Treaty on the International Recognition of theDeposit of Microorganisms for the Purpose of Patent Procedure)》(《布达佩斯条约(Budapest Treaty)》)的条款进行的。
申请人表明依照37C.F.R.§1.808(a)(2)“保藏人对保藏材料的公众可获得性所施加的所有限制将在授予专利时不可撤销地去除”。此表述受制于此章节的段落(b)(即37C.F.R.§1.808(b))。
甘蔗肠杆菌现在已经重新分类为甘蔗科萨克氏菌,生物的名称在整个手册中可互换使用。
本发明的许多微生物来源于两种野生型菌株,如图6和图7中所描绘。菌株CI006为先前在肠杆菌属中分类的细菌物种(参见前述重新分类为科萨克氏菌属),且图6鉴别来源于CI006的突变体的谱系。菌株CI019是在拉恩氏菌属中分类的细菌物种,且图7鉴别来源于CI019的突变体的谱系。关于图6和图7,注意到以名称包括CM的菌株是紧接在所述CM菌株左边描绘的菌株的突变体。下表1中发现CI006科萨克氏菌属野生型(WT)和CI019拉恩氏菌属WT的保藏信息。
本申请案中所描述的一些微生物沉积在2017年1月6日或2017年8月11日保藏在毕格罗国家海洋藻类和微生物保藏中心(Bigelow National Center for Marine Algae andMicrobiota)(NCMA),位于美国缅因州04544东槽道毕格罗大道60(60Bigelow Drive,EastBoothbay,Maine 04544,USA)。如前所述,保藏是在国际承认用于专利程序的微生物保藏布达佩斯条约的条款下进行。表1提供国家海藻和微生物中心保藏号和上述布达佩斯条约保藏的保藏日期。
甘蔗科萨克氏菌(Kosakonia sacchari)(WT)、水生拉恩氏菌(Rahnellaaquatilis)(WT)和变异体/重塑甘蔗科萨克氏菌(variant/remodeled Kosakoniasacchari)菌株的生物纯培养物在2017年1月6日保藏在毕格罗国家海洋藻类和微生物保藏中心(NCMA),位于美国缅因州04544东槽道毕格罗大道60,且分别指定NCMA专利保藏指定编号201701001、201701003和201701002。可适用的保藏信息在下表1中发现。
变异体/重塑甘蔗科萨克氏菌(variant/remodeled Kosakonia sacchari)菌株的生物纯培养物在2017年8月11日保藏在毕格罗国家海洋藻类和微生物保藏中心(NCMA),位于美国缅因州04544东槽道毕格罗大道60,且分别指定NCMA专利保藏指定编号201708004、201708003和201708002。可适用的保藏信息在下表1中发现。
变栖克雷伯菌(Klebsiella variicola)(WT)的生物纯培养物在2017年8月11日保藏在毕格罗国家海洋藻类和微生物保藏中心(NCMA),位于美国缅因州04544东槽道毕格罗大道60,且指定NCMA专利保藏指定编号201708001。两个变栖克雷伯菌变异体/重塑菌株(Klebsiella variicola variants/remodeled strains)的生物纯培养物在2017年12月20日保藏在毕格罗国家海洋藻类和微生物保藏中心(NCMA),位于美国缅因州04544东槽道毕格罗大道60,且分别指定NCMA专利保藏指定编号201712001和201712002。可适用的保藏信息在下表1中发现。
表1:在布达佩斯条下保藏的微生物
分离的且生物纯的微生物
在某些实施例中,本发明提供尤其在农业中具有应用的分离的且生物纯的微生物。所揭示的微生物可以以其分离和生物纯状态利用,且将其调配成组合物(关于示例性组合物的描述参见下文部分)。此外,本发明提供含有所揭示的分离的和生物纯微生物的至少两个成员的微生物组合物,以及利用所述微生物组合物的方法。此外,本发明提供经由利用所揭示的分离的和生物纯微生物调节植物中的固氮的方法。
在一些方面,本发明的分离的和生物纯微生物是来自表1的那些微生物。在其它方面,本发明的分离的和生物纯微生物来源于表1的微生物。例如,本文提供来自表1的微生物的菌株、子菌株、突变体或衍生物。本发明涵盖表1中所列的微生物的所有可能组合,所述组合有时形成微生物聚生体。来自表1的微生物可单独地或以任何组合与本发明中所提及的任何植物、活性分子(合成分子、有机分子等)、佐剂、载剂、补充剂或生物组合。
在一些方面,本发明提供包括如在表2-8中分组的物种的微生物组合物。在一些方面,包括各种微生物物种的这些组合物被称为微生物聚生体或联合体。
关于表2-8,字母A到I表示本发明的微生物的非限制性选择,其定义为:
A=具有表1中所鉴别的保藏号201701001的微生物;
B=具有表1中所鉴别的保藏号201701003的微生物;
C=具有表1中所鉴别的保藏号201701002的微生物;
D=具有表1中所鉴别的保藏号201708004的微生物;
E=具有表1中所鉴别的保藏号201708003的微生物;
F=具有表1中所鉴别的保藏号201708002的微生物;
G=具有表1中所鉴别的保藏号201708001的微生物;
H=具有表1中所鉴别的保藏号201712001的微生物;和
I=具有表1中所鉴别的保藏号201712002的微生物。
表2:八种和九种菌株组合物
表3:七种菌株组合物
表4:六种菌株组合物
表5:五种菌株组合物
表6:四种菌株组合物
表7:三种菌株组合物
表8:两种菌株组合物
在一些实施例中,微生物组合物可选自表2-8的任何成员群组。
农业组合物
包括根据本文所描述的方法产生的细菌或细菌种群和/或具有如本文所描述的特征的组合物可以呈液体、泡沫或干燥产品形式。还可以使用包括根据本文所描述的方法产生的细菌或细菌种群和/或具有如本文所描述的特征的组合物来改良植物特性。在一些实例中,包括细菌种群的组合物可以呈干粉、粉末和水的浆液或可流动种子处理剂形式。包括细菌种群的组合物可包被到种子的表面上,且可呈液体形式。
组合物可以在生物反应器(如连续搅拌釜反应器、间歇反应器)和农场中制造。在一些实例中,组合物可以储存在如水罐的容器中或以小型散装储存。在一些实例中,组合物可以储存在选自由以下组成的群组的物件内:瓶、广口瓶、安瓿、包装、器皿、包、盒子、储藏箱、包封、纸箱、容器、筒仓、运输容器、车厢和/或箱子。
组合物也可用于改良植物性状。在一些实例中,可以将一或多种组合物包被到种子上。在一些实例中,可以将一或多种组合物包被到幼苗上。在一些实例中,可以将一或多种组合物包被到种子的表面上。在一些实例中,可以将一或多种组合物包被为种子表面上方的层。在一些实例中,包被到种子上的组合物可以呈液体形式、呈干燥产品形式、呈泡沫形式、呈粉末和水的浆液形式或呈可流动种子处理剂形式。在一些实例中,可以通过用一或多种组合物对种子和/或幼苗进行喷雾、浸没、包被、囊封和/或撒粉,将一或多种组合物施加到种子和/或幼苗。在一些实例中,可以将多种细菌或细菌种群包被到植物的种子和/或幼苗上。在一些实例中,细菌组合中的至少两种、至少三种、至少四种、至少五种、至少六种、至少七种、至少八种、至少九种、至少十种或超过十种细菌可以选自以下属中的一种:食酸菌属、土壤杆菌属(Agrobacterium)、芽孢杆菌属、伯克霍尔德氏菌属、金黄杆菌属、短小杆菌属、肠杆菌属、埃希氏菌属、甲基杆菌属、类芽孢杆菌属、泛菌属、假单胞菌属、雷尔氏菌属、糖杆菌属(Saccharibacillus)、鞘氨醇单胞菌属和寡养单胞菌属。
在一些实例中,内生组合中的至少两种、至少三种、至少四种、至少五种、至少六种、至少七种、至少八种、至少九种、至少十种或超过十种细菌和细菌种群选自以下科中的一种:芽孢杆菌科(Bacillaceae)、伯克霍尔德氏菌科(Burkholderiaceae)、丛毛单胞菌科(Comamonadaceae)、肠杆菌科(Enterobacteriaceae)、黄杆菌科(Flavobacteriaceae)、甲基杆菌科(Methylobacteriaceae)、微杆菌科(Microbacteriaceae)、类芽孢杆菌科(Paenibacillileae)、假单胞菌科(Pseudomonnaceae)、根瘤菌科(Rhizobiaceae)、鞘氨醇单胞菌科(Sphingomonadaceae)、黄单胞菌科(Xanthomonadaceae)、枝孢霉科(Cladosporiaceae)、日规壳菌(Gnomoniaceae)、未定地位(Incertae sedis)、毛球壳科(Lasiosphaeriaceae)、丛赤壳科(Netriaceae)和格孢菌科(Pleosporaceae)。
在一些实例中,内生组合中的至少两种、至少三种、至少四种、至少五种、至少六种、至少七种、至少八种、至少九种、至少十种或超过十种细菌和细菌种群选自以下科中的一种:芽孢杆菌科(Bacillaceae)、伯克霍尔德氏菌科(Burkholderiaceae)、丛毛单胞菌科(Comamonadaceae)、肠杆菌科(Enterobacteriaceae)、黄杆菌科(Flavobacteriaceae)、甲基杆菌科(Methylobacteriaceae)、微杆菌科(Microbacteriaceae)、类芽孢杆菌科(Paenibacillileae)、假单胞菌科(Pseudomonnaceae)、根瘤菌科(Rhizobiaceae)、鞘氨醇单胞菌科(Sphingomonadaceae)、黄单胞菌科(Xanthomonadaceae)、枝孢霉科(Cladosporiaceae)、日规壳菌(Gnomoniaceae)、未定地位(Incertae sedis)、毛球壳科(Lasiosphaeriaceae)、丛赤壳科(Netriaceae)、格孢菌科(Pleosporaceae)。
组合物的实例可包含用于商业上重要的农作物的种子包衣,所述农作物例如高粱、芥花、番茄、草莓、大麦、水稻、玉蜀黍和小麦。组合物的实例还可以包含用于玉米、大豆、芥花、高粱、马铃薯、水稻、蔬菜、谷类和油籽的种子包衣。如本文所提供的种子可以是基因修饰生物体(GMO)、非GMO、有机或常规的。在一些实例中,可以将组合物喷涂在植物的地上部分上,或通过插入到种有植物种子的犁沟中、浇水到土壤中或将根部浸入组合物的悬浮液中而施加到根部。在一些实例中,可以维持细胞活力和人工接种且定殖宿主植物的能力合适的方式使组合物脱水。细菌物种可以10
可以将包括本文所描述的细菌种群的组合物包被到种子的表面上。因此,也考虑了包括用本文所描述的一或多种细菌包被的种子的组合物。种子包衣可以通过将细菌种群与多孔的化学惰性颗粒状载剂混合而形成。或者,组合物可直接插入到种有种子的犁沟中,或喷涂到植物叶片上,或通过将根部浸入组合物的悬浮液中进行施加。有效量的组合物可以用于用活细菌生长来填充邻近植物根部的底土区域,或用活细菌生长来填充植物的叶片。一般来说,有效量是足以产生具有改良性状(例如所需固氮水平)的植物的量。
本文所描述的细菌组合物可以使用农业上可接受的载剂调配。适用于这些实施例的调配物可包含选自由以下组成的群组的至少一个成员:增粘剂、微生物稳定剂、杀真菌剂、抗细菌剂、防腐剂、稳定剂、表面活性剂、抗复合剂、除草剂、杀线虫剂、杀虫剂、植物生长调节剂、肥料、灭鼠剂、干燥剂、杀菌剂、养分或其任何组合。在一些实例中,组合物可以是贮存稳定的。举例来说,本文所描述的组合物中的任一种可以包含农业上可接受的载剂(例如,肥料(如非天然存在的肥料)、粘合剂(如非天然存在的粘合剂)和农药(如非天然存在的农药)中的一或多种)。非天然存在的粘合剂可以是例如聚合物、共聚物或合成蜡。举例来说,本文所描述的包衣种子、幼苗或植物中的任一种可以在种子包衣中含有此类农业上可接受的载剂。在本文所描述的组合物或方法中的任一种中,农业上可接受的载剂可以是或可以包含非天然存在的化合物(例如,非天然存在的肥料、非天然存在的粘合剂(如聚合物、共聚物或合成蜡)或非天然存在的农药)。下文描述了农业上可接受的载剂的非限制性实例。农业上可接受的载剂的其它实例是所属领域中已知的。
在一些情况下,细菌与农业上可接受的载剂混合。载剂可以是固体载剂或液体载剂,且呈各种形式,包含微球、粉末、乳液等。载剂可以是赋予多种特性,如提高的稳定性、可湿性或可分散性的数种载剂中的任何一或多种。组合物中可以包含润湿剂,如天然或合成表面活性剂,其可以是非离子或离子表面活性剂,或其组合。油包水乳液也可以用于调配包含分离的细菌的组合物(参见例如美国专利第7,485,451号)。可以制备的合适的调配物包含可湿性粉剂、颗粒、凝胶、琼脂条或团粒、增稠剂等、微囊封粒子等、液体,如水性流体、水性悬浮液、油包水乳液等。调配物可包含谷物或豆科植物产品,例如磨碎的谷物或豆类、来源于谷物或豆类的汤或粉、淀粉、糖或油。
在一些实施例中,农业载剂可以是土壤或植物生长培养基。可以使用的其它农业载剂包含水、肥料、植物类油、保湿剂或其组合。或者,农业载剂可以是固体,如硅藻土、壤土、二氧化硅、海藻酸盐、粘土、膨润土、蛭石、种壳、其它植物和动物产品或组合,包含颗粒、团粒或悬浮液。还考虑了前述成分中的任一种的混合物作为载剂,如但不限于佩斯塔(pesta)(面粉和高岭土),壤土、砂土或粘土中基于琼脂或面粉的团粒等。调配物可包含细菌的食物源,如大麦、水稻,或其它生物材料,如种子、植物部分、甘蔗渣、来自谷物加工的壳或茎秆、来自建筑场所垃圾的磨碎植物材料或木材、锯末或来自纸、织物或木材回收的小纤维。
例如,肥料可以用于帮助促进生长或为种子、幼苗或植物提供养分。肥料的非限制性实例包含氮、磷、钾、钙、硫、镁、硼、氯、锰、铁、锌、铜、钼和硒(或其盐)。肥料的其它实例包含一或多种氨基酸、盐、碳水化合物、维生素、葡萄糖、NaCl、酵母提取物、NH
在一些实施例中,粘合剂可以是例如蜡,如巴西棕榈蜡(carnauba wax)、蜂蜡、中国蜡、虫胶蜡、鲸蜡(spermaceti wax)、小烛树蜡(candelilla wax)、蓖麻蜡、小冠巴西棕蜡(ouricury wax)和米糠蜡、多糖(例如,淀粉、糊精、麦芽糖糊精、海藻酸盐和壳聚糖)、脂肪、油、蛋白质(例如,明胶和玉米蛋白)、阿拉伯胶和虫胶。粘合剂可以是非天然存在的化合物,例如聚合物、共聚物和蜡。例如,可以用作粘合剂的聚合物的非限制性实例包含:聚乙酸乙烯酯、聚乙酸乙烯酯共聚物、乙烯乙酸乙烯酯(EVA)共聚物、聚乙烯醇、聚乙烯醇共聚物、纤维素(例如,乙基纤维素、甲基纤维素、羟甲基纤维素、羟丙基纤维素以及羧甲基纤维素)、聚乙烯吡咯烷酮、氯乙烯、偏二氯乙烯共聚物、木质素磺酸钙、丙烯酸共聚物、聚乙烯基丙烯酸酯、聚环氧乙烷、酰基酰胺聚合物和共聚物、聚丙烯酸羟乙酯、甲基丙烯酰胺单体和聚氯丁二烯。
在一些实例中,粘合剂、抗真菌剂、生长调节剂和农药(例如,杀虫剂)中的一或多种是非天然存在的化合物(例如,以任何组合)。农业上可接受的载剂的其它实例包含分散剂(例如,聚乙烯吡咯烷酮/乙酸乙烯酯PVPIVA S-630)、表面活性剂、粘结剂和填充剂。
配制物还可以含有表面活性剂。表面活性剂的非限制性实例包含氮表面活性剂掺合物,如Prefer 28(Cenex)、Surf-N(US)、Inhance(Brandt)、P-28(Wilfarm)和Patrol(Helena);酯化的种子油包含Sun-It II(AmCy)、MSO(UAP)、Scoil(Agsco)、Hasten(Wilfarm)和Mes-100(Drexel);且有机硅表面活性剂包含Silwet L77(UAP)、Silikin(Terra)、Dyne-Amic(Helena)、Kinetic(Helena)、Sylgard 309(Wilbur-Ellis)和Century(Precision)。在一个实施例中,表面活性剂以0.01%v/v到10%v/v之间的浓度存在。在另一实施例中,表面活性剂以0.1%v/v到1%v/v之间的浓度存在。
在某些情况下,调配物包含微生物稳定剂。此类试剂可以包含干燥剂,其可以包含可以被分类为干燥剂的任何化合物或化合物的混合物,而不管一或多种化合物是否以实际上对液体接种菌具有干燥作用的浓度使用。此类干燥剂理想地与所使用的细菌种群相容,且应提高微生物种群经受住在种子上施加后和经受住干燥的能力。合适的干燥剂的实例包含海藻糖、蔗糖、甘油和亚甲二醇中的一或多种。其它合适的干燥剂包含(但不限于)非还原糖和糖醇(例如,甘露糖醇或山梨糖醇)。引入到调配物中的干燥剂的量可以在按重量/体积计约5%到约50%的范围内,例如,在约10%到约40%之间、在约15%到约35%之间或在约20%到约30%之间。在一些情况下,调配物中含有如杀真菌剂、抗细菌剂、除草剂、杀线虫剂、杀虫剂、植物生长调节剂、灭鼠剂、杀菌剂或养分的试剂是有利的。在一些实例中,试剂可包含提供对种子表面传播的病原体的防范的保护剂。在一些实例中,保护剂可提供对土传病原体的一定水平的控制。在一些实例中,保护剂可主要在种子表面上有效。
在一些实例中,杀真菌剂可包含可以抑制真菌生长或杀死真菌的化合物或试剂,无论是化学还是生物的。在一些实例中,杀真菌剂可包含可抑制真菌或杀真菌的化合物。在一些实例中,杀真菌剂可以是保护剂,或主要在种子表面上有效的试剂,提供对种子表面传播的病原体的防范且提供对土传病原体的一定水平的控制。保护剂杀真菌剂的非限制性实例包含克菌丹(captan)、代森锰(maneb)、福美双(thiram)或咯菌腈。
在一些实例中,杀真菌剂可以是内吸性杀真菌剂,其可以被吸收到出苗的幼苗中且抑制或杀死宿主植物组织内的真菌。用于种子处理剂的内吸性杀真菌剂包含(但不限于)以下:嘧菌酯、萎锈灵(carboxin)、精甲霜灵、甲霜灵、噻菌灵、三氟敏(trifloxystrobin)和各种三唑杀真菌剂,包含苯醚甲环唑(difenoconazole)、种菌唑、戊唑醇和灭菌唑(triticonazole)。精甲霜灵和甲霜灵主要用于靶向水霉菌腐霉属(Pythium)和疫霉属(Phytophthora)。视植物物种而定,一些杀真菌剂相比于其它杀真菌剂是优选的,因为病原真菌物种的敏感性存在细微差异,或因为杀真菌剂分布或植物敏感性存在差异。在一些实例中,杀真菌剂可以是生物控制剂,例如细菌或真菌。此类生物体可以寄生到病原真菌,或分泌毒素或可以杀死真菌或以其它方式阻止真菌生长的其它物质。任何类型的杀真菌剂,尤其通常在植物上使用的杀真菌剂,可以用作种子组合物中的控制剂。
在一些实例中,种子包衣组合物包括具有抗细菌特性的控制剂。在一个实施例中,具有抗细菌特性的控制剂选自本文其它地方所描述的化合物。在另一实施例中,化合物是链霉素(Streptomycin)、土霉素(oxytetracycline)、欧索林酸(oxolinic acid)或庆大霉素(gentamicin)。可以用作种子包衣组合物一部分的抗细菌化合物的其它实例包含基于双氯酚和苄醇半缩甲醛(来自ICI的
在一些实例中,生长调节剂选自由以下组成的群组:脱落酸(Abscisic acid)、甲草胺(amidochlor)、嘧啶醇(ancymidol)、6-苄基氨基嘌呤、芸苔素内酯(brassinolide)、仲丁灵(butralin)、克美素(chlormequat)(矮壮素(chlormequat chloride))、氯化胆碱、环丙酰草胺(cyclanilide)、丁酰肼(daminozide)、调呋酸(dikegulac)、噻节因(dimethipin)、2,6-二甲基嘌啶、乙烯利(ethephon)、氟节胺(flumetralin)、呋嘧醇(flurprimidol)、嗪草酸甲酯(fluthiacet)、福芬素(forchlorfenuron)、赤霉酸(gibberellic acid)、抗倒胺(inabenfide)、吲哚-3-乙酸、顺丁烯二酰肼、氟磺酰草胺(mefluidide)、壮棉素(mepiquat)(缩节胺(mepiquat chloride))、萘乙酸、N-6-苄基腺嘌呤、巴克素(paclobutrazol)、调环酸三硫代磷酸酯(prohexadionephosphorotrithioate)、2,3,5-三碘苯甲酸、抗倒酯(trinexapac-ethyl)和烯效唑(uniconazole)。生长调节剂的其它非限制性实例包含油菜素甾醇(brassinosteroid)、细胞分裂素(例如,激动素(kinetin)和玉米素(zeatin))、生长素(例如,吲哚乙酸和吲哚基乙酰基天冬氨酸)、类黄酮和异类黄酮(例如,芒柄花黄素和香叶木素(diosmetin))、植物抗毒素(例如,大豆抗毒素(glyceolline))和诱导植物抗毒素的寡糖(例如,果胶、几丁质、壳聚糖、聚半乳糖醛酸和寡聚半乳糖醛酸)和吉贝素(gibellerin)。此类试剂理想地与上面施加调配物的农业种子或幼苗相容(例如,其不应对植物的生长或健康有害)。此外,试剂理想地是一种不会导致对人类、动物或工业使用的安全担忧的试剂(例如,没有安全问题,或化合物足够不稳定以至于来源于植物的商品植物产品含有可忽略量的化合物)。
线虫拮抗性生物控制剂的一些实例包含ARF18;30线虫捕捉菌属(Arthrobotrysspp.);毛壳菌属种(Chaetomium spp.);三七根腐病原菌属种(Cylindrocarpon spp.);外蝇属种(Exophilia spp.);镰刀菌属种(Fusarium spp.);粘帚霉种(Gliocladium spp.);食线虫菌物被毛孢种(Hirsutella spp.);蜡蚧菌属种(Lecanicillium spp.);单孢子菌属种(Monacrosporium spp.);甲藻属种(Myrothecium spp.);新孢子虫属种(Neocosmosporaspp.);拟青霉属种(Paecilomyces spp.);普可尼亚属种(Pochonia spp.);星形孢酵母属种(Stagonospora spp.);囊泡-丛枝真菌(vesicular-arbuscular mycrookizal fungi);伯克霍尔德菌属种(Burkholderia spp.);巴氏杆菌属种(Pasteuria spp.);短芽孢杆菌属种(Brevibacillus spp.);假单胞菌属种(Pseudomonas spp.);和根际细菌(根际细菌)。尤其优选的线虫拮抗生物控制剂包含ARF18、少孢节丛孢菌(Arthrobotrys oligospora)、少孢线虫捕捉菌(Arthrobotrys dactyloides)、球毛壳菌(Chaetomium globosum)、异丝藻柱孢(Cylindrocarpon heteronema)、甄氏外瓶霉(Exophilia jeanelmei)、嗜鱼外瓶霉(Exophilia pisciphila)、曲霉镰刀菌(Fusarium aspergilus)、茄病镰刀菌(Fusariumsolani)、链孢粘帚霉(Gliocladiumcatenulatum)、粉红粘帚霉(Gliocladium roseum)、绿粘帚霉(Gliocladium vixens)、洛斯里被毛孢(Hirsutella rhossiliensis)、明尼苏达被毛孢(Hirsutella minnesotensis)、蜡蚧轮枝菌(Lecanicillium lecanii)、掘氏单顶孢(Monacrosporium drechsleri)、桥区单顶孢(Monacrosporium gephyropagum)、疣孢漆斑菌(Myrotehcium verrucaria)、侵管新赤壳菌(Neocosmospora vasinfecta)、淡紫拟青霉菌(Paecilomyces lilacinus)、厚垣普可尼亚菌(Pochonia chlamydosporia)、异皮壳多孢菌(Stagonospora heteroderae)、菜豆壳多孢菌(Stagonospora phaseoli)、囊泡-丛枝菌根真菌、洋葱伯克霍尔德氏菌、穿刺巴斯德氏菌、多刺巴斯德氏菌(Pasteuria thornei)、西泽巴斯德氏菌(Pasteuria nishizawae)、分支巴斯德氏菌(Pasteuria ramosa)、美国高尔夫球协会巴斯德氏菌、侧孢短芽孢杆菌菌株G4、荧光假单胞菌和根际细菌。
养分的一些实例可以选自由以下组成的群组:氮肥,包含(但不限于)尿素、硝酸铵、硫酸铵、无压氮溶液、氨水、无水氨、硫代硫酸铵、硫包膜尿素、脲甲醛、IBDU、聚合物包膜尿素、硝酸钙、脲醛和亚甲脲、磷肥,如磷酸氢二铵、磷酸一铵、多磷酸铵、浓过磷酸钙和三重过磷酸钙,和钾肥,如氯化钾、硫酸钾、硫酸钾镁、硝酸钾。此类组合物可以在种子包衣组合物中以游离盐或离子的形式存在。或者,养分/肥料可以复合或螯合,以提供随时间推移的持续释放。
杀鼠剂的一些实例可包含选自由以下组成的物质的群组:2-异戊酰基茚满-1,3-二酮、4-(喹喔啉-2-基氨基)苯磺酰胺、α-氯醇、磷化铝、安妥(antu)、三氧化二砷、碳酸钡、双鼠脲(bisthiosemi)、溴鼠灵(brodifacoum)、溴敌隆(bromadiolone)、溴鼠胺(bromethalin)、氰化钙、氯醛糖、氯敌鼠(chlorophacinone)、胆钙化醇、氯杀鼠灵(coumachlor)、克灭鼠(coumafuryl)、杀鼠迷(coumatetralyl)、鼠立死(crimidine)、鼠得克(difenacoum)、噻鼠灵(difethialone)、敌鼠(diphacinone)、麦角钙化醇、氟鼠灵(flocoumafen)、氟乙酰胺、氟鼠啶(flupropadine)、氟鼠啶盐酸盐、氰化氢、碘甲烷、林丹(lindane)、磷化镁、溴甲烷、鼠特灵(norbormide)、毒鼠磷(phosacetim)、膦、磷、杀鼠酮(pindone)、亚砷酸钾、灭鼠优(pyrinuron)、海葱糖苷(scilliroside)、亚砷酸钠、氰化钠、氟乙酸钠、番木鳖碱(strychnine)、硫酸铊、华法林(warfarin)和磷化锌。
在液体形式,例如溶液或悬浮液中,细菌种群可以混合或悬浮于水或水性溶液中。合适的液体稀释剂或载剂包含水、水性溶液、石油馏出物或其它液体载剂。
固体组合物可以通过将细菌种群分散在适当分开的固体载剂之中或之上而制备,所述固体载剂如泥炭、小麦、麸、蛭石、粘土、滑石、膨润土、硅藻土、漂白土(fuller'searth)、巴氏灭菌土壤等。当此类调配物用作可湿性粉剂时,可以使用生物相容的分散剂,如非离子、阴离子、两性或阳离子分散剂和乳化剂。
在调配时使用的固体载剂包含例如矿物载剂,如高岭土、叶蜡石、膨润土、蒙脱土、硅藻土、酸性白土、蛭石和珍珠岩,和无机盐,如硫酸铵、磷酸铵、硝酸铵、尿素、氯化铵和碳酸钙。另外,可使用有机细粉,如小麦面粉、麦麸和米糠。液体载剂包含植物油(如大豆油和棉籽油)、甘油、乙二醇、聚乙二醇、丙二醇、聚丙二醇等。
害虫
可包括本文所教示的任何微生物的本发明的农业组合物有时与一或多种农药组合。
与本发明的微生物组合的农药可靶向下文所提及的害虫中的任一种。
“害虫”包含(但不限于)昆虫、真菌、细菌、线虫、螨虫、扁虱等。昆虫害虫包含选自以下各者的昆虫:鞘翅目、双翅目、膜翅目、鳞翅目、食毛目、同翅目、半翅目、直翅目、缨翅目、革翅目、等翅目、虱目、蚤目、毛翅目等,尤其鳞翅目和鞘翅目。
所属领域的技术人员将认识到,并非所有化合物都对所有害虫同样有效。可与本发明的微生物组合的化合物可显示针对昆虫害虫的活性,其可包含经济上重要的农学、森林、温室、苗圃观赏性植物、食品和纤维、公共和动物健康、家庭和商业结构、家庭和存储产品害虫。
如前所述,本发明的农业组合物(其可包括本文所教示的任何微生物)在实施例中与一或多种农药组合。这些农药可针对以下害虫中的任一者具有活性:
鳞翅目的幼虫包含(但不限于)粘虫、切根虫、循环子和夜蛾科的草地黏虫(Spodoptera frugiperda)J E史密斯(J E Smith)秋夜蛾(fall armyworm)中的heliothines;甜菜夜蛾哈布纳(S.exigua Hubner);斜纹夜蛾法布里休斯(S.lituraFabricius)(烟草切根虫(tobacco cutworm)、簇毛虫(cluster caterpillar));蓓带夜蛾沃克(Mamestra configurata Walker)(披肩粘虫(bertha armyworm));甘蓝夜蛾(M.brassicae Linnaeus)(甘蓝夜蛾(cabbage moth));地老虎胡天纳格尔(Agrotisipsilon Hufnagel)(小地老虎(black cutworm));胖夜蛾属莫里森(A.orthogoniaMorrison)(西地老虎(western cutworm));地栖盘腹蚁法布里休斯(A.subterraneaFabricius)(粒肤地老虎);棉叶波纹叶蛾哈布纳(Alabama argillacea Hubner)(衣蛾);粉纹夜蛾哈布纳(Trichoplusia ni Hubner)(甘蓝尺蠖);大豆夜蛾沃克尔(Pseudoplusiaincludens Walker)(大豆尺蠖);黎豆夜蛾哈布纳(Anticarsia gemmatalis Hubner)(绒毛豆毛虫);沙菜夜蛾法布里休斯(Hypena scabra Fabricius)(绿色三叶草蠕虫);美洲烟叶蛾法布里休斯(Heliothis virescens Fabricius)(烟草夜蛾);粘虫霍沃思(Pseudaletiaunipuncta Haworth)(夜盗蛾);丫纹夜蛾巴恩斯和麦克唐纳(Athetis mindara Barnesand Mcdunnough(粗皮地老虎);切夜蛾属哈里斯(Euxoa messoria Harris)(黑暗面蠕虫);埃及钻夜蛾博伊斯杜瓦(Earias insulana Boisduval)(带刺棉铃虫);翠纹钻夜蛾法布里休斯(E.vittella Fabricius)(点样棉铃虫);棉铃虫哈布纳(Helicoverpa armigeraHubner)(美国棉铃虫);玉米螟棉铃虫玉米(H.zea Boddie)(玉米穗夜蛾(corn earworm)或棉铃虫);乌夜蛾属哈里斯(Melanchra picta Harris)(斑马毛虫);栖夜蛾属(Egiracurialis)格鲁特(Grote)(柑橘夜蛾(Xylomyges))(柑橘切根虫);蛀虫、鞘蛾、结网毛虫和来自螟蛾科族欧洲玉米螟(Ostrinia nubilalis)哈布纳的雕叶虫(欧洲玉米螟);脐橙螟(Amyelois transitella)沃克尔(海军柑橘虫);地中海粉斑螟泽勒(Anagasta kuehniellaZeller)(地中海粉娥);粉斑螟蛾沃克尔(Cadra cautella Walker)(粉斑螟);禾草螟属沃克尔(Chilo suppressalis Walker)(稻茎螟虫);粉虱(C.partellus)、高粱螟(sorghumborer)、米蛾斯坦顿(Corcyra cephalonica Stainton)(大米娥);玉米根草螟(Crambuscaliginosellus)克莱门(Clemens)(玉米齿根结网毛虫);草螟(C.teterrellus Zincken)(蓝草禾草螟);纵卷叶野螟属(Cnaphalocrocis medinalis Guenee)(稻纵卷叶螟);蟛蜞菊哈布纳(Desmia funeralis Hubner)(葡萄野螟);绢野螟属林奈(Diaphania hyalinataLinnaeus)(甜瓜野螟);黄瓜绢野螟(D.nitidalis)斯托尔(Stoll)(泡菜虫);西南玉米螟(Diatraea grandiosella)戴尔(Dyar)(西南玉米螟);小蔗杆草螟(D.saccharalis)法布里休斯(甘蔗螟虫);禾草螟(Eoreuma loftini)戴尔(墨西哥大米螟);烟草粉斑螟(Ephestiaelutella)哈布纳(烟草(可可)粉螟);大蜡螟(Galleria mellonella)林奈(大蜡螟);野螟蛾(Herpetogramma licarsisalis)沃克尔(草地螟);向日葵同斑螟(Homoeosomaelectellum)赫尔斯特(Hulst)(向日葵螟);南美玉米苗斑螟(Elasmopalpus lignosellus)泽勒(小玉米茎蛀虫);小蜡螟(Achroia grisella)法布里休斯(小蜡螟);草地螟(Loxostege sticticalis)林奈(黄绿条螟);茶树结网蛾(Orthaga thyrisalis)沃克尔(茶树网蛾);豆野螟(Maruca testulalis)盖伊尔(豆荚蛀螟);印度谷螟(Plodiainterpunctella)哈布纳(印度谷螟);三化螟(Scirpophaga incertulas)沃克尔(黄带趾弄蝶);芹菜网螟(Udea rubigalis Guenee)(芹菜网暝);和卷蛾科长翅卷蛾属(familyTortricidae Acleris gloverana)沃尔辛厄姆(Walsingham)(西方黑头芽卷蛾)的后黄卷蛾(leafrollers)、幼芽青虫(budworms)、种虫(seed worms)和果虫(fruit worms);黑头长翅卷蛾(A.variana)弗纳尔德(Fernald)(东方黑头虫);果树黄卷蛾(Archipsargyrospila)沃克尔(果树卷叶蛾);玫瑰黄卷蛾(A.rosana)林奈(欧洲卷叶蛾);和其它黄卷蛾属(Archips)物种、棉褐带卷蛾(Adoxophyes orana)费舍尔冯罗斯拉斯坦姆(Fischervon Rosslerstamm)(棉褐带卷蛾);细卷蛾属(Cochylis hospes)沃尔辛厄姆(带状向日葵细卷叶蛾);小卷蛾属(Cydia latiferreana)沃尔辛厄姆(榛小卷蛾);苹果蠹蛾(C.pomonella)林奈(冷蛾);黄粉虫(Platynota flavedana)克莱门(花斑卷叶蛾);荷兰石竹小卷蛾(P.stultana)沃尔辛厄姆(杂食卷叶蛾);葡萄浆果小卷蛾(Lobesia botrana)丹尼斯&希弗穆勒(Denis&Schiffermuller)(欧洲葡萄藤蛾);苹白小卷蛾(Spilonotaocellana)丹尼斯&希弗穆勒(苹果芽小卷叶蛾);葡萄小食心虫(Endopiza viteana)克莱门(葡萄卷叶蛾);葡萄螟蛾(Eupoecilia ambiguella)哈布纳(葡萄果蠹蛾);巴西苹果卷叶蛾(Bonagota)梅里克(Meyrick)(巴西苹果卷叶蛾);梨小食心虫(Grapholita molesta)比斯克(Busck)(梨小食心虫);向日葵芽蛾(Suleima helianthana)莱利(Riley)(向日葵螟);带卷蛾属物种(Argyrotaenia spp.)。
所选择的鳞翅目其它农学害虫包含(但不限于)秋星尺蠖(Alsophila pometaria)哈里斯(秋星尺蠖);桃条麦蛾(Anarsia lineatella)泽勒(桃芽蛾);栎黄条大蚕蛾(Anisota senatoria)史密斯(J.E.Smith)(桔条柞蚕);柞蚕(Antheraea pernyi-Meneville)(中国柞蚕蛾);家蚕(Bombyx mori)林奈(蚕);棉叶穿孔潜蛾(Bucculatrixthurberiella)比斯克(棉叶穿孔潜蛾);纹黄豆粉蝶(Colias eurytheme)博伊斯杜瓦(Boisduval)(苜蓿毛虫);胡桃天社蛾(Datana integerrima)格鲁特&罗宾逊(Grote&Robinson)(胡桃毛虫);西伯利亚松毛虫(Dendrolimus sibiricus Tschetwerikov)(西伯利亚丝蛾);榆秋黄尺蛾(Ennomos subsignaria)哈布纳(榆角尺蠖);菩提松尺蛾(Erannistiliaria)哈里斯(林登尺蠖);黄毒蛾属(Euproctis chrysorrhoea)林奈(棕尾毒蛾);美国哈里斯纳柞蚕(Harrisina americana Guerin-Meneville)(葡萄叶雕叶虫);行列半白大蚕蛾(Hemileuca oliviae)科克雷尔(牧草天蚕蛾);美国白蛾(Hyphantria cunea)德鲁里(Drury)(秋结网毛虫);番茄蠹蛾(Keiferia lycopersicella)沃尔辛厄姆(番茄蛲虫);铁杉尺蠖(Lambdina fiscellaria fiscellaria)赫尔斯特(东方铁杉尺蠖);西方铁杉尺蠖(L.fiscellaria lugubrosa)赫尔斯特(威斯登铁杉尺蠖);雪毒蛾(Leucoma salicis)林奈(柳毒蛾);舞毒蛾(Lymantria dispar)林奈(舞毒蛾);番茄天蛾(Manducaquinquemaculata)霍沃思(Haworth)(五花山楂蛾、番茄虫);天蛾(M.sexta)霍沃思(番茄虫、烟草天蛾);秋尺蛾属(Operophtera brumata)林奈(冬娥);春尺蠖(Paleacritavernata)佩克(Peck)(春尺蠖);大凤蝶(Papilio cresphontes)克拉默(Cramer)(巨型燕尾橙犬);加州蟛蜞菊(californica)帕卡德(Packard)(加利福尼亚柞蚕);柑橘潜叶蛾(Phyllocnistis citrella Stainton)(柑桔潜叶蛾);潜叶虫(Phyllonorycterblancardella)法布里休斯(点样潜叶蛾);大菜粉蝶(Pieris brassicae)林奈(大型粉蝶);菜粉蝶(P.rapae)林奈(小菜蛾);暗脉菜粉蝶(P.napi)林奈(绿脉菜粉蝶);洋蓟羽(Platyptilia carduidactyla)莱利(朝鲜蓟羽流娥);小菜蛾(Plutella xylostella)林奈(小菜蛾);红铃虫(Pectinophora gossypiella)桑德斯(Saunders)(粉红棉铃虫);纹白蝶(Pontia protodice)博伊斯杜瓦和勒孔特(Leconte)(南方菜粉蝶);杂食尺蠖(Sabulodesaegrotata Guenee)(杂食尺蠖);赤峰毛虫(Schizura concinna)史密斯(红驼毛虫);麦蛾(Sitotroga cerealella)奥利维尔(Olivier)(麦蛾);异舟蛾属(Thaumetopoeapityocampa)希弗米勒(Schiffermuller)(松树毛虫);幕谷蛾(Tineola bisselliella)胡梅尔(Hummel)(负袋夜蛾);番茄斑潜蝇(Tuta absoluta)梅里克(番茄潜叶蛾);巢蛾属(Yponomeuta padella)林奈(巢蛾);实夜蛾属(Heliothis subflexa Guenee);天幕毛虫属物种(Malacosoma spp.)和古毒蛾属物种(Orgyia spp.);欧洲玉米螟(Ostrinianubilalis)(欧洲玉米螟);种蝇(seed corn maggot);小地老虎(Agrotis ipsilon)(黑毛虫)。
鞘翅目的幼虫和成虫包含来自长角象虫科(families Anthribidae)、豆象科(Bruchidae)和象虫科(Curculionidae)(包含但不限于:墨西哥棉铃象甲(Anthonomusgrandis Boheman)(棉铃象鼻虫)的象鼻虫(weevils);稻水象甲(Lissorhoptrusoryzophilus Kuschel)(稻水象甲);谷象属(Sitophilus granarius)林奈(谷象);米象(S.oryzae)林奈(米象);苜蓿象甲(Hypera punctata)法布里休斯(车轴草叶象虫);密点细枝象(Cylindrocopturus adspersus)勒孔特(向日葵茎象鼻虫);黄褐小爪象(Smicronyxfulvus)勒孔特(红葵花籽象甲);灰葵花籽象甲(S.sordidus)勒孔特(灰葵花籽象甲);玉米长喙象(Sphenophorus maidis)奇滕登(Chittenden)(玉米谷象));叶甲科(familyChrysomelidae)的跳甲(flea beetles)、黄瓜甲虫(cucumber beetles)、根虫、叶甲(leafbeetles)、马铃薯甲虫和潜叶虫(leafminers)(包含但不限于:马铃薯甲虫(Leptinotarsadecemlineata)赛伊(Say)(科罗拉多马铃薯甲虫);玉米根萤叶甲(Diabrotica virgiferavirgifera)勒孔特(西方玉米根萤叶甲);北美玉米根萤叶甲(D.barberi)史密斯和劳伦斯(Lawrence)(北方长角叶甲);黄瓜十一星叶甲(D.undecimpunctata howardi)巴伯(Barber)(南方玉米根虫);玉米跳甲(Chaetocnema pulicaria)梅尔斯海默(Melsheimer)(玉米跳甲);萝卜菜跳甲(Phyllotreta cruciferae)格策(Goeze)(十字花科跳甲);黄曲条跳甲(Phyllotreta striolata)(黄条叶蚤);葡萄肖叶甲(Colaspis brunnea)法布里休斯(葡萄肖叶甲);谷物叶甲(Oulema melanopus)林奈(谷物叶甲);向日葵叶甲(Zygogrammaexclamationis)法布里休斯(向日葵叶甲);来自瓢虫科(family Coccinellidae)的甲虫(包含但不限于:墨西哥豆瓢虫(Epilachna varivestis Mulsant)(墨西哥豆瓢虫));来自金龟子科(family Scarabaeidae)的金龟子(chafers)和甲虫(包含但不限于:日本金龟子(Popillia japonica Newman)(日本金龟子);犀金龟(Cyclocephala borealis)阿罗(Arrow)(北方假面金龟子、白蛴螬(white grub));缺斑黛灰蝶(C.immaculata)奥利维尔(南方金假面龟子、白蛴螬);欧洲切根鳃金龟(Rhizotrogus majalis)拉佐莫夫斯基(Razoumowsky)(欧洲金龟子);食叶甲(Phyllophaga crinita)伯迈斯特(Burmeister)(白蛴螬);胡萝卜甲虫家具窍蠹(Ligyrus gibbosus De Geer)(胡萝卜甲虫);皮蠹科(familyDermestidae)的红缘皮蠹(carpet beetles);来自叩甲科(family Elateridae)、金针虫属物种(Eleodes spp.)、梳爪叩头虫属物种(Melanotus spp.)、宽胸叩头虫属物种(Conoderus spp.)、柠檬苦素物种(Limonius spp.)、叩甲属物种(Agriotes spp.)、七星瓢虫属物种(Ctenicera spp.)、盲蝽属物种(Aeolus spp.)的铁线虫(wireworms);来自小蠹科(family Scolytidae)的树皮甲虫(bark beetles)和来自拟步甲科(familyTenebrionidae)的甲虫;菜豆萤叶甲(Cerotoma trifurcate)(豆叶甲);和铁线虫。
双翅目昆虫的成虫和幼虫包含潜叶虫美洲黍潜叶蝇(Agromyza parvicornisLoew)(玉米潜叶蛾);蠓(midges)(包含但不限于高梁瘿蚊(Contarinia sorghicola)科基莱特(Coquillett)(高粱蠓);黑森麦杆蝇(Mayetiola destructor)赛伊(小麦瘿蚊);麦红吸浆虫(Sitodiplosis mosellana Gehin)(小麦吸浆虫);向日葵籽瘿蚊(Neolasiopteramurtfeldtiana Felt)(向日葵籽瘿蚊));果蝇(fruit flies)(实蝇科)(Tephritidae)、瑞典麦秆蝇(Oscinella frit)林奈(fruit flies);蛆(maggots)(包含但不限于:灰地种蝇(Delia platura)梅根(Meigen)(种蝇);麦地种蝇(D.coarctata Fallen)(冬作种蝇)和其它地种蝇物种(Delia spp.)、美州麦杆蝇(Meromyza americana)菲奇(Fitch)(美州麦杆蝇);家蝇(Musca domestica)林奈(苍蝇);黄腹厩蝇(Fannia canicularis)林奈、小家蝇(F.femoralis)施泰因(Stein)(小家蝇);厩螫蝇(Stomoxys calcitrans)林奈(厩蝇));苍蝇(face flies)、角蝇(horn flies)、丽蝇(blow flies)、金蝇属物种(Chrysomya spp.);伏蝇属物种(Phormia spp.)和其它家蝇害虫、马蝇虻属物种(horse flies Tabanusspp.);肤蝇胃蝇属物种(bot flies Gastrophilus spp.);狂蝇属物种(Oestrus spp.);牛蛆皮蝇属物种(cattle grubs Hypoderma spp.);鹿蝇斑虻属物种(deer flies Chrysopsspp.)蜱蝇属(Melophagus ovinus)林奈(凯兹(keds))和其它短角亚目(Brachycera)、蚊虫伊蚊属物种(mosquitoes Aedes spp.);按蚊属物种(Anopheles spp.);库蚊属物种(Culexspp.);黑色苍蝇原蚋属物种(Prosimulium spp.);蚋属物种(Simulium spp.);咬蠓、沙蝇、眼菌蚊(sciarids)和其它长角亚目。
半翅目和同翅目昆虫的成虫和若虫,如(但不限于)来自球蚜科(familyAdelgidae)的球蚜(adelgids)、来自盲蝽科(family Miridae)的盲蝽象(plant bugs)、来自蝉科(family Cicadidae)的蝉、叶蝉(leafhoppers)、微叶蝉属物种(Empoasca spp.);来自大叶蝉科(family Cicadellidae)、来自菱飞蝨科(families Cixiidae)、蛾蜡蝉科(Flatidae)、樗鸡总科(Fulgoroidea)、瓢蜡蝉科(Issidae)和飞虱科(Delphacidae)的飞虱(planthoppers)、来自角蝉科(family Membracidae)的角蝉(treehoppers)、来自木蝨科(family Psyllidae)的木虱(psyllids)、来自粉虱科(family Aleyrodidae)的粉虱(whiteflies)、来自蚜科(family Aphididae)的蚜虫(aphids)、来自根瘤蚜科(familyPhylloxeridae)的根瘤蚜(phylloxera)、来自粉蚧科(family Pseudococcidae)的水蜡虫(mealybugs)、来自介壳虫科(families Asterolecanidae)、蚧科(Coccidae)、胭蚧科(Dactylopiidae)、盾蚧科(Diaspididae)、绒蚧科(Eriococcidae)、旌蚧科(Ortheziidae)、战蚧科(Phoenicococcidae)和珠蚧科(Margarodidae)的甲鳞(scales)、来自网蝽科(Tingidae)的网椿(lace bugs)、来自蝽科(family Pentatomidae)的椿象(stink bugs)、臭虫(cinch bugs)、土长蝽属物种(Blissus spp.);和其它来自长蝽科(familyLygaeidae)的长蝽(seed bugs)、来自沫蝉科(Cercopidae)的沫蝉(spittlebugs)、来自缘蝽科(family Coreidae)的南瓜虫(squash bugs)和来自红蝽科(family Pyrrhocoridae)的秋恙螨(red bugs)和棉椿象(cotton stainers)。
来自同翅目昆虫的农学上至关重要的成员还包含(但不限于):豌豆属(Acyrthisiphon pisum)哈里斯(豌豆蚜);豆蚜(Aphis craccivora)科克(Koch)(豇豆蚜);黑豆蚜(A.fabae Scopoli)(黑豆蚜);棉蚜(A.gossypii)格洛弗(Glover)(棉蚜、瓜蚜);玉米根蚜(A.maidiradicis)福尔贝斯(Forbes)(玉米根蚜);苹果蚜家具窍蠹(A.pomi DeGeer)(苹果蚜);绣线菊蚜(A.spiraecola)帕奇(Patch)(飞虱蚜虫);马铃薯长须蚜(Aulacorthum solani)卡尔滕巴赫(Kaltenbach)(指顶花无网长管蚜);草莓毛管蚜(Chaetosiphonfragaefolii)克莱尔(Cockerell)(草莓蚜);麦双尾蚜(Diuraphis noxia)库尔久莫夫(Kurdjumov)/莫尔德维尔科(Mordvilko)小麦抗俄国蚜虫(Russian wheataphid);苹粉红劣蚜(Dysaphis plantaginea Paaserini)(苹粉红劣蚜);苹果绵蚜(Eriosoma lanigerum)豪斯曼(Hausmann)(苹绵蚜);甘蓝蚜(Brevicoryne brassicae)林奈(甘蓝蚜);梅大尾蚜(Hyalopterus pruni)乔弗瓦(Geoffroy)(桃大尾蚜);萝卜蚜(Lipaphis erysimi)卡尔滕巴赫(菜缢管蚜);谷物蚜(Metopolophium dirrhodum)沃克尔(谷物蚜);大戟长管蚜(Macrosiphum euphorbiae)托马斯(Thomas)(茄长管蚜);桃蚜(Myzus persicae)苏尔寿(Sulzer)(桃蚜、绿桃蚜);莴苣蚜(Nasonovia ribisnigri)莫斯利(Mosley)(莴苣膨管蚜);瘿绵蚜属物种(Pemphigus spp.)(根蚜和瘿蚜);玉米蚜(Rhopalosiphum maidis Fitch)(玉米叶蚜);禾谷缢管蚜(R.padi)林奈(禾谷缢管蚜);麦二叉蚜(Schizaphis graminum Rondani)(麦二叉蚜);牛鞭草蚜(Sipha flava)福尔贝斯(蔗黄伪毛蚜);麦长管蚜(Sitobion avenae)法布里休斯(长角麦蚜);斑纹蚜(Therioaphismaculata)巴克顿(Buckton)(点样苜蓿蚜);橘二岔蚜(Toxoptera aurantii Boyer deFonscolombe)(黑色橘蚜)和桔二岔蚜(T.citricida Kirkaldy)(棕橘蚜);高粱蚜(Melanaphis sacchari)(甘蔗蚜);球蚜属物种(Adelges spp.)(球蚜);长山核桃根瘤蚜(Phylloxera devastatrix Pergande)(山核桃根瘤蚜);烟粉虱(Bemisia tabaciGennadius)(烟草白粉虱、甘薯粉虱);银叶粉虱(B.argentifolii Bellows&Perring)(银叶白粉虱);柑桔粉虱(Dialeurodes citri)阿什米德(Ashmead)(柑橘白粉虱);粉虱属(Trialeurodes abutiloneus)(带翼白粉虱)和温室白粉虱(T.vaporariorum Westwood)(温室白粉虱);蚕豆微叶蝉(Empoasca fabae)哈里斯(马铃薯微叶蝉);灰飞虱(Laodelphaxstriatellus Fallen)(小灰飞虱);紫菀叶蝉(Macrolestes quadrilineatus)福斯贝斯(紫菀叶蝉);黑尾叶蝉属(Nephotettix cinticeps)尤勒(Uhler)(大青叶蝉);稻叶蝉(N.nigropictus)斯塔尔(Stal)(稻叶蝉);褐稻虱(Nilaparvata lugens)斯塔尔(稻褐飞虱);玉米飞虱(Peregrinus maidis)阿什米德(玉米飞虱);白背飞虱(Sogatellafurcifera)霍瓦斯(Horvath)(白背飞虱);稻飞虱(Sogatodes orizicola)缪尔(Muir)(稻飞虱);苹白小叶蝉(Typhlocyba pomaria)麦卡蒂(McAtee)(苹白小叶蝉);葡萄小叶蝉物种(Erythroneoura spp.)(葡萄小叶蝉);十七年蝉(Magicicada septendecim)林奈(周期蝉);吹绵蚧(Icerya purchasi)马斯克尔(Maskell)(吹绵蚧);齿盾蚧属(Quadraspidiotusperniciosus)康斯托克(Comstock)(梨圆蚧);桔臀纹粉蚧(Planococcus citri)里索(Risso)(桔粉蚧);粉蚧属物种(Pseudococcus spp.)(其它粉蚧复合体);梨木虱(Cacopsylla pyricola)福尔斯特(Foerster)(梨木虱);柿木虱(Trioza diospyri)阿什米德(柿木虱)。
来自半翅目昆虫的物种包含(但不限于):喜绿蝽(Acrosternum hilare)赛伊(绿椿象);南瓜缘蝽家具窍蠹(Anasa tristis De Geer)(南瓜虫);多毛长蝽(Blissusleucopterus leucopterus)赛伊(麦长蝽);棉网蝽(Corythuca gossypii)法布里休斯(棉网蝽);番茄盲蝽(Cyrtopeltis modesta Distant)(番茄虫);棉红蝽属(Dysdercussuturellus)赫里希-谢弗(Herrich-Schaffer)(棉椿象);美洲蝽属(Euschistus servus)赛伊(褐臭蝽);斑点臭虫(E.variolarius Palisot de Beauvais)(一个斑点臭虫);长椿科物种(Graptostethus spp.)(种虫复合体);叶足松籽虫(Leptoglossus corculus)赛伊(叶足松籽虫);牧草盲蝽(Lygus lineolaris Palisot de Beauvais)(无泽盲蝽);豆荚草盲蝽(L.Hesperus)奈特(Knight)(西方无泽盲蝽);草地虫(L.pratensis)林奈(普通草地虫);牧草盲椿(L.rugulipennis Poppius)皮乌斯(Poppius)(欧洲无泽盲蝽);原丽盲蝽(Lygocoris pabulinus)林奈(普通绿色被囊体);稻绿蝽(Nezara viridula)林奈(南方绿椿象);美洲稻蝽(Oebalus pugnax)法布里休斯(稻椿象);乳草长蝽(Oncopeltusfasciatus)达拉斯(达拉斯)(大乳粉蚧);棉跳盲蝽(Pseudatomoscelisseriatus)罗伊特(Reuter)(棉花蚤斗)。
半翅目昆虫如褐家鼠(Calocoris norvegicus)格梅林(Gmelin)(草莓虫);平原菟丝子(Orthops campestris)林奈;苹盲蝽(Plesiocoris rugicollis Fallen)(苹盲蝽);盲蝽(Cyrtopeltis modestus Distant)(番茄虫);烟草黑斑盲蝽(Cyrtopeltis notatusDistant)(苍蝇);白尾蟛蜞菊(Spanagonicus albofasciatus)罗伊特(带白色标记的跳蚤);刺槐盲蝽(Diaphnocoris chlorionis)赛伊(刺槐盲蝽);葱盲蝽(honeylocust plantbug)奈特(葱盲蝽);棉跳盲蝽(Pseudatomoscelis seriatus)罗伊特(棉跳盲蝽);苜蓿盲蝽(Adelphocorisrapidus)赛伊(苜蓿褐盲蝽);四线盲蝽(Poecilocapsus lineatus)法布里休斯(四线叶虫);麦长蝽(Nysius ericae)席林(Schilling)(谷长蝽);菜青虫(Nysiusraphanus)霍华德(Howard)(谷长蝽);稻绿蝽(Nezara viridula)林奈(南方绿椿象);扁盾蝽属物种(Eurygaster spp.);缘蝽科物种(Coreidae spp.);红蝽科物种(Pyrrhocoridaespp.);谷蛾科物种(Tinidae spp.);负蝽科物种(Blostomatidae spp.);猎椿科物种(Reduviidae spp.)和臭虫科物种(Cimicidae spp.)。
壁虱(Acari)(螨虫)的成虫和幼虫如郁金香瘿螨(Aceria tosichella)凯弗(Keifer)(卷叶螨);麦岩螨(Petrobia latens)穆勒(棕色麦岩螨);叶螨科(familyTetranychidae)的叶螨和红螨、苹果红蜘蛛(Panonychus ulmi)科克(Koch)(欧洲红蜘蛛);棉叶螨(Tetranychus urticae)科克(二斑叶螨);(麦克丹尼尔螨(T.mcdanieli)麦格雷戈(McGregor)(麦克丹尼尔螨);朱砂叶螨(T.cinnabarinus)博伊斯杜瓦(朱砂叶螨);土耳其斯坦叶螨(T.turkestani)乌加罗夫(Ugarov)&尼科尔斯基(Nikolski)(草莓蛛螨);细须螨科(family Tenuipalpidae)的扁平螨、短须螨属(Brevipalpus lewisi)麦格雷戈(橘扁平螨);瘿螨科(family Eriophyidae)的锈病和芽螨以及其它叶取食螨和在人和动物健康中至关重要的螨,即,表皮螨科(family Epidermoptidae)中的尘螨、蠕形螨科(familyDemodicidae)中的滤泡螨、甜食螨科(family Glycyphagidae)中的粉粒螨、硬蜱科(Ixodidae)中的扁虱(ticks)。肩突硬蜱(Ixodes scapularis)赛伊(鹿蜱);全环硬蜱(I.holocyclus)纽曼(Neumann)(澳大利亚麻痹蜱);革蜱属(Dermacentor variabilis)赛伊(美洲犬蜱);美洲花蜱(Amblyomma americanum)林奈(孤星蜱)和痒螨科(Psoroptidae)、蒲螨科(Pyemotidae)和疥螨科(Sarcoptidae)的痂痒螨。
缨尾目昆虫害虫,如衣鱼(Lepisma saccharina)林奈(衣鱼);斑衣鱼(Thermobiadomestica)帕卡德(Packard)(家衣鱼)。
额外节肢动物害虫包含:蜘蛛目(Araneae)的蜘蛛,如褐皮花蛛(Loxoscelesreclusa)格雷奇(Gertsch)和穆拉克(Mulaik)(褐色蜘蛛)以及黑寡妇蜘蛛(Latrodectusmactans)法布里休斯(黑寡妇球腹蛛)和蚰蜒目(Scutigeromorpha)的蜈蚣,如蚰蜒蚰蜒(Scutigera coleoptrata)林奈(家蜈蚣)。
臭虫和其它相关昆虫的超家族,包含(但不限于)属于蝽科(familyPentatomidae)的物种(稻绿蝽(Nezara viridula)、茶翅蝽(Halyomorpha halys)、壁蝽(Piezodorus guildini)、美洲蝽(Euschistus servus)、喜绿蝽(Acrosternum hilare)、美洲蝽(Euschistus heros)、美洲蝽(Euschistus tristigmus)、喜绿蝽、黄纹蝽(Dichelopsfurcatus)、翎虱(Dichelops melacanthus)和菘蝽(Bagrada hilaris)(菘虫))、龟蝽科(family Plataspidae)(筛豆龟蝽(Megacopta cribraria)-豆龟蝽)和土蝽科(familyCydnidae)(板栗壳(Scaptocoris castanea)-椿象)和鳞翅目物种(包含但不限于:小菜蛾,例如谷实夜蛾(Helicoverpa zea Boddie);大豆尺蠖,例如大豆夜蛾沃克尔和黎豆毛虫(velvet bean caterpillar)例如黎豆夜蛾胡贝尔(Huber)。
线虫包含寄生线虫(parasitic nematodes),如根结线虫(root-knot)、包囊(cyst)和根腐线虫(lesion nematodes),包含异皮线虫属物种(Heterodera spp.)、根结线虫属物种(Meloidogyne spp.)和球胞囊线虫属物种(Globodera spp.);尤其胞囊线虫(cyst nematodes)的成员,包含(但不限于)大豆异皮线虫(Heterodera glycines)(大豆孢囊线虫);甜菜胞囊线虫(Heterodera schachtii)(甜菜包囊线虫);禾谷孢囊线虫(Heterodera avenae)(谷类包囊线虫)和马铃薯球胞囊线虫(Globodera rostochiensis)和球胞囊线虫属(Globodera pailida)(马铃薯胞囊线虫)。根腐线虫包含草地垫刃线虫属物种(Pratylenchus spp.)。
包括农药和本发明的微生物的农药组合物
如前所述,可包括本文所教示的任何微生物的本发明的农业组合物有时与一或多种农药组合。农药可以包含除草剂、杀虫剂、杀真菌剂、杀线虫剂等。
在一些实施例中,农药/微生物组合可以以组合物形式施用且可以与其它化合物同时或依次施用到待处理的作物区域或植物。这些化合物可以是肥料、除草剂、低温保护剂、表面活性剂、清洁剂、杀虫皂、休眠油、聚合物和/或时间释放或生物可降解的载剂调配物,其允许在单次施用调配物之后长期给药目标区域。其还可以是选择性除草剂、化学杀虫剂、杀病毒剂、杀微生物剂、抗阿米巴药(amoebicide)、农药、杀真菌剂、杀菌剂、杀线虫剂、杀软体动物剂或这些调配物中的数种的混合物(如果需要),和其它农业上可接受的载剂、表面活性剂或调配物领域中通常采用的施用促进佐剂。合适的载剂(即农业上可接受的载剂)和佐剂可以是固体或液体且对应于调配物技术中通常采用的物质,例如天然或再生矿物质、溶剂、分散剂、湿润剂、粘着剂、增粘剂、粘合剂或肥料。同样地,可将调配物制备成可食用的诱饵或形成到害虫捕集器中,以允许目标害虫食用或摄入杀虫调配物。
可与本发明的微生物组合的示例性化学组合物包含:
果实/蔬菜除草剂:莠去津(Atrazine)、除草定(Bromacil)、敌草隆(Diuron)、草甘膦(Glyphosate)、利谷隆(Linuron)、赛克津(Metribuzin)、西玛津(Simazine)、氟乐灵(Trifluralin)、吡氟禾草灵(Fluazifop)、草铵膦(Glufosinate)、卤磺隆春白菊(Halosulfuron Gowan)、百草枯(Paraquat)、拿草特(Propyzamide)、烯禾啶(Sethoxydim)、氟丙嘧草酯(Butafenacil)、氯吡嘧磺隆(Halosulfuron)、茚嗪氟草胺(Indaziflam);果实/蔬菜杀虫剂:涕灭威(Aldicarb)、苏云金芽孢杆菌(Bacillus thuringiensis)、甲萘威(Carbaryl)、克百威(Carbofuran)、毒死蜱(Chlorpyrifos)、氯氰菊酯(Cypermethrin)、溴氰菊酯(Deltamethrin)、二嗪磷(Diazinon)、马拉硫磷(Malathion)、害极灭(Abamectin)、氟氯氰菊酯/β氟氯氰菊酯(Cyfluthrin/betacyfluthrin)、来福灵(Esfenvalerate)、λ-三氟氯氰菊酯(Lambda-cyhalothrin)、灭螨醌(Acequinocyl)、联苯肼酯(Bifenazate)、甲氧虫酰(Methoxyfenozide)、氟酰脲(Novaluron)、环虫酰肼(Chromafenozide)、噻虫啉(Thiacloprid)、呋虫胺(Dinotefuran)、嘧螨酯(FluaCrypyrim)、唑虫酰胺(Tolfenpyrad)、噻虫胺(Clothianidin)、螺螨酯(Spirodiclofen)、γ-氯氟氰菊(Gamma-cyhalothrin)、螺螨甲酯(Spiromesifen)、多杀霉素(Spinosad)、氯虫酰胺(Rynaxypyr)、溴氰虫酰胺(Cyazypyr)、爱绿士(Spinotoram)、杀铃脲(Triflumuron)、螺虫乙酯(Spirotetramat)、吡虫啉(Imidacloprid)、氟苯虫酰胺(Flubendiamide)、硫双威(Thiodicarb)、氰氟虫腙(Metaflumizone)、氟啶虫胺腈(Sulfoxaflor)、丁氟螨酯(Cyflumetofen)、腈吡螨酯(Cyanopyrafen)、吡虫啉(Imidacloprid)、噻虫胺(Clothianidin)、噻虫嗪(Thiamethoxam)、爱绿士、硫双威、氟啶虫酰胺(Flonicamid)、甲硫威(Methiocarb)、甲氨基阿维菌素(Emamectin benzoate)、茚虫威(Indoxacarb)、强力霉素(Forthiazate)、苯线磷(Fenamiphos)、硫线磷(Cadusaphos)、吡丙醚(Pyriproxifen)、苯丁锡(Fenbutatinoxide)、己噻唑(Hexthiazox)、灭多威(Methomyl)、4-[[(6-氯吡啶-3-基)甲基](2,2-二氟乙基)氨基]呋喃-2(5H)-酮;果实蔬菜杀真菌剂:多菌灵(Carbendazim)、嘧菌酯(Chlorothalonil)、EBDC、硫磺(Sulphur)、甲基硫菌灵(Thiophanate-methyl)、嘧菌酯(Azoxystrobin)、霜脲氰(Cymoxanil)、氟啶胺(Fluazinam)、乙膦酸(Fosetyl)、异菌脲(Iprodione)、醚菌酯(Kresoxim-methyl)、甲霜灵/精甲霜灵(Metalaxyl/mefenoxam)、肟菌酯(Trifloxystrobin)、噻唑菌胺(Ethaboxam)、丙森锌(Iprovalicarb)、肟菌酯(Trifloxystrobin)、环酰菌胺(Fenhexamid)、富马酸氧氟沙星(Oxpoconazole fumarate)、氰霜唑(Cyazofamid)、咪唑菌酮(Fenamidone)、苯酰菌胺(Zoxamide)、啶氧菌酯(Picoxystrobin)、吡唑醚菌酯(Pyraclostrobin)、环氟菌胺(Cyflufenamid)、啶酰菌胺(Boscalid);
谷类除草剂:异丙隆(Isoproturon)、溴苯腈(Bromoxynil)、碘苯腈(loxynil)、苯氧基(Phenoxies)、氯磺隆(Chlorsulfuron)、炔草酸(Clodinafop)、二氯苯氧基苯氧基丙酸(Diclofop)、吡氟酰草胺(Diflufenican)、精噁唑禾草灵(Fenoxaprop)、双氟磺草胺(Florasulam)、(Fluoroxypyr)、甲磺隆(Metsulfuron)、醚苯磺隆(Triasulfuron)、氟酮磺隆(Flucarbazone)、氯磺隆(lodosulfuron)、丙苯磺隆(Propoxycarbazone)、氟吡草胺(Picolin-afen)、甲基二磺隆(Mesosulfuron)、氟丁酰草胺(Beflubutamid)、草吡唑(Pinoxaden)、酰嘧磺隆(Amidosulfuron)、噻吩磺隆(Thifensulfuron Methyl)、苯磺隆(Tribenuron)、氟啶嘧磺隆(Flupyrsulfuron)、磺酰磺隆(Sulfosulfuron)、磺酰草吡唑(Pyrasulfotole)、甲氧磺草胺(Pyroxsulam)、氟噻草胺(Flufenacet)、三甲苯草酮(Tralkoxydim)、砜吡草唑(Pyroxasulfon);谷类杀真菌剂:多菌灵、(Chlorothalonil)、嘧菌酯(Azoxystrobin)、环丙唑醇(Cyproconazole)、嘧菌环胺(Cyprodinil)、丁苯吗啉(Fenpropimorph)、氟环唑(Epoxiconazole)、醚菌酯(Kresoximmethyl)、(Quinoxyfen)、戊唑醇(Tebuconazole)、肟菌酯(Trifloxystrobin)、硅氟唑(Simeconazole)、啶氧菌酯(Picoxystrobin)、吡唑醚菌酯(Pyraclostrobin)、醚菌胺(Dimoxystrobin)、丙硫菌唑(Prothioconazole)、氟嘧菌酯(Fluoxastrobin);谷类杀虫剂:乐果(Dimethoate)、λ-氯氟氰菊(Lambda-cyhalothrin)、溴氰菊酯、α-氯氰菊酯(alpha-Cypermethrin)、β-氟氯氰菊酯(β-cyfluthrin)、联苯菊酯(Bifenthrin)、吡虫啉(Imidacloprid)、噻虫胺、噻虫嗪(Thiamethoxam)、噻虫啉、啶虫脒(Acetamiprid)、呋虫胺(Dinetofuran)、毒死蜱(Clorphyriphos)、甲胺磷(Metamidophos)、甲基氧亚甲基(Oxidemethon methyl)、抗蚜威(Pirimicarb)、甲硫威;
玉米除草剂:莠去津(Atrazine)、甲草胺(Alachlor)、溴苯腈(Bromoxynil)、乙草胺(Acetochlor)、麦草畏(Dicamba)、二氯吡啶酸(Clopyralid)、S-二甲酚草胺(S-Dimethenamid)、草铵膦(Glufosinate)、草甘膦(Glyphosate)、异噁唑草酮(Isoxaflutole)、S-异丙甲草胺(S-Metolachlor)、硝磺草酮(Mesotrione)、烟嘧磺隆(Nicosulfuron)、氟嘧磺隆(Primisulfuron)、砜嘧磺隆(Rimsulfuron)、磺草酮(Sulcotrione)、甲酰嘧磺隆(Foramsulfuron)、苯吡唑草酮(Topramezone)、环磺酮(Tembotrione)、索氟纳西(Saflufenacil)、噻酮磺隆(Thiencarbazone)、氟噻草胺(Flufenacet)、砜吡草唑(Pyroxasulfon);玉米杀虫剂:克百威、毒死蜱、联苯菊酯、氟虫睛(Fipronil)、吡虫啉、λ-氯氟氰菊(Lambda Cyhalothrin)、七氟菊酯(Tefluthrin)、特丁硫磷(Terbufos)、噻虫嗪、噻虫胺、螺甲螨酯、氟苯虫酰胺、杀铃脲、氯虫酰胺、溴氰菊酯、硫双威、β-氟氯氰菊(β-Cyfluthrin)、氯氰菊酯、联苯菊酯、虱螨脲(Lufenuron)、氟虫脲(Triflumoron)、七氟菊酯、丁基嘧啶磷(Tebupirim-phos)、乙虫腈(Ethiprole)、氰虫酰胺、噻虫啉、啶虫脒、呋虫胺、阿维菌素(Avermectin)、甲硫威、螺螨酯、螺虫乙酯;玉米杀真菌剂:种衣酯(Fenitropan)、福美双、丙硫菌唑、戊唑醇、三氟敏;
水稻除草剂:丁草胺(Butachlor)、敌稗(Propanil)、四唑嘧磺隆(Azimsulfuron)、苄嘧磺隆(Bensulfuron)、氰氟草酯(Cyhalo-fop)、杀草隆(Daimuron)、四唑酰草胺(Fentrazamide)、唑吡嘧磺隆(Imazosulfuron)、苯噻酰草胺(Mefenacet)、噁嗪草酮(Oxaziclomefone)、吡嘧磺隆(Pyrazosulfuron)、稗草丹(Pyributicarb)、二氯喹啉酸(Quinclorac)、禾草丹(Thiobencarb)、茚草酮(Indanofan)、氟噻草胺(Flufenacet)、四唑酰草胺、氯吡嘧磺隆(Halosulfuron)、噁嗪草酮(Oxaziclomefone)、苯并双环酮(Benzobicyclon)、环酯草醚(Pyriftalid)、平速烂(Penoxsulam)、双草醚(Bispyribac)、丙炔噁草酮(Oxadiargyl)、乙氧嘧磺隆(Ethoxysulfuron)、丙草胺(Pretilachlor)、甲基磺草酮(Mesotrione)、特呋喃隆(Tefuryltrione)、噁二唑(Oxadiazone)、噁唑禾草灵、嘧啶硫蕃(Pyrimisulfan);水稻杀虫剂:二嗪磷(Diazinon)、杀螟硫磷(Fenitro-thion)、仲丁威(Fenobucarb)、久效磷(Monocrotophos)、丙硫克百威(Benfuracarb)、噻嗪酮(Buprofezin)、呋虫胺、氟虫腈、吡虫啉、异丙威(Isoprocarb)、噻虫啉、环虫酰肼、噻虫啉、呋虫胺、噻虫胺、乙虫清、氟苯虫酰胺(Flubendiamide)、氯虫酰胺、溴氰菊酯、啶虫脒、噻虫嗪、溴氰虫酰胺、多杀霉素、爱绿士、因灭汀-苯甲酸盐(Emamectin-Benzoate)、氯氰菊酯、毒死蜱、杀螟丹(Cartap)、甲胺磷、醚菊酯(Etofen-prox)、三唑磷(Triazophos)、4-[[(6-氯吡啶-3-基)甲基](2,2-二氟乙基)氨基]呋喃-2(5H)-酮、克百威、丙硫克百威(Benfuracarb);水稻杀真菌剂:甲基硫菌灵、嘧菌酯、环丙酰菌胺(Carpropamid)、敌瘟磷(Edifenphos)、嘧菌腙(Ferimzone)、异稻瘟净(Iprobenfos)、稻瘟灵(Isoprothiolane)、戊菌隆(Pencycuron)、烯丙苯噻唑(Probenazole)、咯喹酮(Pyroquilon)、三环唑(Tricyclazole)、三氟敏、双氯氰菌胺(Diclocymet)、稻瘟酰胺(Fenoxanil)、硅氟唑(Simeconazole)、噻酰菌胺(Tiadinil);
棉花除草剂:敌草隆、氟草隆(Fluometuron)、MSMA、乙氧呋草醚(Oxyfluorfen)、扑草净(Prometryn)、氟乐灵、唑草酮(Carfentrazone)、烯草酮(Clethodim)、稳杀得(Fluazifop-butyl)、草甘膦、达草灭(Norflurazon)、二甲戊灵(Pendimethalin)、嘧草硫醚(Pyrithiobac-sodium)、三氟啶磺隆(Trifloxysulfuron)、吡喃草酮(Tepraloxydim)、草铵膦、丙炔氟草胺(Flumioxazin)、噻苯隆(Thidiazuron);棉花杀虫剂:乙酰甲硫磷(Acephate)、涕灭威、毒死蜱、氯氰菊酯、溴氰菊酯、马拉硫磷、久效磷、害极灭、啶虫脒、甲氨基阿维菌素、吡虫啉、茚虫威、λ-三氟氯氰菊酯、多杀霉素、硫双威、γ-氯氟氰菊、螺螨甲酯、啶虫丙醚、氟啶虫酰胺、氟苯虫酰胺、杀铃脲、氯虫酰胺、β-氟氯氰菊酯(Beta-Cyfluthrin)、螺虫乙酯、噻虫胺、噻虫嗪、噻虫啉、呋虫胺、氟苯虫酰胺、溴氰虫酰胺、多杀霉素、爱绿士、γ三氟氯氰菊酯(gamma Cyhalothrin)、4-[(6-氯吡啶-3-基)甲基](2,2-二氟乙基)氨基]呋喃-2(5H)-酮、硫双威、阿维菌素、氟啶虫酰胺、氟啶虫酰胺(Pyridalyl)、螺螨甲酯、氟啶虫胺腈、丙溴磷(Profenophos)、三唑磷(Thriazophos)、硫丹(Endosulfan);棉花杀真菌剂:土菌灵(Etridiazole)、甲霜灵、五氯硝基苯(Quintozene);
大豆除草剂:甲草胺、灭草松(Bentazone)、氟乐灵、氯嘧磺隆(ChlorimuronEthyl)、氯酯磺草胺(Cloransulam-Methyl)、精噁唑禾草灵、氟磺胺草醚(Fomesafen)、苄草丹(Fluazifop)、草甘膦、甲氧咪草烟(Imazamox)、灭草喹(Imazaquin)、咪草烟(Imazethapyr)、(S-)异丙甲草胺((S-)Metolachlor)、赛克津、二甲戊灵、吡喃草酮、草铵膦;大豆杀虫剂:λ-三氟氯氰菊酯(Lambda-cyhalothrin)、灭多威(Methomyl)、对硫磷(Parathion)、硫威(Thiocarb)、吡虫啉、噻虫胺、噻虫嗪、噻虫啉、啶虫脒、呋虫胺、氟苯虫酰胺、氯虫酰胺、溴氰虫酰胺、多杀霉素、爱绿士、因灭汀-苯甲酸盐、氟虫睛、乙虫腈、溴氰菊酯、β-氟氯氰菊酯、γ/λ氯氟氰菊、4-[(6-氯吡啶-3-基)甲基](2,2-二氟乙基)氨基]呋喃-2(5H)-酮、螺虫乙酯、多杀菌素、杀铃脲、氟啶虫酰胺、硫双威、β-氟氯氰菊酯;大豆杀真菌剂:嘧菌酯、环丙唑醇、氟环唑、粉唑醇(Flutriafol)、吡唑醚菌酯、戊唑醇、三氟敏、丙硫菌唑、四氟醚唑(Tetraconazole);
甜菜除草剂:杀草敏(Chloridazon)、甜菜安(Desmedipham)、乙氧呋草磺(Ethofumesate)、敌菜宁(Phenmedipham)、野麦畏(Triallate)、二氯吡啶酸、吡氟禾草灵、环草定(Lenacil)、苯嗪草酮(Metamitron)、喹草酸(Quinmerac)、噻草酮(Cycloxydim)、氟胺磺隆(Triflusulfuron)、吡喃草酮(Tepraloxydim)、喹禾灵(Quizalofop);甜菜杀虫剂:吡虫啉、噻虫胺、噻虫嗪、噻虫啉、啶虫脒、呋虫胺、溴氰菊酯、β-氟氯氰菊、γ/λ氯氟氰菊、4-[(6-氯吡啶-3-基)甲基](2,2-二氟乙基)氨基]呋喃-2(5H)-酮、七氟菊酯、氯虫酰胺、甲霜灵(Cyaxypyr)、氟虫睛、克百威;
芥花除草剂:二氯吡啶酸、二氯苯氧基苯氧基丙酸、吡氟禾草灵、草铵膦、草甘膦、吡唑草胺(Metazachlor)、氟乐灵胺苯磺隆(Trifluralin Ethametsulfuron)、喹草酸、喹禾灵、烯草酮、吡喃草酮;芥花杀真菌剂:嘧菌酯、多菌灵、咯菌腈(Fludioxonil)、异菌脲、咪鲜胺(Prochloraz)、乙烯菌核利(Vinclozolin);芥花杀虫剂:克百威有机磷农药(Carbofuranorganophos-phates)、拟除虫菊酯(Pyrethroids)、噻虫啉、溴氰菊酯、吡虫啉、噻虫胺、噻虫嗪、啶虫脒、呋喃(Dineto-furan)、β-氟氯氰菊酯、γ/λ氯氟氰菊、氟戊酸酯(tau-Fluvaleriate)、乙虫腈、多杀霉素、爱绿士、氟苯虫酰胺、氯虫酰胺、溴氰虫酰胺、4-[(6-氯吡啶-3-基)甲基](2,2-二氟乙基)氨基]呋喃-2(5H)-酮。
包括杀虫剂和本发明的微生物的杀虫组合物
如前所述,可包括本文所教示的任何微生物的本发明的农业组合物有时与一或多种杀虫剂组合。
在一些实施例中,本文所阐述的组合物中可包含杀虫组合物,且可以与其它化合物同时或依次施用到植物或其部分。杀虫剂包含碳酸铵、含水硅酸钾、硼酸、硫酸铜、元素硫、石灰硫、蔗糖辛酸酯、4-[(6-氯吡啶-3-基)甲基](2,2-二氟乙基)氨基]呋喃-2(5H)-酮、阿维菌素(abamectin)、鱼藤酮(notenone)、喹螨醚(fenazaquin)、唑螨酯(fenpyroximate)、哒螨灵(pyridaben)、嘧螨醚(pyrimedifen)、吡螨胺(tebufenpyrad)、唑虫酰胺(tolfenpyrad)、乙酰甲硫磷(acephate)、甲氨基阿维菌素(emamectin benzoate)、雷皮菌素(lepimectin)、弥拜菌素(milbemectin)、氢化苯乙烯(hdroprene)、烯虫炔酯(kinoprene)、烯虫酯(methoprene)、苯氧威(fenoxycarb)、蚊蝇醚(pyriproxyfen)、甲基溴和其它烷基卤化物、氟糠基氟化物、氯化苦(chloropicrin)、硼砂(borax)、氧化硼钠(disodium octaborate)、硼酸钠(sodium borate)、偏硼酸钠(sodium metaborate)、吐酒石(tartar emetic)、棉隆(dazomet)、威百亩(metam)、吡蚜酮(pymetrozine)、氟虫吡喹(pyrifluquinazon)、氟芬特嗪(flofentezine)、氟螨嗪(diflovidazin)、噻螨酮(hexythiazox)、联苯肼酯、噻虫嗪、吡虫啉、唑螨酯、印楝素(azadirachtin)、氯菊酯(permethrin)、来福灵、啶虫脒、联苯菊酯(bifenthrin)、茚虫威(indoxacarb)、印楝素、除虫菊素(pyrethrin)、吡虫啉、β-氟氯氰菊酯、治螟磷(sulfotep)、丁基嘧啶磷(tebupirimfos)、双硫磷(temephos)、特丁硫磷(terbufos)、杀虫畏(tetrachlorvinphos)、甲基乙拌磷(thiometon)、三唑磷、棉铃威(alanycarb)、涕灭威、噁虫威(bendiocarb)、免扶克(benfluracarb)、丁酮威(butocarboxim)、丁酮砜威(butoxycarboxim)、甲萘威、克百威、丁硫克百威(carbosulfan)、乙硫苯威(ethiofencarb)、仲丁威(fenobucarb)、伐虫脒(formetanate)、呋线威(furathiocarb)、异丙威、甲硫威、甲基戊基(methymyl)、速灭威(metolcarb)、杀线威(oxamyl)、抗蚜威(primicarb)、残杀威(propoxur)、硫双威(thiodicarb)、久效威(thiofanox)、唑蚜威(triazamate)、混杀威(trimethacarb)、XMC、灭杀威(xylylcarb)、乙酰甲硫磷、甲基吡啶磷(azamethiphos)、益棉磷(azinphos-ethyl)、保棉磷(azinphos-methyl)、硫线磷(cadusafos)、氯氧菌酯(chlorethoxyfox)、敌百虫(trichlorfon)、蚜灭磷(vamidothion)、氯丹(chlordane)、硫丹、乙虫腈、氟虫睛、氟丙菊酯(acrinathrin)、烯丙菊酯(allethrin)、联苯菊酯、生物丙烯菊酯(bioallethrin)、生物丙烯醚X-环戊烯基(bioalletherin X-cyclopentenyl)、苄呋菊酯(bioresmethrin)、环氯菊酯(cyclorothrin)、氟氯氰菊酯、三氟氯氰菊酯、氯氰菊酯、苯醚氰菊酯(cyphenothrin)[(1R)-反式异构体]、溴氰菊酯、右旋烯炔菊酯(empenthrin)[(EZ)-(1R)-异构体]、来福灵(esfenvalerate)、醚菊酯(etofenprox)、甲氰菊酯(fenpropathrin)、氰戊菊酯(fenvalerate)、氟氰戊菊酯(flucythrinate)、氟氯苯菊酯(flumethrin)、苄螨醚(halfenprox)、白消安(kadathrin)、苯醚菊酯[(1R)-反式异构体]炔丙菊酯(prallethrin)、除虫菊素(pyrethrins)除虫菊(pyrethrum)、苄呋菊酯(resmethrin)、氟硅菊酯(silafluofen)、七氟菊酯、胺菊酯(tetramethrin)、胺菊酯[(1R)-异构体]、四溴菊酯(tralomethrin)、四氟菊酯(transfluthrin)、α-氯氰菊酯、β-氟氯氰菊酯、β-氯氰菊酯(beta-cypermethrin)、(d-顺式-反式)、(d-反式烯丙菊酯)、γ-氯氟氰菊、λ-三氟氯氰菊酯(lamda-cyhalothrin)、氟胺氰菊酯(tau-fluvalinate)、θ-氯氰菊酯(theta-cypermethrin)、ζ-氯氰菊酯(zeta-cypermethrin)、甲氧滴滴涕(methoxychlor)、尼古丁(nicotine)、氟啶虫胺腈、啶虫脒、噻虫胺、呋虫胺、吡虫啉、烯啶虫胺(nitenpyram)、噻虫啉(thiacloprid)、噻虫嗪(thiamethoxan)、特布氨磷(tebuprimphos)、β-氟氯氰菊酯(beta-cyfluthrin)、噻虫胺、氟啶虫酰胺、氟蚁腙(hydramethylnon)、双甲脒(amitraz)、氟苯虫酰胺、氯虫酰胺、λ-氯氟氰菊、多杀霉素、γ三氟氯氰菊酯、球孢白僵菌(Beauveriabassiana)、辣椒油树脂提取物(capsicum oleoresin extract)、大蒜油(garlic oil)、甲萘威、毒死蜱、氟啶虫胺腈(sulfoxaflor)、λ-氯氟氰菊、毒虫畏(Chlorfenvinphos)、毒死蜱(Chlormephos)、毒死蜱(Chlorpyrifos)、甲基毒死蜱(Chlorpyrifos-methyl)、蝇毒磷(Coumaphos)、杀螟腈(Cyanophos)、内吸磷-S-甲基(Demeton-S-methyl)、二嗪磷(Diazinon)、敌敌畏(Dichlorvos/DDVP)、百治磷(Dicrotophos)、乐果(Dimethoate)、甲基毒虫畏(Dimethylvinphos)、乙拌磷(Disulfoton)、EPN、乙硫磷(Ethion)、灭线磷(Ethoprophos)、伐灭磷(Famphur)、苯线磷、杀螟硫磷(Fenitrothion)、倍硫磷(Fenthion)、噻唑磷(Fosthiazate)、庚烯磷(Heptenophos)、烟碱硫磷(Imicyafos)、异柳磷(Isofenphos)、异丙基O-(甲氧基氨基硫代-磷酰基)水杨酸酯、噁唑磷、马拉硫磷、灭蚜磷(Mecarbam)、甲胺磷(Methamidophos)、杀扑磷(Methidathion)、速灭磷(Mevinphos)、久效磷、二溴磷(Naled)、氧乐果(Omethoate)、亚砜磷(Oxydemeton-methyl)、对硫磷、甲基对硫磷(Parathion-methyl)、稻丰散(Phenthoate)、甲拌磷(Phorate)、伏杀硫磷(Phosalone)、亚胺硫磷(Phosmet)、磷胺(Phosphamidon)、辛硫磷(Phoxim)、甲基嘧啶磷(Pirimiphos-methyl)、丙溴磷(Profenofos)、胺丙畏(Propetamphos)、丙硫磷(Prothiofos)、吡唑硫磷(Pyraclofos)、哒嗪硫磷(Pyridaphenthion)、喹硫磷(Quinalphos)、嘧螨酯(fluacrypyrim)、虫酰肼(tebufenozide)、氯虫苯甲酰胺、苏云金芽孢杆菌库尔斯塔克亚种(Bacillus thuringiensis subs.Kurstaki)、特丁硫磷、矿物油、甲氰菊酯、间醛(metaldehyde)、溴氰菊酯、二嗪磷、乐果、除虫脲(diflubenzuron)、蚊蝇醚、迷迭香油(reosemary oil)、薄荷油(peppermint oil)、香叶醇(geraniol)、印楝素、增效醚(piperonyl butoxide)、氰虫酰胺(cyantraniliprole)、α氯氰菊酯(alphacypermethrin)、七氟菊酯、吡蚜酮、马拉硫磷、苏云金芽孢杆菌以色列亚种(Bacillusthuringiensis subsp.israelensis)、三氯杀螨醇(dicofol)、溴螨酯(bromopropylate)、苯螨特(benzoximate)、印楝素、氟啶虫酰胺、大豆油、微藻色杆菌菌株PRAA4-1(Chromobacterium subtsugae strain PRAA4-1)、ζ氯氰菊酯(zeta cypermethrin)、亚胺硫磷、甲氧虫酰(methoxyfenozide)、石蜡油(paraffinic oil)、螺虫乙酯、灭多威、绿僵菌菌株F52(Metarhizium anisopliae strain F52)、灭线磷(ethoprop)、三氯杀螨砜(tetradifon)、炔螨特(propargite)、苯丁锡(fenbutatin oxide)、三唑锡(azocyclotin)、三唑锡、三环锡(cyhexatin)、丁醚脲(diafenthiuron)、球形芽孢杆菌(Bacillussphaericus)、乙螨唑(etoxazole)、氟吡菌酮(flupyradifurone)、印楝素、球孢白僵菌、丁氟螨酯(cyflumetofen)、印楝素、灭螨猛(chinomethionat)、乙酰甲硫磷、玫烟色靛红阿波普卡菌株97(Isaria fumosorosea Apopka strain 97)、十水四硼酸钠、甲氨基阿维菌素、冰晶石、乙基多杀菌素(spinetoram)、土荆芥提取物(Chenopodium ambrosioidesextract)、氟酰脲(novaluron)、呋虫胺、甲萘威、灭螨醌(acequinocyl)、氟吡菌酮、磷酸铁、高岭土、噻嗪酮(buprofezin)、灭蝇胺(cyromazine)、环虫酰肼(chromafenozide)、氯虫酰肼(halofenozide)、甲氧虫酰、虫酰肼、(bistrifluron)、氟啶脲(chlorfluazuron)、除虫脲、氟螨脲(flucycloxuron)、氟虫脲(flufenoxuron)、六伏隆(hexaflumuron)、虱螨脲(lufenuron)、诺卡龙(nocaluron)、多氟脲(noviflumuron)、氟苯脲(teflubenzuron)、杀铃脲(triflumuron)、杀虫磺(bensultap)、杀螟丹(cartap hydrochloride)、杀虫环(thiocyclam)、杀虫双(thiosultap-sodium)、DNOC、虫螨腈(chlorfenapyr)、磺酰胺(sulfuramid)、甲拌磷(phorate)、唑虫酰胺、氟啶虫胺腈、印楝油(neem oil)、苏云金芽孢杆菌柔嫩亚种菌株SA-10(Bacillus thuringiensis subsp.tenebrionis strain SA-10)、灭蝇胺(cyromazine)、热杀死伯克霍尔德菌属种(heat-killed Burkholderia spp.)、氰虫酰胺、腈吡螨酯(cyenopyrafen)、丁氟螨酯、氰化钠、氰化钾、氰化钙、磷化铝、磷化钙、磷化氢、磷化锌、螺碘苯(spriodiclofen)、螺甲螨酯、(spirotetramat)、氰氟虫腙(metaflumizone)、氟苯虫酰胺、吡氟酰胺(pyflubumide)、杀线威、苏云金芽孢杆菌亚莎华亚种(Bacillus thuringiensis subsp.aizawai)、乙螨唑和来福灵
表9.与可与本发明的微生物组合的各种作用模式相关的示例性杀虫剂
表10.可以与本发明的微生物组合的示例性农药列表
杀虫剂还包含增效剂或活化剂,其本身不被视为有毒或杀虫剂,但其是与杀虫剂一起用以协同作用或增强杀虫剂活性的材料。增效剂或活化剂包含胡椒基丁醚。
生物合理的农药
杀虫剂可以是生物合理的,或也可以称为生物农药或生物性农药。生物合理是指对特定目标害虫具有不利或致死作用的天然来源的任何物质(或类似天然来源的物质的人造物质),例如昆虫、杂草、植物疾病(包含线虫)和脊椎动物害虫具有独特作用模式,对人类、家养植物和动物是无毒的,且对野生动物和环境具有极少或无不利影响。
生物合理的杀虫剂(或生物农药或生物性农药)可以分组为:(1)生物化学物质(激素、酶、信息素和天然试剂,如昆虫和植物生长调节剂)、(2)微生物(病毒、细菌、真菌、原虫和线虫)或(3)植物掺入保护剂(PIP)-主要为转基因植物,例如Bt玉米。
生物农药或生物性农药可以广泛地包含由活微生物或天然产品制造且为控制植物害虫而出售的药剂。生物塑化剂可以是:微生物、生物化学物质和化学信息素。生物农药还可以包含肽、蛋白质和核酸,如双链DNA、单链DNA、双链RNA、单链RNA和夹层DNA或RNA。
细菌、真菌、卵菌、病毒和原虫都用于昆虫害虫的生物控制。最广泛使用的微生物生物农药是昆虫病原性细菌苏云金芽孢杆菌(Bt),其在细菌孢子形成期间产生蛋白质晶体(Btδ-内毒素),所述蛋白质晶体在被易感昆虫食用时能够引起肠细胞裂解。微生物Bt生物农药由细菌孢子和δ-内毒素晶体组成,其在发酵罐中大量产生且调配成可喷雾产品。Bt不伤害脊椎动物且对人、有益的生物体和环境是安全的。因此,Bt喷雾剂是用于水果和蔬菜作物上的害虫管理的日益增加策略,其中其高水平选择性和安全性被认为是合乎需要的,且其中对合成化学杀虫剂的抗性是一个问题。还已在例如玉蜀黍、大豆和棉花的商品作物上使用Bt喷雾剂,但随着基因修饰植物的出现,农民正越来越多地种植Bt转基因作物品种。
其它微生物杀虫剂包含基于昆虫病原性杆状病毒的产品。对节肢动物具有致病性的杆状病毒属于病毒科且具有包装到核衣壳中的大圆形、共价闭合和双链DNA基因组。从鳞翅目、膜翅目和双翅目昆虫中鉴别出超过700种杆状病毒。杆状病毒通常对其宿主昆虫具有高度特异性,且因此对环境、人类、其它植物和有益的生物体是安全的。全世界已有超过50种杆状病毒产品用于控制不同昆虫害虫。在美国和欧洲,苹果蠹蛾颗粒体病毒(Cydiapomonella granulovirus,CpGV)被用作对抗苹果上的苹果蠹蛾的淹没性生物农药。作为美国最大的苹果生产地,华盛顿州在13%苹果作物上使用CpGV。在巴西,在1990年代中期,在高达4百万公顷(大约35%)的大豆作物上使用大豆毛虫黎豆夜蛾(Anticarsiagemmatalis)。病毒(如
已开发至少170种基于昆虫病原真菌的不同生物农药产品以用于防治温室作物、水果和田间蔬菜以及商品作物中的至少五种昆虫和螨。大部分产品是基于子囊菌类球孢白僵菌(Beauveria bassiana)或黑僵菌(Metarhizium anisopliae)。还已经开发黑僵菌(M.anisopliae)以控制非洲和澳大利亚的蝗虫和蚱蜢,且由联合国粮农组织(Food andAgriculture Organization of the United Nations,FAO)推荐用于管控蝗虫。
美国登记的多种微生物农药列举于卡巴卢克(Kabaluk)等人,2010(卡巴卢克J.T.等人(编),2010,《微生物农药在世界代表管辖区的使用和管理(The Use and Regulationof Microbial Pesticides in Representative Jurisdictions Worldwide.)》,全球国际生物防治组织(IOBC Global),第99页)的表16中,且在所选国家登记的微生物农药列举于赫施勒-塞莱多内(Hoeschle-Zeledon)等人,2013(赫施勒-塞莱多内I.、P.纽恩斯万德(P.Neuenschwander)和L.库马尔(L.Kumar)(2013),《生物防治的监管挑战(RegulatoryChallenges for biological control)》,国际热带农业研究所(InternationalInstitute of Tropical Agriculture,IITA)SP-IPM秘书处,伊巴丹(Ibadan),尼日利亚(Nigeria),第43页)的附录4中,其各自以全文引用的方式并入本文中。
植物产生广泛多种次级代谢物,阻止食草动物取食。这些次级代谢物中的一些可以用作生物农药。其包含例如除虫菊素,其是由除虫菊(Chrysanthemumcinerariaefolium)产生的快速作用的杀虫化合物。其具有低哺乳动物毒性但在施用之后快速降解。此短暂的持续促使合成除虫菊酯(拟除虫菊酯)的开发。最广泛使用的植物化合物是印楝油,一种从印楝(Azadirachta indica)的种子提取的杀虫化学物质。两种高度活性农药可基于通过土壤放线菌合成的次级代谢物获得,但其已由监管机构评估为其是否为合成化学农药。多杀霉素是来自刺糖多孢菌(Saccharopolyspora spinosa)的两种巨环内酯化合物的混合物。其具有极低的哺乳动物毒性且残余物在田地中快速降解。农民和种植者在1997年引入后广泛使用它,但抗性已经在一些重要的害虫(如西花蓟马(westernflower thrips))中发展。阿维菌素是由除虫链霉菌产生的巨环内酯化合物。其针对一系列害虫物种具有活性,但也对它产生了抗性,例如,在叶螨(tetranychid mites)中。
已发现来自多种生物体的肽和蛋白质具有农药特性。可能最重要的是来自蜘蛛毒液的肽(金,G.F.(King,G.F.)和哈迪M.C.(Hardy,M.C.)(2013)《蜘蛛毒液肽:结构、药理学和控制昆虫害虫的潜力(Spider-venom peptides:structure,pharmacology,andpotential for control of insect pests)》,《年度评论.昆虫学(Annu.Rev.Entomol.)》58:475-496)。蜘蛛毒液肽中二硫键的独特排列使其对蛋白酶具有极高抗性。因此,这些肽在昆虫肠道和血淋巴中高度稳定,且其中许多具有口服活性。肽靶向昆虫神经系统中广泛范围的受体和离子通道。杀虫肽的其它实例包含:作用于电压门控Na
化学信息素是由一种生物体产生的化学信号,所述生物体在相同或不同物种的个体中引起行为变化。用于作物保护的最广泛使用的化学信息素是昆虫性信息素,其中一些昆虫性信息素现在可以合成且用于通过质量捕获、诱杀系统和交配干扰来监测或防治害虫。在世界范围内,超过660,000公顷的土壤使用交配干扰,且在果园作物中特别有用。
如本文所使用,“转基因杀虫特性”是指由经基因工程改造以表达对一或多种害虫有害的核酸或多肽的植物展现的特性。在一个实施例中,本发明的植物对来自本发明的害虫中的任何一或多者的附接和/或感染具有抗性。在一个实施例中,特性包括来自苏云金芽孢杆菌的营养期杀虫蛋白(VIP)、来自植物的凝集素和蛋白酶抑制剂、萜类化合物、来自链霉菌属物种的胆固醇氧化酶、昆虫壳多糖酶和真菌壳多糖酶、细菌杀虫蛋白和早期识别抗性基因的表达。在另一实施例中,特性包括对害虫有毒的苏云金芽孢杆菌蛋白质的表达。在一个实施例中,Bt蛋白是Cry蛋白(晶体蛋白))。Bt作物包含Bt玉米、Bt棉化和Bt大豆。Bt毒素可以来自Cry科(参见例如克里克莫尔(Crickmore)等人,1998,《微生物学(Microbiol)》,《分子生物学评论(Mol.Biol.Rev.)》62:807-812),其对鳞翅目、鞘翅目和双翅目昆虫尤其有效。
Bt Cry和Cyt毒素属于被称为成孔毒素(PFT)的一类细菌毒素,其以水溶性蛋白质的形式分泌,所述蛋白质经过构象变化以便插入到其宿主的细胞膜中或跨越所述细胞膜进行移位。存在两个主要组的PFT:(i)α-螺旋毒素,其中α-螺旋区形成跨膜孔,和(ii)β-桶毒素,其通过形成由来自各单体的β片层夹构成的β-桶而插入到膜中。参见派克(Parker)MW,Feil SC,“成孔蛋白毒素:从结构到功能”,《生物物理与分子生物学的进展(Prog.Biophys.Mol.Biol.)》,2005年5月;88(1):91-142。第一类PFT包含毒素,如大肠杆菌素(colicin)、外毒素A、白喉毒素和Cry三结构域毒素。另一方面,气溶素(aerolysin)、α-溶血素、炭疽保护性抗原、胆固醇依赖性毒素作为裂解素(perfringolysin)O且Cyt毒素属于β-桶毒素。同上,一般来说,PFT产生细菌分泌其毒素且这些毒素与位于宿主细胞表面上的特定受体相互作用。在大多数情况下,PFT在诱导插入胜任的寡聚结构的形成的受体结合之后由宿主蛋白酶活化。最后,在大多数情况下,通过减小诱导蛋白质的熔融球状态的pH来触发膜插入。同上。
产生Bt Cry蛋白的转基因作物的开发允许通过环境友好的替代方案取代化学杀虫剂。在转基因植物中,Cry毒素连续地产生,保护毒素免于降解且使其可为嘴嚼口器昆虫和蛀干昆虫接触到。植物中的Cry蛋白产生已经通过用植物偏移的密码子使用工程改造Cry基因,通过去除推定的剪接信号序列和删除原毒素的羧基末端区来改进。参见舒勒TH(Schuler TH)等人,“抗虫转基因植物”,《生物技术趋势(Trends Biotechnol)》,1998;16:168-175。抗昆虫作物的使用已显著减弱了在这些转基因作物种植的区域中化学农药的使用。参见,伊姆M(Qaim M)、齐柏尔曼D(Zilberman D),“发展中国家基因修饰作物的产量效应”,《科学(Science)》,2003年2月7日;299(5608):900-2。
已知的cry蛋白包含:δ-内毒素包含(但不限于):Cry 1、Cry 2、Cry 3、Cry 4、Cry5、Cry 6、Cry 7、Cry 8、Cry 9、Cry 10、Cry 11、Cry 12、Cry 13、Cry 14、Cry 15、Cry 16、Cry 17、Cry 18、Cry 19、Cry 20、Cry 21、Cry 22、Cry 23、Cry 24、Cry 25、Cry 26、Cry 27、Cry 28、Cry 29、Cry 30、Cry 31、Cry 32、Cry 33、Cry 34、Cry 35、Cry 36、Cry 37、Cry 38、Cry 39、Cry 40、Cry 41、Cry 42、Cry 43、Cry 44、Cry 45、Cry 46、Cry 47、Cry 49、Cry 51、Cry 52、Cry 53、Cry 54、Cry 55、Cry 56、Cry 57、Cry 58、Cry 59、Cry 60、Cry 61、Cry 62、Cry 63、Cry 64、Cry 65、Cry 66、Cry 67、Cry 68、Cry 69、Cry 70和Cry 71类δ-内毒素基因和苏云金芽孢杆菌细胞裂解cyt 1和cyt 2基因。
这些类的苏云金芽孢杆菌杀虫蛋白的成员包含(但不限于):CrylAa1(保藏号#AAA22353);Cry1Aa2(保藏号#AAA22552);Cry1Aa3(保藏号#BAA00257);Cry1Aa4(保藏号#CAA31886);Cry1Aa5(保藏号#BAA04468);Cry1Aa6(保藏号#AAA86265);Cry1Aa7(保藏号#AAD46139);Cry1Aa8(保藏号#126149);Cry1Aa9(保藏号#BAA77213);CrylAa10(保藏号#AAD55382);CrylAa11(保藏号#CAA70856);Cry1Aa12(保藏号#AAP80146);Cry1Aa13(保藏号#AAM44305);Cry1Aa14(保藏号#AAP40639);Cry1Aa15(保藏号#AAY66993);Cry1Aa16(保藏号#HQ439776);Cry1Aa17(保藏号#HQ439788);Cry1Aa18(保藏号#HQ439790);Cry1Aa19(保藏号#HQ685121);Cry1Aa20(保藏号#JF340156);Cry1Aa21(保藏号#JN651496);Cry1Aa22(保藏号#KC158223);Cry1Abl(保藏号#AAA22330);Cry1Ab2(保藏号#AAA22613);Cry1Ab3(保藏号#AAA22561);Cry1Ab4(保藏号#BAA00071);Cry1Ab5(保藏号#CAA28405);Cry1Ab6(保藏号#AAA22420);Cry1Ab7(保藏号#CAA31620);Cry1Ab8(保藏号#AAA22551);Cry1Ab9(保藏号#CAA38701);Cry1Ab10(保藏号#A29125);CrylAb11(保藏号#Il2419);Cry1Ab12(保藏号#AAC64003);Cry1Ab13(保藏号#AAN76494);Cry1Ab14(保藏号#AAG16877);Cry1Ab15(保藏号#AA013302);Cry1Ab16(保藏号#AAK55546);Cry1Ab17(保藏号#AAT46415);Cry1Ab18(保藏号#AAQ88259);Cry1Ab19(保藏号#AAW31761);Cry1Ab20(保藏号#ABB72460);Cry1Ab21(保藏号#ABS18384);Cry1Ab22(保藏号#ABW87320);Cry1Ab23(保藏号#HQ439777);Cry1Ab24(保藏号#HQ439778);Cry1Ab25(保藏号#HQ685122);Cry1Ab26(保藏号#HQ847729);Cry1Ab27(保藏号#JN135249);Cry1Ab28(保藏号#JN135250);Cry1Ab29(保藏号#JN135251);Cry1Ab30(保藏号#JN135252);Cry1Ab31(保藏号#JN135253);Cry1Ab32(保藏号#JN135254);Cry1Ab33(保藏号#AAS93798);Cry1Ab34(保藏号#KC156668);Cry1Ab-样(保藏号#AAK14336);Cry1Ab-样(保藏号#AAK14337);Cry1Ab-样(保藏号#AAK14338);Cry1Ab-样(保藏号#ABG88858);Cry1Ac1(保藏号#AAA22331);Cry1Ac2(保藏号#AAA22338);Cry1Ac3(保藏号#CAA38098);Cry1Ac4(保藏号#AAA73077);Cry1Ac5(保藏号#AAA22339);Cry1Ac6(保藏号#AAA86266);Cry1Ac7(保藏号#AAB46989);Cry1Ac8(保藏号#AAC44841);Cry1Ac9(保藏号#AAB49768);CrylAc10(保藏号#CAA05505);CrylAc11(保藏号#CAA10270);Cry1Ac12(保藏号#Il2418);Cry1Ac13(保藏号#AAD38701);Cry1Ac14(保藏号#AAQ06607);Cry1Ac15(保藏号#AAN07788);Cry1Ac16(保藏号#AAU87037);CrylAc17(保藏号#AAX18704);Cry1Ac18(保藏号#AAY88347);Cry1Ac19(保藏号#ABD37053);Cry1Ac20(保藏号#ABB89046);Cry1Ac21(保藏号#AAY66992);Cry1Ac22(保藏号#ABZ01836);Cry1Ac23(保藏号#CAQ30431);Cry1Ac24(保藏号#ABL01535);Cry1Ac25(保藏号#FJ513324);Cry1Ac26(保藏号#FJ617446);Cry1Ac27(保藏号#FJ617447);Cry1Ac28(保藏号#ACM90319);Cry1Ac29(保藏号#DQ438941);Cry1Ac30(保藏号#GQ227507);Cry1Ac31(保藏号#GU446674);Cry1Ac32(保藏号#HM061081);Cry1Ac33(保藏号#GQ866913);Cry1Ac34(保藏号#HQ230364);Cry1Ac35(保藏号#JF340157);Cry1Ac36(保藏号#JN387137);Cry1Ac37(保藏号#JQ317685);CrylAd1(保藏号#AAA22340);Cry1Ad2(保藏号#CAA01880);CrylAe1(保藏号#AAA22410);CrylAf1(保藏号#AAB82749);CrylAg1(保藏号#AAD46137);CrylAh1(保藏号#AAQ14326);Cry1Ah2(保藏号#ABB76664);Cry1Ah3(保藏号#HQ439779);CrylAi1(保藏号#AA039719);Cry1Ai2(保藏号#HQ439780);Cry1A-样(保藏号#AAK14339);Cry1Bal(保藏号#CAA29898);Cry1Ba2(保藏号#CAA65003);Cry1Ba3(保藏号#AAK63251);Cry1Ba4(保藏号#AAK51084);Cry1Ba5(保藏号#AB020894);Cry1Ba6(保藏号#ABL60921);Cry1Ba7(保藏号#HQ439781);CrylBb1(保藏号#AAA22344);Cry1Bb2(保藏号#HQ439782);Cry1Bcl(保藏号#CAA86568);Cry1Bdl(保藏号#AAD10292);Cry1Bd2(保藏号#AAM93496);CrylBe1(保藏号#AAC32850);Cry1Be2(保藏号#AAQ52387);Cry1Be3(保藏号#ACV96720);Cry1Be4(保藏号#HM070026);CrylBf1(保藏号#CAC50778);Cry1Bf2(保藏号#AAQ52380);Cry1Bgl(保藏号#AA039720);Cry1Bhl(保藏号#HQ589331);Cry1Bil(保藏号#KC156700);Cry1Cal(保藏号#CAA30396);Cry1Ca2(保藏号#CAA31951);Cry1Ca3(保藏号#AAA22343);Cry1Ca4(保藏号#CAA01886);Cry1Ca5(保藏号#CAA65457);Cry1Ca6[1](保藏号#AAF37224);Cry1Ca7(保藏号#AAG50438);Cry1Ca8(保藏号#AAM00264);Cry1Ca9(保藏号#AAL79362);CrylCa10(保藏号#AAN16462);Cry1Ca11(保藏号#AAX53094);Cry1Ca12(保藏号#HM070027);Cry1Ca13(保藏号#HQ412621);Cry1Ca14(保藏号#JN651493);CrylCb1(保藏号#M97880);Cry1Cb2(保藏号#AAG35409);Cry1Cb3(保藏号#ACD50894);Cry1Cb-样(保藏号#AAX63901);Cry1Dal(保藏号#CAA38099);Cry1Da2(保藏号#I76415);Cry1Da3(保藏号#HQ439784);Cry1 Dbl(保藏号#CAA80234);Cry1 Db2(保藏号#AAK48937);Cry1 Dcl(保藏号#ABK35074);Cry1Eal(保藏号#CAA37933);Cry1Ea2(保藏号#CAA39609);Cry1Ea3(保藏号#AAA22345);Cry1Ea4(保藏号#AAD04732);Cry1Ea5(保藏号#A15535);Cry1Ea6(保藏号#AAL50330);Cry1Ea7(保藏号#AAW72936);Cry1Ea8(保藏号#ABX11258);Cry1Ea9(保藏号#HQ439785);CrylEa10(保藏号#ADR00398);CrylEa11(保藏号#JQ652456);Cry1Ebl(保藏号#AAA22346);Cry1Fal(保藏号#AAA22348);Cry1Fa2(保藏号#AAA22347);Cry1Fa3(保藏号#HM070028);Cry1Fa4(保藏号#HM439638);Cryl Fbl(保藏号#CAA80235);Cry1Fb2(保藏号#BAA25298);Cry1Fb3(保藏号#AAF21767);Cry1Fb4(保藏号#AAC10641);Cry1Fb5(保藏号#AA013295);Cry1Fb6(保藏号#ACD50892);Cry1Fb7(保藏号#ACD50893);CrylGal(保藏号#CAA80233);Cry1Ga2(保藏号#CAA70506);CrylGbl(保藏号#AAD10291);Cry1Gb2(保藏号#AA013756);CrylGcl(保藏号#AAQ52381);CrylHa1(保藏号#CAA80236);CrylHbl(保藏号#AAA79694);Cry1Hb2(保藏号#HQ439786);CrylH-样(保藏号#AAF01213);CrylIal(保藏号#CAA44633);Cry1Ia2(保藏号#AAA22354);Cry1Ia3(保藏号#AAC36999);Cry1Ia4(保藏号#AAB00958);Cry1Ia5(保藏号#CAA70124);Cry1Ia6(保藏号#AAC26910);Cry1Ia7(保藏号#AAM73516);Cry1Ia8(保藏号#AAK66742);Cry1Ia9(保藏号#AAQ08616);Cry1Ia10(保藏号#AAP86782);CrylIa11(保藏号#CAC85964);Cry1Ia12(保藏号#AAV53390);Cry1Ia13(保藏号#ABF83202);Cry1Ia14(保藏号#ACG63871);Cry1Ia15(保藏号#FJ617445);Cry1Ia16(保藏号#FJ617448);CrylIal7(保藏号#GU989199);CrylIal8(保藏号#ADK23801);CrylIal9(保藏号#HQ439787);Cry1Ia20(保藏号#JQ228426);Cry1Ia21(保藏号#JQ228424);Cry1Ia22(保藏号#JQ228427);Cry1Ia23(保藏号#JQ228428);Cry1Ia24(保藏号#JQ228429);Cry1Ia25(保藏号#JQ228430);Cry1Ia26(保藏号#JQ228431);Cry1Ia27(保藏号#JQ228432);Cry1Ia28(保藏号#JQ228433);Cry1Ia29(保藏号#JQ228434);Cry1Ia30(保藏号#JQ317686);Cry1Ia31(保藏号#JX944038);Cry1Ia32(保藏号#JX944039);Cry1Ia33(保藏号#JX944040);CrylIb1(保藏号#AAA82114);Cry1Ib2(保藏号#ABW88019);Cry1Ib3(保藏号#ACD75515);Cry1Ib4(保藏号#HM051227);Cry1Ib5(保藏号#HM070028);Cry1Ib6(保藏号#ADK38579);Cry1Ib7(保藏号#JN571740);Cry1Ib8(保藏号#JN675714);Cry1Ib9(保藏号#JN675715);Cry1Ib10(保藏号#JN675716);CrylIbll(保藏号#JQ228423);CrylIcl(保藏号#AAC62933);Cry1Ic2(保藏号#AAE71691);CrylIdl(保藏号#AAD44366);Cry1Id2(保藏号#JQ228422);CrylIel(保藏号#AAG43526);Cry1Ie2(保藏号#HM439636);Cry1Ie3(保藏号#KC156647);Cry1Ie4(保藏号#KC156681);Cryllfl(保藏号#AAQ52382);CrylIgl(保藏号#KC156701);CrylI-样(保藏号#AAC31094);CrylI-样(保藏号#ABG88859);CrylJal(保藏号#AAA22341);Cry1Ja2(保藏号#HM070030);Cry1Ja3(保藏号#JQ228425);CrylJbl(保藏号#AAA98959);CrylJcl(保藏号#AAC31092);Cry1Jc2(保藏号#AAQ52372);CrylJdl(保藏号#CAC50779);CrylKal(保藏号#AAB00376);Cry1Ka2(保藏号#HQ439783);CrylLal(保藏号#AAS60191);Cry1La2(保藏号#HM070031);CrylMal(保藏号#FJ884067);Cry1Ma2(保藏号#KC156659);CrylNal(保藏号#KC156648);CrylNbl(保藏号#KC156678);Cryl-样(保藏号#AAC31091);Cry2Aal(保藏号#AAA22335);Cry2Aa2(保藏号#AAA83516);Cry2Aa3(保藏号#D86064);Cry2Aa4(保藏号#AAC04867);Cry2Aa5(保藏号#CAA10671);Cry2Aa6(保藏号#CAA10672);Cry2Aa7(保藏号#CAA10670);Cry2Aa8(保藏号#AA013734);Cry2Aa9(保藏号#AA013750);Cry2Aal O(保藏号#AAQ04263);Cry2Aal 1(保藏号#AAQ52384);Cry2Aa12(保藏号#AB183671);Cry2Aa13(保藏号#ABL01536);Cry2Aa14(保藏号#ACF04939);Cry2Aa15(保藏号#JN426947);Cry2Abl(保藏号#AAA22342);Cry2Ab2(保藏号#CAA39075);Cry2Ab3(保藏号#AAG36762);Cry2Ab4(保藏号#AA013296);Cry2Ab5(保藏号#AAQ04609);Cry2Ab6(保藏号#AAP59457);Cry2Ab7(保藏号#AAZ66347);Cry2Ab8(保藏号#ABC95996);Cry2Ab9(保藏号#ABC74968);Cry2Ab10(保藏号#EF157306);Cry2Abll(保藏号#CAM84575);Cry2Ab12(保藏号#ABM21764);Cry2Ab13(保藏号#ACG76120);Cry2Ab14(保藏号#ACG76121);Cry2Ab15(保藏号#HM037126);Cry2Ab16(保藏号#GQ866914);Cry2Abl7(保藏号#HQ439789);Cry2Ab18(保藏号#JN135255);Cry2Ab19(保藏号#JN135256);Cry2Ab20(保藏号#JN135257);Cry2Ab21(保藏号#JN135258);Cry2Ab22(保藏号#JN135259);Cry2Ab23(保藏号#JN135260);Cry2Ab24(保藏号#JN135261);Cry2Ab25(保藏号#JN415485);Cry2Ab26(保藏号#JN426946);Cry2Ab27(保藏号#JN415764);Cry2Ab28(保藏号#JN651494);Cry2Acl(保藏号#CAA40536);Cry2Ac2(保藏号#AAG35410);Cry2Ac3(保藏号#AAQ52385);Cry2Ac4(保藏号#ABC95997);Cry2Ac5(保藏号#ABC74969);Cry2Ac6(保藏号#ABC74793);Cry2Ac7(保藏号#CAL18690);Cry2Ac8(A保藏号#CAM09325);Cry2Ac9(保藏号#CAM09326);Cry2Ac10(保藏号#ABN15104);Cry2Acll(保藏号#CAM83895);Cry2Ac12(保藏号#CAM83896);Cry2Adl(保藏号#AAF09583);Cry2Ad2(保藏号#ABC86927);Cry2Ad3(保藏号#CAK29504);Cry2Ad4(保藏号#CAM32331);Cry2Ad5(保藏号#CA078739);Cry2Ael(保藏号#AAQ52362);Cry2Afl(保藏号#AB030519);Cry2Af2(保藏号#GQ866915);Cry2Agl(保藏号#ACH91610);Cry2Ahl(保藏号#EU939453);Cry2Ah2(保藏号#ACL80665);Cry2Ah3(保藏号#GU073380);Cry2Ah4(保藏号#KC156702);Cry2Ail(保藏号#FJ788388);Cry2Aj(保藏号#);Cry2Akl(保藏号#KC156660);Cry2Bal(保藏号#KC156658);Cry3Aal(保藏号#AAA22336);Cry3Aa2(保藏号#AAA22541);Cry3Aa3(保藏号#CAA68482);Cry3Aa4(保藏号#AAA22542);Cry3Aa5(保藏号#AAA50255);Cry3Aa6(保藏号#AAC43266);Cry3Aa7(保藏号#CAB41411);Cry3Aa8(保藏号#AAS79487);Cry3Aa9(保藏号#AAW05659);Cry3Aa10(保藏号#AAU29411);Cry3Aall(保藏号#AAW82872);Cry3Aa12(保藏号#ABY49136);Cry3Bal(保藏号#CAA34983);Cry3Ba2(保藏号#CAA00645);Cry3Ba3(保藏号#JQ397327);Cry3Bbl(保藏号#AAA22334);Cry3Bb2(保藏号#AAA74198);Cry3Bb3(保藏号#Il5475);Cry3Cal(保藏号#CAA42469);Cry4Aal(保藏号#CAA68485);Cry4Aa2(保藏号#BAAOOl 79);Cry4Aa3(保藏号#CAD30148);Cry4Aa4(保藏号#AFB18317);Cry4A-样(保藏号#AAY96321);Cry4Bal(保藏号#CAA30312);Cry4Ba2(保藏号#CAA30114);Cry4Ba3(保藏号#AAA22337);Cry4Ba4(保藏号#BAAOOl 78);Cry4Ba5(保藏号#CAD30095);Cry4Ba-样(保藏号#ABC47686);Cry4Cal(保藏号#EU646202);Cry4Cbl(保藏号#FJ403208);Cry4Cb2(保藏号#FJ597622);Cry4Ccl(保藏号#FJ403207);Cry5Aal(保藏号#AAA67694);Cry5Abl(保藏号#AAA67693);Cry5Acl(保藏号#I34543);Cry5Adl(保藏号#ABQ82087);Cry5Bal(保藏号#AAA68598);Cry5Ba2(保藏号#ABW88931);Cry5Ba3(保藏号#AFJ04417);Cry5Cal(保藏号#HM461869);Cry5Ca2(保藏号#ZP_04123426);Cry5Dal(保藏号#HM461870);Cry5Da2(保藏号#ZP_04123980);Cry5Eal(保藏号#HM485580);Cry5Ea2(保藏号#ZP_04124038);Cry6Aal(保藏号#AAA22357);Cry6Aa2(保藏号#AAM46849);Cry6Aa3(保藏号#ABH03377);Cry6Bal(保藏号#AAA22358);Cry7 Aal(保藏号#AAA22351);Cry7Abl(保藏号#AAA21120);Cry7Ab2(保藏号#AAA21121);Cry7Ab3(保藏号#ABX24522);Cry7 Ab4(保藏号#EU380678);Cry7 Ab5(保藏号#ABX79555);Cry7Ab6(保藏号#ACI44005);Cry7 Ab7(保藏号#ADB89216);Cry7 Ab8(保藏号#GU145299);Cry7Ab9(保藏号#ADD92572);Cry7Bal(保藏号#ABB70817);Cry7Bbl(保藏号#KC156653);Cry7Cal(保藏号#ABR67863);Cry7Cbl(保藏号#KC156698);Cry7Dal(保藏号#ACQ99547);Cry7Da2(保藏号#HM572236);Cry7Da3(保藏号#KC156679);Cry7Eal(保藏号#HM035086);Cry7Ea2(保藏号#HM132124);Cry7Ea3(保藏号#EEM19403);Cry7Fal(保藏号#HM035088);Cry7Fa2(保藏号#EEM19090);Cry7Fbl(保藏号#HM572235);Cry7Fb2(保藏号#KC156682);Cry7Gal(保藏号#HM572237);Cry7Ga2(保藏号#KC156669);Cry7Gbl(保藏号#KC156650);Cry7Gcl(保藏号#KC156654);Cry7Gdl(保藏号#KC156697);Cry7Hal(保藏号#KC156651);Cry7Ial(保藏号#KC156665);Cry7Jal(保藏号#KC156671);Cry7Kal(保藏号#KC156680);Cry7Kbl(保藏号#BAM99306);Cry7Lal(保藏号#BAM99307);Cry8Aal(保藏号#AAA21117);Cry8Abl(保藏号#EU044830);Cry8Acl(保藏号#KC156662);Cry8Adl(保藏号#KC156684);Cry8Bal(保藏号#AAA21118);Cry8Bbl(保藏号#CAD57542);Cry8Bcl(保藏号#CAD57543);Cry8Cal(保藏号#AAA21119);Cry8Ca2(保藏号#AAR98783);Cry8Ca3(保藏号#EU625349);Cry8Ca4(保藏号#ADB54826);Cry8Dal(保藏号#BAC07226);Cry8Da2(保藏号#BD133574);Cry8Da3(保藏号#BD133575);Cry8Dbl(保藏号#BAF93483);Cry8Eal(保藏号#AAQ73470);Cry8Ea2(保藏号#EU047597);Cry8Ea3(保藏号#KC855216);Cry8Fal(保藏号#AAT48690);Cry8Fa2(保藏号#HQl 74208);Cry8Fa3(保藏号#AFH78109);Cry8Gal(保藏号#AAT46073);Cry8Ga2(保藏号#ABC42043);Cry8Ga3(保藏号#FJ198072);Cry8Hal(保藏号#AAW81032);Cry8Ial(保藏号#EU381044);Cry8Ia2(保藏号#GU073381);Cry8Ia3(保藏号#HM044664);Cry8Ia4(保藏号#KC156674);Cry8Ibl(保藏号#GU325772);Cry8Ib2(保藏号#KC156677);Cry8Jal(保藏号#EU625348);Cry8Kal(保藏号#FJ422558);Cry8Ka2(保藏号#ACN87262);Cry8Kbl(保藏号#HM123758);Cry8Kb2(保藏号#KC156675);Cry8Lal(保藏号#GU325771);Cry8Mal(保藏号#HM044665);Cry8Ma2(保藏号#EEM86551);Cry8Ma3(保藏号#HM210574);Cry8Nal(保藏号#HM640939);Cry8Pal(保藏号#HQ388415);Cry8Qal(保藏号#HQ441166);Cry8Qa2(保藏号#KC152468);Cry8Ral(保藏号#AFP87548);Cry8Sal(保藏号#JQ740599);Cry8Tal(保藏号#KC156673);Cry8-样(保藏号#FJ770571);Cry8-样(保藏号#ABS53003);Cry9Aal(保藏号#CAA41122);Cry9Aa2(保藏号#CAA41425);Cry9Aa3(保藏号#GQ249293);Cry9Aa4(保藏号#GQ249294);Cry9Aa5(保藏号#JXl 74110);Cry9Aa样(保藏号#AAQ52376);Cry9Bal(保藏号#CAA52927);Cry9Ba2(保藏号#GU299522);Cry9Bbl(保藏号#AAV28716);Cry9Cal(保藏号#CAA85764);Cry9Ca2(保藏号#AAQ52375);Cry9Dal(保藏号#BAAl9948);Cry9Da2(保藏号#AAB97923);Cry9Da3(保藏号#GQ249293);Cry9Da4(保藏号#GQ249297);Cry9Dbl(保藏号#AAX78439);Cry9Dcl(保藏号#KCl 56683);Cry9Eal(保藏号#BAA34908);Cry9Ea2(保藏号#AA012908);Cry9Ea3(保藏号#ABM21765);Cry9Ea4(保藏号#ACE88267);Cry9Ea5(保藏号#ACF04743);Cry9Ea6(保藏号#ACG63872);Cry9Ea7(保藏号#FJ380927);Cry9Ea8(保藏号#GQ249292);Cry9Ea9(保藏号#JN651495);Cry9Ebl(保藏号#CAC50780);Cry9Eb2(保藏号#GQ249298);Cry9Eb3(保藏号#KC156646);Cry9Ecl(保藏号#AAC63366);Cry9Edl(保藏号#AAX78440);Cry9Eel(保藏号#GQ249296);Cry9Ee2(保藏号#KC156664);Cry9Fal(保藏号#KC156692);Cry9Gal(保藏号#KC156699);Cry9-样(保藏号#AAC63366);CrylOAal(保藏号#AAA22614);Cry10Aa2(保藏号#E00614);Cry10Aa3(保藏号#CAD30098);Cry10Aa4(保藏号#AFB18318);CrylOA-样(保藏号#DQ167578);Cryl lAal(保藏号#AAA22352);Cryl 1Aa2(保藏号#AAA22611);Cry11Aa3(保藏号#CAD30081);Cry11Aa4(保藏号#AFB18319);CryllAa-样(保藏号#DQ166531);CryllBal(保藏号#CAA60504);CryllBbl(保藏号#AAC97162);Cry11Bb2(保藏号#HM068615);Cry12Aal(保藏号#AAA22355);Cry13Aal(保藏号#AAA22356);Cry14Aal(保藏号#AAA21516);Cry14Abl(保藏号#KC156652);Cry15Aal(保藏号#AAA22333);Cryl6Aal(保藏号#CAA63860);Cry17Aal(保藏号#CAA67841);Cry18Aal(保藏号#CAA67506);Cryl8Bal(保藏号#AAF89667);Cry18Cal(保藏号#AAF89668);Cry19Aal(保藏号#CAA68875);Cry19Bal(保藏号#BAA32397);Cry19Cal(保藏号#AFM37572);Cry20Aal(保藏号#AAB93476);Cry20Bal(保藏号#ACS93601);Cry20Ba2(保藏号#KC156694);Cry20-样(保藏号#GQ144333);Cry21Aal(保藏号#I32932);Cry21Aa2(保藏号#I66477);Cry21Bal(保藏号#BAC06484);Cry21Cal(保藏号#JF521577);Cry21Ca2(保藏号#KC156687);Cry21Dal(保藏号#JF521578);Cry22Aal(保藏号#I34547);Cry22Aa2(保藏号#CAD43579);Cry22Aa3(保藏号#ACD93211);Cry22Abl(保藏号#AAK50456);Cry22Ab2(保藏号#CAD43577);Cry22Bal(保藏号#CAD43578);Cry22Bbl(保藏号#KC156672);Cry23Aal(保藏号#AAF76375);Cry24Aal(保藏号#AAC61891);Cry24Bal(保藏号#BAD32657);Cry24Cal(保藏号#CAJ43600);Cry25Aal(保藏号#AAC61892);Cry26Aal(保藏号#AAD25075);Cry27Aal(保藏号#BAA82796);Cry28Aal(保藏号#AAD24189);Cry28Aa2(保藏号#AAG00235);Cry29Aal(保藏号#CAC80985);Cry30Aal(保藏号#CAC80986);Cry30Bal(保藏号#BAD00052);Cry30Cal(保藏号#BAD67157);Cry30Ca2(保藏号#ACU24781);Cry30Dal(保藏号#EF095955);Cry30Dbl(保藏号#BAE80088);Cry30Eal(保藏号#ACC95445);Cry30Ea2(保藏号#FJ499389);Cry30Fal(保藏号#ACI22625);Cry30Gal(保藏号#ACG60020);Cry30Ga2(保藏号#HQ638217);Cry31Aal(保藏号#BABll 757);Cry31Aa2(保藏号#AAL87458);Cry31Aa3(保藏号#BAE79808);Cry31Aa4(保藏号#BAF32571);Cry31Aa5(保藏号#BAF32572);Cry31Aa6(保藏号#BA144026);Cry31Abl(保藏号#BAE79809);Cry31Ab2(保藏号#BAF32570);Cry31Acl(保藏号#BAF34368);Cry31Ac2(保藏号#AB731600);Cry31Adl(保藏号#BA144022);Cry32Aal(保藏号#AAG36711);Cry32Aa2(保藏号#GU063849);Cry32Abl(保藏号#GU063850);Cry32Bal(保藏号#BAB78601);Cry32Cal(保藏号#BAB78602);Cry32Cbl(保藏号#KC156708);Cry32Dal(保藏号#BAB78603);Cry32Eal(保藏号#GU324274);Cry32Ea2(保藏号#KC156686);Cry32Ebl(保藏号#KC156663);Cry32Fal(保藏号#KC156656);Cry32Gal(保藏号#KC156657);Cry32Hal(保藏号#KC156661);Cry32Hbl(保藏号#KC156666);Cry32Ial(保藏号#KCl 56667);Cry32Jal(保藏号#KCl56685);Cry32Kal(保藏号#KCl 56688);Cry32Lal(保藏号#KC156689);Cry32Mal(保藏号#KC156690);Cry32Mbl(保藏号#KC156704);Cry32Nal(保藏号#KC156691);Cry32Oal(保藏号#KC156703);Cry32Pal(保藏号#KC156705);Cry32Qal(保藏号#KC156706);Cry32Ral(保藏号#KC156707);Cry32Sal(保藏号#KC156709);Cry32Tal(保藏号#KC156710);Cry32Ual(保藏号#KC156655);Cry33Aal(保藏号#AAL26871);Cry34Aal(保藏号#AAG50341);Cry34Aa2(保藏号#AAK64560);Cry34Aa3(保藏号#AAT29032);Cry34Aa4(保藏号#AAT29030);Cry34Abl(保藏号#AAG41671);Cry34Acl(保藏号#AAG50118);Cry34Ac2(保藏号#AAK64562);Cry34Ac3(保藏号#AAT29029);Cry34Bal(保藏号#AAK64565);Cry34Ba2(保藏号#AAT29033);Cry34Ba3(保藏号#AAT29031);Cry35Aal(保藏号#AAG50342);Cry35Aa2(保藏号#AAK64561);Cry35Aa3(保藏号#AAT29028);Cry35Aa4(保藏号#AAT29025);Cry35Abl(保藏号#AAG41672);Cry35Ab2(保藏号#AAK64563);Cry35Ab3(保藏号#AY536891);Cry35Acl(保藏号#AAG50117);Cry35Bal(保藏号#AAK64566);Cry35Ba2(保藏号#AAT29027);Cry35Ba3(保藏号#AAT29026);Cry36Aal(保藏号#AAK64558);Cry37 Aal(保藏号#AAF76376);Cry38Aal(保藏号#AAK64559);Cry39Aal(保藏号#BAB72016);Cry40Aal(保藏号#BAB72018);Cry40Bal(保藏号#BAC77648);Cry40Cal(保藏号#EU381045);Cry40Dal(保藏号#ACF15199);Cry41Aal(保藏号#BAD35157);Cry41Abl(保藏号#BAD35163);Cry41Bal(保藏号#HM461871);Cry41Ba2(保藏号#ZP_04099652);Cry42Aal(保藏号#BAD35166);Cry43Aal(保藏号#BAD15301);Cry43Aa2(保藏号#BAD95474);Cry43Bal(保藏号#BAD15303);Cry43Cal(保藏号#KC156676);Cry43Cbl(保藏号#KC156695);Cry43Ccl(保藏号#KC156696);Cry43-样(保藏号#BAD15305);Cry44Aa(保藏号#BAD08532);Cry45Aa(保藏号#BAD22577);Cry46Aa(保藏号#BAC79010);Cry46Aa2(保藏号#BAG68906);Cry46Ab(保藏号#BAD35170);Cry47 Aa(保藏号#AAY24695);Cry48Aa(保藏号#CAJ18351);Cry48Aa2(保藏号#CAJ86545);Cry48Aa3(保藏号#CAJ86546);Cry48Ab(保藏号#CAJ86548);Cry48Ab2(保藏号#CAJ86549);Cry49Aa(保藏号#CAH56541);Cry49Aa2(保藏号#CAJ86541);Cry49Aa3(保藏号#CAJ86543);Cry49Aa4(保藏号#CAJ86544);Cry49Abl(保藏号#CAJ86542);Cry50Aal(保藏号#BAE86999);Cry50Bal(保藏号#GU446675);Cry50Ba2(保藏号#GU446676);Cry51Aal(保藏号#AB114444);Cry51Aa2(保藏号#GU570697);Cry52Aal(保藏号#EF613489);Cry52Bal(保藏号#FJ361760);Cry53Aal(保藏号#EF633476);Cry53Abl(保藏号#FJ361759);Cry54Aal(保藏号#ACA52194);Cry54Aa2(保藏号#GQ140349);Cry54Bal(保藏号#GU446677);Cry55Aal(保藏号#ABW88932);Cry54Abl(保藏号#JQ916908);Cry55Aa2(保藏号#AAE33526);Cry56Aal(保藏号#ACU57499);Cry56Aa2(保藏号#GQ483512);Cry56Aa3(保藏号#JX025567);Cry57Aal(保藏号#ANC87261);Cry58Aal(保藏号#ANC87260);Cry59Bal(保藏号#JN790647);Cry59Aal(保藏号#ACR43758);Cry60Aal(保藏号#ACU24782);Cry60Aa2(保藏号#EA057254);Cry60Aa3(保藏号#EEM99278);Cry60Bal(保藏号#GU810818);Cry60Ba2(保藏号#EA057253);Cry60Ba3(保藏号#EEM99279);Cry61Aal(保藏号#HM035087);Cry61Aa2(保藏号#HM132125);Cry61Aa3(保藏号#EEM19308);Cry62Aal(保藏号#HM054509);Cry63Aal(保藏号#BA144028);Cry64Aal(保藏号#BAJ05397);Cry65Aal(保藏号#HM461868);Cry65Aa2(保藏号#ZP_04123838);Cry66Aal(保藏号#HM485581);Cry66Aa2(保藏号#ZP_04099945);Cry67Aal(保藏号#HM485582);Cry67Aa2(保藏号#ZP_04148882);Cry68Aal(保藏号#HQ113114);Cry69Aal(保藏号#HQ401006);Cry69Aa2(保藏号#JQ821388);Cry69Abl(保藏号#JN209957);Cry70Aal(保藏号#JN646781);Cry70Bal(保藏号#AD051070);Cry70Bbl(保藏号#EEL67276);Cry71Aal(保藏号#JX025568);Cry72Aal(保藏号#JX025569);Cyt1Aa(基因库保藏号X03182);Cyt1Ab(基因库保藏号X98793);Cyt1B(基因库保藏号U37196);Cyt2A(基因库保藏号Z14147);和Cyt2B(基因库保藏号U52043)。
δ-内毒素的实例还包含(但不限于)美国专利第5,880,275号、第7,858,849号、第8,530,411号、第8,575,433号和第8,686,233号的Cry1A蛋白质;美国专利第8,304,604号、第8,304,605号和第8,476,226号的DIG-3或DIG-11毒素(α-螺旋1的N端缺失和/或cry蛋白的α-螺旋2变异体(如Cry1A、Cry3A));美国专利申请案序列号10/525,318的Cry1B;美国专利第6,033,874号的Cry1C;美国专利第5,188,960号和第6,218,188的Cry1F;美国专利第7,070,982号;第6,962,705号和第6,713,063号的Cry1A/F嵌合体);美国专利第7,064,249号的Cry2蛋白(如Cry2Ab蛋白));Cry3A蛋白包含(但不限于)通过融合至少两种不同Cry蛋白的可变区和保守区的独特组合产生的工程改造杂交杀虫蛋白(eHIP)(美国专利申请公开号2010/0017914);美国专利第7,329,736号、第7,449,552号、第7,803,943号、第7,476,781号、第7,105,332号、第7,378,499号和第7,462,760号的Cry4蛋白;Cry5蛋白;Cry6蛋白;Cry8蛋白;Cry9蛋白,如Cry9A、Cry9B、Cry9C、Cry9D、Cry9E和Cry9F家族的成员,包含(但不限于)美国专利第8,802,933号的Cry9D蛋白和美国专利第8,802,934号的Cry9B蛋白;奈莫夫(Naimov)等人,(2008),“应用和环境微生物学(Applied and EnvironmentalMicrobiology)”,74:7145-7151的Cry15蛋白;美国专利第6,127,180号、第6,624,145号和第6,340,593号的Cry22、Cry34Abl蛋白;美国专利第6,248,535号、第6,326,351号、第6,399,330号、第6,949,626号、7,385,107号和第7,504,229号的CryET33和cryET34蛋白;美国专利公开号2006/0191034、2012/0278954和PCT公开号WO 2012/139004的CryET33和CryET34同系物;美国专利第6,083,499号、第6,548,291号和第6,340,593号的Cry35Abl蛋白;Cry46蛋白、Cry51蛋白、Cry二元毒素;TIC901或相关毒素;美国专利申请公开号2008/0295207的TIC807;美国PCT 2006/033867的ET29、ET37、TIC809、TIC810、TIC812、TIC127、TIC128;美国专利第8,513,494号的TIC853毒素、美国专利第8,236,757号的AXMI-027、AXMI-036和AXMI-038;美国专利第7,923,602号的AXMI-031、AXMI-039、AXMI-040、AXMI-049;WO 2006/083891的AXMI-018、AXMI-020和AXMI-021;WO 2005/038032的AXMI-010;WO2005/021585的AXMI-003;美国专利申请公开案第2004/0250311号的AXMI-008;美国专利申请公开号2004/0216186的AXMI-006;美国专利申请公开号2004/0210965的AXMI-007;美国专利申请号2004/0210964的AXMI-009;美国专利申请公开号2004/0197917的AXMI-014;美国专利申请公开号2004/0197916的AXMI-004;WO 2006/119457的AXMI-028和AXMI-029;WO2004/074462的AXMI-007、AXMI-008、AXMI-0080rf2、AXMI-009、AXMI-014和AXMI-004;美国专利第8,084,416号的AXMI-150;美国专利申请公开号2011/0023184的AXMI-205;美国专利申请公开号2011/0263488的AXMI-011、AXMI-012、AXMI-013、AXMI-015、AXMI-019、AXMI-044、AXMI-037、AXMI-043、AXMI-033、AXMI-034、AXMI-022、AXMI-023、AXMI-041、AXMI-063和AXMI-064;美国专利申请公开号2010/0197592的AXMI-R1和相关蛋白;WO 2011/103248的AXMI221lZ、AXMI222z、AXMI223z、AXMI224z和AXMI225z;WO 2011/103247和美国专利第8,759,619号的AXMI218、AXMI219、AXMI220、AXMI226、AXMI227、AXMI228、AXMI229、AXMI230和AXMI231;美国专利第8,334,431号的AXMI-115、AXMI-113、AXMI-005、AXMI-163和AXMI-184;美国专利申请公开号2010/0298211的AXMI-001、AXMI-002、AXMI-030、AXMI-035和AXMI-045;美国专利申请公开号2009/0144852的AXMI-066和AXMI-076;美国专利第8,318,900号的AXMI128、AXMI130、AXMI131、AXMI133、AXMI140、AXMI141、AXMI142、AXMI143、AXMI144、AXMI146、AXMI148、AXMI149、AXMI152、AXMI153、AXMI154、AXMI155、AXMI156、AXMI157、AXMI158、AXMI162、AXMI165、AXMI166、AXMI167、AXMI168、AXMI169、AXMI170、AXMI171、AXMI172、AXMI173、AXMI174、AXMI175、AXMI176、AXMI177、AXMI178、AXMI179、AXMI180、AXMI181、AXMI182、AXMI185、AXMI186、AXMI187、AXMI188、AXMI189;美国专利申请公开号2010/0005543号的AXMI079、AXMI080、AXMI081、AXMI082、AXMI091、AXMI092、AXMI096、AXMI097、AXMI098、AXMI099、AXMI100、AXMI101、AXMI102、AXMI103、AXMI104、AXMI107、AXMI108、AXMI109、AXMI110、AXMI111、AXMI112、AXMI114、AXMI116、AXMI117、AXMI118、AXMI119、AXMI120、AXMI121、AXMI122、AXMI123、AXMI124、AXMI1257、AXMI1268、AXMI127、AXMI129、AXMI164、AXMI151、AXMI161、AXMI183、AXMI132、AXMI138、AXMI137、美国专利申请公开号US20140223598的AXMI270、美国专利申请公开号US20140223599的AXMI279、美国专利第8,319,019号的具有修饰的蛋白水解位点的cry蛋白(如Cry1A和Cry3A);来自美国专利申请公开号2011/0064710的苏云金芽孢杆菌菌株VBTS 2528的Cry1Ac、Cry2Aa和Cry1Ca毒素蛋白。其它Cry蛋白是所属领域的技术人员众所周知的。参见N.克里克莫尔等人,“苏云金芽孢杆菌杀虫晶体蛋白命名的修订(Revision of the Nomenclature for the Bacillusthuringiensis Pesticidal Crystal Proteins)”,(1998)《微生物学和分子生物学评论(Microbiology and Molecular Biology Reviews)》,”(1998)第62卷:807-813;还参见N.克里克莫尔等人,“苏云金芽孢杆菌毒素命名(Bacillus thuringiensis toxinnomenclature)”(2016),http://www.btnomenclature.info/。
使用Cry蛋白作为转基因植物性状是所属领域技术人员众所周知的,且包含(但不限于)表达CrylAc、Cry1Ac+Cry2Ab、CrylAb、CrylA.105、CrylF、Cry1Fa2、CrylF+CrylAc、Cry2Ab、Cry3A、mCry3A、Cry3Bbl、Cry34Abl、Cry35Abl、Vip3A、mCry3A、Cry9c和CBI-Bt的植物的Cry转基因植物已获得监管批准。参见萨纳乌哈(Sanahuja)等人,“苏云金芽孢杆菌:研究、开发和商业应用的世纪(Bacillus thuringiensis:a century of research,development and commercial applications)”,(2011)《植物生物技术杂志(PlantBiotech Journal)》,4月9(3):283-300和CERA(2010)GM环境风险评估作物数据库中心(Crop Database Center for Environmental Risk Assessment,CERA),ILSI调研地基,华盛顿,cera-gmc.org/index.php?action=gm_crop_database,其可以使用“www”前缀在万维网(world-wide web)上访问。所属领域技术人员众所周知的一种以上的杀虫蛋白也可以在植物中表达,如Vip3Ab&CrylFa(US2012/0317682);CrylBE&CrylF(US2012/0311746);CrylCA&CrylAB(US2012/0311745);CrylF&CryCa(US2012/0317681);CrylDA&CrylBE(US2012/0331590);CrylDA&CrylFa(US2012/0331589);CrylAB&CrylBE(US2012/0324606);CrylFa&Cry2Aa和Cryll&CrylE(US2012/0324605);Cry34Ab/35Ab和Cry6Aa(US20130167269);Cry34Ab/VCry35Ab&Cry3Aa(US20130167268);CrylAb&CrylF(US20140182018);和Cry3A和CrylAb或Vip3Aa(US20130116170).杀虫蛋白还包含杀虫脂肪酶,所述杀虫脂肪酶包含美国专利第7,491,869号的脂质酰基水解酶和如来自链霉菌(珀塞尔(Purcell)等人,(1993)《生物化学与生物物理学研究通讯(Biochem Biophys ResCommun)》15:1406-1413)。
杀虫蛋白还包含VIP(营养期杀虫蛋白)毒素。昆虫病原细菌产生聚积在包涵体或伴胞晶体(如前述Cry和Cyt蛋白)中的杀虫蛋白,以及分泌到培养基中的杀虫蛋白。后者之中是Vip蛋白,其根据其氨基酸同一性划分成四种家族。Vip1和Vip2蛋白充当二元毒素,且对鞘翅目和半翅目的一些成员具有毒性。Vip1组分被认为结合到昆虫中肠的膜中的受体,且Vip2组分进入细胞,其中其显示其针对肌动蛋白的ADP-核糖基转移酶活性,从而阻止微丝形成。Vip3不具有与Vip1或Vip2的序列相似性,且对鳞翅目的广泛多种成员具有毒性。其作用模式在蛋白水解活化、结合到中肠上皮细胞膜和成孔方面已显示类似Cry蛋白的作用模式,尽管Vip3A蛋白不与Cry蛋白共享结合位点。后者特性使其成为良好候选物,其与转基因植物(苏云金杆菌处理的作物[Bt作物])中的Cry蛋白组合以防预或延迟昆虫抗性且拓宽杀虫谱。存在Bt棉花和Bt玉蜀黍的市售种植品种,其表达Vip3Aa蛋白以及Cry蛋白。对于最近报告的Vip4家族,尚未发现目标昆虫。参见沙克龙(Chakroun)等人,“来自昆虫病原细菌的细菌营养期杀虫蛋白(Vip)”,《微生物学和分子生物学评论(Microbiol Mol BiolRev.)》2016年3月2日;80(2):329-50。可以在美国专利第5,877,012号、第6,107,279号、第6,137,033号、第7,244,820号、第7,615,686号和第8,237,020号等发现VIP。其它VIP蛋白对所属领域的技术人员是众所周知的(参见,lifesci.sussex.ac.uk/home/Neil_Crickmore/Bt/vip.html,其可以使用“www”前缀在万维网上访问)。
农药蛋白还包含毒素复合物(TC)蛋白质,其可从生物体获得,如致病杆菌属、光杆状菌属(Photorhabdus)和类芽孢杆菌属(参见美国专利第7,491,698号和第8,084,418号)。一些TC蛋白具有“独立”杀虫活性且其它TC蛋白增强由相同给定生物体产生的独立毒素的活性。可通过来源于不同属的源生物体的一或多种TC蛋白“增效剂”来增强“独立”TC蛋白(来自光杆状菌属、致病杆菌属或类芽孢杆菌属)的毒性。存在三种主要类型的TC蛋白。如本文中所提及,A类蛋白质(“蛋白A”)是独立毒素。B类蛋白质(“蛋白B”)和C类蛋白质(“蛋白C”)增强A类蛋白质的毒性。A类蛋白质的实例是TcbA、TcdA、XptAl和XptA2。B类蛋白质的实例是TcaC、TcdB、XptBlXb和XptCl Wi。C类蛋白质的实例是TccC、XptClXb和XptBl Wi。杀虫蛋白还包含蛛蛛、蛇和蝎毒液蛋白质。蛛蛛毒液肽的实例包含(但不限于)细胞毒素-1肽和其突变体(美国专利第8,334,366号)。
一些当前登记的PIP在表11中列出。转基因植物还已工程改造以表达针对昆虫基因的dsRNA(鲍姆(Baum,J.A.)等人(2007)通过RNA干扰防治鞘翅目昆虫害虫(Control ofcoleopteran insect pests through RNA interference),《自然生物技术(NatureBiotechnology)》25:1322-1326;毛(Mao,Y.B.)等人,(2007)通过植物介导的RNAi沉默棉铃虫P450单加氧酶基因削弱棉酚的幼虫耐受性(Silencing a cotton bollwormP450monooxygenase gene by plant-mediated RNAi impairs larval tolerance ofgossypol.),《自然生物技术》25:1307-1313)。RNA干扰可以通过将害虫馈送到转基因植物上来在害虫中触发。因此,害虫喂养引起害虫的损伤或死亡。
表11.可与本发明的微生物组合的示例性掺入植物的保护剂的列表
在一些实施例中,本文所阐述的农药中的任何一或多种可以与本发明的微生物中的任何一或多种一起利用且可以施用到植物或其部分,包含种子。
除草剂
如前所述,可包含本文所教示的任何微生物的本发明的农业组合物有时与一或多种除草剂组合。
包括根据本文所描述的方法产生的细菌或细菌种群和/或具有如本文所描述的特征的组合物可进一步包含一或多种除草剂。在一些实施例中,将除草剂组合物施用到植物和/或植物部分。在一些实施例中,除草剂组合物可包含于本文所阐述的组合物中,且可与其它化合物同时或依次施用于植物或其部分。
除草剂包含2,4-D、2,4-DB、乙草胺(acetochlor)、三氟羧草醚(acifluorfen)、甲草胺(alachlor)、莠灭净(ametryn)、莠去津(atrazine)、氯氨吡啶酸(aminopyralid)、氟草胺(benefin)、苄嘧磺隆(bensulfuron)、地散磷(bensulide)、灭草松(bentazon)、氟吡草酮(bicyclopyrone)、除草定(bromacil)、溴苯腈(bromoxynil)、丁草敌(butylate)、唑草酮(carfentrazone)、氯嘧磺隆(chlorimuron)、氯磺隆(chlorsulfuron)、烯草酮(clethodim)、异噁草酮(clomazone)、二氯吡啶酸(clopyralid)、氯酯磺草胺(cloransulam)、草灭特(cycloate)、DCPA、甜菜安(desmedipham)、麦草畏(dicamba)、敌草腈(dichlobenil)、禾草灵(diclofop)、双氯磺草胺(diclosulam)、氟吡草腙(diflufenzopyr)、二甲酚草胺(dimethenamid)、敌草快(diquat)、敌草隆(diuron)、DSMA、草藻灭(endothall)、EPTC、烯氯乐灵(ethalfluralin)、乙氧呋草磺(ethofumesate)、噁唑禾草灵(fenoxaprop)、吡氟禾草灵(fluazifop-P)、氟酮磺隆(flucarbzone)、氟噻草胺(flufenacet)、唑嘧磺草胺(flumetsulam)、苯氧乙酸(flumiclorac)、丙炔氟草胺(flumioxazin)、氟草隆(fluometuron)、氯氟吡氧乙酸(fluroxypyr)、氟磺胺草醚(fomesafen)、甲酰胺磺隆(foramsulfuron)、草铵膦(glufosinate)、草甘膦、氯吡嘧磺隆(halosulfuron)、环嗪酮(hexazinone)、咪草酯(imazamethabenz)、甲氧咪草烟、甲基咪草烟(imazapic)、咪唑喹啉酸(imazaquin)、咪草烟(imazethapyr)、异噁唑草酮(isoxaflutole)、乳氟禾草灵(lactofen)、利谷隆(linuron)、MCPA、MCPB、硝磺草酮(mesotrione)、异丙甲草胺(metolachlor-s)、嗪草酮(metribuzin)、茚嗪氟草胺、甲磺隆、禾草敌(molinate)、MSMA、敌草胺(napropamide)、萘草胺(naptalam)、烟嘧磺隆(nicosulfuron)、达草灭(norflurazon)、氨磺乐灵(oryzalin)、噁草酮、乙氧呋草醚、百草枯、壬酸(pelargonic acid)、二甲戊灵、敌菜宁、氨氯吡啶酸(picloram)、氟嘧磺隆、氨基丙氟灵(prodiamine)、扑草净、拿草特(pronamide)、敌稗、氟磺隆(prosulfuron)、杀草敏(pyrazon)、嘧硫草醚(pyrithioac)、二氯喹啉酸、喹禾灵(quizalofop)、砜嘧磺隆、S-异丙甲草胺、烯禾啶、环草隆(siduron)、西玛津、甲磺草胺(sulfentrazone)、甲嘧磺隆(sulfometuron)、磺酰磺隆(sulfosulfuron)、丁噻隆(tebuthiuron)、环磺酮(tembotrione)、特草定(terbacil)、噻唑烟酸(thiazopyr)、噻吩磺隆(thifensulfuron)、禾草丹(thiobencarb)、苯吡唑草酮(topramezone)、肟草酮(tralkoxydim)、野麦畏(triallate)、醚苯磺隆(triasulfuron)、苯磺隆(tribenuron)、三氯吡氧乙酸(triclopyr)、氟乐灵(trifluralin)和氟胺磺隆(triflusulfuron)。
在一些实施例中,本文所阐述的除草剂中的任何一或多种可与本文所阐述的植物或其部分中的任何一或多种一起利用。
除草产品可包含CORVUS、BALANCE FLEXX、CAPRENO、DIFLEXX、LIBERTY、LAUDIS、AUTUMN SUPER和DIFLEXX DUO。
在一些实施例中,下表12中所阐述的除草剂中的任何一或多种可以与本文所教示的微生物中的任何一或多种一起利用,且可以施用到本文所阐述的植物或其部分中的任何一或多个。
表12.可以与本发明的微生物组合的示例性除草剂的列表
杀真菌剂
如前所述,可包括本文所教示的任何微生物的本发明的农业组合物有时与一或多种杀真菌剂组合。
包括根据本文所描述的方法产生的细菌或细菌种群和/或具有如本文所描述的特征的组合物可进一步包含一或多种杀真菌剂。在一些实施例中,杀真菌组合物可包含于本文所阐述的组合物中,且可以与其它化合物同时或依次施用于植物或其部分。杀真菌剂包含嘧菌酯、克菌丹、萎锈灵、噻唑菌胺(ethaboxam)、咯菌腈、精甲霜灵、咯菌腈、噻菌灵、噻苯达唑(thiabendaz)、种菌唑、代森锰锌(mancozeb)、氰霜唑(cyazofamid)、苯酰菌胺(zoxamide)、甲霜灵、PCNB、羟菌唑(metaconazole)、吡唑醚菌酯(pyraclostrobin)、枯草芽孢杆菌菌株QST 713、氟唑环菌胺(sedaxane)、噻虫嗪、咯菌腈、福美双、甲基立枯磷(tolclofos-methyl)、肟菌酯、枯草芽孢杆菌菌株MBI 600、吡唑醚菌酯(pyraclostrobin)、氟嘧菌酯(fluoxastrobin)、短小芽孢杆菌菌株QST 2808、百菌清(chlorothalonil)、铜、粉唑醇(flutriafol)、氟唑菌酰胺(fluxapyroxad)、代森锰锌、咯菌腈、吡噻菌胺(penthiopyrad)、三唑、(propiconaozole)、丙硫菌唑、戊唑醇、氟嘧菌酯、吡唑醚菌酯、啶氧菌酯(picoxystrobin)、(qols)、四氟醚唑(tetraconazole)、肟菌酯、环丙唑醇(cyproconazole)、粉唑醇(flutriafol)、SDHI、EBDC、氟唑环菌胺、MAXIM QUATTRO(咯菌腈、精甲霜灵、嘧菌酯和噻苯达唑)、RAXIL(戊唑醇、丙硫菌唑、甲霜灵和乙氧化牛脂烷基胺)和苯并烯氟菌唑(benzovindiflupyr)。
在一些实施例中,本文所阐述的杀真菌剂中的任何一或多种可与本文所阐述的植物或其部分中的任何一或多种一起利用。
激素
如前所述,可包括本文所教示的任何微生物的本发明的农业组合物有时与一或多种激素组合。
包括根据本文所描述的方法产生的细菌或细菌种群和/或具有如本文所描述的特征的组合物可进一步包含一或多种激素。在一些实施例中,将激素组合物施用到植物和/或植物部分。在一些实施例中,激素组合物可包含于本文所阐述的组合物中,且可以与其它化合物同时或依次施用于植物或其部分。
激素包含(但不限于)生长素、细胞分裂素、赤霉素、脱落酸、乙烯、油菜素甾醇、茉莉酸、独脚金内酯和独脚金内酯的化学模拟物。
在一些实施例中,本文所阐述的激素中的任何一或多种可与本文所阐述的植物或其部分中的任何一或多种一起利用。
独脚金内酯
如前所述,可包括本文所教示的任何微生物的本发明的农业组合物有时与一或多种独脚金内酯或独脚金内酯的化学模拟物组合。此类化合物描述于2016年4月23日提交的PCT/US2016/029080中,且标题为:用于作物液压增强的方法,其以引用的方式并入本文中。其进一步描述于2018年6月12日发布的美国专利第9,994,557号中,且标题为:独脚金内酯调配物和其用途,其以引用的方式并入本文中。
在一些实施例中,独脚金内酯是式(I)化合物、其盐、溶剂化物、多晶型物、立体异构体或异构体:其中:a、b和c是以下中的一者:
式(I)
i.a是0或2,且b和c各自独立地是0、1或2;
ii.a是1,b是0,且c是0或2;
iii.a是1,b是1,且c是1或2;或
iv.a是1,b是2,且c是0、1或2;
每个A独立地是O或S;
每个E独立地是O、S或-NR
每个G独立地是C;
R
R
每个R
且
每个R
在一些实施例中,独脚金内酯是式(1)化合物、其盐、溶剂化物或异构体,其中:
每个E独立地是O、S或-NR
每个G独立地是C或N;
R
R
R
在一些实施例中,本文所阐述的独脚金内酯中的任何一或多种或独脚金内酯的模拟物可与本文所阐述的植物或其部分中的任何一或多种一起利用。
在所述方法的一些实施例中,本发明的农业组合物(其可包括本文所教示的任何微生物)与一或多种独脚金内酯或独脚金内酯的化学模拟物的组合或其任何组合,相比于未经接触的植物,经接触的植物的产量扩增;相比于未经接触的植物,经接触的植物的枯萎减少或延迟;相比于未经接触的植物,经接触的植物的膨压延长或保持,相比于未经接触的植物,经接触的植物的一或多个瓣片的损失减少或延迟;相比于未经接触的植物,经接触的植物的叶绿素含量维保持;相比于未经接触的植物,经接触的植物的叶绿素含量的损失减少或延迟;相比于未经接触的植物,经接触的植物的叶绿素含量增加;相比于未经接触的植物,经接触的植物的盐度耐受性提高;相比于未经接触的植物,经接触的植物的耗水量降低;相比于未经接触的植物,经接触的植物的耐旱性提高,相比于未经接触的植物,经接触的植物的害虫抗性提高,相比于未经接触的植物,经接触的植物的农药消耗降低。
在所述方法的一个实施例中,相比于未经接触的植物,经接触的植物的产量增加。
在所述方法的另一实施例中,相比于未经接触的植物,经接触的植物的寿命延长。
在所述方法的另一实施例中,相比于未经接触的植物,经接触的植物的枯萎减少或延迟。
在所述方法的另一实施例中,相比于未经接触的植物,经接触的植物的枯萎减少或延迟。
在所述方法的另一实施例中,相比于未经接触的植物,经接触的植物的膨压延长或保持。
在所述方法的另一实施例中,相比于未经接触的植物,经接触的植物的一或多个瓣片的损失减少或延迟。
在所述方法的另一实施例中,相比于未经接触的植物,经接触的植物的叶绿素含量保持。
在所述方法的另一实施例中,相比于未经接触的植物,经接触的植物的叶绿素含量的损失减少或延迟。
在所述方法的另一实施例中,相比于未经接触的植物,经接触的植物的叶绿素含量增加。
在所述方法的另一实施例中,相比于未经接触的植物,经接触的植物的盐度耐受性提高。
在所述方法的另一实施例中,相比于未经接触的植物,经接触的植物的耗水量减少。
在所述方法的另一实施例中,相比于未经接触的植物,经接触的植物的耐旱性提高。
在所述方法的另一实施例中,相比于未经接触的植物,经接触的植物的害虫抗性提高。
在所述方法的另一实施例中,相比于未经接触的植物,经接触的植物的农药消耗减少。
在另一个实施例中,当可包括本文所教示的任何微生物的本发明的农业组合物与一或多种独脚金内酯或独脚金内酯的化学模拟物组合时,相比于未经接触的植物,植物的蒸发增加。
在另一实施例中,当可包括本文所教示的任何微生物的本发明的农业组合物与一或多种独脚金内酯或独脚金内酯的化学模拟物组合时,相比于基本上相同但未经接触的植物,经接触的植物的冠层温度降低至少约0.1℃、0.2℃、0.3℃、0.4℃、0.5℃、0.6℃、0.7℃、0.8℃、0.9℃、1.0℃。
在另一实施例中,当可包括本文所教示的任何微生物的本发明的农业组合物与一或多种独脚金内酯或独脚金内酯的化学模拟物组合时,在与植物接触时引发植物的液压增强,其中相比于基本上相同但以其它方式未经接触的植物,经接触的植物的永久性枯萎点降低。
在另一个实施例中,当可包括本文所教示的任何微生物的本发明的农业组合物与一或多种独脚金内酯或独脚金内酯的化学模拟物组合时,相比于未经接触的植物,植物的蒸发增加。
杀线虫剂
如前所述,可包括本文所教示的任何微生物的本发明的农业组合物有时与一或多种杀线虫剂组合。
包括根据本文所描述的方法产生的细菌或细菌种群和/或具有如本文所描述的特征的组合物可进一步包含一或多种杀线虫剂。在一些实施例中,杀线虫组合物可包含于本文所阐述的组合物中,且可以与其它化合物同时或依次施用于植物或其部分。杀线虫剂可选自以下各者:D-D、1,3-二氯丙烯、二溴乙烷、1,2-二溴-3-氯丙烷、甲基溴、氯化苦、威百亩钠、棉隆、异硫氰酸甲酯、四硫代碳酸钠、涕灭威、涕灭砜威、克百威、杀线威、灭线磷、苯线磷、硫线磷、噻唑磷、特丁硫磷、丰索磷、甲拌磷、DiTera、甲壳素(clandosan)、青藤碱、甲基碘、溴丙炔、2,5-二羟甲基-3,4-二羟基吡咯烷(DMDP),或阿维菌素、叠氮化钠、糠醛、坚强芽孢杆菌、阿維菌素、噻虫嗪、咯菌腈、噻虫胺、水杨酸和苯并-(1,2,3)-噻二唑-7-硫代甲酸S-甲酯中的任何一或多种。
在一些实施例中,本文所阐述的杀线虫剂中的任何一或多种可与本文所阐述的植物或其部分中的任何一或多者一起利用。
在一些实施例中,本文所阐述的杀线虫剂、杀真菌剂、除草剂、杀虫剂和/或农药中的任何一或多者可与本文所阐述的植物或其部分中的任何一或多者一起利用。
肥料、氮稳定剂和脲酶抑制剂
如前所述,可包括本文所教示的任何微生物的本发明的农业组合物有时与以下各者中的一或多者组合:肥料、氮稳定剂或脲酶抑制剂。
在一些实施例中,肥料与本发明的方法和细菌组合使用。除许多其它以外,肥料包含无水氨、脲、硝酸铵和脲-硝酸铵(UAN)组合物。在一些实施例中,弹出式施肥和/或种肥与本发明的方法和细菌组合使用。
在一些实施例中,氮稳定剂与本发明的方法和细菌组合使用。氮稳定剂包含氯啶、2-氯-6-(三氯甲基)吡啶、N-SERVE 24、INSTINCT、二氰二胺(DCD)。
在一些实施例中,脲酶抑制剂与本发明的方法和细菌组合使用。脲酶抑制剂包含N-(正丁基)-硫代磷酸三酰胺(NBPT)、AGROTAIN、AGROTAIN PLUS和AGROTAIN PLUS SC。此外,本发明考虑利用AGROTAIN ADVANCED 1.0、AGROTAIN DRI-MAXX和AGROTAIN ULTRA。
此外,可以使用稳定形式的肥料。举例来说,稳定形式的肥料是SUPER U(在稳定化的尿素基颗粒中含有46%氮),SUPERU含有脲酶和硝化抑制剂以保护其免于脱硝、浸出和挥发。本文还可使用稳定和靶向叶面肥料,如NITAMIN。
弹出式肥料通常用于玉米田地中。弹出式施肥包括在种植时伴随种子施用数磅的养分。弹出式施肥用于增加幼苗活力。
本文可使用的缓慢或控释肥料需要:含有植物养分的肥料,其呈延缓其对于植物吸收和在施用之后使用的可用性的形式,或其使其对于植物的可用性显著长于例如硝酸铵或尿素、磷酸铵或氯化钾的‘可快速获得的养分肥料’的可用性的形式。初步可用性的此类延迟或持续可用性的延长时间可由多种机构发生。这些包含通过半渗透性包衣、闭塞、蛋白质材料或其它化学形式、通过水溶性低分子量化合物的缓慢水解或通过其它未知手段控制材料的水溶性。
本文可使用的稳定氮肥需要:已添加氮稳定剂的肥料。氮稳定剂是添加到肥料中的物质,其延长肥料的氮组分保持在脲-N或氨-N形式的土壤中的时间。
本文可使用的硝化抑制剂需要:抑制含氨-N到硝酸盐-N的生物氧化的物质。一些实例包含:(1)由陶氏化学公司(Dow Chemical)制造的通用名为氯啶的2-氯-6-(三氯甲基-吡啶);(2)由石黑田工业(Ishihada Industries)制造的通用名为ATC的4-胺基-1,2,4-三唑-HCl;(3)美国氰胺(American Cyanamid)制造的通用名为CI-1580的2,4-二氨基-6-三氯-甲基三嗪;(4)由昭和电工(Showa Denko)制造的通用名为DCD的二氰二胺;(5)由新柳梭(Nitto Ryuso)制造的通用名为TU的硫脲;(6)由立邦(Nippon)制造的通用名为MT的1-氢硫基-1,2,4-三唑;(7)由三井东压化学公司(Mitsui Toatsu)制造的通用名为AM的2-胺基-4-氯-6-甲基-嘧啶;(8)来自BASF的3,4-二甲基吡唑磷酸盐(DMPP);(9)来自日东化学公司(Nitto Chemical Ind.)的1-酰胺-2-硫脲(ASU);(10)硫代硫酸铵(ATS);(11)1H-1,2,4-三唑(HPLC);(12)来自奥林马西森(Olin Mathieson)的5-环氧乙烷-3-三氯-甲基1,2,4-硫代二唑(氯唑灵(Terrazole));(13)3-甲基吡唑(3-MP);(14)1-氨甲酰基-3-甲基-吡唑(CMP);(15)印楝素;和(16)DMPP。
本文可使用的脲酶抑制剂需要:抑制酶脲酶对尿素的水解作用的物质。数千化学物质已被评估为土壤脲酶抑制剂(库氏(Kiss)和斯密海安(Simihaian),2002)。然而,所测试的许多化合物中的仅几个化合物满足以下所需要求:无毒、在低浓度下有效、稳定且与尿素(固体和溶液)相容、在土壤中可降解且便宜。其可以根据其结构和其与酶脲酶的假定相互作用来分类(沃森(Watson),2000、2005)。已提议四种主要类别的脲酶抑制剂:(a)与巯基基团(巯基试剂)相互作用的试剂、(b)异羟肟酸酯、(c)农业作物保护化学物质和(d)尿素和相关化合物的结构类似物。N-(正丁基)硫代磷酸三酰胺(NBPT)、苯基磷酸二酰胺(PPD/PPDA)和对苯二酚可能是研究最彻底的脲酶抑制剂(库氏和斯密海安,2002)。研究和实际测试也已用N-(2-硝基苯基)磷酸三酰胺(2-NPT)和硫代硫酸铵(ATS)进行。有机-磷化合物是尿素的结构类似物且是脲酶活性的最有效抑制剂中的一些,阻断酶的活性位点(沃森,2005)。
玉米的杀虫种子处理剂(IST)
玉米种子处理剂通常靶向害虫的三种谱:线虫、真菌幼苗疾病和昆虫。
杀虫剂种子处理剂通常是种子处理剂包装的主要组分。当今可获得的大多数玉米种子具有包含杀真菌剂和杀虫剂的基础包装。在一些方面,种子处理剂的杀虫剂选择包含PONCHO(噻虫胺)、CRUISER/CRUISER EXTREME(噻虫嗪)和GAUCHO(吡虫啉)。所有这三种产品都是新烟碱化学物质。250(.25mg AI/种子)速率下的CRUISER和PONCHO是可用于玉米的最常见基础选择中的一些。在一些方面,用于处理剂的杀虫剂选择包含CRUISER 250噻虫嗪、CRUISER 250(噻虫嗪)加LUMIVIA(氯虫苯甲)、CRUISER 500(噻虫嗪)和PONCHO VOTIVO1250(噻虫胺&坚强芽孢杆菌I-1582)。
先锋基杀虫剂种子处理剂包装由具有也可用的PONCHO/VOTIVO 1250的CRUISER250组成。VOTIVO是保护免于线虫的生物剂。
孟山都的产品包含属于ACCELERON处理剂综合体的玉米、大豆和棉花。迪卡尔布(Dekalb)玉米种子与PONCHO 250呈标准。生产者还具有升级到PONCHO/VOTIVO的选择,其中PONCHO以500速率施用。
Agrisure、Golden Harvest和Garst具有基础包装,所述基础包装具有杀真菌剂和CRUISER 250。AVICTA完整玉米也可用;此包含CRUISER 500、杀真菌剂和线虫保护。然而,CRUISER EXME是可用作种子处理剂包装的另一选择;然而,CRUISER的量与常规CRUISER种子处理剂(即,250、500或1250)相同。
另一选择是购买可用的最小杀虫剂处理剂,且使经销商处理下游的种子。
玉米的可商购IST在下表13中列出且可以与本文所教示的微生物中的一或多种组合。
表13.包含可以与本发明的微生物组合的IST的示例性种子处理剂的列表
F=杀真菌剂;I=杀虫剂;N=杀线虫剂;P=植物生长调节剂
细菌种群在作物上的应用
本文所描述的细菌或细菌种群的组合物可以施加到犁沟、滑石中或以种子处理剂形式施用。组合物可以以散装、小型散装、袋装形式或在滑石中施用到种子包装。
种植器可以种植处理过的种子,且根据常规方式、双行或不需要耕耘的方式生长作物。可以使用控制料斗或单个料斗分配种子。也可以使用压缩空气或手动分配种子。可以使用可变速率技术进行种子放置。另外,可以使用可变速率技术来施用本文所描述的细菌或细菌种群。在一些实例中,细菌可以施用到玉米、大豆、芥花、高粱、马铃薯、水稻、蔬菜、谷类、假谷物的种子和油籽。谷类的实例可包含大麦、福尼奥米(fonio)、燕麦、帕尔默草(palmer's grass)、黑麦、珍珠粟(pearl millet)、高粱、斯佩尔特小麦(spelt)、画眉草(teff)、黑小麦和小麦。假谷物的实例可包含面包坚果(breadnut)、荞麦、香蒲、奇亚籽(chia)、亚麻、籽粒苋(grain amaranth)、汉扎(hanza)、藜麦和芝麻。在一些实例中,种子可以是基因修饰生物体(GMO)、非GMO、有机或常规的。
可以另外使用添加剂(如微肥、PGR、除草剂、杀虫剂和杀真菌剂)来处理作物。添加剂的实例包含作物保护剂,如杀虫剂、杀线虫剂、杀真菌剂;增效剂,如着色剂、聚合物、粒化剂、预激剂和消毒剂;和其它试剂,如接种菌、PGR、软化剂和微量养分。PGR可以是影响根部生长、开花或茎伸长的天然或合成植物激素。PGR可以包含生长素、赤霉素、细胞分裂素、乙烯和脱落酸(ABA)。
组合物可以与液体肥料组合施用在犁沟中。在一些实例中,液体肥料可保持在罐中。NPK肥料含有钠、磷和钾的大量营养素。
组合物可改良植物性状,如促进植物生长、维持叶片中高的叶绿素含量、增加果实或种子数目以及增加果实或种子单位重量。本发明的方法可用于引入或改良多种期望性状中的一或多种。可引入或改良的性状的实例包含:根部生物质量、根长、高度、芽长、叶数、水分利用效率、总生物质量、产量、果实大小、籽粒大小、光合作用速率、耐旱性、耐热性、耐盐性、对线虫胁迫的抗性、对真菌病原体的抗性、对细菌病原体的抗性、对病毒病原体的抗性、代谢物水平、代谢物水平下的调节、蛋白质组表达。期望的性状,包含高度、总生物质量、根部和/或芽生物质量、种子发芽、幼苗存活、光合效率、蒸腾速率、种子/果实数目或质量、植物籽粒或果实产量、叶片叶绿素含量、光合速率、根长或其任何组合可以用于测量生长,且与在相同条件下生长的参考农业植物(例如,无引入和/或改良性状的植物)的生长速率进行比较。在一些实例中,期望的性状,包含高度、总生物质量、根部和/或芽生物质量、种子发芽、幼苗存活、光合效率、蒸腾速率、种子/果实数目或质量、植物籽粒或果实产量、叶片叶绿素含量、光合速率、根长或其任何组合可以用于测量生长,且与在相似条件下生长的参考农业植物(例如,无引入和/或改良性状的植物)的生长速率进行比较。
宿主植物的农学性状可包含(但不限于)以下:与在没有所述种子处理配制物的情况下的由种子生长的等值线植物相比,改变的油含量、改变的蛋白质含量、改变的种子碳水化合物组成、改变的种子油组成和改变的种子蛋白质组成、耐化学性、耐寒性、延迟的衰老、抗病性、耐旱性、穗重、生长改善、健康增强、耐热性、除草剂耐受性、草食动物抗性、改善的固氮、提高的氮利用率、改善的根部架构、提高的水分利用效率、增加的生物质量、增加的根长、增加的种子重量、增加的芽长、增加的产量、在水受限条件下增加的产量、仁粒质量、仁粒含水量、金属耐受性、穗数、每只穗的仁粒数、荚数、营养增强、病原体抗性、害虫抗性、光合能力提高、耐盐性、滞绿、活力提高、增加的成熟种子的干重、增加的成熟种子的鲜重、增加的每株植物成熟种子的数目、提高的叶绿素含量、增加的每株植物的荚数、增加的每株植物的荚长、减少的每株植物枯萎叶片的数目、减少的每株植物严重枯萎叶片的数目、和增加的每株植物非枯萎叶片的数目、代谢物水平的可检测调控、转录物水平的可检测调控和蛋白质组中的可检测调控。
在一些情况下,用与被接种植物的植物成分相同的植物物种分离出的细菌或细菌种群来接种植物。举例来说,通常在一种玉蜀黍(Zea mays)(玉米)中发现的细菌或细菌种群与在自然状态下缺乏所述细菌和细菌种群的另一种玉米的植物的植物成分缔合。在一个实施例中,细菌和细菌种群来源于如被接种植物的植物成分的植物的相关物种的植物。举例来说,将通常在Iltis(伊尔蒂斯)等人的二倍体多年生玉米(Zea diploperennis)(二倍体多年生类玉米(diploperennial teosinte))中发现的细菌和细菌种群施用到玉蜀黍(玉米),或反之亦然。在一些情况下,用与被接种植物的植物元素异源的细菌和细菌种群来接种植物。在一个实施例中,细菌和细菌种群来源于另一物种的植物。举例来说,将通常在双子叶植物中发现的细菌和细菌种群施用到单子叶植物(例如,用大豆源性细菌和细菌种群接种玉米),或反之亦然。在其它情况下,待接种到植物上的细菌和细菌种群来源于待接种的植物的相关物种。在一实施例中,细菌和细菌种群来源于相关分类单元,例如来源于相关物种。另一物种的植物可以是农业植物。在另一实施例中,细菌和细菌种群是接种到任何宿主植物成分中的经设计组合物的一部分。
在一些实例中,细菌或细菌种群是外源的,其中细菌和细菌种群是从与被接种植物不同的植物中分离的。举例来说,在一个实施例中,细菌或细菌种群可以从与待接种植物相同的物种的不同植物中分离。在一些情况下,细菌或细菌种群可以从与接种植物相关的物种中分离。
在一些实例中,本文所描述的细菌和细菌种群能够从一种组织类型移动到另一组织类型。举例来说,本发明在种子外部上包被后对植物成熟组织内细菌和细菌种群的检测和分离证明了细菌和细菌种群从种子外部移入成熟化植物的营养组织的能力。因此,在一个实施例中,细菌种群和细菌种群能够从种子外部移动到植物的营养组织中。在一个实施例中,包被到植物种子上的细菌和细菌种群能够在种子发芽成营养状态时定位于植物的不同组织。例如,细菌和细菌种群可以定位于植物中的组织中的任一种,包含:根部、不定根部、种子5根、根毛、芽、叶、花、苞、穗、分生组织、花粉、雌蕊、子房、雄蕊、果实、匍匐茎、根茎、根瘤、块茎、毛状体、保卫细胞、泌水孔、瓣片、萼片、颖片、叶轴、维管形成层、韧皮部和木质部。在一个实施例中,细菌和细菌种群能够定位于植物的根部和/或根毛。在另一实施例中,细菌和细菌种群能够定位于光合组织,例如植物的叶和芽。在其它情况下,细菌和细菌种群定位于植物的维管组织中,例如在木质部和韧皮部中。在又一实施例中,细菌和细菌种群能够定位于植物的生殖组织(花、花粉、雌蕊、子房、雄蕊、果实)。在另一实施例中,细菌和细菌种群能够定位于植物的根部、芽、叶和生殖组织。在又一实施例中,细菌和细菌种群定殖植物的果实或种子组织。在又一实施例中,细菌和细菌种群能够定殖植物,使得其存在于植物的表面中(即,其存在可检测地呈现于植物的外部或植物的表层)。在其它实施例中,细菌和细菌种群能够定位于植物的基本上全部或全部组织。在某些实施例中,细菌和细菌种群不定位于植物的根部。在其它情况下,细菌和细菌种群并不定位于植物的光合组织。
还可以通过测量作物的相对成熟度或作物热单位(CHU)来评定组合物的有效性。例如,可以将细菌种群施用到玉米,且可以根据玉米粒的相对成熟度或玉米粒达到最大重量的时间来评定玉米生长。作物热单位(CHU)也可以用于预测玉米作物的成熟。CHU通过测量作物生长的每日最高温度来确定热量积累量。
在实例中,细菌可定位于植物中的任何组织,包含:根部、不定根部、种子根部、根毛、芽、叶、花、苞穗、分生组织、花粉、雌蕊、子房、雄蕊、果实、匍匐茎、根茎、根瘤、块茎、毛状体、保卫细胞、泌水孔、瓣片、萼片、颖片、叶轴、维管形成层、韧皮部和木质部。在另一实施例中,细菌或细菌种群能够定位于光合组织,例如植物的叶和芽。在其它情况下,细菌和细菌种群定位于植物的维管组织中,例如在木质部和韧皮部中。在另一实施例中,细菌或细菌种群能够定位于植物的生殖组织(花、花粉、雌蕊、子房、雄蕊或果实)。在另一实施例中,细菌和细菌种群能够定位于植物的根部、芽、叶和生殖组织。在另一实施例中,细菌或细菌种群定殖植物的果实或种子组织。在又一实施例中,细菌或细菌种群能够定殖植物,使得其存在于植物表面中。在另一实施例中,细菌或细菌种群能够定位于植物的大体上全部或全部组织。在某些实施例中,细菌或细菌种群不定位于植物的根部。在其它情况下,细菌和细菌种群并不定位于植物的光合组织。
可以通过测量作物生长的各种特征来评定施加到作物上的细菌组合物的有效性,这些特征包含(但不限于)种植率、播种活力、根部强度、耐旱性、株高、干燥和试验重量。
植物物种
本文所描述的方法和细菌适用于多种植物中的任一种,如大麦属(Hordeum)、稻属(Oryza)、玉蜀黍属和小麦属(Triticeae)的植物。合适植物的其它非限制性实例包含苔藓、地衣和藻类。在一些情况下,植物具有经济、社会和/或环境价值,如粮食作物、纤维作物、油料作物、林业或纸浆和造纸工业中的植物、用于生物燃料生产的原料和/或观赏植物。在一些实例中,植物可以用于生产具有经济价值的产品,如谷物、面粉、淀粉、糖浆、粗粉、油、膜、包装、营养食品产品、纸浆、动物饲料、鱼饲料、用于工业化学品的散装材料、谷类产品、经过加工的人类食品、糖、酒精和/或蛋白质。作物植物的非限制性实例包含玉米、水稻、小麦、大麦、高粱、小米、燕麦、黑麦黑小麦、荞麦、甜玉米、甘蔗、洋葱、番茄、草莓和芦笋。在一些实施例中,本文所描述的方法和细菌适用于多种转基因植物、非转基因植物和其杂交植物中的任一种。
在一些实例中,可以使用本文所公开的方法和组合物获得或改良的植物可以包含对于农业、园艺、用于生产生物燃料分子和其它化学品的生物质量和/或林业来说重要或令人感兴趣的植物。这些植物的一些实例可以包含菠萝、香蕉、椰子、百合、家山黧豆(grasspea)和草;以及双子叶植物,例如豆类、苜蓿、粘果酸浆(tomatillo)、甜瓜、鹰嘴豆、菊苣、三叶草、羽衣甘蓝、小扁豆、大豆、烟草、马铃薯、甘薯、萝卜、甘蓝菜、油菜(rape)、苹果树、葡萄、棉、葵花、拟南芥(thale cress)、芥花、柑橘属(包含橙、柑橘(mandarin)、金橘(kumquat)、柠檬、酸橙、葡萄柚、红橘(tangerine)、橘柚(tangelo)、香橼(citron)以及柚子(pomelo))、胡椒、菜豆(bean)、生菜、柳枝稷(Panicum virgatum)(风倾草(switch))、高粱(Sorghum bicolor)(高粱(sorghum)、苏丹草(sudan))、奇岗(Miscanthus giganteus)(芒草)、蔗属(Saccharum sp.)(能源甘蔗(energycane))、欧洲大叶杨(Populus balsamifera)(白杨)、玉蜀黍(玉米)、大豆(Glycine max)(大豆(soybean))、甘蓝型油菜(Brassicanapus)(芥花)、普通小麦(Triticum aestivum)(小麦)、陆地棉(Gossypium hirsutum)(棉)、水稻(Oryza sativa)(水稻(rice))、向日葵(Helianthus annuus)(向日葵(sunflower))、紫花苜蓿(Medicago sativa)(苜蓿)、甜菜(Beta vulgaris)(甜菜(sugarbeet))、御谷(Pennisetum glaucum)(珍珠粟)、黍属(Panicum spp.)、高粱属、芒属、蔗属、蔗茅属(Erianthus spp.)、白杨属(Populus spp.)、黑麦(Secale cereale)(黑麦(rye))、柳属(Salix spp.)(柳树)、桉属(Eucalyptus spp.)(桉树)、小黑麦属(Triticosecale spp.)(小麦属-25小麦×黑麦)、竹子、红花(Carthamus tinctorius)(红花(safflower))、桐油树(Jatropha curcas)(麻风树属(Jatropha))、蓖麻(Ricinuscommunis)(蓖麻(castor))、油棕(Elaeis guineensis)(油棕(oil palm))、海枣(Phoenixdactylifera)(椰枣(date palm))、肯氏假槟榔(Archontophoenix cunninghamiana)(国王假槟榔(king palm))、金山葵(Syagrus romanzoffiana)(皇后葵(queen palm))、亚麻(Linum usitatissimum)(亚麻(Linum usitatissimum))、芥菜(Brassica juncea)、木薯(Manihot esculenta)(木薯(cassaya))、番茄(Lycopersicon esculentum)(番茄(tomato))、莴苣(Lactuca saliva)(生菜)、大蕉(Musa paradisiaca)(香蕉)、马铃薯(Solanum tuberosum)(马铃薯(potato))、甘蓝(Brassica oleracea)(椰菜、花椰菜、球芽甘蓝)、山茶(Camellia sinensis)(茶)、草莓(Fragaria ananassa)(草莓(strawberry))、可可树(Theobroma cacao)(可可(cocoa))、小粒咖啡(Coffea arabica)(咖啡)、酿酒葡萄(Vitis vinifera)(葡萄)、菠萝(Ananas comosus)(菠萝(pineapple))、辣椒(Capsicumannum)(辣椒和甜椒)、洋葱(Allium cepa)(洋葱(onion))、厚皮甜瓜(Cucumis melo)(甜瓜)、黄瓜(Cucumis sativus)(黄瓜(cucumber))、笋瓜(Cucurbita maxima)(南瓜属(squash))、南瓜(Cucurbita moschata)(南瓜属)、菠菜(Spinacea oleracea)(菠菜(spinach))、西瓜属(Citrullus lanatus)(西瓜)、咖啡黄葵(Abelmoschus esculentus)(秋葵)、茄(Solanum melongena)(茄子)、罂粟(Papaver somniferum)(罂粟(opiumpoppy))、东方罂粟(Papaver orientale)、欧洲红豆杉(Taxus baccata)、短叶红豆杉(Taxus brevifolia)、黄花蒿(Artemisia annua)、大麻(Cannabis saliva)、喜树(Camptotheca acuminate)、长春花(Catharanthus roseus)、长春花(Vinca rosea)、正鸡纳树(Cinchona officinalis)、秋水仙(Coichicum autumnale)、加州藜芦(Veratrumcalifornica)、洋地黄(Digitalis lanata)、毛地黄(Digitalis purpurea)、薯蓣5属(Dioscorea 5spp.)、穿心莲(Andrographis paniculata)、颠茄(Atropa belladonna)、曼陀罗(Datura stomonium)、小檗属(Berberis spp.)、三尖杉属(Cephalotaxus spp.)、麻黄(Ephedra sinica)、麻黄属(Ephedra spp.)、古柯(Erythroxylum coca)、雪花莲(Galanthus wornorii)、赛莨菪属(Scopolia spp.)、千层塔(Lycopodium serratum)(蛇足石杉(Huperzia serrata))、石松属(Lycopodium spp.)、蛇根木(Rauwolfia serpentina)、萝芙木属(Rauwolfia spp.)、血根草(Sanguinaria canadensis)、天仙子属(Hyoscyamusspp.)、金盏花(Calendula officinalis)、短舌匹菊(Chrysanthemum parthenium)、毛喉鞘蕊花(Coleus forskohlii)、小白菊(Tanacetum parthenium)、灰白银胶菊(Partheniumargentatum)(银胶菊(guayule))、橡胶树属(Hevea spp.)(橡胶)、留兰香(Menthaspicata)(薄荷)、辣薄荷(Mentha piperita)(薄荷)、红木(Bixa orellana)、六出花属(Alstroemeria spp.)、蔷薇属(Rosa spp.)(玫瑰)、香石竹(Dianthus caryophyllus)(康乃馨)、矮牵牛属(Petunia spp.)(矮牵牛)、一品红(Poinsettia pulcherrima)(一品红(poinsettia))、烟草(Nicotiana tabacum)(烟草(tobacco))、白羽扇豆(Lupinus albus)(羽扇豆)、海燕麦(Uniola paniculata)(燕麦)、大麦(Hordeum vulgare)(大麦(barley))以及黑麦草属(Lolium spp.)(黑麦)。
在一些实例中,可以使用单子叶植物。单子叶植物属于以下的目:泽泻目(Alismatales)、天南星目(Arales)、棕榈目(Arecales)、凤梨目(Bromeliales)、鸭跖草目(Commelinales)、环花目(Cyclanthales)、莎草目(Cyperales)、谷精草目(Eriocaulales)、水鳖目(Hydrocharitales)、灯芯草目(Juncales)、百合目(Lilliales)、茨藻目(Najadales)、兰目(Orchidales)、露兜树目(Pandanales)、禾本目(Poales)、帚灯草目(Restionales)、霉草目(Triuridales)、香蒲目(Typhales)以及姜目(Zingiberales)。属于裸子植物类的植物是苏铁目(Cycadales)、银杏目(Ginkgoales)、买麻藤目(Gnetales)以及松目(Pinales)。在一些实例中,单子叶植物可以选自由以下组成的群组:玉蜀黍、水稻、小麦、大麦以及甘蔗。
在一些实例中,可以使用双子叶植物,包含属于以下的目的植物:马兜铃目(Aristochiales)、菊目(Asterales)、肉穗果目(Batales)、桔梗目(Campanulales)、白花菜目(Capparales)、石竹目(Caryophyllales)、木麻黄目(Casuarinales)、卫矛目(Celastrales)、山茱萸目(Cornales)、岩梅目(Diapensales)、五桠果目(Dilleniales)、川续断目(Dipsacales)、柿树目(Ebenales)、杜鹃花目(Ericales)、杜仲目(Eucomiales)、大戟目(Euphorbiales)、豆目(Fabales)、壳斗目(Fagales)、龙胆目(Gentianales)、牻牛儿苗目(Geraniales)、小二仙草目(Haloragales)、金缕梅目(Hamamelidales)、Middles目、胡桃目(Juglandales)、唇形目(Lamiales)、樟目(Laurales)、玉蕊目(Lecythidales)、莱脱纳目(Leitneriales)、木兰目(Magniolales)、锦葵目(Malvales)、杨梅目(Myricales)、桃金娘目(Myrtales)、睡莲目(Nymphaeales)、罂粟目(Papeverales)、胡椒目(Piperales)、车前目(Plantaginales)、蓝雪目(Plumb aginales)、川苔草目(Podostemales)、花荵目(Polemoniales)、远志目(Polygalales)、蓼目(Polygonales)、报春花目(Primulales)、山龙眼目(Proteales)、大花草目(Rafflesiales)、毛茛目(Ranunculales)、鼠李目(Rhamnales)、蔷薇目(Rosales)、茜草目(Rubiales)、杨柳目(Salicales)、檀香目(Santales)、无患子目(Sapindales)、瓶子草科(Sarraceniaceae)、玄参目(Scrophulariales)、山茶目(Theales)、昆栏树目(Trochodendrales)、伞形目(Umbellales)、荨麻目(Urticales)以及堇菜目(Violates)。在一些实例中,双子叶植物可以选自由以下组成的群组:棉、大豆、胡椒以及番茄。
在一些情况下,待改良的植物不容易适合于实验条件。例如,作物植物可能花费过长时间才能生长到足以在多个迭代中连续地实际评定改良的性状。相应地,最初分离出细菌的第一植物和/或施用了基因操纵细菌的多个植物可以是模型植物,如更适合于在所需条件下进行评估的植物。模型植物的非限制性实例包含狗尾草属(Setaria)、短柄草属(Brachypodium)和拟南芥属(Arabidopsis)。随后可以将根据本公开的方法使用模型植物分离的细菌的能力施用于另一类型的植物(例如作物植物),以确认改良性状的赋予。
可以通过本文所公开的方法改良的性状包含植物的任何可观察到的特征,包含例如生长速率、高度、重量、颜色、味道、气味、植物的一种或多种化合物(包含例如代谢物、蛋白质、药物、碳水化合物、油以及任何其它化合物)产生的变化。还设想了基于基因型信息选择植物(例如,包含响应于细菌的植物基因表达模式,或鉴别基因标记物(如与固氮增加相关的标记物)的存在)。还可以基于与某一特征或性状(如期望的特征或性状)的存在相反,不存在、遏止或抑制某一特征或性状(如不期望的特征或性状)来选择植物。
非经遗传修饰的玉蜀黍
本文所描述的方法和细菌适合于多种非经遗传修饰的玉蜀黍植物或其部分中的任一种。并且在一些方面中,玉米为有机的。此外,本文所描述的方法和细菌适合于以下非经遗传修饰的杂合物、品种、谱系等中的任一种。在一些实施例中,玉米品种一般属于六个类别:甜玉米、硬质型玉米、爆花用玉米、臼齿形玉米、有稃种玉米和粉质玉米。
黄色su品种包含早玉(Earlivee)、早霞玉(Early Sunglow)、圣丹斯玉(Sundance)、早金班坦玉(Early Golden Bantam)、伊奥齐玉(Iochief)、名玉(Merit)、禧年玉(Jubilee)和金十字班坦玉(Golden Cross Bantam)。白su品种包含真铂玉(TruePlatinum)、乡绅玉(Country Gentleman)、银皇后玉(Silver Queen)和斯托威尔常青玉(Stowell's Evergreen)。双色su品种包含糖及黄金玉(Sugar&Gold)、速成玉(Quickie)、双标准玉(Double Standard)、黄油及糖玉(Butter&Sugar)、糖豆玉(Sugar Dots)、蜂蜜及奶油玉(Honey&Cream)。多色su品种包含霍克斯玉(Hookers)、三合玉(Triple Play)、绘山玉(Painted Hill)、黑墨西哥玉(Black Mexican)/阿兹特克玉(Aztec)。
黄色se品种包含黄油金玉(Buttergold)、早熟玉(Precocious)、斯普林特里特玉(Spring Treat)、糖面包玉(Sugar Buns)、卡洛玉(Colorow)、康堤国王玉(Kandy King)、粉紫R/M玉(Bodacious R/M)、塔士多玉(Tuxedo)、极佳玉(Incredible)、梅林玉(Merlin)、奇迹(Miracle)和康堤科恩玉(Kandy Korn EH)。白se种类包含春雪玉(Spring Snow)、糖珍珠玉(Sugar Pearl)、乳白玉(Whiteout)、云九号玉(Cloud Nine)、高山玉(Alpine)、银国王玉(Silver King)和银玉(Argent)。双色se品种包含糖幼玉(Sugar Baby)、弗利特玉(Fleet)、邦乔玉(Bon Jour)、三位体玉(Trinity)、双汁玉(Bi-Licious)、诱玉(Temptation)、美味玉(Luscious)、极美味玉(Ambrosia)、雅阁玉(Accord)、博科玉(Brocade)、兰斯洛特玉(Lancelot)、贵宝石玉(Precious Gem)、桃及奶油中等EH玉(Peaches and Cream Mid EH)和可口R/M玉(Delectable R/M)。多色se品种包含红宝石皇后玉(Ruby Queen)。
黄色sh2品种包含特级早期超甜玉(Extra Early Super Sweet)、特可夫玉(Takeoff)、早期特级甜玉(Early Xtra Sweet)、瑞夫琳玉(Raveline)、夏季甜黄玉(SummerSweet Yellow)、脆国王玉(Krispy King)、加里森(Garrison)、伊利尼金玉(Illini Gold)、挑战者玉(Challenger)、百香玉(Passion)、卓越玉(Excel)、禧年超甜玉(JubileeSuperSweet)、伊利尼特级甜玉(Illini Xtra Sweet)和脆'N甜玉(Crisp'N Sweet)。白sh2品种包含夏季甜白玉(Summer Sweet White)、塔霍玉(Tahoe)、阿斯彭玉(Aspen)、珍品玉(Treasure)、特甜玉(How Sweet It Is)和卡米洛特玉(Camelot)。双色sh2品种包含夏季甜双色玉(Summer Sweet Bicolor)、光辉玉(Radiance)、蜂蜜'N珍珠玉(Honey'N Pearl)、阿罗哈玉(Aloha)、眩目玉(Dazzle)、哈德逊玉(Hudson)和非凡玉(Phenomenal)。
黄色sy品种包含埃普劳斯玉(Applause)、因费诺玉(Inferno)、如蜜玉(Honeytreat)和加蜜玉(Honey Select)。白sy品种包含银爵玉(Silver Duchess)、辛德瑞拉玉(Cinderella)、马塔皮塞特玉(Mattapoisett)、阿瓦隆玉(Avalon)和迷人玉(Captivate)。双色sy品种包含有价玉(Pay Dirt)、启示玉(Revelation)、复兴玉(Renaissance)、魅力玉(Charisma)、协生玉(协力)、蒙托克玉(Montauk)、克莉斯汀玉(Kristine)、好运玉(Serendipity)/普罗维登斯玉(Providence)和浮雕玉(Cameo)。
黄色增强型超甜品种包含特软1ddA(Xtra-Tender 1ddA)、特软11dd(Xtra-Tender11dd)、未来131Y(Mirai 131Y)、未来130Y(Mirai 130Y)、幻玉(Vision)和未来002(Mirai002)。白色增强型超甜品种包含特软3dda(Xtra-Tender 3dda)、特软31dd(Xtra-Tender31dd)、未来421W(Mirai 421W)、XTH 3673和奉献玉(Devotion)。双色增强型超甜品种包含特软2dda、特软21dd、启动XR(Kickoff XR)、未来308BC、安森木XR(Anthem XR)、未来336BC、美妙XR(Fantastic XR)、胜利玉(Triumph)、未来301BC、恒星玉(Stellar)、美国梦玉(American Dream)、未来350BC和迷恋玉(Obsession)。
硬质型玉米品种包含青铜橙玉(Bronze-Orange)、糖果红硬粒玉(Candy RedFlint)、弗洛里安尼红硬粒玉(Floriani Red Flint)、玻璃宝石玉(Glass Gem)、印地安装饰性(彩虹)玉(Indian Ornamental(Rainbow))、曼丹红粉质玉(Mandan Red Flour)、绘山玉(Painted Mountain)、佩特梅克玉(Petmecky)、彻罗基白粉质玉(Cherokee WhiteFlour),
爆花用玉米品种包含帝王蝴蝶玉(Monarch Butterfly)、黄蝴蝶玉(YellowButterfly)、午夜蓝玉(Midnight Blue)、红宝石红玉(Ruby Red)、混合型幼水稻玉(MixedBaby Rice)、淡紫色皇后玉(Queen Mauve)、蘑菇片玉(Mushroom Flake)、日本种无壳玉(Japanese Hull-less)、草莓玉(Strawberry)、蓝色萨满玉(Blue Shaman)、微型彩色玉(Miniature Colored)、微型粉色玉(Miniature Pink)、宾夕法尼亚州荷兰种黄油风味玉(Pennsylvania Dutch Flavor)和红草莓玉(Red Strawberry)。
臼齿形玉米品种包含血腥屠夫玉(Bloody Butcher)、蓝色克拉格玉(BlueClarage)、俄亥俄州蓝色克拉格玉(Ohio Blue Clarage)、彻罗基白鹰玉(Cherokee WhiteEagle)、山核桃藤玉(Hickory Cane)、山核桃国王玉(Hickory King)、杰里科尔斯双生玉(Jellicorse Twin)、肯塔基州彩虹玉(Kentucky Rainbow)、戴蒙摩根的屠夫武士玉(Daymon Morgan's Knt.Butcher)、利明玉(Leaming)、利明黄玉(Leaming's Yellow)、麦科马克的蓝巨人玉(McCormack's Blue Giant)、尼尔帕马斯特玉(Neal Paymaster)、彭戈溪屠夫玉(Pungo Creek Butcher)、里德黄凹玉(Reid's Yellow Dent)、罗藤克拉格玉(Rotten Clarage)和田纳西州红穗玉(Tennessee Red Cob)。
在一些实施例中,玉米品种包含P1618W、P1306W、P1345、P1151、P1197、P0574、P0589和P0157。W=白色玉米。
在一些实施例中,本文所描述的方法和细菌适合于本文所阐述的玉蜀黍品种中的任何杂合物。
经遗传修饰的玉蜀黍
本文所描述的方法和细菌适合于经遗传修饰的玉蜀黍植物或其部分的杂合物、品种、谱系等中的任一种。
此外,本文所描述的方法和细菌适合于已经在一个或多个国家中批准的以下经遗传修饰玉蜀黍事件中的任一种:32138(32138SPT Maintainer)、3272(ENOGEN)、3272 xBt11、3272 x bt11 x GA21、3272 x Bt11 x MIR604、3272 x Bt11 x MIR604 x GA21、3272x Bt11 x MIR604 x TC1507 x 5307 x GA21、3272 x GA21,3272 x MIR604、3272 xMIR604x GA21、4114,5307(AGRISURE Duracade)、5307 x GA21、5307 x MIR604 x Bt11 xTC1507 x GA21(AGRISURE Duracade 5122)、5307 x MIR604 x Bt11 x TC1507 x GA21 xMIR162(AGRISURE Duracade 5222)、59122(Herculex RW)、59122 x DAS40278、59122xGA21、59122 x MIR604、59122 x MIR604 x GA21、59122 x MIR604 x TC1507、59122xMIR604 x TC1507 x GA21、59122 x MON810、59122 x MON810 x MIR604、59122 x MON810x NK603、59122 x MON810 x NK603 x MIR604、59122 x MON88017、59122 x MON88017 xDAS40278、59122 x NK603(Herculex RW ROUNDUP READY 2)、59122xNK603 x MIR604、59122 x TC1507 x GA21,676,678,680,3751 IR、98140、98140 x 59122、98140 x TC1507、98140 x TC1507 x 59122、Bt10(Bt10)、Bt11[X4334CBR,X4734CBR](AGRISURE CB/LL)、Bt11 x 5307、Bt11 x 5307 x GA21、Bt11 x 59122 x MIR604、Br11 x59122 x MIR604 xGA21、Bt11 x 59122 x MIR604 x TC1507、M53、M56、DAS-59122-7、Bt11 x 59122 x MIR604x TC1507 x GA21、Bt11 x 59122 x TC1507、TC1507 xDAS-59122-7、Bt11 x 59122 xTC1507 x GA21、Bt11 x GA21(AGRISURE GT/CB/LL)、Bt11 x MIR162(AGRISURE Viptera2100)、BT11 x MIR162 x 5307、Bt11 x MIR162 x 5307x GA21、Bt11 x MIR162 x GA21(AGRISURE Viptera 3110)、Bt11 x MIR162 x MIR604(AGRISURE Viptera 3100)、Bt11 xMIR162 x MIR604 x 5307、Bt11 x MIR162 x MIR604 x5307 x GA21、Bt11 x MIR162 xMIR604 x GA21(AGRISURE Viptera 3111/AGRISUREViptera 4)、Bt11、MIR162 x MIR604 xMON89034 x 5307 x GA21、Bt11 x MIR162 xMIR604 x TC1507、Bt11 x MIR162 x MIR604x TC1507 x 5307、Bt11 x MIR162 x MIR604x TC1507 x GA21、Bt11 x MIR162 xMON89034、Bt11 x MIR162 x MON89034 x GA21、Bt11 x MIR162 x TC1507、Bt11 x MIR162x TC1507 x 5307、Bt11 x MIR162 x TC1507 x5307 x GA21、Bt11 x MR162 x TC1507 xGA21(AGRISURE Viptera 3220)、BT11 xMIR604(Agrisure BC/LL/RW)、Bt11 x MIR604 x5307、Bt11 x MIR604 x 5307 x GA21、Bt11 x MIR604 x GA21、Bt11 x MIR604 x TC1507、Bt11 x MIR604 x TC1507 x 5307、Bt11x MIR604 x TC1507 x GA21、Bt11 x
额外的经遗传修饰的植物
本文所描述的方法和细菌适合于多种经遗传修饰的植物或其部分中的任一种。
此外,本文所描述的方法和细菌适合于已经在一个或多个国家中批准的以下经遗传修饰的植物事件中的任一种。
表14-可与本公开的微生物组合的水稻性状
表15-可与本公开的微生物组合的苜蓿性状
表16-可与本公开的微生物组合的小麦性状
表17-可与本公开的微生物组合的向日葵性状
表18-可与本公开的微生物组合的大豆性状
表19-可与本公开的微生物组合的玉米性状
以下是对于表19中出现的简写的定义。AM-具有YGCB、HX1、LL、RR2的OPTIMUMACREMAX昆虫保护系统。AMT-具有RW、YGCB、HX1、LL、RR2的OPTIMUM ACREMAX TRISECT昆虫保护系统。AMXT-(OPTIMUM ACREMAX极限(XTreme))。HXX-HERCULEX XTRA含有Herculex I和Herculex RW基因。HX1-含有HERCULEX I昆虫保护基因,其可提供防止欧洲玉米蛀虫、西南玉米蛀虫、黑毛虫、秋夜蛾、西方豆毛虫(western bean cutworm)、小玉米茎蛀虫、南方玉米茎蛀虫和甘蔗蛀虫;以及抑制玉米耳虫。LL-含有用于抗LIBERTY除草剂的LIBERTYLINK基因。RR2-含有ROUNDUP READY玉米2号性状,其当根据标签说明施用时,针对过度施用标签说明的草甘膦除草剂提供作物安全性。YGCB-含有YIELDGARD玉米蛀虫基因,其对欧洲玉米蛀虫、西南玉米蛀虫和南方玉米茎秆蛀虫提供高水平的抗性;对玉米耳虫和普通茎秆蛀虫提供中等抗性;对秋夜蛾提供高于平均水平的抗性。RW-含有AGRISURE根虫抗性性状。Q-针对易受影响的欧洲玉米蛀虫、西南玉米蛀虫、黑毛虫、秋夜蛾、小玉米茎秆蛀虫、南方玉米茎秆蛀虫、茎秆蛀虫、甘蔗蛀虫和玉米耳虫提供保护或抑制;以及提供保护免于易受影响的西方玉米根虫、北方玉米根虫和墨西哥玉米根虫造成的幼虫损伤;含有(1)产生Cry1F和Cry34ab1和Cry35ab1蛋白质的HERCULEX XTRA昆虫保护基因,(2)包含产生mCry3A蛋白质的基因的AGRISURE RW性状,和(3)产生Cry1Ab蛋白质的YIELDGARD玉米蛀虫基因。
农业组合物的浓度和施用率
如前述,可以多种方式将包括所教示微生物的本公开的农业组合物施用于植物。在两个特定方面,本公开涵盖沟内处理剂或种子处理剂。
对于种子处理剂实施例,本公开的微生物可以多种浓度存在于种子上。例如,在种子处理剂中可以发现微生物处于以下cfu/种子浓度:1×10
在美国,约10%的玉米种植面积的种子密度在约36,000种子/公顷以上;1/3的玉米种植面积的种子密度在约33,000到36,000种子/公顷之间;1/3的玉米种植面积的种子密度在约30,000到33,000种子/公顷之间,并且其余部分的面积是可变的。参见史蒂夫布森(Steve Butzen)所写的“玉米播种率考虑因素(Corn Seeding Rate Considerations)”,可获自:https://www.pioneer.com/home/site/us/agronomy/library/corn-seeding-rate-considerations/
以下表20利用所考虑的种子处理剂实施例中的各种cfu浓度/种子(横列)和各种种子面积种植密度(第1列:15K-41K)来计算cfu/公顷的总量,其可用于各种农业场景(即种子处理剂浓度/种子×种植的种子密度/公顷)。因此,如果利用具有1×10
表20:针对种子处理剂实施例的总CFU/公顷计算
对于沟内实施例,本公开的微生物可以以下cfu浓度/公顷施用:1×10
在一些方面,沟内组合物含于液体调配物中。在液体沟内实施例中,微生物可以以下cfu浓度/毫升存在:1×10
候选微生物的转录组谱分析
本发明人的先前工作需要对菌株CI010进行转录组谱分析,以鉴别在环境氮存在下具有活性的启动子。菌株CI010在补充有10mM谷氨酰胺的确定的无氮培养基中培养。从这些培养物中提取总RNA(凯杰(QIAGEN)RNeasy试剂盒),并且使其通过启迪公司(Illumina)HiSeq(SeqMatic,加利福尼亚州弗里蒙特)进行RNAseq测序。使用Geneious将测序读段映射到CI010基因组数据,并且鉴别在近端转录启动子控制下的高度表达基因。
表21-23列出了如通过总RNA的RNASeq测序测量的基因和其相对表达量。记录近端启动子的序列以用于诱变nif路径、氮利用相关路径或具有所需表达量的其它基因。
表21
表22
表23
表24-菌株的表
实例
出于说明本公开的各种实施例的目的给出以下实例,并且并不意图以任何方式限制本公开。所属领域的技术人员将认识到涵盖于如由权利要求书范围限定的本公开精神内的其中变化和其它用途。
引导微生物重塑(GMR)平台的实施例的示例概述可概括于图1A的示意图中。
图1A说明可以首先表征微生物组的组合物并且鉴别目的物种(例如以发现具有适当定殖特征的微生物)。
可以绘制目的物种的代谢并且将其与遗传学相联系。例如,可以表征微生物的固氮路径。可以在一系列环境条件下检查正表征的路径。例如,可以检查微生物在各种水平的外源性氮存在下在其环境中固定大气氮的能力。氮的代谢可能涉及通过AmtB转运蛋白使氨(NH
之后,可以使用包含但不限于缀合和重组、化学诱变、适应性进化以及基因编辑的方法将靶向非属间基因组更改引入微生物的基因组。靶向非属间基因组更改可以包含基因组的插入、破坏、缺失、更改、微扰、修饰等。
随后将衍生物重塑的微生物用于接种作物,所述微生物包括由重塑的基础基因型产生的所需表型。
在某些实施例中,本公开提供能够固定大气氮并且将此类氮供应到植物的非属间重塑微生物。在各方面,甚至在存在外源性氮的情况下,这些非属间重塑微生物能够固定大气氮。
图1B描绘微生物组步骤的测量的展开视图。在一些实施例中,本公开发现具有所需定殖特征的微生物物种,且随后在后续重塑过程中利用那些物种。
现将以更特定的方式描述前述引导微生物重塑(GMR)平台。
在各方面,GMR平台包括以下步骤:
A.分离-从目的作物植物的土壤、根际、表面等获得微生物;
B.表征-涉及表征经分离微生物的目的基因型/表型(例如基因组序列、定殖能力、固氮活性、P溶解能力、目的代谢物的排泄、植物促进化合物的排泄等)
C.驯化-开发用于微生物的非属间遗传修饰的分子方案;
D.非属间工程改造活动和优化-生成在关键路径中具有遗传修饰(例如定殖相关基因、固氮/同化基因、P溶解基因)的衍生物非属间微生物菌株;
E.分析-评估体外(例如ARA分析)和植物内(例如定殖分析)所衍生非属间菌株的目的表型。
F.反复工程改造活动/分析-反复步骤D和E以进一步改良微生物菌株。
GMR平台过程步骤中的每一者现将在下文详细说明。
A.微生物的分离
1.获得土壤样品
微生物将从植物的土壤和/或根部分离。在一个实例中,植物将在实验室或温室中在小罐中生长。土壤样品将从各种农业领域获得。例如,可收集具有不同质地特征的土壤,包含壤土(例如泥炭粘土壤土、砂质壤土)、粘土土壤(例如重粘土、粉质粘土)、砂质土壤、粉质土壤、泥炭土壤、白垩质土壤等。
2.生长诱饵植物(bait plant)
诱饵植物(目的植物)(例如玉米、小麦、水稻、高粱、小米、大豆、蔬菜、果实等)的种子将种植到每种土壤类型中。在一个实例中,将在不同土壤类型中种植不同种类的诱饵植物。例如,如果目的植物是玉米,那么将在上文所描述的各种土壤类型中种植不同种类的玉米(如饲料玉米、甜玉米、传统玉米等)的种子。
3.收获土壤和/或根部样品并接种于适当培养基上
将通过在数周(例如2-4周)生长之后进行根除来收获植物。作为在实验室/温室中生长植物的替代方案,目的植物的土壤和/或根部可直接从具有不同土壤类型的区域收集。
为了分离根际微生物和附生植物,将通过用蒸馏水使土壤饱和或用手轻轻地使土壤松散来轻轻地移出植物以避免根部的损坏。如果存在较大土壤粒子,那么将通过使根部浸没在再一池的蒸馏水中和/或通过使根部轻轻地振荡来去除这些粒子。将切割根部,并且将通过使根部放入具有少量蒸馏水的培养盘或管中且使培养盘/管在振荡器上轻轻地振荡或在低速下使管离心来制备粘附到根部的土壤的浆料。此浆料将如下文所描述进行处理。
为了分离内生菌,将用去离子水去除根部表面上的过量土壤。去除土壤后,将对植物进行表面灭菌,并且将其在无菌水中剧烈冲洗。将从植物上切下清洁的1cm根部区段,并且将其放入含有3mm钢珠的磷酸盐缓冲盐水溶液中。将通过用凯杰(Qiagen)组织裂解器(组织裂解器(TissueLyser)II)剧烈振荡溶液来生成浆料。
取决于待分离微生物所需的植物有益性状,可以各种方式处理土壤和/或根部浆料。例如,可将土壤和根部浆料稀释并且接种到各种类型的筛选培养基上,以分离根际微生物、内生微生物、附生微生物和其它与植物相关的微生物。例如,如果所需的植物有益性状是固氮,那么土壤/根部浆料将被接种于无氮培养基(例如Nfb琼脂培养基)上以分离固氮微生物。类似地,为了分离磷酸盐溶解细菌(PSB),可使用含有磷酸钙作为唯一磷源的培养基。PSB可以溶解磷酸钙并且同化且释放较高量的磷。这一反应在培养盘上表现为晕圈或透明区域,且可用作用于分离PSB的初始步骤。
4.挑选菌落、纯化培养物并筛选目的基因的存在
对在步骤A3中获得的微生物群体进行划线以获得单一菌落(纯培养物)。使纯培养物的一部分再悬浮于合适的培养基(例如R2A与甘油的混合物)中,并且对其进行PCR分析以筛选一或多种目的基因的存在。例如,为了鉴别固氮细菌(固氮生物),可以对经分离微生物的纯化培养物进行PCR分析以检测nif基因的存在,所述基因编码将大气固氮成可供活生物体使用的氮形式过程中所涉及的酶类。
5.存库经纯化培养物
将存储经分离菌株的经纯化培养物,例如在-80℃下存储,以用于未来参考和分析。
B.经分离微生物的表征
1.种系发生表征和全基因组测序
将分析经分离微生物的种系发生表征(属和物种的指配)并且将测序所述微生物的全基因组。
对于种系发生表征,将使用简并16S rDNA引物对经分离微生物的16S rDNA进行测序以生成种系发生一致性。16S rDNA序列读段将映射到数据库以初始地指配经分离微生物的属、物种和菌株名称。全基因组测序用作将种系发生属/物种指配到微生物的最终步骤。
将对经分离微生物的全基因组进行测序以鉴别关键路径。对于全基因组测序,将使用基因组DNA分离试剂盒(例如,来自凯杰的QIAmp DNA微型试剂盒)分离基因组DNA并且将使用所属领域中已知的方法制备总DNA库。将使用所属领域中已知的高通量测序(也称为下一代测序)方法对全基因组进行测序。例如,启迪公司(Illumina,Inc.)、罗氏(Roche)和太平洋生物科学(Pacific Biosciences)提供可以用于制备总DNA库并且进行全基因组测序的全基因组测序工具。
将组装每个经分离菌株的全基因组序列;将鉴别目的基因;标注;并且将其注为用于重塑的潜在目标。全基因组序列将存储在数据库中。
2.分析在温室中定殖宿主植物的微生物
经分离微生物将以在温室中定殖宿主植物来表征。对此,所需宿主植物(例如玉米、小麦、水稻、高粱、大豆)的种子将用单独或组合的经分离微生物的培养物接种,且将其种植到土壤中。可替代地,单独或组合的经分离微生物的培养物可以通过将土壤直接接种在根部上而施用到宿主植物的根部。微生物的定殖潜能将例如使用下文更详细描述的定量PCR(qPCR)方法来分析。
3.在小规模田地试验中分析用于定殖宿主植物的微生物并且从所定殖根部样品中分离RNA(CAT试验)
将在小规模田地试验中评定定殖所需宿主植物的经分离微生物。另外,将从所定殖根部样品中分离RNA以获得菌株在田地环境中的转录组数据。这些小规模田地试验在本文中被称为CAT(定殖和转录)试验,因为这些试验提供菌株在田地环境中的定殖和转录数据。
对于这些试验,宿主植物(例如玉米、小麦、水稻、高粱、大豆)的种子将使用单独或组合的经分离微生物的培养物接种,且将其种植到土壤中。可替代地,单独或组合的经分离微生物的培养物可以通过将土壤直接接种在根部上而施用到宿主植物的根部。CAT试验可以在多种土壤中和/或在各种温度和/或水分条件下进行以评定定殖潜能以及获得微生物在各种土壤类型中和各种环境条件下的转录组概况。
将例如使用如下文所描述的qPCR方法评估所接种微生物对宿主植物根部的定殖。
在一个方案中,如下评估经分离微生物的定殖潜能。在种植玉米种子后一天,将1ml微生物过夜培养物(SOB培养基)在种子所位于的准确位置处浸透。1mL的这种过夜培养物大致等效于约10^9cfu,在彼此3倍内变化,这取决于正使用何种菌株。每株幼苗每周用补充有2.5mM或0.25mM硝酸铵的50mL经修饰的霍格兰氏溶液(Hoagland's solution)施肥3次。种植后四周时,收集根部样品用于DNA提取。使用加压的喷水将土壤残渣冲洗掉。随后使用凯杰Tissuelyzer将这些组织样品均质化,并且随后根据所推荐的方案使用QIAmp DNA微型试剂盒(凯杰)提取DNA。使用Stratagene Mx3005P RT-PCR使用引物对这些DNA提取物进行qPCR分析,所述引物经设计(使用NCBI的Primer BLAST)以对微生物的基因组中的每一者中的基因座具有特异性。
对微生物的基因组副本的存在进行定量,这反映微生物的定殖潜能。通过对PCR扩增产物进行测序来确认微生物物种的一致性。
另外,将从所定殖的根部和/或土壤样品中分离RNA且进行测序。
不同于DNA概况,RNA概况取决于环境条件而变化。因此,测序从所定殖的根部和/或土壤分离的RNA将反映根际中植物内的基因的转录活性。
可在不同时间点从所定殖根部和/或土壤样品分离RNA以分析所定殖微生物在这些时间点处的RNA概况的变化。
例如,可以在田地的施肥之后立刻和在田地的施肥之后数周从所定殖的根部和/或土壤样品中分离RNA,并且进行测序以生成相对应的转录概况。
类似地,可以在高磷酸盐和低磷酸盐条件下进行RNA测序以了解在这些条件下何种基因在转录上具有活性或被抑制。
用于转录组/RNA测序的方法为所属领域中已知的。简单来说,将从经分离微生物的经纯化培养物分离总RNA;将使用逆转录酶制备cDNA;且将使用上文所描述的高通量测序工具对cDNA进行测序。
可以将来自转录组分析的测序读段映射到基因组序列并且可以鉴别目的基因的转录启动子。
4.分析经分离微生物的植物有益活性
将评估经分离微生物的植物有益活性。
例如,将使用乙炔还原分析(ARA)来分析固氮微生物的固氮活性或将分析磷酸盐溶解微生物的磷酸盐溶解作用。可利用目的任何参数并且可开发针对此活性的适当分析。举例来说,分析可包含定殖度量值的增长曲线和对于产生植物激素(如吲哚乙酸(IAA)或赤霉素)的分析。可以开发对于目的任何植物有益活性的分析。
这一步骤将确认目的表型并且消除任何假阳性。
5.从经分离微生物选择潜在候选物
以上步骤中生成的数据将用于选择微生物以用于进一步开发。例如,将选择显示定殖潜能、植物有益活性和/或相关DNA和RNA概况的所需组合的微生物以用于驯化和重塑。
C.所选择的微生物的驯化
将驯化所选择的微生物;其中,所述微生物将转换为可遗传控制且可鉴别的形式。
1.抗生素敏感性测试
驯化微生物的一种方式是对具有抗生素抗性的所述微生物进行工程改造。对此,将测试野生型微生物菌株对各种抗生素的敏感性。如果菌株对抗生素敏感,那么所述抗生素可以是以供重塑菌株的基因工具/载体使用的良好候选物。
2.设计和构建载体
将构造对于载体复制具有条件性的所述载体(例如自杀质粒)以驯化所选择的微生物(宿主微生物)。例如,将构造自杀质粒,所述自杀质粒含有适当抗生素抗性标记物、反向选择标记物、在供体微生物(例如大肠杆菌)中维持的复制起点、编码荧光蛋白(GFP、RFP、YFP、CFP等)以通过荧光筛选插入的基因、缀合到宿主微生物的转移起点和包括与宿主基因组同源臂的具有所需基因变异的多核苷酸序列。载体可包括SceI位点和其它额外元素。
示例性抗生素抗性标记物包含氨苄青霉素抗性标记物、卡那霉素抗性标记物、四环素抗性标记物、氯霉素抗性标记物、红霉素抗性标记物、链霉素抗性标记物、壮观霉素抗性标记物等。示例性反向选择标记物包含sacB、rpsL、tetAR、pheS、thyA、lacY、gata-1、ccdB等。
3.供体微生物的生成
在一个方案中,自杀质粒将转化成大肠杆菌ST18(胺基乙酰丙酸的营养缺陷体,ALA)以生成供体微生物,所述自杀质粒含有适当抗生素抗性标记物、反向选择标记物、在含有pir复制起始子基因的大肠杆菌ST18中维持的λpir复制起点、编码绿色荧光蛋白(GFP)以通过荧光筛选插入的基因、缀合到宿主微生物的转移起点和包括与宿主基因组同源臂的具有所需基因变异的多核苷酸序列(例如来自微生物自身基因组内的用于插入到异源位置中的启动子)。
4.混合供体微生物与宿主微生物
供体微生物将与宿主微生物(来自步骤B5的所选择候选微生物)混合以允许质粒缀合性整合到宿主基因组中。供体与宿主微生物的混合物将接种于含有所述抗生素且不含有ALA的培养基上。自杀质粒能够在供体微生物(大肠杆菌ST18)中复制,但不能在宿主中复制。因此,当含有供体和宿主微生物的混合物接种于含有所述抗生素且不含有ALA的培养基上时,仅将质粒整合到宿主细胞基因组中的所述宿主细胞将能够在培养基上生长且形成菌落。由于不存在ALA,供体微生物将不会生长。
5.确认载体的整合
将通过培养盘上的菌落的荧光和使用菌落PCR确认在宿主微生物的预期基因座处的自杀质粒的恰当整合,所述自杀质粒含有荧光蛋白标记物、抗生素抗性标记物、反向选择标记物等。
6.划线确认整合菌落
宿主微生物中的第二轮同源重组将环出(去除)质粒主链,使得所需基因变异(例如来自微生物自身基因组内的用于插入到异源位置中的启动子)整合到一定百分比的宿主微生物的宿主基因组中,同时使一定百分比恢复回野生型。
可以通过在适当的培养基上使宿主微生物菌落生长来选择已经环出质粒主链(并且因此环出反向选择标记物)的所述宿主微生物菌落。
例如,如果将sacB用作反向选择标记物,那么将通过在含有蔗糖的培养基上使菌落生长来测试由于质粒主链损失引起的此标记物的损失(sacB赋予对蔗糖的敏感性)。在此培养基上生长的菌落将损失sacB标记物和质粒主链,且将含有所需基因变异或恢复到野生型。并且,由于荧光蛋白标记物的损失,这些菌落将不会在培养盘上发荧光。
在一些分离物中,sacB或其它反向选择标记物并不赋予蔗糖或其它反向选择机制充分敏感性,这使得筛选大量菌落以分离成功的环出物(loop-out)成为必要。在那些情况下,可以通过使用在宿主细胞中独立地复制并且表达识别整合式自杀质粒主链中的位点的限制性核酸内切酶(例如SceI)的“辅助质粒”来帮助环出。具有整合式自杀质粒的菌株用辅助质粒转化,所述辅助质粒含有抗生素抗性标记物、与宿主菌株兼容的复制起点和编码由组成型或诱导型启动子控制的限制性核酸内切酶的基因。通过限制性核酸内切酶在整合式质粒主链中诱导的双链断裂促进同源重组以环出自杀质粒。这会增加反向选择培养盘上的环出菌落的数目并且减少需要筛选以发现含有所需突变的菌落的菌落的数目。随后在没有针对质粒进行抗生素选择的情况下,通过培养和连续传代从菌株中去除辅助质粒。针对单一菌落对传代的培养物进行划线,挑选菌落并筛选对用于选择辅助质粒的抗生素具有敏感性的菌落,以及通过菌落PCR确认不存在质粒。最后,对基因组进行测序并且如D6中所描述确认不存在辅助质粒DNA。
7.通过菌落PCR确认基因变异的整合
将挑选在含有蔗糖的培养基(或取决于所使用的反向选择标记物的其它适当培养基)上较好地生长的菌落,且将通过使用菌落PCR筛选菌落来确认在预期基因座处基因变异的存在。
尽管此实例描述了一个用于驯化微生物和将基因变异引入到微生物中的方案,但所属领域的普通技术人员将理解,可以使用所属领域中已知的多种其它技术将基因变异引入到所选择的微生物中,所述其它技术如:聚合酶链反应诱变、寡核苷酸-定向诱变、饱和诱变、片段改组诱变、同源重组、ZFN、TALENS、CRISPR系统(Cas9、Cpf1等)、化学诱变和其组合。
8.对于步骤C2-C7的反复
如果步骤C2-C7中的任一个未能提供预期结果,那么将重复所述步骤以设计可包括用于促进将所需基因变异和标记物并入到宿主微生物中的不同元素的替代性载体。
9.开发标准操作程序(SOP)
一旦步骤C2-C7可针对给定菌株不断地再现,则所述步骤将用于开发用于所述菌株和载体的标准操作程序(SOP)。这一SOP可以用于改良微生物的其它植物有益性状。
D.非属间工程改造活动和优化
1.鉴别用于优化的基因目标
所选择的微生物将经工程改造/重塑以改良植物有益活性的性能。对此,将鉴别用于改良植物有益活性的基因靶标。
可以不同方式鉴别基因靶标。例如,可以鉴别目的基因,同时标注来自经分离微生物的全基因组测序的基因。可以通过文献检索来鉴别这些基因。例如,固氮中所涉及的基因在文献中是已知的。这些已知基因可以用作引入基因变异的靶标。还可以基于在步骤B3(用于定殖的小规模田地试验)中获得的RNA测序数据或通过进行下文步骤中描述的RNA测序来鉴别基因靶标。
2.选择用于启动子交换的启动子
用于改良植物有益活性的所需基因变异可包括启动子交换,其中靶基因的天然启动子由来自微生物基因组内的更强或更弱启动子(当与天然启动子相比时)或以不同方式调节的启动子(例如,N-独立型)替换。如果靶基因的表达增加了植物有益活性(例如nifA,其表达增强了微生物中的固氮),那么用于启动子交换的所需启动子是与靶基因的天然启动子相比会进一步增加靶基因的表达量的更强启动子(与所述天然启动子相比)。如果靶基因的表达降低了植物有益活性(例如下调固氮的nifL),则用于启动子交换的所需启动子是与靶基因的天然启动子相比会显著降低靶基因的表达量的弱启动子(与所述天然启动子相比)。可以将启动子插入到基因中以“敲除”基因表达,而同时上调下游基因的表达。
可基于RNA测序数据而选择用于启动子交换的启动子。例如,可使用RNA测序数据以鉴别强和弱启动子或组成型活性与诱导型启动子。
例如,为了鉴别强和弱启动子或组成型活性与诱导型启动子,在固氮路径中,所选择的微生物将在贫氮和足氮条件下在体外培养;微生物的RNA将从这些培养物中分离;并且进行测序。
在一个方案中,将比较在贫氮和足氮条件下微生物的RNA概况并且将鉴别具有所需转录水平的活性启动子。可选择这些启动子以交换弱启动子。
还可使用步骤B3中获得的RNA测序数据选择启动子,所述步骤反映宿主植物根际中植物内的微生物的RNA概况。
在不同条件下的RNA测序允许选择以下启动子:a)在施肥的田地条件下在宿主植物生长周期期间在根际中具有活性,以及b)在相关体外条件下也具有活性,因此这些启动子可以被快速筛选。
在示例性方案中,来自定殖分析(例如步骤B3)的植物内RNA测序数据用于测量经分离微生物中基因的表达量。在一个实施例中,基因表达量被计算为每千碱基的转录每百万映射读取的读数(RPKM)。将不同基因的表达水平与靶基因的表达量进行比较,并且选择与各种基因相关的、显示出与靶基因相比的最高或最低表达量的至少前10、20、30、40、50、60或70个启动子作为用于启动子交换的可能候选物。因此,人们观察相对于靶基因的各种基因的表达量,且随后选择相对于靶(或标准)基因表现出增加的表达的基因,且随后发现与所述基因相关的启动子。
例如,如果靶基因上调nifA,那么选择显示出与nifA相比的最高表达量的基因的前10、20、30、40、50或60个启动子作为用于启动子交换的可能候选物。
这些候选物可以进一步基于体外RNA测序数据进行决选(short-listed)。例如,对于作为靶基因的nifA,基于植物内RNA测序数据而选择的可能启动子候选物通过在体外贫氮与足氮条件下选择具有与nifA相比类似或增加的基因表达量的启动子来进一步选择。
在此步骤中所选择的启动子组用于交换靶基因(例如nifA)的天然启动子。在体外分析中测试具有被交换启动子的重塑菌株;消除具有低于预期活性的菌株;且在田地测试具有预期或高于预期活性的菌株。启动子选择的循环可以在重塑菌株上重复进行以进一步改良其植物有益活性。
此处描述了一种示例性启动子交换实验,所述实验是基于来自变栖克雷伯菌(Klebsiella variicola)菌株CI137的植物内和体外RNA测序数据进行的,以改善固氮性状。在ARA分析中,在0mM和5mM谷氨酰胺浓度下分析CI137,并且从这些ARA样品中提取RNA。经由NextSeq测序RNA,并且将来自一个样品的读数子集映射到CI137基因组(体外RNA测序数据)。在CI137的定殖和活性分析(例如步骤B3)中,在V5阶段从玉米植物的根部提取RNA。合并来自六个植物的样品;使用NextSeq对来自合并样品的RNA进行测序,并且将读数映射到CI137基因组(植物内RNA测序数据)。在2×10
所属领域的普通技术人员将从以上实例了解,尽管植物内和/或体外RNA测序数据可用于选择用于启动子交换的启动子,但启动子选择的步骤是高度不可预测的且涉及许多挑战。
例如,植物内RNA测序主要揭露高度表达的基因;然而,难以检测基因表达的细小差异和/或具有低表达量的基因。举例来说,在一些植物内RNA测序实验中,检测来自微生物基因组的约5000个基因中的仅约40个基因。因此,植物内RNA测序技术可用于鉴别丰度表达的基因和其相应启动子;然而,所述技术难以鉴别低表达基因和相应启动子以及基因表达之间的小差异。
此外,植物内RNA概况反映在分离微生物时的基因的状态;然而,田地条件的略微变化可实质上改变根际/附生/内生微生物的RNA概况。因此,难以事先预测基于一个田地试验的RNA测序数据而选择的启动子是否会在体外和田地测试重塑菌株时提供靶基因的所需表达量。
另外,植物内评估是费时且费资源的;因此,植物内实验无法频繁地进行和/或快速或容易地重复。另一方面,虽然可以相对快速且容易地进行体外RNA测序,但体外条件并不能模拟田地条件,并且可以显示体外高活性的启动子可能并不显示植物内的相当活性。
此外,启动子常常不如在新情形下所预测的那样表现。因此,植物内和体外RNA测序数据充其量只能充当启动子选择步骤中的起始点;然而,在某些情况下,到达会在田地提供靶基因的所需表达量的任何特定启动子是不可预测的。
启动子选择步骤中的另一限制为可供使用的启动子的数目。因为本发明的目标之一是提供非转基因微生物;用于启动子交换的启动子需要选自微生物的基因组或属内。因此,不同于转基因方法,本发明方法不能仅仅去查阅文献还要发现/使用来自不同宿主生物体的表征良好的转基因启动子。
另一约束是启动子在所需生长期期间必须具有植物内的活性。例如,对于植物内的氮的最高要求一般在生长季晚期,例如晚期营养期和早期生殖期。例如,在玉米中,氮吸收在V6(六叶)到R1(生殖阶段1)阶段期间是最高的。因此,为了增加氮在玉米的V6到R1阶段期间的可用性,重塑微生物必须在玉米生命周期的这些阶段期间显示最高的固氮活性。相应地,需要选择在玉米的晚期营养和早期生殖阶段期间具有植物内活性的启动子。这一约束不仅减少可在启动子交换中测试的启动子的数目,而且使启动子选择的步骤不可预测。如上文所论述,产生不可预测性,部分是因为尽管来自小规模田地试验(例如步骤B3)的RNA测序数据可用于鉴别在所需生长阶段期间具有植物内活性的启动子,但RNA数据是基于样品收集时的田地条件(例如,土壤的类型、土壤中的水位、可用氮的含量等)。如所属领域的普通技术人员将理解,田地条件可能在同一田地内经一段时间而改变,并且还在各种田地中有实质上改变。因此,在一个田地条件下所选择的启动子可能不如在其它田地条件下所预期的那样表现。类似地,所选择的启动子可能不如在交换之后所期望的那样表现。因此,事先难以预料所选择的启动子是否会在目的植物的所需生长期期间具有植物内活性。
3.设计非属间基因变异
基于步骤D1(基因靶标的鉴别)和D2(用于启动子交换的启动子的鉴别),将设计非属间基因变异。
术语“非属间”指示待引入到宿主中的基因变异不含有来自宿主属外部的核酸序列(即,无转基因DNA)。尽管载体和/或其它基因工具将用于将基因变异引入到宿主微生物中,但本公开的方法包含环出(去除)引入到宿主微生物中的主链载体序列或其它基因工具从而仅使得所需基因变异引入到宿主基因组中的步骤。因此,所得微生物是非转基因的。
示例性非属间基因变异包含目的基因中的突变,其可改进由所述基因编码的蛋白质的功能;组成型活性启动子,其可替换目的基因的内源性启动子以增加基因的表达;将使目的基因失活的突变;将启动子从宿主的基因组内插入到异源性位置中,例如将启动子插入到导致所述基因失活并且上调下游基因的基因中;等等。突变可以是点突变、插入和/或缺失(基因的完全或部分缺失)。例如,在一个方案中,为了改善宿主微生物的固氮活性,所需基因变异可包括nifL基因(固氮路径的负调节因子)的失活性突变和/或包括将nifH基因(催化固定大气氮的关键反应的固氮酶铁蛋白)的内源性启动子替换为组成型驱动nifH基因表达的组成型活性启动子。
4.生成非属间衍生物菌株
在设计非属间基因变异之后,将进行步骤C2-C7以生成非属间衍生物菌株(即重塑微生物)。
5.存库重塑微生物的经纯化培养物
将在库中保存重塑微生物的经纯化培养物,使得可以针对下文所描述的全基因组测序提取gDNA。
6.确认所需基因变异的存在
将提取重塑微生物的基因组DNA并且将使用先前所描述的方法对基因组DNA进行全基因组测序。所得读数将映射到先前存储于LIMS中的读数以确认:a)所需基因变异的存在,和b)完全不存在映射到用于生成重塑微生物的载体序列(例如质粒主链或辅助质粒序列)的读数。
这一步骤允许非宿主属DNA(转基因DNA)的敏感性检测,所述DNA可以在环出载体主链(例如自杀质粒)方法之后保留于菌株中且可以提供对基因变异的偶然脱靶插入的控制等。
E.对于重塑微生物的分析
1.对植物有益活性的分析
将体外评估重塑微生物的植物有益活性和生长动力学。
例如,将通过乙炔还原分析、铵排泄分析等评估重塑用于改善固氮功能的菌株的固氮活性和适合度。
将评估重塑用于改善的磷酸盐溶解的菌株的磷酸盐溶解活性。
这一步骤允许针对目的表型快速、中等到高通量筛选重塑菌株。
2.对经更改基因的定殖和转录的分析
将使用B3中描述的步骤评估重塑菌株在温室中或在田地中对宿主植物的定殖。另外,将从所定殖的根部和/或土壤样品中分离RNA并且对其测序以分析靶基因的转录活性。靶基因包括含有所引入的基因变异的基因并且还可以包括在微生物的植物有益性状中起作用的其它基因。
例如,基因(nif基因)簇控制微生物的固氮活性。使用上文所描述的方案,基因变异可以引入到nif基因中的一者中(例如启动子插入),而nif簇中的其它基因呈其内源性形式(即其基因序列和/或启动子区并未更改)。RNA测序数据将针对含有基因变异的nif基因的转录活性进行分析,并且还可以针对未因所插入基因变化而直接更改但仍然可能受所引入基因变化的影响的其它nif基因进行分析。
这一步骤允许确定根际中体外表现最好的菌株的适合度并且允许测量植物内经更改基因的转录活性。
F.反复工程改造活动/分析
来自体外和植物内分析(步骤E1和E2)的数据将用于反复地堆叠有益突变。
此外,可以重复上文所描述的步骤A-E以微调微生物的植物有益性状。例如,将使用在第一轮中重塑的微生物菌株接种植物;在数周生长之后收获;并且将分离来自土壤和/或植物根部的微生物。将表征经分离微生物的功能活性(植物有益性状和定殖潜能)以及DNA和RNA概况,以便选择具有改善的植物有益活性和定殖潜能的微生物。所选择的微生物将被重塑以进一步改善所述植物有益活性。将针对所述功能活性(植物有益性状和定殖潜能)以及体外和植物内RNA概况对重塑微生物进行筛选,并且将选择表现最好的菌株。如需要,可以重复步骤A-E以进一步改善来自第二轮的重塑微生物的植物有益活性。所述过程可重复1、2、3、4、5、6、7、8、9、10或更多轮。
上文所描述的示例性步骤概述于以下表A中。
表A-引导微生物重塑平台的实施例的概述
不同于野生型(WT)微生物的纯生物勘探或转基因方法,GMR允许对微生物内的关键调节网络进行非属间基因优化,这改善对于WT微生物的植物有益表型,但不存在与转基因方法相关的风险(例如,不可预测的基因功能、公共和监管问题)。关于有问题的“传统生物勘探”方法的描述,参见图1C,所述方法与所教示的GMR平台相比具有若干缺点。
用于开发农业微生物的其它方法集中于广泛的实验室开发(其常常在田地规模下失败),或在不理解基础机制/植物-微生物相互作用情况下的广泛的温室或“田地优先(field-first)”测试。关于有问题的“田地-第一种生物勘探方法(field-first approachto bioprospecting)”系统的描述,参见图1D,所述方法与所教示的GMR平台相比具有若干缺点。
GMR平台的一个优势为鉴别活性启动子,所述启动子在对于目标作物来说关键的生理学重要时间下具有活性,并且所述启动子在特定的农业相关的环境条件下也具有活性。
如已解释,在固氮的情形下,GMR平台能够鉴别微生物启动子序列,所述微生物启动子序列在升高的外源性氮的环境条件下具有活性,由此允许重塑微生物在现代农业中耕作物条件下以及在植物最需要固定氮的时候固定大气氮并将其输送到目标作物植物中。关于玉米生长周期中的时间段的描述,参见图1E,在所述时间段中,植物最需要氮。所教示的GMR平台能够产生重塑微生物,所述重塑微生物在需要氮的时间段向玉米植物供应氮并且即使在土壤环境中存在外源性氮的情况下也能输送此类氮。
这些启动子可以通过根际RNA测序和将读数映射到微生物基因组序列来鉴别,并且关键路径可以被“再编程”以在植物生长周期的关键阶段期间打开或关闭。另外,通过对经优化微生物进行全基因组测序和与先前转化的序列的映射,所述方法能够确保没有转基因序列会由于质粒DNA的脱靶插入、PCR未检测到的质粒的低含量保留或抗生素抗性而偶然地释放到田地。
GMR平台通过反复地在实验室和植物环境中评估微生物来组合这些方法,从而产生在温室和田地条件中而非仅在实验室条件中稳健的微生物。
可在图1F-1I中发现所教示的GMR平台的各种方面和实施例。GMR平台在衍生/产生/生产具有植物有益特性(例如固氮)的重塑微生物方面表现极好。
传统生物勘测方法不能够产生具有前述特性的微生物。
在重塑微生物用于固氮的情形下,存在重塑微生物可能具有的若干特性。举例来说,图1J描绘本公开的重塑微生物可能具有的五个特性。
此外,如实例2中可以看出,本发明人已利用GMR平台以产生能够固定大气氮并且即使在外源性氮存在于环境中的条件下也将所述氮输送到玉米植物的重塑非属间细菌(即甘蔗科萨克氏菌(Kosakonia sacchari))。参见图1K-M,其说明所述重塑过程成功地:(1)使nifA表达与内源性氮调节解耦;以及(2)改善固定氮的同化和排泄。
当施用至玉米作物时,这些重塑微生物最终引起玉米产量的改良。参见图1N。
如先前所解释,由工业哈伯-博世法产生的氮肥并未被目标作物很好地利用。降雨、径流、加热、挥发和土壤微生物组会降解所施用的化肥。这相当于不仅浪费了金钱,而且还增加了污染而没有增加所收获的产量。为此,联合国已计算出几乎80%的肥料在作物可利用其之前已损失。因此,现代农业肥料的生产和输送不仅对环境有害,而且其效率极低。参见图1O,其说明当前氮输送系统的低效,所述系统产生施肥不足的田地、过度施肥的田地和对环境有害的氮径流。
当前GMR平台和所得重塑微生物提供将固氮和输送到植物的较好方法。如将在以下实例中看到,本公开的非属间重塑微生物能够定殖玉米植物的根部并且即使在存在外源性氮的情况下也用固定的大气氮灌输所述玉米植物。通过所教示的GMR平台能够实现的固氮和递送的这一系统将帮助现代农业转化成环境更可持续系统。
多种固氮细菌可以发现于自然界中,包含农业土壤中。然而,微生物向作物提供足够的氮以减少肥料使用的潜能可能受到施肥土壤中固氮酶基因的抑制以及与作物根部紧密相关的低丰度的限制。与关键商业作物紧密相关的微生物的鉴别、分离和育种可能会破坏和改善将氮感测和固氮联系起来的调节网络,并发掘与作物相关的微生物的重要氮贡献。为此,鉴别与玉米的根部系统相关且定殖其的固氮微生物。这一步骤对应于图1A和图1B中所描绘的“测量微生物组组合物”。
收集来自农艺学相关土壤中生长的玉米植物的根部样品,并且从根际和内球提取微生物种群。提取来自这些样品的基因组DNA,之后进行16S扩增子测序以描绘群落组合物的概况。
甘蔗科萨克氏菌微生物(菌株PBC6.1)经分离且通过16S rRNA和全基因组测序进行分类。这是一种尤其令人感兴趣的能够定殖到根部相关微生物群(图2)的几乎21%丰度的固氮物。为了评估菌株对外源性氮的敏感性,用经典乙炔还原分析(ARA)和不同含量的谷氨酰胺补充测量纯培养物中的固氮速率。物种在无氮培养基中展现高水平的固氮活性,但外源性固定氮抑制nif基因表达和固氮酶活性(菌株PBC6.1,图3C、图3D)。另外,当在固氮条件下生长的PBC6.1的上清液中测量释放的氨时,可检测到极少的固定氮的释放(图3E)。
我们假设,如果控制氮代谢的调节网络被重塑以允许在存在固定氮的情况下的最优固氮酶表达和氨释放,那么PBC6.1可以是在施肥田中的固定氮的重要促成因素。
充分的基因多样性应存在于PBC6.1基因组内以实现广泛的表型重塑(作为以非属间方式重塑基础基因架构的结果)而无需插入转基因或合成调节因子。分离的菌株具有至少5.4Mbp的基因组和典型固氮基因簇。PBC6.1中的相关氮代谢路径与用于固氮的模式生物体(产酸克雷伯菌(Klebsiella oxytoca)m5al)的那些类似。
鉴别了若干基因调节网络节点,其可加强固氮且将所述氮连续输送到宿主植物中,尤其以高外源性浓度的固定氮形式(图3A)。nifLA操纵子通过NifA引起的转录活化和NifL对NifA的氮及氧依赖性抑制来直接调节nif簇的其余部分。nifL的破坏可以取消NifA的抑制并且在氧和外源性固定氮两者存在下改善nif表达。此外,在不依赖氮的启动子的控制下表达nifA可以使固氮酶生物合成与NtrB/NtrC氮感测复合物的调节解耦。
微生物通过谷氨酰胺合成酶(GS)将固定氮同化为谷氨酰胺,分别通过GS的腺苷酰化和脱腺苷酰化而由双结构域腺苷酰基转移酶(ATase)酶GlnE可逆调节,以减弱和恢复活性。截断GlnE蛋白以使其去腺苷酰基(AR)结构域缺失可能导致组成型腺苷酰化谷氨酰胺合成酶限制微生物的氨同化并且增加胞内和胞外氨。
最后,减少AmtB(负责吸收氨的转运蛋白)的表达可能产生更多的胞外氨。
为了在不使用转基因的情况下生成合理设计的微生物表型,采用了两种方法来重塑微生物的基础基因架构:(1)使得编码蛋白质结构域或整个基因的基因组序列的无标记物缺失以及(2)通过基因组内启动子重排来重新铺设调节网络。
通过反复重塑过程,生成PBC6.1的数种非转基因衍生物菌株(表25)。
表25.此研究中使用的经分离和衍生甘蔗科萨克氏菌菌株的列表。Prm,衍生自PBC6.1基因组的启动子序列;ΔglnE
进行若干体外分析以表征衍生物菌株的特定表型。ARA用于评估菌株对外源性氮的敏感性,其中PBC6.1在高谷酰胺浓度下展现出固氮酶活性的抑制(图3D)。相比之下,大多数衍生物菌株在高谷氨酰胺浓度下显示出具有所观察到的不同程度的乙炔还原的去抑制表型。通过qPCR分析的样品中nifA的转录速率与乙炔还原速率充分相关(图4),这支持了nifL破坏和将不依赖氮的启动子插入以驱动nifA可能导致nif簇去抑制作用的假设。
与不具有这些突变的野生型或衍生物菌株相比,具有经更改GlnE或AmtB活性的菌株显示出显著增加的铵排泄速率(图3E),这说明这些基因型对氨同化和再吸收的影响。
进行两个实验以研究PBC6.1衍生物(重塑微生物)与玉米植物的相互作用并且对将固定氮并入到植物组织中进行定量。首先,使用同位素示踪剂在温室研究中定量微生物固氮的速率。简单来说,用15N标识的肥料使植物生长,且植物组织中15N的稀释浓度指示来自微生物的固定氮的贡献。用所选择的微生物菌株接种玉米幼苗,且使植物生长到V6生长阶段。其后解构植物以能够测量微生物定殖和基因表达以及通过同位素比质谱(IRMS)测量植物组织中的15N/14N比率。对气生组织的分析显示出PBC6.38对植物氮含量的贡献小、不显著,以及PBC6.94对所述氮含量贡献显著(p=0.011)。在地面以上玉米叶子中发现的大约20%的氮是由PBC6.94产生的,而其余部分来自种子、盆栽混合土(potting mix)或其它土生微生物的“背景(background)”固定(图5C)。这说明我们的微生物育种和重塑输送路径(pipeline)可生成能够在氮肥存在下对植物产生显著氮贡献的重塑菌株。测量植物组织内的微生物转录,并且在衍生物重塑的菌株中观察到nif基因簇的表达,而没有在野生型菌株中观察到(图5B),这显示nif去抑制对于在施肥条件下BNF对作物贡献的重要性。通过qPCR测量的根部定殖表明,所测试的每种菌株的定殖密度不同(图5A)。观察到PBC6.38与PBC6.94之间的定殖率有50倍差异。这一差异可能指示,由于高水平的固定和排泄,PBC6.94相对于PBC6.38在根际的适合度降低。
方法
基本培养基含有(每升)25g Na
玉米幼苗从种子(DKC 66-40,伊利诺伊州迪卡尔布(DeKalb,IL))在控制在22℃(夜间)到26℃(白天)的温室环境中生长两周,并在从加利福尼亚州圣华金县(San JoaquinCounty,CA)收集的土壤中曝露于16小时的光照循环。收获根部并且用无菌去离子水洗涤以去除散块土壤。在设置30下用2mm不锈钢珠在组织裂解器(组织裂解器II,凯杰P/N 85300)中使根部组织均质化三分钟,并且以13,000rpm使样品离心1分钟以分离组织与根部相关细菌。将上清液分成两份,且使用一份经由16S rRNA扩增子测序来表征微生物组,且将剩余份稀释并接种于补充有1.5%琼脂的不含氮培养液(NfB)培养基上。将培养盘在30℃下培育5-7天。利用引物Ueda19f和Ueda406r通过菌落PCR来测试显现的菌落中nifH基因的存在。分离来自具有阳性nifH菌落PCR的菌株的基因组DNA(QIAamp DNA微型试剂盒,目录号51306,凯杰,德国)并测序(Illumina MiSeq v3,SeqMatic,加利福尼亚州弗里蒙特)。在序列组装和标注之后,在下游研究中利用含有固氮基因簇的分离物。
使用ZR96基因组DNA I试剂盒(兹莫研究(Zymo Research)P/N D3011)从根部相关细菌中分离基因组DNA,并且使用靶向799f和1114r的带新纪元(nextera)条码的引物生成16S rRNA扩增子。纯化扩增子库并且用Illumina MiSeq v3平台(SeqMatic,加利福尼亚州弗里蒙特)测序。使用minikraken数据库,使用Kraken对读数以分类学方式进行分类(图2)
使用乙炔还原分析的经修改形式来测量纯培养物条件下的固氮酶活性。在30℃下以200RPM振荡在SOB(RPI,P/N S25040-1000)中自单一菌落繁殖菌株24小时,且随后以1:25传代培养至生长培养基中并使其有氧生长24小时(30℃,200RPM)。随后将1ml基本培养基培养物添加到气密亨盖特(Hungate)管中4ml的补充有0到10mM谷氨酰胺的基本培养基中,并使其厌氧生长4小时(30℃,200RPM)。去除10%顶部空间,随后通过注射相等体积的乙炔来代替,并且继续培育1小时。其后,经由气密注射器去除2ml顶部空间以用于使用装备有火焰电离检测器(FID)的安捷伦(Agilent)6850气相色谱来定量乙烯生产量。
在厌氧生物反应器中使用分批发酵测量呈氨形式的固定氮的排泄。在96孔DeepWell培养盘中在1ml/孔的SOB中自单一菌落繁殖菌株。将培养盘在30℃下以200RPM振荡来培育24小时,且随后以1:25稀释到含有1ml/孔的生长培养基的新制培养盘中。将细胞培育24小时(30℃,200RPM),且随后以1:10稀释到含有基本培养基的新制培养盘中。将培养盘转移到具有>98.5%氮、1.2-1.5%氢和<30ppM氧的气体混合物的厌氧室,并且在室温下以1350RPM培育66-70小时。通过测量590nm下的光密度将初始培养物生物量与结束时的生物量进行比较。随后通过离心分离细胞,并使用Megazyme氨分析试剂盒(P/N K-AMIAR)来分析来自反应器培养液的上清液中的游离氨,以标准化为每个时间点的生物量。
轻轻地振荡根部以去除松散粒子,且分离根部系统并将其在RNA稳定溶液(赛默飞世尔(Thermo Fisher)P/N AM7021)中浸泡30分钟。随后用无菌去离子水简单冲洗根部。在组织裂解器(组织裂解器II,凯杰P/N 85300)中于2ml裂解缓冲液(凯杰P/N 79216)中,利用1/2英寸不锈钢滚珠轴承使用玻珠击打(bead beating)使样品均质化。用ZR-96Quick-gDNA试剂盒(兹莫研究P/N D3010)进行基因组DNA提取,并且使用RNeasy试剂盒(凯杰P/N74104)进行RNA提取。
种植后四天,将1ml细菌过夜培养物(大约10
在如根部定殖分析中所描述的生长和处理幼苗中测量了根部相关微生物的转录概况分析。使用Illumina NextSeq平台(SeqMatic,加利福尼亚州弗里蒙特)对纯化的RNA进行测序。使用bowtie2,使用‘极度敏感局部’参数(‘--very-sensitive-local’parameter)和最小校准分数30,将读数映射到接种菌株的基因组。使用samtools计算整个基因组的覆盖率。将差异覆盖率标准化为管家基因表达,并且使用Circos使整个基因组可视化且使用DNAplotlib使整个nif基因簇可视化。另外,经由靶向纳斯瑞分析来定量植物内转录概况。在nCounter Sprint(核心诊断(Core Diagnostics),加利福尼亚州哈沃德(Hayward,CA))上处理经纯化RNA。
进行15N肥料稀释实验以评估经优化菌株的植物内活性。使用蛭石与经洗涤砂(于DI H
在种植后五天,利用将1ml细胞悬浮液直接浸湿于新出现的胚芽鞘上方来接种幼苗。从SOB中的5ml过夜培养物制备接种物,将其在5ml PBS中旋转向下且再悬浮两次以去除残余SOB,之后最终稀释到1.0的OD(大约10
在种植后的5、9、14和19天,用含有2%的15N富集的2mM KNO
在四周时,收获植物并且在最低节点处分离成用于根部gDNA和RNA提取的样品和用于IRMS的气生组织。按需要擦拭气生组织以去除砂,将其整个放置到纸袋中并且在60℃下干燥至少72小时。一旦完全干燥,通过玻珠击打将整个气生组织均质化,并由MBL稳定同位素实验室(MBL Stable Isotope Laboratory)(生态系统中心(The EcosystemsCenter),马萨诸塞州伍兹霍尔市(Woods Hole,MA))通过δ15N同位素比质谱法(IRMS)分析5-7mg样品。使用下式计算NDFA百分比:%NDFA=(UTC的δ15N平均值-样品的δ15N)/(UTC的δ15N平均值)×100。
为了评估本公开的重塑菌株在不同氮方案下对玉米生长和生产率的功效,进行田地试验。
试验用(1)六种菌株加对照的七个子地块(subplot)处理进行-四个主地块包括用局部验证的0、15、85和100%的最大氮回报率(maximum return to nitrogen;MRTN)。对照(仅UTC)用10 100%MRTN加,5、10或15磅进行。处理具有四次重复试验。
玉米地块(最小的)为30英尺长,共计4行,其中每个位置124个地块。所有观察结果均取自所述地块的中央两行并且所有破坏性取样均取自外侧的行。将种子样品冷藏直到使用前1.5到2小时。
本地农业实践:种子为没有常规杀真菌剂和杀虫剂处理的商业玉米。所有种子处理剂均由一位种子处理专家实施以确保均一性。种植日期、播种率、杂草/昆虫管理等保持至本地农业实践。除杀真菌剂施用外,遵循标准管理实践。
土壤表征:评估土壤质地和土壤肥力。针对每一重复试验预种植土壤样品以确保残余硝酸盐含量低于50lbs/Ac。从0cm到30cm取土壤核心。针对pH、CEC、总K和P进一步表征土壤。
评估:在每公顷种植后14天(DAP)评估初始植物种群,并进一步评估:(1)14DAP&V10的活力(1到10级,w/10=极佳);(2)记录地块中任何时候症状明显的疾病等级;(3)如果地块中出现倒伏(lodging),记录倒伏的任何差异;(4)产量(Bu/公顷),调整为标准水分百分比;(5)测试重量;以及(6)谷物水分百分比。
取样要求:在三个时间点(在试验起始之前,V10-VT,收获后1周)进行土壤取样。以每样品10克对所有六个位置和所有地块(124地块×3个时间点×6个位置)取样。
定殖取样:在针对五个位置的两个时间点(V10和VT)和在六个时间点(V4、V8、V10、VT、R5和收获后)收集定殖样品。如下收集样品:(1)0%和100%MRTN,每个位置60个地块;(2)从外侧行随机选择的每个地块的4个植物;(3)5克根部、8英寸茎秆和顶部的三片叶子-分别装袋并编号-每个地块12/袋;(4)五个位置(60个地块×2个时间点×12袋/地块);以及一个位置(60个地块×6个时间点×12袋/地块。
在两个时间点(V4-V6和VT)使用Greenseeker仪器进行标准化差异植被指数(NDVI)测定。对所有六个位置处的每个地块进行评估(124地块×2个时间点×6个位置)。
从最佳说明处理差异的一个位置用Win Rhizo进行根部分析。随机取样每个地块的十个植物(来自每一外侧行的5个相邻植物;优选的是V3-V4阶段的植物)并且轻轻地洗涤以去除尽可能多的泥土。将十个根部放入塑料袋并且进行标识。用WinRhizo根部分析(WinRhizo Root Analysis)来分析。
在R2与R5之间的所有六个位置处测量茎秆特征。记录每个地块十个植物在6”高度处的茎秆直径,也记录在6”标记物上方的第一节间的长度。监测十个植物;来自两个内部行的中央的五个连续植物。评估六个位置(124个地块×2次测量×6个位置)。
从所有地块和所有位置分析组织硝酸盐。当玉米处于黑色层形成后一周与三周之间时,8”茎秆段在土壤上方6”开始;去除叶鞘。评估所有位置和地块(6个位置×124个地块)。
记录从种植到收获的所有位置的以下天气数据:每日最高和最低温度、在播种时的土壤温度、每日降雨量加灌溉量(如施用)和任何不寻常的天气事件(如过度的雨、风、冷或热)。
所有六个位置的产量数据呈现于表26中。氮速率对产量具有显著影响,但不同氮速率下的菌株对产量并不具有显著影响。然而,在最低氮速率下,菌株CI006、CM029和CI019在数值上比UTC产量高4到6bu/公顷。在15%的MRTN下,菌株CM029、CI019和CM081的产量也在数值上增加了2到4bu/公顷。
表26:所有六个位置的产量数据
另一种分析方法呈现于表27中。所述表包括对氮的响应最大的四个位置,这表明可用残余氮最低。这一方法并未更改氮速率显著影响产量的评估,在对所有氮速率进行平均化时,所述菌株并未受影响。然而,在最低N速率下,所有菌株的数值产量优势更加明显,尤其是CI006、CM029和CM029/CM081,其中产量从8bu/公顷提高到10bu/公顷。在15%MRTN下,菌株CM081比UTC产量高5bu。
表27:所有四个位置的产量数据4个位置的平均值-SGS、AgIdea、Bennett、RFR
田地试验的结果也在图9-15中说明。结果指示本公开的微生物能够增加植物产量,这指向所教示微生物能够增加重要农业作物(即玉米)中的固氮。
基于田地的结果进一步验证所公开的非属间修饰所选择的微生物菌株的基因组的方法,以便当将所述经工程改造的菌株施用于作物时在田地背景中产生农业相关性结果。
图6描绘衍生自菌株CI006(WT甘蔗科萨克氏菌)的经修饰重塑菌株的谱系。田地数据表明CI006 WT菌株的经工程改造衍生物(即CM029)能够在田地背景中产生数值相关性结果。例如,表26说明,在0%MRTN下,CM029与产量呈141.2bu/公顷的未经处理的对照相比产出147.0bu/公顷(增加5.8bu/公顷)。表26还说明,在15%MRTN下,CM029与产量呈165.1bu/公顷的未经处理的对照相比产出167.3bu/公顷(增加2.2bu/公顷)。表27支持这些结论,且说明,在0%MRTN下,CM029与产量呈131.9bu/公顷的未经处理的对照相比产出140.7bu/公顷(增加8.8bu/公顷)。表27还说明,在15%MRTN下,CM029与产量呈161.3bu/公顷的未经处理的对照相比产出164.1bu/公顷(增加2.8bu/公顷)。
图7描绘衍生自菌株CI019(WT水生拉恩氏菌)的经修饰重塑菌株的谱系。田地数据表明CI019 WT菌株的经工程改造衍生物(即CM081)能够在田地背景中产生数值相关性结果。例如,表26说明,在15%MRTN下,CM081与产量呈165.1bu/公顷的未经处理的对照相比产出169.3bu/公顷(增加4.2bu/公顷)。表27支持这些结论,且说明,在0%MRTN下,CM081与产量呈131.9bu/公顷的未经处理的对照相比产出136.3bu/公顷(增加4.4bu/公顷)。表27还说明,在15%MRTN下,CM081与产量呈161.3bu/公顷的未经处理的对照相比产出166.8bu/公顷(增加5.5bu/公顷)。
此外,可在表27中看到,在0%MRTN下的CM029/CM081的组合与产量呈131.9bu/公顷的未经处理的对照相比产出141.4bu/公顷(增加9.5bu/公顷)。
为了评估本公开的重塑菌株在不同氮方案下对玉米生长和生产率的功效,进行田地试验。以下田地数据表明本公开的非属间微生物能够在氮限制性环境以及非氮限制性环境两者中固定大气氮并且将所述氮输送到植物-从而引起增加的产量。
试验在整个美国的七个位置处进行,其中六个中西部位置地理条件不同。五个氮方案用于肥料处理:地点/区域的标准农业实践的100%、100%减25磅、100%减50磅、100%减75磅和0%;所有方案均以每公顷计算。100%方案的每公顷氮的磅数取决于地点/区域的标准农业实践。前述氮方案在约153磅/公顷到约180磅/公顷范围内,其中平均值为约164磅氮/公顷。
在每一肥料方案内存在14种处理。每一方案具有六次重复试验,并且利用裂区设计。14种处理包含:12种对不同微生物的处理,1种对具有与主地块相同的肥料速率的UTC的处理,和1种对具有100%氮的UTC的处理。在100%氮方案中,第2种UTC为100加25磅。
最小的玉米地块为30英尺长,共4行(在行与行之间有30英寸),其中每个位置420个地块。除非另外指出,否则所有观察结果均取自植物的中央两行并且所有破坏性取样均取自外侧的行。将种子样品冷藏直到使用前1.5到2小时。
本地农业实践:种子为在无生物共施用的情况下用商业种子处理剂施用的商业玉米。除杀真菌剂施用(如果需要)外,将播种速率、种植日期、杂草/昆虫管理、收获时间和其它标准管理实践保持至所述区域的本地农业实践标准。
微生物应用:在已经接受正常化学处理的种子上,以种子处理剂形式将微生物施用于种子。种子包被有包括微生物的发酵培养液。
土壤表征:评估土壤质地和土壤肥力。利用标准土壤取样程序,其包含深度为0-30cm和30-60cm的土壤核心。标准土壤取样包含测定硝酸盐氮、铵氮、总氮、有机物和CEC。标准土壤取样进一步包含测定pH、总钾和总磷。为了测定氮肥含量,取得来自每一位置的种植前土壤样品以确保对于硝酸盐氮来说0-12"以及潜在地12"到24"土壤区域。
在种植和施肥之前,从UTC的0到6-12"收集2ml土壤样品。使用所述行的中间收集每个氮区每次重复试验的一个样品。(5种肥料方案×6次重复试验=三十个土壤样品)。
种植后(V4-V6),从UTC的0到6-12"收集2ml土壤样品。使用所述行的中间收集每个氮区每次重复试验的一个样品。(5种肥料方案×6次重复试验=三十个土壤样品)。
收获后(V4-V6),从UTC的0到6-12"收集2ml土壤样品。使用所述行的中间收集每个氮区每次重复试验的一个样品。在UTC的0-12"以及UTC的潜在地12-24"下收集额外的收获后土壤样品(5种肥料方案×6次重复试验=三十个土壤样品)。
来自每一肥料方案的V6-V10土壤样品(不包含100%和100%+25lbs[100%区块中]的处理),用于0-12"和12-24"下的所有肥料方案。(5种肥料方案×2个深度=每个位置10个样品)。
来自每一肥料方案的收获后土壤样品(不包含100%和100%+25lbs[100%区块中]的处理),用于0-12"和12-24"下的所有肥料方案。(5种肥料方案×2个深度=每个位置10个样品)。
评估:在约50%UTC下评估初始植物种群并且在收获之前评估最终植物种群。评估包含(1)潜在温度(温度探针);(2)V4和V8-V10时的活力(1-10,其中10=极佳);(3)V8-V10和V14时的植物高度;(4)调整至标准湿度百分数的产量(蒲式耳/公顷);(5)测试重量;(6)谷物湿度百分数;(7)黑色层中的茎秆硝酸盐测试(420个地块×7个位置);(8)在V4-V6时在0%和100%肥料下,以在拉链袋中每个地块1个植物的定殖(1个植物×14种处理×6次重复试验×2种肥料方案=168个植物);(9)在V4-V6时在0%和100%肥料下,以在拉链袋中每个地块1个植物的转录组学(1个植物×14种处理×6次重复试验×2种肥料方案=168个植物);(10)在两个时间点(V4-V6和VT)使用Greenseeker仪器测定标准化差异植被指数(NDVI)或标准化差异红边(NDRE),以评估所有7个位置上的每个地块(420个地块×2个时间点×7个位置=5,880个数据点);(11)测量在R2和R5之间的所有7个位置上的茎秆特征,记录每个地块10个植物在6"高度处的茎秆直径,记录6"标记物上方的第一节间长度,监测10个植物(来自两内侧行中心的5个连续植物)(420个地块×10个植物×7个位置=29,400个数据点)。
监测流程:实践者访问了V3-V4阶段的所有试验以评估对处理的早季反应,且在生殖生长阶段期间监测成熟度。本地合作人员在持续基础上访问研究试验。
天气信息:收集跨越种植到收获时间的天气数据并且由以下组成:每日最高和最低温度、在播种时的土壤温度、每日降雨量加灌溉量(如施用)和不寻常的天气事件(如过度的雨、风、冷或热)。
数据报告:包含上文所示的数据在内,田地试验生成的数据点包含土壤质地;行间距;地块大小;灌溉量;耕作量;先前作物;播种率;植物种群;季节性肥料投入,包含来源、速率、时间选择和布置;收获面积尺寸,收获方法,如手工或机器收获,以及使用的测量工具(天平、产量监测器等)。
结果:来自前述田地试验的选择结果报告于图16和图17中。
在图16中,可以看出,相比于野生型菌株(WT),本公开的重塑微生物(即6-403)产生更高的产量,并且相比于未处理的对照(UTC),产生更高的产量。相比于所述区域的标准农业实践,“-25lbs N”处理每公顷少使用25lbs N。“100%N”UTC处理意图描绘所述区域的标准农业实践,其中100%的N标准利用率由农民部署。微生物“6-403”保藏为NCMA201708004且可见于表1。这是突变体甘蔗科萨克氏菌(也称为CM037)且是来自CI006WT的后代突变体菌株。
在图17中,所获得的产量结果表明本公开的重塑微生物在所有位置表现一致。此外,产量结果表明本公开的微生物在氮供应紧张的环境(即氮限制性环境)以及具有足够氮供应(即非氮限制性条件)的环境两者中表现良好。微生物“6-881”(也称为CM094,PBC6.94)且其是来自CI006 WT的后代突变体甘蔗科萨克氏菌菌株,保藏为NCMA201708002且可见于表1。微生物“137-1034”,其是来自CI137 WT的后代突变体变栖克雷伯菌菌株,保藏为NCMA201712001且可见于表1中。微生物“137-1036”,其是来自CI137 WT的后代突变体变栖克雷伯菌菌株,保藏为NCMA 201712002且可见于表1。微生物“6-404”(也称为CM38,PBC6.38)且其是来自CI006 WT的后代突变体甘蔗科萨克氏菌菌株,保藏为NCMA 201708003且可见于表1。
评估本公开的重塑微生物并且针对整个季节一公顷地中所产生的氮产量彼此相比较。参见图8、图24和图25。
本发明人假设,为了使经工程改造的非属间微生物的种群有益于现代中耕作物农业系统,那么微生物的种群需要产生每季每公顷至少一磅或更多的氮。
为此,本发明人已出人意料地发现一种能够尤其促进以下各者的微生物的功能属:增加非豆科作物的产量;和/或减轻农民依赖于外源性氮施用;和/或能够产生每季每公顷至少一磅氮,即使是在非限制性环境中,所述属由定殖能力×每小时每个微生物所产生的N的mmol的乘积界定(即,图8、24和25的线划分)。
关于图8、24和25,将使用本公开微生物的某些数据汇总,以便描绘通过本公开微生物每公顷-季节输送的氮磅数的热图,其被记录为每g鲜重的微生物随每小时微生物所输送的氮的mmol的变化。在横切较大图像的细线下方是每公顷-季节输送小于一磅氮的微生物,且高于所述线的是每公顷-季节输送大于一磅氮的微生物。
田地数据以及野生型定殖热图:针对玉米中的N生产来分析图8热图中所用的微生物。对于WT菌株CI006和CI019,从单个田地地点取得玉米根部定殖数据。对于剩余菌株,假设定殖与WT田地水平相同。使用在5mM谷氨酰胺下的体外ARA分析来测定固N活性。在图8中热图下方的表给出每小时每个微生物产生的mmol N的精确值(每小时每个微生物的mmolN)以及在热图中显示的每个微生物的每克鲜重的精确CFU(CFU/g fw)。
田地数据热图:图24热图中所用的数据衍生自在田地条件下针对玉米中的N生产所分析的微生物菌株。每一点表示由使用来自单个田地地点的玉米根部定殖数据的微生物所产生的Ib N/公顷。使用在5mM的呈谷氨酰胺或磷酸铵形式的N下的体外ARA分析来测定固N活性。以下表28给出每小时每个微生物产生的mmol N的精确值(每小时每个微生物的mmolN)以及在图24的热图中显示的每个微生物的每克鲜重的精确CFU(CFU/g fw)。
温室以及实验室数据热图:图25热图中所用的数据衍生自在实验室和温室条件下针对玉米中的N生产所分析的微生物菌株。每一点表示由单个菌株产生的lb N/公顷。白点表示在温室条件下收集玉米根部定殖数据的菌株。黑点表示突变菌株,其玉米根部定殖水平衍生自野生型亲本菌株的平均田地玉米根部定殖水平。带阴影线的点表示在其平均田地玉米根部定殖水平下的野生型亲本菌株。在所有情况下,通过在5mM的呈谷氨酰胺或磷酸铵形式的N下的体外ARA分析来测定固N活性。以下表29给出每小时每个微生物产生的mmol N的精确值(每小时每个微生物的mmol N)以及在图25的热图中显示的每个微生物的每克鲜重的精确CFU(CFU/g fw)。
表28:图24-田地数据热图
表29:图25-温室和实验室数据热图
结论:图8、24、25以及表28和29中的数据说明所描述属的十余个代表性成员(即,在各图中线条右侧的微生物)。此外,这些许多代表性成员来自分类属的不同阵列,所述分类属的不同阵列可见于以上表28和29中。更进一步,本发明人已发现描绘许多微生物中发现的结构/功能关系的大量基因属性。这些基因关系可见于本公开的许多表中,这些表列出了本发明人引入的遗传修饰,其中包含将至少一种基因变异引入到固氮或同化基因调节网络的至少一个基因或非编码多核苷酸中。
因此,新发现的属由以下各者支持:(1)稳健的数据集,(2)十余个代表性成员,(3)来自不同分类属的成员,和(4)界定属成员的基础基因架构中的结构/功能关系的遗传修饰的类别。
将利用表1中所描述的经保藏的九种微生物(6种非基因间重塑微生物和3种WT微生物)中的一种或多种与杀虫剂可尼丁组合来进行实验。微生物与可尼丁的组合用于在生长室实验中处理玉米种子。
进行生长室实验,其中使玉米种子在受控标准生长条件下发芽。所述实验包含:(a)未处理的玉米种子,(b)用可尼丁处理的玉米种子,(c)用表1中所描述的微生物中的一种或多种处理的玉米种子,和(d)用可尼丁与表1中所描述的微生物中的一种或多种的组合处理的玉米种子。每种处理将有大约100颗种子。
与所有其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与可尼丁的组合而处理的玉米种子展现(1)较多数量的发芽的种子,(2)较快的发芽时间,和(3)较快地到达第三叶圈营养阶段。
与其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与可尼丁的组合而处理的玉米种子显现协同效应。
将利用表1中所描述的经保藏的九种微生物(6种非基因间重塑微生物和3种WT微生物)中的一种或多种与杀虫剂噻虫嗪组合来进行实验。微生物与噻虫嗪的组合用于在生长室实验中处理玉米种子。
进行生长室实验,其中使玉米种子在受控标准生长条件下发芽。所述实验包含:(a)未处理的玉米种子,(b)用噻虫嗪处理的玉米种子,(c)用表1中所描述的微生物中的一种或多种处理的玉米种子,和(d)用噻虫嗪与表1中所描述的微生物中的一种或多种的组合处理的玉米种子。每种处理将有大约100颗种子。
与所有其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与噻虫嗪的组合而处理的玉米种子展现(1)较多数量的发芽的种子,(2)较快的发芽时间,和(3)较快地到达第三叶圈营养阶段。
与其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与噻虫嗪的组合而处理的玉米种子显现协同效应。
将利用表1中所描述的经保藏的九种微生物(6种非基因间重塑微生物和3种WT微生物)中的一种或多种与杀虫剂剋安勃组合来进行实验。微生物与剋安勃的组合用于在生长室实验中处理玉米种子。
进行生长室实验,其中使玉米种子在受控标准生长条件下发芽。所述实验包含:(a)未处理的玉米种子,(b)用剋安勃处理的玉米种子,(c)用表1中所描述的微生物中的一种或多种处理的玉米种子,和(d)用剋安勃与表1中所描述的微生物中的一种或多种的组合处理的玉米种子。每种处理将有大约100颗种子。
与所有其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与剋安勃的组合而处理的玉米种子展现(1)较多数量的发芽的种子,(2)较快的发芽时间,和(3)较快地到达第三叶圈营养阶段。
与其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与剋安勃的组合而处理的玉米种子显现协同效应。
将利用表1中所描述的经保藏的九种微生物(6种非基因间重塑微生物和3种WT微生物)中的一种或多种与杀虫剂吡虫啉组合来进行实验。微生物与吡虫啉的组合用于在生长室实验中处理玉米种子。
进行生长室实验,其中使玉米种子在受控标准生长条件下发芽。所述实验包含:(a)未处理的玉米种子,(b)用吡虫啉处理的玉米种子,(c)用表1中所描述的微生物中的一种或多种处理的玉米种子,和(d)用吡虫啉与表1中所描述的微生物中的一种或多种的组合处理的玉米种子。每种处理将有大约100颗种子。
与所有其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与吡虫啉的组合而处理的玉米种子展现(1)较多数量的发芽的种子,(2)较快的发芽时间,和(3)较快地到达第三叶圈营养阶段。
与其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与吡虫啉的组合而处理的玉米种子显现协同效应。
将利用表1中所描述的经保藏的九种微生物(6种非基因间重塑微生物和3种WT微生物)中的一种或多种与杀真菌剂MAXIM QUATTRO(4种活性剂-咯菌腈+精甲霜灵(也被称为甲霜灵)+嘧菌酯+噻菌灵)组合来进行实验。微生物与MAXIM QUATTRO的组合用于在生长室实验中处理玉米种子。
进行生长室实验,其中使玉米种子在受控标准生长条件下发芽。所述实验包含:(a)未处理的玉米种子,(b)用MAXIM QUATTRO处理的玉米种子,(c)用表1中所描述的微生物中的一种或多种处理的玉米种子,和(d)用MAXIM QUATTRO与表1中所描述的微生物中的一种或多种的组合处理的玉米种子。每种处理将有大约100颗种子。
与所有其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与MAXIM QUATTRO的组合而处理的玉米种子展现(1)较多数量的发芽的种子,(2)较快的发芽时间,和(3)较快地到达第三叶圈营养阶段。
与其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与MAXIM QUATTRO的组合而处理的玉米种子显现协同效应。
将利用表1中所描述的经保藏的九种微生物(6种非基因间重塑微生物和3种WT微生物)中的一种或多种与杀真菌剂甲霜灵组合来进行实验。微生物与甲霜灵的组合用于在生长室实验中处理玉米种子。
进行生长室实验,其中使玉米种子在受控标准生长条件下发芽。所述实验包含:(a)未处理的玉米种子,(b)用甲霜灵处理的玉米种子,(c)用表1中所描述的微生物中的一种或多种处理的玉米种子,和(d)用甲霜灵与表1中所描述的微生物中的一种或多种的组合处理的玉米种子。每种处理将有大约100颗种子。
与所有其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与甲霜灵的组合而处理的玉米种子展现(1)较多数量的发芽的种子,(2)较快的发芽时间,和(3)较快地到达第三叶圈营养阶段。
与其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与甲霜灵的组合而处理的玉米种子显现协同效应。
将利用表1中所描述的经保藏的九种微生物(6种非基因间重塑微生物和3种WT微生物)中的一种或多种与杀真菌剂种菌唑组合来进行实验。微生物与种菌唑的组合用于在生长室实验中处理玉米种子。
进行生长室实验,其中使玉米种子在受控标准生长条件下发芽。所述实验包含:(a)未处理的玉米种子,(b)用种菌唑处理的玉米种子,(c)用表1中所描述的微生物中的一种或多种处理的玉米种子,和(d)用种菌唑与表1中所描述的微生物中的一种或多种的组合处理的玉米种子。每种处理将有大约100颗种子。
与所有其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与种菌唑的组合而处理的玉米种子展现(1)较多数量的发芽的种子,(2)较快的发芽时间,和(3)较快地到达第三叶圈营养阶段。
与其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与种菌唑的组合而处理的玉米种子显现协同效应。
将利用表1中所描述的经保藏的九种微生物(6种非基因间重塑微生物和3种WT微生物)中的一种或多种与杀真菌剂RAXIL PRO MD(3种活性剂-戊唑醇+丙硫菌唑+甲霜灵,和作为表面活性剂的乙氧基化牛脂烷基胺)组合来进行实验。微生物与RAXIL PRO MD的组合用于在生长室实验中处理玉米种子。
进行生长室实验,其中使玉米种子在受控标准生长条件下发芽。所述实验包含:(a)未处理的玉米种子,(b)用RAXIL PRO MD处理的玉米种子,(c)用表1中所描述的微生物中的一种或多种处理的玉米种子,和(d)用RAXIL PRO MD与表1中所描述的微生物中的一种或多种的组合处理的玉米种子。每种处理将有大约100颗种子。
与所有其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与RAXIL PRO MD的组合而处理的玉米种子展现(1)较多数量的发芽的种子,(2)较快的发芽时间,和(3)较快地到达第三叶圈营养阶段。
与其它处理组相比,预期用来自表1的6种非基因间重塑微生物中的一种或多种与RAXIL PRO MD的组合而处理的玉米种子显现协同效应。
本公开教示适用于检测多种前述实例中所用的微生物的引物、探针和分析。所述分析能够检测衍生/突变的非属间重塑微生物中的非天然核苷酸“接合”序列。这些非天然存在的核苷酸接合点可以用作一种诊断类型,其指示微生物中存在特定基因变异。
本发明技术能够经由利用专门的定量PCR方法(包含独特设计的引物和探针)检测这些非天然存在的核苷酸接合点。探针可以结合到非天然存在的核苷酸接合序列。也就是说,可使用以荧光报告子标识的由寡核苷酸组成的序列特异性DNA探针,其只允许在探针与其互补序列杂交后进行检测。定量方法可以确保仅非天然存在的核苷酸接合点将经由所教示的引物扩增,并且因此可以经由非特异性染料或经由利用特异性杂交探针被检测到。所述方法的另一方面是选择引物,使得引物位于接合序列的两侧,使得如果发生扩增反应,则存在所述接合序列。
因此,基因组DNA可以从样品中提取且用于通过使用qPCR定量本公开的微生物的存在。qPCR反应中所利用的引物可以是引物Blast(Primer Blast)设计的引物(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)以扩增野生型基因组的独特区域或工程改造的非属间突变菌株的独特区域。qPCR反应可以使用SYBR GreenER qPCR超混合液通用(SuperMix Universal)(赛默飞世尔(Thermo Fisher)P/N 11762100)试剂盒进行,仅使用正向和反向扩增引物;或者,卡帕探针力(Kapa Probe Force)试剂盒(卡帕生物系统(KapaBiosystems)P/N KK4301)可以与扩增引物和含有5'末端处的FAM染料标识、内部ZEN猝灭剂以及3'末端处的小槽粘合剂和荧光猝灭剂的TaqMan探针一起使用(整合式DNA技术)。
可以用于qPCR方法中的某些引物、探针和非原生接合序列在以下表30中列出。具体来说,非原生接合序列可见于SEQ ID NO:372-405中。
表31:重塑的非属间微生物
表32:重塑的非属间微生物
本发明的编号实施例
不管所附权利要求书,本发明阐述以下编号实施例:
1.一种种子处理剂组合物,其包括:
a.多个非属间重塑细菌,其具有至少约1.0×10
b.至少一种农药。
2.根据实施例1所述的种子处理剂组合物,其中所述农药是杀真菌剂。
3.根据实施例1或2所述的种子处理剂组合物,其中所述农药是选自由以下组成的群组的杀真菌剂:咯菌腈、甲霜灵、精甲霜灵、嘧菌酯、噻菌灵、种菌唑、戊唑醇、丙硫菌唑和其组合。
4.根据实施例1所述的种子处理剂组合物,其中所述农药是杀虫剂。
5.根据实施例1或4所述的种子处理剂组合物,其中所述农药是新烟碱类杀虫剂。
6.根据实施例1或4所述的种子处理剂组合物,其中所述农药是选自由以下组成的群组的杀虫剂:吡虫啉、噻虫胺、噻虫嗪、氯虫苯甲酰胺,和其组合。
7.根据实施例1至6中任一个所述的种子处理剂组合物,其中所述至少一种农药是杀真菌剂和杀虫剂组合。
8.根据实施例1所述的种子处理剂组合物,其中所述农药是杀线虫剂。
9.根据实施例1所述的种子处理剂组合物,其中所述农药是除草剂。
10.根据实施例1至9中任一个所述的种子处理剂组合物,其中所述农药是选自表13中的那些农药。
11.根据实施例1至10中任一个所述的种子处理剂组合物,其中所述非属间重塑细菌和农药展现协同作用。
12.根据实施例1至11中任一个所述的种子处理剂组合物,其中将所述种子处理剂安置到种子上。
13.根据实施例1至12中任一个所述的种子处理剂组合物,其中将所述种子处理剂安置到来自禾本科的种子上。
14.根据实施例1至13中任一个所述的种子处理剂组合物,其中将所述种子处理剂安置到谷物种子上。
15.根据实施例1至14中任一个所述的种子处理剂组合物,其中将所述种子处理剂安置到玉米、水稻、小麦、大麦、高粱、小米、燕麦、黑麦或黑小麦种子上。
16.根据实施例1至15中任一个所述的种子处理剂组合物,其中将所述种子处理剂安置到玉米种子上。
17.根据实施例1至16中任一个所述的种子处理剂组合物,其中将所述种子处理剂安置到遗传修饰的玉米种子上。
18.根据实施例1至17中任一个所述的种子处理剂组合物,其中将所述种子处理剂安置到遗传修饰的玉米种子上,其中所述玉米包括除草剂耐受性性状。
19.根据实施例1至18中任一个所述的种子处理剂组合物,其中将所述种子处理剂安置到遗传修饰的玉米种子上,其中所述玉米包括昆虫抗性性状。
20.根据实施例1至19中任一个所述的种子处理剂组合物,其中将所述种子处理剂安置到遗传修饰的玉米种子上,其中所述玉米包括除草剂耐受性性状和昆虫抗性性状。
21.根据实施例1至20中任一个所述的种子处理剂组合物,其中将所述种子处理剂安置到遗传修饰的玉米种子上,其中所述玉米包括表19中列出的性状。
22.根据实施例1至16中任一个所述的种子处理剂组合物,其中将所述种子处理剂安置到非遗传修饰的玉米种子上。
23.根据实施例1至23中任一个所述的种子处理剂组合物,其中将所述种子处理剂安置到甜玉米、硬质型玉米、爆米花、臼齿形玉米、有稃种玉米或粉质玉米上。
24.根据实施例1至23中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌在暴露到其的植物中产生1%或更多的固定氮。
25.根据实施例1至24中任一个所述的种子处理剂组合物,其中所述非属间重塑细菌能够在外源氮存在下固定大气氮。
26.根据实施例1至25中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌的每个成员包括引入到固氮或同化遗传调节网络的至少一种基因或非编码多核苷酸中的至少一个基因变异。
27.根据实施例1至26中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌的每个成员包括可操作地连接到所述固氮或同化遗传调节网络的至少一个基因的引入的控制序列。
28.根据实施例1至27中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌的每个成员包括可操作地连接到所述固氮或同化遗传调节网络的至少一个基因的异源启动子。
29.根据实施例1至28中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌的每个成员包括至少一个基因变异,其被引入到选自由以下组成的群组的成员中:nifA、nifL、ntrB、ntrC、编码谷氨酰胺合成酶的多核苷酸、glnA、glnB、glnK、drat、amtB、编码谷氨酰胺酶的多核苷酸、glnD、glnE、nifJ、nifH、nifD、nifK、nifY、nifE、nifN、nifU、nifS、nifV、nifW、nifZ、nifM、nifF、nifB、nifQ、与固氮酶生物合成相关的基因,或其组合。
30.根据实施例1至29中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌的每个成员包括引入到所述固氮或同化遗传调节网络的至少一种基因或非编码多核苷酸中的至少一个基因变异,所述基因或非编码多核苷酸产生以下各者中的一或多者:NifA或谷氨酰胺酶的增加的表达或活性;NifL、NtrB、谷氨酰胺合成酶、GlnB、GlnK、DraT、AmtB的减少的表达或活性;GlnE的减少的去腺苷酰基活性;或GlnD的减少的去尿苷酰基活性。
31.根据实施例1至30中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌的每个成员包括突变nifL基因,其已被更改以包括插入到所述nifL基因中的异源启动子。
32.根据实施例1至31中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌的每个成员包括突变glnE基因,其产生缺乏去腺苷酰基(AR)结构域的截短GlnE蛋白质。
33.根据实施例1至32中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌的每个成员包括突变amtB基因,其导致所述amtB基因缺乏表达。
34.根据实施例1至33中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌的每个成员包括以下各者中的至少一者:突变nifL基因,其已被更改以包括插入到所述nifL基因中的异源启动子;突变glnE基因,其产生缺乏去腺苷酰基(AR)结构域的截短GlnE蛋白质;突变amtB基因,其导致所述amtB基因缺乏表达;和其组合。
35.根据实施例1至34中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌的每个成员包括突变nifL基因和突变glnE基因,所述突变nifL基因已被更改以包括插入到所述nifL基因中的异源启动子,所述突变glnE基因产生缺乏去腺苷酰基(AR)结构域的截短GlnE蛋白质。
36.根据实施例1至35中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌的每个成员包括突变nifL基因、突变glnE基因和突变amtB基因,所述突变nifL基因已被更改以包括插入到所述nifL基因中的异源启动子;所述突变glnE基因产生缺乏去腺苷酰基(AR)结构域的截短GlnE蛋白质;所述突变amtB基因导致所述amtB基因缺乏表达。
37.根据实施例1至36中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌以每种子约1×10
38.根据实施例1至37中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌包括至少两种不同细菌物种。
39.根据实施例1至38中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌包括相同细菌物种的至少两种不同菌株。
40.根据实施例1至39中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌包括选自以下的细菌:水生拉恩氏菌(Rahnella aquatilis)、变栖克雷伯菌(Klebsiella variicola)、精神无色杆菌(Achromobacter spiritinus)、马鞭草无色杆菌属(Achromobacter marplatensis)、壁微杆菌(Microbacterium murale)、中间克鲁瓦氏菌属(Kluyvera intermedia)、假甘蔗科萨克氏菌(Kosakonia pseudosacchari)、肠杆菌属(Enterobacter sp.)、生脂固氮螺菌(Azospirillum lipoferum)、甘蔗科萨克氏菌(Kosakonia sacchari),和其组合。
41.根据实施例1至40中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌是内生的、附生的或根际的。
42.根据实施例1至41中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌包括选自以下的细菌:以NCMA 201701002形式沉积的细菌、以NCMA 201708004形式沉积的细菌、以NCMA 201708003形式沉积的细菌、以NCMA 201708002形式沉积的细菌、以NCMA 201712001形式沉积的细菌、以NCMA 201712002形式沉积的细菌,和其组合。
43.根据实施例1至42中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌包括具有与选自SEQ ID NO:177-260、296-303的核酸序列至少约90%序列一致性的核酸序列的细菌。
44.根据实施例1至43中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌包括具有与选自SEQ ID NO:177-260、296-303的核酸序列至少约95%序列一致性的核酸序列的细菌。
45.根据实施例1至44中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌包括具有与选自SEQ ID NO:177-260、296-303的核酸序列至少约99%序列一致性的核酸序列的细菌。
46.根据实施例1至45中任一个所述的种子处理剂组合物,其中所述多个非属间重塑细菌包括具有选自SEQ ID NO:177-260、296-303的核酸序列的细菌。
虽然本文已示出且描述本发明的优选实施例,但是对于所属领域的技术人员将显而易见的是,此类实施例仅借助于实例而提供。所属领域的技术人员现将在不脱离本发明的情况下意识到大量变型、变化和取代。应理解,本文所描述的本发明的实施例的各种替代方案可用于实践本发明。随附权利要求书旨在限定本发明的范围,并且由此覆盖这些权利要求书和其等效物的范围内的方法和结构。
通过引用并入
出于所有目的,本文中所引用的所有参考文献、论文、公开、专利、专利公开和专利申请的全文均通过引用并入本文中。然而,提及本文所引用的任何参考文献、论文、公开、专利、专利公开和专利申请不是并且不应认为是承认或以任何形式暗示其构成有效现有技术或形成世界上任何国家的公共常识的部分。此外,2018年5月22日发布的并且标题为:用于改善植物性状的方法和组合物的美国专利第9,975,817号在此以引用的方式并入。此外,2018年1月12日提交的并且标题为:用于改善植物性状的方法和组合物的PCT/US2018/013671在此以引用的方式并入。
- 包括重构固氮微生物的农业组合物
- 包含包括磺基甜菜碱的抗微生物增强剂的组合物以及增加组合物的抗微生物效力的方法
