携带突变的肿瘤驱动基因的干细胞及其用途
文献发布时间:2023-06-19 10:54:12
技术领域
本发明属于生物制药领域,具体涉及携带突变的肿瘤驱动基因的干细胞及其在预防癌症中的用途。
背景技术
癌症有病毒感染引起的和非病毒感染引起的,目前针对病毒感染引起的癌症疫苗已经取得了很好的疗效,例如宫颈癌疫苗。而针对非病毒感染引起的癌症疫苗的疗效还不是很理想。针对病毒引起的肿瘤疫苗能成功是因为他的致病原很清楚,只要开发针对病毒的疫苗预防免疫机体就能使机体获得特异的针对该病毒的免疫细胞或抗体储备起来。当机体感染了该病毒后,这些免疫细胞或抗体就能协同固有免疫一起清除病毒,保护机体不被其侵害,从而预防肿瘤的发生。
鉴于异体间甚至同一个体内肿瘤的异质性都非常大,对非病毒感染引起的肿瘤很难找到很好的单一的或者某几个靶点来消灭整个肿瘤,而且初始治疗时没有被杀灭的肿瘤会不断的进化来逃避免疫监视和清除(Pandya et al.,2016)。尽管随着人们对肿瘤逃逸进化机制理解的深入,出现了检查点阻断和CAR-T等新的免疫疗法,且新疗法不断改善着肿瘤病人的存活率,但是仍然有些肿瘤如胰腺癌的五年存活率没有得到明显改善(Siegel etal.,2017),而且这些免疫疗法对不少病人是无效的。这些免疫疗法失败的原因主要有两个:一是使用的时间不对,理论上越早期治疗,效果越好;二是选用的靶点不能靶向所有的肿瘤细胞。因此携带尽可能多的肿瘤靶点的预防性肿瘤疫苗即全细胞肿瘤疫苗仍然是值得关注的。目前的全细胞肿瘤疫苗包括自体的和异体的。
自体全肿瘤细胞疫苗因其可为机体提供个体化的大量肿瘤相关抗原,其疗效很值得期待。但自体全肿瘤细胞需要手术切除后的标本来建立,所以它只能应用于治疗而非预防,并且并不是所有标本都可以建系成功,因此该方法困难重重。同种异体全细胞疫苗为预防性应用提供了更多的选择,但其不能代表肿瘤的广泛异质性,并可能会导致促进肿瘤分化的筛选压力(Srivatsan et al.,2014)。
上述限制表明,急需开发一种在肿瘤未形成时就能获得个体肿瘤细胞的新方法。干细胞技术,特别是诱导多能性干细胞(iPSCs)技术为实现这一想法提供了可能。
发明内容
本发明利用iPSC技术产生全肿瘤细胞疫苗,其保留了个体肿瘤的独特特征,为癌症的预防和/或治疗提供了强有力的工具。
本发明的发明人在从成体细胞诱导而来的iPSCs中导入未激活的KRas
全肿瘤细胞疫苗经溶瘤病毒感染后能够显著提高其免疫原性已被证实(Lemay etal.,2012),本发明的发明人也已证明顺序使用两种抗原性不同的病毒治疗相比于使用单一病毒对肿瘤生长的控制更有效(Tysome et al,2012)。为了确认溶瘤病毒是否可以作为强效免疫佐剂感染肿瘤细胞激起机体对肿瘤细胞的免疫反应,本发明检测了溶瘤病毒感染肿瘤细胞后肿瘤细胞所发生的变化。已知免疫原性细胞死亡(ICD)能高效激起抗肿瘤免疫,其特征包括HMGB1释放,CRT暴露和ATP释放(Kroemer et al.,2013)。多项研究已证实溶瘤病毒是ICD的强效诱导剂(Guo et al.,2014),因此本发明研究了肿瘤细胞感染腺病毒和痘苗病毒后能否诱发这些特征。令人鼓舞的是,本发明发现胰腺癌细胞在感染这两种病毒48小时后都能够被诱发释放ATP。但只有痘苗病毒VVL15-RFP能够诱导胰腺癌细胞系DT6606释放HMGB1和暴露钙网蛋白(Figures 2B和2C)。因此,这两种病毒都能够触发ICD的某些特征,当其用于初次-加强免疫时能够相互补充。
本发明还研究了最优的肿瘤细胞经病毒感染的疫苗方案(VICCV),用腺和痘苗溶瘤病毒分别感染的DT6606细胞以不同的顺序组合在第0周和第4周分别免疫四周大的KPC转基因小鼠。免疫完两周后,在体外用生长被抑制的DT6606或无关的CMT93细胞刺激不同顺序免疫过的小鼠的脾细胞,结果显示用腺病毒感染的肿瘤细胞先免疫,痘苗病毒感染的肿瘤细胞进行加强免疫的免疫方案能够诱导显著的对同种细胞的IFNγ应答,而不是对无关肿瘤细胞。
因此,本发明提供了一种个体化预防癌症(包括实体瘤或恶性血液病)的方法和疫苗。
在一些实施方案中,本发明公开了一种用于在个体中预防癌症(例如,实体瘤或恶性血液病)的方法,其包括向所述个体施用本发明所构建的细胞或包含本发明所构建细胞的疫苗组合物。
在一些实施方案中,本发明所构建的细胞是在个体的干细胞,优选为人的干细胞,导入可受控表达的突变的肿瘤驱动基因,所述突变的肿瘤驱动基因选自突变的KRas、突变的p53和突变的BRAC1/2中之一、之二或三者,其中“突变的”是指能驱动细胞发生癌变的任何的相对于个体的野生型KRas、p53或BRAC1/2的突变。
在本发明的一些实施方案中,通过静脉内、腹膜内、鞘内、心室内、关节内或眼内注射施用本发明所构建的细胞或包含本发明所构建细胞的疫苗组合物。在一些实施方案中,实体瘤选自胰腺癌、肺癌、肝癌、胃癌、头颈癌、淋巴癌、食道癌、肠癌(如结肠癌、直肠癌等)、肾癌、膀胱癌、胶质母细胞瘤、乳腺癌、前列腺癌、卵巢癌、神经母细胞瘤、中枢神经系统肿瘤或黑色素瘤等。
在本发明的一些实施方案中,所述个体是人。在一些实施方案中,对象是非患癌的健康个体、诊断具有患癌风险的健康个体或任何有预防癌症想法或计划的个体,本发明的个体甚至可以包括已经患癌的患者。
在本发明一些实施方案中,干细胞是自体干细胞或异体干细胞,优选为自体干细胞。在一些实施方案中,干细胞选自由以下组成的组:成体干细胞、胚胎干细胞、胎儿干细胞、间充质干细胞、神经干细胞、全能干细胞、多能干细胞(包括诱导的多能干细胞,iPSCs)、寡能干细胞、单能干细胞(例如可以定向分化为肺细胞、胃细胞、肾细胞等的单能干细胞)、内皮干细胞、骨髓干细胞、脐带血干细胞、成体外周血干细胞、成肌细胞干细胞、皮肤成纤维细胞干细胞,及其组合。在一些实施方案中,干细胞是脂肪基质细胞或iPSCs,例如成体细胞诱导的多能干细胞。
在本发明的一些实施方案中,本发明的疫苗组合物除了本发明所构建的细胞之外,还任选地包括佐剂。在本发明的一些实施方案中,本发明的佐剂优选为免疫学上可接受的佐剂。在本发明的一些实施方案中,本发明所构建的细胞和佐剂在施用于对象之前被容纳在同一容器中。在本发明的一些实施方案中,本发明所构建的细胞和佐剂在施用于对象之前被容纳在不同容器中。
在本发明的一些实施方案中,在本发明的疫苗组合物中,所构建的细胞是灭活的。
在一些实施方案中,本发明所构建的细胞是在个体的干细胞中导入了可受控表达地突变的肿瘤驱动基因,其中所述的“可控表达”是指条件性表达目的蛋白或RNA。示例性地,可通过改变细胞内微环境或细胞外环境来开启或关闭目的蛋白或RNA的表达。
在一些实施方案中,本发明所构建的细胞是在个体的干细胞中导入了可受控表达地突变的肿瘤驱动基因,其中“突变的”是指能促使人体细胞发生癌变的任何的相对于人野生型基因的突变,例如相对于任KRas、p53和/或BRAC1/2上的突变。
K-ras基因在肿瘤细胞生长以及血管生成等过程的信号传导通路中起着重要调控作用,正常的K-ras基因处于失活状态,而一旦发生激活突变,它就会持续刺激细胞生长,打乱生长规律,从而导致肿瘤的发生。p53基因是人体抑癌基因,p53基因的突变失活对肿瘤形成起促进作用。BRCA1/2是两个能够抑制恶性肿瘤发生的基因,在调节人体细胞的复制、修复DNA损伤、以及调节细胞的正常生长方面有重要作用。BRCA1和BRCA2突变被认为是大多数家族性乳腺癌和卵巢癌的原因,携带BRAC1和BRAC2突变的人群具有罹患乳腺癌和/或卵巢癌的高风险。
在一些实施方案中,本发明所构建的细胞是在个体的干细胞中导入了可受控表达地突变的KRas、p53和/或BRAC1/2,其中所述的“导入”是指以纯合或杂合的形式用突变的KRas、p53和/或BRAC1/2替换个体中的野生型的KRas、p53和/或BRAC1/2。例如,以同源重组的方式以杂合的形式将突变的KRas、p53和/或BRAC1/2替换个体中的野生型的KRas、p53和/或BRAC1/2。
在一些实施方案中,本发明所构建的细胞是在个体的干细胞中导入了可受控表达地突变的KRas、p53和/或BRAC1/2,其中导入了突变的KRas、p53和/或BRAC1/2的干细胞被诱导分化为特异性组织细胞(包括祖细胞和成熟的组织细胞),例如胰腺组织细胞、肺细胞、肝细胞、胃细胞、头颈部细胞、淋巴细胞、食道组织细胞、肠细胞(如结肠细胞、直肠细胞等)、肾细胞、膀胱细胞、胶质母细胞、乳腺细胞、前列腺细胞、卵巢细胞、神经母细胞、中枢神经细胞等等,及它们对应的祖细胞。
进一步的,在一些实施方案中,本发明所构建的细胞是在个体的干细胞中导入了可受控表达地突变的KRas、p53和/或BRAC1/2,其中导入了突变的KRas、p53和/或BRAC1/2的干细胞被诱导分化为特异性组织细胞,且通过激活或开启突变的KRas、p53和/或BRAC1/2的表达使得所述特异性组织细胞癌变。
进一步的,在一些实施方案中,本发明所构建的细胞是在个体的干细胞中导入了可受控表达地突变的KRas、p53和/或BRAC1/2,其中导入了突变的KRas、p53和/或BRAC1/2的干细胞被诱导分化为特异性组织细胞,且通过激活或开启突变的KRas、p53和/或BRAC1/2的表达使得所述特异性组织细胞癌变,所述癌变的细胞进一步被溶瘤病毒感染,示例性地,所述癌变的细胞进一步被腺病毒感染或痘苗病毒感染。
在本发明的一些实施方案中,在本发明的疫苗组合物中,所构建的细胞在个体的干细胞中导入了可受控表达地突变的KRas、p53和/或BRAC1/2,其中导入了突变的KRas、p53和/或BRAC1/2的干细胞被诱导分化为特异性组织细胞,且通过激活或开启突变的KRas、p53和/或BRAC1/2的表达使得所述特异性组织细胞癌变,所述癌变的细胞进一步被溶瘤病毒感染,示例性地,所述癌变的细胞进一步被腺病毒感染或痘苗病毒感染。优选地,本发明的疫苗组合物包含了所述被腺病毒感染或痘苗病毒感染癌变的细胞之一或这两者。
在本发明的一些实施方案中,提供了本发明所构建的细胞在制备用于预防癌症的疫苗中的用途。
在本发明的一些实施方案中,提供了本发明所构建的细胞的方法,其包括:
个体的干细胞中导入了可受控表达地突变的KRas、p53和/或BRAC1/2中之一、之二或三者的肿瘤驱动基因;
导入了突变的KRas、p53和/或BRAC1/2的干细胞被诱导分化为特异性组织细胞(包括祖细胞和成熟的组织细胞);和/或
通过激活或开启突变的KRas、p53和/或BRAC1/2的表达使得所述特异性组织细胞癌变;
任选地,所述癌变的细胞进一步被溶瘤病毒感染,示例性地,所述癌变的细胞进一步被腺病毒感染或痘苗病毒感染。优选地,所述癌变细胞被腺病毒感染或痘苗病毒感染。
在本发明的一些实施方案中,提供了制备用于预防癌症的疫苗的方法,其包括将本发明所构建的细胞包含在疫苗中的步骤。
进一步地,本发明所构建的细胞还可进一步包含表达癌特异性抗原的核酸。
本发明还提供预防癌症的方法,其包括使用本发明所构建的细胞或所制备疫苗免疫个体的步骤。优选地,所述免疫过程中顺序使用两种或三种或四种不同溶瘤病毒感染的癌变细胞,例如顺序使用腺病毒感染的癌变细胞和痘苗病毒感染的癌变细胞两者免疫个体。
在本发明中,除本发明所构建细胞这一活性成分外,本发明的方法、用途和产品还可以包含合适的药学上或疫苗学可接受的载体,包括促进活性成分加工成制剂(例如适于注射或输注的制剂)的助剂。
适于注射或输注的制剂可包括水性和非水性无菌注射液和水性和非水性无菌混悬剂,所述无菌注射液可任选地包含抗氧化剂、缓冲剂、抑菌剂和能使制剂与目的接收者的血液等压的溶质,所述无菌混悬剂可包括悬浮剂和增稠剂。所述制剂可存在于单位剂量或多剂量容器中,例如密封的安瓿,并且可以保存在冻结干燥的(冻干)条件,在立即使用前仅需要加入无菌液体载体,例如注射用水。
本发明所构建细胞活性成分任选地可与固体赋形剂相组合,且任选地磨碎所得到的混合物,并且需要时,在加入合适的助剂后,加工颗粒的混合物,以获得所需剂型。合适的赋形剂特别是填充剂例如糖,包括乳糖、蔗糖、甘露醇或山梨糖醇;纤维素或淀粉制剂、明胶、黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠和/或聚乙烯吡咯烷酮(PVP)。需要时,可以加入崩解剂,例如交联聚乙烯吡咯烷酮、琼脂或海藻酸或其盐例如海藻酸钠。
在本发明中,施用本发明所构建细胞的量可为能预防癌症的任何量,在本发明中,施用的有效量以及合适的单位剂量的测定在本领域技术人员的能力内,特别是根据本文提供的公开内容的启示下。
根据本发明,本发明的疫苗组合物可以以任意有效剂量施用给受试者。优选地,本发明的疫苗可以以多次剂量给药,例如从约2至约4次剂量,更优选约2-3次剂量。在特别优选的实施方案,在注射疫苗过程中,以每四周给药约一次的频率将本发明的疫苗给药至受试者,例如注射、输注或口服。在特别优选的实施方案,给药为通过注射施用。
应当理解本发明的疫苗可以按用于通过任意适宜的途径给药的任意适宜的方式配制。
本发明的疫苗的剂量单位是基于常规进行给药受试者。例如,剂量单位可以基于给药频率为每月一次等确定。剂量单位也可基于以两次/周、三次/周或一次/月或一次/两个月等确定。
如本文所使用的,“包含”与“包括”、“含有”或“特征在于”同义,并且是包括在内的或开放性的,并且不排除另外的未陈述的元件或方法步骤。术语“包含”在本文中的任何表述,特别是在描述本发明的方法、用途或产品时,应理解为包括基本上由所述组分或元件或步骤组成和由所述组分或元件或步骤组成的那些产品、方法和用途。本文示例性描述的本发明适当地可以在不存在本文未具体公开的任何一种或多种元件、一种或多种限制的情况下进行实践。
本发明的药物中可包含涉及该药学产品的说明书,且该说明书可以含有如下内容:适应症(例如肝纤维化)、施用剂量(例如上述所示例性说明的)以及可能产生的副作用等等。
本文已采用的术语和表述用作描述性而不是限制性术语,并且在此种术语和表述的使用中不预期排除所示和所述特征或其部分的任何等价物,但应认识到各种修饰在请求保护的本发明的范围内是可能的。因此,应当理解尽管本发明已通过优选实施方案和任选特征具体公开,但本领域技术人员可以采用本文公开的概念的修饰和变化,并且此类修饰和变化被视为在如由附加权利要求定义的本发明的范围内。
为更清楚地说明本发明,现结合如下实施例进行详细说明,但这些实施例仅仅是对本发明的示例性描述,并不能解释为对本申请的限制。
附图说明
图1:获得的iPS细胞系的多能性标志(Nanog和Oct4)的表达:其中WT iPSC代表野生型小鼠尾尖成纤维细胞来源的诱导多能干细胞,WT-KP iPSC代表在WT iPSC基础上整合K-Ras
图2:图2A、2B和2C,其中图2A为KRas
图3:iPS细胞向胰腺祖细胞样细胞分化的过程中不同阶段的标志性分子的免疫荧光检测图。
图4:2x10
图5:2x10
图6:细胞在野生型小鼠皮下形成的肿瘤的H&E染色,其中DT6606为携带K-Ras
图7:iPS细胞来源的KP-AC胰腺癌细胞系的转录组与KPC小鼠来源的胰腺癌细胞系(如TB11381、TB32043、TB32047等)的相似性比较,揭示了WT-KP iPS来源的胰腺癌细胞系可以用来做胰腺癌的全细胞肿瘤疫苗。
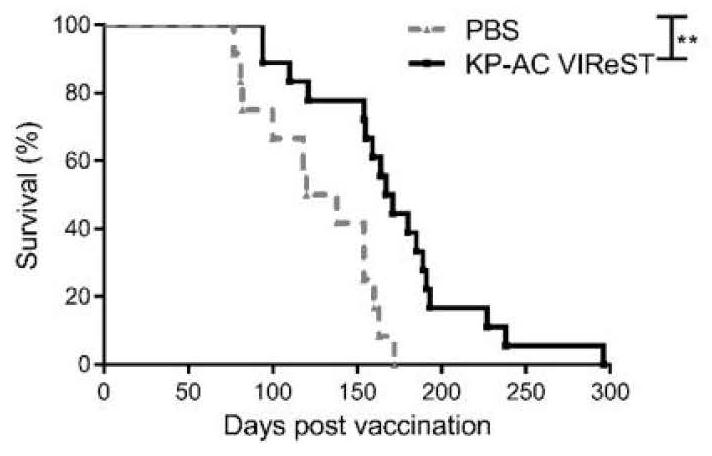
图8:疫苗免疫后的KPC小鼠比PBS对照组的KPC小鼠生存期有显著延长。
图9:免疫后不同时间点的KPC小鼠胰腺组织中浸润的CD8
图10:WT-KP iPS细胞,拟胚体,前肠内胚层,肺祖细胞和KPLC肺癌细胞的形态。
图11:iPS细胞到肺祖细胞各个阶段标志物的免疫荧光结果。
图12:KPLC,KPL 160302S,KPL 160424S在KP同窝小鼠成皮下瘤的生长曲线。
图13:KPLC,KPL 160302S,KPL 160424S在KP同窝小鼠形成皮下瘤的HE染色图片。
图14:KPLC,KPL 160302S,KPL 160424S与WT iPSC/WT-KP iPSC以及胰腺癌细胞系KP-AC/KPC/TB11381的转录组相关矩阵。
图15:KPLC疫苗免疫小鼠肺癌原位模型生存曲线。
图16:KPLC疫苗免疫小鼠肺癌原位模型的肺部CD8/CD4浸润数量。
具体实施方式
本发明结合附图和实施例作进一步的说明。
实施例1:体外培养野生型小鼠尾尖成纤维细胞(TTF)
实验器具:1.眼科剪,眼科镊,玻璃平皿;2.水浴锅;3.培养箱;4.6cm培养皿(提前4-5h用1%gelatin在室温下包被,用时将多余的gelatin吸去)。
实验试剂:1.灭菌加青链霉素双抗(1:100)的PBS;2.1%gelatin;3.普通的细胞培养基(DMEM+10%FBS+1/1000青链霉素双抗);4.70%酒精。
剪3-5cm小鼠尾巴,装在5或15mlEP管里,用70%酒精擦拭一次后,放入含有双抗的PBS中洗涤一次,然后放入第二个含有PBS的培养平皿里再漂洗一次,转入第三个含有PBS的平皿。用剪刀将皮剪开,然后抽出软骨。将软骨用PBS漂洗两次,放在10cm平皿的盖子上来回翻转将PBS去除。然后用普通培养基润洗一次,剪成一厘米长短的段,放在用gelatin包被好的6cm平皿上。贴着6cm平皿的壁向里面加入1ml的培养基。之后放入37度培养箱里培养3-6小时,然后贴着尾巴向里面再滴加3ml培养基,并在37度培养箱里面继续培养3-5天。第一次长出来的细胞就是较纯的成纤维细胞,记为P0代。后续P3代用于进行iPS细胞的诱导。
实施例2:iPS细胞的诱导及鉴定
iPS细胞的多能性用分别携带Oct4、Sox2、Klf4三因子的逆转录病毒Retrovirus感染小鼠尾尖实施例1所获得的成纤维细胞,使其转变成为iPS细胞,并鉴定iPS细胞的多能性。具体步骤如下所述:
iPS细胞诱导:
1.包装逆转录病毒
从Addgene公司购买分别携带小鼠Oct4、Sox2、Klf4 cDNA的逆转录病毒载体。将逆转录病毒载体用磷酸钙转染的方法转染进PlatE细胞中,包装逆转录病毒。细胞转染方法包括以下步骤:
1.1转染细胞的准备
转染前一天将platE细胞接种到10/6cm盘上,密度大约为750万每10cm盘,250万每6cm盘,使用platE/MEF培养基。
1.2磷酸钙沉淀法转染细胞
转染前观察前一天接种的细胞,密度大约在80%时即可转染,转染前需先更换成新鲜plat-E培养液(小于等于2小时),每10cm盘加7.5ml培养基,6cm盘加2.5ml培养基。
钙转试剂和质粒准备
1.3实验步骤:
a)计算待转染的质粒的使用量以及磷酸钙沉淀法转染所需试剂的使用量(见上表);
b)准备好离心管或EP管;
c)加入水后加入所需量的质粒,并吹打混匀;
d)加入2MCaCl
e)加入2xHBS,并通过吸吹混匀,得到混合液;
f)将上步所得混合液静置2-3分钟,然后逐滴均匀的滴加到细胞培养皿中(2.5ml/皿);
g)显微镜下观察并确认后,5%CO
h)转染后10-15小时后换液(六孔板每孔2ml、10cm盘10ml),并继续培养。
i)转染后48小时收第一次病毒,并加新鲜培养基继续培养,72小时收取第二次病毒。
2.iPSCs诱导和收获
将包装好的逆转录病毒感染TTF细胞(以1.5-2万细胞/孔的量种植到12孔板内,12小时后待细胞完全展开,吸弃细胞培养液,每孔添加0.5ml含有8ug/mlpolybrene的新鲜10%FBS培养液。将新鲜收集的Sox2、Klf4、Oct4病毒以1:1:1混合(每种病毒添加0.5ml),加入终浓度为8ug/ml的polybrene,病毒感染TTF细胞的那天记为d0。24h后,同样的方法进行病毒对细胞的再次感染。24h后,细胞换为mES诱导培养基,以后每天更换培养基,其中mES诱导培养基配方如下:高糖基础培养基(DMEM GIBCO C11965)、15%胎牛血清(GIBCO)、1/100NEAA(GIBCO 11140)、1/100 Glutmax(GIBCO 35050)、1/100 pyruvate sodium(GIBCO)、1/200青链霉素(Hyclone SV30010)、1mM beta-巯基乙醇(GIBCO 21985)、白细胞抑制因子(LIF)。10天后挑取iPSCs单克隆。
3.iPS细胞传代
传代前,准备好饲养层细胞(丝裂霉素C处理的胚胎期第13.5天(E13.5)的MEF细胞),2.5-3.0x10
传代的具体步骤如下:
(1).将iPS细胞拿出,将里面的培养基吸去;
(2).用100ul PBS洗一次,加入30ul 0.25%-EDTA trypsin 37℃消化8min,然后加入150ul iPS细胞培养基,并用移液枪吹吸几次,终止消化;
(3).将150uliPS细胞培养基分别以50ul的量分到三个板里,然后放在37℃培养箱中培养;
(4).过夜后换液,将含胰酶的培养基吸去,获得传代的iPS细胞,记为“WT-iPS”。
传代的iPS细胞经过Q-PCR检测外源性多能性因子的失活和内源性多能性因子的表达确认其具有多能性,Q-PCR结果显示P3代的WT-iPS细胞中外源导入的exo-Oct4、exo-Klf4、exo-Sox2表达明显下降,endo-Oct4、endo-KLF4、endo-Sox2表达明显上升。同时,用多能性因子Nanog和Oct4的抗体对P3代的WT-iPS细胞做了免疫荧光,发现这些细胞核内都有这两个因子的表达(图1)。
实施例3:将K-Ras
用含LoxP介导的转录终止元件(loxp-stop-loxp)的pBlueScript-PGK-LSL-K-Ras
同源重组后的WT-KP iPS细胞经过Q-PCR检测外源性多能性因子的失活和内源性多能性因子的表达确认其具有多能性(标记为Nanog和Oct4),见图1。
实施例4:畸胎瘤形成实验
将iPS细胞(WT-iPS和WT-KP iPS)以5x10
实施例5:验证WT-KP iPS来源的胰腺癌细胞系或肺癌细胞系可以分别用来做胰腺癌或肺癌的全细胞肿瘤疫苗
K-Ras
用免疫荧光检测了iPS细胞向胰腺祖细胞样细胞分化的过程中不同阶段的标志性分子(图3)。iPS细胞阶段的标志性分子为Oct4和Nanog,DE(definitive endoderm)阶段的标志性分子为Foxa2和Sox17,PPLC(pancreatic progenitor like cell)阶段的标志性分子为Sox9和Pdx1。免疫荧光结果显示在iPS阶段,Oct4和Nanog在几乎100%的细胞中表达,DE和PPLC阶段的标志性分子不表达。在DE阶段,Foxa2和Sox17在大约70%的细胞中表达,Sox17表达强度更高。在PPLC阶段,Foxa2的表达仍然存在,同时Sox9和Pdx1开始表达,Sox9的表达在大约50%的细胞中,Pdx1表达在大约40%的细胞中。绿色荧光即为阳性信号,蓝色为DAPI染料染的核。WT即野生型小鼠来源的细胞,KPC为KPC小鼠来源的细胞,WT-KP为K-Ras
另外,发现在PPLC阶段用非复制型Ad5-cre病毒感染WT-KP细胞,使K-Ras
另外,通过转录组测序分析发现iPS细胞来源的KP-AC胰腺癌细胞系的转录组与KPC小鼠来源的胰腺癌细胞系(如TB11381、TB32043、TB32047等)有80%左右的相似性(图7),这提示WT-KP iPS来源的胰腺癌细胞系可以用来做胰腺癌的全细胞肿瘤疫苗。
同理,图10为WT-KP iPS细胞向肺祖细胞分化再转化为肺癌细胞在显微镜下的形态变化。WT-KP iPSCs在iPS细胞阶段呈现为在饲养层细胞上的贴壁克隆球;之后悬浮培养形成拟胚体,呈现圆的悬浮克隆球,生长很快,随着小分子化合物的诱导往内胚层方向分化;接下来,贴壁培养向前肠内胚层分化,克隆球内有细胞往四周爬出;在分化到肺祖细胞阶段可观察到出现类似胚胎发育早期形成的肺芽的结构;感染Ad-Cre后,细胞逐步转化为典型的肿瘤细胞形态且能持续传代,把此细胞系命名为KPLC,而不感染Ad-Cre的细胞在几代之内逐渐衰老。
图11为iPS细胞向肺祖细胞分化的过程中不同阶段的标志性分子的免疫荧光检测图。iPS细胞阶段的标志性分子为Oct4,Nanog和Sox2,Endoderm阶段的标志性分子为Foxa2和Sox17,AFE(anterior foregut endoderm)阶段的标志性分子为Sox2和Nkx2.1,LP(lungprogenitors)阶段的标志性分子为Nkx2.1和Sox9。绿色或红色荧光为阳性信号,蓝色为DAPI染料染的核。
由WT-KP iPS细胞转化的肺癌细胞KPLC也被检测了肿瘤相关特性。图12为2x10
如图14所示,iPS细胞来源的KPLC肺癌细胞系的转录组与KP小鼠来源的肺癌细胞系(KPL 160302S和KPL 160424S)的相似性很高,而与iPS来源的KP-AC胰腺癌细胞系和KPC小鼠来源的胰腺癌细胞系(TB11381)的相似性较低,这表明WT-KP iPS来源的肺癌细胞可以用来做肺癌的全细胞肿瘤疫苗。
实施例6:用溶瘤病毒Ad和VV分别预先感染实施例4中的胰腺癌细胞系,然后用MMC处理使其不能增殖,在四周大的KPC小鼠皮下先接种Ad预感染的肿瘤细胞系,间隔四周在同侧小鼠皮下接种VV预感染的细胞系,观察两次免疫对KPC小鼠产生的免疫保护作用。结果发现经过这种免疫方案的KPC小鼠比对照组小鼠生存期有显著延长(见图8)。
用同样的疫苗制作方法处理KPLC而制作成肺癌疫苗,在经Ad-Cre滴鼻后2.5周的KP小鼠皮下先接种Ad预感染的肿瘤细胞系,间隔四周在同侧小鼠皮下接种VV预感染的细胞系,此免疫方案的KP小鼠比对照组小鼠生存期显著延长(见图15)。
同时发现这种免疫方案能引起T细胞介导的免疫保护,图9为免疫后不同时间点的KPC小鼠胰腺组织中浸润的CD8
虽然用上述实施方式描述了本发明,应当理解的是,在不背离本发明的精神的前提下,本发明可进行进一步的修饰和变动,且这些修饰和变动均属于本发明的保护范围之内。
- 携带突变的肿瘤驱动基因的干细胞及其用途
- 一种携带有GCH1基因突变的诱导多能干细胞及分化为神经前体细胞的制备方法
