一种体外诱导造血干细胞向调节性T细胞分化的方法
文献发布时间:2023-06-19 11:08:20
技术领域
本发明涉及生物技术领域,更具体地说涉及一种体外诱导造血干细胞向调节性T细胞分化的方法。
背景技术
器官移植等现已成为治疗终末期器官衰竭的唯一有效手段。器官移植术后患者必须终身服用免疫抑制药物来预防移植排斥和移植物抗宿主病(GVHD)等多种移植免疫疾病。长期服用免疫抑制药物可诱发感染,肿瘤复发,慢性移植物失功能等。为了减少以上副作用,各国的器官移植中心均尝试停用免疫抑制药物,但是药物的停用亦有可能导致肝肾功能异常,代谢紊乱乃至慢性排斥等疾病,停药成功者均为个例报道。因此,寻求能有效诱导移植物内免疫平衡和自我耐受的治疗策略,进而减少或停用免疫抑制药物已成为移植领域的热点课题。
调节性T细胞(Tregs)是一种具有免疫调节功能的T细胞亚群,它参与维持机体免疫平衡。Tregs包括诱导型Tregs(iTregs)和自然Tregs(nTregs),多项体内外研究已显示,Tregs能够通过抑制T细胞,B细胞,NK细胞和树突状细胞等多种免疫细胞的激活、扩增、分化以及效应功能发挥免疫抑制作用。多项报道表明Tregs在肝脏免疫的调节中发挥重要作用,Taylor等报道IL-2预处理可抑制小鼠肝纤维化,减轻肝内炎症细胞浸润,其机制与抑制肝内Th1、Th2,增加Tregs有关,提示Tregs对肝脏免疫损伤具有保护作用;Kinsey发现尾静脉注射Tregs可显著缓解免疫损伤。
近年来,Brouard等报道撤除免疫抑制剂(>1年)的肾移植患者外周血内存在高水平的Tregs;日本的移植中心采用供体抗原富集后单核淋巴细胞成功诱导移植免疫耐受,整体结果为Tregs诱导器官移植免疫耐受提供了强有力的支撑;Pu等于2007年亦报道 Tregs可有效诱导大鼠肝脏移植模型的免疫耐受,2014年在中国南京启动了世界首例自体Tregs诱导肝移植术后免疫耐受的临床研究。至今共实施Tregs治疗17例,5例进入临床撤药状态,进一步证实Tregs在移植免疫耐受中的核心作用。
目前有关调节性T细胞的应用仍受到以下条件的限制:自然产生的Tregs(天然Treg)数量少。天然Tregs在动物体内约占胸腺和外周血CD4
现有的少量临床研究中,Tregs主要由幼稚T细胞在包被CD3/CD28的磁珠和IL-2的刺激下来诱导扩增获得,虽然这种扩增方式可以获得一定量的细胞,但是这种技术也有它的弊端:1)培养易导致细胞Foxp3降低,2)扩增时间越久,Treg功能越低,3)培养成本昂贵。因此寻找新的调节性T细胞来源并建立其制备的标准流程是Tregs开展临床应用的前提。
造血干细胞(Hematopoieticstemcells,HSCs)是血液系统中的成体干细胞,是一个异质性的群体,具有长期自我更新的能力和分化成各类成熟血细胞的潜能。在生理环境下,造血干细胞可募集在胸腺中,并在其环境刺激下,经历增殖、定向分化、TCR重排、β选择、阳性选择和阴性选择等复杂发育过程,最终形成一个具有高度多样性的T细胞库。胸腺内T细胞发育包括DN(双阴)、DP(双阳)和SP(单阳)三个主要阶段,DN阶段又可以分为DN1-4四个不同阶段,其表面标志物分别为:LinCD25-CD44+、LinCD25+CD44+、 LinCD25+CD44-、LinCD25-CD44-,DP细胞其表面标志物分别为:CD3+CD4+CD8+,SP细胞其表面标志物分别为:CD3+CD4-CD8+或CD3+CD4+CD8-。90年代中期,国际上就有了开展造血干细胞向T淋巴细胞分化的研究,但均需要运用胸腺上皮细胞加入刺激,而胸腺上皮细胞获得困难,存在伦理问题,遂无深入研究报道。近年来,多家团队建立了无胸腺细胞的T细胞诱导方案,取得了较好的诱导效果。Pawelec等建立了一种限制性稀释的无性培养体系,该体系添加flt-3配基、IL-3、干细胞因子(SCF)、IL-2等细胞因子,支持 CD34干细胞在缺乏胸腺基质的环境下向T细胞分化,进一步验证显示在有丝分裂原刺激下可产生增殖反应,提示其为成熟的T细胞;Sanchez等则从脐血中分离出一种特异性细胞亚群,可诱导CD34在SCF与IL-7的刺激下转化为CD4+CD8+CD45RA+T细胞。然而,以上所获得的T细胞不能进一步分化为具有免疫调节功能的T辅助细胞(Tregs,Th2等),其原因与缺乏胸腺基底细胞的信号刺激有关。
故现需要建立有效的制备造血干细胞来源Tregs的方法,来解决上述问题。
发明内容
本发明克服了现有技术中的不足,提供了一种体外诱导造血干细胞向调节性T细胞分化的方法,利用该方法产生的调节性T细胞数量多且具有较强的免疫调节功能,不仅可用于Tregs的基础研究,也可作为良好的免疫抑制剂使用。
本发明的目的通过下述技术方案予以实现。
一种体外诱导造血干细胞向调节性T细胞分化的方法,具体步骤如下:
第一步,采集血液;
第二步,对血液进行分离、分选获得到CD34+、CD38+和CD39+;
第三步,选择所述第二步的残留细胞,分选获得CD14+细胞,对该CD14+细胞进行扩增,得到大量的DC细胞;
第四步,对所述第二步中分选得到的CD34
第五步,在所述第四步加入所述第三步中的DC细胞进行第二次诱导,得到CD4
第六步,运用流式分选CD3
优选地,所述第二步中对血液进行分离的具体方法如下:
步骤一,运用2倍生理盐水稀释血液,再向20ml人淋巴细胞分离液上缓慢加入稀释后的血液25ml,在4℃以1500-2000r/min离心25min,吸取离心后中间白色的细胞层即可得到外周血的淋巴细胞;
步骤二,运用流式抗体染色CD34、CD38、CD39,再将所述步骤一中的外周血的淋巴细胞放入流式细胞分选仪分选获得CD34
由上述任一方案优选地是,所述第三步中获得DC细胞的方法为:
步骤一,选择所述第二步的残留细胞,运用流式抗体染色CD14,再将PBMC放入流式细胞分选仪分选获得CD14+细胞;
步骤二,对CD14+细胞进行30Gy辐照;
步骤三,以0.5-1.0X106/ml细胞浓度接种于培养盘中,加入1000U/ml GM-CSF,以及 1000U/ml IL-4进行刺激6天完成扩增,获得DC细胞。
由上述任一方案优选地是,所述第四步中第一次诱导的方法为:对分选所得的CD34
由上述任一方案优选地是,所述第四步中的培养基为α-MEM培养基中添加青霉素100U/ml、链霉素100μg/ml和50mM二羟基乙醇配制而成。
由上述任一方案优选地是,所述第四步中加入胸腺素α1的浓度为40ng/ml。
由上述任一方案优选地是,所述第四步中加入IL-2的浓度为100U/ml,IL-3的浓度为20ng/ml,TGF-β的浓度为100ng/ml。
由上述任一方案优选地是,所述第五步中第二次诱导的方法为:
步骤一,所述第四步中诱导第14天,加入辐照处理的DC细胞和IL-2、IL-3、IL-15、TGF-β以及全反式维甲酸atRA重新刺激,培养9-12日;
步骤二,收集所述步骤一培养后的细胞,得到CD4
由上述任一方案优选地是,所述第五步的步骤一中,所述第四步中诱导14天后的细胞与DC细胞比例为10:1。
由上述任一方案优选地是,所述第五步的所述步骤一中培养的具体方法:每三天计算细胞数并增加培养基,从而保持细胞浓度在0.5X10
由上述任一方案优选地是,所述第五步中培养基由完全RPMI-1640培养基中添加青霉素100U/ml、链霉素100μg/ml、2mM左旋谷氨酸、10mM 4-羟乙基哌嗪乙磺酸、0.1mM 非必须氨基酸、1mM丙酮酸钠和50mM二羟基乙醇配制而成。
由上述任一方案优选地是,所述第五步中加入IL-2的浓度为100U/ml、IL-3的浓度为20ng/ml、IL-15的浓度为10ng/ml、TGF-β的浓度为100ng/ml、10nM atRA。
由上述任一方案优选地是,所述第六步对高纯度的调节性T细胞进行进行刺激、培养扩增的具体方法为:加入辐照处理的DC细胞和IL-2、IL-15、atRA和TRAF6,培养直至细胞数达到目的扩增量。
由上述任一方案优选地是,所述第六步中培养的具体方法:每三天计算细胞数并增加培养基,从而保持细胞浓度在0.5X10
由上述任一方案优选地是,所述第六步中加入IL-2的浓度为100U/ml、IL-15的浓度为10ng/ml、10nM atRA、TRAF6的浓度为10ng/ml。
本发明的有益效果为:
本发明采用人外周血中分离CD34
IL-15、TGF-β、atRA、TRAF6不仅参与了T细胞的分化,还能够促进Tregs的生成,辐照的DC细胞提供了类似胸腺基底细胞的作用,同时为T细胞的激活分化提供了有效的(TCR)信号通路,最终达到增加Foxp3的转录的目的。胸腺素α1浓度为40ng/ml,高浓度胸腺素α1可建立胸腺环境,促进Tregs的分化形成,TRAF6可稳定并提高Tregs得率。
附图说明
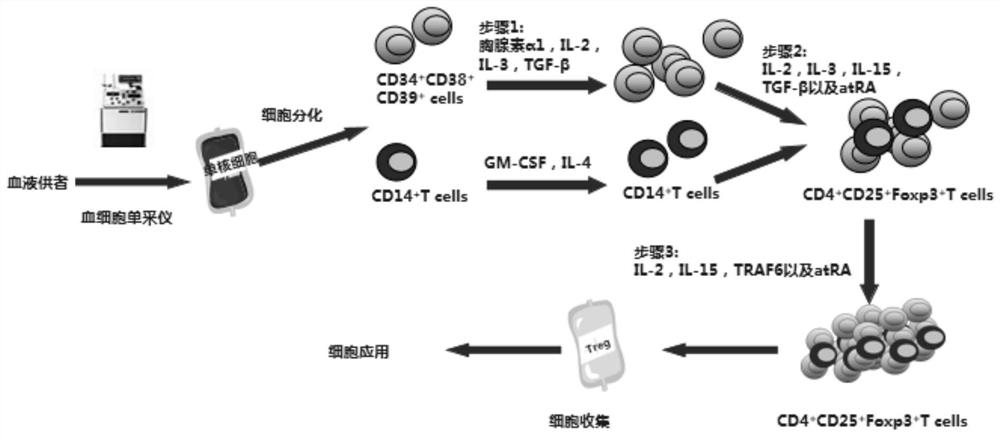
图1为分化方案流程图;
图2为磁珠Tregs与分化所得Tregs体外扩增数量对比图;
图3为磁珠Tregs与分化所得Tregs扩增中CD25,Foxp3双阳性细胞数;
图4为磁珠Tregs与分化所得Tregs对T细胞的抑制效果统计图;
图5为磁珠Tregs与分化所得Tregs对T细胞的抑制效果流式图;
图6为磁珠Tregs与分化所得Tregs对LPS刺激的T细胞细胞因子表达的抑制效果统计图;
图7为异种移植物抗宿主病的生存情况图;
图8为异种移植物抗宿主病的体重变化图;
图9为异种移植物抗宿主病的病理检测图。
具体实施方式
下面通过具体的实施例对本发明的技术方案作进一步的说明。
实施例一
材料:人外周血。
仪器:流式细胞分选仪,流式细胞仪(BD公司,型号:Vantage SE)。
试剂:流式抗体(CD3,CD4,CD34,CD38,CD39,Foxp3等)购自eBioscience,rhIL-2(加入后最终浓度为100IU/ml),rhIL-15(10ng/ml),atRA(加入后最终浓度为10nM)购自惠氏制药。培养基1由α-MEM培养基中添加青霉素100U/ml,链霉素100μg/ml和50mM 二羟基乙醇配制而成。培养基2由完全RPMI-1640培养基中添加100U/ml青霉素,100u g/ml链霉素,2mM左旋谷氩酸,10mM 4-羟乙基哌嗪乙磺酸,0.1mM非必需氨基酸,1mM 丙酮酸钠(以上购于BioSource International公司)和50uM二羟基乙醇(购于Sigma Aldrich公司)配制而成。
如图1实验步骤如下:
1.1体外分化干细胞以获得调节性T细胞
第一步,采集:采用肝素抗凝常规采血手段采集血液
第二步,分离:运用2倍生理盐水稀释血液,再向20ml人淋巴细胞分离液(购于上海欧韦达仪器科技有限公司)上缓慢加入稀释后的血液25ml,在4度以1500-2000转/ 分离心25分钟,吸取离心后中间白色的细胞层即可得到外周血的淋巴细胞(PBMC),运用流式抗体染色CD34、CD38、CD39,再将PBMC放入流式细胞分选仪分选获得CD34
第三步,DC细胞准备:选择第二步的残留细胞,运用流式抗体染色CD14,再将PBMC放入流式细胞分选仪分选获得CD14
第四步,第一次刺激:第一天,向所述第一步中获得的CD34
培养基1为α-MEM培养基中添加青霉素100U/ml,链霉素100μg/ml和50mΜ二羟基乙醇配制而成
第五步,第二次刺激:以上所得细胞加入胸腺素α1(40ng/ml),IL-2(100U/ml),IL-3(20ng/ml),IL-15(10ng/ml),TGF-β(100ng/ml)和atRA(10mM),辐照处理的 DC细胞(10:1)培养9-12天,每三天计算细胞数,并根据细胞密度分盘,补充培养基以及以上细胞因子(培养基2)。
培养基2由完全RPMI-1640培养基中添加青霉素100U/ml,链霉素100μg/ml,2mM左旋谷氨酸,10mM 4-羟乙基哌嗪乙磺酸,0.1mM非必须氨基酸,1mM丙酮酸钠和50mΜ二羟基乙醇配制而成。
第六步,第三次刺激:以上所得细胞加入IL-2(100U/ml),IL-15(10ng/ml),TRAF6(10ng/ml)和atRA(10mM),辐照处理的DC细胞(10:1)培养9天,每三天计算细胞数,并根据细胞密度分盘,补充培养基以及以上细胞因子(培养基2)。
使用细胞前,将上述细胞在含有10%FBS和rh-IL-2(1000IU/ml)的RPMI 1640培养基中休息24小时,收集上述细胞,即为调节性T细胞。
培养基2由完全RPMI-1640培养基中添加青霉素100U/ml,链霉素100μg/ml,2mM左旋谷氨酸,10mM 4-羟乙基哌嗪乙磺酸,0.1mM非必须氨基酸,1mM丙酮酸钠和50mΜ二羟基乙醇配制而成。
如图2所示运用CD4、CD25、CD127磁珠分选人外周血的CD4
如图3所示运用CD4、CD25、CD127磁珠分选人外周血的CD4
1.2分化所得调节性T细胞的分析鉴定
1.2.1将本发明所得的调节性T细胞,anti-CD3/CD28磁珠诱导形成的调节性T细胞按照1:5,1:10,1:20的比例与CFSE荧光标记的T细胞共培养,结果如图四4,图5所示,图3所得的磁珠Tregs或分化所得Tregs与CFSE标记的T细胞于体外共培养,加入抗CD3扩增磁珠,检测相应Tregs对T细胞扩增效率的抑制效果。分化所得Tregs表现出比拟传统方案诱导的调节性T细胞的抑制T细胞增殖的能力,同时在第浓度下,该细胞依旧拥有一定的调节功能。结论:分化所得Tregs具有与传统方案扩增类似的免疫调节能力。
1.2.2将本发明所得的调节性T细胞,anti-CD3/CD28磁珠诱导形成的调节性T细胞与LPS刺激的外周血淋巴细胞共培养三天,并流式检测细胞因子,结果如图6所示,分化所得Tregs在炎症环境下具有一定的稳定性,少量细胞向Th1,Th17细胞的分化。结论:分化所得Tregs具有与磁珠诱导的诱导性调节性T细胞(iTreg)类似的稳定性。
1.2.3将上述方法获得的Tregs单独,或者联合同种异体的荧光燃料CFSE标记的T细胞一起经尾静脉注入SCID小鼠体内,本方法所获得的的调节性T细胞自身并不致病,同时能够抑制效应T细胞的增殖,延缓或者预防GVHD的发生。如图7、图8、图9所示:对照组肝脏出现明显的肝硬化小叶,肾脏出现明显的肾小管坏死和炎症,肺部出现明显的纤维化,而以上病理变化均未出现在调节性T细胞治疗组。可见调节性T细胞具有体内抑制功能,且无毒副作用。
1.3转化研究应用举例
采人外周血,提取造血干细胞后运用上述方案分化调节性T细胞,建立人源化皮肤移植小鼠模型,并用以上细胞进行回输,剂量为5X10
由以上实验得出本发明的优点如下:
(1)造血干细胞分化所得调节性T细胞具有明显的抑制T细胞的增生;
(2)造血干细胞分化所得调节性T细胞本身没有明显的毒副作用,具有体内长期的保护作用能力。
(3)造血干细胞分化所得调节性T细胞可以代替免疫抑制剂或者减少免疫抑制剂的使用剂量,用于器官移植后期免疫维持治疗,同时可以用于自身免疫性疾病患者或I型糖尿病的治疗,这将是器官移植免疫治疗史上里程碑性的突破。
以上对本发明的一个实施例进行了详细说明,但所述内容仅为本发明的较佳实施例,不能被认为用于限定本发明的实施范围。凡依本发明申请范围所作的均等变化与改进等,均应仍归属于本发明的专利涵盖范围之内。
- 一种体外诱导造血干细胞向调节性T细胞分化的方法
- 一种含有YC-1或IL-21的用于将造血干细胞分化为自然杀伤细胞的药剂以及利用该药剂将造血干细胞分化成自然杀伤细胞的方法
