含油种子提取方法
文献发布时间:2023-06-19 11:11:32
相关申请的交叉引用
本申请要求于2018年9月13日提交的美国临时申请号62/730707的优先权利益,该临时申请的内容以其整体并入本文。
背景
本公开的领域一般涉及从含油种子中提取油、可溶性碳水化合物和抗营养化合物。
来自诸如油菜籽、大豆和葵花(籽)之类的含油种子的油通常通过压榨、溶剂提取或两者来提取,以产生将被进一步处理并最终精制用于不同用途的油。压榨和溶剂提取过程均生成主要用于动物饲料的粕(meal)。经压榨的粕可直接销售而无需进一步处理,但是经溶剂提取的粕在销售之前必须脱溶剂和烘烤。
在大豆的情况中,用于提取的全脂薄片状大豆的制备包括清洁含油种子,然后进行破碎、去皮、调理(conditioning)和制成薄片。在现有技术方法中,用己烷提取全脂大豆薄片以生成富含油的油与溶剂混合物(miscella)流和经提取的粕。在葵花(籽)或油菜籽的情况中,油提取通常发生在第一压榨阶段以生成油和饼,以及第二溶剂提取步骤以生成富含油的油与溶剂混合物流和经提取的粕。在各种现有技术提取方法中的任意种中,将经提取的粕在升高的温度下脱溶剂/烘烤以生成粕,并将油与溶剂混合物蒸馏以生成粗制油和用于再循环的回收的溶剂。除了合意的蛋白质之外,该粕特征性地含有不想要的抗营养化合物,其包括但不限于过敏原性蛋白质、可溶性碳水化合物、植酸盐、皂苷、蛋白酶抑制剂、多酚(polyphenolics)、单宁、凝集素和葡糖酸盐。
可以进一步处理经脱溶剂/烘烤的粕,以产生具有降低的可溶性碳水化合物和抗营养物质水平的粕浓缩物。通常,此类进一步处理是用水-乙醇混合物进行第二次提取,以去除可溶性碳水化合物和一些抗营养物质。现有技术提取方法通常被设计成使油的去除最大化,而不考虑所得粕的组成。脱溶剂/烘烤使一部分的一种或更多种抗营养化合物失活。成问题的是,脱溶剂/烘烤导致糖和蛋白质之间的美拉德反应(Maillard reaction),从而使得一部分糖不可利用于后续的提取(例如使用乙醇/水),降低了粕的可消化蛋白质价值,并且降低了去除可溶性碳水化合物(例如糖)和抗营养化合物的提取效率。更尤其,在现有技术方法中,在真空下对粕进行脱溶剂时,约10%的可溶性碳水化合物变得不可利用,并且在没有真空和烘烤的情况下对粕进行脱溶剂时,约25%至35%的可溶性碳水化合物变得不可利用。
因此对从含油种子粕(oilseed meal)中提取油、可溶性碳水化合物和抗营养化合物,从而提供具有提高的蛋白质含量和降低的抗营养化合物含量的粕浓缩物的改进的方法存在着需求。
简述
在本公开的一些方面,提供了从含油种子中提取油和可溶性碳水化合物以形成经提取的含油种子粕的方法。该方法包括按任何顺序实施的如下文详细描述的步骤(a)和(b)。
在至少一个可溶性碳水化合物提取步骤(a)中,(i)使包含油、蛋白质和可溶性碳水化合物的全脂薄片状含油种子或经提取的含油种子粕与有机极性溶剂和水接触;和(ii)分离极性溶剂和水,以形成包含可溶性碳水化合物的提取极性溶剂和经提取的含油种子粕。
在至少一个油提取步骤(b)中,(i)使包含油、蛋白质和可溶性碳水化合物的全脂薄片状含油种子或粗制经提取的含油种子粕与非极性溶剂接触;和(ii)分离非极性溶剂,以形成包含油的提取非极性溶剂和经提取的含油种子粕。
至少一个可溶性碳水化合物提取步骤或至少一个油提取步骤之后的经提取的全脂薄片状含油种子粕称为粗制经提取的含油种子粕。至少一个可溶性碳水化合物提取步骤和至少一个油提取步骤两者之后的经提取的全脂薄片状含油种子粕称为成品经提取的含油种子粕。固体全脂薄片状含油种子事先未经溶剂提取或事先未经热处理。
提取极性溶剂包含至少50 wt.%的含在固体全脂薄片状含油种子中的可溶性碳水化合物。提取非极性溶剂包含至少75 wt.%的含在固体全脂薄片状含油种子中的油。成品经提取的含油种子粕的特征在于蛋白质与油的wt.%比率为至少55:1,且蛋白质与碳水化合物的wt.%比率为至少10:1。
在本公开的一些其它方面,提供了从含油种子中提取油和可溶性碳水化合物以形成经提取的含油种子粕的方法。该方法包括如下文详细描述的步骤(a)和(b)。
在提取步骤(a)中,使包含油、蛋白质和可溶性碳水化合物的固体全脂薄片状含油种子与极性溶剂和非极性溶剂的共沸物接触。在此类方面,固体全脂薄片状含油种子事先未经溶剂提取或事先未经热处理。在分离步骤(b)中,分离共沸溶剂,以形成(i)包含可溶性碳水化合物和油的提取共沸溶剂、和(ii)经提取的含油种子粕。可以根据步骤(a)和(b)对经提取的含油种子粕进行至少一次额外的提取。提取共沸溶剂包含至少75 wt.%的含在固体全脂薄片状含油种子中的油。经提取的含油种子粕的特征在于蛋白质与油的wt.%比率为至少55:1,且可溶性碳水化合物与油的wt.%比率为至少4:1。
附图简述
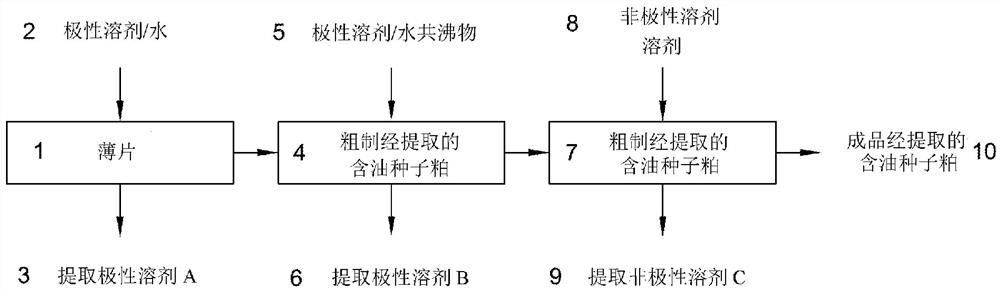
图1A描绘了本公开的一个方面,其通过用极性溶剂和水提取、用极性溶剂和水的共沸物提取和用极性溶剂提取的顺序,从薄片状含油种子中提取可溶性碳水化合物和油。
图1B描绘了本公开的一个方面,其通过用非极性溶剂提取、然后用极性溶剂和水提取的顺序,从含油种子薄片中提取可溶性碳水化合物和油。
图2A描绘了本公开的一个方面,其通过以下方式从薄片状含油种子中提取可溶性碳水化合物和油:用包含70%乙醇和30%水的溶剂进行一系列五次提取以产生包含可溶性碳水化合物的提取溶剂(P1至P5)和经提取的薄片,然后用乙醇/水共沸物提取薄片以产生包含可溶性碳水化合物的提取溶剂(P6)和经提取的薄片,随后用己烷进行一系列四次提取以产生包含己烷和油的油与溶剂混合物(N-P1至N-P4)和具有高蛋白质含量以及低的油和可溶性碳水化合物含量的经提取的薄片。
图2B描绘了本公开的一个方面,其通过以下方式从薄片状含油种子中提取可溶性碳水化合物和油:用己烷进行一系列五次提取以产生包含油的提取溶剂(N-P1至N-P5)和经提取的薄片,然后用包含70%乙醇和30%水的溶剂对薄片进行一系列五次提取以产生包含可溶性碳水化合物的提取溶剂(P1至P5)和具有高蛋白质含量、低的油和可溶性碳水化合物含量的经提取的薄片。
图3描绘了用溶剂对含油种子薄片进行提取的实验装置。
图4A描绘了实施例2的规程,其通过用己烷和甲醇的共沸物(“Hex:MeOH”)按序提取全脂薄片状大豆来生成油与溶剂混合物流(命名为M1至M7)。图4B描绘了实施例2的规程,其先后用油与溶剂混合物流(按M2至M7的顺序)和新鲜的Hex:MeOH逆流提取全脂薄片状大豆,其中“7xb薄片”是指成品经提取的薄片状大豆。
图5描绘了实施例3的提取规程,其中A是初始的全脂薄片,B是所得的经提取的薄片,C是70%乙醇和30%水的混合物,D是主要包含碳水化合物的所得溶剂,E是新鲜的己烷,且F是主要包含油的所得溶剂。流N-P2至N-P5是中间己烷/油流,且P2至P6是主要包含乙醇和糖的中间流。
详述
本公开涉及用以产生具有提高的蛋白质含量以及降低的可溶性碳水化合物(例如糖)和抗营养化合物含量的含油种子粕浓缩物的改进的含油种子提取方法。更尤其,本公开的提取方法消除了对于在可溶性碳水化合物提取之前的脱溶剂/烘烤步骤的需求,从而允许相比于现有技术方法提高油提取效率,同时允许有效去除约20%直至约90%的可溶性碳水化合物(例如糖)和抗营养化合物。
在本公开的一些方面,含油种子提取方法包括在第一提取步骤中从薄片状含油种子粕中提取油和可溶性碳水化合物,该第一提取步骤包括用包含水的有机极性溶剂按序提取薄片状含油种子粕以提取可溶性碳水化合物和抗营养化合物,然后用非极性溶剂进行提取以提取可溶性碳水化合物,或反之亦然。
在本公开的一些其它方面,含油种子提取方法包括用极性溶剂(例如包含水的有机极性溶剂)和非极性溶剂的共沸物从薄片状含油种子粕中同时提取油和可溶性碳水化合物。
适用于本公开的含油种子包括但不限于大豆、葵花(籽)、玉米、芥花籽(油菜籽)、芝麻、棕榈仁、棉(籽)、亚麻(籽)和花生。
下表A中指明了各种含油种子的典型组成(基于干重计):
表A
如本文所使用的“可溶性碳水化合物”通常是指在本文描述的极性溶剂中,在25℃下具有至少5 g/L、至少10 g/L、至少25 g/L或至少50 g/L的溶解度的碳水化合物。可溶性碳水化合物的非限制性实例包括蔗糖、果糖、麦芽糖、半乳糖、葡萄糖、寡糖(例如棉子糖、水苏糖和毛蕊花糖)、肌醇、肌醇半乳糖苷、二半乳糖基肌醇、三半乳糖基肌醇、D-松醇、半乳糖松醇(galactopinitol)A、二半乳糖基松醇A(ciceritol)、三半乳糖基松醇A、半乳糖松醇B、D-手性肌醇、荞麦醇(fagopyritol)B1、荞麦醇B2、荞麦醇B3、D-芒柄醇、半乳糖基d-芒柄醇和二半乳糖基d-芒柄醇。
如本文所使用的“糖”通常是指单糖、二糖和三糖,其包括但不限于蔗糖、果糖、葡萄糖、半乳糖、麦芽糖、水苏糖和棉子糖。
在本公开的各种方面中的任意种中,可通过本领域已知的方法适当地处理含油种子,以产生薄片状含油种子原料。此类含油种子处理通常包括以下顺序的步骤:清洁、破碎、去皮、调理和制成薄片。清洁通常包括去除金属(例如使用磁力分离器),然后筛选以去除尺寸过小的杂质(例如沙)和尺寸过大的杂质(例如纸、塑料等)。破碎包括减小含油种子尺寸(例如将种子减小至4-6片)并使种子(肉)的含油部分可利用于提取,并且通常包括使经清洁的含油种子通过破碎辊以使种子破开并将尺寸减小到规定的尺寸范围。可以例如通过空气抽吸和任选的筛选来将破裂的种子去皮,其中将轻质外皮与种子的重质含油(肉)部分分离。肉可以通过加热(例如加热至约40-70℃)进行调理,并任选地在高达约80℃的温度下干燥。然后将经调理的肉制成薄片以将厚度减小到例如约0.75 mm至约0.25 mm,以便于增加提取表面积并破坏/破裂油细胞,从而改进提取效率。
在本公开的一些实施方案中,固体全脂薄片状含油种子事先未经溶剂提取或事先未经热处理。
各种提取溶剂、溶剂体系和共沸物在本公开的范围内。
合适的有机极性溶剂包括但不限于甲醇、乙醇、异丙醇、正丙醇、正丁醇、四氢呋喃、乙酸乙酯、丙酮和二甲基甲酰胺、及其组合。在一些方面,有机极性溶剂是醇。在一些方面,有机极性溶剂是甲醇或乙醇。在一些其它方面,有机极性溶剂是水和醇(例如甲醇和水或乙醇和水)的组合。有机极性溶剂通常适用于提取亲水性含油种子组分,例如可溶性碳水化合物和其它抗营养物质。
合适的非极性溶剂包括但不限于饱和烃。非限制性实例包括戊烷、环戊烷、己烷和环己烷、及其混合物。在一些方面,非极性溶剂是己烷。非极性溶剂通常适用于从含油种子中提取疏水性油。
共沸物包括但不限于醇和水的组合、以及如在本文别处描述的有机极性溶剂和如在本文别处描述的非极性溶剂的组合。有机极性溶剂和非极性溶剂的共沸物适用于提取亲水性含油种子组分和疏水性含油种子组分两者。建立共沸物所要求的溶剂浓度通常是本领域中已知的。例如,乙醇/水二元共沸物包含约3 wt.%水、约3.5 wt.%水、约4 wt.%水、约4.5wt.%水或约5 wt.%水,其余部分为乙醇。正丙醇/水二元共沸物包含约17 wt.%水、约17.5wt.%水、约18 wt.%水、约18.5 wt.%水、约19 wt.%水或约19.5 wt.%水,其余部分为正丙醇。异丙醇/水二元共沸物包含约37 wt.%水、约37.5 wt.%水、约38 wt.%水、约38.5 wt.%水、约39 wt.%水或约39.5 wt.%水,其余部分为异丙醇。甲醇/己烷二元共沸物包含约26 wt.%甲醇、约26.5 wt.%甲醇、约27 wt.%甲醇、约27.5 wt.%甲醇、约28 wt.%甲醇、约28.5 wt.%甲醇、约29 wt.%甲醇、约29.5 wt.%甲醇或约30 wt.%甲醇,其余部分为己烷。乙醇/己烷二元共沸物包含约18 wt.%乙醇、约18.5 wt.%乙醇、约19 wt.%乙醇、约19.5 wt.%乙醇、约20wt.%乙醇、约20.5 wt.%乙醇、约21 wt.%乙醇、约21.5 wt.%乙醇或约22 wt.%乙醇,其余部分为己烷。包含有机极性溶剂、非极性溶剂和水的三元共沸物(如–例如但不限于-乙醇/己烷/水和甲醇/己烷/水)也在本公开的范围内。
在一些方面,使用如在本文别处描述的共沸物的提取可产生具有两相的油与溶剂混合物。在一些此类方面,上部相可包含几乎所有的非极性溶剂(例如约95%)和几乎所有的种子油(例如至少95%),且下部相可包含几乎所有的极性溶剂(例如约90%)和几乎所有的可溶性碳水化合物(例如至少95%)。如本文中使用的“几乎所有的”是指基于体积百分比或重量百分比计,至少75%、至少85%、至少90%、至少90%、至少95%、至少98%或至少99%。
本领域已知的商业规模的设备通常适用于根据本公开的方法从含油种子中提取油和可溶性碳水化合物。
在本公开的一些方面,含油种子提取方法包括在可溶性碳水化合物提取步骤中,用包含有机极性溶剂和水的溶剂从薄片状含油种子粕中提取可溶性碳水化合物,以及在油提取步骤中,用包含非极性溶剂的溶剂从薄片状含油种子粕中提取油。所述提取步骤可按任何顺序来进行。
可溶性碳水化合物提取可包括至少一次提取或多次提取。可溶性碳水化合物提取方案可适当为分批提取、半连续提取或连续提取。在一些实施方案中,可溶性碳水化合物提取是逆流提取。
在一些此类实施方案中,可使用任选包含约10 wt.%水至约50 wt.%水的有机极性溶剂来进行可溶性碳水化合物提取。在一些此类实施方案中,有机极性溶剂是醇,如,例如甲醇或乙醇。在一些特别的方面,有机极性溶剂是乙醇。在一些特别的实施方案中,采用有机极性溶剂和水的组合,其中水含量是约10 wt.%、约15 wt.%、约20 wt.%、约25 wt.%、约30wt.%、约35 wt.%、约40 wt.%、约45 wt.%或约50 wt.%、以及从中构成的范围,例如约10wt.%至约50 wt.%、约20 wt.%至约40 wt.%或约25 wt.%至约35 wt.%。在一些实施方案中,使用任选包含约10 wt.%水至约50 wt.%水的有机极性溶剂(例如乙醇)来进行薄片状含油种子的1次提取或2次、3次、4次、5次、6次、7次、8次、9次或10次按序提取、以及从中构成的范围,例如2至8次提取、3至7次提取或4至6次提取。可任选进行逆流提取方案。
在一些此类实施方案中,可使用如在本文别处描述的有机极性溶剂和水的共沸物来进行可溶性碳水化合物提取。在一些特别的实施方案中,共沸物是乙醇:水。在一些实施方案中,可使用共沸物来进行1次提取或2次、3次、4次或5次按序提取、以及从中构成的范围,例如2至5次提取或1至3次提取。对于多次提取实施方案,可任选进行逆流提取方案。例如,共沸提取可将经提取的含油种子中的水含量降低约0.5 wt.%、约0.6 wt.%、约0.7wt.%、约0.8 wt.%、约0.9 wt.%或约1 wt.%。
在一些实施方案中,可先后使用至少一次采用任选包含约10 wt.%水至约50 wt.%水的有机极性溶剂的第一可溶性碳水化合物提取和至少一次采用有机极性溶剂和水的共沸物(例如乙醇:水)的第二可溶性碳水化合物提取来进行可溶性碳水化合物提取。一种此类提取实施方案一般性地描绘于图1A中,其中用非共沸有机极性溶剂:水2来提取全脂含油种子薄片1至少一次,以形成提取极性溶剂A 3和粗制经提取的含油种子粕4。用有机极性溶剂/水共沸物5提取粗制经提取的含油种子粕4至少一次,以形成提取极性溶剂B 6,并用非极性溶剂8提取粗制经提取的含油种子粕7,得到溶剂C 9。该方法生成经提取的粕10。
在一些其它实施方案中,如图1B中一般性地描绘的,用非极性溶剂2提取全脂含油种子薄片1至少一次,以形成提取极性溶剂A 3和粗制经提取的含油种子粕4。用有机极性溶剂/水5提取粗制经提取的含油种子粕4至少一次,以形成成品粕7和所得的溶剂B 6。
在各种可溶性碳水化合物提取中的任意种中,溶剂与含油种子的重量比为约0.5:1、约0.75:1、约1:1、约1.1:1、约1.5:1、约2:1、约2.5:1、约3:1、约3.5:1或约4:1、以及从中构成的范围,例如约0.5:1至约4:1、约1:1至约3:1、约1.1:1至约3:1、约1.1:1至约2:1或约1.1:1至约1.5:1。在一些此类实施方案中,至少一个可溶性碳水化合物提取步骤中的溶剂以与含油种子粕相比过量的wt.%存在。在一些实施方案中,各可溶性碳水化合物提取步骤中的溶剂以与含油种子粕相比过量的wt.%存在。
可溶性碳水化合物提取温度适当为约25℃、约30℃、约35℃、约40℃、约45℃、约50℃、约55℃、约60℃、约65℃、约70℃、直至比提取溶剂的沸点低约5℃、以及从中构成的范围,例如约25℃至比溶剂沸点低约5℃、约40℃至比溶剂沸点低约5℃、约40℃至约70℃、约50℃至约70℃或约55℃至约65℃。
在各种可溶性碳水化合物提取实施方案中的任意种中,至少20 wt.%、至少30wt.%、至少40 wt.%、至少50 wt.%、至少60 wt.%、至少70 wt.%、至少80 wt.%或至少90 wt.%的含在含油种子粕中的可溶性碳水化合物被提取进入极性溶剂中。
在各种糖提取实施方案中的任意种中,其中糖提取在油提取之前进行,从中提取了糖的含油种子(称为粗制经提取的含油种子粕)可表征如下。总蛋白质含量为约45 wt.%、约46 wt.%、约47 wt.%、约48 wt.%、约49 wt.%、约50 wt.%、约51 wt.%、约52 wt.%、约53wt.%、约54 wt.%、约55 wt.%、约56 wt.%、约57 wt.%、约58 wt.%、约59 wt.%或约60 wt.%、以及从中构成的范围,例如约45 wt.%至约60 wt.%、约45 wt.%至约55 wt.%或约48 wt.%至约53 wt.%。总可溶性碳水化合物含量为低于10 wt.%、低于5 wt.%、约2.5 wt.%、约3 wt.%、约3.5 wt.%、约4 wt.%、约4.5 wt.%、约5 wt.%、约5.5 wt.%或约6 wt.%、以及从中构成的范围,例如约2.5 wt.%至约6 wt.%或约3 wt.%至约5 wt.%。总油含量通常与未经提取的含油种子的油含量相当。蛋白质与油的重量比为约1.8:1、约1.9:1、约2:1、约2.1:1、约2.2:1、约2.3:1、约2.4:1或约2.5:1、以及从中构成的范围,例如约1.8:1至约2.5:1或约1.8:1至约2.2:1。可溶性碳水化合物与蛋白质的重量比为约0.4:1、约0.35:1、约0.3:1、约0.25:1、约0.2:1、约0.15:1或约0.1:1、以及从中构成的范围,例如约0.1:1至约0.4:1或约0.15:1至约0.3:1。蛋白质与可溶性碳水化合物的重量比为约10:1、约11:1、约12:1、约13:1、约14:1、约15:1或约16:1、以及从中构成的范围,例如约10:1至约16:1或约12:1至约14:1。
油提取可包括至少一次提取或多次提取。油提取方案可适当为分批提取、半连续提取或连续提取。在一些实施方案中,油提取是逆流提取。
在一些此类实施方案中,可使用如在本文别处描述的非极性溶剂进行油提取。在一些特别的方面,非极性溶剂是己烷。在一些实施方案中,可使用非极性溶剂进行含油种子的1次提取或2次、3次、4次、5次、6次、7次、8次、9次或10次按序提取、以及从中构成的范围,例如2至8次提取、1至6次提取、2至6次提取、2至5次提取或3至5次提取。可任选进行逆流提取方案。
一种此类油提取实施方案描绘于图1A和图1B中,图1A中用非极性溶剂8提取粗制经提取的含油种子粕7至少一次,以形成提取非极性溶剂9和成品经提取的含油种子粕10,图1B中用非极性溶剂2提取薄片1至少一次,以形成提取非极性溶剂3。
在各种油提取中的任意种中,非极性溶剂与含油种子的重量比为约0.5:1、约0.75:1、约1:1、约1.1:1、约1.5:1、约2:1、约2.5:1、约3:1、约3.5:1或约4:1、以及从中构成的范围,例如约0.5:1至约4:1、约1:1至约3:1、约1.1:1至约3:1、约1.1:1至约2:1或约1.1:1至约1.5:1。在一些此类实施方案中,至少一个油提取步骤中的溶剂以与含油种子粕相比过量的wt.%存在。在一些实施方案中,各油提取步骤中的溶剂以与含油种子粕相比过量的wt.%存在。
在各种油提取实施方案中的任意种中,至少55 wt.%、至少60 wt.%、至少65 wt.%、至少70 wt.%、至少75 wt.%、至少80 wt.%、至少85 wt.%或至少90 wt.%的含在全脂含油种子粕中的油被提取进入非极性溶剂中。
油提取温度适当为约25℃、约30℃、约35℃、约40℃、约45℃、约50℃、约55℃、约60℃、约65℃、约70℃、直至比提取溶剂的沸点低约5℃、以及从中构成的范围,例如约25℃至比溶剂沸点低约5℃、约40℃至比溶剂沸点低约5℃、约40℃至约70℃、约50℃至约70℃或约55℃至约65℃。
在包括使用有机极性溶剂和使用非极性溶剂的单独提取的各种油提取方面中的任意种中,从中提取了可溶性碳水化合物和油的含油种子(也称为成品经提取的含油种子粕)可表征如下。总蛋白质含量为约55 wt.%、约56 wt.%、约57 wt.%、约58 wt.%、约59wt.%、约60 wt.%、约61 wt.%、约62 wt.%、约63 wt.%、约64 wt.%、约65 wt.%、约66 wt.%、约67 wt.%、约68 wt.%、约69 wt.%、约70 wt.%、约71 wt.%、约72 wt.%、约73 wt.%、约74 wt.%或约75 wt.%、以及从中构成的范围,例如约55 wt.%至约75 wt.%、约60 wt.%至约75 wt.%、约55 wt.%至约72 wt.%、约60 wt.%至约70 wt.%或约65 wt.%至约70 wt.%。总可溶性碳水化合物含量为低于10 wt.%、低于5 wt.%、约2.5 wt.%、约3 wt.%、约3.5 wt.%、约4 wt.%、约4.5 wt.%、约5 wt.%、约5.5 wt.%或约6 wt.%、以及从中构成的范围,例如约2.5 wt.%至约6wt.%或约3 wt.%至约5 wt.%。总油含量为约0.5 wt.%、约0.6 wt.%、约0.7 wt.%、约0.8wt.%、约0.9 wt.%、约1.0 wt.%、约1.1 wt.%、约1.2 wt.%、约1.3 wt.%、约1.4 wt.%或约1.5wt.%、以及从中构成的范围,例如约0.5 wt.%至约1.5 wt.%或约0.7 wt.%至约1.2 wt.%。蛋白质与油的重量比为约或至少50:1、约或至少55:1、约或至少60:1、约或至少70:1、约或至少80:1、约或至少90:1、约或至少100:1、约或至少110:1、约或至少120:1、约或至少130:1、约或至少140:1或约150:1、以及从中构成的范围,例如约50:1至约150:1、约55:1至约100:1或约60:1至约80:1。可溶性碳水化合物与油的重量比为约2:1、约2.5:1、约3:1、约3.5:1、约4:1、约4.5:1、约5:1、约5.5:1、约6:1、约6.5:1、约7:1、约7.5:1或约8:1、以及从中构成的范围,例如约2:1至约8:1或约3:1至约5:1。蛋白质与可溶性碳水化合物的重量比为约或至少10:1、约或至少12:1、约或至少13:1、约或至少14:1、约或至少15:1、约或至少16:1、约或至少17:1、约或至少18:1、约或至少19:1、或约20:1、以及从中构成的范围,例如约12:1至约20:1或约14:1至约18:1。
本公开的一个特别的实施方案描绘于图2A中。在步骤1中,用乙醇:水70:30提取全脂含油种子薄片,以产生提取溶剂P1和经提取的含油种子。在步骤2中,用乙醇:水70:30(乙醇70%)进一步提取步骤1中提取的含油种子,以产生提取溶剂P2和经提取的含油种子。在步骤3中,用乙醇:水70:30进一步提取步骤2中提取的含油种子,以产生提取溶剂P3和经提取的含油种子。在步骤4中,用乙醇:水70:30进一步提取步骤3中提取的含油种子,以产生提取溶剂P4和经提取的含油种子。在步骤5中,用乙醇:水70:30进一步提取步骤4中提取的含油种子,以产生提取溶剂P5和经提取的含油种子。在步骤6中,用共沸乙醇:水96:4(乙醇96%)进一步提取步骤5中提取的含油种子,以产生提取溶剂P6和经提取的含油种子。在步骤7中,用己烷进一步提取步骤6中提取的含油种子,以产生提取溶剂N-P1和经提取的含油种子。在步骤8中,用己烷进一步提取步骤7中提取的含油种子,以产生提取溶剂N-P2和经提取的含油种子。在步骤9中,用己烷进一步提取步骤8中提取的含油种子,以产生提取溶剂N-P3和经提取的含油种子。在步骤10中,用己烷进一步提取步骤9中提取的含油种子,以产生提取溶剂N-P4和成品经提取的含油种子。图2A中描绘的方案的逆流提取方案也在本公开的范围内。
本公开的一个特别的实施方案描绘于图2B中。在步骤1中,用己烷提取全脂含油种子薄片,以产生提取溶剂N-P1和经提取的含油种子。在步骤2中,用己烷进一步提取步骤1中提取的含油种子,以产生提取溶剂N-P2和经提取的含油种子。在步骤3中,用己烷进一步提取步骤2中提取的含油种子,以产生提取溶剂N-P3和经提取的含油种子。在步骤4中,用己烷进一步提取步骤3中提取的含油种子,以产生提取溶剂N-P4和经提取的含油种子。在步骤5中,用己烷进一步提取步骤4中提取的含油种子,以产生提取溶剂N-P5和经提取的含油种子。在步骤6中,用乙醇:水70:30(乙醇70%)进一步提取步骤5中提取的含油种子,以产生提取溶剂P1和经提取的含油种子。在步骤7中,用乙醇:水70:30进一步提取步骤6中提取的含油种子,以产生提取溶剂P2和经提取的含油种子。在步骤8中,用乙醇:水70:30进一步提取步骤7中提取的含油种子,以产生提取溶剂P3和经提取的含油种子。在步骤9中,用乙醇:水70:30进一步提取步骤8中提取的含油种子,以产生提取溶剂P4和经提取的含油种子。在步骤10中,用乙醇:水70:30进一步提取步骤9中提取的含油种子,以产生提取溶剂P5和成品经提取的含油种子。针对图2B中描绘的方案的逆流提取方案也在本公开的范围内。
在本公开的一些方面,含油种子提取方法包括用有机极性溶剂和非极性溶剂的共沸物从薄片状含油种子粕中同时提取油和可溶性碳水化合物。单一相共沸物的使用进一步克服了与有机极性溶剂和非极性溶剂的混合物的非共沸相分离有关的问题。
共沸提取可包括至少一次提取或多次提取。共沸提取方案可适当为分批提取、半连续提取或连续提取。在一些实施方案中,共沸提取是逆流提取。
在本文别处描述了有机极性和非极性溶剂的合适共沸物。在一些实施方案中,共沸物是己烷/乙醇或己烷/甲醇。在一些实施方案中,共沸物是己烷/甲醇。
在一些实施方案中,可使用共沸物进行含油种子的1次提取或2次、3次、4次、5次、6次、7次、8次、9次、10次、11次或12次按序提取、以及从中构成的范围,例如2至12次提取、3至10次提取、5至9次提取或6至8次提取。可任选进行逆流提取方案。
在各种油提取中的任意种中,共沸物与含油种子的重量比为约0.5:1、约0.75:1、约1:1、约1.1:1、约1.5:1、约2:1、约2.5:1、约3:1、约3.5:1或约4:1、以及从中构成的范围,例如约0.5:1至约4:1、约1:1至约3:1、约1.1:1至约3:1、约1.1:1至约2:1或约1.1:1至约1.5:1。在一些此类实施方案中,至少一个提取步骤中的共沸物以与含油种子粕相比过量的wt.%存在。在一些实施方案中,各提取步骤中的共沸物以与含油种子粕相比过量的wt.%存在。
共沸提取温度适当为约25℃、约30℃、约35℃、约40℃、约45℃、约50℃、约55℃、约60℃、约65℃、约70℃、直至比共沸物的沸点低约5℃、以及从中构成的范围,例如约25℃至比溶剂沸点低约5℃、约40℃至比溶剂沸点低约5℃、约40℃至约70℃、约45℃至约60℃或约50℃至约55℃。
在各种共沸提取实施方案中的任意种中,至少60 wt.%、至少65 wt.%、至少70wt.%、至少75 wt.%、至少80 wt.%、至少85 wt.%或至少90 wt.%的含在全脂含油种子粕中的油被提取进入非极性溶剂中。
在各种可溶性碳水化合物提取实施方案中的任意种中,至少50 wt.%、至少60wt.%、至少70 wt.%、至少80 wt.%或至少90 wt.%的含在含油种子粕中的可溶性碳水化合物被提取进入极性溶剂中。
在各种共沸提取实施方案中的任意种中,经提取的含油种子粕可表征如下。总蛋白质含量为约50 wt.%、约52 wt.%、约54 wt.%、约56 wt.%、约58 wt.%、约60 wt.%、约62wt.%、约64 wt.%、约66 wt.%、约68 wt.%、约70 wt.%或约72 wt.%、以及从中构成的范围,例如约50 wt.%至约72 wt.%、约52 wt.%至约66 wt.%或约54 wt.%至约64 wt.%、约60 wt.%至约72 wt.%或约62 wt.%至约70 wt.%。总油含量为约0.5 wt.%、约0.6 wt.%、约0.7 wt.%、约0.8 wt.%、约0.9 wt.%、约1.0 wt.%、约1.1 wt.%、约1.2 wt.%、约1.3 wt.%、约1.4 wt.%或约1.5 wt.%、以及从中构成的范围,例如约0.5 wt.%至约1.5 wt.%、约0.6 wt.%至约1 wt.%或约0.7 wt.%至约0.9 wt.%。总可溶性碳水化合物含量为低于14 wt.%、低于12 wt.%、10wt.%、低于5 wt.%、约2.5 wt.%、约3 wt.%、约4 wt.%、约5 wt.%、约6 wt.%、约7 wt.%、约8wt.%、约9 wt.%、约10 wt.%、约11 wt.%、约12 wt.%、约13 wt.%或约14 wt.%、以及从中构成的范围,例如约2.5 wt.%至约14 wt.%、约2.5 wt.%至约10 wt.%、约5 wt.%至约10 wt.%、约2.5 wt.%至约5 wt.%。蛋白质与油的重量比为约或至少50:1、约或至少55:1、约或至少60:1、约或至少70:1、约或至少80:1、约或至少90:1、约或至少100:1、约或至少110:1、约或至少120:1、约或至少130:1、约或至少140:1或约150:1、以及从中构成的范围,例如约50:1至约150:1、约55:1至约100:1或约60:1至约80:1。可溶性碳水化合物与油的重量比为约5:1、约7.5:1、约10:1、约12.5:1、约15:1、约17.5:1、约20:1、约22.5:1、约25:1、约27.5或约30:1、以及从中构成的范围,例如约5:1至约30:1、约10:1至约25:1或约12.5:1至约20:1。蛋白质与可溶性碳水化合物的重量比为约或至少4:1、约或至少4.5:1、约或至少5:1、约或至少5.5:1、约或至少6:1、约或至少6.5:1、约或至少7:1、约或至少7.5:1、约或至少8:1、约或至少8.5:1、约或至少9:1、约或至少9.5:1、或约10:1、以及从中构成的范围,例如约4:1至约10:1、约4:1至约8:1或约4.5:1至约6:1。
在本公开的各种方面中的任意种中,可通过本领域已知的方法对从中提取了油和可溶性碳水化合物的含油种子粕进行脱溶剂或脱溶剂/烘烤。
实施例
使用图3中描绘的提取系统来进行提取实施例1和2。水冷却器1是可得自IKA的RC-2型号冷却器。水加热器2是可得自Brabender的T151E型号。夹套提取器具有1.2升的容积,且泵8为Watson-Marion 120 U/DV泵(200 rpm)。
提取实施例1和2程序包括将全脂大豆薄片连同溶剂一起放置于提取器5中,以形成提取床7。使加热水(由图3中的流动路线B指示)在各提取实施例的所需温度下循环通过提取器夹套5。使冷却水(由图3中的流动路线A指示)在各提取实施例的所需温度下循环通过冷凝器3。提取的温度通过温度计4所指示的温度来控制。在溶剂洗涤(提取)步骤中,在达到目标提取温度之后,启动泵8,以便于使油与溶剂混合物(包含溶剂、可溶性碳水化合物和油)循环通过提取床7,并且通过烧结板6回到提取床7中。每次溶剂洗涤时间为约15分钟。设置泵8速率,以实现所描述的通过薄片的渗滤速率。
通过清洁、破碎、去皮、调理和制成薄片来制备各实施例中使用的全脂大豆薄片。
在以下实施例中,根据标题为“Oil in Seed Meals and Cakes”的美国油脂化学家协会(American Oil Chemists’ Society,“AOCS”)官方方法Ba 3-38(2017年修订)来测定油含量。总的来说,将磨碎材料的样品称重,并用石油醚提取。收集石油醚提取物,蒸发去除溶剂,并将所得经提取的油称重。通过(油的克数)/(磨碎材料的克数)x100来计算油百分比。任选地,可测量样品水含量,并基于干重计算油百分比结果。
在以下实施例中,可根据标题为“Moisture and Volatile Matter, ForcedDraft Oven Method”的AOCS官方方法Ba 2a-38(2017年修订)来测定水分和挥发性物质含量。总的来说,将称重的材料样品放入配衡水分盘中,然后放置于烘箱中并在130±3℃下干燥2小时。然后从烘箱中移出水分盘,在干燥器中冷却至室温并称重。通过(质量损失(g))/(样品的质量(g))x100来计算水分和挥发性物质百分比。
在以下实施例中,根据标题为“Nitrogen and Protein, Modified KjeldahlMethod”的AOCS官方方法Ba 4d-90(2017年修订)来测定蛋白质含量。凯氏定氮法(Kjeldahlmethod)包括在硫酸的存在下将样品加热到沸腾,硫酸通过氧化分解有机物质并形成包含来自还原的氮的硫酸铵的溶液。然后将该溶液与氢氧化钠混合,并使之沸腾,以将硫酸铵转化为氨。使用指示剂,通过返滴定来测定氨的存在量,由此测定样品中氮的存在量。通过下式来计算氮百分比:
其中mLB=用于样品的标准碱的体积(mL);mLA=用于样品的标准酸的体积(mL);mLBK=滴定1 mL标准酸所需的标准碱的体积(mL)减去滴定完成该方法并蒸馏至1 mL标准酸的试剂空白所需的标准碱的体积(mL);NA=标准酸的当量浓度;和NB=标准碱的当量浓度。通过N% x 6.25计算总蛋白质。
在以下实施例中,通过液相色谱来测量可溶性碳水化合物(糖)含量。使用0.5 mm筛碾磨用于糖测量的样品,并在环境条件下,在恒定搅拌下,使用70%乙醇(样品与70%乙醇重量比为1:10)提取1小时。在连接RI检测器的Agilent 1260 Infinity LiquidChromatograph中测量70%乙醇中的糖含量。柱为Hi-Plex Ca 7.7 x 300 mm, 8μm;流速为0.6 mL/min;时间为30 min;注射体积为20μL;柱室温度为80℃;检测器温度为30℃;且流动相为水。
通过气相色谱法来测量并确定油与溶剂混合物组成。
比较例
通过现有技术己烷提取来提取全脂大豆薄片。在该比较例中,将300 g全脂大豆薄片放置于提取器中,并加入375 g己烷。将提取温度维持在60℃,将到冷凝器中的冷却水维持在20℃,油与溶剂混合物再循环时间为15分钟,且再循环速率为36 mL/min。重复提取6次,总共提取7次。对最终的经提取的大豆薄片(即,7次己烷提取之后)分析水分、蛋白质、油和糖(可溶性碳水化合物)。下表1中报道了结果(干重)连同大豆薄片在提取之前的水分、蛋白质、油和糖。
表1
实施例1
如图2A中一般性描绘的那样,按乙醇和水、乙醇和水的共沸物、以及己烷的顺序来提取全脂大豆薄片。
将300 g全脂大豆薄片放置于提取器中,并加入375 g包含70 wt.%乙醇和30 wt.%水的溶剂混合物。将提取温度维持在60℃,将到冷凝器中的冷却水维持在20℃,油与溶剂混合物再循环时间为15分钟,且再循环速率为36 mL/min。用70%乙醇/30%水重复提取4次,总共提取5次。对经提取的大豆薄片(即,用70%乙醇/30%水提取5次之后)分析水分、蛋白质、油和糖(可溶性碳水化合物),且结果作为“5x 70/30 EtOH/H
然后用375 g乙醇/水共沸物(96 wt.%乙醇/4 wt.%水)进一步提取那些经提取的大豆薄片。将提取温度维持在60℃,将到冷凝器中的冷却水维持在20℃,油与溶剂混合物再循环时间为15分钟,且再循环速率为36 mL/min。对经提取的大豆薄片(即,用乙醇/水共沸物提取1次之后)分析水分、蛋白质、油和糖,且结果作为“1x 96/4 EtOH/H
然后用375 g己烷进一步提取那些经提取的大豆薄片。将提取温度维持在60℃,将到冷凝器中的冷却水维持在20℃,油与溶剂混合物再循环时间为15分钟,且再循环速率为36 mL/min。用己烷重复提取3次,总共提取4次。对经提取的大豆薄片(即,用己烷提取4次之后)分析水分、蛋白质、油和糖,且结果作为“4x己烷”报道于下表2中。
大豆薄片在提取之前的水分、蛋白质、油和糖作为“原料(Raw)”报道于下表2中(干重)。
表2
实施例2
用包含己烷和甲醇(重量比为72%:28%己烷:甲醇)的共沸物的溶剂一系列7次按序逆流提取全脂大豆薄片。
如图4A中所描绘的,在生成待在第二步骤逆流提取方案(下文)中使用的溶剂(油与溶剂混合物)的第一步骤(1a)中,将300 g全脂大豆薄片放置于提取器中,并加入375 g新鲜的己烷:甲醇溶剂。将提取温度维持在52℃,将到冷凝器中的冷却水维持在20℃,油与溶剂混合物再循环时间为15分钟,且再循环速率为36 mL/min。将第一次提取中生成的油与溶剂混合物命名为“M1”,并将经提取的大豆薄片命名为“1x薄片”。用新鲜的己烷:甲醇按序再提取薄片6次(步骤2a至7a),以生成分别命名为“M2”至“M7”的油与溶剂混合物,并将经提取的薄片分别命名为“2x薄片”至“7x薄片”。
如图4B中所描绘的,在第二步骤逆流提取方案中,将300 g全脂大豆薄片放置于提取器中,并加入“M2”油与溶剂混合物。将提取温度维持在52℃,将到冷凝器中的冷却水维持在20℃,油与溶剂混合物再循环时间为15分钟,且再循环速率为36 mL/min。将第一次提取(步骤1b)中生成的油与溶剂混合物命名为“M1b”,并将经提取的大豆薄片命名为“1xb薄片”。分别用M3至M7和新鲜的己烷:甲醇重复提取6次(步骤2b至7b,总共7次提取),以分别生成2xb薄片至7xb薄片。对最终的经提取的大豆薄片(即,7xb薄片)分析水分、蛋白质、油和糖(可溶性碳水化合物),且下表3中报道了结果(干重)连同大豆薄片在提取之前的水分、蛋白质、油和糖。
表3
实施例3
如图5中所描绘的,实施例3对用溶剂按己烷、然后70%乙醇/30%水(70%乙醇)的顺序连续逆流提取全脂大豆薄片进行评价。该评价由最初的使用己烷E的5次分段提取(步骤1至5)组成,将己烷E逆流再循环,生成中间流N-P5、N-P4、N-P3、N-P2和F。随后,使用70%乙醇C进行6次逆流分段提取(步骤6至11),生成中间流P6、P5、P4、P3、P2和D,如在图5中呈现的,其中:A代表全脂薄片;B代表经提取的粕;E代表新鲜的己烷;F代表含有油的己烷;C代表新鲜的乙醇/水70%/30%;且D代表含有糖和少量的己烷、油和蛋白质的乙醇。
该试验的工艺条件如下。用于第一提取顺序的溶剂为己烷;用于第一提取顺序的溶剂为70%乙醇/30%水;溶剂比率为己烷(3:1)和乙醇(4:1);原料是全脂大豆薄片;进料速率为136-181克/分钟;保留时间总共为180分钟,其中针对己烷60分钟,针对乙醇+排放物90分钟;且针对己烷的溶剂温度为60℃,针对乙醇的溶剂温度为71℃。
在Crown Model V 12级连续逆流提取器中进行提取,该提取器相对于固定的凸起筛网(relieved screen)具有连续浆运动。使一些提取器平台不活动,以模拟所需的洗涤和/或排放步骤的数量。在倒风脱溶剂器(“DDD”)中进行粕脱溶剂,所述倒风脱溶剂器具有温和运动、真空和间接加热,并允许控制停留时间。
对最终的经提取的大豆薄片B和初始的全脂薄片分析水分、蛋白质、油和总糖(可溶性碳水化合物–水苏糖+棉子糖+蔗糖+葡萄糖+半乳糖),且结果报道于下表4中(干重)。
表4
实施例4
实施例4对用72 w/w%己烷和28 w/w%甲醇的共沸物7步骤连续逆流提取全脂大豆薄片(A)进行评价。在该评价中,用新鲜的共沸溶剂(72%己烷/28%甲醇)提取6x经提取的大豆粕,以生成成品经提取的粕(通过DDD处理)和1x溶剂;用1x溶剂提取5x经提取的大豆粕,以生成2x溶剂和6x经提取的粕;用2x溶剂提取4x经提取的大豆粕,以生成3x溶剂和5x经提取的粕;用3x溶剂提取3x经提取的大豆粕,以生成4x溶剂和4x经提取的粕;用4x溶剂提取2x经提取的大豆粕,以生成5x溶剂和3x经提取的粕;用5x溶剂提取1x经提取的大豆粕,以生成6x溶剂和2x经提取的粕;以及用6x溶剂提取全脂大豆薄片,以生成提取器排放溶剂(油与溶剂混合物)和1x经提取的大豆粕。按照实施例3在DDD中处理成品经提取的粕。以下描绘实施例4的方案:
在该提取中,溶剂比率为3:1;进料速率为372 g/min;保留时间为60分钟总共+排放物;溶剂温度为55℃;且DDD停留时间、温度和真空分别为15分钟、93℃和10mm Hg。
下表5中报道了针对原始薄片、成品经提取的粕和6x溶剂(油与溶剂混合物)的结果(干重)。
表5
实施例4的结果显示,油没有得到有效提取,且油与溶剂混合物含有过量甲醇。如与其中用共沸物有效提取全脂大豆的实施例2相比,基于迄今的实验结果且不受任何特别理论的束缚,据信,实施例4中没有维持己烷:甲醇共沸物,从而导致溶剂相分离和低效的提取。
本书面说明书使用包括最佳方式在内的实例来公开本发明,并且还使得本领域任何技术人员能够实践本发明,包括制备和使用任何设备或系统,以及实施任何并入的方法。本发明的可获得专利权范围由权利要求书来限定,并且可包括本领域技术人员想到的其它实例。如果此类其它实例具有与权利要求书的字面语言相同的结构要素或者如果它们包括与权利要求书的字面语言没有实质性区别的等同结构要素,则它们意欲在权利要求书的范围内。
- 含油种子提取方法
- AHL4在调控植物脂代谢中的应用及提高植物种子含油量、不饱和脂肪酸含量的方法
