核酸的非特异性结合抑制剂、杂交用试剂和核酸的杂交方法
文献发布时间:2023-06-19 11:21:00
技术领域
本发明涉及用于抑制核酸杂交中的非特异性结合的抑制剂、包含该抑制剂的杂交用试剂、使用该抑制剂的核酸的杂交方法、包含该杂交工序的目标核酸的检测方法。
背景技术
脱氧核糖核酸(DNA)和核糖核酸(RNA)是承载生物体信息的核酸,DNA包含腺嘌呤(dA)、胸腺嘧啶(dT)、胞嘧啶(dC)和鸟嘌呤(dG)作为碱基,RNA包含腺嘌呤(A)、尿嘧啶(U)、胞嘧啶(C)和鸟嘌呤(G)作为碱基。DNA和RNA分别具有与作为互补序列的互补链特异性地结合的性质,其结合亲和性和特异性通过A-T(或U)和C-G的2种特异性的结合模式的组合来实现。与互补链的结合亲和性和特异性由序列所含的各种碱基的序列顺序、构成比率和结合链长、以及依赖于碱基序列的高级结构等决定,但进一步作为外部因素也受到反应液的温度和反应液中的离子强度、以及甲酰胺等核酸变性剂的存在有无调节。该与互补链的核酸结合被称为杂交。
近年来,进行了通过在各种生物体试样中以特定核酸作为目标核酸测定其表达量,来进行疾病的发病预测、诊断的研究。例如,报告了人中存在26000种以上的总基因。另外,近年来,作为非翻译RNA关注于作为短链核酸的微RNA,报告了人中存在2600种以上的微RNA。特别是微RNA是1种序列调节最大超过100种基因表达量等的在人等高等生物的基因表达调节中承担微调(Fine-Tuning)的重要角色的认识提高,其与疾病的关联被重点研究。从这样庞大的候选基因中探索与疾病相关的基因并不容易。作为为了该目的而广泛使用的技术,可列举使用核酸阵列(也被称为DNA微阵列或DNA芯片)的全面的基因表达探索。
核酸阵列在成为支撑体的基板上固定化有具有针对多种目标核酸的互补碱基序列的核酸探针,将从生物体试样提取出的试样中的目标核酸预先用荧光物质等标记分子标记,加样到核酸阵列中,使目标核酸与核酸探针之间杂交,从而能够将目标核酸的表达量作为所形成的核酸复合物的荧光信号进行检测。作为在核酸阵列中调节目标核酸与互补链之间的结合亲和性和特异性的方法,如上所述进行了杂交的反应温度的变更、杂交溶液的组成变更。特别是杂交溶液的组成可以由每个本领域技术人员最适化,是为了在核酸阵列中进行特异性的核酸检测所必须的技术。
但是,一般的核酸阵列在玻璃基板上固定化有互补链探针,但玻璃具有序列非特异性地吸附结合核酸的性质。因此,目标核酸吸附在玻璃基板上,其结果造成背景信号增加。在目标核酸的信号值低的情况下,由于高背景而检测变得困难。
另外,在要使用核酸阵列等检测目标核酸的情况下,有时产生目标核酸和具有与其类似的序列的互补链的核酸之间产生交叉杂交。这种情况下,与目标核酸的信号值相比,交叉杂交的目标核酸的信号值相对高,可能目标核酸的表达量的检测变得困难。
另外,特别是在基因组序列的分析中,由于基因组中包含大量特定序列高度重复的重复序列,因而在目标核酸的检测中,在该目标核酸的重复序列与具有目标核酸的互补链的核酸探针交叉杂交的情况下,测定值的基线上升,检测目标核酸变得困难。
为了抑制以上那样的对核酸阵列基板的非特异性吸附、和具有与目标核酸类似的序列的互补链的核酸的交叉杂交,除了在杂交溶液中添加缓冲剂、盐、水合剂、核酸变性剂等之外,还添加这些核酸的非特异性结合抑制剂(封闭剂)。例如,鲑鱼精DNA是最通用的非特异性结合抑制剂之一。另外,其他的Human Cot-1 DNA、大肠杆菌tRNA、PCR扩增产物(专利文献1)、多聚dA(非专利文献1、非专利文献2)、随机寡聚物等、它们的混合物(专利文献2)等也作为核酸的非特异性结合抑制剂被添加到杂交溶液中使用。
现有技术文献
专利文献
专利文献1:日本特表2009-518004号公报
专利文献2:日本特开2010-29174号公报
非专利文献
非专利文献1:Technical Note,“Implementation of DNA MicroarrayHybridization Protocols,Translation of Manual Methods to Tecan HybridizationStation”、[online]、テカンジャパン株式会社、[2018年10月22日检索]、网址〈URL:http://www.tecan.co.jp/pdf/technote_hs.pdf〉
非专利文献2:Pan SJ.等,BMC Genomics、2002年、第3卷、35号、p.1-12
发明内容
发明所要解决的课题
在如上所述的一直以来使用的核酸的非特异性结合抑制剂中,鲑鱼精DNA是通过将来自鲑鱼精巢的DNA进行超声波破碎或物理剪切处理而片段化而得的。根据提供者不同而不同,但通常具有数百bp~数千bp的分子量分布,已知根据制造批次不同而其分子量分布等性状不同。另外,Human Cot-1 DNA是通过将来自人胎盘的DNA进行剪切处理而片段化而得的,同样来自生物试样,因而根据制造批次不同而分子量分布等性状不同。另外,大肠杆菌tRNA是从大肠杆菌破碎物提取的tRNA,但由于来自生物试样,也可能在制造批次之间性状不同。
如上,在使用来自生物试样的非特异性结合抑制剂来进行目标核酸的检测的情况下,每次更换制造批次都可能影响测定结果。因此,需要获得多个制造批次的非特异性结合抑制剂进行比较评价,特定能得到同等的测定结果的特异的制造批次,并大量确保该制造批次等大量的劳动力。
与此相对,PCR扩增产物通过PCR扩增制造,随机寡聚物通过化学合成制造,因此每个制造批次的品质差异比较小。但是,PCR扩增产物严格来说,由于PCR错误而产生的目的外序列的混入率每个制造批次不同。另外,随机寡聚物一般使用10碱基以下的链长,有时仍然可能每个制造批次所包含的碱基构成不同。因此,即使在这些非特异性结合抑制剂中,也残留着批次切换的影响。
另一方面,多聚dA是由单一碱基(腺嘌呤)构成的DNA,能够化学合成,因此被期待制造批次之间的差异少。多聚dA在将mRNA逆转录时生成的cDNA上的多聚dT封闭的用途中使用,被报告在用核酸阵列评价cDNA样品时,抑制cDNA上的多聚dT与互补链探针上的富腺嘌呤(A)序列之间的假阳性信号(非专利文献2)。然而,在核酸阵列中也产生各种类似序列之间的交叉杂交,单独的多聚dA单独不能期待对这些各种类似序列之间的交叉杂交的抑制效果。因此,在非专利文献2中,也同时添加Human Cot-1 DNA,可以说对各种类似序列之间的交叉杂交的抑制效果实质上是通过Human Cot-1 DNA获得的。
如上,一直以来,通过杂交检测目标核酸时,并不存在有效地抑制目标核酸与具有其类似序列互补链的核酸之间的交叉杂交、并且制造批次之间的品质稳定的非特异性结合抑制剂。本发明要提供使这些特性同时成立的非特异性结合抑制剂。
用于解决课题的手段
本发明者进行了深入研究,结果发现,包含鸟嘌呤(G)的核酸抑制非特异性结合的效果高、并且该核酸的制造批次之间的品质稳定,从而完成了本发明。即,本发明提供以下(1)~(12)。
(1)核酸的非特异性结合抑制剂,包含碱基长度为2~11碱基、且全碱基序列中的鸟嘌呤碱基或甲基化鸟嘌呤碱基的含有率为70%以上的核酸。
(2)根据(1)所述的抑制剂,所述核酸的碱基长度为5~7碱基。
(3)根据(1)或(2)所述的非特异性结合抑制剂,所述鸟嘌呤碱基或甲基化鸟嘌呤碱基是鸟嘌呤碱基。
(4)根据(1)~(3)的任一项所述的抑制剂,所述核酸具有由连续5个鸟嘌呤碱基构成的碱基序列。
(5)根据(1)~(3)的任一项所述的抑制剂,所述核酸的全碱基是鸟嘌呤。
(6)根据(1)~(5)的任一项所述的抑制剂,所述核酸是DNA。
(7)核酸的杂交用试剂,包含(1)~(6)的任一项所述的抑制剂。
(8)核酸的杂交方法,是使目标核酸、和能与该目标核酸特异性地结合的核酸杂交的方法,在该杂交中包括使(1)~(6)的任一项所述的抑制剂共存的操作。
(9)目标核酸的检测方法,包括:使目标核酸、和能与该目标核酸特异性地结合的核酸杂交的杂交工序,和
检测该杂交工序中所形成的核酸复合物的检测工序,
在该杂交工序中包括使(1)~(6)的任一项所述的抑制剂共存的操作。
(10)根据(9)所述的检测方法,其中,使用核酸阵列。
(11)碱基长度为2~11碱基、且全碱基序列中的鸟嘌呤碱基或甲基化鸟嘌呤碱基的含有率为70%以上的核酸作为核酸的非特异性结合抑制剂的用途。
(12)碱基长度为2~11碱基、且全碱基序列中的鸟嘌呤碱基或甲基化鸟嘌呤碱基的含有率为70%以上的核酸用于制造核酸的非特异性结合抑制剂的用途。
发明的效果
本发明的核酸的非特异性结合抑制剂由于具有与鲑鱼精DNA等现有的抑制剂同等或同等以上的非特异性结合的抑制效果,并且制造批次之间的品质稳定,因而其选定、制备不需要劳动力。特别是在利用杂交的目标核酸的检测中,能够稳定地实现交叉杂交的抑制效果。
附图说明
图1是显示鲑鱼精DNA、随机引物和poly-dG5的交叉杂交抑制效果的图(实施例1、2、比较例1、2)。
图2是显示poly-dG5、poly-dG7和poly-dG10的交叉杂交抑制效果的图(实施例3-8)。
图3是显示poly-dG5、GGAGG,GGGAG和TGGGG的交叉杂交抑制效果的图(实施例9-12)。
图4是显示poly-dG5的批次之间的交叉杂交抑制效果的稳定性的图(实施例13)。
图5是显示鲑鱼精DNA的批次之间的交叉杂交抑制效果的不稳定性的图(比较例3)。
具体实施方式
本发明的第一方案(aspect)是用于抑制核酸的杂交时产生的非特异性结合的抑制剂,包含碱基长度为2~11碱基、且该全碱基序列中的鸟嘌呤碱基或甲基化鸟嘌呤碱基的含有率为70%以上的核酸。在包含鸟嘌呤碱基和甲基化鸟嘌呤碱基双方的情况下,其合计含有率为70%以上。在以下的全部说明中,除了根据上下文明显不是那样的情况以外,“鸟嘌呤”这样的术语也包含“甲基化鸟嘌呤”。但是,在实施例(actual working examples)中,“鸟嘌呤”是指未被甲基化的通常的鸟嘌呤。另外,在以下的全部说明中,未被甲基化的通常的鸟嘌呤,比甲基化鸟嘌呤更优选。此外,作为甲基化鸟嘌呤的例子,可列举7-甲基鸟嘌呤(m7G)、O6-甲基鸟嘌呤(O6-MeG)等。
其中,核酸的“非特异性结合”是指除了目标核酸、与具有该目标核酸的序列的互补序列的核酸(探针等)之间杂交时产生的、目标核酸所参与的该杂交(特异性结合)以外的全部结合型反应。
该核酸的非特异性结合的一种方案是在使用核酸阵列(也称为DNA微阵列、DNA芯片)等、固定化有用于检测目标核酸且具有该目标核酸的互补碱基序列的核酸(核酸探针)的支撑体(基板等)时,在目标核酸、和具有与目标核酸类似的序列的互补链的核酸之间产生的交叉杂交。另外,非特异性结合的别的方案,是目标核酸吸附(包含由范德华力产生的物理吸附、由疏水性相互作用产生的化学吸附的两者)于固定化有具有所述目标核酸的互补序列的核酸的支撑体的材料自身。本发明中的核酸的“非特异性结合”中包含这些的任意方案。
本发明的非特异性结合抑制剂所包含的核酸(以下,在本说明书中也称为“本发明的核酸”),其碱基长度为2~11碱基,更优选为5~7碱基,进一步优选为5碱基。另外,该核酸的全碱基序列中的鸟嘌呤碱基的含有率为70%以上。
本发明的核酸的优选方案是多个鸟嘌呤碱基连续排列而成的,其中更优选5碱基的鸟嘌呤碱基连续排列而成的。
本发明的核酸可以按照上述条件包含除了鸟嘌呤碱基以外的碱基,但在将多种碱基混合而合成具有目的序列的核酸的情况下,因为可能以一定概率混入目的外的序列,所以更优选该核酸仅由鸟嘌呤碱基1种构成。
本发明的非特异性结合抑制剂所包含的核酸可以通过一般使用的核酸合成法合成,固相合成法和液相合成法的任一者都可以用于该核酸的合成。例如,在固相合成法中,预先将被称为amidite(酰胺化合物)的修饰核苷酸单体在珠上固相化,通过从寡核苷酸的序列的3’末端侧向5’末端添加核苷酸单体而进行合成。在全部的链长延伸完成之后,从固相珠进行分离,从而获得目的核酸。液相合成法中,通过在高分散性液相支撑体等上同样地添加核苷酸单体,从而获得目的核酸。
合成的核酸可以通过一般使用的脱盐纯化、反相柱纯化、HPLC纯化、PAGE纯化等纯化方法纯化而使用。优选使用通过反相柱纯化、HPLC纯化或PAGE纯化进行了纯化的核酸,更优选使用通过HPLC纯化或PAGE纯化进行了纯化的核酸。
本发明的非特异性结合抑制剂所包含的核酸既可以是DNA、RNA,也可以是人工核酸。作为人工核酸,可列举LNA(Locked Nucleic Acid,锁核酸)、PNA(Peptide NucleicAcid,肽核酸)、ENA(Ethylene-Bridged Nucleic Acid,亚乙基桥核酸)等。另外,也可以使用将多种类型的核酸组合而合成的核酸。LNA、PNA、ENA等人工核酸的酶稳定性高,另一方面制造成本也高。因此,本发明的核酸优选为DNA或RNA,更优选为酶稳定性比较高的DNA。另外,本发明的非特异性结合抑制剂所包含的核酸中,作为碱基,除了腺嘌呤(A)、胸腺嘧啶(T)、胞嘧啶(C)、鸟嘌呤(G)、尿嘧啶(U)以外,也可以含有肌苷(I)。
本发明的核酸也可以包含修饰碱基。例如,C也可以作为5-甲基胞嘧啶(5mC)、5-羟甲基胞嘧啶(5hmC)、5-甲酰基胞嘧啶(5fC)、5-羧基胞嘧啶(5caC)等包含。另外,如上所述,G可以作为7-甲基鸟嘌呤(m7G)、O6-甲基鸟嘌呤(O6-MeG)等包含,或者作为2’-O-甲基核糖核苷包含。
另外,本发明的核酸可以在其5’末端、3’末端的任一方或两方被磷酸基、烷基、烷氧基、氨基、腺嘌呤基、生物素、硫醇、卤素、荧光色素等修饰,不限于此,可以根据其使用目的而使用任意的修饰基。
本发明的非特异性结合抑制剂所包含的核酸在其碱基长度为2碱基或3碱基的情况下,全部由鸟嘌呤碱基构成。
本发明的核酸在其碱基长度为4碱基的情况下,由鸟嘌呤碱基3碱基和任意的1碱基(也可以是鸟嘌呤碱基)构成,该1碱基所配置的位置在该序列中是任意的。在该1碱基是鸟嘌呤碱基的情况下,是全部仅由鸟嘌呤碱基构成的(即,碱基序列为“GGGG”)、更优选的序列。
本发明的核酸在其碱基长度为5碱基的情况下,由鸟嘌呤碱基4碱基和任意的1碱基(也可以是鸟嘌呤碱基)构成,该1碱基所配置的位置在该序列中是任意的。例如,该1碱基为腺嘌呤碱基且位于从5’末端起第3位的核酸(核酸名(DNA):“GGAGG”)、和该1碱基为腺嘌呤碱基且位于从5’末端起第4位的核酸(核酸名(DNA):“GGGAG”)、和该1碱基为胸腺嘧啶碱基且位于从5’末端起第1位的核酸(核酸名(DNA):“TGGGG”)等包含在其中。另外,在该1碱基为鸟嘌呤碱基的情况下,是由全部仅为鸟嘌呤碱基的连续5碱基构成(即,碱基序列为“GGGGG”)的、特别优选的核酸(核酸名(DNA):“poly-dG5”)。
本发明的核酸在其碱基长度为6碱基的情况下,由鸟嘌呤碱基5碱基和任意的1碱基(也可以是鸟嘌呤碱基)构成,该1碱基所配置的位置在该序列中是任意的。其中,优选具有连续的鸟嘌呤5碱基的序列、在其任一末端包含任意的1碱基的构成。另外,该任意的1碱基为鸟嘌呤碱基的情况下,是由全部仅为鸟嘌呤碱基的连续6碱基构成(即,碱基序列为“GGGGGG”)的、更优选的序列。
本发明的核酸在其碱基长度为7碱基的情况下,由鸟嘌呤碱基5碱基和任意的2碱基(也可以是鸟嘌呤碱基)构成,该2碱基所配置的位置在该序列中是任意的。其中,优选具有连续的鸟嘌呤5碱基的序列、在其两末端各包含任意的1碱基或者在任一末端包含任意的2碱基。另外,该2碱基均为鸟嘌呤碱基的情况下,是由全部仅为鸟嘌呤碱基的连续7碱基构成(即,碱基序列为“GGGGGGG”)的、更优选的序列。
本发明的核酸在其碱基长度为8碱基的情况下,由鸟嘌呤碱基6碱基和任意的2碱基(也可以是鸟嘌呤碱基)构成,该2碱基所配置的位置在该序列中是任意的。其中,优选具有连续的鸟嘌呤6碱基的序列、在其两末端各包含任意的1碱基或者在其任一末端包含任意的2碱基。另外,在该2碱基均为鸟嘌呤碱基的情况下,是由全部仅为鸟嘌呤碱基的连续8碱基构成(即,碱基序列为“GGGGGGGG”)的、更优选的序列(核酸名(DNA):“poly-dG8”)。
本发明的核酸在其碱基长度为9碱基的情况下,由鸟嘌呤碱基7碱基和任意的2碱基(包含鸟嘌呤碱基)构成,该2碱基所配置的位置在该序列中是任意的。其中,优选具有连续的鸟嘌呤7碱基的序列、在其两末端各包含任意的1碱基或者在其任一末端包含任意的2碱基。另外在该2碱基均为鸟嘌呤碱基的情况下,是由全部仅为鸟嘌呤碱基的连续9碱基构成(即,碱基序列为“GGGGGGGGG”)的、更优选的序列。
本发明的核酸在其碱基长度为10碱基的情况下,由鸟嘌呤碱基7碱基和任意的3碱基(包含鸟嘌呤碱基)构成,该3碱基所配置的位置在该序列中是任意的。其中,优选具有连续的鸟嘌呤7碱基的序列、在其两末端包含任意的1碱基或2碱基或者在其任一末端包含任意的3碱基。另外,在该3碱基全部为鸟嘌呤碱基的情况下,是由全部仅为鸟嘌呤碱基的连续10碱基构成的、更优选的序列(核酸名(DNA):“poly-dG10”、序列号1)。
本发明的核酸在其碱基长度为11碱基的情况下,由鸟嘌呤碱基8碱基和任意的3碱基(包含鸟嘌呤碱基)构成,该3碱基所配置的位置在该序列中是任意的。其中,优选具有连续的鸟嘌呤8碱基的序列、在其两末端包含任意的1碱基或2碱基或者在其任一末端包含任意的3碱基。另外,在该3碱基全部是鸟嘌呤碱基的情况下,是由全部仅为鸟嘌呤碱基的连续11碱基构成的、更优选的序列(序列号2)。
本发明的第二方案是在核酸的杂交中使用的杂交用试剂,是包含本发明的核酸的试剂。
本发明的杂交用试剂可以作为包含本发明的核酸的溶液制备。本发明的杂交用试剂所包含的本发明的核酸的浓度优选为0.3μM-100μM。高浓度的核酸溶液由于具有粘性,所以从实验操作和制造管理的观点考虑,优选以0.3μM-30μM使用。本发明的核酸的浓度可以根据使用目的、使用方法适宜选择。
本发明的杂交用试剂可以包含多糖,优选可以包含葡聚糖硫酸钠。葡聚糖硫酸钠能够通过其水合作用而模拟提高了目标核酸的浓度的状态,因而可以期待提高杂交的反应速度的效果。葡聚糖硫酸钠的浓度优选为1-30重量%,更优选为1-20重量%,进一步最优选以3-10重量%使用。另外,葡聚糖硫酸钠的分子量可以在3000-100000Da的范围利用。更优选使用分子量5000-30000Da的葡聚糖硫酸钠。
本发明的杂交用试剂可以包含变性剂。例如,可以包含甲酰胺或二甲基亚砜。甲酰胺或二甲基亚砜有减弱核酸碱基之间的氢键的作用,通过调节氢键数不同的A-T之间、G-C之间的结合亲和性,可以期待提高杂交的结合特异性的效果。甲酰胺的浓度优选为1-50体积%,更优选为1-30体积%,进一步最优选以3-25体积%使用。二甲基亚砜的浓度优选为1-40体积%,更优选1-20体积%,最优选以3-10体积%使用。
本发明的杂交用试剂中还可以包含针对蛋白质的非特异性吸附的抑制剂。作为该抑制剂,优选使用牛血清白蛋白(BSA)。BSA通过抑制称为背景噪声的非特异性吸附,可以期待信号/噪声比提高的效果。BSA等非特异性吸附抑制剂的浓度优选为1-100mg/mL,更优选为5-50mg/mL,最优选以10mg/mL使用。
本发明的杂交用试剂中也可以包含对于提高杂交反应的灵敏度有用的物质。例如,杂交反应中生成的气泡可能物理性地阻碍杂交反应,因此也可以包含用于抑制气泡的发生的消泡剂等。作为消泡剂的例子,可列举作为表面活性剂的Tween20(商品名)、Tween60(商品名)、Triton X-100(商品名)、或者硅油等。另外,消泡剂的使用浓度不特别限定,通常为0.001-10重量%左右、优选0.01-1重量%左右。
本发明的杂交用试剂除了包含上述的本发明的核酸以外,可以采用周知的组成,作为具体的制备例,例如,可以以“Ku WC.等、Biochemical and Biophysical ResearchCommunications、2004年、第315卷、1号、p.30-37”中记载的组成作为参考,制成“6×SSPE、0.1%SDS、25%甲酰胺、10mg/mL BSA、10%葡聚糖硫酸钠、15μM poly-dG5”。
本发明的第三方案是核酸的杂交方法,是使本发明的核酸的非特异性结合抑制剂共存,或使用本发明的杂交用试剂而进行杂交的方法。
核酸的杂交方法自身除了使上述的本发明的核酸共存以外,可以通过周知的方法进行,例如,可以使用“Sambrook,J.等、(1998)Molecular Cloning:A Laboratory Manual(2nd ed.),Cold Spring Harbor Laboratory Press,New York”中记载的方法。具体地,可以对预先固定化有互补链核酸探针的支撑体,添加目标核酸和本发明的非特异性的结合抑制剂或本发明的杂交用试剂,在一定温度下孵育,从而进行杂交。本发明的非特异性的结合抑制剂或本发明的杂交用试剂在添加之前使目标核酸在高温热变性一定时间,从而可以更进一步提高核酸结合的特异性。另外,可以通过将目标核酸与互补链核酸探针、和本发明的非特异性的结合抑制剂或杂交用试剂混合,在一定温度孵育,从而进行杂交之后,将互补链核酸探针固定化于支撑体上。
本发明的第四方案是核酸的检测方法,包括:使本发明的核酸的非特异性结合抑制剂共存或使用本发明的杂交用试剂,使目标核酸和能与其特异性地结合的核酸杂交的工序;和检测该杂交中形成的核酸复合物的工序。
使目标核酸和能与其特异性地结合的核酸杂交的工序,可以直接应用上述本发明的第三方案中记载的核酸的杂交方法而实施。
检测杂交工序中形成的核酸复合物的工序自身可以应用周知的核酸的检测方法来进行。例如,在杂交工序中,通过预先将目标核酸用标记分子标记,可以将核酸复合物的量作为标记分子的量检测出。作为标记分子,可以使用有机荧光色素、磷光色素、量子点、荧光蛋白质等荧光体、化学发光蛋白质、放射性同位素、能够进行电子授受的氧化还原体、碱性磷酸酶、辣根过氧化物酶等酶自身、或包含这些标记分子的核酸单体等。在包含标记分子的核酸单体的情况下,可以通过在目标核酸的末端利用酶反应导入来进行标记。
核酸复合物的检测从灵敏度方面、简便性考虑作为标记分子优选使用荧光体,此时,可以将核酸复合物的量作为荧光体所发出的荧光信号值用荧光显微镜、酶标仪等进行测定。
核酸复合物的检测也可以将目标核酸和能与其特异性地结合的核酸探针的结合作为核酸嵌入剂的荧光波长变化检测出。作为核酸嵌入剂,可以使用溴化乙锭、“SYBR(注册商标)Green”、或它们的替代产品。例如,可以在使用核酸阵列的杂交工序之后,将形成了目标核酸与核酸探针的复合物的核酸阵列浸入核酸嵌入剂液中,用缓冲液等洗涤,然后将核酸复合物的量作为核酸嵌入剂所发出的荧光信号值用荧光显微镜、酶标仪进行测定。
复合物核酸的检测可以使用原位(in situ)杂交、菌落杂交、斑点印记、RNA印记、DNA印记等公知的方法,以及在支撑体上固定化有与目标核酸特异性地结合、且具有目标核酸的互补碱基序列的核酸(核酸探针)的核酸阵列(DNA微阵列、DNA芯片等)实施。
作为核酸阵列,可以使用一般售卖的。例如,アフィメトリックス社的“GeneChip(注册商标)Arrays”、アジレント·テクノロジー社的寡聚DNA芯片、東レ社的“3D-Gene(注册商标)”等,但优选使用由于支撑体为树脂制,因而核酸的物理吸附少,并通过用微珠搅拌杂交溶液而搅拌效率提高了的東レ社的“3D-Gene(注册商标)”。
实施例
通过以下实施例具体说明本发明,但本发明不限于实施例的范围,实施例只不过是对于专利申请的发明能够考虑到的多个实施方式中的几个。
实施例1、2、比较例1、2
作为核酸阵列,使用東レ社制的DNA微阵列“3D-Gene(注册商标)human miRNAoligo chip(对应于miRBase release 21)”,选择作为能够产生交叉杂交的miRNA的hsa-miR-6858-5p(miRBase Accession No.MIMAT0027616、序列号3)作为目标核酸,评价杂交反应中的本发明的核酸的非特异性结合抑制剂的交叉杂交抑制效果。
目标核酸hsa-miR-6858-5p作为5’末端磷酸基修饰体化学合成(委托ファスマック社合成、HPLC纯化级)。将该目标核酸溶解在蒸馏水中调制成2.5fmol/μL,将其中的5fmol部分使用“3D-Gene(注册商标)miRNA labeling kit”(東レ社)进行荧光标记,按照其标准方案,使用所述核酸阵列进行杂交。
作为核酸的非特异性结合抑制剂使用“poly-dG5”(委托ファスマック社合成、反相柱纯化级),针对“miRNA Hybridization buffer V3”制备杂交溶液使其分别为终浓度1μM(实施例1)、10μM(实施例2),用于杂交。
另外,作为比较对照,制备鲑鱼精DNA(Invitrogen社、型号:15632011)为终浓度92μg/mL(比较例1)的杂交溶液,“Random Primer(N)9”(タカラバイオ社、型号:3802)为终浓度6.5μg/mL(相当于2.2μM)(比较例2)的杂交溶液,进行杂交。
将杂交后的DNA微阵列用“微阵列扫描仪”(東レ社)测定荧光强度。扫描仪的设定为激光输出100%、光电倍增管的电压设定为AUTO设定。使用数值化软件““3D-Gene”Extraction”(東レ社),将所得的扫描图像的各斑点的荧光强度作为信号值进行数值化。将目标核酸的信号值、与作为交叉杂交检测到的信号中的最高的hsa-miR-4498(miRBaseAccession No.MIMAT0019033、序列号4)的信号值的比(hsa-miR-6858-5p的信号值/hsa-miR-4498的信号值)作为S/N比计算出。
将其结果示于图1。与不添加核酸的非特异性结合抑制剂时的S/N比(1.58)相比,添加了鲑鱼精DNA时的S/N比提高到2.78,确认了交叉杂交的抑制效果。添加了RandomPrimer(N)9时的S/N比为1.33,未确认交叉杂交的抑制效果。另一方面,将作为本发明的非特异性结合抑制剂的poly-dG5以1μM、10μM的浓度使用时,S/N比分别为1.95、2.47,随着添加浓度而交叉杂交的抑制效果提高。即可知,poly-dG5以至少1μM以上的浓度显示交叉杂交的抑制效果。
实施例3-8
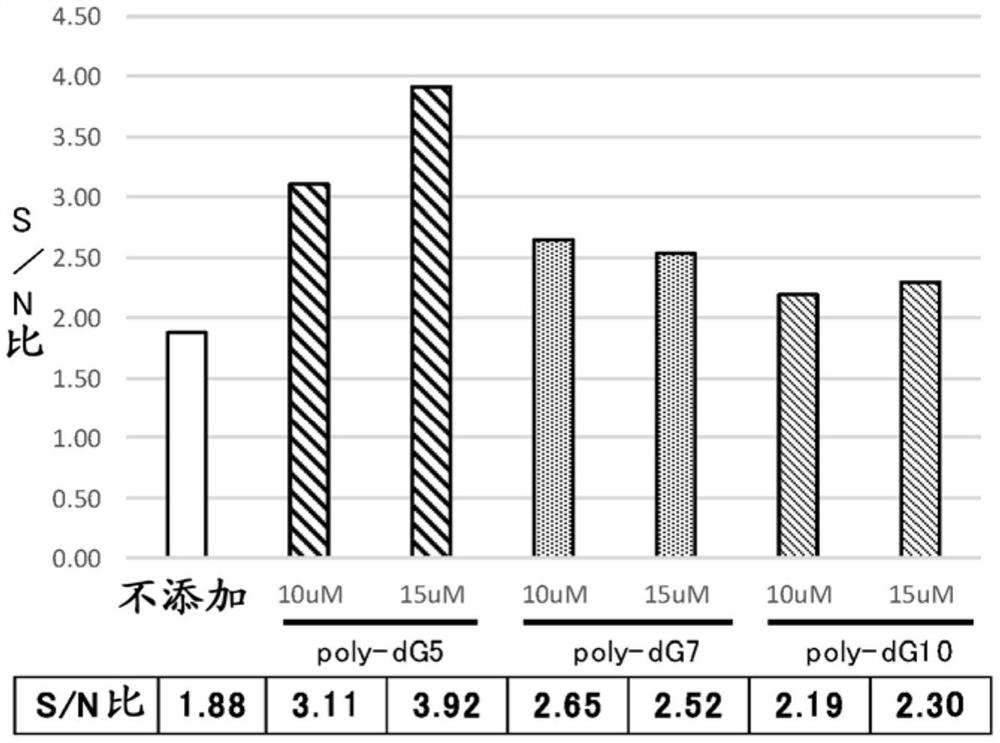
作为核酸的非特异性结合抑制剂,以“poly-dG5”(委托ファスマック社合成、HPLC纯化级)为终浓度10μM(实施例3)、15μM(实施例4)、另外“poly-dG7”(委托ファスマック社合成、HPLC纯化级)为终浓度10μM(实施例5)、15μM(实施例6)、另外“poly-dG10”(委托ファスマック社合成、HPLC纯化级、序列号1)为终浓度10μM(实施例7)、15μM(实施例8)的方式,分别制备杂交溶液,用于杂交,除此以外,与实施例1同样地,进行目标核酸hsa-miR-6858-5p的杂交,评价交叉杂交的抑制效果。
将其结果示于图2。将poly-dG5以10μM、15μM添加时,S/N比分别提高到3.11、3.92,发挥了鲑鱼精DNA(比较例1)以上的交叉杂交的抑制效果。另外,将poly-dG7以10μM、15μM添加时,将poly-dG10以10μM、15μM添加时,与不添加时相比,S/N比分别提高。由该结果可知,碱基长度为5-10的具有鸟嘌呤碱基连续序列的核酸,具有交叉杂交的抑制效果,其中poly-dG5(15μM)显示突出高的交叉杂交的抑制效果。
实施例9-12
作为核酸的非特异性结合抑制剂,以“poly-dG5”(委托ファスマック社合成、反相柱纯化级)(实施例9)、“GGAGG”(委托ファスマック社合成、HPLC纯化级)(实施例10)、“GGGAG”(委托ファスマック社合成、HPLC纯化级)(实施例11)、“TGGGG”(委托ファスマック社合成、HPLC纯化级)(实施例12)为终浓度15μM的方式,分别制备杂交溶液,用于杂交,除此以外,与实施例1同样地,进行目标核酸hsa-miR-6858-5p的杂交,评价交叉杂交的抑制效果。
将其结果示于图3。在添加本发明的任一核酸的非特异性结合抑制剂时,都与不添加时相比,S/N比提高。由该结果可知,不仅是显示高的交叉杂交的抑制效果的poly-dG5这样的仅由鸟嘌呤碱基构成的核酸,以高比率包含鸟嘌呤碱基的核酸都具有交叉杂交的抑制效果。
实施例13
评价本发明的核酸的非特异性结合抑制剂的由制造批次差异产生的对交叉杂交抑制效果的影响。
作为核酸的非特异性结合抑制剂,准备“poly-dG5”(委托ファスマック社合成、反相柱纯化级)的不同制造批次4批次,与实施例4(或实施例9)同样地,分别以终浓度15μM制备杂交溶液,对于各批次分别进行4次(N=4;4批次合计为测定N=16)杂交。
其结果示于图4。poly-dG5的各批次(N=4)的S/N比的平均值和CV值为,批次1:平均值3.75和CV值4.25%、批次2:平均值3.79和CV值3.82%、批次3:平均值3.69和CV值4.22%、批次4:平均值3.60和CV值5.33%,4批次整体为平均值3.71和CV值4.47%。本发明的核酸的非特异性结合抑制剂在制造批次之间没有大的性能差,发挥稳定的交叉杂交的抑制效果。
比较例3
作为一直以来使用的核酸的非特异性结合抑制剂,准备鲑鱼精DNA(Invitrogen社、型号:15632011)的不同制造批次4批次,与实施例13同样地,分别以终浓度92μg/mL制备杂交溶液,对于各批次分别进行4次(N=4;4批次合计为测定N=16)杂交。
其结果示于图5。鲑鱼精DNA的各批次(N=4)的S/N比的平均值和CV值为,批次1:平均值2.43和CV值3.24%、批次2:平均值2.72和CV值5.26%、批次3:平均值2.90和CV值3.20%、批次4:平均值2.63和CV值5.51%,4批次整体为平均值2.67和CV值7.75%。显示与本发明的核酸的非特异性结合抑制剂相比,一直以来使用的鲑鱼精DNA在交叉杂交的抑制效果方面存在大的批次间差异。
序列表自由文本
序列号1:设计的序列,poly-dG10
序列号2:设计的序列
- 核酸的非特异性结合抑制剂、杂交用试剂和核酸的杂交方法
- 一种非特异性扩增天然短片段核酸的方法和试剂盒
