一种高特异性检测嗜肺军团菌的核酸适配体及其检测方法与应用
文献发布时间:2023-06-19 11:22:42
技术领域
本发明涉及防控高致病性微生物领域,尤其涉及一种高特异性检测嗜肺军团菌的核酸适配体及其检测方法与应用。
背景技术
嗜肺军团菌(Legionella pneumophila)是近年来在世界各地频繁报道的一种革兰氏阴性条件致病菌。军团菌病最早于1976年首次报道。当年的7月23日,在美国费城召开的退伍军人大会上爆发了大规模的感染,导致22人死亡,数百人出现非典型肺炎的症状。次年,美国疾病预防控制中心(CDC)的科学家从病人的肺组织分离出致病的元凶:军团病杆菌(Legionnaires’disease bacterium,LDB)。1979年,美国CDC将军团病杆菌正式命名为嗜肺军团菌。此后世界各地时有军团菌病暴发的报道,我国也于1982年首次报道了军团菌感染的临床病例。
军团菌感染人类的主要途径是中央空调冷却塔工作时形成的含菌气溶胶。当免疫力低下的人群吸入含有军团菌的气溶胶时,军团菌会进入到肺部并感染肺泡巨噬细胞(Alveolar macrophage),在其中增殖并扩散,引起可致命的急性呼吸道传染病。我国卫生部颁布的WS 394-2012《公共场所集中空调通风系统卫生规范》4.3中明确规定公共场所集中空调中不得检出嗜肺军团菌。但随着城镇的现代化程度越来越高,集中空调和供水系统等设施的使用范围不断扩大,由此而带来的军团菌病的潜在危害性也大大增加。尤其是在我国南方,夏季长时间开空调,封闭的公共场所里军团菌病更容易扩散传播,如何针对环境中及人体内的嗜肺军团菌进行快速的特异性检测是目前亟待解决的问题。
目前已有多种方法应用于军团菌的检测鉴定,这些方法都存在许多缺陷和局限性。首先,针对环境中的嗜肺军团菌的检测,GB/T 18204.5-2013《公共场所卫生检验方法第5部分:集中空调通风系统》规定水中及空气中的嗜肺军团菌检测方法为分离培养法配合生化反应、血清分型鉴定,但由于嗜肺军团菌不易生长,分离培养很难得到嗜肺军团菌,研究表明该方法敏感度为10%~80%,稳定性和重复性差,导致该方法检测假阴性率很高,并且该方法检测周期为3-14天,检测时间非常长,不具有检测时效性。其次,针对人体感染嗜肺军团菌后的检测WS 195-2001《军团病诊断标准及处理原则》中规定的方法包括分离培养法、酶联免疫吸附法(ELISA)、扩增法(PCR)三大类。分离培养法的缺陷已经在上述说明,酶联免疫吸附法存在灵敏度低的缺陷,检测限一般≥1000CFU/mL。扩增法(PCR)需要昂贵的仪器设备,并且操作过程极易产生交叉污染,造成假阳性的出现。
核酸适配体(Aptamer)是一类在体外筛选的,能与相应目标物专一并紧密结合的一类单链寡核苷酸序列。核酸适配体可单独作为生物探针对目标生物进行检测识别,其优点在于:第一,特异性高,其单链寡核苷酸序列形成的二级或三级空间结构可与病原微生物表面复杂的靶结构(如表面抗原蛋白质空间结构、表面多糖类空间结构)特异性结合,从而达到捕捉和识别病源微生物的作用;第二,亲和力强,核酸适配体形成的特异性空间结构可有效的结合在目标生物靶标上,不易脱落;第三,灵敏度高,核酸适配体生物探针对目标生物的灵敏度一般为10-100CFU/mL,相比ELISA的方法进步一个数量级;第四,反应快速,核酸适配体生物探针可在5-15分钟内与目标生物快速结合,相比分离培养法3-14天检测周期,大大缩短了时间;第五,经济成本低容易制造,传统的抗体蛋白(单抗及多抗)生物探针在产业化生产时制作过程复杂成本高,而核酸适配体生物探针产业化简单,生产耗材成本低、制作过程简单,在获得序列顺序后,通过基因编辑技术可大量生产。近年,学者们通过指数富集系统进化技术(SELEX),获得了个别病原细菌的特异核酸适配体。相关已有研究结果见下表1。
表1已有的核酸适配体序列
但至今仍未有检测嗜肺军团菌的核酸适配体的研究报道,同步地,也没有核酸适配体对嗜肺军团菌进行快速检测方法的报道。
发明内容
本发明的目的在于克服现有技术的不足,提供一种高特异性检测嗜肺军团菌的核酸适配体及其检测方法与应用。本发明筛选获得的嗜肺军团菌核酸适配体,及利用所得核酸适配体对嗜肺军团菌的快速检测应用,对于有效的监控防治公共卫生环境中的嗜肺军团菌以及人感染嗜肺军团菌的快速诊断具有十分重要的意义。
本发明不仅克服现有嗜肺军团菌检测技术的不足,还填补了核酸适配体在检测嗜肺军团菌应用上的空白,
为实现上述目的,本发明采取的技术方案为:提供一种高特异性检测嗜肺军团菌的核酸适配体,所述核酸适配体包括GGTACTTCC、GGGCA茎环结构和TGAAGTGTTTAGGA结构。
本发明的核酸适配体通过基因测序以及使用mfold算法、Quikfold Web server、RNA Struture软件预测适配体与嗜肺军团菌结合区域,发现核酸适配体具有GGTACTTCC、GGGCA茎环结构、TGAAGTGTTTAGGA结构。
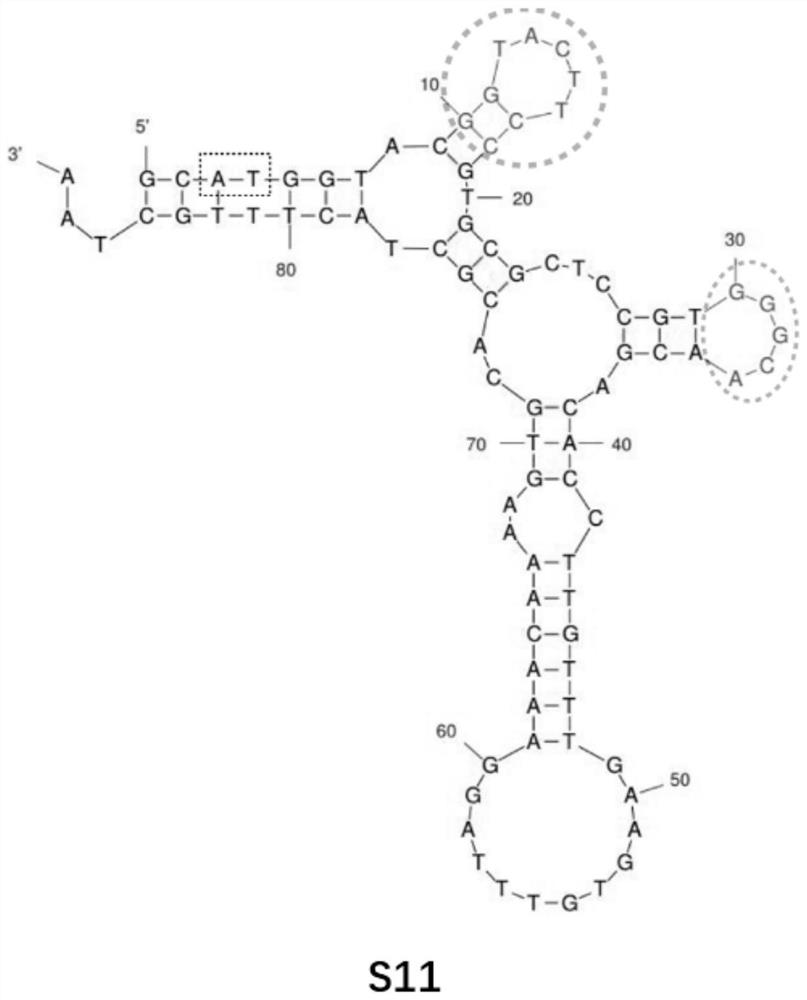
作为本发明所述核酸适配体的优选实施方式,所述核酸适配体的序列如SE Q IDNO:1所示。所述核酸适配体为核酸适配体S11,其核苷酸序列为:GCATGGTACGGTACTTCCGTGCGCTCCGTGGGCAACGACACCTTGTTTGAAGTGTTTAGGAAACAAAAGTGCACGCTACTTTGCTAA。
本发明还提供所述核酸适配体在检测嗜肺军团菌中的应用。
作为本发明所述应用的优选实施方式,所述嗜肺军团菌为嗜肺军团菌LP02或嗜肺军团菌JR32。
本发明同时提供一种用于检测嗜肺军团菌的试剂盒,所述试剂盒中含有所述核酸适配体。
本发明还提供一种检测嗜肺军团菌的方法,所述方法包括以下步骤:将所述核酸适配体加入待测样本,用485nm激发光激发,测定535nm处的发射光强度,通过测定发射光强度判断核酸适配体与样本是否结合,从而检测样本中是否存在嗜肺军团菌。
作为本发明所述检测方法的优选实施方式,所述核酸适配体带有荧光修饰。
作为本发明所述检测方法的优选实施方式,所述荧光修饰为FAM修饰。
本发明的有益效果:
(1)本发明成功研究得到高特异性识别嗜肺军团菌的核酸适配体序列及结构。通过SELEX筛选,选择1条高特异性识别嗜肺军团菌核酸适配体序列,序列特点包括具有GGTACTTCC、GGGCA茎环结构、TGAAGTGTTTAGGA结构。
(2)本发明的高特异性识别嗜肺军团菌的核酸适配体,在荧光检测结果和解离常数检测结果中能够表现出对军团菌的选择性结合,表现出高特异性、高亲和力和高结合性,可以运用基于核酸适配体的嗜肺军团菌检测系统完成嗜肺军团菌及其相近种属的快速检测需要,防控高致病性微生物,对于有效的监控防治公共卫生环境中的嗜肺军团菌具有着十分重要的意义。
附图说明
图1:体外筛选适配体结果图;其中A:PCR产品通过电泳分析结果图;通道1,DNA标记;通道2,扩增的DNA产物;黑色箭头表示DNA扩增出条带;B:1-17轮各轮次筛选后适配体产量;黑色箭头为第2、6、9、13轮适配体产量较低。
图2:使用多扫描光谱测定13条嗜肺军团菌核酸适配体序列S1、S4、S5、S6、S10、S11、S16、S17、S20、S21、S28、S31、S32与JR32野生嗜肺军团菌特异性结合荧光值大小结果图。
图3:为核酸适配体序列与嗜肺军团菌结合位点预测图;使用DNA mfold服务器,并基于最小自由能算法,预测筛选所得适配体(S11和S28)的二级结构,虚线圆圈所示区域为保守的茎环结构;S11具有GGTACTTCC、GGGCA残基形成的茎环结构、TGAAGTGTTTAGGA结构。
图4:为FAM标记的核酸适配体S11的荧光检测图;经FAM标记的S11核酸适配体与嗜肺军团菌JR32和LP02细胞孵育后可见明显的荧光。而FAM标记的S11与阴性对照细胞(大肠埃希氏菌Escherichia coli、枯草芽孢杆菌Bacillus subtilis、丁香假单包菌Pseudomonas syringae、金黄色酿脓葡萄球菌Staphylococcus aureus、考特拉军团菌Legionella quateirensis、阿德莱德军团菌Legionella adelaidensis)没有任何明确的荧光信号。
图5:核酸适配体对不同细胞的特异性荧光检测图;结果表明S11与JR32、LP02结合后荧光信号强烈,阴性对照细胞几乎无信号。
图6:不同采样环境中S11适配体相对荧光值结果图。
图7:为嗜肺军团菌JR32和LP02的核酸适配体S11的解离常数0-500nM浓度范围内变化图。
具体实施方式
为更清楚地表述本发明的创新性与有效性,下面结合具体实施例进一步说明,但不能用于限制本发明,此仅是本发明的部分实施例。
实施例1SELEX筛选
为了提高核酸适配体的筛选效率,综合实验可行性、研究成本以及保留靶物质天然构像等多方面因素后,我们使用全细胞-SELEX进行嗜肺军团菌核酸适配体的具体筛选工作。
经过17轮选择(图1B),ssDNA结合到靶细胞中,共对60个克隆转化体进行了测序,以识别特定的核酸适配体候选物。经测序后,筛选出13条高特异性嗜肺军团菌核酸适配体序列,分别编号为S1、S4、S5、S6、S10、S11、S16、S17、S20、S21、S28、S31、S32。进一步地,通过使用多扫描光谱,根据核酸适配体与JR32野生嗜肺军团菌特异性结合荧光值大小(表2),选择1条独特的核酸适配体S11,核酸适配体序列如表3。
表2核酸适配体与JR32野生嗜肺军团菌特异性结合荧光值
表3核酸适配体序列
实施例2核酸适配体结合位点预测
经筛选的核酸适配体S11的GC含量为49%。GC/AT比是核苷酸组成的基本序列特征之一。本实施例中,对核酸适配体S11的序列进一步预测结合位点。
为进一步了解核酸适配体序列对于嗜肺军团菌结合位点,以及序列对位点结合的影响,我们使用mfold算法预测核酸适配体结构折叠:http://unafold.rna.albany.edu/?q_mfold/DNA-Fold-Form,预测模型设置条件为4℃下,Na
使用Quikfold Web server:
结果显示,核酸适配体S11具有GGTACTTCC、GGGCA茎环结构(图3中虚线区域)、TGAAGTGTTTAGGA结构。
实施例3核酸适配体对不同细胞的特异性荧光检测
(1)菌种来源
Legionella pneumophila subsp.pneumophila str.Philadelphia 1来源嗜肺军团菌L.pneumophila血清I型费城株,胸腺嘧啶合成营养缺陷型,基因型Smr rpsL hsdRthyA,中山大学生命科学学院分子生物实验室馈赠,下称嗜肺军团菌LP02。
Legionella pneumophila str.Corby来源嗜肺军团菌L.pneumophila血清I型费城株,从上海疾病预防控制中心菌种保藏库购得,下称嗜肺军团菌JR32。
(2)核酸适配体对不同细胞的特异性荧光检测的具体方法
合成5’端FAM修饰的核酸适配体,使用250nM浓度的核酸适配体溶液(96℃变性10min,冰上退火10min)与10
用大肠埃希氏菌(Escherichia coli),枯草芽孢杆菌(Bacillus subtilis),丁香假单包菌(Pseudomonas syringae),考特拉军团菌(Legionella quateirensis),阿德莱德军团菌(Legionella adelaidensis)以及金黄色酿脓葡萄球菌(Staphylococcus aureus)作为阴性对照(图3A)。
(3)实验结果
结果如图4所示,用FAM标记S11观察到荧光标记的军团菌JR32和Lp02细胞,但用FAM-S11孵育的阴性对照细胞未显示任何明确细胞上的荧光信号。
如图5所示,通过使用多扫描光谱,检测到荧光强度,S11与JR32、LP02结合后荧光信号强烈,阴性对照细胞几乎无信号,核酸适配体S11表现出对军团菌JR32和Lp02的选择性结合。
这些结果表明,核酸适配体S11对军团菌JR32和Lp02表现出亲和力和高选择性。
实施例4嗜肺军团菌核酸适配体特异性荧光检测
用不同采样方法(沉降、泵吸、冷凝)从空气中采集细菌,接种到营养培养基上,分离纯化,得到嗜肺军团菌以外的其他细菌混合样本,配制成10
表4不同采样环境中S11核酸适配体相对荧光值
实施例5核酸适配体与嗜肺军团菌的解离常数(Kd值)
为了更详细地评估核酸适配体与嗜肺军团菌结合紧密程度,我们通过测定核酸适配体与菌株的解离常数,确定核酸适配体S11与军团性肺炎嗜血杆菌JR32和Lp02的结合亲和力。
具体方法:将荧光素标记的核酸适配体S11分为6个浓度组进行测定,分别为12.5nM、31.25nM、62.5nM、125nM、250nM和500nM。分别与10
结果如图7和表5所示,核酸适配体S11对军团菌肺炎JR32和Lp02均有高特异性,紧密结合。
表5不同浓度核酸适配体S11与嗜肺军团菌的结合强度
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
SEQUENCE LISTING
<110> 深圳市尚康生物科技有限公司
<120> 一种高特异性检测嗜肺军团菌的核酸适配体及其检测方法与应用
<130> 2021.02.07
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 87
<212> DNA
<213> 人工合成
<400> 1
gcatggtacg gtacttccgt gcgctccgtg ggcaacgaca ccttgtttga agtgtttagg 60
aaacaaaagt gcacgctact ttgctaa 87
- 一种高特异性检测嗜肺军团菌的核酸适配体及其检测方法与应用
- 一种高特异性检测嗜肺军团菌的核酸适配体及其检测方法与应用
