具核梭杆菌荧光定量检测试剂盒及其制备方法与检测方法
文献发布时间:2023-06-19 11:30:53
技术领域
本发明涉及医学临床技术领域,具体为一种具核梭杆菌荧光定量检测试剂盒及其制备方法与检测方法。
背景技术
具核梭杆菌(Fusobacterium nucleatum,Fn)是一种广泛存在于人体和多种动物体内的无芽孢专性厌氧杆菌。过去Fn一直被视为人体口咽部的正常菌群之一,近年来从临床标本中被分离出来,已被证实为一种条件致病菌,其不仅与口腔疾病有关,还有败血症、盆腔炎、食管癌、结直肠癌等疾病有密切关系。特别是结直肠癌(CRC),作为全球第三大常见肿瘤,是引起肿瘤相关死亡的第二大病因,其发生、发展、分子分型、患者化疗后反应、预后等都与具核梭杆菌密切相关:结直肠癌患者的肿瘤组织及粪便中,具核梭杆菌的丰度显著升高;具核梭杆菌能够通过诱导癌细胞自噬而导致CRC患者化疗耐药与肿瘤的术后复发,复发患者肿瘤组织中具核梭杆菌含量明显高于未复发患者;在检测结直肠癌及高危腺瘤时,CRC及高危腺瘤患者粪便中具核梭杆菌丰度高于健康人,结合粪便免疫化学检测(FIT)与粪便具核梭杆菌定量,可提升CRC诊断的准确性和灵敏度。具核梭杆菌可影响CRC进展中的多个阶段:促进癌细胞增殖、肿瘤免疫逃逸、复发和化疗耐药性等。因此具核梭杆菌可作为潜在的标志物用于CRC诊断和预后评估,也是治疗CRC的潜在靶点,临床上对于具核梭杆菌的鉴定和检测也得到越来越多的重视。
目前,具核梭杆菌检测方法有多种,具体可细分为细菌学、免疫学、组织病理学、分子生物学方法等。细菌学方法,即传统的微生物培养及鉴定,耗时长、效率低,特别是厌氧菌的分离培养对培养条件有着苛刻要求,极易出现假阴性。免疫学方法多依赖细菌培养的基础。组织病理学鉴定可对组织样本中的具核梭杆菌进行定位,但对样本类型、采集保存条件等要求较高。而分子生物学方法,尤其是实时荧光定量PCR(RT-qPCR或qPCR)法,因其灵敏度高,特异性强,不依赖培养,可对多种类型标本进行直接检测并同时进行定量或相对定量等优点,已成为目前检测病原微生物应用最多的手段。具核梭杆菌的荧光定量PCR检测方法及应用已得到越来越多的认可,但仍面临着挑战:不同研究团队检测的基因靶标的不一致性,导致缺少判定检测结果的统一标准,且缺少对于具核梭杆菌荧光PCR检测方法特异性、灵敏度及应用范围的专门研究。此外,目前关于具核梭杆菌的检测研究多局限于对粪便样本或结直肠癌组织样本中的具核梭杆菌进行检测,而具核梭杆菌作为口腔中的常见共生菌及条件致病菌,可引起口咽部和口腔外多种感染性疾病,因此,对口腔拭子或牙菌斑等多种临床样本中的具核梭杆菌进行检测同样具有重要的临床意义。因此急需开发出一种便捷的适用于多种临床样本的通用型具核梭杆菌检测试剂方法,从而方便检测,提高检测效率。
发明内容
本发明提供具核梭杆菌荧光定量检测试剂盒及其制备方法与检测方法。
本发明的方案是:
一种具核梭杆菌荧光定量检测试剂盒,包括第一试剂、第二试剂、第一反应液、第二反应液、定量参考品、临界阳性对照、强阳性对照与阴性对照,所述第二反应液包括特异性扩增具核梭杆菌基因与细菌16S rDNA基因的引物及探针溶液。
作为优选的技术方案,所述第一试剂为样品保存液,所述样品保存液包括0.01-1mol/L的EDTA、0.01-3mol/L的Tris-HCl、0.05-0.5mol/L的NaCl、质量分数为0.1%-0.5%的SDS、浓度为0.01-0.5M的柠檬酸钠、10-50%的无水乙醇中的一种或多种组合而成。
作为优选的技术方案,所述第二试剂为核酸提取液,所述核酸提取液包括100-500mM Tris-HCl、20-100mM EDTA、0.4-1M NaCl与体积分数为1%-4%的SDS,所述Tris-HCl的pH7.4,所述EDTA的pH7.4。
作为优选的技术方案,所述第一反应液为酶反应液,所述酶反应液包括PCR反应缓冲液、dNTPs、tTH酶、UNG酶、BSA、甜菜碱、DMSO和Mg
作为优选的技术方案,所述临界阳性对照与强阳性对照分别包括灭活的具核梭杆菌标准菌株,强阳性对照浓度为10
阳性质控品及定量参考品
根据所扩增片段区域,构建质粒并导入到大肠杆菌E.coli TOP10菌株,作为阳性对照品,使用数字PCR(ddPCR)对每批次的阳性对照品进行定量,并进行相应的倍数稀释,制备4×10
ddPCR所用引物:dd-F:CTAGATATCGGATCCCGACACC;
dd-R:TTCTTTGTGACACGGGCCCGT。
试剂盒检测下限(灵敏度)
使用浓度为4、40copies/ml的模拟样本各5个,验证检出率。
本发明还公开了一种特异性扩增具核梭杆菌的核酸组合引物及其探针的制备方法,依据NCBI数据库中细菌核酸序列,设计具核梭杆菌与细菌16S rDNA引物与探针,引物长度18-25bp,避免产生二级结构;引物GC含量为40-60%,Tm值50-60℃;依据上下游引物所扩增的产物序列选择20-28个碱基片段作为探针区域,避免产生二级结构;探针GC含量为50-60%,Tm值55-65℃;所述具核梭杆菌的核酸组合中的引物组合包括第一引物对与第二引物对,所述第一引物对的上游引物的碱基序列如SEQ ID NO.1所示,所述第一引物对的下游引物的碱基序列如SEQ ID NO.2所示,所述第二引物对的上游引物碱基序列如SEQ ID NO.3所示,所述第二引物对的下游引物碱基序列如SEQ ID NO.4所示,在引物及探针设计过程中若同一位点出现不同碱基可能性,使用相应简并碱基替代(见图6)。
上游引物SEQ ID NO.1:
IR-F4:GMAACRCGARGAACCTTACC
下游引物SEQ ID NO.2:
IR-R4:GCGCTCGTTRCGGGACTTAA第二对引物探针序列如下:
上游引物SEQ ID NO.3:
Fn-F3:TCAAGAGGGACTCGAACC
下游引物SEQ ID NO.4:
Fn-R3:CCTGCATGTGTTGTTAACTG
作为优选的技术方案,所述具核梭杆菌的核酸组合中的探针包括第一探针与第二探针,所述第一探针与第二探针的5'端标记有荧光基团,探针3'端标记有淬灭基团,所述探针的5'端标记有荧光基团,3'端标记有淬灭基团,所述荧光基团为FAM、VIC、TET、JOE、HEX、CY3、CY5、ROX、RED610、TEXAS RED、RED670、NED中的其中一种,所述淬灭基团为6-TAMRA、BHQ-1~3与结合分子沟的非荧光淬灭剂其中的一种。
作为优选的技术方案,所述第一探针的序列如SEQ ID NO.5所示,所述第二探针的序列如SEQ ID NO.6所示。
第一探针SEQ ID NO.5:
ROX-5'-GCATGGYTGTCGTCAGCTCGTGT-3'-BHQ2
第二探针SEQ ID NO.6:
Fn-Probe3:FAM-5'-GGAGACCGATGCTCTACCAATTGAG-3'-BHQ1
本发明还公开了一种具核梭杆菌荧光定量检测试剂盒的检测方法,包括下列步骤:
1)样本处理,将样品加入第一试剂,预处理后加入第二试剂混匀后,样本进行100℃水浴或金属浴10min,13000rpm离心1min,取上清液备用或-80℃保存;
2)反应体系,将含有上清液的试管中加入第一反应液、第二反应液、模板DNA与水;
3)反应程序,放置有上述试管的荧光PCR检测仪进行循环,第一阶段,95℃预变性30~600s;第二阶段,95℃,3~20s;58~60℃,10~45s,同时收集相应的荧光信号,40~45个循环;
4)结果判断,不同浓度定量参考品溶液,扩增结果均有明显的S型扩增曲线;根据扩增曲线Ct值判断,浓度与扩增循环数Ct结果具有很好的线性关系;
步骤3)中反应结束后,根据各反应管中样本的扩增曲线与循环数Ct作为具核梭杆菌基因存在与否的判断依据;
细菌16S rDNA基因的检测信号呈现S扩增曲线且Ct值小于38,表明本次扩增有效;当细菌16S rDNA基因无S扩增曲线,表明本次扩增无效;在扩增有效的前提下,若待测样本产生S型扩增曲线且Ct值小于38,则所述样本中存在具核梭杆菌基因;若待测样本扩增Ct值大于或等于38,待测样本中不存在具核梭杆菌基因或所含有的具核梭杆菌基因低于检测下限;
在步骤1)中采用粪便样本时,根据各反应管中样本的具核梭杆菌基因扩增Ct值与16S rDNA扩增Ct值的差异,作为判断结直肠癌与癌前息肉的标准;在有效扩增时,若CtFn-CtIR>19,结果判断为结直肠癌与癌前息肉低风险,若CtFn-CtIR≤19,结果判断为结直肠癌与癌前息肉高风险;其中CtFn表示具核梭杆菌基因扩增Ct值,CtIR表示16S rDNA扩增Ct值;根据Fn标准曲线,用来计算出每mg样本中具核梭杆菌的拷贝数,并定量分析标本中具核梭杆菌的含量。
作为优选的技术方案,所述步骤1)样本处理中样本包括粪便样本、口腔拭子样本与组织样本其中的一种或多种;其中粪便样本为将患者的粪便收集到第一试剂中,常温或4℃保存2周,-20℃保存6个月;生理盐水洗涤样本1~2次;取200μl样本加入100-500μl第二试剂,涡旋振荡充分混匀,获得粪便样本;所述口腔拭子样本为从患者口腔中采集口腔拭子或牙斑菌置入第一试剂中,13000rpm离心5-10min后,加入50-100μl第二试剂然后进行涡旋震荡充分混匀,获得口腔拭子样本;所述组织样本为新鲜组织先用生理盐水洗涤一次,切成宽度<1cm的切片,加入第一试剂,石蜡包埋组织需加入二甲苯进行脱蜡处理,装有组织样本的无菌离心管中加入加入PBS,加入100mg直径0.1-0.2mm的玻璃珠,涡旋振荡混匀,10000rpm离心1min,弃上清;加入PBS涡旋振荡混匀室温离心,弃上清,重复2次;加入100-500μl第二试剂,涡旋振荡充分混匀获得组织样本。
由于采用了上述技术方案,具核梭杆菌荧光定量检测试剂盒及其制备方法与检测方法,包括第一试剂、第二试剂、第一反应液、第二反应液、定量参考品、临界阳性对照、强阳性对照与阴性对照,所述第二反应液包括特异性扩增具核梭杆菌基因与细菌16S rDNA基因的引物及探针溶液。
本发明的优点,提供了一种检测样本中具核梭杆菌的核酸组合,该组合能特异、高灵敏地检测临床样本中的具核梭杆菌;
提供该具核梭杆菌荧光定量检测核酸组合的阳性质控品及梯度浓度定量参考品,可对样本中的具核梭杆菌进行细菌定量或相对定量;
与现有技术相比,本发明提供的具核梭杆菌检测试剂盒能够检出多种类型临床样本中的具核梭杆菌,且具有较高的灵敏度和特异性,可便捷地应用于临床多种场景,有效提高检测效率;还可对具核梭杆菌进行定量检测,且操作简单,利于推广应用。
本发明根据具核梭杆菌基因靶点设计特异性引物,并制备相应阳性质控品及定量参考品,可将检测结果假阳性和假阴性控制在极低水平,提高检测结果的准确性。根据不同临床需求,可对包括唾液、牙菌斑、粪便、组织等不同类型样本中的具核梭杆菌进行快速检测及定量。
附图说明
图1为梯度浓度扩增曲线图(浓度:4×10
图2为具核梭杆菌定量检测试剂盒线性区间、最低检测限的线型图、指数图;
图3为检测下限验证图,其中在4×10
图4为不同浓度引物及探针组合扩增效率图(左)及验证浓度范围图(右);
图5为体现精密度、重复性的扩增曲线图(选择4×10
10
图6为简并碱基符号对应表图;
图7为具核梭杆菌癌组织与癌旁组织含量差异图。
具体实施方式
为了弥补背景技术中提到的不足,本发明提供了具核梭杆菌荧光定量检测试剂盒及其制备方法与检测方法以解决上述背景技术中的问题。
一种具核梭杆菌荧光定量检测试剂盒,包括第一试剂、第二试剂、第一反应液、第二反应液、定量参考品、临界阳性对照、强阳性对照与阴性对照,所述第二反应液包括特异性扩增具核梭杆菌基因与细菌16S rDNA基因的引物及探针溶液。
所述第一试剂为样品保存液,所述样品保存液包括0.01-1mol/L的EDTA、0.01-3mol/L的Tris-HCl、0.05-0.5mol/L的NaCl、质量分数为0.1%-0.5%的SDS、浓度为0.01-0.5M的柠檬酸钠、10-50%的无水乙醇中的一种或多种组合而成。
所述第二试剂为核酸提取液,所述核酸提取液包括100-500mM Tris-HCl、20-100mM EDTA、0.4-1M NaCl与体积分数为1%-4%的SDS,所述Tris-HCl的pH7.4,所述EDTA的pH7.4。
所述第一反应液为酶反应液,所述酶反应液包括PCR反应缓冲液、dNTPs、tTH酶、UNG酶、BSA、甜菜碱、DMSO和Mg
所述临界阳性对照与强阳性对照分别包括灭活的具核梭杆菌标准菌株,强阳性对照浓度为10
阳性质控品及定量参考品
根据所扩增片段区域,构建质粒并导入到大肠杆菌E.coli TOP10菌株,作为阳性对照品,使用数字PCR(ddPCR)对每批次的阳性对照品进行定量,并进行相应的倍数稀释,制备4×10
ddPCR所用引物:dd-F:CTAGATATCGGATCCCGACACC;
dd-R:TTCTTTGTGACACGGGCCCGT。
试剂盒检测下限(灵敏度)
使用浓度为4、40copies/ml的模拟样本各5个,验证检出率。
本发明还公开了一种特异性扩增具核梭杆菌的核酸组合引物及其探针的制备方法,依据NCBI数据库中细菌核酸序列,设计具核梭杆菌与细菌16S rDNA引物与探针,引物长度18-25bp,避免产生二级结构;引物GC含量为40-60%,Tm值50-60℃;依据上下游引物所扩增的产物序列选择20-28个碱基片段作为探针区域,避免产生二级结构;探针GC含量为50-60%,Tm值55-65℃;所述具核梭杆菌的核酸组合中的引物组合包括第一引物对与第二引物对,所述第一引物对的上游引物的碱基序列如SEQ ID NO.1所示,所述第一引物对的下游引物的碱基序列如SEQ ID NO.2所示,所述第二引物对的上游引物碱基序列如SEQ ID NO.3所示,所述第二引物对的下游引物碱基序列如SEQ ID NO.4所示,在引物及探针设计过程中若同一位点出现不同碱基可能性,使用相应简并碱基替代。
上游引物SEQ ID NO.1:
IR-F4:GMAACRCGARGAACCTTACC
下游引物SEQ ID NO.2:
IR-R4:GCGCTCGTTRCGGGACTTAA
第二对引物探针序列如下:
上游引物SEQ ID NO.3:
Fn-F3:TCAAGAGGGACTCGAACC
下游引物SEQ ID NO.4:
Fn-R3:CCTGCATGTGTTGTTAACTG
作为优选的技术方案,所述具核梭杆菌的核酸组合中的探针包括第一探针与第二探针,所述第一探针与第二探针的5'端标记有荧光基团,探针3'端标记有淬灭基团,所述探针的5'端标记有荧光基团,3'端标记有淬灭基团,所述荧光基团为FAM、VIC、TET、JOE、HEX、CY3、CY5、ROX、RED610、TEXAS RED、RED670、NED中的其中一种,所述淬灭基团为6-TAMRA、BHQ-1~3与结合分子沟的非荧光淬灭剂其中的一种。
所述第一探针的序列如SEQ ID NO.5所示,所述第二探针的序列如SEQ ID NO.6所示。
第一探针SEQ ID NO.5:
ROX-5'-GCATGGYTGTCGTCAGCTCGTGT-3'-BHQ2
第二探针SEQ ID NO.6:
Fn-Probe3:FAM-5'-GGAGACCGATGCTCTACCAATTGAG-3'-BHQ1
本发明还公开了一种具核梭杆菌荧光定量检测试剂盒的检测方法,包括下列步骤:
1)样本处理,将样品加入第一试剂,预处理后加入第二试剂混匀后,样本进行100℃水浴或金属浴10min,13000rpm离心1min,取上清液备用或-80℃保存;
2)反应体系,将含有上清液的试管中加入第一反应液、第二反应液、模板DNA与水;
3)反应程序,放置有上述试管的荧光PCR检测仪进行循环,第一阶段,95℃预变性30~600s;第二阶段,95℃,3~20s;58~60℃,10~45s,同时收集相应的荧光信号,40~45个循环;
4)结果判断,不同浓度定量参考品溶液,扩增结果均有明显的S型扩增曲线;根据扩增曲线Ct值判断,浓度与扩增循环数Ct结果具有很好的线性关系;
步骤3)中反应结束后,根据各反应管中样本的扩增曲线与循环数Ct作为具核梭杆菌基因存在与否的判断依据;
细菌16S rDNA基因的检测信号呈现S扩增曲线且Ct值小于38,表明本次扩增有效;当细菌16S rDNA基因无S扩增曲线,表明本次扩增无效;在扩增有效的前提下,若待测样本产生S型扩增曲线且Ct值小于38,则所述样本中存在具核梭杆菌基因;若待测样本扩增Ct值大于或等于38,待测样本中不存在具核梭杆菌基因或所含有的具核梭杆菌基因低于检测下限;
在步骤1)中采用粪便样本时,根据各反应管中样本的具核梭杆菌基因扩增Ct值与16SrDNA扩增Ct值的差异,作为判断结直肠癌与癌前息肉的标准;在有效扩增时,若CtFn-CtIR>19,结果判断为结直肠癌与癌前息肉低风险,若CtFn-CtIR≤19,结果判断为结直肠癌与癌前息肉高风险;其中CtFn表示具核梭杆菌基因扩增Ct值,CtIR表示16SrDNA扩增Ct值;根据Fn标准曲线,用来计算出每mg样本中具核梭杆菌的拷贝数,并定量分析标本中具核梭杆菌的含量。
所述步骤1)样本处理中样本包括粪便样本、口腔拭子样本与组织样本其中的一种或多种;其中粪便样本为将患者的粪便收集到第一试剂中,常温或4℃保存2周,-20℃保存6个月;生理盐水洗涤样本1~2次;取200μl样本加入100-500μl第二试剂,涡旋振荡充分混匀,获得粪便样本;所述口腔拭子样本为从患者口腔中采集口腔拭子或牙斑菌置入第一试剂中,13000rpm离心5-10min后,加入50-100μl第二试剂然后进行涡旋震荡充分混匀,获得口腔拭子样本;所述组织样本为新鲜组织先用生理盐水洗涤一次,切成宽度<1cm的切片,加入第一试剂,石蜡包埋组织需加入二甲苯进行脱蜡处理,装有组织样本的无菌离心管中加入加入PBS,加入100mg直径0.1-0.2mm的玻璃珠,涡旋振荡混匀,10000rpm离心1min,弃上清;加入PBS涡旋振荡混匀室温离心,弃上清,重复2次;加入100-500μl第二试剂,涡旋振荡充分混匀获得组织样本。
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面结合具体实施例,进一步阐述本发明。
实施例1:
(1)引物及探针设计、核酸组合
根据NCBI数据库中细菌16S rRNA核酸序列,设计具核梭杆菌和内参引物。设置参数:长度18-25bp,避免产生二级结构;引物GC含量为40-60%,Tm值50-60℃,优选55℃。根据上下游引物所扩增的产物序列选择20-28b个碱基片段作为探针区域,避免产生二级结构;引物GC含量为50-60%,Tm值55-65℃,优选60℃。探针的5'端标记有荧光基团,3'端标记有淬灭基团,所述荧光基团为FAM、VIC、TET、JOE、HEX、CY3、CY5、ROX、RED610、TEXAS RED、RED670、NED中的一种,所述淬灭基团为6-TAMRA、BHQ-1~3、和结合分子沟的非荧光淬灭剂中的一种。
其中,在引物及探针设计过程中若同一位点出现不同碱基可能性,使用相应简并碱基替代(图6)。
设计内参引物及探针序列如下:
F4:GMAACRCGARGAACCTTACC
R4:GCGCTCGTTRCGGGACTTAA
Probe4:GCATGGYTGTCGTCAGCTCGTGT
具核梭杆菌引物探针序列如下:
F3:TCAAGAGGGACTCGAACC
R3:CCTGCATGTGTTGTTAACTG
Probe3:GGAGACCGATGCTCTACCAATTGAG
(2)核酸(引物及探针)组合体系优化
使用不同浓度引物及探针组合,固定模板DNA浓度(例如使用4×10
(3)阳性质控品及定量参考品
根据所扩增片段区域,构建质粒并导入到大肠杆菌E.coli TOP10菌株,作为阳性对照品,使用数字PCR(ddPCR)对每批次的阳性对照品进行定量,并进行相应的倍数稀释,制备4×10
ddPCR所用引物:dd-F:CTAGATATCGGATCCCGACACC;
dd-R:TTCTTTGTGACACGGGCCCGT。
(3)试剂盒组合
试剂盒组合包括:第一试剂(样品保存液)、第二试剂(核酸提取液)、第一反应液(酶反应液)、第二反应液(核酸组合)、定量参考品、临界阳性对照、强阳性对照、阴性对照
试剂1包括:0.01-1mol/L的EDTA、0.01-3mol/L的Tris-HCl,0.05-0.5mol/L的NaCl,质量分数为0.1%-0.5%的SDS、浓度为0.01-0.5M的柠檬酸钠、10-50%的无水乙醇中的一种或多种。
试剂2包括:100-500mM Tris-HCl(pH7.4)、20-100mM EDTA(pH7.4)、0.4-1M NaCl和体积分数为1%-4%的SDS中的一种或多种。
第一反应液:PCR反应缓冲液、dNTPs、tTH酶、UNG酶、BSA、甜菜碱、DMSO和Mg
第二反应液:特异性扩增具核梭杆菌基因及细菌16S rDNA基因的引物及探针溶液。
阳性对照包括灭活的具核梭杆菌标准菌株,强阳性对照浓度为10
(4)试剂盒检测下限(灵敏度)
使用浓度为4、40copies/ml的模拟样本各5个,验证检出率。
(5)试剂盒使用方法:
步骤1.样本处理:
(1)粪便样本:
样品保存液:EDTA 45mM、Tris-HCl 40mM,NaCl 140mM,SDS 0.5%。
将患者的粪便收集到样品保存液中,常温或4℃保存2周,-20℃保存6个月;生理盐水洗涤样本一次或两次;取200mg(或200μl)样本加入100-500μl核酸提取液,涡旋振荡充分混匀。
(2)口腔拭子(牙菌斑)样本:
样品保存液:0.01-1mol/L的EDTA、0.01-3mol/L的Tris-HCl,0.05-0.5mol/L的NaCl,质量分数为0.1%-0.5%的SDS、浓度为0.01-0.5M的柠檬酸钠、10-30%的无水乙醇。
样本13000rpm离心5-10min后,加入50-100μl核酸提取液涡旋震荡充分混匀。
(3)组织样本:
新鲜组织先用生理盐水洗涤一次,切成宽度小于1cm的切片,样品保存液:0.1%-50%的无水乙醇,室温下可保存数日,4℃可保存数年。
石蜡包埋组织需加入二甲苯进行脱蜡处理:
1)石蜡切片:(5-10μm厚,1×1cm
2)石蜡块:手术刀刮取约30mg的组织样本(尽量去除多余的石蜡);
3)福尔马林等固定液或上述保存液中的样本:取30mg样本,用手术刀切为数块,置于1.5ml离心管中。
将样本装入无菌离心管中,加入PBS,加入二甲苯或者无需加入二甲苯,加入100mg直径0.1-0.2mm的玻璃珠,涡旋振荡混匀,10000rpm离心1min,弃上清。加入PBS涡旋振荡混匀室温离心,弃上清,重复2次。加入100-500μl核酸提取液,涡旋振荡充分混匀。
上述各类型样本经预处理并加入第二试剂(核酸提取液)混匀后,100℃水浴或金属浴10min,13000rpm离心1min,取上清备用或-80℃保存。
步骤2.反应体系
反应体系可根据实际情况进行调整使用。
步骤3.反应程序:
适用机型:ABI 7500,CFX96,罗氏480,SLAN-96S等型号荧光PCR检测仪不同仪器的循环条件如下:
(1)通用的循环条件:
(2)CFX96等仪器快速条件设置:
(3)ABI 7500快速条件的专业模式设置:
步骤4.结果判断:
不同浓度参考品溶液,扩增结果均有明显的S型扩增曲线。根据扩增曲线Ct值判断,浓度与扩增循环数Ct结果具有很好的线性关系。
反应结束后,根据各反应管中样本的扩增曲线与循环数Ct作为具核梭杆菌基因存在与否的判断依据。
样本内参IR(16SrDNA)的检测信号呈现S扩增曲线且Ct值小于38,表明本次扩增有效;当内参基因无S扩增曲线,表明本次扩增无效。在扩增有效的前提下:若待测样本产生S型扩增曲线且Ct值小于38,则所述样本中存在具核梭杆菌基因;若待测样本扩增Ct值大于或等于38,待测样本中不存在具核梭杆菌基因或所含有的具核梭杆菌基因低于检测下限;在粪便样本中,根据各反应管中样本的具核梭杆菌基因扩增Ct值与16SrDNA扩增Ct值的差异,作为判断结直肠癌与癌前息肉风险高低的标准。在有效扩增时,若CtFn-CtIR>19,结果判断为结直肠癌与癌前息肉低风险,若CtFn-CtIR≤19,结果判断为结直肠癌与癌前息肉高风险。其中CtFn表示具核梭杆菌基因扩增Ct值,CtIR表示16SrDNA扩增Ct值。另外,根据Fn标准曲线,可以计算出每mg样本中具核梭杆菌的拷贝数,并定量分析标本中具核梭杆菌的含量。
实施例2:
本实施例提供一种检测具核梭杆菌的核酸组合,核酸组合包括引物组合和探针;引物组合包括第一引物对和第二引物,第一引物对的碱基序列如SEQ ID NO.1-2所示,第二引物对的碱基序列如SEQ ID NO.3-4所示,第一引物对的序列如下:
上游引物SEQ ID NO.1:
IR-F4:GMAACRCGARGAACCTTACC
下游引物SEQ ID NO.2:
IR-R4:GCGCTCGTTRCGGGACTTAA
第二对引物探针序列如下:
上游引物SEQ ID NO.3:
Fn-F3:TCAAGAGGGACTCGAACC
下游引物SEQ ID NO.4:
Fn-R3:CCTGCATGTGTTGTTAACTG
探针包括第一探针和第二探针,第一探针的序列如SEQ ID NO.5所示,第二探针的序列如SEQ ID NO.6所示;探针的5'端标记有荧光基团,探针3'端标记有淬灭基团。
探针的序列如下:
第一探针SEQ ID NO.5:
IR-Probe4:ROX-5'-GCATGGYTGTCGTCAGCTCGTGT-3'-BHQ2
第二探针SEQ ID NO.6:
Fn-Probe3:FAM-5'-GGAGACCGATGCTCTACCAATTGAG-3'-BHQ1
在本发明的其他的实施例中,荧光基团还可以是VIC、TET、JOE、HEX、CY3、CY5、ROX、RED610、TEXAS RED、RED670、NED中的一种,淬灭基团还可以是6-TAMRA、BHQ-1~3、和结合分子沟的非荧光淬灭剂(Minor Groove Binder,non-fluorescent quencher,MGB,NFQ)中的一种。
设计内参引物及探针序列如下:
F4:GMAACRCGARGAACCTTACC
R4:GCGCTCGTTRCGGGACTTAA
Probe4:GCATGGYTGTCGTCAGCTCGTGT
具核梭杆菌引物探针序列如下:
F3:TCAAGAGGGACTCGAACC
R3:CCTGCATGTGTTGTTAACTG
Probe3:GGAGACCGATGCTCTACCAATTGAG
上述检测具核梭杆菌的核酸组合的使用方法如下:
以待检样本DNA为模板,加入上述引物及探针组合进行PCR扩增反应,PCR反应体系为25μl:加入2×qPCR酶反应液12.5μl,上游引物及下游引物各0.5μl,探针各0.2μl;模板DNA 0.5μl、以及ddH
PCR反应程序为:第一阶段:95℃预变性2min;第二阶段:95℃10s、60℃30s,同时收集FAM和ROX信号,40个循环。
实施例3:
本实施例提供一种检测具核梭杆菌的试剂盒,该试剂盒包括实施例2提供的第二反应液,还包括可以直接进行PCR反应的酶反应液。
试剂盒的使用方法,参考实施例2提供的PCR扩增反应体系以及PCR反应程序,区别在于PCR反应体系为30μl:加入酶反应液15μl,第二反应液6μl,;模板DNA 1μl、以及ddH
实施例4:
本实施例提供本实施例提供一种检测具核梭杆菌的试剂盒,该试剂盒包括如实施例2提供的检测具核梭杆菌的检测第二反应液及酶反应液。还包括粪便样品保存液:EDTA45mM、Tris-HCl 40mM,NaCl 140mM,SDS 0.5%。
试剂盒的使用方法参考如下步骤:
粪便样本收集到粪便样品保存液中,常温或4℃保存2周,-20℃保存6个月;生理盐水洗涤样本一次或两次;取200mg(或200μl)样本加入100-500μl核酸提取液,涡旋振荡充分混匀。100℃水浴10min,13000rpm离心1min,取上清备用。
荧光PCR反应体系为25μl:加入酶反应液12.5μl,第二反应液5μl;模板DNA 0.5μl、以及ddH
PCR反应程序为:第一阶段:95℃预变性2min;第二阶段:95℃10s、60℃30s,同时收集FAM和ROX信号,40个循环。
结果分析:以荧光信号达到设定的阈值所需的循环数Ct作为判断标准,当目的基因与内参基因均呈现S型扩增曲线,表明样本中含有具核梭杆菌,否则不含有具核梭杆菌。同时根据标准曲线,可以计算出单位体积样本中具核梭杆菌的拷贝数,从而定量分析标本中具核梭杆菌的含量。
实施例5:
本实施例提供本实施例提供一种检测具核梭杆菌的试剂盒,该试剂盒包括如实施例2提供的检测具核梭杆菌的检测第二反应液及酶反应液。还包括口腔拭子样品保存液:0.01-1mol/L的EDTA、0.01-3mol/L的Tris-HCl,0.05-0.5mol/L的NaCl,质量分数为0.1%-0.5%的SDS、浓度为0.01-0.5M的柠檬酸钠、10-30%的无水乙醇。
试剂盒的使用方法参考如下步骤:
采集口腔拭子或牙菌斑后置于口腔拭子样本保存液中,涡旋振荡;混悬液13000rpm离心5-10min后,加入50-100μl核酸提取液涡旋震荡充分混匀。100℃金属浴10min,13000rpm离心1min,取上清备用。
本实施例提供的检测试剂盒的PCR反应体系及程序参考实施例4。
实施例6
本实施例提供本实施例提供本实施例提供一种检测具核梭杆菌的试剂盒,该试剂盒包括如实施例2提供的检测具核梭杆菌的第二反应液及酶反应液,样品保存液(包括0.5mol/L的EDTA、1mol/L的Tris-HCl和0.1mol/L的NaCl)以及核酸提取液。
新鲜组织先用生理盐水洗涤一次,切成宽度小于1cm的切片,加入样品保存液:0.1%-50%的无水乙醇,室温下可保存数日,4℃可保存数年。
石蜡包埋组织需加入二甲苯进行脱蜡处理:
1)石蜡切片:(5-10μm厚,1×1cm
2)石蜡块:手术刀刮取约30mg的组织样本(尽量去除多余的石蜡);
3)福尔马林等固定液或上述保存液中的样本:取30mg样本,用手术刀切为数块,置于1.5ml离心管中。
将组织样本装入无菌离心管中,加入PBS,加入二甲苯或者无需加入二甲苯,加入100mg直径0.1-0.2mm的玻璃珠,涡旋振荡混匀,10000rpm离心1min,弃上清。加入PBS涡旋振荡混匀室温离心,弃上清,重复2次。加入100-500μl核酸提取液,涡旋振荡充分混匀。
样本经上述预处理并加入核酸提取液混匀后,100℃水浴或金属浴10min,13000rpm离心1min,取上清备用或-80℃保存。
PCR反应体系及程序参考实施例4。
本发明的试剂盒:
1.PCR反应混合液
PCR反应液各组分与浓度组成如下:Taq DNA聚合酶1.5U,UNG酶0.2U,dUTP0.6μM、dATP、dCTP、dGTP各0.2μM,2mM的Mg
如图3所示:
分别使用不同浓度引物及探针,在保证扩增效率的前提下,建议的PCR反应体系中核酸组合的最优浓度为:Fn上游引物、下游引物、IR上游引物、下游引物分别为0.2μM,Fn探针及IR探针分别为0.1μM。
2.参考品DNA的制备
(1)构建包含具核梭杆菌基因片段的质粒作为标准品:以具核梭杆菌基因序列为模板,由生工生物工程(上海)股份有限公司合成包括SEQ ID NO.7所示的核酸序列,将SEQID NO.7序列连接到pUC57载体,并测序校对。将构建的质粒梯度稀释为浓度分别为4×10
(2)阳性对照包括灭活的具核梭杆菌标准菌株,浓度为10
(3)阴性对照包括非具核梭杆菌样本DNA溶液。
3.性能验证
(1)制备不同浓度参考品:
将上述合成的具核梭杆菌基因片段重组质粒进行定量,配置得到10
(2)反应体系配制具体参见实施例1,每个反应管中加入5μl一种梯度稀释的质粒模版。
(3)荧光实时定量PCR反应与检测具体参见实施例1。
结果判断:
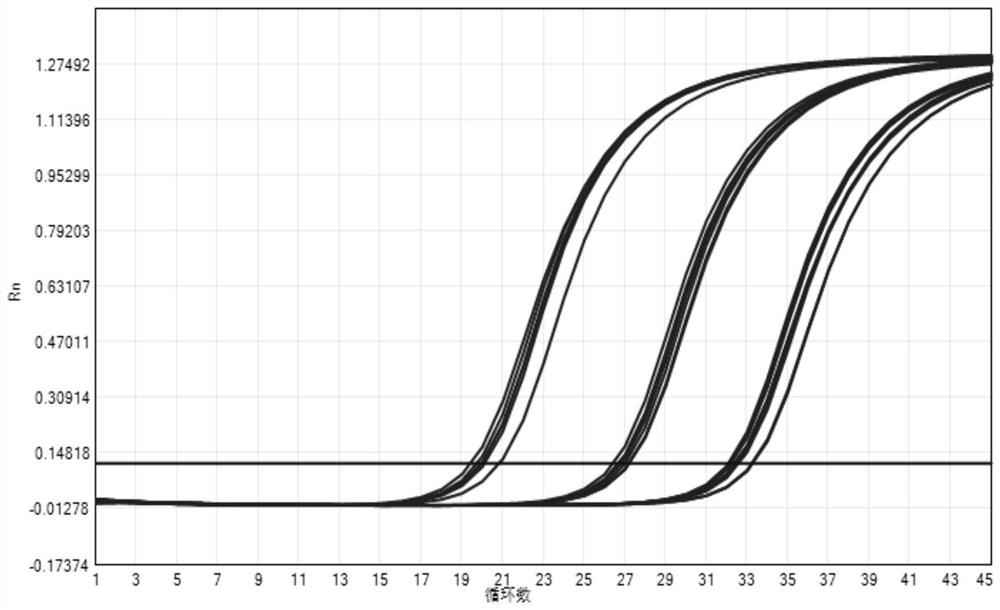
如图1、图2、图3所示:
图1中的曲线分别表示具核梭杆菌质粒按十倍梯度稀释为4×10
如图5及表1所示:
由上述线性关系选取Fn质粒浓度选择4×10
表1精密度、重复性
从上述的实验可以看出本发明提供的核酸组合的引物对和探针特异性很强、灵敏度很高,且对多类型临床样本适用。
综上所述,本发明实施例提供的具核梭杆菌的核酸组合能特异的识别具核梭杆菌的基因序列,快速高效的检测出具核梭杆菌,结果准确可靠;应用该核酸组合并制备具核梭杆菌的检测试剂盒,能方便快捷地帮助检测出样本中的具核梭杆菌,检测结果准确,使用方便,有利于实际应用和推广。
以上显示和描述了本发明的基本原理、主要特征及本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 具核梭杆菌荧光定量检测试剂盒及其制备方法与检测方法
- 一种血清中HBV DNA的实时荧光定量检测试剂盒及其检测方法
