具有改进特异性的修饰的T淋巴细胞
文献发布时间:2023-06-19 11:34:14
1.
本申请为2014年2月6日提交的、发明名称为“具有改进特异性的修饰的T淋巴 细胞”、申请号为201480020004.4的中国发明专利申请的分案申请。
本申请要求2013年2月6日提交的美国专利申请号61/761,548的优先权,其公开内容通过引用以其整体结合到本文中。
2.发明领域
本文的公开内容涉及免疫学领域,更具体地讲,涉及T淋巴细胞或其它免疫细胞的修饰。
3.
免疫系统的细胞例如T淋巴细胞(亦称为T细胞)通过受体或受体复合体识别并与特 定的抗原相互作用,其在识别或与所述抗原相互作用时引起细胞活化。所述受体的实例是抗原特异性T淋巴细胞受体复合体(TCR/CD3),一种8种蛋白质的复合体。T细胞受 体(TCR)在T淋巴细胞的表面上表达。一种成分CD3,其具有不变结构,在TCR被配 体占据后,负责胞内信号转导。抗原-CD3复合体(TCR/CD3)的T淋巴细胞受体识别由 主要组织相容性复合体(MHC)的蛋白质呈递给它的抗原肽。MHC和肽的复合体在抗原 呈递细胞和其它T淋巴细胞靶的表面上表达。刺激TCR/CD3复合体导致T淋巴细胞的 活化和随之发生的抗原特异性免疫应答。TCR/CD3复合体在效应子功能和免疫系统调 节中起重要作用。
T淋巴细胞需要第二协同刺激以变成完全活性的。在没有这种信号的情况下,T淋巴细胞对结合TCR的抗原不起反应,或变得无反应性。这类协同刺激信号由例如CD28 (一种T淋巴细胞蛋白质)提供,其与抗原呈递细胞上的CD80和CD86相互作用。ICOS (可诱导共刺激分子(Inducible COStimulator)),另一种T淋巴细胞蛋白质,当与ICOS配 体结合时提供协同刺激信号。
TCR复合体的必需抗原结合、信号转导和刺激功能通过遗传重组方法被简化为单一 多肽链,通常称为嵌合抗原受体(CAR)。参见例如Eshhar,美国专利号7,741,465;Eshhar, 美国专利申请公布号2012/0093842。携带所述CAR的T淋巴细胞一般称为CAR-T淋巴 细胞。然而,虽然所述CAR有效地使T淋巴细胞靶向特异性肿瘤相关抗原或肿瘤特异 性抗原,并可有效地靶向T淋巴细胞以杀死表达所述抗原的肿瘤细胞,这类设计遇到指 导T淋巴细胞杀死同样表达所述抗原的正常健康细胞的严重副作用。因此,所述CAR-T 淋巴细胞的使用一般限于表达机体中的任何其它细胞都不表达的抗原的肿瘤,这是一种 相对罕见情况。
本文描述了克服现行CAR设计的这个缺点的包含嵌合受体的修饰的T淋巴细胞。
4.
第一个方面,本文提供修饰的淋巴细胞,例如包含至少两种不同的多肽(例如嵌合受体)的修饰的T淋巴细胞,其中来源于第一多肽(例如嵌合受体)与第一抗原结合的免疫信号与由第二多肽(例如嵌合受体)产生的协同刺激信号相分开,且其中协同刺激信号依赖于第二抗原被第二嵌合受体的抗原结合。如本文全文中所用,“第一多肽”表示产生一 级抗原结合免疫信号的多肽,“第二多肽”是产生协同刺激免疫信号的多肽。在某些实施 方案中,使用单个CAR构建体,将两种多肽(例如嵌合受体)导入修饰的T淋巴细胞中, 其中该多肽被允许两个分立的多肽(以基本相等的量)从单一ORF中表达的可切割序列 (T2A或P2A)分隔开。
在一个实施方案中,本文提供含有以下的修饰的T淋巴细胞(CAR-T淋巴细胞):包含结合第一抗原的第一胞外抗原结合结构域和第一胞内信号转导结构域的第一多肽,其中所述第一多肽不含协同刺激结构域;和包含结合第二抗原的第二胞外抗原结合结构域或结合所述第二抗原的受体和第二胞内信号转导结构域的第二多肽;其中只有当所述第一信号转导结构域和所述第二信号转导结构域两者都分别被所述第一抗原和所述第二 抗原激活时,所述修饰的淋巴细胞才变成有最大毒性。在一个具体的实施方案中,在所 述第二抗原不与所述第二结合结构域结合的情况下所述第一抗原与所述第一抗原结合 结构域的结合,或在所述第一抗原不与所述第一结合结构域结合的情况下所述第二抗原 与所述第二抗原结合结构域的结合,诱导所述修饰的T淋巴细胞无反应性,或所述T淋 巴细胞对所述第一抗原或所述第二抗原不起反应。
在另一个具体的实施方案中,所述第一抗原结合结构域和所述第二抗原结合结构域 独立地为受体的抗原结合部分、抗体的抗原结合部分或其它基于肽的大分子抗原结合剂。在某些具体的实施方案中,所述第一抗原结合结构域或所述第二抗原结合结构域的 任一个或两个是scFv抗体片段。在具体的实施方案中,所述第一多肽或所述第二多肽 的任一个或两个另外包含跨膜结构域。在其它具体的实施方案中,所述第一多肽或所述 第二多肽包含T细胞存活基序。在一个具体的实施方案中,T细胞存活基序是CD28 T 细胞存活基序。在其它具体的实施方案中,所述T细胞存活基序是IL-7受体(IL-7R)的 胞内信号转导结构域、IL-12受体的胞内信号转导结构域、IL-15受体的胞内信号转导结 构域、IL-21受体的胞内信号转导结构域或转化生长因子β(TGFβ)受体的胞内信号转导 结构域。在另一个更具体的实施方案中,所述第一多肽或所述第二多肽含有包含T细胞 存活基序的CD28分子的部分。在一个更具体的实施方案中,所述第一多肽或所述第二 多肽含有包含T细胞存活基序的CD28分子。在某些具体的实施方案中,所述第一胞内 信号转导结构域含有包含基于免疫受体酪氨酸活化基序(ITAM)的多肽序列。在一个更具 体的实施方案中,所述多肽序列是CD3ζ信号转导结构域。
在某些具体的实施方案中,所述第一抗原是肿瘤细胞上的抗原。在一个更具体的实 施方案中,所述肿瘤细胞是实体瘤中的细胞。在另一个更具体的实施方案中,所述肿瘤细胞是血癌细胞。在另一个具体的实施方案中,所述抗原是肿瘤相关抗原或肿瘤特异性 抗原。在更具体的实施方案中,所述肿瘤相关抗原或肿瘤特异性抗原是Her2、前列腺干 细胞抗原(PSCA)、PSMA(前列腺特异性膜抗原)、B细胞成熟抗原(BCMA)、甲胎蛋白 (AFP)、癌胚抗原(CEA)、癌抗原-125(CA-125)、CA19-9、钙网膜蛋白、MUC-1、上皮 膜蛋白(EMA)、上皮肿瘤抗原(ETA)、酪氨酸酶、黑素瘤相关抗原(MAGE)、CD34、CD45、 CD99、CD117、嗜铬粒蛋白、细胞角蛋白、结蛋白、胶质细胞原纤维酸性蛋白(GFAP)、 巨囊性病液状蛋白(GCDFP-15)、HMB-45抗原、蛋白质melan-A(T淋巴细胞识别的黑素 瘤抗原;MART-1)、myo-D1、肌特异性肌动蛋白(MSA)、神经丝、神经元特异性烯醇化 酶(NSE)、胎盘碱性磷酸酶、突触泡蛋白、甲状腺球蛋白、甲状腺转录因子-1、二聚体 形式的丙酮酸激酶同工酶M2型(肿瘤M2-PK)、CD19、CD22、CD27、CD30、CD70、GD2(神经节苷脂G2)、EphA2、CSPG4、CD138、FAP(成纤维细胞活化蛋白)、CD171、 kappa、lambda、5T4、α
在另一个具体的实施方案中,所述第一抗原是整联蛋白αvβ3(CD61)、泌乳激素、K-Ras(V-Ki-ras2 Kirsten大鼠肉瘤病毒癌基因)或Ral-B。
在另一个具体的实施方案中,所述第二抗原是生长因子、细胞因子或白介素。在一个具体的实施方案中,第二抗原是与血管生成或血管发生有关的分子,例如生长因子、 细胞因子或白介素。在更具体的实施方案中,所述第二抗原是血管内皮生长因子(VEGF)、 碱性成纤维细胞生长因子(bFGF)、血小板衍生生长因子(PDGF)、肝细胞生长因子(HGF)、 胰岛素样生长因子(IGF)或白介素-8(IL-8)。因此,所述第二抗原结合结构域可以是例如 对VEGF、bFGF、PDGF、HGF、IGF或IL-8有特异性的抗体(或其片段,例如scFv); 或对VEGF、bFGF、PDGF、HGF、IGF或IL-8有特异性的受体。在一个具体的实施方 案中,所述第二抗原结合结构域是VEGF、bFGF、PDGF、HGF、IGF、TGF-β、IL4、 IL-10、IL13或IL-8的受体。在另一个具体的实施方案中,所述第二抗原结合结构域是 VEGF的受体,其中VEGF的所述受体是VEGFR,例如VEGFR1、VEGFR2或VEGFR3。
在另一个具体的实施方案中,所述第二抗原提供的信号转导活化是非特异性的,但 与缺氧有关。在更具体的实施方案中,所述刺激通过激活缺氧诱导因子-1α(HIF-1α)、HIF-1β、HIF-2α、HIF-2β、HIF-3α或HIF-3β来诱导。
在另一个具体的实施方案中,所述第二抗原是白介素。
在另一个具体的实施方案中,所述第二抗原是损伤相关分子模式分子(DAMP;亦称为alarmin)。在更具体的实施方案中,所述DAMP是热激蛋白、染色质相关蛋白高迁移 率组框1(chromatin-associated protein high mobility group box 1,HMGB1)、S100A8(亦称为MRP8或钙粒蛋白A)、S100A9(亦称为MRP14或钙粒蛋白B)、血清淀粉状蛋白A (SAA)、脱氧核糖核酸、腺苷三磷酸、尿酸或硫酸肝素。
在某些具体的实施方案中,所述第二抗原是与由肿瘤细胞呈递的抗原结合的抗体上 的抗原。
在一个具体的实施方案中,本文提供含有以下的修饰的T淋巴细胞(CAR-T淋巴细胞):包含结合第一抗原的第一胞外抗原结合结构域和第一胞内信号转导结构域的第一 多肽,其中所述第一多肽不含协同刺激结构域;和包含结合VEGF的第二胞外抗原结合 结构域和第二胞内信号转导结构域(协同刺激结构域)的第二多肽;其中当所述第一信号 转导结构域和所述第二信号转导结构域两者都分别被所述第一抗原和所述第二抗原激 活时,所述修饰的淋巴细胞才变成有最大毒性。在一个具体的实施方案中,所述第一抗 原是PSCA、PSMA或BCMA。在另一个具体的实施方案中,所述第一胞外抗原结合结 构域包含抗体或其片段(例如scFv),例如对PSCA、PSMA或BCMA有特异性的抗体或 其片段。在另一个具体的实施方案中,结合VEGF的所述抗原结合结构域是VEGF的受 体,即VEGFR。在另一个具体的实施方案中,所述VEGFR是VEGFR1、VEGFR2或 VEGFR3。在另一个具体的实施方案中,所述VEGFR是VEGFR2。
在本文任何实施方案的具体实施方案中,所述第二多肽包含一个或多个协同刺激结 构域。在具体的实施方案中,所述一个或多个协同刺激结构域包含协同刺激性CD27多肽序列、协同刺激性CD28多肽序列、协同刺激性OX40(CD134)多肽序列、协同刺激 性4-1BB(CD137)多肽序列、TILR2、TILR4、TILR7、TILR9、Fc受体γ链、Fc受体ε 链或协同刺激诱导型T细胞协同刺激性(ICOS)多肽序列的一个或多个。
在本文提供的修饰T淋巴细胞的一个具体的实施方案中,所述第一多肽包含胞外肿 瘤抗原结合结构域和CD3ζ信号转导结构域,且其中所述第二多肽包含其中所述抗原是血管生成或血管形成因子的抗原结合结构域和一个或多个协同刺激分子信号转导结构域。所述血管生成因子可以是例如VEGF。所述一个或多个协同刺激分子信号转导基序 可包含例如来自CD27、CD28、OX40、ICOS和4-1BB各自的协同刺激信号转导结构域。 在一个更具体的实施方案中,所述第一多肽包含胞外肿瘤抗原结合结构域和CD3ζ信号 转导结构域,且其中所述第二多肽包含其中所述抗原是VEGF的抗原结合结构域和来自 CD27、CD28、OX40、ICOS和4-1BB各自的协同刺激信号转导结构域。在一个更具体 的实施方案中,所述第一多肽或所述第二多肽包含T细胞存活基序。在更具体的实施方 案中,所述T细胞存活基序是或来源于IL-7受体(IL-7R)的胞内信号转导结构域、IL-12 受体的胞内信号转导结构域、IL-15受体的胞内信号转导结构域、IL-21受体的胞内信号 转导结构域或转化生长因子β(TGFβ)受体的胞内信号转导结构域。因此,在所述修饰T 淋巴细胞的一个更具体的实施方案中,所述第一多肽包含胞外肿瘤抗原结合结构域和 CD3ζ信号转导结构域,且其中所述第二多肽包含其中所述抗原是VEGF(一种IL-7受体 胞内T细胞存活基序)的抗原结合结构域和来自CD27、CD28、OX40、ICOS和4-1BB 各自的协同刺激信号转导结构域。
在修饰的T淋巴细胞的另一个具体实施方案中,所述第一抗原是肿瘤特异性抗原或 肿瘤相关抗原,所述第一胞内信号转导结构域包含CD3ζ信号转导结构域;且其中所述第二多肽包含结合所述第二抗原的抗原结合结构域和来自CD27、CD28、OX40、ICOS 和4-1BB各自的协同刺激信号转导结构域。在一个更具体的实施方案中,所述第二多肽 另外包含是或来源于以下的胞内T细胞存活基序(例如T细胞存活基序):IL-7受体(IL-7R) 的胞内信号转导结构域、IL-12受体的胞内信号转导结构域、IL-15受体的胞内信号转导 结构域、IL-21受体的胞内信号转导结构域或转化生长因子β(TGFβ)受体的胞内信号转 导结构域的。
在本文提供的修饰T淋巴细胞的任一个的具体实施方案中,所述第二抗原是VEGF或IL-4。
在某些实施方案中,仅所述第一抗原结合结构域或所述第二抗原结合结构域与肿瘤 相关抗原或肿瘤特异性抗原结合,所述第一抗原结合结构域或所述第二抗原结合结构域 的另一个与不是肿瘤特异性抗原或肿瘤相关抗原的抗原结合。在这类实施方案中,仅第一或第二刺激信号之一由肿瘤特异性抗原或肿瘤相关抗原产生;第一或第二刺激信号的另一个由其它类型的抗原(例如与肿瘤环境相关的抗原(例如蛋白质或其它生物分子))产生。
在某些实施方案中,本文还提供包含第一和第二多肽和一个或多个其它多肽(例如 一个或多个包含抗原结合结构域和信号转导结构域的其它多肽)的修饰的T淋巴细胞。在具体的实施方案中,仅所述多肽之一(例如仅所述第一多肽、所述第二多肽或所述一 个或多个其它多肽之一)包含与肿瘤相关抗原或肿瘤特异性抗原结合的抗原结合结构 域;剩余的所述多肽的每一个包含与不是肿瘤相关抗原或肿瘤特异性抗原的抗原结合的 抗原结合结构域。在其它具体的实施方案中,所述第一多肽、所述第二多肽和所述一个 或多个其它多肽的两个或更多个包含与一种或多种肿瘤相关抗原或肿瘤特异性抗原结 合的抗原结合结构域,其中所述多肽的至少一个包含不与肿瘤相关抗原或肿瘤特异性抗 原结合的抗原结合结构域。
另一方面,本文提供修饰的T淋巴细胞,其含有包含结合第一抗原的第一胞外抗原结合结构域和第一胞内信号转导结构域的第一多肽;和包含结合第二抗原的第二胞外抗原结合结构域或结合所述第二抗原的受体和第二胞内信号转导结构域的第二多肽,其中所述第二多肽不含协同刺激结构域;其中只有当所述第一信号转导结构域和所述第二信号转导结构域两者都分别被所述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才变成有最大毒性。在一个具体的实施方案中,在所述第二抗原不与所述第二结合结构 域结合的情况下所述第一抗原与所述第一抗原结合结构域的结合,或在所述第一抗原不 与所述第一结合结构域结合的情况下所述第二抗原与所述第二抗原结合结构域的结合 诱导所述修饰的T淋巴细胞无反应性,或所述修饰的T淋巴细胞对所述第一抗原不起反 应。在一个具体的实施方案中,所述第一抗原结合结构域和所述抗原结合结构域独立地 为受体的抗原结合部分或抗体的抗原结合部分。在另一个具体的实施方案中,所述第一 抗原结合结构域或所述第二抗原结合结构域的任一个或两个是scFv抗体片段。在具体 的实施方案中,所述第一多肽和/或所述第二多肽还包含跨膜结构域。在一个更具体的实 施方案中,所述第一多肽或所述第二多肽包含T细胞存活基序,例如本文所述T细胞存 活基序的任一种。
在另一个具体的实施方案中,所述第一抗原是肿瘤细胞(例如实体瘤中的细胞或血 癌细胞)上的抗原。在一个具体的实施方案中,所述第一抗原是肿瘤相关抗原或肿瘤特异性抗原,例如Her2、前列腺干细胞抗原(PSCA)、PSMA(前列腺特异性膜抗原)、B细 胞成熟抗原(BCMA)、甲胎蛋白(AFP)、癌胚抗原(CEA)、癌抗原-125(CA-125)、CA19-9、 钙网膜蛋白、MUC-1、上皮膜蛋白(EMA)、上皮肿瘤抗原(ETA)、酪氨酸酶、黑素瘤相 关抗原(MAGE)、CD34、CD45、CD99、CD117、嗜铬粒蛋白、细胞角蛋白、结蛋白、 胶质细胞原纤维酸性蛋白(GFAP)、巨囊性病液状蛋白(GCDFP-15)、HMB-45抗原、蛋 白质melan-A(T淋巴细胞识别的黑素瘤抗原;MART-1)、myo-D1、肌特异性肌动蛋白 (MSA)、神经丝、神经元特异性烯醇化酶(NSE)、胎盘碱性磷酸酶、突触泡蛋白、甲状 腺球蛋白、甲状腺转录因子-1、二聚体形式的丙酮酸激酶同工酶M2型(肿瘤M2-PK)、 异常ras蛋白或异常p53蛋白。在某些实施方案中,肿瘤相关抗原是CD19、CD22、CD27、 CD30、CD70、GD2(神经节苷脂G2)、EGFRvIII(表皮生长因子变体III)、精液蛋白17 (Sp17)、mesothelin、PAP(前列腺酸性磷酸酶)、prostein、TARP(T细胞受体γ另起读框 蛋白)、Trp-p8或STEAP1(前列腺六跨膜上皮抗原1)。
在另一个具体的实施方案中,所述第一抗原是整联蛋白αvβ3(CD61)、泌乳激素、K-Ras(V-Ki-ras2 Kirsten大鼠肉瘤病毒癌基因)或Ral-B。
在某些具体的实施方案中,所述第二胞内信号转导结构域含有包含基于免疫受体酪 氨酸活化基序(ITAM)的多肽序列,例如CD3ζ信号转导结构域。在一个具体的实施方案中,所述第二抗原是生长因子、细胞因子或白介素。在另一个具体的实施方案中,所述 第二抗原是与血管生成或血管发生有关的生长因子、细胞因子或白介素,例如VEGF、 bFGF、PDGF、HGF、IGF或IL-8。在其它更具体的实施方案中,因所述第二嵌合受体 引起的信号转导通过激活例如HIF-1α、HIF-1β、HIF-2α、HIF-2β、HIF-3α或HIF-3β等 缺氧相关因子来诱导。在其它具体的实施方案中,所述第二抗原是白介素。在其它具体 的实施方案中,所述第二抗原是DAMP,例如热激蛋白、HMGB1、S100A8、S100A9、 SAA、DNA、ATP、尿酸或硫酸肝素。在其它具体的实施方案中,所述第二抗原是所给 予的肽,例如抗体或合成多肽。在其它具体的实施方案中,所述第二抗原是与由肿瘤细 胞呈递的抗原结合的抗体上的抗原。在某些具体的实施方案中,所述第一多肽和/或所述 第二多肽包含一个或多个协同刺激结构域,例如协同刺激性CD27多肽序列、协同刺激 性CD28多肽序列、协同刺激性OX40(CD134)多肽序列、协同刺激性4-1BB(CD137) 多肽序列、TILR2、TILR4、TILR7、TILR9、Fc受体γ链、Fc受体ε链或协同刺激诱导 型T细胞协同刺激性(ICOS)多肽序列的一个或多个。在上述实施方案的任一个中,在一 个具体的实施方案中,所述第一多肽或所述第二多肽包含T细胞存活基序,例如所述T 细胞存活基序是或来源于IL-7受体(IL-7R)的胞内信号转导结构域、IL-12受体的胞内信 号转导结构域、IL-15受体的胞内信号转导结构域、IL-21受体的胞内信号转导结构域或 转化生长因子β(TGFβ)受体的胞内信号转导结构域。
另一方面,本文提供治疗患有疾病或病症的个体的方法,其中所述疾病或病症的特 征在于或可在于第一抗原,并与第二抗原有关。在一个实施方案中,所述第一抗原是肿瘤相关抗原或肿瘤特异性抗原。
3.1附图简述
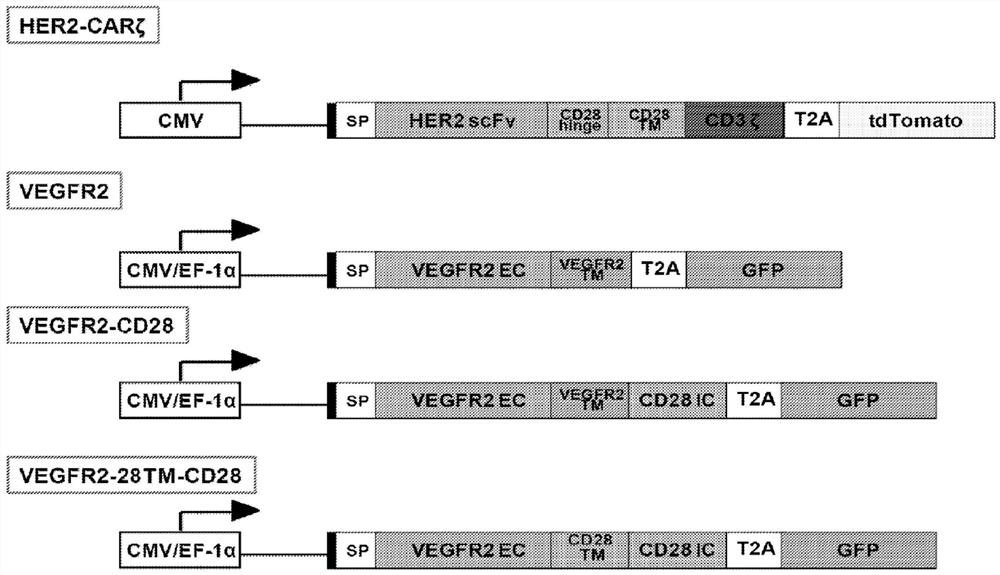
图1:4种CAR的图示。SP:信号肽;EC:胞外;TM:跨膜;IC:胞内。
图2:4种CAR的图示。SP:信号肽;EC:胞外;TM:跨膜;IC:胞内。
5.
本文提供被导向显示所需抗原的细胞,且与现有基于T淋巴细胞的疗法相比对所述 细胞有更大特异性的遗传修饰的免疫系统细胞,例如T淋巴细胞(T lymphocytes)。一般来讲,对现有修饰的T淋巴细胞进行修饰以表达称为嵌合抗原受体即CAR的多肽。参 见例如Eshhar,美国专利号7,741,465。表达CAR的T淋巴细胞称为CAR-T淋巴细胞。 CAR的一般结构包含包括胞外部分和胞内部分的单一多肽链;任选加入跨膜部分以将 CAR锚在T淋巴细胞的细胞膜中。胞外部分包括能够结合目标抗原(例如细胞上的抗原, 例如肿瘤特异性抗原或肿瘤相关抗原)的结构域或基序。胞内部分包括能够转导在响应 抗原与CAR的胞外部分结合时激活T淋巴细胞所必需的第一抗原结合信号的结构域或 基序。通常,该结构域或基序包含或是ITAM(基于免疫受体酪氨酸的活化基序)。适于 CAR的含ITAM的多肽包括例如ζCD3链(CD3ζ)或其含ITAM的部分。鉴于对于完全激 活,T淋巴细胞需要第二协同刺激信号,因此在最近反复的CAR设计中,胞内部分另 外包含一个或多个协同刺激基序,通常为CD27、CD28或CD137(4-1BB)的协同刺激部 分。这类设计允许表达CAR的T淋巴细胞在目标抗原与CAR的胞外结构域结合时变得 被完全激活,使得CAR-T淋巴细胞能够杀死携带抗原的细胞。
虽然这类修饰的T淋巴细胞在杀死携带特定抗原的有害细胞时可能是高度有效的, 但是在杀死表达低但可检出量的所述抗原的正常细胞时也有效。修饰T淋巴细胞的这类 肿瘤外活性可能导致对接受者的正常组织的严重损害,甚至死亡。例如,给予导向过表达ERBB2的肿瘤的10
然而,可通过将一级抗原结合信号转导与协同刺激分隔来降低或消除通过CAR介导的这种肿瘤外作用,使得仅抗原结合不足以激活修饰的T淋巴细胞,例如,其中可预 期一级信号和二级信号两者在携带肿瘤的而非正常的组织内是特别明显的。本文公开的 这种分隔通过使用经修饰表达协同刺激多肽(例如嵌合受体),或经修饰以表达两种或更 多种人工多肽(例如嵌合受体)的T淋巴细胞来实现,所述多肽的至少一种包含一级抗原 结合信号转导结构域且也不含协同刺激基序,而且所述多肽的至少一种包含协同刺激结 构域或基序,但不含一级抗原结合信号转导结构域,其中两种或更多种嵌合受体不与相 同的抗原结合。除一级信号转导多肽(不论天然TCR还是人工多肽)以外的非结合的协同 刺激多肽导致修饰的T淋巴细胞不起反应、无反应性或细胞凋亡。
5.1.
5.1.1.
在某些实施方案中,本文提供包含单一人工协同刺激多肽(例如嵌合受体)的修饰T 淋巴细胞,其在响应特定抗原时提供协同刺激信号;然而,一级抗原结合信号通过天然 T细胞受体蛋白转导。这种单一多肽包含例如与第一抗原结合的抗原结合结构域和一个 或多个协同刺激结构域,但缺乏产生一级抗原结合信号的结构域,例如ITAM或CD3ζ。 这种配置中的修饰的T细胞,依赖于天然T细胞受体和用于一级抗原结合信号转导的 CD3ζ信号转导蛋白。协同刺激多肽提供提高T淋巴细胞对特定抗原的应答的协同刺激 信号。在某些实施方案中,T细胞天然地识别第一抗原例如肿瘤特异性抗原(TSA)或肿 瘤相关抗原(TAA)和人工多肽(例如嵌合受体),协同刺激多肽的抗原结合结构域还结合 所述第一抗原。在其它实施方案中,T细胞天然地识别第一抗原例如肿瘤特异性抗原 (TSA)或肿瘤相关抗原(TAA)和人工多肽(例如嵌合受体),协同刺激多肽的抗原结合结构 域结合第二不同的抗原,例如不同的TSA或TAA。在其它实施方案中,T细胞天然地 识别第一抗原例如肿瘤特异性抗原(TSA)或肿瘤相关抗原(TAA)和人工多肽(例如嵌合受 体),协同刺激多肽的抗原结合结构域结合不是TSA或TAA的第二抗原。
人工多肽(例如嵌合受体)的抗原结合部分可以是与抗原结合的任何多肽结构域,基 序或序列。在某些实施方案中,抗原结合结构域是受体的抗原结合部分或抗体的抗原结合部分。例如,抗原结合结构域可以是受体或其抗原结合部分,例如由肿瘤细胞产生的 配体的受体、抗体、抗体链或其抗原结合部分、Fc结构域、糖磷脂酰肌醇锚定结构域等。 因此,在某些实施方案中,抗原结合结构域是scFv抗体片段。在某些其它的实施方案 中,抗原结合结构域是另一种形式的基于肽的大分子抗原结合剂,例如噬菌体展示蛋白 质。在某些其它的实施方案中,抗原结合结构域不直接结合抗原,但与结合抗原的修饰 蛋白质结合。例如,在一个具体的实施方案中,抗原结合结构域包含配体,例如与配体 结合的生物素,例如抗原结合多肽或大分子上的抗生物素蛋白。在不同的实施方案中, 通过抗原结合结构域的抗原结合可限于与主要组织相容性复合体(MHC)相关的抗原呈 递,或可以是无MHC限制的。
在某些实施方案中,人工多肽(嵌合受体)内的一个或多个协同刺激结构域包含协同 刺激性CD27多肽序列、协同刺激性CD28多肽序列、协同刺激性OX40(CD134)多肽序 列、协同刺激性4-1BB(CD137)多肽序列或协同刺激诱导型T细胞协同刺激性(ICOS)多 肽序列的一个或多个。
第一抗原可以是任何目标抗原,例如在细胞表面表达的抗原。在优选的实施方案中, 所述第一抗原是肿瘤细胞上的抗原,例如TAA或TSA。肿瘤细胞可以是例如实体瘤或 血癌的细胞。在某些具体的实施方案中,所述抗原是肿瘤相关抗原或肿瘤特异性抗原, 例如Her2、前列腺干细胞抗原(PSCA)、PSMA(前列腺特异性膜抗原)、B细胞成熟抗原 (BCMA)、ERK5、甲胎蛋白(AFP)、癌胚抗原(CEA)、癌抗原-125(CA-125)、CA19-9、 钙网膜蛋白、MUC-1、上皮膜蛋白(EMA)、上皮肿瘤抗原(ETA)、酪氨酸酶、黑素瘤相 关抗原(MAGE)、CD34、CD45、CD99、CD117、嗜铬粒蛋白、细胞角蛋白、结蛋白、 胶质细胞原纤维酸性蛋白(GFAP)、巨囊性病液状蛋白(GCDFP-15)、HMB-45抗原、蛋 白质melan-A(T淋巴细胞识别的黑素瘤抗原;MART-1)、myo-D1、肌特异性肌动蛋白 (MSA)、神经丝、神经元特异性烯醇化酶(NSE)、胎盘碱性磷酸酶、突触泡蛋白、甲状 腺球蛋白、甲状腺转录因子-1、二聚体形式的丙酮酸激酶同工酶M2型(肿瘤M2-PK)、 异常ras蛋白、或异常p53蛋白。在某些实施方案中、肿瘤相关抗原是CD19、CD22、 CD27、CD30、CD70、GD2(神经节苷脂G2)、EGFRvIII(表皮生长因子变体III)、精液 蛋白17(Sp17)、mesothelin、PAP(前列腺酸性磷酸酶)、prostein、TARP(T细胞受体γ 另起读框蛋白)、Trp-p8或STEAP1(前列腺六跨膜上皮抗原1)。
在某些实施方案中,TAA或TSA是癌症/睾丸(CT)抗原,例如BAGE、CAGE、 CTAGE、FATE、GAGE、HCA661、HOM-TES-85、MAGEA、MAGEB、MAGEC、NA88、 NY-ESO-1、NY-SAR-35、OY-TES-1、SPANXB1、SPA17、SSX、SYCP1或TPTE。
在某些其它的实施方案中,TAA或TSA是糖或神经节苷脂,例如fuc-GM1、GM2(肿 瘤胚胎抗原免疫原性-1;OFA-I-1);GD2(OFA-I-2)、GM3、GD3等。
在某些其它的实施方案中,TAA或TSA是α-辅肌动蛋白-4、Bage-1、BCR-ABL、 Bcr-Abl融合蛋白、β-联蛋白、CA 125、CA 15-3(CA 27.29\BCAA)、CA 195、CA 242、 CA-50、CAM43、Casp-8、cdc27、cdk4、cdkn2a、CEA、coa-1、dek-can融合蛋白、EBNA、 EF2、EB病毒抗原、ETV6-AML1融合蛋白、HLA-A2、HLA-A11、hsp70-2、KIAAO205、 Mart2、Mum-1、2和3、neo-PAP、肌球蛋白I类、OS-9、pml-RARα融合蛋白、PTPRK、 K-ras、N-ras、磷酸丙糖异构酶、Gage3,4,5,6,7、GnTV、Herv-K-mel、Lage-1、NA-88、 NY-Eso-1/Lage-2、SP17、SSX-2、TRP2-Int2、gp100(Pmel 17)、酪氨酸酶、TRP-1、TRP-2、 MAGE-1、MAGE-3、RAGE、GAGE-1、GAGE-2、p15(58)、RAGE、SCP-1、Hom/Mel-40、 PRAME、p53、H-Ras、HER-2/neu、E2A-PRL、H4-RET、IGH-IGK、MYL-RAR、人乳 头瘤病毒(HPV)抗原E6和E7、TSP-180、MAGE-4、MAGE-5、MAGE-6、p185erbB2、p180erbB-3、c-met、nm-23H1、PSA、TAG-72-4、CA 19-9、CA 72-4、CAM 17.1、NuMa、 K-ras、13-联蛋白、Mum-1、p16、TAGE、PSMA(前列腺特异性膜抗原)、B细胞成熟抗 原(BCMA)、CT7、端粒酶、43-9F、5T4、791Tgp72、13HCG、BCA225、BTAA、CD68\KP1、 CO-029、FGF-5、G250、Ga733(EpCAM)、HTgp-175、M344、MA-50、MG7-Ag、MOV18、 NB\70K、NY-CO-1、RCAS1、SDCCAG16、TA-90、TAAL6、TAG72、TLP或TPS。
在另一个具体的实施方案中,所述第一抗原是整联蛋白αvβ3(CD61)、泌乳激素、K-Ras(V-Ki-ras2 Kirsten大鼠肉瘤病毒癌基因)或Ral-B。
其它肿瘤相关抗原和肿瘤特异性抗原是本领域技术人员已知的,可被本文提供的修 饰的T淋巴细胞靶向。
在其中被人工多肽的抗原结合结构域结合的第二抗原不是TSA或TAA的某些实施方案中,抗原可以是例如生长因子、细胞因子或白介素,例如与血管生成或血管发生有 关的生长因子、细胞因子或白介素。这类生长因子、细胞因子或白介素可包括例如血管 内皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)、血小板衍生生长因子(PDGF)、 肝细胞生长因子(HGF)、胰岛素样生长因子(IGF)或白介素-8(IL-8)。
肿瘤还可在肿瘤局部造成缺氧环境。因此,在其它更具体的实施方案中,由所述人工多肽(例如嵌合受体)的信号转导通过激活例如HIF-1α、HIF-1β、HIF-2α、HIF-2β、HIF-3α或HIF-3β等缺氧相关因子来诱导,或另通过缺氧应答元件活化来诱导。
肿瘤还可对正常组织造成局部损害,引起称为损伤相关分子模式分子(DAMP;亦称为alarmin)的分子释放。在某些实施方案中,第二抗原是DAMP,例如热激蛋白、染色 质相关蛋白高迁移率组框1(HMGB1)、S100A8(MRP8、钙粒蛋白A)、S100A9(MRP14、 钙粒蛋白B)、血清淀粉状蛋白A(SAA)、脱氧核糖核酸、腺苷三磷酸、尿酸或硫酸肝素。
5.1.2.
一方面,本文提供修饰的T淋巴细胞,其含有包含结合第一抗原的第一胞外抗原结合结构域和第一胞内信号转导结构域的第一多肽,其中所述第一多肽不含协同刺激结构域;和包含结合第二抗原的第二胞外抗原结合结构域或结合所述第二抗原的受体和第二胞内信号转导结构域的第二多肽;其中只有当所述第一信号转导结构域和所述第二信号转导结构域两者都分别被所述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才变成有最大毒性。通常,两种多肽两者均为嵌合受体。在所述第二抗原不与所述第二结 合结构域结合的情况下所述第一抗原与所述第一抗原结合结构域的结合,或在所述第一 抗原不与所述第一结合结构域结合的情况下所述第二抗原与所述第二抗原结合结构域 的结合诱导所述修饰的T淋巴细胞无反应性,或赋予修饰的T淋巴细胞对仅第一抗原与 第一抗原结合结构域的结合不起反应。
第一多肽和第二多肽的抗原结合部分可独立地为与抗原结合的任何多肽结构域、基 序或序列。所述第一抗原结合结构域和所述第二抗原结合结构域独立地为受体的抗原结 合部分或抗体的抗原结合部分。例如,第一和第二抗原结合结构域可以是受体或其抗原结合部分,例如由肿瘤细胞产生的配体的受体、抗体、抗体链或其抗原结合部分、Fc 结构域、糖磷脂酰肌醇锚定结构域等。在某些实施方案中,因此,所述第一抗原结合结 构域或所述第二抗原结合结构域的任一个或两个是scFv抗体片段。在某些其它的实施 方案中,第一和第二抗原结合结构域可以是基于肽的大分子抗原结合剂的另一种形式, 例如噬菌体展示蛋白质。在不同的实施方案中,通过抗原结合结构域的抗原结合可限于 与主要组织相容性复合体(MHC)有关的抗原呈递,或可以是无MHC限制的。
除胞外和胞内部分以外,所述第一多肽和/或所述第二多肽优选另外包含跨膜结构 域。跨膜结构域可获自或来源于任何跨膜蛋白质的跨膜结构域,并可包括所述跨膜结构域的所有或部分。在具体的实施方案中,跨膜结构域可获自或来源于例如CD16、细胞 因子受体和白介素受体或生长因子受体等。
所述第一多肽或所述第二多肽还可包含T细胞存活基序。T细胞存活基序可以是在被抗原刺激后促进T淋巴细胞的存活的任何多肽序列或基序。在某些实施方案中,T细 胞存活基序是或来源于CD3、CD28、IL-7受体(IL-7R)的胞内信号转导结构域、IL-12 受体的胞内信号转导结构域、IL-15受体的胞内信号转导结构域、IL-21受体的胞内信号 转导结构域或转化生长因子β(TGFβ)受体的胞内信号转导结构域。
第一多肽的第一胞内信号转导结构域可以是例如能够以类似于天然T淋巴细胞受体的CD3ζ(CD3 zeta)链的方式转导来自第一多肽的第一抗原结合结构域的抗原结合信 号的任何多肽。在某些实施方案中,第一胞内信号转导结构域含有包含基于免疫受体酪 氨酸活化基序(ITAM)的多肽序列。优选多肽序列是CD3ζ信号转导结构域或其信号转导 变体。
第二多肽包含一个或多个协同刺激结构域,当第二抗原与第二多肽的第二抗原结合 结构域结合时能够使第二多肽提供协同刺激。可以使用任何协同刺激基序或其功能部分。在某些具体的实施方案中,一个或多个协同刺激结构域包含协同刺激性CD27多肽 序列、协同刺激性CD28多肽序列、协同刺激性OX40(CD134)多肽序列、协同刺激性 4-1BB(CD137)多肽序列或协同刺激诱导型T细胞协同刺激性(ICOS)多肽序列的一个或 多个。
第一抗原可以是任何目标抗原,例如在细胞表面表达的抗原。在优选的实施方案中, 所述第一抗原是肿瘤细胞上的抗原,例如TSA或TAA,例如上文第5.1节公开的TSA 或TAA的任一个。肿瘤细胞可以是例如实体瘤或血癌的细胞。
抗原可以是任何肿瘤或癌症类型(例如以下)的细胞上表达的任何抗原:例如淋巴瘤、 肺癌、乳腺癌、前列腺癌、肾上腺皮质癌、甲状腺癌、鼻咽癌、黑素瘤(例如恶性黑素瘤)、皮肤癌、结肠直肠癌、硬纤维瘤、促结缔组织增生性小圆细胞肿瘤、内分泌肿瘤、 尤因肉瘤、外周性原始神经外胚层肿瘤、实体生殖细胞肿瘤、肝胚细胞瘤、成神经细胞 瘤、非横纹肌肉瘤软组织肉瘤、骨肉瘤、成视网膜细胞瘤、横纹肌肉瘤、维尔姆斯瘤、 成胶质细胞瘤、粘液瘤、纤维瘤、脂肪瘤等。在更具体的实施方案中,所述淋巴瘤可以 是慢性淋巴细胞白血病(小淋巴细胞性淋巴瘤)、B细胞幼淋巴细胞白血病、淋巴浆细胞 性淋巴瘤、瓦尔登斯特伦巨球蛋白血症、脾边缘区淋巴瘤、浆细胞骨髓瘤、浆细胞瘤、 结外边缘区B细胞淋巴瘤、MALT淋巴瘤、结节边缘区B细胞淋巴瘤、滤泡性淋巴瘤、 套细胞淋巴瘤、弥散性大B细胞淋巴瘤、纵膈(胸腺)大B细胞淋巴瘤、血管内大B细胞 淋巴瘤、原发性渗出性淋巴瘤、伯基特淋巴瘤、T淋巴细胞幼淋巴细胞白血病、T淋巴 细胞大颗粒淋巴细胞白血病、侵袭性NK细胞白血病、成人T淋巴细胞白血病/淋巴瘤、 结外NK/T淋巴细胞淋巴瘤(鼻型)、肠病型T淋巴细胞淋巴瘤、肝脾T淋巴细胞淋巴瘤、 母细胞性NK细胞淋巴瘤、蕈样肉芽肿病、塞扎里综合征、原发性皮肤间变性大细胞淋 巴瘤、淋巴瘤样丘疹病、血管免疫母细胞性T淋巴细胞淋巴瘤、外周T淋巴细胞淋巴瘤 (未分类)、间变性大细胞淋巴瘤、霍奇金淋巴瘤或非霍奇金淋巴瘤。
第二抗原可以是不同于第一抗原但优选与第一抗原有关的任何抗原。例如,第一和 第二抗原两者可以是存在于肿瘤细胞类型上的肿瘤相关抗原或肿瘤特异性抗原。优选第 一抗原是肿瘤相关抗原或肿瘤特异性抗原,所述第二抗原不是肿瘤相关抗原或肿瘤特异 性抗原。在这类实施方案中,第二抗原在某些实施方案中与肿瘤的方面(例如肿瘤环境)有关。例如,肿瘤可在肿瘤周围的组织中诱导炎性状态,并可将促进血管生成的血管生 成生长因子、白介素和/或细胞因子释放进入肿瘤和释放在肿瘤周围。因此,在具体的实 施方案中,第二抗原是生长因子、细胞因子或白介素,例如与血管生成或血管发生有关 的生长因子、细胞因子或白介素。这类生长因子、细胞因子或白介素可包括例如血管内 皮生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)、血小板衍生生长因子(PDGF)、 肝细胞生长因子(HGF)、胰岛素样生长因子(IGF)或白介素-8(IL-8)。
肿瘤还可造成肿瘤局部的缺氧环境。因此,在其它更具体的实施方案中,因所述第二嵌合受体引起的信号转导通过激活例如HIF-1α、HIF-1β、HIF-2α、HIF-2β、HIF-3α 或HIF-3β等缺氧相关因子来诱导,或另通过缺氧应答元件活化来诱导。
肿瘤还可对正常组织造成局部损害,引起称为损伤相关分子模式分子(DAMP;亦称为alarmin)的分子释放。在某些实施方案中,第二抗原是DAMP,例如热激蛋白、染色 质相关蛋白高迁移率组框1(HMGB1)、S100A8(MRP8、钙粒蛋白A)、S100A9(MRP14、 钙粒蛋白B)、血清淀粉状蛋白A(SAA)、脱氧核糖核酸、腺苷三磷酸、尿酸或硫酸肝素。
可能将嵌合受体(例如第二嵌合受体多肽)导向对于抗原或周围组织不是天然的抗 原。例如,可使肿瘤细胞或周围正常组织的细胞与结合细胞上的至少一种抗原的抗体接触。在这种情况下,抗体自身上的任何抗原可与第二嵌合受体多肽的第二抗原结合部分 结合。在某些实施方案中,与第一多肽的第一抗原结合部分结合的第一抗原是与由肿瘤 细胞呈递的抗原结合的抗体上的抗原。在某些实施方案中,与第二多肽的第二抗原结合 部分结合的第二抗原是与由肿瘤细胞呈递的抗原结合的抗体上的抗原。在某些实施方案 中,第一抗原是第一抗体上的抗原,第二抗原是第二抗体上的抗原。在这类实施方案中, 第一抗体可以是与例如肿瘤相关抗原或肿瘤特异性抗原结合的抗体,第二抗体是细胞因 子、白介素、生长因子、DAMP或其它与肿瘤相关的非TAA、非TSA蛋白的抗体。
5.1.3.
因此,在一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和胞内CD3ζ信号转导结构域的第一多肽;和b)包含结合血 管生成或血管形成因子的胞外抗原结合结构域和第二胞内信号转导结构域的第二多肽, 其中所述第一多肽不含协同刺激结构域;其中只有当所述第一信号转导结构域和所述第 二信号转导结构域两者都分别被所述第一抗原和所述第二抗原激活时,所述修饰的淋巴 细胞才变成有最大毒性。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的scFv 或其抗原结合部分和胞内CD3ζ信号转导结构域的第一多肽,其中所述第一多肽不含协 同刺激结构域;和b)包含结合血管生成或血管形成因子的胞外抗原结合结构域和第二胞 内信号转导结构域的第二多肽;其中只有当所述第一信号转导结构域和所述第二信号转 导结构域两者都分别被所述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才变 成有最大毒性。
在一种更具体的配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的胞外抗原结合结构域和胞内CD3ζ信号转导结构域的第一多肽,其中所述第一抗原 是肿瘤相关抗原(TAA)或肿瘤特异性抗原(TSA),其中所述第一多肽不含协同刺激结构 域;和b)包含结合第二抗原的第二胞外抗原结合结构域和第二胞内信号转导结构域的第 二多肽,其中所述第二抗原是VEGF、bFGF、PDGF、HGF、IGF或IL-8;其中只有当 所述第一信号转导结构域和所述第二信号转导结构域两者都分别被所述第一抗原和所 述第二抗原激活时,所述修饰的淋巴细胞才变成有最大毒性。
在另一种更具体的配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和第一胞内CD3ζ信号转导结构域的第一多肽,其中所 述第一抗原是TAA或TSA,其中所述第一多肽不含协同刺激结构域;和b)包含结合第 二抗原的第二胞外抗原结合结构域和第二胞内信号转导结构域的第二多肽,其中所述第 二抗原是VEGF、bFGF、PDGF、HGF、IGF或IL-8,所述第二胞内信号转导结构域包 含来自CD27、CD28、OX40、ICOS和4-1BB的一种或多种的协同刺激信号转导结构域; 其中只有当所述第一信号转导结构域和所述第二信号转导结构域两者都分别被所述第 一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才变成有最大毒性。
在另一种更具体的配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的胞外抗原结合结构域和胞内CD3ζ信号转导结构域的第一多肽,其中所述第一抗 原是Her2、PSCA、PSMA、BCMA、ERK5、AFP、CEA、CA-125、CA19-9、钙网膜蛋 白、MUC-1、EMA、ETA、酪氨酸酶、MAGE、CD34、CD45、CD99、CD117、嗜铬粒 蛋白、细胞角蛋白、结蛋白、GFAP、GCDFP-15、HMB-45抗原、MART-1、myo-D1、 MSA、神经丝、NSE、胎盘碱性磷酸酶、突触泡蛋白、甲状腺球蛋白、甲状腺转录因子 -1、肿瘤M2-PK、CD19、CD22、CD27、CD30、CD70、GD2(神经节苷脂G2)、EGFRvIII (表皮生长因子变体III)、精液蛋白17(Sp17)、mesothelin、PAP(前列腺酸性磷酸酶)、 prostein、TARP(T细胞受体γ另起读框蛋白)、Trp-p8、STEAP1(前列腺六跨膜上皮抗原1)、异常ras蛋白或异常p53蛋白;其中所述第一多肽不含协同刺激结构域;和b)包 含结合第二抗原的胞外抗原结合结构域和包含来自CD27、CD28、OX40、ICOS和4-1BB 的一种或多种的协同刺激信号转导结构域的第二胞内信号转导结构域的第二多肽,其中 所述第二抗原是VEGF、bFGF、PDGF、HGF、IGF或IL-8;其中只有当所述第一信号 转导结构域和所述第二信号转导结构域两者都分别被所述第一抗原和所述第二抗原激 活时,所述修饰的淋巴细胞才变成有最大毒性。
在另一种更具体的配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的胞外抗原结合结构域和胞内CD3ζ信号转导结构域的第一多肽,其中所述第一抗 原是Her2、PSCA、PSMA、BCMA、ERK5、AFP、CEA、CA-125、CA19-9、钙网膜蛋 白、MUC-1、EMA、ETA、酪氨酸酶、MAGE、CD34、CD45、CD99、CD117、嗜铬粒 蛋白、细胞角蛋白、结蛋白、GFAP、GCDFP-15、HMB-45抗原、MART-1、myo-D1、 MSA、神经丝、NSE、胎盘碱性磷酸酶、突触泡蛋白、甲状腺球蛋白、甲状腺转录因子 -1、肿瘤M2-PK、CD19、CD22、CD27、CD30、CD70、GD2(神经节苷脂G2)、EGFRvIII (表皮生长因子变体III)、精液蛋白17(Sp17)、mesothelin、PAP(前列腺酸性磷酸酶)、prostein、TARP(T细胞受体γ另起读框蛋白)、Trp-p8、STEAP1(前列腺六跨膜上皮抗原1)、异常ras蛋白或异常p53蛋白,其中所述第一多肽不含协同刺激结构域;和b)包 含结合第二抗原的第二胞外抗原结合结构域和包含来自CD27、CD28、OX40、ICOS和 4-1BB每个的协同刺激信号转导结构域的胞内信号转导结构域的第二多肽,其中所述第 二抗原是VEGF、bFGF、PDGF、HGF、IGF或IL-8;其中只有当所述第一信号转导结 构域和所述第二信号转导结构域两者都分别被所述第一抗原和所述第二抗原激活时,所 述修饰的淋巴细胞才变成有最大毒性。
在另一种更具体的配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的scFv或其抗原结合部分和胞内CD3ζ信号转导结构域的第一多肽,其中所述第一 抗原是Her2、PSCA、PSMA、BCMA、ERK5、AFP、CEA、CA-125、CA19-9、钙网膜 蛋白、MUC-1、EMA、ETA、酪氨酸酶、MAGE、CD34、CD45、CD99、CD117、嗜铬 粒蛋白、细胞角蛋白、结蛋白、GFAP、GCDFP-15、HMB-45抗原、MART-1、myo-D1、 MSA、神经丝、NSE、胎盘碱性磷酸酶、突触泡蛋白、甲状腺球蛋白、甲状腺转录因子 -1、肿瘤M2-PK、CD19、CD22、CD27、CD30、CD70、GD2(神经节苷脂G2)、EGFRvIII (表皮生长因子变体III)、精液蛋白17(Sp17)、mesothelin、PAP(前列腺酸性磷酸酶)、 prostein、TARP(T细胞受体γ另起读框蛋白)、Trp-p8、STEAP1(前列腺六跨膜上皮抗 原1)、异常ras蛋白或异常p53蛋白,其中所述第一多肽不含协同刺激结构域;和b)包含结合第二抗原的胞外抗原结合结构域和包含来自CD27、CD28、OX40、ICOS和4-1BB 每个的协同刺激信号转导结构域的第二胞内信号转导结构域的第二多肽,其中所述第二 抗原是VEGF、bFGF、PDGF、HGF、IGF或IL-8;其中只有当所述第一信号转导结构 域和所述第二信号转导结构域两者都分别被所述第一抗原和所述第二抗原激活时,所述 修饰的淋巴细胞才变成有最大毒性。
在上述具体配置的任一个中,所述第一多肽或所述第二多肽的任一个或两个包含T 细胞存活基序,例如来自CD28、IL-7R、IL-12R、IL-15R、IL-21R、TGFβR的T细胞 存活基序。
5.1.4.
可构建修饰的T淋巴细胞内所包含的两种多肽(例如嵌合受体)使得第一抗原(例如 TAA或TSA)与第一多肽的第一抗原结合结构域的结合不产生一级抗原结合信号,但产生协同刺激信号,而第二抗原的结合产生一级抗原结合信号。这类配置可享有与上述第 一配置相同的优势,因为必需产生2个抗原结合事件以完全激活T淋巴细胞。
因此,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和第一胞内信号转导结构域的第一多肽;和b)包含结合第二抗原的第二胞外抗原结合结构域和第二胞内信号转导结构域的第二多肽,其中所述第二多肽不含协同刺激结构域;其中只有当所述第一信号转导结构域和所述第二信号转导结构域两者都分别被所述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才变成有最大毒性。同上,第一抗原和第二抗原是不同的抗原。在一个具体的实施方案中,在所述第二抗原不与所 述第二结合结构域结合的情况下所述第一抗原与所述第一抗原结合结构域的结合,或在 所述第一抗原不与所述第一结合结构域结合的情况下所述第二抗原与所述第二抗原结 合结构域的结合诱导所述修饰的T淋巴细胞无反应性。
在某些实施方案中,所述第一抗原结合结构域和所述第二抗原结合结构域独立地为 任何抗原结合结构域,例如上述第5.2节公开的抗原结合结构域的任一种,例如受体的抗原结合部分或抗体的抗原结合部分。在一个更具体的实施方案中,所述第一抗原结合 结构域或所述第二抗原结合结构域的任一个或两个是scFv抗体片段。
第一多肽包含一个或多个协同刺激结构域,使得当第一抗原与第一多肽的第一抗原 结合结构域结合时第一多肽能够提供协同刺激。可以使用任何协同刺激基序或其功能部 分。在某些具体的实施方案中,一个或多个协同刺激结构域包含协同刺激性CD27多肽序列、协同刺激性CD28多肽序列、协同刺激性OX40(CD134)多肽序列、协同刺激性 4-1BB(CD137)多肽序列或协同刺激诱导型T细胞协同刺激性(ICOS)多肽序列的一个或 多个。
第二多肽的第二胞内信号转导结构域可以是例如能够以类似于天然T淋巴细胞受体的CD3ζ(CD3 zeta)链的方式从第二多肽的第二抗原结合结构域转导抗原结合信号的 任何多肽。在某些实施方案中,第二胞内信号转导结构域含有包含基于免疫受体酪氨酸 活化基序(ITAM)的多肽序列。优选多肽序列是CD3ζ信号转导结构域或其信号转导变体。
在某些实施方案中,所述第一多肽或所述第二多肽的任一个还包含跨膜结构域。在 某些实施方案中,第一多肽包含一个或多个协同刺激结构域,使得当第一抗原与第二多肽的第一抗原结合结构域结合时第一多肽能够提供协同刺激。可使用任何协同刺激结构域或其功能部分,例如来自CD27、CD28、OX40、ICOS和4-1BB每个的协同刺激信号 转导结构域。在某些其它的实施方案中,所述第一多肽或所述第二多肽包含T细胞存活 基序。
在该配置中,第一抗原可以是任何目标抗原,例如在细胞表面表达的抗原。在优选的实施方案中,所述第一抗原是肿瘤细胞上的抗原。肿瘤细胞可以是例如实体瘤或血癌 的细胞,例如上文第5.2节公开的癌症或肿瘤类型的任一种。在某些具体的实施方案中, 所述抗原是TAA或TSA,例如上文第5.1节公开的TAA或TSA的任一种。
第二抗原可以是不同于第一抗原但优选与第一抗原有关的任何抗原。例如,第一和 第二抗原两者可以是存在于肿瘤细胞类型上的肿瘤相关抗原或肿瘤特异性抗原。优选第 一抗原是TAA或TSA,而所述第二抗原不是TAA或TSA。在这类实施方案中,第二 抗原在某些实施方案中可与肿瘤的方面(例如肿瘤环境)有关。例如,肿瘤可在肿瘤周围 的组织中诱导炎性状态,并可将促进血管生成的血管生成生长因子、白介素和/或细胞因 子释放进入肿瘤和释放在肿瘤周围。因此,在具体的实施方案中,第二抗原是生长因子、 细胞因子或白介素,例如与血管生成或血管发生有关的生长因子、细胞因子或白介素, 例如VEGF、bFGF、PDGF、HGF、IGF或IL-8。在其它更具体的实施方案中,因所述 第二嵌合受体引起的信号转导通过激活例如HIF-1α、HIF-1β、HIF-2α、HIF-2β、HIF-3α 或HIF-3β等缺氧相关因子来诱导。在某些其它的实施方案中,第二抗原是DAMP,例 如热激蛋白、HMGB1、S100A8(MRP8、钙粒蛋白A)、S100A9(MRP14、钙粒蛋白B)、 SAA、脱氧核糖核酸、腺苷三磷酸、尿酸或硫酸肝素。
5.1.5.
因此,在一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和第一胞内信号转导结构域的第一多肽;和b)包含结合血管生成或血管形成因子的第二胞外抗原结合结构域和胞内CD3ζ信号转导结构域的第二多肽,其中所述第二多肽不含协同刺激结构域;其中只有当所述第一信号转导结构域和所 述第二信号转导结构域两者都分别被所述第一抗原和所述第二抗原激活时,所述修饰的 淋巴细胞才变成有最大毒性。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的scFv 或其抗原结合部分和第一胞内信号转导结构域的第一多肽;和b)包含结合血管生成或血 管形成因子的第二胞外抗原结合结构域和胞内CD3ζ信号转导结构域的第二多肽,其中 所述第二多肽不含协同刺激结构域;其中只有当所述第一信号转导结构域和所述第二信 号转导结构域两者都分别被所述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞 才变成有最大毒性。
在一种更具体的配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和第一胞内信号转导结构域的第一多肽,其中所述第一抗原是肿瘤相关抗原(TAA)或肿瘤特异性抗原(TSA);和b)包含结合第二抗原的第二胞外 抗原结合结构域和胞内CD3ζ信号转导结构域的第二多肽,其中所述第二抗原是VEGF、 bFGF、PDGF、HGF、IGF或IL-8,其中所述第二多肽不含协同刺激结构域;其中只有 当所述第一信号转导结构域和所述第二信号转导结构域两者都分别被所述第一抗原和 所述第二抗原激活时,所述修饰的淋巴细胞才变成有最大毒性。
在另一种更具体的配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和包含来自CD27、CD28、OX40、ICOS和4-1BB的一 种或多种的协同刺激信号转导结构域的第一胞内信号转导结构域的第一多肽,其中所述 第一抗原是TAA或TSA;和b)包含结合第二抗原的第二胞外抗原结合结构域和胞内 CD3ζ信号转导结构域的第二多肽,其中所述第二抗原是VEGF、bFGF、PDGF、HGF、 IGF或IL-8,其中所述第二多肽不含协同刺激结构域;其中只有当所述第一信号转导结 构域和所述第二信号转导结构域两者都分别被所述第一抗原和所述第二抗原激活时,所 述修饰的淋巴细胞才变成有最大毒性。
在另一种更具体的配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的胞外抗原结合结构域和包含来自CD27、CD28、OX40、ICOS和4-1BB的一种或 多种的协同刺激信号转导结构域的胞内信号转导结构域的第一多肽,其中所述第一抗原 是Her2、PSCA、PSMA、BCMA、ERK5、AFP、CEA、CA-125、CA19-9、钙网膜蛋白、 MUC-1、EMA、ETA、酪氨酸酶、MAGE、CD34、CD45、CD99、CD117、嗜铬粒蛋白、 细胞角蛋白、结蛋白、GFAP、GCDFP-15、HMB-45抗原、MART-1、myo-D1、MSA、 神经丝、NSE、胎盘碱性磷酸酶、突触泡蛋白、甲状腺球蛋白、甲状腺转录因子-1、肿 瘤M2-PK、CD19、CD22、CD27、CD30、CD70、GD2(神经节苷脂G2)、EGFRvIII(表 皮生长因子变体III)、精液蛋白17(Sp17)、mesothelin、PAP(前列腺酸性磷酸酶)、prostein、 TARP(T细胞受体γ另起读框蛋白)、Trp-p8、STEAP1(前列腺六跨膜上皮抗原1)、异常 ras蛋白或异常p53蛋白;和b)包含结合第二抗原的胞外抗原结合结构域和胞内CD3ζ信号转导结构域的第二多肽,其中所述第二抗原是VEGF、bFGF、PDGF、HGF、IGF 或IL-8,其中所述第二多肽不含协同刺激结构域;其中只有当所述第一信号转导结构域 和所述第二信号转导结构域两者都分别被所述第一抗原和所述第二抗原激活时,所述修 饰的淋巴细胞才变成有最大毒性。
在另一种更具体的配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和包含来自CD27、CD28、OX40、ICOS和4-1BB每个 的协同刺激信号转导结构域的胞内信号转导结构域的第一多肽,其中所述第一抗原是 Her2、PSCA、PSMA、BCMA、ERK5、AFP、CEA、CA-125、CA19-9、钙网膜蛋白、 MUC-1、EMA、ETA、酪氨酸酶、MAGE、CD34、CD45、CD99、CD117、嗜铬粒蛋白、 细胞角蛋白、结蛋白、GFAP、GCDFP-15、HMB-45抗原、MART-1、myo-D1、MSA、 神经丝、NSE、胎盘碱性磷酸酶、突触泡蛋白、甲状腺球蛋白、甲状腺转录因子-1、肿 瘤M2-PK、CD19、CD22、CD27、CD30、CD70、GD2(神经节苷脂G2)、EGFRvIII(表 皮生长因子变体III)、精液蛋白17(Sp17)、mesothelin、PAP(前列腺酸性磷酸酶)、prostein、TARP(T细胞受体γ另起读框蛋白)、Trp-p8、STEAP1(前列腺六跨膜上皮抗原1)、异常 ras蛋白或异常p53蛋白;和b)包含结合第二抗原的第二胞外抗原结合结构域和胞内 CD3ζ信号转导结构域的第二多肽,其中所述第二抗原是VEGF、bFGF、PDGF、HGF、 IGF或IL-8,其中所述第二多肽不含协同刺激结构域;其中只有当所述第一信号转导结 构域和所述第二信号转导结构域两者都分别被所述第一抗原和所述第二抗原激活时,所 述修饰的淋巴细胞才变成有最大毒性。
在另一种更具体的配置中,本文提供修饰的T淋巴细胞,其包含:a)结合第一抗原的第一胞外抗原结合结构域和包含来自CD27、CD28、OX40、ICOS和4-1BB每个的协 同刺激信号转导结构域的胞内信号转导结构域的第一多肽,其中所述第一胞外抗原结合 结构域是csFv或其抗原结合部分,且其中所述第一抗原是Her2、PSCA、PSMA、BCMA、 ERK5、AFP、CEA、CA-125、CA19-9、钙网膜蛋白、MUC-1、EMA、ETA、酪氨酸酶、 MAGE、CD34、CD45、CD99、CD117、嗜铬粒蛋白、细胞角蛋白、结蛋白、GFAP、 GCDFP-15、HMB-45抗原、MART-1、myo-D1、MSA、神经丝、NSE、胎盘碱性磷酸 酶、突触泡蛋白、甲状腺球蛋白、甲状腺转录因子-1、肿瘤M2-PK、CD19、CD22、CD27、 CD30、CD70、GD2(神经节苷脂G2)、EGFRvIII(表皮生长因子变体III)、精液蛋白17 (Sp17)、mesothelin、PAP(前列腺酸性磷酸酶)、prostein、TARP(T细胞受体γ另起读框 蛋白)、Trp-p8、STEAP1(前列腺六跨膜上皮抗原1)、异常ras蛋白或异常p53蛋白;和b)包含结合第二抗原的胞外抗原结合结构域和胞内CD3ζ信号转导结构域的第二多肽, 其中所述第二抗原是VEGF、bFGF、PDGF、HGF、IGF或IL-8,其中所述第一多肽不 含协同刺激结构域;其中只有当所述第一信号转导结构域和所述第二信号转导结构域两 者都分别被所述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才变成有最大毒 性。
在上述具体配置的任一个中,所述第一多肽或所述第二多肽的任一个或两个包含T 细胞存活基序,例如来自CD28、IL-7R、IL-12R、IL-15R、IL-21R、TGFβR的T细胞 存活基序。
5.1.6.
在第四种配置中,可构建修饰的T淋巴细胞内所包含的2个嵌合受体,使得导向第一抗原的第一嵌合受体包含一级抗原结合信号转导结构域和协同刺激结构域两者,但无包含T细胞存活基序的多肽序列,而导向第二抗原的第二嵌合受体含有包含T细胞存活 基序的多肽序列。在该配置中,T淋巴细胞被导向表达所需抗原的细胞,且在抗原结合 时,产生抗原结合和协同刺激信号;然而,在第二嵌合受体与第二抗原结合不存在时, T淋巴细胞不被引向存活。因此,肿瘤外作用再次被消除或减轻。
因此,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域、信号转导结构域和一个或多个协同刺激基序的第一多肽;和b)包含结合第 二抗原的第二胞外抗原结合结构域和T细胞存活基序的第二多肽,其中所述第二多肽不 含协同刺激基序;其中所述信号转导结构域和所述T细胞存活基序两者都分别被所述第 一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才存活。在某些实施方案中,所述 T细胞存活基序是IL-7受体胞内T细胞存活基序,是来自CD28、IL-7R、IL-12R、IL-15R、 IL-21R或TGFβR的T细胞存活基。在某些实施方案中,所述第一多肽或所述第二多肽 的任一个或两个包含跨膜结构域。在一个更具体的实施方案中,所述第二多肽含有包含 T细胞存活基序的CD27、CD28、IL-7R、IL-12R、IL-15R、IL-21R或TGFβR的结构域。
同上,在结构上第一抗原结合结构域和所述第二抗原结合结构域独立地为任何抗原 结合结构域,例如上述第5.2节公开的抗原结合结构域的任一种,例如受体的抗原结合部分或抗体的抗原结合部分。在一个更具体的实施方案中,所述第一抗原结合结构域或 所述第二抗原结合结构域的任一个或两个是scFv抗体片段。第一抗原可以是任何目标 抗原,例如在细胞表面表达的抗原。在优选的实施方案中,所述第一抗原是肿瘤细胞上 的抗原。肿瘤细胞可以是例如实体瘤或血癌的细胞,例如上文第5.2节公开的癌症或肿 瘤类型的任一种。在某些具体的实施方案中,所述抗原是TAA或TSA,例如上文第5.1 节公开的TAA或TSA的任一种。第二抗原,其不同于第一抗原,可以是血管生成或血 管形成因子,例如上文第5.1节公开的血管生成或血管形成因子的任一种;或任何 DAMP,例如上文第5.1节公开的DAMP。在其它具体的实施方案中,因所述第二嵌合 受体引起的信号转导通过激活例如HIF-1α、HIF-1β、HIF-2α、HIF-2β、HIF-3α或HIF-3β 等缺氧相关因子来诱导。
第一多肽的第一胞内信号转导结构域可以是例如能够以类似于天然T淋巴细胞受体的CD3ζ(CD3 zeta)链的方式转导来自第一多肽的第一抗原结合结构域的抗原结合信 号的任何多肽。在某些实施方案中,第二胞内信号转导结构域含有包含基于免疫受体酪 氨酸活化基序(ITAM)的多肽序列。优选多肽序列是CD3ζ信号转导结构域或其信号转导 变体。第一多肽还包含一个或多个协同刺激结构域,例如任何协同刺激基序或其功能部 分,例如协同刺激性CD27、CD28、OX40(CD134)、4-1BB(CD137)或ICOS多肽序列。
5.1.7.
在一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域、胞内CD3ζ信号转导结构域和一个或多个协同刺激基序的第一多 肽;和b)包含结合第二抗原的第二胞外抗原结合结构域和T细胞存活基序的第二多肽, 其中所述第二多肽不含协同刺激基序;其中所述信号转导结构域和所述T细胞存活基序 两者都分别被所述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域、胞内CD3ζ信号转导结构域和来自CD27、CD28、OX40(CD134)、 4-1BB(CD137)或ICOS的协同刺激多肽序列的第一多肽;和b)包含结合第二抗原的第 二胞外抗原结合结构域和T细胞存活基序的第二多肽,其中所述第二多肽不含协同刺激 基序;其中所述信号转导结构域和所述T细胞存活基序两者都分别被所述第一抗原和所 述第二抗原激活时,所述修饰的淋巴细胞才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域、胞内CD3ζ信号转导结构域和来自CD27、CD28、OX40(CD134)、 4-1BB(CD137)或ICOS的协同刺激多肽序列的第一多肽;和b)包含结合第二抗原的第 二胞外抗原结合结构域和T细胞存活基序的第二多肽,其中所述第二抗原是血管生成或 血管形成因子,或DAMP,其中所述第二多肽不含协同刺激基序;其中所述信号转导结 构域和所述T细胞存活基序两者都分别被所述第一抗原和所述第二抗原激活时,所述修 饰的淋巴细胞才存活。在其它更具体的实施方案中,因所述第二嵌合受体引起的信号转 导通过激活例如HIF-1α、HIF-1β、HIF-2α、HIF-2β、HIF-3α或HIF-3β等缺氧相关因子 来诱导。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域、胞内CD3ζ信号转导结构域和来自CD27、CD28、OX40(CD134)、 4-1BB(CD137)或ICOS的协同刺激多肽序列的第一多肽;和b)包含结合第二抗原的第 二胞外抗原结合结构域和T细胞存活基序的第二多肽,其中所述第二抗原是VEGF、 bFGF、PDGF、HGF、IGF或IL-8,其中所述第二多肽不含协同刺激基序;其中所述信 号转导结构域和所述T细胞存活基序两者都分别被所述第一抗原和所述第二抗原激活 时,所述修饰的淋巴细胞才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域、胞内CD3ζ信号转导结构域和来自CD28、OX40和4-1BB的 协同刺激多肽序列的第一多肽;和b)包含结合第二抗原的第二胞外抗原结合结构域和T 细胞存活基序的第二多肽,其中所述第二多肽不含协同刺激基序;其中所述信号转导结 构域和所述T细胞存活基序两者都分别被所述第一抗原和所述第二抗原激活时,所述修 饰的淋巴细胞才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域、胞内CD3ζ信号转导结构域和来自CD27、CD28、OX40(CD134)、 4-1BB(CD137)或ICOS的协同刺激多肽序列的第一多肽,其中所述第一抗原是TAA或 TSA;和b)包含结合第二抗原的第二胞外抗原结合结构域和T细胞存活基序的第二多肽, 其中所述第二多肽不含协同刺激基序;其中所述信号转导结构域和所述T细胞存活基序 两者都分别被所述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域、胞内CD3ζ信号转导结构域和来自CD27、CD28、OX40(CD134)、 4-1BB(CD137)或ICOS的协同刺激多肽序列的第一多肽,其中所述第一抗原是TAA或 TSA;和b)包含结合第二抗原的第二胞外抗原结合结构域和T细胞存活基序的第二多肽, 其中所述第二抗原是VEGF、bFGF、PDGF、HGF、IGF或IL-8,其中所述第二多肽不 含协同刺激基序;其中所述信号转导结构域和所述T细胞存活基序两者都分别被所述第 一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域、胞内CD3ζ信号转导结构域和来自CD27、CD28、OX40(CD134)、 4-1BB(CD137)或ICOS的协同刺激多肽序列的第一多肽,其中所述第一抗原是Her2、PSCA、PSMA、BCMA、ERK5、AFP、CEA、CA-125、CA19-9、钙网膜蛋白、MUC-1、 EMA、ETA、酪氨酸酶、MAGE、CD34、CD45、CD99、CD117、嗜铬粒蛋白、细胞角 蛋白、结蛋白、GFAP、GCDFP-15、HMB-45抗原、MART-1、myo-D1、MSA、神经丝、 NSE、胎盘碱性磷酸酶、突触泡蛋白、甲状腺球蛋白、甲状腺转录因子-1、肿瘤M2-PK、 CD19、CD22、CD27、CD30、CD70、GD2(神经节苷脂G2)、EGFRvIII(表皮生长因子 变体III)、精液蛋白17(Sp17)、mesothelin、PAP(前列腺酸性磷酸酶)、prostein、TARP(T 细胞受体γ另起读框蛋白)、Trp-p8、STEAP1(前列腺六跨膜上皮抗原1)、异常ras蛋白或异常p53蛋白;和b)包含结合第二抗原的第二胞外抗原结合结构域和T细胞存活基序 的第二多肽,其中所述第二多肽不含协同刺激基序;其中所述信号转导结构域和所述T 细胞存活基序两者都分别被所述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞 才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域、胞内CD3ζ信号转导结构域和来自CD27、CD28、OX40和4-1BB 每个的协同刺激多肽序列的第一多肽,其中所述第一抗原是Her2、PSCA、PSMA、 BCMA、ERK5、AFP、CEA、CA-125、CA19-9、钙网膜蛋白、MUC-1、EMA、ETA、 酪氨酸酶、MAGE、CD34、CD45、CD99、CD117、嗜铬粒蛋白、细胞角蛋白、结蛋白、 GFAP、GCDFP-15、HMB-45抗原、MART-1、myo-D1、MSA、神经丝、NSE、胎盘碱 性磷酸酶、突触泡蛋白、甲状腺球蛋白、甲状腺转录因子-1、肿瘤M2-PK、CD19、CD22、 CD27、CD30、CD70、GD2(神经节苷脂G2)、EGFRvIII(表皮生长因子变体III)、精液 蛋白17(Sp17)、mesothelin、PAP(前列腺酸性磷酸酶)、prostein、TARP(T细胞受体γ 另起读框蛋白)、Trp-p8、STEAP1(前列腺六跨膜上皮抗原1)、异常ras蛋白或异常p53蛋白;和b)包含结合第二抗原的第二胞外抗原结合结构域和T细胞存活基序的第二多 肽,其中所述第二抗原是VEGF、bFGF、PDGF、HGF、IGF或IL-8,其中所述第二多 肽不含协同刺激基序;其中所述信号转导结构域和所述T细胞存活基序两者都分别被所 述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含第一胞外抗原结合结构域、胞内CD3ζ信号转导结构域和来自CD27、CD28、OX40和4-1BB每个的协同 刺激多肽序列的第一多肽;所述第一胞外抗原结合结构域结合Her2、PSCA、PSMA、 BCMA、ERK5、AFP、CEA、CA-125、CA19-9、钙网膜蛋白、MUC-1、EMA、ETA、 酪氨酸酶、MAGE、CD34、CD45、CD99、CD117、嗜铬粒蛋白、细胞角蛋白、结蛋白、 GFAP、GCDFP-15、HMB-45抗原、MART-1、myo-D1、MSA、神经丝、NSE、胎盘碱 性磷酸酶、突触泡蛋白、甲状腺球蛋白、甲状腺转录因子-1、肿瘤M2-PK、CD19、CD22、 CD27、CD30、CD70、GD2(神经节苷脂G2)、EGFRvIII(表皮生长因子变体III)、精液 蛋白17(Sp17)、mesothelin、PAP(前列腺酸性磷酸酶)、prostein、TARP(T细胞受体γ 另起读框蛋白)、Trp-p8、STEAP1(前列腺六跨膜上皮抗原1)、异常ras蛋白或异常p53 蛋白;和b)包含结合VEGF的第二胞外抗原结合结构域的第二多肽,其中所述第二多肽 不含协同刺激基序;其中所述信号转导结构域和所述T细胞存活基序两者都分别被所述 第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才存活。
5.1.8.
在第五种配置中,可构建修饰的T淋巴细胞内所包含的2个嵌合受体,使得导向第一抗原的第一嵌合受体包含第一胞外抗原结合结构域和T细胞存活基序(例如胞内T细 胞存活基序),但无一级抗原结合信号转导结构域(例如CD3ζ)且无协同刺激结构域,同 时导向第二抗原的第二嵌合受体含有包含一级抗原结合信号转导结构域(例如CD3ζ)和 一个或多个协同刺激结构域的多肽序列。在该配置中,T淋巴细胞被导向表达所需抗原 的细胞,且在抗原结合时,产生T淋巴细胞存活信号;然而,在第二嵌合受体与第二抗 原结合不存在时,因为不产生抗原结合和协同刺激信号,所以不激活T淋巴细胞。因此, 肿瘤外作用再次被消除或减轻。
因此,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和T细胞存活基序的第一多肽,其中所述第一多肽不含一级抗原结合信号转 导结构域或协同刺激基序;和b)包含结合第二抗原的第二胞外抗原结合结构域和一个或 多个协同刺激基序的第二多肽;其中只有当所述第一信号转导结构域和所述第二信号转 导结构域两者都分别被所述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才存 活,并被激活。在某些实施方案中,所述T细胞存活基序是IL-7受体胞内T细胞存活 基序,是来自CD28、IL-7R、IL-12R、IL-15R、IL-21R或TGFβR的T细胞存活基。在 某些实施方案中,所述第一多肽或所述第二多肽的任一个或两个包含跨膜结构域。在一 个更具体的实施方案中,所述第一多肽含有包含T细胞存活基序的CD27、CD28、IL-7R、 IL-12R、IL-15R、IL-21R或TGFβR的结构域。
同上,在结构上第一抗原结合结构域和所述第二抗原结合结构域独立地为任何抗原 结合结构域,例如上文第5.2节公开的抗原结合结构域的任何类型,例如受体的抗原结合部分或抗体的抗原结合部分。在一个更具体的实施方案中,所述第一抗原结合结构域 或所述第二抗原结合结构域的任一个或两个是scFv抗体片段。第一抗原可以是任何目 标抗原,例如在细胞表面表达的抗原。在优选的实施方案中,所述第一抗原是肿瘤细胞 上的抗原。肿瘤细胞可以是例如实体瘤或血癌的细胞,例如上文第5.1节公开的癌症或 肿瘤类型的任一种。在某些具体的实施方案中,所述抗原是TAA或TSA,例如上文第 5.1节公开的TAA或TSA的任一种。第二抗原,其不同于第一抗原,可以是血管生成 或血管形成因子,例如上文第5.1节公开的血管生成或血管形成因子的任一种;或任何 DAMP,例如上文第5.1节公开的DAMP。在其它更具体的实施方案中,因所述第二嵌 合受体引起的信号转导通过激活例如HIF-1α、HIF-1β、HIF-2α、HIF-2β、HIF-3α或HIF-3β 等缺氧相关因子来诱导。
第二多肽的胞内信号转导结构域可以是例如能够以类似于天然T淋巴细胞受体的CD3ζ(CD3 zeta)链的方式自第二多肽的抗原结合结构域转导抗原结合信号的任何多肽。在某些实施方案中,胞内信号转导结构域含有包含基于免疫受体酪氨酸活化基序(ITAM)的多肽序列。优选多肽序列是CD3ζ信号转导结构域或其信号转导变体。第二多肽还包 含一个或多个协同刺激结构域,例如任何协同刺激基序或其功能部分,例如协同刺激性 CD27、CD28、OX40(CD134)、4-1BB(CD137)或ICOS多肽序列。
5.1.9.
在一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和T细胞存活基序的第一多肽,其中所述第一多肽不含一级抗原结 合信号转导结构域且不含协同刺激基序;和b)包含结合第二抗原的第二胞外抗原结合结 构域、胞内CD3ζ信号转导结构域和一个或多个协同刺激基序的第二多肽;其中只有当 所述信号转导结构域和所述T细胞存活基序分别被所述第二抗原和所述第一抗原激活 时,所述修饰的淋巴细胞才被激活并存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和T细胞存活基序的第一多肽,其中所述第一多肽不含一级抗原 结合信号转导结构域且不含协同刺激基序;和b)包含结合第二抗原的第二胞外抗原结合 结构域、胞内CD3ζ信号转导结构域和来自CD27、CD28、OX40(CD134)、4-1BB(CD137) 或ICOS的协同刺激多肽序列的第二多肽;其中只有当所述T细胞存活基序和所述信号 转导结构域分别被所述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才被激活 并存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和T细胞存活基序的第一多肽,其中所述第一多肽不含一级抗原 结合信号转导结构域且不含协同刺激基序;和b)包含结合第二抗原的第二胞外抗原结合 结构域、胞内CD3ζ信号转导结构域和来自CD27、CD28、OX40(CD134)、4-1BB(CD137) 或ICOS的协同刺激多肽序列的第二多肽,其中所述第二抗原是血管生成或血管形成因 子,或DAMP;其中所述第二多肽不含一级抗原结合信号转导结构域且不含协同刺激基 序;其中只有当所述T细胞存活基序和所述信号转导结构域两者都分别被所述第一抗原 和所述第二抗原激活时,所述修饰的淋巴细胞才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和T细胞存活基序的第一多肽,其中所述第一多肽不含一级抗原 结合信号转导结构域且不含协同刺激基序;和b)包含结合第二抗原的第二胞外抗原结合 结构域、胞内CD3ζ信号转导结构域和来自CD27、CD28、OX40(CD134)、4-1BB(CD137) 或ICOS的协同刺激多肽序列的第二多肽,其中所述第二抗原是VEGF、bFGF、PDGF、 HGF、IGF或IL-8;其中只有当所述T细胞存活基序和所述信号转导结构域两者都分别 被所述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和T细胞存活基序的第一多肽,其中所述第一多肽不含一级抗原 结合信号转导结构域且不含协同刺激基序;和b)包含结合第二抗原的第二胞外抗原结合 结构域、胞内CD3ζ信号转导结构域和来自CD28、OX40和4-1BB的协同刺激多肽序 列的第二多肽;其中只有当所述T细胞存活基序和所述信号转导结构域两者都分别被所 述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和T细胞存活基序的第一多肽,其中所述第一抗原是TAA或 TSA,其中所述第一多肽不含一级抗原结合信号转导结构域且不含协同刺激基序;和b) 包含结合第二抗原的第二胞外抗原结合结构域、胞内CD3ζ信号转导结构域和来自 CD27、CD28、OX40(CD134)、4-1BB(CD137)或ICOS的协同刺激多肽序列的第二多肽; 其中只有当所述T细胞存活基序和所述信号转导结构域两者都分别被所述第一抗原和 所述第二抗原激活时,所述修饰的淋巴细胞才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和T细胞存活基序的第一多肽,其中所述第一抗原是TAA或TSA,其中所述第一多肽不含一级抗原结合信号转导结构域且不含协同刺激基序;和b) 包含结合VEGF、bFGF、PDGF、HGF、IGF或IL-8的第二胞外抗原结合结构域、胞内 CD3ζ信号转导结构域和来自CD27、CD28、OX40(CD134)、4-1BB(CD137)或ICOS的 协同刺激多肽序列的第二多肽;其中只有当所述T细胞存活基序和所述信号转导结构域 两者都分别被所述第一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和T细胞存活基序的第一多肽,其中所述第一抗原是Her2、 PSCA、PSMA、BCMA、ERK5、AFP、CEA、CA-125、CA19-9、钙网膜蛋白、MUC-1、 EMA、ETA、酪氨酸酶、MAGE、CD34、CD45、CD99、CD117、嗜铬粒蛋白、细胞角 蛋白、结蛋白、GFAP、GCDFP-15、HMB-45抗原、MART-1、myo-D1、MSA、神经丝、 NSE、胎盘碱性磷酸酶、突触泡蛋白、甲状腺球蛋白、甲状腺转录因子-1、肿瘤M2-PK、 CD19、CD22、CD27、CD30、CD70、GD2(神经节苷脂G2)、EGFRvIII(表皮生长因子 变体III)、精液蛋白17(Sp17)、mesothelin、PAP(前列腺酸性磷酸酶)、prostein、TARP(T 细胞受体γ另起读框蛋白)、Trp-p8、STEAP1(前列腺六跨膜上皮抗原1)、异常ras蛋白 或异常p53蛋白;其中所述第一多肽不含一级抗原结合信号转导结构域且不含协同刺激基序;和b)包含结合第二抗原的第二胞外抗原结合结构域、胞内CD3ζ信号转导结构域 和来自CD27、CD28、OX40(CD134)、4-1BB(CD137)或ICOS的协同刺激多肽序列的 第二多肽;其中只有当所述T细胞存活基序和所述信号转导结构域两者都分别被所述第 一抗原和所述第二抗原激活时,所述修饰的淋巴细胞才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合第一抗原的第一胞外抗原结合结构域和T细胞存活基序的第一多肽,其中所述第一抗原是Her2、 PSCA、PSMA、BCMA、ERK5、AFP、CEA、CA-125、CA19-9、钙网膜蛋白、MUC-1、 EMA、ETA、酪氨酸酶、MAGE、CD34、CD45、CD99、CD117、嗜铬粒蛋白、细胞角 蛋白、结蛋白、GFAP、GCDFP-15、HMB-45抗原、MART-1、myo-D1、MSA、神经丝、 NSE、胎盘碱性磷酸酶、突触泡蛋白、甲状腺球蛋白、甲状腺转录因子-1、肿瘤M2-PK、 CD19、CD22、CD27、CD30、CD70、GD2(神经节苷脂G2)、EGFRvIII(表皮生长因子 变体III)、精液蛋白17(Sp17)、mesothelin、PAP(前列腺酸性磷酸酶)、prostein、TARP(T 细胞受体γ另起读框蛋白)、Trp-p8、STEAP1(前列腺六跨膜上皮抗原1)、异常ras蛋白 或异常p53蛋白;其中所述第一多肽不含一级抗原结合信号转导结构域且不含协同刺激基序;和b)包含结合第二抗原的第二胞外抗原结合结构域、胞内CD3ζ信号转导结构域 和来自CD27、CD28、OX40和4-1BB每个的协同刺激多肽序列的第二多肽,其中所述 第二抗原是VEGF、bFGF、PDGF、HGF、IGF或IL-8;其中只有当所述T细胞存活基 序和所述信号转导结构域两者都分别被所述第一抗原和所述第二抗原激活时,所述修饰 的淋巴细胞才存活。
在另一种配置中,本文提供修饰的T淋巴细胞,其包含:a)包含结合Her2、PSCA、PSMA、BCMA、ERK5、AFP、CEA、CA-125、CA19-9、钙网膜蛋白、MUC-1、EMA、 ETA、酪氨酸酶、MAGE、CD34、CD45、CD99、CD117、嗜铬粒蛋白、细胞角蛋白、 结蛋白、GFAP、GCDFP-15、HMB-45抗原、MART-1、myo-D1、MSA、神经丝、NSE、 胎盘碱性磷酸酶、突触泡蛋白、甲状腺球蛋白、甲状腺转录因子-1、肿瘤M2-PK、CD19、 CD22、CD27、CD30、CD70、GD2(神经节苷脂G2)、EGFRvIII(表皮生长因子变体III)、 精液蛋白17(Sp17)、mesothelin、PAP(前列腺酸性磷酸酶)、prostein、TARP(T细胞受 体γ另起读框蛋白)、Trp-p8、STEAP1(前列腺六跨膜上皮抗原1)、异常ras蛋白或异常 p53蛋白的第一胞外抗原结合结构域和T细胞存活基序的第一多肽,其中所述第一多肽 不含一级抗原结合信号转导结构域且不含协同刺激基序;和b)包含结合第二抗原的第二 胞外抗原结合结构域、胞内CD3ζ信号转导结构域和来自CD27、CD28、OX40和4-1BB每个的协同刺激多肽序列的第二多肽,其中所述第二抗原是VEGF;其中只有当所述T 细胞存活基序和所述信号转导结构域两者都分别被所述第一抗原和所述第二抗原激活 时,所述修饰的淋巴细胞才存活。
5.1.10.
在某些实施方案中,修饰的T淋巴细胞包含修饰的TCR作为第一多肽和产生协同刺激信号的人工第二多肽。在具体的实施方案中,例如通过天然抗原结合结构域用结合 特定抗原的结构域置换,对修饰的TCR进行修饰。在一个具体的实施方案中,将T淋 巴细胞用编码抗MART-1TCR的α和β链的多核苷酸转化。T淋巴细胞同样可用多编 码α和βTCR亚基的核苷酸转化,其中TCR被导向抗原,例如TSA或TAA。在优选 的实施方案中,修饰的T淋巴细胞另外用编码人工协同刺激多肽(例如上文第5.1节公开 的协同刺激多肽,或上文第5.2节公开的第二多肽之一)的多核苷酸转化。
在其中修饰的T淋巴细胞包含两种多肽(例如嵌合受体)的某些实施方案中,第一多 肽包含第一抗原结合结构域、一级抗原结合信号转导结构域(例如CD3ζ)和单一协同刺激 结构域(例如CD28或其协同刺激多肽序列),第二多肽包含第二抗原结合结构域和至少一个协同刺激结构域,例如来自CD27、4-1BB、OX40、IL-7R等的协同刺激结构域。 在一个更具体的实施方案中,第二多肽包含至少2个或包含至少3个协同刺激结构域。
在某些其它的实施方案中,本文提供的修饰的T淋巴细胞含有包含第一抗原结合结 构域、一级抗原结合信号转导结构域(例如CD3ζ)和不含协同刺激结构域(例如CD28或其协同刺激多肽序列)的第一多肽(例如嵌合受体);包含第二抗原结合结构域和至少一个协同刺激结构域的第二多肽(嵌合受体);和包含抗原结合结构域和至少一个其它协同刺激结构域的第三多肽。在该实施方案中,协同刺激结构域的总数被分在至少两种独立的 嵌合受体之间。至少两种不同的嵌合受体可包含结合相同抗原或不同抗原的抗原结合结 构域。
5.2.
可通过例如酰化、酰胺化、糖基化、甲基化、磷酸化、硫酸盐化、苏素化、泛素化 等,修饰用于产生本文提供的修饰的T淋巴细胞的本文提供的第一和第二多肽。可用能 够提供可检测信号的标记(例如用放射性同位素和荧光化合物)对多肽进行标记。第一或 第二多肽的一个或多个侧链可被衍生化,例如赖氨酰基和氨基端残基用琥珀酸或其它羧 酸酐的衍生化,或用例如亚氨基酯例如甲基吡啶亚胺甲酯;磷酸吡哆醛;吡哆醛;氯硼 氢化物;三硝基苯磺酸;O-甲基异脲;2,4-戊二酮衍生化;和与乙醛酸盐的转氨酶催化 反应。可通过与碳二亚胺(R-N=C=N-R')例如1-环己基-3-(2-吗啉基-(4-乙基)碳二亚胺或 1-乙基-3-(4-氮鎓-4,4-二甲基苯基)碳二亚胺反应,选择性地修饰羧基侧基、天冬氨酰基 或谷氨酰基。
5.3.
所公开的多肽(例如嵌合受体)可按照本领域众所周知的方法由多核苷酸序列编码。 多核苷酸可包含在适于免疫细胞(例如T淋巴细胞)转化的任何多核苷酸载体内。例如,T淋巴细胞可使用含有编码第一和第二多肽(例如嵌合受体)的多核苷酸合成载体、慢病 毒或反转录病毒载体、自主复制质粒、病毒(例如反转录病毒、慢病毒、腺病毒或疱疹 病毒)等转化。适于T淋巴细胞转化的慢病毒载体包括但不限于例如描述于美国专利号 5,994,136、6,165,782、6,428,953、7,083,981和7,250,299的慢病毒载体。适于T淋巴细 胞转化的HIV载体包括但不限于例如描述于美国专利号5,665,577的慢病毒载体。
可用于在例如修饰的T淋巴细胞内产生第一和第二多肽的核酸包括DNA、RNA或 核酸类似物。可在碱基部分、糖部分或磷酸骨架上修饰核酸类似物,并可包括脱氧尿苷 替代脱氧胸苷、5-甲基-2'-脱氧胞苷或5-溴-2'-脱氧胞苷替代脱氧胞苷。糖部分的修饰可 包括核糖的2'羟基修饰形成2'-O-甲基或2'-O-烯丙基糖。可修饰脱氧核糖磷酸酯骨架以 产生吗啉代核酸,其中每个碱基部分与6元吗啉代环或肽核酸连接,其中脱氧磷酸骨架 被假肽骨架置换,并保留4种碱基。参见例如Summerton和Weller(1997)Antisense Nucleic AcidDrug Dev.7:187-195;以及Hyrup等(1996)Bioorgan.Med.Chain.4:5-23。 此外,脱氧磷酸骨架可被例如硫代磷酸酯或二硫代磷酸酯骨架、氨基磷酸酯或烷基磷酸 三酯骨架置换。
5.4.
可用于本文提供的组合物和方法的T淋巴细胞可以是幼稚T淋巴细胞或MHC限制性T淋巴细胞。在某些实施方案中,T淋巴细胞是肿瘤浸润性淋巴细胞(TIL)。在某些实 施方案中,T淋巴细胞从肿瘤活检样品中分离,或从肿瘤活检样品分离的T淋巴细胞中 扩增。在某些其它的实施方案中,T细胞从自外周血、脐带血或淋巴扩增的T淋巴细胞 分离,或从自外周血、脐带血或淋巴扩增的T淋巴细胞扩增。
用于本发明方法的免疫细胞(例如修饰的T淋巴细胞)优选对于待给予修饰的T淋巴 细胞的个体是自体的。在某些其它的实施方案中,修饰的T淋巴细胞对于待给予修饰的T淋巴细胞的个体是同种异体的。在使用同种异体T淋巴细胞制备修饰的T淋巴细胞时, 优选选择可降低个体的移植物抗宿主病(GVHD)的可能性的T淋巴细胞。例如,在某些 实施方案中,选择病毒特异生T淋巴细胞用于制备修饰的T淋巴细胞;预期这类淋巴细 胞结合任何受体抗原(recipient antigen)的天然能力大大降低,并因此变得被任何受体抗 原激活。在某些实施方案中,共同给予宿主一种或多种免疫抑制剂,例如环孢菌素、他 克莫司、西罗莫司、环磷酰胺等,来降低受体介导的同种异体T淋巴细胞排斥。
在一个实施方案中,T淋巴细胞获自个体,任选随后扩增,然后用编码第一多肽的第一多核苷酸和编码第二多肽的第二多核苷酸转化,任选随后扩增。可使用例如对每个 载体是独特的选择标记,选择双重转化子。在另一个实施方案中,T淋巴细胞获自个体, 任选随后扩增,然后用编码第一多肽和第二多肽的多核苷酸转化,任选随后扩增。使用 选择标记选择含有所述多核苷酸的细胞。
在某些实施方案中,除人工协同刺激多肽(在其中使用单一协同刺激多肽的实施方 案中)以外,或除第一多肽和第二多肽(在其中修饰的T淋巴细胞包含区分抗原结合信号转导和协同刺激信号转导的多肽的实施方案中)以外,修饰的T淋巴细胞包含天然TCR 蛋白,例如能够形成天然TCR复合体的TCR-α和TCR-β。在某些其它的实施方案中, 在修饰的T淋巴细胞中编码TCR-α和TCR-β的天然基因的任一个或两个被修饰成无功 能的,例如部分或全部缺失、插入突变等。
在某些实施方案中,T淋巴细胞从肿瘤病变中分离,例如是肿瘤浸润性淋巴细胞;预期这类T淋巴细胞对TSA或TAA有特异性。
在某些实施方案中,第一多肽和第二多肽的信号转导基序可用来促进修饰的T淋巴 细胞的增殖和扩增。例如,未修饰的T淋巴细胞和含有包含CD3ζ信号转导结构域和 CD28协同刺激结构域的多肽的T淋巴细胞可使用抗CD3和CD28的抗体(例如连接至 珠粒的抗体)扩增;参见例如美国专利号5,948,893、6,534,055、6,352,694、6,692,964、 6,887,466和6,905,681。同样,抗第一多肽中的信号转导基序的抗体和抗第二多肽中的 信号转导基序的抗体可用来刺激包含第一和第二多肽两者的T淋巴细胞的增殖。
在某些实施方案中,不论第一和第二多肽在T淋巴细胞内从单一载体表达还是从两 个单独的载体表达,第一多肽和第二多肽分别与之结合的第一和第二抗原可用来促进表 达第一多肽和第二多肽两者的T淋巴细胞的选择性扩增。例如,在一个实施方案中,其中第一多肽与之结合的第一抗原是TSA,而第二多肽与之结合的第二抗原是血管生成因子,在TSA和血管生成因子存在下培养包含第一多肽和第二多肽的T淋巴细胞,导致 与在仅第一或第二抗原存在时,即在任一种不存在时的培养相比增殖增加。
在某些其它的实施方案中,使用结合与可被第二多肽结合的抗原偶联的第一多肽中 的信号转导结构域的抗体,刺激包含第一和第二多肽的T淋巴细胞增殖。例如,在其中第一多肽的信号转导结构域是CD3ζ且与第二多肽结合的抗原是VEGF的实施方案中, 通过在与结合CD3ζ的抗体组合的VEGF存在下培养细胞,来刺激包含第一和第二多肽 的T淋巴细胞增殖。在其它实施方案中,使用可被第一多肽结合的抗原和第二肽中的协 同刺激基序,来刺激包含第一和第二多肽的T淋巴细胞增殖。例如,在其中与第一多肽 结合的抗原是HER2且第二多肽中的协同刺激基序获自CD28的实施方案中,通过在 HER2蛋白和与CD28结合的抗体存在时培养细胞,来刺激包含第一和第二多肽的T淋 巴细胞增殖。
在上述实施方案的任一个中,抗原和/或抗体可游离存在于其中T淋巴细胞是培养物的培养基中,或任一个或两个可与固相载体(例如组织培养塑料表面、珠粒等)连接。
修饰的T淋巴细胞可任选包含需要时能够杀死基本上所有的修饰T淋巴细胞的“自杀基因”或“安全开关”。例如在某些实施方案中,修饰的T淋巴细胞可包含HSV胸苷激 酶基因(HSV-TK),其在与更昔洛韦接触时引起修饰的T淋巴细胞死亡。在另一个实施 方案中,修饰的T淋巴细胞包含诱导型胱天蛋白酶,例如诱导型胱天蛋白酶9(胱天蛋 白酶9),例如允许使用特定的小分子药物二聚化的胱天蛋白酶9和人FK506结合蛋白 之间的融合蛋白。参见Straathof等,
5.5.
修饰的免疫细胞,例如,本文提供的修饰的T淋巴细胞可用来治疗具有需要被T淋巴细胞靶向(例如被杀死)的一种或多种类型的细胞的个体。在某些实施方案中,待杀死 的细胞是癌细胞,例如肿瘤细胞。在优选的实施方案中,癌细胞是实体瘤的细胞。在具 体的实施方案中,细胞是以下的细胞:淋巴瘤、肺癌、乳腺癌、前列腺癌、肾上腺皮质 癌、甲状腺癌、鼻咽癌、黑素瘤(例如恶性黑素瘤)、皮肤癌、结肠直肠癌、硬纤维瘤、 促结缔组织增生性小圆细胞肿瘤、内分泌肿瘤、尤因肉瘤、外周性原始神经外胚层肿瘤、 实体生殖细胞肿瘤、肝胚细胞瘤、成神经细胞瘤、非横纹肌肉瘤软组织肉瘤、骨肉瘤、 成视网膜细胞瘤、横纹肌肉瘤、维尔姆斯瘤、成胶质细胞瘤、粘液瘤、纤维瘤、脂肪瘤 等。在更具体的实施方案中,所述淋巴瘤可以是慢性淋巴细胞白血病(小淋巴细胞性淋 巴瘤)、B细胞幼淋巴细胞白血病、淋巴浆细胞性淋巴瘤、瓦尔登斯特伦巨球蛋白血症、 脾边缘区淋巴瘤、浆细胞骨髓瘤、浆细胞瘤、结外边缘区B细胞淋巴瘤、MALT淋巴瘤、 结节边缘区B细胞淋巴瘤、滤泡性淋巴瘤、套细胞淋巴瘤、弥散性大B细胞淋巴瘤、 纵膈(胸腺)大B细胞淋巴瘤、血管内大B细胞淋巴瘤、原发性渗出性淋巴瘤、伯基特淋 巴瘤、T淋巴细胞幼淋巴细胞白血病、T淋巴细胞大颗粒淋巴细胞白血病、侵袭性NK 细胞白血病、成人T淋巴细胞白血病/淋巴瘤、结外NK/T淋巴细胞淋巴瘤(鼻型)、肠病 型T淋巴细胞淋巴瘤、肝脾T淋巴细胞淋巴瘤、母细胞性NK细胞淋巴瘤、蕈样肉芽肿 病、塞扎里综合征、原发性皮肤间变性大细胞淋巴瘤、淋巴瘤样丘疹病、血管免疫母细 胞性T淋巴细胞淋巴瘤、外周T淋巴细胞淋巴瘤(未分类)、间变性大细胞淋巴瘤、霍奇金淋巴瘤或非霍奇金淋巴瘤。
可通过本领域普通技术人员已知的、表明疾病或病症的进展、对具体的疾病或病症 是特有的一个或多个标准,来评价在给予患有可通过T淋巴细胞治疗的疾病或病症的个体(例如患有癌症的个体)后修饰的T淋巴细胞的功效。一般来讲,当一个或多个所述标 准从疾病状态值或范围向着或接近正常值或范围可检测(例如显著)地移动时,将修饰的 T淋巴细胞给予所述个体是有效的。
可在任何药学上可接受的溶液、优选适于递送活细胞的溶液,例如盐水溶液(例如林格氏液)、明胶、糖(例如乳糖、直链淀粉、淀粉等)、脂肪酸酯、羟甲基纤维素、聚乙 烯吡咯烷酮等中,配制修饰的T淋巴细胞。优选将这类制备物在加入修饰的T淋巴细胞 之前灭菌,并且可与例如润滑剂、防腐剂、稳定剂、乳化剂、影响渗透压的盐、缓冲剂 和着色剂等助剂混合。适用于配制修饰的T淋巴细胞的药用载体是本领域已知的,并描 述于例如WO 96/05309。
在某些实施方案中,将修饰的T淋巴细胞配制成单独的剂量,其中所述单独的剂量包含至少、至多或约1×10
6.实施例
6.1.
个体表现为T2期前列腺癌,未扩散到局部淋巴结或其它淋巴结(N0,M0)。确定组织学分级为G2。总的来说,个体被确诊为患有II期前列腺癌。通过在30分钟内静脉内 输注,给予个体在200mL盐水溶液介于10
6.2.
个体表现为T2期前列腺癌、未扩散到局部淋巴结或其它淋巴结(N0,M0)。确定组织学分级为G2。总的来说,个体被确诊为患有I1期前列腺癌。通过在30分钟内静脉 内输注,给予个体200mL盐水溶液中的介于10
6.3.
个体表现为扩散至至少一个局部淋巴结的3期乳腺癌。在手术切除癌组织后,通过在30分钟内静脉内输注,给予个体200mL盐水溶液中的介于10
6.4.
该实施例描述了包含两个嵌合抗原受体(CAR)的修饰的T淋巴细胞的产生,其中第一CAR包含对肿瘤特异性抗原有特异性的抗原结合结构域,且其中第二CAR包含对不 是肿瘤特异性抗原但与肿瘤发生有关的抗原有特异性的抗原结合结构域。
采用标准方法制备图1所示CAR。构建由与CD28铰链、CD28跨膜(TM)结构域、 CD3ζ链和tdTomato报道基因连接的抗HER2抗体的scFv组成的基于抗HER2的CAR, “HER2-CARζ”,并克隆至慢病毒载体中。该CAR表示包含对肿瘤特异性抗原有特异性 的抗原结合结构域和刺激结构域的CAR。
产生包含对VEGF(一种不是肿瘤特异性抗原的抗原)有特异性的抗原结合结构域和 协同刺激结构域的两种CAR,“VEGFR2-CD28”和“VEGFR2-28TM-CD28”。两种CAR 包含由VEGF抗原受体的一部分即VEGFR2构成的抗原结合结构域。VEGFR2-CD28包 含人VEGFR2胞外(EC)结构域接着VEGFR2 TM结构域、CD28 IC结构域、T2A序列 (thosea asigna病毒2A肽)和GFP(用作报道基因)。VEGFR2-28TM-CD28包含人VEGFR2 胞外(EC)结构域接着CD28 TM结构域、CD28胞内(IC)结构域、T2A序列和GFP。
还产生了用于VEGF识别的对照构建体。对照构建体,命名为“VEGFR2”,包含人VEGFR2胞外(EC)结构域接着VEGFR2 TM结构域、T2A序列和GFP。对照构建体因此 没有存在于命名为VEGFR2-CD28和VEGFR2-28TM-CD28的构建体中的CD28 IC结构 域。
检查了上述CAR构建体通过T细胞的表达。为了分离T细胞,采用Ficoll-PaquePlus
将包含HER2-CARζ、VEGFR2-CD28、VEGFR2-28TM-CD28或VEGFR2 CAR构建 体的质粒电穿孔至原代T细胞中,将电穿孔的T细胞培养在RPMI-10培养基中过夜。 在电穿孔后24小时收获T细胞,用HER2-人IgG-Fc嵌合体蛋白染色,接着用与APC(用 于抗HER2检测)缀合的山羊抗人IgG-Fc多克隆抗体或小鼠抗人VEGFR2单克隆抗体 (mAb;用于VEGFR2检测)染色。染色细胞通过流式细胞术分析。在所有情况下,检测 CAR的抗原结合结构域和各CAR的报道基因(tdTomato或GFP)的表达,证实了T细胞 被转基因稳定转导。具有各CAR构建体的IL-7活化T细胞的转导进一步证实 HER2-CARζ构建体可在转染的T细胞中介导抗HER2表达,VEGFR2-CD28、 VEGFR2-28TM-CD28和VEGFR2 CAR构建体可在转染的T细胞中介导阳性VEGFR2 表达。
为了确保内源VEGFR2表达不与含VEGFR2 EC结构域的构建体中VEGFR2胞外 结构域的表达竞争结合VEGF,进行了初步实验以评价通过活化T细胞引起的VEGF产 生和VEGFR2表达的水平。
如上所述分离人原代T细胞,用抗CD3/CD28
通过Cytometric Bead Array(CBA),测量在上述DynaBead活化后T细胞上清液中的VEGF-A。检测到最小VEGF分泌(<10pg/ml)。
数据表明活化人T细胞最低限度地表达内源VEGF和VEGFR2。
为了评价包含VEGFR2 EC结构域的构建体介导协同刺激的能力,人原代全T细胞用VEGFR2-CD28、VEGFR2-28TM-CD28或VEGFR2慢病毒载体(lentivector)转染,接 着用固定化抗人CD3和抗人VEGFR2 mAb或可溶性VEGF刺激。选择抗人CD3作为 配体以引发双重信号转导系统中的第一“信号”(即肿瘤抗原被包含对肿瘤抗原有特异性 的抗原结合结构域和活化结构域(例如CD3ζ链)的CAR结合)。将T细胞与抗VEGFR2 mAb或可溶性VEGF一起培养导致被VEGFR2-CD28慢病毒载体或 VEGFR2-28TM-CD28慢病毒载体转染的T细胞但非被VEGFR2慢病毒载体转染的T细 胞的刺激,如活化标志物CD69和4-1BB上调所表明的一样。
此外,确定了在抗VEGFR2 mAb处理或VEGF处理时,VEGFR2-CD28慢病毒载 体和VEGFR2-28TM-CD28慢病毒载体转染的T细胞,但非用VEGFR2慢病毒载体转染 的T细胞,分泌高水平的IL-2、粒酶B和IFN-γ。总之,结果表明当VEGFR2 EC作为 包含CD28 IC结构域的CAR的部分表达时,转染的T细胞中VEGFR2 EC结构域的表 达可介导胞内CD28信号转导。
通过用固定化HER2-Fc嵌合体蛋白刺激T细胞,在转染的T细胞中测定了 HER2-CARζ的功能有效性。作为CD28协同刺激的阳性对照,产生另一种构建体 “HER2-CAR28ζ”,其与命名为HER2-CARζ的CAR构建体相同,不同之处在于在CD28 跨膜(TM)结构域和CD3ζ链之间包括CD28胞内结构域。
为了确定T细胞被HER2-Fc嵌合体蛋白刺激,刺激后48小时检查了T细胞活化标 志物CD69和CD71的表达。仅tdTomato阳性细胞显示在HER2-CARζ和HER2-CAR28ζ 转染的细胞两者中CD69和CD71上调。与用HER2-CARζ转染的T细胞相比,在用 HER2-CAR28ζ转染的T细胞中观察到CD69和CD71的较高的频率和平均荧光强度(与 HER2-CARζ细胞(模拟转染的细胞=0.04%表达)的25%表达相比,42%HER2-CAR28ζ 细胞表达CD69;与HER2-CARζ细胞(模拟转染的细胞=0.04%表达)的10%表达相比, 27%HER2-CAR28ζ细胞表达CD71),表明了HER2-CAR28ζ构建体的胞内CD28信号 转导结构域的活性。
还测定了用抗VEGFR2 mAb或VEGF与HER2-CARζ或HER2-CAR28ζ转染的T 细胞一起培养的作用。将T细胞用HER2-Fc和VEGFR2 mAb或VEGF处理48小时, 接着流式细胞术分析以评价CD69和CD71的表面表达。观察到与上述相比,CD69和 CD71表达两者仅极小提高。
在证实VEGFR2介导的协同刺激后,评价了HER2-CARζ和VEGFR2-CD28IC双重 信号转导。为了评价双重信号转导,如上所述分离T细胞,并用(i)包含抗HER2结构域 的CAR(即HER2-CARζ);和(ii)包含VEGFR2受体胞外结构域的CAR(即命名为 VEGFR2-CD28、VEGFR2-28TM-CD28或VEGFR2的CAR)两者转染。如上所述采用流 式细胞术,通过测量报道基因表达(即tdTomato或GFP),证实了各个CAR通过转染的 T细胞表达。
在T细胞用HER2-Fc和抗VEGFR2 mAb或VEGF任一个刺激后,检查了通过用 HER2-CARζ和3个VEGFR2 CAR构建体(即命名为VEGFR2-CD28、 VEGFR2-28TM-CD28或VEGFR2的CAR构建体)之一两者转染的T细胞表达的T细胞 活化标志物CD69和CD71。
然后,在表达GFP的T细胞(即表达包含VEGFR2 EC结构域的CAR构建体的T 细胞)中观察到CD69和CD71表达的剂量反应性增加。用VEGF刺激还显示CD69和 CD71表达在表达GFP的T细胞(即表达包含VEGFR2 EC结构域的CAR构建体的T细 胞)中扩增。在所测试的最高剂量下(1ug/ml HER2-Fc/1ug/ml抗VEGFR2或1ug/ml HER2-Fc/100ng/ml抗VEGF),与包含对照构建体(即命名为VEGFR的CAR构建体)的 T细胞相比,在包含VEGFR2-28TM-CD28构建体的T细胞中观察到CD69和CD71表 达稳健增加,因此证实了VEGFR2协同刺激。与包含对照构建体(即命名为VEGFR的 CAR构建体)的T细胞相比,当比较通过包含VEGFR2-CD28构建体的T细胞表达CD69 和CD71时,观察到类似趋势。
该实施例证实了可产生包含两种CAR的功能性CAR T细胞,其信号转导结构域存在于第一种CAR中,协同刺激结构域存在于第二种CAR中。这类CAR T细胞可用于 疾病(例如癌症)的治疗,其中需要利用依赖通过两种CAR识别两个不同抗原的双重信号 转导方法。
6.5.
该实施例描述了包含可用于描述于本申请的双重信号转导方法的CAR的修饰的T淋巴细胞的产生。修饰的T淋巴细胞含有包含对肿瘤特异性抗原有特异性的抗原结合结 构域的第一嵌合抗原受体和包含对不是肿瘤特异性抗原但与肿瘤发生有关的抗原有特 异性的抗原结合结构域的第二嵌合抗原受体。在该实施例中,使用其CAR被P2A(其许 两个分立的CAR(以基本相等的量)从单一ORF中表达)分隔的单个CAR构建体,将两 种CAR导入修饰的T细胞中。
图2表示包含CAR的构建体。第一构建体“CAR1”包含抗HER2 scFv,接着CD28 铰链、CD28跨膜(TM)结构域、CD3ζ链、T2A序列和tdTomato报道基因。“CAR2”包 含抗HER2 scFv,接着CD28铰链、CD28跨膜(TM)结构域、CD28 IC结构域、CD3ζ 链、T2A序列和tdTomato报道基因。“CAR3”包含人VEGFR2胞外(EC)结构域,接着 VEGFR2 TM结构域、P2A序列、抗HER2 scFv、CD28铰链、CD28跨膜(TM)结构域和 CD3ζ链。“CAR4”包含人VEGFR2胞外(EC)结构域,接着CD28跨膜(TM)结构域、CD28 IC结构域、抗HER2 scFv、CD28铰链、CD28跨膜(TM)结构域和CD3ζ链。
CAR1表示包含一级信号转导结构域(CD3ζ链),但没有协同刺激结构域的第一代抗HER2 CAR。CAR 2表示包含一级信号转导结构域(CD3ζ链)和协同刺激结构域(CD28 IC 结构域)两者的第二代抗HER2 CAR。CAR3是双重CAR对照构建体;它包含HER2一 级信号转导部分(HER2 scFV和CD3ζ链),还包含VEGFR2二级信号转导结构域,但是 二级信号转导结构域没有协同刺激结构域。CAR4是双重CAR构建体;它包含HER2 一级信号转导部分(HER2 scFV和CD3ζ链),还包含具有协同刺激结构域(CD28 IC)的 VEGFR2二级信号转导结构域。
如上所述分离全T细胞,用上述CAR构建体(CAR1-CAR4)转染,在转导后24小时 分析。在用所有的CAR构建体转染的T细胞中检测到抗HER2的表达。在用CAR3或 CAR4转染的T细胞中检测到抗HER2和VEGFR2两者的表达。因此,证实了通过T 细胞适当表达上述CAR构建体。
一旦证实CAR构建体的表达,就将表达构建体的T细胞用HER2-Fc(0.25ug/ml或1.0ug/ml)培养—以诱导含有HER2-scFv的构建体的刺激(一级信号转导)—单独或与抗VEGFR2抗体(0.25ug/ml或1.0ug/ml)或VEGF(1、10或100ng/ml)组合—以诱导含有 VEGFR2的构建体的刺激(协同刺激)。在仅用抗HER2活化观察到的刺激期间,在用 CAR1或CAR2转染的T细胞中,观察到VEGFR2活化不改变表面标志物表达T细胞 活化标志物CD69或CD71(通过流式细胞术评价)。
相比之下,与用仅HER2-Fc刺激的表达CAR4的CAR T细胞中的CD69表达相比, 在用CAR4转染的T细胞中,用HER2-Fc和抗VEGFR2两者刺激导致CD69表达增加。 用在构建体的VEGFR2 CAR(即CAR3)中没有协同刺激结构域的对照双重刺激CAR构 建体(CAR3)转染的T细胞中,未观察到在HER2-Fc刺激时CD69表达上调的这种 VEGFR2介导的增加。具体来讲,与用仅0.25μg/ml HER2-Fc的刺激的CD69
同样,相对于用在构建体的VEGFR2 CAR(即CAR3)中没有协同刺激结构域的对照双重刺激CAR构建体(CAR3)转导的T细胞中的CD69表达水平,在用CAR4转导的T 细胞中,用HER2-Fc和VEGF两者刺激导致CD69表达增加。具体来讲,与仅用0.25μg/ml HER2-Fc刺激时CD69
粒酶B是存在于细胞毒性T淋巴细胞颗粒中的酶。评价了用CAR1、CAR3或CAR4 转染的T细胞的粒酶B分泌。与用任一对照CAR(CAR1或CAR3)转染的T细胞相比, 以0.25ug/mlHER2-Fc/0.25ug/ml抗VEGFR2和0.25ug/ml HER2-Fc/1.0ug/ml抗 VEGFR2的剂量用HER2-Fc和抗VEGFR2刺激时,用CAR4转染的T细胞表达水平提 高的粒酶B。同样,与用任一对照CAR(CAR1或CAR3)转染的T细胞相比,当以0.25 ug/ml HER2-Fc/1ng/ml VEGF和0.25ug/mlHER2-Fc/100ng/ml VEGF的剂量用HER2-Fc 和VEGF刺激时,用CAR4转染的T细胞表达水平提高的粒酶B。
在用与抗VEGFR2抗体或VEGF组合的HER2-Fc刺激后,评价了用CAR1、CAR3 或CAR4转染的T细胞的活力。如上所述分离全T细胞。在培养24小时后,将T细胞 用HER2-Fc(1.0ug/ml)和抗VEGFR2抗体(0.25ug/ml或1.0ug/ml)或VEGF(1ng/ml或 100ng/ml)的任一种刺激48小时。在总共13天的培养后,测定了T细胞的活力。在每 种情况下,相对于用双重对照CAR(即CAR3)或命名为CAR1的对照CAR转染的T细 胞,用双重刺激CAR(即CAR4)转染的T细胞显示活力增加。
该实施例证实了实施例4的结果—可产生包含两种CAR的功能性CAR T细胞,其 信号转导结构域存在于第一种CAR中,协同刺激结构域存在于第二种CAR中—还进一 步证实两种CAR构建体可在CAR T细胞中作为单一构建体表达(例如可以是可用包含 两种CAR的单一CAR构建体转染的T细胞)。
等同内容
本公开内容不限于本文所述具体的实施方案的范围。实际上,根据前面的描述,除所描述的以外本文提供的主题的各种修改对于本领域技术人员而言将是显而易见的。这类修改预期落入随附权利要求书的范围内。
本文引用了各种出版物、专利和专利申请,其公开内容通过引用以其整体结合到本 文中。
- 具有改进特异性的修饰的T淋巴细胞
- 具有改进特异性的修饰的T淋巴细胞
