调节补体系统的方法、制剂及其应用
文献发布时间:2023-06-19 11:54:11
技术领域
本发明属于生物医药领域,具体地,涉及调节补体系统的方法、制剂及其应用。
背景技术
血小板衍生生长因子-D(PDGF-D)是血小板衍生生长因子(PDGF)家族的成员之一,在生理和病理条件下发挥多种功能。研究表明,在很多疾病的病理过程中,PDGF-D促进炎症并增加单核细胞和巨噬细胞的迁移。而抑制PDGF-D则可缓解病理症状,如抑制巨噬细胞的浸润,减少脉络膜新生血管等。这些研究强调了PDGF-D在病理条件下对免疫细胞浸润的影响。然而,PDGF-D是如何诱导炎性细胞活化和迁移的还不是很清楚。另外,用单克隆抗体CR002抑制PDGF-D可减少实验性肾炎模型中C5b-9的沉积,说明PDGF-D对补体系统的功能具有一定的调节作用。不过其中的机制还缺乏深入的研究。
老年性黄斑变性(AMD)是导致中央视力进行性丧失的一个重要原因,如果不加以控制,最终会导致失明,严重影响患者的生活质量。目前针对于AMD的治疗方法主要是集中于对晚期血管新生的干预,效果并不令人满意。AMD病理机制复杂,参与病理过程的因素较多,抑制某个因子后常常由于其他因素的补偿效应而产生耐药性。如利用抗血管内皮生长因子(VEGF)的药物阻断VEGF/VEGFR信号通路的从而抑制血管生成。然而,该疗法只对某些患者是有效的,并且持续时间较短,许多患者需长期、多次向玻璃体内注射药物,这常常会导致耐药性和其他眼部并发症。此外,受到广泛期待的联合抗VEGF(雷珠单抗)和抗PDGF-B(Fovista)疗法在几个关键的III期临床试验中以失败告终。这些事实都提示我们需要对AMD的机制进行更深入的研究以寻找到更多更有效的治疗靶点。
发明内容
本发明的目的在于提供调节补体系统的方法、制剂及其应用,以补充针对补体系统的调节机制。
根据本发明的一个方面,提供一种调节补体系统的方法,通过抑制PDGF-D信号通路以抑制补体系统的活化。
优选地,包括通过抗原抗体免疫反应抑制PDGF-D的表达。
优选地,包括通过基因沉默抑制PDGF-D的表达。
优选地,包括通过抑制PDGF-D受体以抑制PDGF-D信号通路的表达。
根据本发明的另一个方面,提供一种用于调节补体系统的制剂:其活性成分为PDGF-D抑制剂,PDGF-D抑制剂包括PDGF-D受体抑制剂、PDGF-D配体抑制剂中的至少一种。
优选地,PDGF-D配体抑制剂包括靶向PDGF-D的核酸效应分子或单克隆抗体中的至少一种。
优选地,核酸效应分子为shRNA。
优选地,单克隆抗体为单克隆抗体CR002。
优选地,PDGF-D受体抑制剂为crenolanib。根据本发明的另一个方面,提供上述用于调节补体系统的制剂在制备抗炎药物中的应用。
根据本发明的另一个方面,提供上述用于调节补体系统的制剂在制备治疗老年性黄斑变性药物中的应用。
PDGF-D对补体系统的功能具有一定的调节作用,比如,在PDGF-D处于过表达状态时,补体途径的相关基因(如C1q、C3)上调,从而促进炎症反应并诱导脉络膜血管新生。通过抑制PDGF-D的过表达,能够有效地抑制补体系统的活化,进而显著降低了脉络膜新生血管增生以及炎症细胞的活化和迁移。炎症是AMD的一个关键的发病机制,因此,补体系统在AMD的发病机制中起着重要作用,通过控制PDGF-D的表达以调节补体系统,应用靶向PDGF-D的抑制剂制备的药物,不仅具有良好的抗炎作用,还能够对AMD的治疗发挥优良的药物功效。
附图说明
图1为RPE特异性过表达PDGF-D载体;
图2视网膜下注射AAV-GFP或AAV-PDGF-D的小鼠提供的样本的免疫荧光图像;
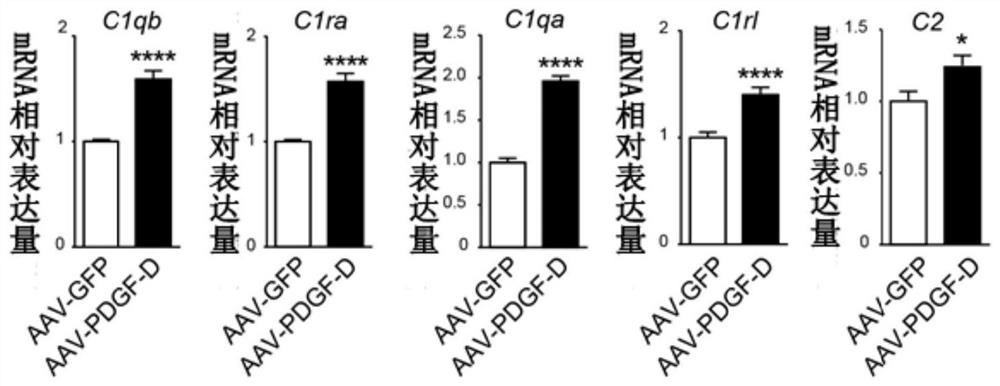
图3为视网膜下注射AAV-GFP或AAV-PDGF-D的小鼠的视网膜或RPE-脉络膜复合体的实时定量PCR检测结果;
图4为视网膜下注射AAV-GFP或AAV-PDGF-D的小鼠的视网膜或RPE-脉络膜复合体的蛋白免疫印迹测试结果;
图5为视网膜下注射AAV-GFP或AAV-PDGF-D的小鼠RPE-脉络膜中与补体途径相关的差异表达基因热图;
图6为PDGF-D诱导小鼠RPE-脉络膜的实时定量PCR结果;
图7为RPE-脉络膜的蛋白免疫印迹检测结果;
图8为RPE-脉络膜的免疫荧光染色图;
图9为对应图8的测试中的C1q表达量;
图10为RPE特异性过表达PDGF-D模型小鼠腹腔注射SB290157后眼球中IBA1表达的免疫荧光染色结果图;
图11为对图10中视网膜和脉络膜IBA1
图12为小鼠在注射SB290157后的M1巨噬细胞极化基因表达量统计图;
图13为小鼠在注射SB290157后的M2巨噬细胞极化基因表达量统计图;
图14为小鼠在注射SB290157后的视网膜和脉络膜的免疫荧光染色结果图;
图15为对应图14的内皮细胞(CD31
图16为小鼠在注射SB290157后的RPE-脉络膜的实时定量PCR结果;
图17为RPE-脉络膜铺片免疫荧光染色结果;
图18为对应图17中的CNV面积(IB4
图19为RPE-脉络膜铺片免疫荧光染色结果;
图20为对应图19中的IB4+和IBA1+细胞定量统计图;
图21为实施例2中构建的激光诱导CNV模型小鼠注射生理盐水前后的C3a含量水平及IBA1
图22为实施例2中构建的激光诱导CNV模型小鼠注射CR002前后的C3a含量水平及IBA1
图23为实施例2中构建的激光诱导CNV模型小鼠注射crenolanib前后的C3a含量水平及IBA1
图24为实施例2中构建的激光诱导CNV模型小鼠注射Vatalanib前后的C3a含量水平及IBA1
图25为实施例2中构建的激光诱导CNV模型小鼠注射Destruxin A5前后的C3a含量水平及IBA1
具体实施方式
为了使本技术领域的人员更好地理解本发明方案,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。
实施例1
1.实验构建方式
1)利用腺相关病毒构建PDGF-D组织特异性过表达小鼠模型
a.构建RPE特导性过表达的腺相关病毒(AAV):利用人VMD2基因转录起始位点上游-598bp至+378bp序列作为视网膜色素上皮细胞(RPE)特异性启动子,并利用PDGF-D基因(NM_025208)的编码序列作为目的片段构建载体,并包装成血清型8型AAV。-80℃保存。
b.小鼠视网膜下注射AAV:局部应用托吡卡胺散瞳,腹腔注射4%水合氯醛(10ml/kg体重)进行麻醉,然后滴加普鲁卡因胺对角膜进行表面麻醉,并使用羧甲基纤维素钠避免角膜干燥。视网膜下注射用无菌5μl注射器(Hamilton,CAT:7633-01),33号针(Hamilton,CAT:7803-05,33/15mm/3),从角膜缘后穿刺进行视网膜下注射AAV-GFP或AAV-PDGF-D(5×10
2)进行转录组学分析确定差异表达基因谱
a.RNA测序:注射AAV后4周处死小鼠并摘取眼球,于体视显微镜下在冰盒上去除眼球周围的结缔组织和肌肉,并快速解剖眼球分离RPE-脉络膜混合体提取RNA进行转录组测序。
b.转录组学分析:使用STAR(v2.4.2a)将测序的原始读数比对到小鼠MM10参考基因组,然后使用RSEM(V1.2.29)生成已知基因模型的FPKM值。用DESeq2(v1.22.2)软件确定差异表达基因。根据每个样本的FPKM确定倍数变化。用以下条件筛选差异表达基因:P值≤0.1,FDR值≤0.1,倍数变化≥1.5,平均FPKM值≥1。使用pheatmap(v1.0.12)生成热图。
3)验证PDGF-D对补体系统的调节作用
a.实时定量PCR检测:用TRNzol试剂(TIANGEN,CAT:DP424)提取总RNA,然后用反转录试剂盒(TIANGEN,CAT:KR116)合成cDNA。配制10μL PCR反应体系后将板放入PCR仪Quantstudio 6K Flex System(Life Technologies)进行实时定量聚合酶链反应。使用软件Quantstudio 12K Flex v1.2.2(Thermo Fisher Science)对结果进行分析。
b.蛋白免疫印迹:蛋白提取使用含有蛋白酶和磷酸酶抑制剂的RIPA裂解缓冲液(Thermo Fisher Science,CAT:A32961)。在还原条件下用SDS-PAGE分离裂解产物,并转移到PVDF膜。用5%脱脂牛奶封闭膜,在4℃下用一抗孵育过夜,然后与辣根过氧化物酶(HRP)偶联的二抗室温孵育1小时。使用以下抗体:anti-C1q(Abcam,CAT:AB182451),anti-C3(Abcam,CAT:200999)。使用Syngene Gbox/Chemi-XT16设备进行曝光检测。
c.免疫荧光染色:取眼球冰冻切片,用0.5%Triton-X100孵育15min,然后用5%正常山羊血清室温封闭1h,一抗4℃孵育过夜。所用一抗为:CD16/32(BD,CAT:553141),CD206(Bio-Rad,CAT:MCA2235GA),IBA1(WAKO,CAT:019-19741),CD31(Bio-Rad,CAT:MCA2388),NG2(Millipore,CAT:AB5320)和α-SMA(Abcam,CAT:AB5694)。然后二抗室温孵育1小时,1μg/ml DAPI孵育10min,封片,用蔡司LSM700激光扫描共聚焦显微镜成像。
d.观察PDGF-D对激光诱导脉络膜新生血管(CNV)模型中补体系统的调节作用:小鼠视网膜下注射AAV后4周,腹腔注射4%水合氯醛(10ml/kg体重)进行麻醉,局部应用托吡卡胺散瞳。用激光在距视神经等距离处制作4个激光光斑,参数为功率90mV,持续时间75ms,光斑大小75μm(Oculight红外激光系统810nm,IRIDEX公司)。激光光凝后在小鼠角膜涂抹抗生素妥布霉素软膏,并将小鼠置于37℃电热毯上直至苏醒后放回动物房。7天后取材进行冰冻切片和免疫荧光染色。
4)观察腹腔注射SB290157对PDGF-D作用效果的影响
a.对RPE特异性过表达PDGF-D小鼠模型进行腹腔注射C3a拮抗剂SB290157:SB290157(MCE,CAT:HY-101502A)溶于无菌二甲基亚砜(DMSO,Sigma,CAT:D4540)配制成200mg/ml存储液,-80℃保存。腹腔注射前用玉米油将储存液稀释至最终浓度20mg/ml。小鼠视网膜下注射AAV后3周,按30mg/kg体重进行腹腔注射SB290157。每2日注射1次,共注射3次后取材进行后续检测。
b.观察对激光诱导CNV模型进行腹腔注射SB290157:小鼠视网膜下注射AAV 3周后,按30mg/kg体重进行腹腔注射SB290157。每2日注射1次,共注射3次后按(3.d)中的方法进行激光光凝,在激光光凝7天后按30mg/kg体重进行腹腔注射SB290157。每2日注射1次,共注射3次后取材进行后续检测。
2.测试结果
1)RPE特异性过表达PDGF-D促进了RPE-脉络膜复合体中补体系统的激活为了在小鼠RPE细胞中过表达PDGF-D,我们构建了由视网膜色素上皮特异性VMD2启动子驱动的表达人PDGF-D的8型腺相关病毒(AAV-PDGF-D)载体(图1)。视网膜下注射AAV-PDGF-D或AAV-GFP(作为对照)4周后,如图2所示,免疫荧光染色显示PDGF-D或GFP分别位于RPE层,表明RPE特异性PDGF-D过表达模型构建成功。实时定量PCR检测视网膜下注射AAV-GFP或AAV-PDGF-D的小鼠视网膜或RPE-脉络膜复合体中PDGF-D的相对mRNA表达,结果如图3所示,在RPE-脉络膜复合体中检测到PDGF-D mRNA的过度表达,而参照图4,蛋白免疫印迹显示PDGF-D蛋白在小鼠视网膜或RPE-脉络膜复合体中过度表达。
我们收集视网膜下注射AAV-PDGF-D后4周的RPE-脉络膜复合体进行转录组学分析,结果显示差异表达基因主要富集于与免疫系统的调节相关的功能,其中补体途径相关基因上调(图5)。实时定量PCR结果(图6)显示PDGF-D诱导小鼠RPE-脉络膜中补体途径基因上调,蛋白免疫印迹(图7)显示PDGF-D促进RPE-脉络膜中C1q和C3的表达,由此证实了经典和替代补体途径的激活。免疫荧光染色(图8、9)进一步证实PDGF-D过表达样本的RPE-脉络膜中都大量C1q表达。
2)抑制补体系统可以有效抑制PDGF-D异常表达诱导的炎症及血管新生
为了测试了阻断补体激活是否可以有效控制PDGF-D的促炎症以及促新生血管效应,我们对上述RPE特异性PDGF-D过表达模型小鼠进行腹腔注射C3a受体拮抗剂SB290157,参照图10、11,SB290157的注射显著降低了视网膜及脉络膜中巨噬细胞(IBA1+)的浸润,并且抑制了RPE-脉络膜复合物中M1和M2巨噬细胞极化标志物的表达,图12、13显示了SB290157抑制了PDGF-D诱导的M1(图12)和M2(图13)巨噬细胞极化基因的上调。
此外,内皮细胞和壁细胞的免疫荧光染色结果(图14、15)显示,在SB290157的作用下,SB290157减少了内皮细胞(CD31+)和血管壁细胞(α-SMA+)的数量,即血管密度和平滑肌细胞覆盖率显著降低,相关促血管新生的基因表达水平也明显下降(图16)。
3)SB290157可以有效缓解PDGF-D促进的病理性血管新生
如图17、18所示,RPE-脉络膜铺片免疫荧光染色显示AAV-PDGF-D增加了激光诱导CNV的面积和IBA1+巨噬细胞的数量,由此说明,脉络膜下注射AAV-PDGF-D能促进激光诱导脉络膜新生血管模型中CNV的面积并显著促进免疫细胞的浸润。重要的是,如图19、20,腹腔注射SB290157降低了新生血管病变中的免疫细胞密度(IBA1+巨噬细胞数量)并且抑制CNV(减少了CNV面积)。综上所述,SB290157可以有效缓解PDGF-D促进的病理性血管新生。
上述实验结果说明,PDGF-D过表达通过激活补体系统,从而诱发炎症及血管新生产生。
实施例2
实施例1的实验结果表明,PDGF-D的过表达通过激活补体系统,进而诱发炎症和血管新生的产生,在补体系统中,C3是含量最多、最重要的一个组成部分,它是补体两条主要激活途径的中心环节,对于炎症的发生发展具有重要意义。研究显示,无论是AMD病人还是动物模型中,C3在疾病的早期进程中出现明显上升而在后期恢复正常水平,提示补体系统在调节AMD病理进程中发挥着重要作用。本实施例通过构建AMD常用模型激光诱导脉络膜新生血管(CNV)模型,验证不同时间点抑制PDGF-D信号通路对补体系统、实验模型的炎症及血管新生情况所产生的影响。
1.实验构建方式
1)观察抑制PDGF-D通路对激光诱导CNV模型(laser-CNV)中补体系统的调节作用:向野生小鼠玻璃体腔注射CR002或crenolanib抑制PDGF-D信号通路,1天后构建激光诱导CNV模型,激光光凝后第4h,12h,24h取材进行qPCR和western blot实验检测补体系统的活化水平,剩余小鼠在光凝后分别注射不同次数的CR002或crenolanib,并于光凝后第7天取材进行冰冻切片和免疫荧光染色检测,以观察抑制PDGF-D对激光诱导CNV模型不同病理阶段的补体系统、炎症水平以及脉络膜新生血管的影响。
2)玻璃体腔注射药物抑制VEGF/VEGFR信号通路:向玻璃体腔注射Vatalanib(PTK787)从而抑制VEGF/VEGFR信号通路,1天后构建激光诱导CNV小鼠模型,光凝后第4h,12h,24h取材进行qPCR和western blot实验检测补体系统的活化水平,剩余小鼠在光凝后分别注射不同次数的Vatalanib,光凝后第7天取材进行冰冻切片和免疫荧光染色检测,以观察抑制VEGF/VEGFR信号通路对激光诱导CNV模型不同病理阶段的补体系统、炎症水平以及脉络膜新生血管的影响。
3)玻璃体腔注射药物抑制PDGF-B信号通路:向玻璃体腔注射Destruxin A5从而抑制PDGF-B信号通路,1天后构建激光诱导CNV小鼠模型,激光光凝后第4h,12h,24h取材进行qPCR和western blot实验检测补体系统的活化水平。剩余小鼠在光凝后分别注射不同次数的Destruxin A5,光凝后第7天取材进行冰冻切片和免疫荧光染色检测,以观察抑制PDGF-B对激光诱导CNV模型不同病理阶段的补体系统、炎症水平以及脉络膜新生血管的影响。
4)对照组设置方式:向玻璃体腔注射生理盐水以构建对照组,1天后构建激光诱导CNV小鼠模型,光凝后第4h,12h,24h取材进行qPCR和western blot实验检测补体系统的活化水平。剩余小鼠在光凝后分别注射不同次数的生理盐水,光凝后第7天取材进行冰冻切片和免疫荧光染色检测,观察激光诱导CNV模型不同病理阶段的补体系统活化水平、炎症水平以及脉络膜新生血管情况。
5)实验结果表征方式
本实施例所涉及的实时定量PCR检测、蛋白免疫印迹、免疫荧光染色、激光光凝的处理方式与实施例1保持一致,在此不再赘述。
2.测试结果
在本实施例所构建小鼠模型中,对照组的实验鼠在注射生理盐水之后,其补体系统活化水平在激光光凝后4小时即开始升高,12小时到达峰值,3天后炎症等临床症状不仅没有缓解而且有恶化的趋势。相对而言,分别通过注射CR002、crenolanib、Vatalanib、Destruxin A5都能够起到对AMD炎症表现起到一定的缓解作用。通过对比图21~25,相对而言,对小鼠模型进行CR002、crenolanib注射后对补体系统的抑制效果(C3a表达水平下降)最强烈,对免疫细胞密度(IBA1+巨噬细胞数量)水平所起到的下降效果更为显著,与上述两种处理方式相对应的AMD炎症临床表现的好转也更为明显。在注射3次以后,分别对应CR002、crenolanib注射的实验组小鼠的AMD炎症表现基本消失。然而,对应Destruxin A5注射的实验小鼠的炎症表现在注射5次以后才基本消失,而对应Vatalanib注射的实验小鼠虽然注射3次后血管新生得到有效缓解,但依然有炎症表现。而且,在停药之后,分别对应CR002、crenolanib注射的实验组小鼠没有复发,而分别对应Vatalanib、Destruxin A5注射的实验小鼠均有复发的情况出现。
上述实验结果说明,通过抑制PDGF-D的表达能够有效缓解补体系统激活所导致的AMD炎症。
以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
- 调节补体系统的方法、制剂及其应用
- 靶向特异性补体系统抑制剂、其制备方法及应用
