在多核苷酸链上编码数据的方法
文献发布时间:2023-06-19 11:55:48
技术领域
本发明一般涉及在多核苷酸上编码数据的方法。本发明还涉及读取在多核苷酸上编码的数据的方法。方法涉及使多核苷酸链相对于纳米反应器移动;并且当多核苷酸链的部分移动通过纳米反应器时选择性修饰所述部分。在多核苷酸链上的选择性修饰的模式在多核苷酸链上编码数据。本发明一般还涉及用于在多核苷酸链上编码数据的系统;用于读取在多核苷酸链上编码的数据;和数据编码/数据读取平台。
背景技术
持续需要存储数据。一些计算预测到2025年全球数据存储需求为大约175泽字节。这类存储需求将越来越依赖于新技术来有效地编码和检索数据。
另外需要在延长的时间尺度内有效地存储数据。然而,当今用于存储数据的物理介质随时间推移易于恶化,从而导致相关联的数据保真度损失。
已经提出解决这种需求的一种方法是使用多核苷酸(如DNA)编码数据以用于长期数据存储。
最早在20世纪60年代就提出将数据存储在多核苷酸(如DNA)上的概念,并且近年来,人们进行许多努力来证明在DNA上读取和写入数据的可行系统。
迄今为止,大多数尝试都集中在从头合成编码数据的DNA序列。举例来说,二进制数据可编码为DNA嵌段。可通过常规手段如氨基磷酸酯化学在体外合成DNA嵌段。这类DNA嵌段可包括辅助信息,如地址序列、扩增或测序标签等。为了编码大量数据,使用多个嵌段,其中嵌段根据其地址序列进行排序。然而,这类编码步骤非常缓慢并且昂贵。特别地,这类编码步骤可受到DNA合成的限制。已经提出各种方法来解码由此编码的数据。一些方法涉及DNA的扩增,随后是常规测序技术,如Sanger测序。然而,这类方法对于大规模数据存储和读取为不可行的,因为吞吐速度为有限的;加上涉及的扩增步骤可引入错误。已经提出下一代测序方法,但是没有克服编码/合成步骤中的固有局限。
因此,需要使用多核苷酸(如DNA)的改进的数据存储方法。特别需要避免与已知方法相关联的缺点的方法,如需要通过从头合成来合成DNA的嵌段;组合DNA嵌段以允许存储大量数据;或扩增DNA以进行数据检索。本发明解决这些需求中的一些或全部。
发明内容
发明人已经认识到,通过控制多核苷酸链相对于纳米反应器的移动,并且当多核苷酸链的部分在纳米反应器内移动时选择性修饰所述部分,可在多核苷酸链上编码数据。多核苷酸链的修饰确定在分析修饰的链时获得的信号的特征。因此,对链的修饰可在链上编码数据。
发明人已经发现将多核苷酸链的待修饰的部分限制在纳米反应器中为特别有益的。链的部分通过纳米反应器的受控移动允许以极高的准确度对链的特定区域进行受控修饰。因此修饰的特定区域允许在链上编码数据。此外,可以可靠地并且以高速率修饰多核苷酸链。
因此,本发明的方法通过将多核苷酸限制在纳米反应器中而利用可以的精确控制。举例来说,纳米反应器可将多核苷酸限制在单一维度上,使得对多核苷酸的修饰被限制在所述维度上。多核苷酸在纳米反应器内的受控移动和位置允许数据以极高的精度在多核苷酸链上编码数据。控制和速率的组合典型地远优于涉及从头合成用于编码数据的多核苷酸的现有技术。
使用本发明的方法可以实现长的写入长度。尽管近年来有一些有限的改进,但是长链DNA仍然不可在相邻单元中可靠地从头合成。而是,这类链典型地由较小的片段在合成后组装在一起。本发明的方法没有这类限制。长的多核苷酸链可相对于纳米反应器移动,并且当多核苷酸链的部分移动通过纳米反应器时可选择性修饰所述部分。因此,在本发明的方法中可寻址长度为千碱基、兆碱基或甚至数十或数百兆碱基的链。
如下面更详细地讨论的,在本发明中用于编码数据的多核苷酸链可为天然存在的(例如,从天然存在的或修饰的生物体中提取)或可合成产生。然而,即使在本发明的方法中使用合成的多核苷酸链时,也不需要将这些链逐个单体地合成。相比之下,长的多核苷酸链可通过串接长的重复单元来产生。与需要不同多核苷酸链的受控组装的技术相比,这类反应要简单得多并且更易于扩展。换句话说,本发明的方法为有利的,因为它们不需要合成并且随后组合多核苷酸的多个不同小单元,或者不需要为了编码数据而“逐个碱基”地合成多核苷酸。
本发明的方法允许将天然或合成产生的多核苷酸用作数据存储介质,并且进行修饰以便在多核苷酸上编码数据。本发明的方法允许以极高的效率编码数据。多核苷酸链通过纳米反应器的受控移动可极其快速。举例来说,多核苷酸链可以每秒数百或数千个碱基或甚至更快的速率可控制地穿过纳米孔。此外,通过使用可单独寻址的纳米反应器阵列,过程几乎可无限扩展。举例来说,纳米反应器阵列可含有数百至数千或甚至数百万个可独立寻址的纳米反应器。此外,使用非常长的多核苷酸链的能力当然也意味着可编码更多数据。
本发明的方法的另外的优点是通过将数据编码到多核苷酸链上,记录的数据密度可非常高。其中以单分子水平读取在多核苷酸链上编码的数据的本发明的实施例还可允许以极高的准确度读取数据。
因此,本文提供在多核苷酸链上编码数据的方法,其包含:
(A)使多核苷酸链相对于纳米反应器移动;和
(B)当多核苷酸链的部分移动通过纳米反应器时选择性修饰所述部分;
其中在多核苷酸链上的选择性修饰的模式在链上编码数据。
链相对于纳米反应器可控地移动。多核苷酸链的选择性修饰的部分典型地对应于由此编码的数据单元。
典型地,纳米反应器包含纳米孔。纳米反应器可包含围绕纳米孔的纳米体积。纳米孔可为跨膜蛋白纳米孔、固态纳米孔、DNA折纸孔或基于聚合物的塑料孔,例如,纳米孔可为跨膜β-桶蛋白孔。
本发明涉及修饰多核苷酸链。对多核苷酸链进行的修饰典型地不更改多核苷酸链的总长度;即,数据在多核苷酸链主链上编码,而不涉及向多核苷酸链中添加单体单元或从多核苷酸链中去除单体单元。
可对多核苷酸链进行任何合适的修饰。举例来说,修饰可为表观遗传修饰。选择性修饰多核苷酸链的部分可包含使纳米反应器中的多核苷酸链的部分经受包含以下的反应条件:(i)一种或多种化学试剂的存在、不存在或浓度;(ii)在酶修饰多核苷酸链内的核苷酸的条件下使酶与多核苷酸链接合;(iii)电磁辐射的存在或不存在;和/或(iv)施加热量的存在或不存在。
本发明的方法可另外包含以下步骤:
(C)确定在多核苷酸链上的选择性修饰的模式。
在这类方法中,确定在多核苷酸链上的选择性修饰的模式通常包含确定对多核苷酸链进行的修饰的存在、不存在、程度或特性。以此方式,可读取在多核苷酸链上编码的数据。本发明的方法可包含表征修饰的多核苷酸链。除了在多核苷酸链上编码的数据之外,还可确定多核苷酸链的特征。举例来说,可确定多核苷酸链的序列。确定在多核苷酸链上的选择性修饰的模式和/或表征修饰的多核苷酸链典型地包含使检测器与修饰的多核苷酸链接触,使得多核苷酸链相对于检测器移动;和当多核苷酸链相对于检测器移动时进行指示修饰的多核苷酸链的一个或多个特性的一个或多个测量。检测器通常为跨膜孔;并且在其中纳米反应器为跨膜孔的本发明的实施例中,检测器可为与纳米反应器相同的跨膜孔。
本文还提供
-一种修饰多核苷酸链的方法,其包含:
(A)使多核苷酸链相对于纳米反应器移动;和
(B)当多核苷酸链的部分移动通过纳米反应器时选择性修饰所述部分;
其中任选地,方法、多核苷酸链、纳米反应器和/或进行的选择性修饰如前述权利要求中任一项所定义。
-一种用于在多核苷酸链上编码数据的系统,系统包含纳米反应器,纳米反应器被配置成当多核苷酸链移动通过纳米反应器时选择性修饰多核苷酸链的部分;
-一种用于读取在多核苷酸链上编码的数据的系统;系统包含检测器,检测器被配置成当多核苷酸链相对于检测器移动时确定在多核苷酸链上的选择性修饰的模式;
-一种数据编码/数据读取平台,其包含:
i)纳米反应器,其被配置成当多核苷酸链移动通过纳米反应器时选择性修饰多核苷酸链的部分;
ii)任选的存储装置,其用于存储在纳米反应器中修饰后的多核苷酸链;和
iii)检测器,其被配置成当多核苷酸链相对于检测器移动时确定在多核苷酸链上的选择性修饰的模式;
-一种纳米孔和/或围绕纳米孔的纳米体积作为纳米反应器的用途,其用于当多核苷酸链相对于纳米孔移动时选择性修饰多核苷酸链的部分;和
-一种数据存储介质,其包含选择性修饰的多核苷酸,其中所述修饰的多核苷酸可使用本发明的方法获得。
本文公开的系统允许迅速读取这类修饰的(编码的)多核苷酸,并且准许迅速检索存储在其中的数据。
本文还提供选择性修饰在纳米反应器内的多核苷酸链的方法。在一些实施例中,多核苷酸链和纳米反应器如本文所述。
附图说明
应当理解,附图是为了说明的目的,而不旨在限制。
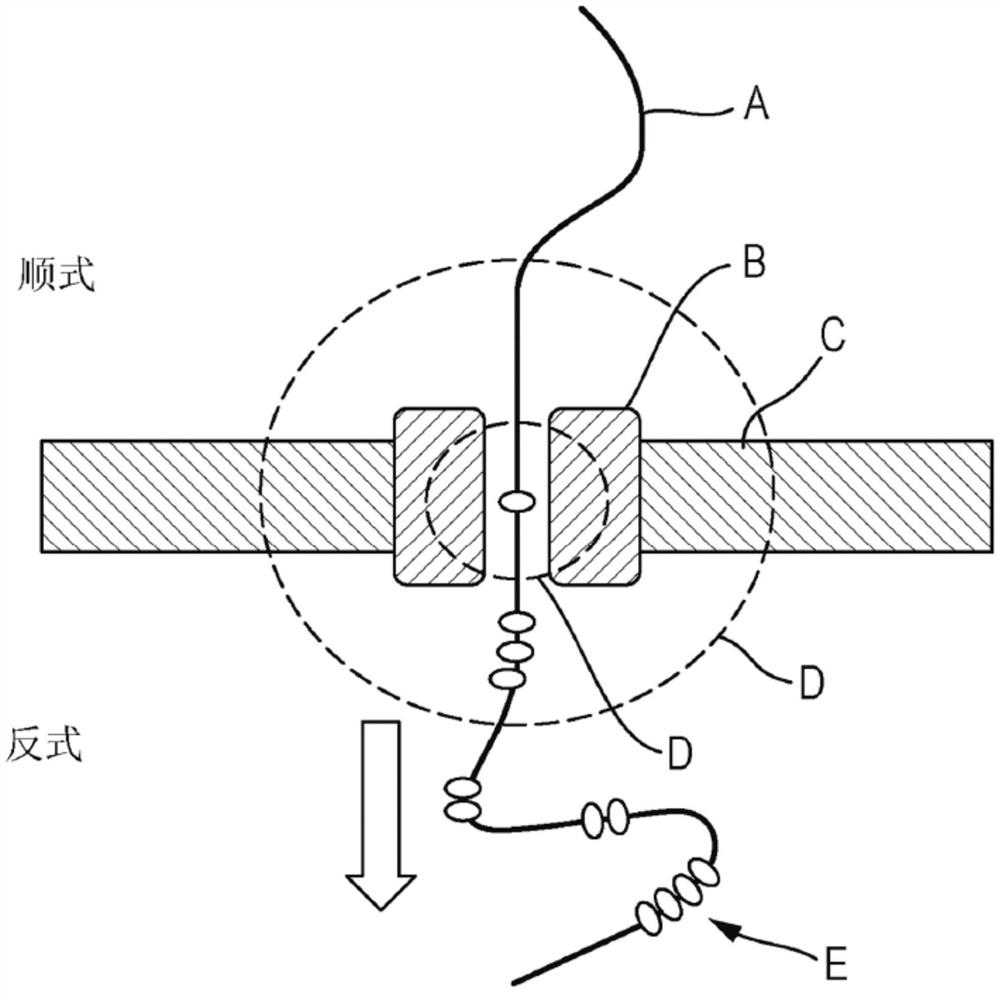
图1示出用于选择性修饰聚合物(如DNA)的纳米反应器的示意图。所述图示出可如何在修饰在纳米反应器内的多核苷酸区域的条件下使聚合物(A)如多核苷酸(如本文中更详细描述的)与纳米反应器接触。举例来说,纳米反应器可为膜(C)中的纳米孔(B),其分离标记为顺式和反式的两个隔室。如本文中更详细描述的,纳米孔可为膜中的纳米通道、纳米缝、纳米腔等。纳米反应器可为围绕纳米孔的纳米体积。围绕纳米孔的纳米体积也称为反应区域(D)。相对于纳米反应器移动聚合物,使得随时间推移,聚合物的不同区域可暴露于反应区域。举例来说,可通过使聚合物穿过跨越膜的纳米孔易位而使聚合物相对于纳米孔移动。可例如通过本领域已知的各种手段来实现受控移动,包括使用跨越膜的施加化学电位、跨越膜的施加电压、酶马达(为清楚起见未示出)。反应区域中的聚合物区域可在聚合物通过纳米孔易位时通过化学方法在纳米孔的通道中或附近进行修饰。因此,通过控制聚合物的移动和化学反应的时序,可以选择性修饰聚合物以产生修饰的聚合物(E)(例如修饰的DNA)。为了数据存储的目的,聚合物上修饰位置的控制可用于编码数据。举例来说,可通过将修饰模式对未修饰的数据选择性修饰到聚合物中来编码数据。
图2说明一些示例性方式,其中电磁辐射(如光)可用于控制化学反应以修饰多核苷酸。(A)电磁辐射可施加到纳米反应器(例如,纳米孔或围绕纳米孔的体积),其中在纳米反应器内发生条件改变以促进其中的多核苷酸区域的反应性,从而修饰在纳米反应器内的多核苷酸。(B)电磁辐射可用附接的光敏剂(例如,图2中标记为np的纳米颗粒,如金或量子点)施加到纳米反应器(例如,纳米孔或围绕纳米孔的体积)。活性光敏剂在使得能够对多核苷酸的附近部分进行反应性修饰的条件下产生局部改变。(C)电磁辐射可施加到固定在纳米反应器(例如,纳米孔或围绕纳米孔的体积)内部的光敏剂。
如所描述的纳米反应器的照射可用于在局部反应区域中产生不同改变。举例来说,金颗粒或金等离子导向器可用于产生局部加热。金颗粒或金等离子导向器也可用于改变局部电条件,从而改变附近带电分子(如多核苷酸)和溶液中离子的相互作用。可替代地,量子点颗粒或许多有机分子可用于重新发射辐射。量子点或许多有机分子的照射也可在存在或氧化性化学物质的情况下产生反应性氧物种(ROS)。局部条件的改变可直接或与溶液中的反应性物种组合使用,以控制附近反应区域中的反应性,从而选择性修饰多核苷酸链的一部分。
图3说明为了控制化学反应以修饰纳米反应器中的聚合物的目的而使用电压来控制化学试剂递送到或通过纳米反应器(例如,纳米孔)的一个实例。所述图说明例如在膜的相对侧上最初分离使得不可发生反应(标记为非活性状态)的两种交叉反应的反应物(A)和(B)的简化实例。通过纳米反应器(例如,纳米孔)更改离子条件,例如通过调节跨越膜的施加电压(在图3中标记为活性状态),可用于将反应物A和B驱动到纳米反应器中(在图3中描绘为纳米孔,尽管这不具有限制性)。
反应物A和B旨在为说明性的,并且不具有限制性。系统中可存在单一类型的反应性物种,或多种类型的反应性物种。一些反应性物种最初可共定位在纳米反应器外部(例如,氧化剂可与保护性清除剂共定位)。每种类型或反应物可为单个实体(例如,马达酶或反应性酶),或多个分子(例如,以相对较高浓度溶解的离子)。
使得反应物能够在活性状态下彼此共定位可用于控制多核苷酸的移动。举例来说,可施加电压以驱动金属辅因子离子(例如反应物A)穿过纳米孔的相对侧上的马达酶(例如反应物B,优选作为结合到多核苷酸的单一酶,未在图中示出),以使得NTP能够水解以控制多核苷酸的易位
使得反应物能够在活性状态下彼此共定位可用于产生反应性条件,以选择性修饰反应区域中的多核苷酸的部分。修饰多核苷酸的反应物的实例包括例如将离子(例如金属辅因子离子)与反应性小分子(例如单电子氧化剂)组合,或将离子(例如金属辅因子离子)与反应性酶(例如DNA-甲基转移酶)组合。
图4说明使用电压用于控制纳米反应器(如纳米孔)中的化学反应物的浓度的一个实施例。在图4中,施加到反式隔室的正电压驱动带正电荷的辅因子金属离子(标记为M
图4还示出M
选择性修饰纳米孔中的多核苷酸的部分的反应性的电压控制可与多核苷酸通过纳米孔的近似恒定受控移动组合,以将修饰的模式编码到多核苷酸中,例如以编码数据。举例来说,图4说明可如何使用进行性酶马达(如解旋酶)以近似恒定的速度使多核苷酸移动通过纳米孔,并且可以高/低调制电压以分别将修饰/未修饰的模式编码到多核苷酸中。在此系统中,必须确保在反应性辅因子M+/Ox和酶燃料辅因子M+/NTP之间存在有限的交叉反应性以用于NTP水解。可替代地,多核苷酸可通过非酶促的、电压无关的手段(如经由磁珠)来控制。
图5示出多核苷酸的移动可如何通过使用太大而无法完整穿过孔的二级结构通过纳米反应器(如纳米孔)来控制的一些实例。当遇到孔时,二级结构使链暂停,直到施加足够的力(例如通过施加电压)以克服杂交并且使链解缠,然后它可滑动到序列中的下一个二级结构元件。如这样的重复序列可使用已知方法设计,并且通过合成手段,例如通过将相同的小的合成寡核苷酸的单元串接在一起来构建。A)双链多核苷酸的短区段(其中双链太大而无法通过)可用于使多核苷酸暂停。B)多核苷酸中的发夹可用于使多核苷酸暂停。C)多核苷酸中的四链体结构可用于使多核苷酸暂停。可更改结构的强度,以控制使结构解缠所需的力的大小。因此,在低电压下,结构可无限期地固定多核苷酸。在高电压下,二级结构可快速解缠以使链前进。在中间电压状态下,二级结构将在前进之前暂停一段时间。
图6示出二级结构(四链体)的移动控制可如何与基于光的修饰组合以选择性修饰多核苷酸的区域。通过电压的反馈控制,组合精心设计的二级结构元件,可以控制多核苷酸的移动,使多核苷酸在多核苷酸的区域之间向后或向前前进。当暂停时,然后可例如通过用光照射来选择性修饰这些区域,以在多核苷酸中产生修饰模式。
在此方案中,也可以将多核苷酸再次向后移动。举例来说,这可用于重复失败的修饰,或重新读取链以读取在其上编码的数据。
图7说明其中当修饰(通过用光照射)以恒定的规则时段发生时电压可用于选择性控制多核苷酸的移动的实例。所述图示出拉出纳米孔的多核苷酸,其中被动分子制动器减慢移动。在低电压下,移动可减慢或暂停,并且在高电压下,多核苷酸可通过酶制动器快速拉动。以此方式可以根据需要使多核苷酸在纳米孔中前进和暂停,以控制暴露于反应区域的多核苷酸的部分。位置控制以恒定频率组合周期性修饰条件(例如,用光照射以在纳米孔中产生修饰核苷酸的反应性氧物种,在图7中,当灯熄灭时标记为A并且当灯亮时标记为B)使得能够沿多核苷酸产生受控的修饰模式。
图8示意性地说明在纳米孔纳米反应器中接头的断裂,从而导致链裂解。图8A示出由在纳米孔中捕获封端的DNA链(例如由链霉亲和素终止的DNA链)表示的最初状态。当用正确频率的光照射时,接头裂解(图8B),这导致随后不久的自发链损失(图8C),因为链太短而无法在施加电压条件下保持结合。然后,现在未被占用的孔从溶液中捕获新的完整底物,返回到图8A中所描绘的状态,并且可重复所述过程。图8证明纳米孔内的多核苷酸链的光介导的修饰。基于多核苷酸链的光修饰断裂,尤其是多核苷酸链的侧链断裂的策略可用于本公开的方法中。
图9示出来自图8所述的断裂过程的代表性实验性离子电流对时间数据,但是其中多核苷酸底物不包含光可裂解的接头(例如,其中多核苷酸底物为链霉亲和素封端的聚-T链,如实例中所述)。图9A示出捕获测试DNA分析物的单个纳米孔的典型离子电流对时间迹线。G为测试分析物的开放孔水平并且H为阻断水平。图9B示出冲洗掉测试分析物后的孔电流(I1)。图9C示出添加反应测试底物之后的数据,其中电流下降到表示捕集封端的多核苷酸链的水平J1。链保持永久性地被捕集,因此在没有照射的情况下,阻滞为永久性的。图9D示出UV照射的时段。J2指示捕集的DNA链的捕获电流水平。标记为K的线指示短暂UV脉冲的时序。L指示由于UV照射而导致的捕集链水平的漂移。图9D指示由于对照(例如polyT)底物的多个UV脉冲而没有捕获链的损失。数据在实例中讨论。
图10示出与图9类似的数据和标记。然而,在图10中,多核苷酸链含有可光裂解的接头。与图9相比,在图10D中可看到显著差异。与其中在照射后没有链的损失的图9的非可光裂解样品不同,在具有可光裂解接头的此样品中,链几乎立即损失(标记为M),随后在高百分比的UV脉冲中从溶液中捕获另一条未裂解的链。图10证明多核苷酸链在孔上(即在纳米反应器内)的成功修饰。数据在实例中讨论。
图11说明借助于马达蛋白(有凹口的圆)通过纳米孔的受控移动的多核苷酸底物的制备。所述图示出缀合在一起以形成底物的组分,包含纳米孔测序衔接子“RAP”、种子组分A、中心主单元B的n个重复单元和尾部单元C。还示出重叠的互补链“DW088”。
图12说明多核苷酸底物(例如,图11中所示的底物)通过纳米孔纳米反应器的马达蛋白控制的移动。如图所示,马达蛋白和电压可一起用于控制多核苷酸通过孔的易位,并且在需要时使期望的区段暂停在纳米孔中。
在施加电压下在纳米孔纳米反应器中最初捕获后,多核苷酸将易位,直到接触停滞在“停滞位点”的马达蛋白(图12A)。在向反式施加高正电压的情况下,马达蛋白将被推过停滞位点并且继续控制DNA通过纳米孔的移动(图12B)。当施加电压高时,马达蛋白将继续穿过其在链的重复B单元中遇到的所有后续停滞位点。当电压下降到较低的保持电压时,例如在期望的时间点,马达蛋白将不能够克服其遇到的下一个停滞,由此使底物通过纳米孔纳米反应器的易位停滞并且在低电压时段的持续期间使特定的B单元在纳米孔纳米反应器中暂停(图12C>图12A)。在需要时,可再次增加电压,使马达蛋白通过停滞继续DNA易位。因此,通过控制电压,可以暂停和恢复底物通过纳米孔的移动。
图13示出图12中描述的移动的代表性实验性离子电流对时间数据以及由图11中描述的由RAP+A+(B)n+C单元构成的串接DNA链。使用基准测序条件和自定义电压控制脚本在MinION上获取数据。
图13示出串接DNA底物通过纳米孔的捕获和后续移动控制的典型实例。在(a)处,首先在高电压V1(在此实例中为+180mV)下捕获底物,直到马达蛋白接触纳米孔的顶部,导致特征性的电流阻断降低。马达蛋白防止另外的易位,直到其被施加电压的力推过第一停滞。在停滞时的短暂暂停后,将马达推过停滞,并且当马达蛋白在ATP燃料受控移动下将DNA进料到纳米孔中时,观察到“RAP+A”信号穿过纳米孔。当电压保持在V1时,马达蛋白在每个停滞的短暂暂停后继续行进通过“Bn”单元中的后续停滞位点。停滞位点产生特征性的大电流偏转(e),如下面的缩放所指示。暂停标记为(d)。
当电压降低到点(b)处的保持电压V2(例如+60mV)时,穿过孔的离子电流立即下降,并且较低电压施加的力减小导致马达蛋白不能够克服其遇到的下一个停滞位点。在V2时段期间,电流信号的缺乏改变明显地指示DNA链停滞,并且在马达蛋白的控制下不再穿过孔。当电压在点(c)处再次增加到V1时,马达蛋白在短暂暂停后被推过停滞,并且继续沿链行进并且通过(B)单元中的后续停滞位点。此处使用的DNA在C单元上的DNA的3'末端没有结合到链霉亲和素,因此链在到达末端时离开孔。数据在实例中讨论。
此图说明电压改变可如何用于控制多核苷酸(如DNA)在纳米反应器(如纳米孔)中的移动和停滞,由此使得能够控制哪些单元长时间保持在纳米孔中。这可用于例如使DNA沿链在期望位置停滞足够的时间,以施加反应以仅修饰纳米孔中或附近的期望单元,以例如编码修饰的模式以将数据编码到DNA链中。
图14示出在CsgG纳米孔中捕获polyT背景中含有3个鸟嘌呤碱基的单链DNA多核苷酸的代表性电流阻断。链在纳米孔中被捕获5'末端,并且被捕集与DNA上的3'生物素结合的traptavidin,使得鸟嘌呤碱基位于纳米孔的中心收缩部附近。如图所示,电流阻断的幅度指示鸟嘌呤碱基的状态。图14示出3个样品的代表性捕获事件(离子电流对时间):图14A:未处理的DNA样品,其在polyT背景中含有3个鸟嘌呤碱基;图14B:与图14A相同的样品,但是在敏化剂核黄素的存在下暴露于UV照射;和图14C:阳性对照样品,其DNA在与图14A中未修饰的dG碱基相当的位置处含有3个8-氧代-dG碱基。如图14所说明,来自经处理的样品B)的阻断水平与8-氧代-dG对照C)的阻断水平相匹配,因此指示照射已修饰在纳米孔纳米反应器内的链。
图15示出为了编码数据的目的具有可光裂解的侧链化学性质的多核苷酸底物可如何通过光介导的光裂解来修饰。图15示出串联多核苷酸底物的“B”部分的实例,如图11所示的底物,其在链中的给定位置处含有可修饰的侧链部分“R”(图15A)。图15B示出附接到DNA,例如DNA多核苷酸的主链的可光裂解分子的实例。图15C示出在用正确波长的光照射时,分子经历光裂解。
图16示出通过对纳米孔中的可光裂解的侧链进行选择性光裂解来选择性修饰串联DNA底物的一个单元(如图15中所述的一个单元)的示意图。图16A示出保持在纳米孔中的底物,例如在低电压下暂停,其中可光裂解的侧链R定位在光敏剂(标记为S)附近。在照射整个纳米孔系统后,敏化剂吸收入射辐射并且以不同的波长局部重新发射辐射。可光裂解的侧链不吸收入射的全局波长,并且仅对来自敏化剂的局部重新发射辐射敏感,这导致如所指示的光裂解和侧链分子的损失。(图16B)。纳米孔中此单元之外的底物的其余部分上的其它可光裂解的R基团(未示出)距离敏化剂更远,并且没有暴露于足以使得能够光裂解的辐射。
图17示出例如在MinION芯片上的通道阵列中来自3个通道(通道1、通道2和通道n)的代表性离子电流对时间数据。每个通道使用电极和电路系统独立寻址,从而使得能够单独控制到所述通道的施加电压。举例来说,在采用MinION ASIC的一些实施例中,使用解锁电路系统根据需要在保持电压(V2)和全局电压(V1)之间独立地切换每个通道。在一些实施例中,如具有主动监视和反馈控制的Oxford Nanopore MinKNOW软件的软件用于独立地实时监视电流水平。在一些实施例中,软件监视电流水平以对每个通道中的DNA底物的向前移动进行测序和检测,并且根据需要切换电压,以便编码预定的数据模式。如在重复单元下的图所指示,通道1被设置为将[000110…]编码到链中,通道2被设置为将[10010…]编码到链中并且通道n被设置为将[01010…]编码到链中。这将在实例中进行更详细的描述。
图18示出用于对λ噬菌体DNA的3.5千碱基区段进行纳米孔测序的典型实验性离子电流对时间信号。在MinION流通池(牛津纳米孔技术(Oxford Nanopore Technologies))上使用FLO-MIN106化学对多核苷酸进行测序。所述图标记鸟嘌呤残基的位置,其以高密度跨越序列扩散。鸟嘌呤可更容易地在图18的下图中的缩放区段中挑选出来,这是为了方便参考而提供的。
图19示出借助于马达蛋白当多核苷酸的部分在纳米孔中或附近从顺式向反式移动通过纳米孔时选择性修饰所述部分的示意图。多核苷酸含有嘌呤碱基,例如通过天然DNA分布的鸟嘌呤碱基。通过将系统照射到修饰的鸟嘌呤(G*),例如8-氧代-鸟嘌呤或其它氧化的鸟嘌呤产物,仅将与敏化剂(S)相邻的纳米孔中的鸟嘌呤碱基(标记为G)修饰。
图20说明以近似恒定速率移动通过纳米孔的λ噬菌体dsDNA的片段,所述片段用不规则的反应信号修饰以在链中产生独特的修饰模式。以不规则的间隔施加反应条件,例如由适当的光源照射,以修饰如所指示的链长的标记鸟嘌呤碱基的部分,以便编码唯一的模式以存储数据。
具体实施方式
应当理解,所公开的方法和产品的不同应用可以针对本领域的特定需求。还应当理解,本文所用的术语仅出于描述方法和产品的特定实施例的目的,而不旨在进行限制。
另外,如在本说明书和所附权利要求中所使用的,除非内容另外明确指明,否则单数形式的“一种(a)”、“一个(an)”以及“所述(the)”均包括复数对象。因此,例如,提及“多核苷酸(a polynucleotide)”包括两个或更多个多核苷酸,提及“跨膜孔(a transmembranepore)”包括两个或更多个孔,等等。
本文引用的所有出版物、专利和专利申请,无论是上文还是下文,均通过引用整体并入本文。
通用方法
发明人设计一种在多核苷酸链上编码数据的方法,其包含:
(A)使多核苷酸链相对于纳米反应器移动;和
(B)当多核苷酸链的部分移动通过纳米反应器时选择性修饰所述部分;
其中在多核苷酸链上的选择性修饰的模式在链上编码数据。
多核苷酸可为在本文中更详细描述的任何多核苷酸。
可使用任何适当的方法使多核苷酸移动通过纳米反应器。举例来说,多核苷酸典型地为带电荷的。因此,电压可用于使多核苷酸移动通过纳米反应器。纳米反应器可为如本文所述的任何合适的纳米反应器。举例来说,如本文中更详细描述的,纳米反应器可为纳米孔,在这种情况下,跨越纳米孔的施加电压可用于使多核苷酸与纳米孔接触并且使多核苷酸相对于纳米孔移动。
方法用于在所述多核苷酸上编码数据。多核苷酸可用于数据的存储。可使用任何适合的修饰。本文讨论可对多核苷酸进行的合适的修饰。可用于在多核苷酸上编码数据的任何修饰均可用于本发明。
本发明的方法典型地不更改多核苷酸链的总长度。多核苷酸链的总长度通常以构成多核苷酸链的单体单元的数量表示。在这些方法中,多核苷酸链中单体单元的数量典型地为不变的。举例来说,选择性修饰多核苷酸链的部分典型地不包含向多核苷酸链中添加单体单元或从多核苷酸链中去除单体单元。
因此,本领域技术人员将理解,在一些实施例中,本发明的方法可被比作为自动收报机条带机制。提供这种类比仅是为了说明并且绝不限制本发明。在这一类比中,“条带”为多核苷酸链并且穿过纳米反应器,其中所述多核苷酸链被修饰的方式与通过例如在条带上打孔而在自动收报机条带上编码数据的方式大致相同。条带长度不更改,但是将数据编码到条带上。以相同的方式,在本文公开的方法中,多核苷酸链的主链典型地不被更改;而是将数据编码到多核苷酸链上。编码到多核苷酸链上的数据可被视为除了可由未修饰的多核苷酸链编码的任何数据之外编码的附加信息层。举例来说,未修饰的多核苷酸链可为可编码一个或多个多肽等的多核苷酸序列。对多核苷酸链进行的修饰编码其上的附加数据,其可在本发明的方法中如本文所述进行读取。因此,在本发明的方法中在多核苷酸链上编码的数据典型地为在本发明的方法中被修饰之前未修饰的多核苷酸链中不存在的“外源”数据。
在本发明的方法中,纳米反应器典型地包含纳米孔。在这类实施例中,纳米反应器可包含纳米孔的内部体积或纳米孔的内部体积的一部分。纳米反应器可包含纳米孔的整个内部体积。纳米反应器可仅包含纳米孔的一部分的内部体积。举例来说,如果使用蛋白纳米孔并且蛋白纳米孔具有例如桶和管腔区域,那么纳米反应器可包含桶或管腔或两者,或桶的一部分或管腔的一部分或两者。本领域技术人员将理解,可根据方法的应用并且例如根据待修饰的多核苷酸链的部分的大小(例如,待编码的数据单元的大小)来控制纳米反应器的大小。
纳米反应器可包含围绕纳米孔的纳米体积。纳米体积可包含从纳米孔的一个或多个开口延伸至约30nm的体积。举例来说,纳米体积可包含从纳米孔的一个或多个开口延伸至约20nm、约10nm或约5nm的体积。举例来说,如果纳米孔具有顺式和反式开口两者,那么纳米体积可从顺式开口、反式开口或顺式和反式开口两者延伸。延伸超过纳米反应器(例如,超过纳米孔的开口)的纳米体积也被称为反应区域(例如,图1中示出为(D))。
纳米孔可为跨膜蛋白纳米孔、固态纳米孔、DNA折纸孔或基于聚合物的塑料孔。纳米孔可为跨膜β-桶蛋白孔。纳米孔可包含膜中或跨越膜的阱、间隙、通道、管、沟槽或狭缝。纳米孔在本文中更详细描述。
方法可包含使多核苷酸链穿过纳米孔。如本文中更详细描述的,可在施加电压下使多核苷酸链通过纳米孔传递(易位)。用于通过纳米孔使多核苷酸链易位的方法和设备为本领域众所周知的,并且在本文中更详细描述。
如以上所解释的,方法涉及当多核苷酸链的部分移动通过纳米反应器时选择性修饰所述部分。可进行任何合适的修饰。举例来说,可进行允许将多核苷酸链的修饰的部分与多核苷酸链的未修饰的(非修饰的或较少修饰的)部分区分的任何修饰。
在一些实施例中,选择性修饰多核苷酸链的部分包含对多核苷酸链进行表观遗传修饰。对多核苷酸链进行许多表观遗传修饰为本领域技术人员已知的,并且在本文中更详细描述一些修饰。
当多核苷酸链的部分移动通过纳米反应器时,所述部分的选择性修饰可以任何合适的方式进行。典型地,选择性修饰多核苷酸链的部分包含使纳米反应器中的多核苷酸链的部分经受包含以下的反应条件:(i)一种或多种化学试剂的存在、不存在或浓度;(ii)在酶修饰多核苷酸链内的核苷酸的条件下使酶与多核苷酸链接合;(iii)电磁辐射的存在或不存在;和/或(iv)施加热量的存在或不存在。这类反应条件在本文中更详细描述。
本发明的方法可另外包含以下步骤:
(C)确定在多核苷酸链上的选择性修饰的模式。
在这类方法中,确定在多核苷酸链上的选择性修饰的模式典型地包含确定对多核苷酸链进行的修饰的存在、不存在、程度或特性。这样,确定对多核苷酸链进行的修饰的存在、不存在、程度或特性对应于读取在多核苷酸链上编码的数据。因此,将数据写入多核苷酸链可利用在多核苷酸链相对于纳米反应器移动时对多核苷酸链进行的修饰来鉴定,并且在多核苷酸链相对于纳米反应器移动时读取由此写入多核苷酸链的数据可利用确定对多核苷酸链进行的修饰的存在、不存在、程度或特性来鉴定。
在一些实施例中,方法包含表征修饰的多核苷酸链。这类表征不同于确定对多核苷酸链进行的修饰的存在、不存在、程度或特性。举例来说,表征修饰的多核苷酸链可允许确定关于多核苷酸链“主链”的信息,例如其序列或任何一种或多种特定核苷酸的百分比含量。确定对多核苷酸链进行的修饰的存在、不存在、程度或特性可允许读取被编码为其上的单独“层”的数据。
本发明还提供一种修饰多核苷酸链的方法,其包含:
(A)使多核苷酸链相对于纳米反应器移动;和
(B)当多核苷酸链的部分移动通过纳米反应器时选择性修饰所述部分。
在这类方法中,多核苷酸链典型地为如本文所述的多核苷酸链。纳米反应器典型地为如本文描述的纳米反应器当多核苷酸链的部分移动通过纳米反应器时,对所述部分进行的选择性修饰典型地为如本文所述的修饰。方法可为如本文所述的方法,例如在多核苷酸链上编码数据的方法。
多核苷酸的部分的修饰
在本发明的方法中,多核苷酸链可包含在纳米反应器内的一个或多个部分和在纳米反应器外部的一个或多个部分。在这类实施例中,方法可包含使在纳米反应器内的多核苷酸的一个或多个部分经受反应条件,使得(i)在纳米反应器内的多核苷酸的一个或多个部分被修饰,并且(ii)在纳米反应器外部的多核苷酸的一个或多个部分未被修饰或被修饰成与在纳米反应器内的多核苷酸的部分不同。
多核苷酸链的选择性修饰的部分典型地为多核苷酸链的序列部分。因此,所述部分典型地沿多核苷酸链彼此跟随。方法不需要修饰沿多核苷酸链彼此依次跟随的所有部分。举例来说,当多核苷酸链的部分穿过纳米反应器时,一些部分可被修饰而其它部分可不被修饰。可替代地,可将所有部分修饰到例如不同程度。一些部分可在多核苷酸链的第一次穿过纳米反应器时被修饰,而其它部分可在多核苷酸链的第二次穿过纳米反应器时被修饰。多核苷酸链上的修饰模式在多核苷酸链上编码数据。
因此,可选择性修饰在纳米反应器内的多核苷酸的一个或多个部分,而不修饰在纳米反应器外部的多核苷酸的一个或多个部分。举例来说,多核苷酸的修饰的部分可表示为1,而多核苷酸的未修饰的部分可表示为0,使得可在多核苷酸上编码二进制数据。可替代地,多核苷酸的修饰的部分可表示为0,而多核苷酸的未修饰的部分可表示为1,使得可在多核苷酸上编码二进制数据。
可选择性修饰在纳米反应器内的多核苷酸的一个或多个部分,而不同地修饰在纳米反应器外部的多核苷酸的一个或多个部分。因此,在纳米反应器内的多核苷酸的一个或多个部分可以第一方式被选择性修饰(即经受第一修饰),而在纳米反应器外部的多核苷酸的一个或多个部分以第二方式被修饰(即经受第二修饰)。第一修饰和第二修饰可为不同的修饰,即多核苷酸的化学药物在第一和第二修饰之间可不同。第一修饰和第二修饰可为相同的修饰,但是施加到不同的程度。举例来说,第一修饰可对应于在纳米反应器内的多核苷酸的一个或多个部分的至少10%、至少20%、至少30%、至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或更多的修饰。第二修饰可对应于在纳米反应器外部的多核苷酸的一个或多个部分的至多99%、至多98%、至多95%、至多90%、至多80%、至多70%、至多60%、至多50%、至多40%、至多30%、至多20%、至多10%或更少的修饰。本发明的方法为非常敏感的,并且对在纳米反应器内的多核苷酸的一个或多个部分和在纳米反应器外部的多核苷酸的一个或多个部分进行修饰的程度或性质之间的微小差异甚至可用于在多核苷酸上编码数据。
多核苷酸上编码的数据
选择性修饰的多核苷酸链的部分对应于由此编码的数据单元。举例来说,当多核苷酸的序列部分相对于纳米反应器移动时,多核苷酸的序列部分可相对于如本文所述的纳米反应器以在多核苷酸上编码的数据单元移动。
取决于所使用的方法和纳米反应器的应用等,所述部分可具有任何合适的长度。举例来说,在纳米反应器中被修饰的多核苷酸链的部分可为1至约1000个核苷酸,例如在纳米反应器中被修饰的多核苷酸链的部分可为1至约100个核苷酸,例如在纳米反应器中被修饰的多核苷酸链的部分可为1至约10个核苷酸。本领域技术人员可根据方法的应用,例如根据存储在多核苷酸链上的数据的数量和性质,确定要使用的适当部分。可通过控制纳米反应器的大小、多核苷酸链相对于纳米反应器的移动速度、允许发生修饰的持续时间等来控制在纳米反应器中被修饰的多核苷酸的单元的大小,即被编码的数据单元的大小。纳米反应器可被配置成当多核苷酸相对于纳米反应器移动时修饰多核苷酸中的任何期望数量的核苷酸。在一些方法中,当多核苷酸中的各个核苷酸相对于纳米反应器移动时,纳米反应器能够修饰各个核苷酸。
举例来说,如果核苷酸的修饰表示为1,并且缺乏核苷酸的修饰表示为0,那么可基于多核苷酸中的序列核苷酸的修饰或不修饰而在多核苷酸上编码二进制数据。然而,方法不限于单个核苷酸的修饰。如本领域技术人员将理解的,可将多核苷酸内的核苷酸嵌段修饰为编码数据的单元。多核苷酸内的核苷酸嵌段的修饰可表示为1或0,其中缺乏核苷酸嵌段的修饰表示为0或1。然而,利用编码特定数据(例如字或命令)(“数据结构”)的核苷酸嵌段内的核苷酸的修饰模式,可以进行更复杂的编码。
本发明的方法典型地包含当所述多核苷酸链的约10
多核苷酸
本发明的方法涉及在多核苷酸链移动通过纳米反应器时在所述多核苷酸链上编码数据。
多核苷酸(如核酸)为包含两个或更多个核苷酸的大分子。多核苷酸可为单链或双链的。多核苷酸或核酸可以包含任何核苷酸的任何组合。核苷酸可以是天然存在的或人工的。
核苷酸通常含有核碱基、糖和至少一个磷酸基。核碱基和糖形成核苷。
核碱基通常是杂环的。核碱基包括(但不限于)嘌呤和嘧啶,且更详细地说腺嘌呤(A)、鸟嘌呤(G)、胸腺嘧啶(T)、尿嘧啶(U)和胞嘧啶(C)。
糖通常是戊糖。核苷酸糖包括(但不限于)核糖和脱氧核糖。糖优选地是脱氧核糖。多核苷酸优选地包含以下核苷:脱氧腺苷(dA)、脱氧尿苷(dU)和/或胸苷(dT)、脱氧鸟苷(dG)和脱氧胞苷(dC)。
核苷酸通常是核糖核苷酸或脱氧核糖核苷酸。核苷酸通常含有单磷酸、二磷酸或三磷酸。核苷酸可以包含多于三个磷酸,如4个或5个磷酸。磷酸可以附接在核苷酸的5'或3'侧上。核苷酸包括(但不限于):单磷酸腺苷(AMP)、单磷酸鸟苷(GMP)、单磷酸胸苷(TMP)、单磷酸尿苷(UMP)、单磷酸5-甲基胞啶、单磷酸5-羟基甲基胞苷、单磷酸胞嘧啶核苷(CMP)、环单磷酸腺苷(cAMP)、环单磷酸鸟苷(cGMP)、单磷酸脱氧腺苷(dAMP)、单磷酸脱氧鸟苷(dGMP)、单磷酸脱氧胸苷(dTMP)、单磷酸脱氧尿苷(dUMP)、单磷酸脱氧胞苷(dCMP)和单磷酸脱氧甲基胞苷。核苷酸优选地选自AMP、TMP、GMP、CMP、UMP、dAMP、dTMP、dGMP、dCMP和dUMP。
核苷酸可以无碱基(即缺乏核碱基)。核苷酸还可缺乏核碱基和糖(即是C3间隔子)。
聚核苷酸中的核苷酸可以任何方式彼此附接。核苷酸通常通过其糖和磷酸基附接,如在核酸中那样。核苷酸可以通过其核碱基连接,如在嘧啶二聚体中那样。
多核苷酸可以是核酸,如脱氧核糖核酸(DNA)或核糖核酸(RNA)。多核苷酸可包含与一个DNA链杂交的一个RNA链。多核苷酸可以是本领域中已知的任何合成核酸,如肽核酸(PNA)、甘油核酸(GNA)、苏糖核酸(TNA)、锁核酸(LNA)或具有核苷酸侧链的其它合成聚合物。PNA主链由通过肽键连接的重复N-(2-氨基乙基)-甘氨酸单元构成。GNA主链由通过磷酸二酯键连接的重复二醇单元构成。TNA主链由通过磷酸二酯键连接在一起的重复苏糖构成。LNA由如上文所论述的具有额外的连接核糖部分中的2'氧和4'碳的桥的核糖核苷酸形成。
多核苷酸优选是DNA、RNA或DNA或RNA杂交体,最优选是DNA。DNA/RNA杂交体可以在同一条链上包含DNA和RNA。优选地,DNA/RNA杂交体包含与RNA链杂交的一条DNA链。
可更改多核苷酸的主链以减少链断裂的可能性。举例来说,已知DNA在许多条件下都比RNA更稳定。可修饰多核苷酸链的主链以避免由例如苛刻的化学物质如自由基引起的损坏。
含有非天然或修饰的碱基的DNA或RNA可通过使用适当的聚合酶在修饰的NTP存在下扩增天然DNA或RNA多核苷酸来产生。
本发明的方法涉及多核苷酸的修饰。除了通过本发明的方法进行修饰之外,多核苷酸中的一个或多个核苷酸可被氧化或甲基化。多核苷酸中的一或多个核苷酸可为受损的。例如,多核苷酸可以包含嘧啶二聚体。此类二聚体通常与紫外线损伤有关并且是皮肤黑色素瘤的主要病因。多核苷酸中的一或多个核苷酸可以例如用标记或标签修饰。多核苷酸可包含一或多个间隔子。
多核苷酸可以为单链或双链的。
单链多核苷酸在一些方法中可为有利的。举例来说,在一些方法中,期望消除通过在纳米反应器外部,如在纳米孔的内部体积外部进行的双链DNA/RNA再退火而施加的力。再退火施加的力可将DNA/RNA从纳米孔中拉出。
在一些实施例中,单链多核苷酸可含有具有强二级结构的区域,如发夹、四链体或三链体DNA(例如参见图5)。这些类型的结构可用于控制多核苷酸相对于纳米反应器的移动,例如当多核苷酸移动通过纳米孔时。举例来说,可以在单链底物中使用周期性发夹或四链体来控制多核苷酸通过纳米孔的移动。举例来说,二级结构可用于暂停多核苷酸通过纳米孔的移动,其中多核苷酸在施加电压下以粘滑的方式移动通过纳米孔,其中多核苷酸在沿链遇到每个连续的二级结构时在纳米孔中短暂暂停,然后再通过孔的力将其解缠并且易位。这类方法为附加有益的,因为它们允许获得反馈。因此,举例来说,当多核苷酸链从一个位置滑动到另一个位置时,可通过纳米反应器(例如,通过如本文所述的纳米孔)实时检测到连续移动。然后可相应地调节多核苷酸链相对于纳米反应器的移动。举例来说,如果施加电压用于控制移动,那么通过这类“滑动”获得的反馈可用于告知在整个方法的应用中使用的施加电压。例如,可降低施加电压以将多核苷酸链保持在纳米反应器(如纳米孔)内,并且可增加施加电压以推进多核苷酸链相对于纳米反应器(例如,纳米孔)移动。
多核苷酸在相对于纳米反应器移动并且由此被修饰之后可重整二级结构。举例来说,当纳米反应器为纳米孔时,多核苷酸可在易位通过纳米孔后形成或重新形成二级结构。这类二级结构可用于防止多核苷酸在低或没有施加负电压(施加到纳米孔的反侧)下通过纳米反应器(纳米孔)移回。
可在+V、0V和-V之间调制施加电压,以控制含有连续二级结构的多核苷酸的移动,以使多核苷酸向前移动、暂停(例如使得能够化学反应)或使多核苷酸反向。当通过滑动分子制动器使用单链DNA时,可以在大致0mV的施加电压下使DNA在纳米孔中的移动暂停。
在其它实施例中,DNA或RNA优选为双链的。在某些方法中,双链多核苷酸的使用可为有利的。举例来说,在二级结构引起不想要的问题的情况下,例如在形成可更改分子通过纳米孔的移动的不想要的四链体的情况下,例如通过在期望平滑连续速度的情况下在移动中产生不想要的暂停)(二级结构必须解缠才能穿过小的纳米孔),双链多核苷酸可用于减少一级易位单链多核苷酸中的二级结构的形成。然而,双链多核苷酸可包含单链区和具有其它结构的区域,如发夹环、三链体和/或四链体。如上所述,在单链多核苷酸的上下文中,这类二级结构可为有用的。
在一些实施例中,多核苷酸为双链的,其中双链分子的两条链共价连接,例如在分子的末端处通过用发夹结构将一条链的5'末端与另一条链的3'末端接合。具有连接的模板和补体的链可用于例如将修饰的信息(例如在模板中)与原始数据(例如在原始反向补体中)进行比较。举例来说,在用连接的模板和补体组分修饰dsDNA链的模板链后,可例如通过纳米孔测序仪重新读取DNA,将模板链中的修饰的DNA与反向补体链中未更改的DNA进行比较,以例如验证对DNA进行的改变的质量。
在一些实施例中,孔足够大以传递双链多核苷酸,并且可对dsDNA的一条或两条链进行修饰。
多核苷酸可以是任何长度的。例如,多核苷酸的长度可以是至少10个、至少50个、至少100个、至少150个、至少200个、至少250个、至少300个、至少400个或至少500个核苷酸或核苷酸对。靶多核苷酸可以是1000个或更多个核苷酸或核苷酸对,长度为5000个或更多个核苷酸或核苷酸对或长度为100000个或更多个核苷酸或核苷酸对或长度为500,000个或更多个核苷酸或核苷酸对,或长度为1,000,000个或更多个核苷酸或核苷酸对,长度为10,000,000或更多个核苷酸或核苷酸对,或长度为100,000,000或更多个核苷酸或核苷酸对,或长度为200,000,000或更多个核苷酸或核苷酸对,或染色体的整个长度。在一些实施例中,多核苷酸优选非常大(千碱基至兆碱基长),以便将大量数据编码到单链中。在其它实施例中,多核苷酸具有短或中等长度,以使得能够更快地随机存取读取数据。
多核苷酸可为寡核苷酸。寡核苷酸是短核苷酸聚合物,其通常具有50个或更少核苷酸,如40个或更少、30个或更少、20个或更少、10个或更少或5个或更少核苷酸。靶寡核苷酸的长度优选是约15至约30个核苷酸,例如长度是约20至约25个核苷酸。例如,寡核苷酸的长度可以是约15、约16、约17、约18、约19、约20、约21、约22、约23、约24、约25、约26、约27、约28、约29或约30个核苷酸。
多核苷酸可为较长靶多核苷酸的片段。在此实施例中,较长多核苷酸典型地片段化为多个,如两个或更多个较短的多核苷酸。
多核苷酸可为天然存在的。举例来说,多核苷酸可源自常见生物,如病毒、细菌、古细菌、植物或动物。可选择或更改这类生物以例如通过调节碱基组成、去除不想要的序列元件等来调节源多核苷酸的序列。为了获得期望的多核苷酸特征,选择和更改生物体为本领域普通技术人员的常规操作。
可基于序列的期望特征来选择多核苷酸的源生物体。期望特征包括由生物体产生的单链与双链多核苷酸的比率;由生物体产生的多核苷酸序列的复杂性、由生物体产生的多核苷酸的组成(如GC组成)或由生物体产生的连续多核苷酸链的长度。举例来说,当需要大约50kb的连续多核苷酸链时,可使用λ噬菌体DNA。如果需要更长的连续链,那么其它生物体可用于产生多核苷酸;例如,大肠杆菌(E.coli)产生大约4.5Mb的连续dsDNA。
在一些实施例中,通过控制源材料来知道每个纳米孔中天然多核苷酸的同一性。举例来说,在含有多个纳米反应器(例如纳米孔)的系统中,对于每个纳米反应器(例如纳米孔),源模板材料可为全长连续约50kbase的λ噬菌体dsDNA。然而,尽管起始多核苷酸在每种情况下可为相同的,但是对每个单个多核苷酸进行的修饰可为不同的,例如以将不同的信息编码到每个多核苷酸中。在一些实施例中,通过纳米孔进料的多核苷酸的序列为事先未知的。在其它实施例中,多核苷酸的序列为已知的。
在一些实施例中,当使用天然多核苷酸源时,所用的链在捕获到纳米孔中以进行修饰之前为未知的。在这些情况下,有时优选在修饰过程之前或期间对多核苷酸进行测序。
在一个实施例中,首先在部分或全部修饰多核苷酸之前对其进行测序,然后与已知的参考数据库进行比对以确定序列的同一性。一旦已知序列,就可基于对组成的了解来更改修饰过程。举例来说,如果修饰过程仅作用于G碱基,那么序列的知识可用于控制链的位置,例如控制反应体积中含有G碱基的期望序列的暂停,以确保期望碱基的最佳修饰。
在另一个实施例中,在修饰过程期间对链进行测序和/或鉴定。这可用于更好地控制链的哪些区域被修饰。在一些实施例中,通过将实时信号或碱基判读与已知参考物比对来实时确定序列。确定多核苷酸序列的示例性方法在WO 2016/059427中描述,其以引用的方式并入本文中。多核苷酸链的碱基组成的预定知识可用于更选择性地控制何时施加反应条件(例如光)。这对于控制修饰以在已知位置选择性修饰单个碱基或选定数量的碱基可为有用的。当在距对碱基敏感的纳米孔“读取器”位置一些距离处发生修饰时,在实施例中当这类读取器用于表征所进行的修饰时,预定的知识也可为有用的。举例来说,可在纳米孔读取器的上方或下方(如距离>1nm)发生修饰。读取器中的碱基与敏化剂附近的碱基之间的移动速率和相对距离的知识可用于更好地控制序列中反应区域的选择性。
在一些实施例中,碱基组成为未知的,并且修饰以覆盖多个碱基的更长的拉伸进行,从而产生修饰和未修饰的“岛”。
另外,测序可用于确认修饰已成功。然后当检测到不成功的修饰时,可对链采取另外的行动。举例来说,在一些实施例中,链的方向可反向(例如,通过使施加电位反向,例如在多核苷酸最初向前移动通过纳米孔后,使其向后穿过纳米孔),从而使待修饰的区域可在不成功的修饰后返回到反应体积以重复修饰过程。可重复此过程,直到检测到成功的修饰。
可替代地,如果在不可重复过程的系统中检测到不成功的修饰(例如,如果链的方向不可反向),那么可更改DNA的稍后区段的修饰标准,以解决先前不成功的修饰。举例来说,此过程可用于纠正错误写入的数据,方法是稍后另外沿多核苷酸再次写入相同的数据,从而仅在需要时才产生冗余(相对于从一开始就内置到代码中的冗余,这可以不必要地浪费空间)。
在一些实施例中,多核苷酸为合成的或半合成的。举例来说,DNA或RNA可为纯合成的,通过常规的DNA合成方法合成,例如基于亚磷酰胺的化学方法。合成的多核苷酸亚基可通过已知手段,如连接或化学键接合在一起,以产生更长的链。在链上编码数据之前,链可在纳米反应器(例如,纳米孔)阵列中合成(例如,连接在一起)。在一些实施例中,可例如通过连接适当的序列将内部自形成结构(例如发夹、四链体)设计到底物中。用于控制移动的酶也可加载到产品底物上。
在一些实施例中,对于将实施修饰的大部分区域,多核苷酸具有简化的核苷酸组成。举例来说,DNA链可仅或基本上由G和A碱基构成。这类碱基不容易杂交并且可容易地以修饰和未修饰的形式区分。
在一些实施例中,多核苷酸具有相同亚基的重复模式。举例来说,重复单元可为(AmGn)q,其中m、n和q为正整数。举例来说,m通常为1至20,如1至10,例如1至5,例如1、2、3、4或5。n通常为1至20,如1至10,例如1至5,例如1、2、3、4或5。m和n可相同或不同。q通常为1至约100,000。典型的重复单元可为例如(AAAAAAGGGGGG)q。
重复的多核苷酸可通过本领域已知的许多手段来制备,例如通过将合成的亚基与使得能够连接的粘性末端串接在一起。在一些实施例中,多核苷酸因此可为串接的多核苷酸。串接多核苷酸的方法在PCT/GB2017/051493中描述。
合成的多核苷酸可通过本领域已知的手段(包括PCR、掺入细菌工厂等)进行复制并且放大以用于生产。
在一些实施例中,更改多核苷酸以增加或降低对外部试剂的反应性。举例来说,在混合碱基系统中,可期望控制哪些碱基能够被修饰而哪些背景碱基不应当被修饰。可选择背景碱基,使得它们相对于标准碱基具有降低的反应性,以限制不想要的反应的可能性。举例来说,碱基ATC的反应性比G的反应性低,因此可以调节多核苷酸链的组成以在不需要修饰的区域和要进行修饰的G含量高的区域中具有较少的反应性ATC碱基的运行。可替代地,当暴露于适当的反应条件时,可选择旨在被修饰的碱基以具有更高的反应性。
在一些实施例中,多核苷酸可包含含有反应性侧链的碱基。可根据需要在侧链上并入任何合适的反应性官能团。反应性官能团的合适实例包括点击化学试剂。
点击化学是由Kolb等人于2001年首次引入的术语,以描述在小规模和大规模应用两者中可靠地工作的一组不断扩展的强大的、选择性的和模块化的组成部分(Kolb HC,Finn,MG,Sharpless KB,点击化学:来自几个良好反应的不同化学功能(Click chemistry:diverse chemical function from a few good reactions),《应用化学国际版(Angew.Chem.Int.Ed.)》40(2001)2004-2021)。他们已经定义了点击化学的一组严格标准,如以下所示:“反应必须是模块化的、范围宽、产率非常高、只产生可以通过非色谱方法去除的无害副产物并且可以是立体特异性的(但不一定是对映选择性的)。所需的工艺特性包括简单的反应条件(理想情况下,该工艺应对氧气和水不敏感),易于获得的起始材料和试剂,不使用溶剂或使用良性溶剂(诸如水)或易于除去,以及简单的产物分离。如果需要,必须通过诸如结晶或蒸馏等非色谱方法纯化,并且产物必须在生理条件下是稳定的”。
点击化学的合适的实例包括但不限于以下:
(a)1,3偶极环加成反应的无铜变体,其中,叠氮化物与炔烃在应变下(例如在环辛烷环中)反应;
(b)一个接头上的氧亲核试剂与另一个接头上的环氧化物或氮丙啶反应性部分的反应;以及
(c)施陶丁格连接,其中,炔部分可以被芳基膦取代,导致与叠氮化物的特异性反应,得到酰胺键。
任何反应性基团均可用于本发明。反应性基团可以是适合点击化学的基团。反应性基团可以是在WO 2010/086602中,特别是在该申请的表4中公开的那些基团中的任何一个。
在一些实施例中,在修饰之前和之后,多核苷酸都能够由多核苷酸马达控制,以控制相对于纳米反应器的移动,例如,以控制通过纳米孔的易位。一些多核苷酸马达(如解旋酶)耐受天然多核苷酸的显著改变,包括非天然主链、更改的糖、更改的具有附接的小或大加合物的碱基、无碱基位点等。本文描述一些示例性多核苷酸马达。
优选地,多核苷酸的修饰形式和未修饰形式在延长的时间段内在适当的存储条件下都是稳定的。举例来说,当在适当的条件下存储时,呈修饰和/或未修饰形式的多核苷酸可稳定超过1天、1个月、1年、10年等。多核苷酸的必要稳定性可基于其应用来确定,并且可使用本领域已知的方法来控制,包括使用高纯度试剂和在适当的条件下存储。在一些实施例中,多核苷酸必须在纳米反应器中修饰后进行加工,以更改碱基、稳定化学反应、存储多核苷酸等。在一些实施例中,可通过常规的聚合酶扩增方法复制最终修饰的链,同时在复制过程中保留修饰信息。
多核苷酸相对于纳米反应器的移动
在本发明的方法中,在纳米反应器中在适当的反应条件下修饰多核苷酸。当多核苷酸相对于纳米反应器移动时,向多核苷酸链施加反应条件。举例来说,多核苷酸可穿过纳米反应器(如穿过纳米孔)。在其它实施例中,多核苷酸可穿过纳米反应器,如跨越纳米孔的开口。多核苷酸相对于纳米反应器的移动可如本文中更详细描述。在本发明的一些实施例中,纳米反应器包含纳米孔内的内部体积和/或围绕纳米孔的纳米体积。举例来说,纳米反应器可为纳米孔。多核苷酸可相对于纳米孔移动;例如,多核苷酸可移动通过(易位)纳米孔。纳米孔可为如本文所述的任何合适的纳米孔。
在本发明的方法中,多核苷酸链可连续移动通过纳米反应器,同时当多核苷酸链的部分移动通过纳米反应器时选择性修饰所述部分。在一些实施例中,方法包含相对于纳米反应器以恒定速率移动多核苷酸链,并且当多核苷酸链移动通过纳米反应器时以规则或不规则的频率向所述多核苷酸链施加反应条件。在其它实施例中,方法包含相对于纳米反应器以可变速率移动多核苷酸链,并且当多核苷酸链移动通过纳米反应器时以规则或不规则的频率向所述多核苷酸链施加反应条件。通过控制其中在多核苷酸链移动通过纳米反应器时向多核苷酸链施加反应条件的方式,可控制将数据编码到多核苷酸链上的方式。在附图中示出这类方法的实例。
本发明的方法的其它实施例包含中断多核苷酸链相对于纳米反应器的移动,同时当多核苷酸链的部分移动通过纳米反应器时选择性修饰所述部分。
在附图中示出这类方法的实例。举例来说,通过中断多核苷酸链相对于纳米反应器的移动,同时选择性修饰在纳米反应器内的多核苷酸链的部分,可精细地控制对在纳米反应器内的多核苷酸链的部分进行的修饰的程度。
因此,在一个实施例中,多核苷酸可以恒定速率移动通过纳米反应器,例如通过纳米孔或围绕纳米孔的体积。在另一个实施例中,多核苷酸可以可变速率移动通过纳米反应器,例如通过纳米孔或围绕纳米孔的体积。在多核苷酸移动通过纳米反应器同时,通过施加适当的反应条件对多核苷酸进行修饰。反应条件可周期性地施加。举例来说,施加反应条件可引起在纳米反应器内的多核苷酸的部分的修饰,并且多核苷酸的修饰的部分可对应于如1或0的信号以编码数据。当不施加反应条件时,在纳米反应器内的多核苷酸的部分不被修饰,并且多核苷酸的未修饰的部分可对应于不同的信号,如0或1,从而允许编码数据。
反应条件可以规则或不规则的频率施加。规则的频率可通过例如规则地脉冲光源或热源或通过将试剂规则地添加到纳米反应器中(例如添加到围绕纳米反应器的环境中导致扩散到纳米反应器中)来实现。不规则的频率可通过例如不规则地脉冲光源或热源或通过将试剂不规则地添加到纳米反应器中(例如添加到围绕纳米反应器的环境中导致扩散到纳米反应器中)来实现。规则施加反应条件以便在多核苷酸相对于纳米反应器移动时对其进行修饰可为有益的,因为这可准许更简单的设置或允许对多核苷酸进行更可预测的修饰,这可减少后续数据分析的复杂性以解码数据。不规则施加反应条件可为有益的,因为当多核苷酸相对于纳米反应器移动时可允许在多核苷酸中记录更复杂的数据。
在多核苷酸上编码数据的任何合适的反应条件可用于本发明的方法。本文描述用于在多核苷酸上编码数据的一些合适的反应条件。
纳米反应器
在本发明的方法中,可使用任何合适的纳米反应器。
纳米反应器通常包含纳米孔内的内部体积和/或围绕纳米孔的纳米体积。纳米孔可为任何合适的纳米孔。各种合适的纳米孔在本文中更详细描述。
通常,当纳米反应器包含纳米孔或围绕纳米孔的纳米体积时,纳米孔为跨膜蛋白纳米孔、固态纳米孔、DNA折纸孔或基于聚合物的塑料孔。最通常地,纳米孔为跨膜β-桶蛋白孔。
纳米孔为通过膜的孔或通道,其准许由施加电位驱动的水合离子流过或在膜内流动。纳米孔可为在一定程度上横穿膜的蛋白孔,或者可为具有在一定程度上横穿膜的结构的非蛋白孔,如多核苷酸孔或固态孔。孔可为DNA折纸孔。孔可以是生物的或人工的。
膜在本文中更详细描述。
在本发明中,纳米反应器可包含纳米孔的内部体积或纳米孔的内部体积的一部分。可使用如本文所述的任何合适的纳米孔。有时,纳米体积包含从纳米孔的一个或多个开口延伸至约30nm的体积。举例来说,纳米体积可包含从纳米孔的一个或多个开口延伸至约20nm,如从纳米孔的一个或多个开口延伸至约15nm,例如至约10nm,例如至约5nm的体积。纳米体积可围绕纳米孔的顺式开口延伸。纳米体积可围绕纳米孔的反式开口延伸。纳米体积可围绕纳米孔的顺式开口和反式开口延伸。
适用于本发明的跨膜孔可为固态孔。固态纳米孔典型地为在合成膜中形成的纳米级孔。合适的固态孔包括但不限于氮化硅孔、二氧化硅孔和石墨烯孔。固态纳米孔可例如通过聚焦的离子束或电子束来制造,因此孔的大小可自由调节。在美国专利号6,464,842、WO03/003446、WO2005/061373、美国专利号7,258,838、美国专利号7,466,069、美国专利号7,468,271和美国专利号7,253,434中讨论合适的固态孔以及其生产方法。
跨膜孔可为DNA折纸孔(Langecker等人,《科学(Science)》,2012;338:932-936)。DNA折纸孔在WO2013/083983中公开。
跨膜孔可为基于聚合物的孔。合适的孔可由基于聚合物的塑料,如聚酯,例如聚对苯二甲酸乙二醇酯(PET)经由轨迹蚀刻制成。
适用于本发明的跨膜孔可为跨膜蛋白孔。跨膜蛋白孔为多肽或多肽的集合,其准许由施加电位驱动的离子从膜的一侧流向膜的另一侧。跨膜蛋白孔为在一定程度上横穿膜的结构,并且可具有在一侧或两侧延伸超出膜的结构。跨膜蛋白孔可为准许水合离子从膜的一侧流向膜的另一侧的单一或多聚蛋白。然而,跨膜蛋白孔不是必须得横穿膜。它可在一端封闭。例如,孔可为膜中的阱、间隙、通道、管、沟槽或狭缝,水合离子可沿它流动或流入其中。
跨膜蛋白孔典型地包含离子可流动通过的桶或通道。孔的亚基典型地围绕中心轴线并且为跨膜β-桶或通道或跨膜α-螺旋束或通道提供链。跨膜蛋白孔典型地包含允许多核苷酸(如DNA或RNA)移动或移动进入和/或通过孔的通道。
跨膜蛋白孔可为单体或寡聚物。寡聚物优选地由几个重复亚基组成,如至少6个、至少7个、至少8个、至少9个、至少10个、至少11个、至少12个、至少13个、至少14个、至少15个或至少16个亚基。举例来说,孔可为六聚孔、七聚孔、八聚孔或九聚孔。孔可为其中所有亚基都相同的同源寡聚物,或者为包含两个或更多个(如3、4、5或6个)不同亚基的异源寡聚物。
跨膜蛋白孔的桶或通道典型地包含促进与多核苷酸相互作用的氨基酸。这些氨基酸优选地位于桶或通道的收缩部附近(如在1、2、3、4或5nm内)。跨膜蛋白孔典型地包含一个或多个带正电荷的氨基酸,如精氨酸、赖氨酸或组氨酸,或芳香族氨基酸,如酪氨酸或色氨酸。这些氨基酸典型地促进孔与核苷酸、多核苷酸或核酸之间的相互作用。
根据本发明适用的跨膜蛋白孔可源自β-桶孔或α-螺旋束孔。
β-桶孔包含由β-链形成的桶或通道。合适的β-桶孔包括但不限于β-毒素,如α-溶血素(αHL)、炭疽毒素和杀白细胞素,以及细菌的外膜蛋白/孔蛋白,如耻垢分枝杆菌(Mycobacterium smegmatis)孔蛋白(Msp),例如MspA、MspB、MspC或MspD、CsgG,外膜孔蛋白F(OmpF)、外膜孔蛋白G(OmpG)、外膜磷脂酶A以及奈瑟氏球菌(Neisseria)自主转运蛋白脂蛋白(NalP)以及其它孔,如胞溶素。其它β-桶孔包括SP1、溶血性蛋白呋喃糖毒素C(FraC)、促胰液素如InvG或GspD、气溶素、NetB、VdaC(电压依赖性阴离子通道)、VCC(霍乱弧菌(vibrio cholerae)溶细胞素)、炭疽保护性抗原或ATPase转子如酵母线粒体ATPase的C10转子环、海氏肠球菌(Enterococcus hirae)的V-ATPase的K环、酒石酸泥杆菌(Ilycobactertartaricus)ATPase的C11转子环或假坚强芽孢杆菌(Bacillus pseudofirmus)ATPase的C13转子环。因此,在一些实施例中,跨膜蛋白纳米孔选自MspA、α-溶血素、CsgG、胞溶素、InvG、GspD、杀白细胞素、FraC、气溶素、NetB和其功能同源物以及其片段。跨膜蛋白孔的结构在蛋白质数据库中可用,例如MspA、α-HL和CsgG分别为蛋白质数据库条目1UUN、7AHL和4UV3。
α-螺旋束孔包含由α-螺旋形成的桶或通道。合适的α-螺旋束孔包括但不限于内膜蛋白和α外膜蛋白,如WZA和ClyA毒素。
纳米孔可为CsgG孔,例如来自大肠杆菌菌株K-12亚株MC4100的CsgG,或其同源物或突变物。突变CsgG孔可包含一种或多种突变单体。CsgG孔可为包含相同单体的均聚物,或包含两种或更多种不同单体的杂聚物。源自CsgG的合适的孔公开于WO 2016/034591、WO2017/149316、WO2017/149317、WO2017/149318和国际专利申请号PCT/GB2018/051191和PCT/GB2018/051858中。
跨膜蛋白孔可源自胞溶素。WO 2013/153359中公开源自胞溶素的合适的孔。
跨膜孔可源自或基于α-溶血素(α-HL)。野生型α-溶血素孔由7个相同的单体或亚基形成(即,它是七聚的)。α-溶血素孔可以是α-溶血素-NN或其变体。变体可包含在位置E111和K147处的N个残基。
跨膜蛋白孔可源自Msp,更具体地,源自MspA。在WO 2012/107778中公开了衍生自MspA的合适的孔。
在一个实施例中,纳米孔为促胰液素孔,例如GspD或InvG,或其同源物或突变体。促胰液素纳米孔在WO2018/146491中描述。
跨膜孔可为本文所述的孔的变体,如(例如)Msp的变体、α-溶血素(α-HL)、胞溶素、CsgG、ClyA、Sp1或溶血性蛋白呋喃糖毒素C(FraC)。给定(“参考”)多肽的变体是具有不同于参考多肽的氨基酸序列并且保留其形成孔的能力的氨基酸序列的多肽。可以使用本领域已知的任何方法来测定变体形成孔的能力。例如,变体可以与其他适当的亚基一起插入到两亲性层中,并且可以确定其寡聚形成孔的能力。用于将亚基插入膜诸如两亲性层的方法是本领域已知的。例如,可以将纯化形式的亚基悬浮于含有三嵌段共聚物膜的溶液中,使得其扩散到膜并且通过结合到膜和组装成功能性状态来插入。替代性地,可以使用M.A.Holden,H.Bayley.《美国化学协会期刊(J.Am.Chem.Soc.)》2005,127,6502-6503和WO 2006/100484中描述的“拾取和放置”方法将亚基直接插入膜中。
在给定参考序列的整个长度内,基于氨基酸的相似性或同一性,变体可与序列至少50%同源。更优选地,基于整个序列上氨基酸参考序列的氨基酸的相似性或同一性,变体可以为至少55%、至少60%、至少65%、至少70%、至少75%、至少80%、至少85%、至少90%且更优选地至少95%、97%或99%同源。在100个或更多个例如125、150、175或200或更多个连续氨基酸的一段中,可以至少有80%,例如至少85%、90%或95%的氨基酸相似性或同一性(“硬同源性”)。
本领域的标准方法可以用于确定同源性。举例来说,UWGCG程序包提供BESTFIT程序,其可用于计算同源性,例如用其默认设置(Devereux等人(1984)《核酸研究(NucleicAcids Research)》12,第387到395页)。PILEUP和BLAST算法可用于计算同源性对序列进行排序(例如鉴定等同残基或对应序列(通常用其默认设置)),例如如Altschul S.F.(1993)《分子进化杂志(J Mol Evol)》36:290-300;Altschul,S.F等人(1990)《分子进化杂志》215:403-10中所描述。用于执行BLAST分析的软件可通过美国国家生物技术信息中心(NationalCenter for Biotechnology Information)(http://www.ncbi.nlm.nih.gov/)公开地获得。可以使用成对同一性或通过应用评分矩阵诸如BLOSUM62并转换为当量同一性来测量类似性。由于其表示功能变化而非演化改变,所以在确定同源性时将掩盖故意突变的位置。可以通过使用位置特异性评分矩阵,例如在蛋白质序列综合数据库中使用PSIBLAST更敏感地确定类似性。可以使用反映氨基酸的化学物理特性(例如电荷)而不是反映进化时间尺度上的替换频率的不同的评分矩阵。
可对孔的序列,如Msp、α-溶血素(α-HL)、胞溶素、CsgG、ClyA、Sp1和溶血性蛋白呋喃糖毒素C(FraC)进行氨基酸替换。例如,可以进行多达1、2、3、4、5、10、20或30个替换。保守替换用具有相似化学结构、相似化学特性或相似侧链体积的其他氨基酸替换氨基酸。引入的氨基酸可以具有与其替代的氨基酸相似的极性、亲水性、疏水性、碱性、酸性、中性或电荷。替代地,保守替换可以引入另一种芳族或脂族氨基酸替代现有的芳族或脂族氨基酸。
在寡聚跨膜蛋白孔的情况下,可在每个单体多肽亚基或任何一种或多种单体中进行突变。合适地,在本发明的一个实施例中,对寡聚蛋白内的所有单体进行所描述的突变。突变单体为其序列不同于野生型孔单体的序列并且保持形成孔的能力的单体。用于确认突变单体形成孔的能力的方法在所属领域中是众所周知的。
可以例如通过添加组氨酸残基(his标签)、天冬氨酸残基(asp标签)、链霉亲和素标签、flag标签、SUMO标签、GST标签或MBP标签,或在多肽天然地不含信号序列的情况下通过添加这类序列以促进其从细胞分泌,来修饰本文所述的任何蛋白质,如跨膜蛋白孔,从而帮助其鉴定或纯化。引入遗传标签的另一种方法是使标签在孔或构建体的天然或工程化位置上发生化学反应。这样的一个实例是使凝胶移位试剂与在孔的外部工程化的半胱氨酸反应。这已被证明是用于分离溶血素的异质寡聚物的方法(Braha等人(1997)生化与分子生物学(Chem Biol).4(7):497-505)。
孔可以用显露的标记来标记。显露的标记可以是允许检测孔的任何合适的标记。合适的标记包括但不限于荧光分子、放射性同位素、例如
本文描述的任何蛋白质,诸如跨膜蛋白质孔,可以合成地或通过重组手段制备。例如,可以通过体外翻译和转录(IVTT)来合成孔。可以修饰孔的氨基酸序列以包括非天然存在的氨基酸或以增加蛋白质的稳定性。当通过合成手段生产蛋白质时,可以在生产期间引入这样的氨基酸。孔也可以在合成或重组生产后更改。
可以使用本领域已知的标准方法来产生本文描述的任何蛋白质,诸如跨膜蛋白质孔。可以使用本领域的标准方法衍生并复制编码孔或构建体的多核苷酸序列。可以使用本领域中的标准技术在细菌宿主细胞中表达编码孔或构建体的多核苷酸序列。可以通过由重组表达载体原位表达多肽在细胞中产生孔。表达载体任选地携带诱导型启动子以控制多肽的表达。这些方法描述于Sambrook,J.和Russell,D.(2001)中所述。《分子克隆:实验室手册》,第3版.纽约冷泉港的冷泉港实验室出版社中。
可以在通过任何蛋白质液相色谱系统纯化之后或在重组表达之后,从产蛋白质生物体大规模产生孔。典型的蛋白质液相色谱系统包括FPLC、AKTA系统、Bio-Cad系统、Bio-Rad BioLogic系统和Gilson HPLC系统。
多核苷酸相对于纳米反应器的移动
如以上所解释的,本发明的方法典型地涉及多核苷酸相对于纳米反应器的移动,例如相对于纳米孔内的内部体积和/或围绕纳米孔的纳米体积的移动。
可以任何合适的方式控制多核苷酸相对于纳米反应器的移动。
可通过本领域已知的手段控制多核苷酸相对于纳米反应器的移动(例如穿过纳米孔),以使得能够有足够的时间例如识别多核苷酸的区域,允许足够的时间进行反应以修饰期望区域。反应在本文中讨论。
在这些方法中,多核苷酸相对于纳米反应器移动的平均速度(例如,当其移动通过纳米孔或围绕纳米孔的纳米体积时)可为约0.1核苷酸/秒至约10,000核苷酸/秒的范围,例如约0.5至约5000核苷酸/秒,例如约1至约1000核苷酸/秒,如约50至约500核苷酸/秒,例如约100至约250核苷酸/秒。当多核苷酸相对于纳米反应器移动时,可控制多核苷酸相对于纳米反应器的速度,以允许有时间如本文所述修饰多核苷酸的期望单元。多核苷酸相对于纳米反应器的移动可为平滑的,即,随时间推移为规则的。多核苷酸相对于纳米反应器的移动可为不规则的。举例来说,多核苷酸可以滑粘随机方式相对于纳米反应器移动(例如可移动通过纳米孔或通过围绕纳米孔的纳米体积),在期望区域暂停期望的时间量(例如经历修饰多核苷酸的反应),并且然后向前或向后移动到下一个区域,然后再次暂停。当在连续的暂停位置之间向前或向后移动时,多核苷酸可非常快速地移动,例如以大于10,000核苷酸/秒的速度移动,因为可不必限制暂停位置之间的速度。这种移动形式可通常用于本发明的方法中,所述方法使用在本文中另外讨论的二级结构或阻滞来控制移动。
可通过外部手段,如通过施加电压、通过加热或通过光,或通过控制可用的酶燃料的量来控制多核苷酸相对于纳米反应器的移动速度(例如,当多核苷酸移动通过纳米孔或通过围绕纳米孔的纳米体积时)。
二级结构
可通过多核苷酸内的二级结构或杂交的多核苷酸结构来控制多核苷酸相对于纳米反应器的移动。这类结构在其中纳米反应器为纳米孔或围绕纳米孔的纳米体积的本发明的实施例中可特别有用。
在本领域中众所周知的用于控制多核苷酸通过纳米孔的移动的二级结构的实例包括双链区域、发夹结构、三链体区域、四链体结构等。当结构太大而不能完整地穿过纳米孔时,需要一定量的力使结构解缠并且通过纳米孔使解缠或半解缠的形式易位。
解缠二级结构所需的力的大小取决于如多核苷酸的性质、溶液的条件(例如pH和离子强度等)以及纳米孔的形状和结构的因素。可更改这些因素以控制二级结构的稳定性,并且进而控制移动中暂停的持续时间。
对于给定系统使结构解缠所需的力的大小可使用控制实验来校准。二级结构可使用本领域已知的普通多核苷酸设计工具来设计,以控制结构的大小和形状以及在施加力下结构的稳定性。
图5说明二级结构的各种实例可如何用于控制多核苷酸通过纳米孔的移动。
二级结构使得能够在施加电压的施加下滑粘控制多核苷酸移动通过纳米反应器(例如纳米孔)。施加电压的调制可用于控制多核苷酸的移动。举例来说,在低或零施加电压状态下,力将不足以克服二级结构的杂交,因此多核苷酸易位将无限期地暂停直到电压增加至解杂交所需的阈值以上。可通过施加低电压来实现低电压状态,所述低电压例如为低于约60mV,例如低于约50mV,更经常低于约40mV如30mV或以下、20mV或以下,或更低如10mV或以下的电压。可将电压设置成低于使结构解杂交所需的电压。这类电压可以实验方式确定,或者可基于二级结构和其中杂交程度的知识来预测。
在高于解杂交阈值的较高施加电压下,结构在施加电压的作用下解缠并且通过纳米孔易位。解杂交所需的阈值电压可以实验方式确定,或者可基于二级结构和其中杂交程度的知识来预测。典型地,解杂交所需的阈值电压可为至少30mV,如至少40mV、至少50mV、至少60mV、至少80mV、至少100mV或更高。
在阈值电压之上,在遇到每个二级结构时的暂停持续时间可通过控制施加电压来控制。举例来说,在中等的施加电压(例如40-80mV)下,二级结构可在解缠之前平均暂停几秒钟。在高得多的电压(例如,大于100mV)下,结构可在解缠之前暂停不到1秒。
多核苷酸相对于纳米反应器的移动方向可通过变化施加电压来控制。举例来说,使施加电压的极性反向可用于使多核苷酸反向易位回通过纳米反应器(例如,通过纳米孔),例如重新访问多核苷酸的先前区域以重复修饰以表征所述区域。表征在本文中更详细描述。
响应于脚本化协议或检测到期望的特性改变(例如成功修饰)而更改电压的电压例程可用于控制多核苷酸的移动,例如,使用零电压或低电压在选定区域连续暂停以进行修饰或检测多核苷酸的特征,然后通过施加足够高的电压向前或向后移动多核苷酸序列以使二级结构解缠。因此,电压控制可用于仅在多核苷酸中的期望位置处暂停以选择性修饰多核苷酸,例如为了编码信息的目的而编码修饰的和未修饰的区域的模式。
捕集
在一些方法中,可期望在多核苷酸相对于纳米反应器移动之后(例如,在其通过纳米孔或围绕纳米孔的纳米体积易位后)暂时捕集多核苷酸以控制多核苷酸的移动。
举例来说,一些方法涉及多核苷酸相对于纳米反应器(例如通过纳米孔)从顺式向反式隔室的移动。在纳米孔反侧的多核苷酸区域上的捕集元件可用于使多核苷酸保留在纳米孔中,并且在施加电压关闭或电压极性反转的情况下防止多核苷酸从纳米孔中损失或方向反向,从而起到将多核苷酸从纳米孔中向回拉出的作用。
二级结构可用于捕集多核苷酸的移动。举例来说,二级结构,如四链体或发夹,在解缠后可自发重组,以便允许多核苷酸相对于纳米反应器(例如通过纳米孔)移动。当重整时,它们可再次提供空间阻滞以反向易位,直到施加足够的力或其它解杂交条件。
也可通过使用结合分子来实现单链多核苷酸的捕集。举例来说,在涉及使多核苷酸经由纳米反应器(例如,通过纳米孔的移动)从顺式隔室向反式隔室移动的方法中,一旦通过纳米反应器(例如,纳米孔)易位,结合分子就可用于结合多核苷酸,以产生空间阻滞以防止反向易位,直到施加足够的条件解结合。合适的结合分子的实例包括杂交产生双链多核苷酸的区段的多核苷酸;蛋白如与生物素化多核苷酸碱基结合的链霉亲和素,或多核苷酸结合蛋白如单链结合蛋白(SSB)、recA等。多核苷酸结合蛋白在本文中更详细描述。
轮烷
在本发明的方法中,被修饰的多核苷酸可被捕集在纳米反应器中,如在纳米孔中。这类捕集可例如通过将大的阻塞部分附接到多核苷酸的末端以防止易位来实现。大的阻塞部分可为链间交联的多核苷酸、大的蛋白(例如,附接到生物素化多核苷酸的链霉亲和素)、大的分子等。
捕集可用于将修饰的多核苷酸存储在纳米反应器中,如在纳米孔中。举例来说,在修饰后,多核苷酸可被捕集在纳米孔中并且存储直到需要读取链内编码的数据,然后可通过将链通过纳米孔移回并且表征编码的数据来重新读取所述链,如本文中更详细描述。
多核苷酸结合蛋白
本发明的一些方法涉及如本文所述的多核苷酸结合蛋白的用途。
多核苷酸结合蛋白可以能够控制多核苷酸相对于纳米反应器的移动。确定蛋白是否结合到多核苷酸在本领域中是简单的。
多核苷酸结合蛋白(例如,多核苷酸解链酶)可以源自多核苷酸处理酶。多核苷酸处理酶是能够与多核苷酸相互作用并且修饰其的至少一个性质的多肽。在一些公开的方法中,多核苷酸处理酶并不需要显示酶促活性,只要其能够结合多核苷酸并且控制其移动通过孔即可。例如,在这种方法中,可以对酶进行修饰以移除其酶促活性或可以在防止其充当酶的条件下使用。
可使用多核苷酸马达,例如聚合酶、解旋酶、易位酶、核酸外切酶等控制多核苷酸相对于纳米反应器的移动。多核苷酸马达在本文中也称为多核苷酸处理酶。
多核苷酸处理酶优选是能够加工长的多核苷酸链而不与多核苷酸解结合的酶。典型地,多核苷酸处理酶能够沿500个核苷酸碱基对直至2.5亿个核苷酸碱基对的多核苷酸链移动,如1,000、2,000、5,000、10,000、50,000或100,000个核苷酸碱基对直至2亿、1亿、1千万或1百万个核苷酸碱基对。
多核苷酸处理酶可以源自溶核酶。多核苷酸处理酶可以源自任何酶分类(EC)组的成员:3.1.11、3.1.13、3.1.14、3.1.15、3.1.16、3.1.21、3.1.22、3.1.25、3.1.26、3.1.27、3.1.30和3.1.31。所述酶可以是WO 2010/086603中公开的酶。
优选的酶是聚合酶、核酸外切酶、解旋酶、易位酶以及拓扑异构酶,如旋转酶。
核酸处理酶可以是聚合酶。当聚合酶沿着多核苷酸移动时,聚合酶通常将合成互补的多核苷酸链。在其他方面,可以以类似于易位酶的方式使用聚合酶。聚合酶可以是保留其沿着多核苷酸移动的能力,但是不合成互补链的修饰的聚合酶。当核酸处理酶是未修饰的聚合酶时,该酶通常能够沿着最高达30kb的多核苷酸移动。可以通过修饰聚合酶以封闭一个开口来增加移动距离,当该酶沿着多核苷酸的一部分进入时,多核苷酸能够从中解结合。对于这类修饰的聚合酶,上面指定的较长的多核苷酸长度可由聚合酶加工聚合酶可为
互补链的合成可能是有利的,因为它增加了多核苷酸的量。增加多核苷酸的量可以提高使用通过该方法选择的多核苷酸的任何后续测定的灵敏度。当多核苷酸含有修饰的碱基时,聚合酶可以用于合成含有正常碱基的互补链,这可能对于使用多核苷酸的后续测定也是有利的。
使用聚合酶可以具有的优点是其可以用于区分受损的多核苷酸与未受损的多核苷酸。例如,聚合酶可能无法穿过DNA中的脱碱基核苷酸或胸腺嘧啶二聚体。因此,可以使用使用聚合酶的方法将受损的多核苷酸从未受损的多核苷酸分离。
拓扑异构酶可以是任何Moiety Classification(EC)组5.99.1.2和5.99.1.3的成员。
解旋酶可以是例如超家族1或超家族2的成员。所述解旋酶是优选地以下家族之一的成员:Pif1样、Upf1样、UvrD/Rep、Ski样、Rad3/XPD、NS3/NPH-II、DEAD、DEAH/RHA、RecG样、REcQ样、T1R样、Swi/Snf样和Rig-I样。这些家族中的前三个家族在超家庭1中以及后十个家族在超家庭2中。解旋酶更优选地是以下亚家族之一的成员:RecD、Upf1(RNA)、PcrA、Rep、UvrD、Hel308、Mtr4(RNA)、XPD、NS3(RNA)、Mss116(RNA)、Prp43(RNA)、RecG、RecQ、T1R、RapA和Hef(RNA)。那些亚家族中的前五个亚家族在超家族1中,以及后十一个亚家族在超家族2中。Upf1、Mtr4、NS3、Mss116、Prp43和Hef亚家族的成员是RNA解旋酶。其他亚家族的成员是DNA解旋酶。
解旋酶可以是多聚或寡聚解旋酶。换句话说,解旋酶可能需要形成多聚体或寡聚体诸如二聚体以起作用。在这样的实施例中,两个或更多个部分不能在不同的单体上。解旋酶优选地是单聚的。换句话说,解旋酶优选地不需要形成多聚体或寡聚体诸如二聚体即可起作用。例如,Hel308、RecD、TraI和XPD解旋酶都是单聚解旋酶。这些将在下文更详细地讨论。确定解旋酶是寡聚/多聚还是单聚的方法是本领域已知的。例如,可以检查使用解旋酶解缠的放射性标记的或荧光标记的多核苷酸的动力学。替代地,可以使用尺寸排阻色谱法分析解旋酶。
单聚解旋酶可以包含附接在一起的若干结构域。例如,TraI解旋酶和TraI亚组解旋酶可以含有两个RecD解旋酶结构域、释放酶结构域和C末端结构域。这些结构域通常形成能够起作用而不会形成寡聚体的单聚解旋酶。
合适的解旋酶的具体实例包括Hel308、NS3、Dda、UvrD、Rep、PcrA、Pif1和TraI。这些解旋酶通常作用于单链DNA。可沿双链DNA的两条链移动的解旋酶的实例包括FtsK和六聚体酶复合物,或多亚基复合物如RecBCD。
解旋酶可以是,例如,在WO 2013/057495、WO 2013/098562、WO2013098561、WO2014/013260、WO 2014/013259、WO 2014/013262和WO/2015/055981中公开的解旋酶、修饰的解旋酶或解旋酶构建体中的任何一个。Hel308解旋酶优选地包含在WO 2014/013260中公开的任何一种或多种修饰。Dda解旋酶优选地包含在WO 2015/055981和/或WO 2016/055777中公开的任何一种或多种修饰。
核酸处理酶可为外切核酸酶。典型地,如果核酸处理酶为核酸外切酶,那么核酸外切酶呈非活性形式,因此当其沿多核苷酸移动时不消化多核苷酸。在方法中可以使用任何外切核酸酶。用于方法的优选的酶包括来自大肠杆菌的外切核酸酶III酶、来自大肠杆菌的外切核酸酶I、噬菌体λ外切核酸酶和衍生自来自大肠杆菌的外切核酸酶III的酶、来自大肠杆菌的外切核酸酶I、噬菌体λ外切核酸酶。衍生自这些外切核酸酶之一的酶优选地包含负责结合至核酸并且用于消化核酸的结构域(催化结构域)。
马达可为单链马达或双链马达如FtsK、噬菌体泵。
可使用单个马达、同一马达的多个单元或马达的组合来控制移动。在本文公开的一些方法中,可使用任何数量的多核苷酸马达。例如,可使用1、2、3、4、5、6、7、8、9、10个或更多个多核苷酸马达。在一些公开的方法中,可使用不同数量的多核苷酸马达。可使用上文提到的多核苷酸马达中的两个或更多个的任何组合。优选的多核苷酸马达为如上文所论述的解旋酶。举例来说,两个或更多个解旋酶可为两个或更多个Dda解旋酶。两个或更多个解旋酶可为一个或多个Dda解旋酶和一个或多个TrwC解旋酶。两个或更多个解旋酶可以是相同解旋酶的不同变体。两个或更多个解旋酶可以优选地彼此附接。两个或更多个解旋酶可以更优选地彼此共价附接。解旋酶可以按任何次序和使用任何方法来附接。用于这种方法的优选的解旋酶构建体描述于WO2014/013260、WO 2014/013259、WO 2014/013262和WO2015/055981中。
可通过本领域众所周知的手段来选择马达的类型、对马达的修饰和运行条件,以控制移动的速度。可更改的条件包括马达、pH、盐浓度、燃料或辅因子浓度的突变等。移动的速度优选地为0.1至10,000核苷酸/秒,最优选地为1至1000核苷酸/秒。
多核苷酸移动通过纳米孔的方向可通过选择马达和多核苷酸在纳米孔中的取向来控制。举例来说,参见PCT/GB2012/052579中的讨论。举例来说,可对多核苷酸进行取向,使得5'末端或3'首先进入孔。这分别称为5'向下或3'向下。可基于马达沿多核苷酸的5'至3'或3'至5'的移动方向来选择马达。通过选择期望的马达并且在期望方向上捕获纳米孔中的多核苷酸,可以以与施加电压相同的方向将多核苷酸进料到纳米孔中,或逆着施加电压将多核苷酸从纳米孔中向回拉出。
举例来说,蛋白质可进行修饰,使得其结合多核苷酸(即保持多核苷酸结合能力)但不充当易位酶(即当具备所有便于移动的必需组分(例如ATP和Mg
当解旋酶不具备便于移动的必需组分或进行修饰以阻止或防止其移动时,所述解旋酶可以结合多核苷酸并且当多核苷酸被施加的场拉入孔中时起到减慢多核苷酸移动的作用。在非活性模式中,多核苷酸是否被3'或5'向下捕获无关紧要,其是通过充当制动器的酶朝向反式侧将多核苷酸拉入孔中的所施加的场。当在非活性模式中时,通过解旋酶对多核苷酸的移动控制可以多种方式(包括棘轮、滑动和制动)描述。还可以以这种方式来使用缺乏解旋酶活性的解旋酶变体。
多核苷酸处理酶可共价附接到纳米反应器,例如孔。多核苷酸可在多于一个(如两个或三个)点处附接到孔。在多于一个点处将孔附接到酶上可用于限制酶的移动性。例如,多个附接可用于限制酶旋转的自由度或其移动远离孔的能力。可使用本领域已知的任何方法将纳米孔共价附接到酶。纳米孔和酶可分开产生,并且然后附接到一起。两种组分可以任何配置附接。例如,所述两种组分可经由其末端(即,氨基或羧基末端)氨基酸附接。合适的配置包括但不限于酶的氨基末端附接到亚基的羧基末端,并且反之亦然。可替代地,所述两种成分可以通过其序列内的氨基酸附接。例如,酶可附接到孔的亚基的环区域中的一个或多个氨基酸。在优选实施例中,酶的末端氨基酸附接到孔的亚基的环区域中的一个或多个氨基酸。
可将纳米孔基因融合到多核苷酸处理酶。如果从单个多核苷酸序列表达整个构建体,那么纳米孔基因融合到酶。可以任何方式组合纳米孔和酶的编码序列以形成对构建体进行编码的单个多核苷酸序列。可以任何配置来将纳米孔和酶基因融合。纳米孔和酶可经由其末端氨基酸来融合。例如,可将酶的氨基末端与纳米孔的羧基末端融合,并且反之亦然。酶的氨基酸序列优选地以框架形式添加到纳米孔的氨基酸序列中。换句话说,优选将酶插入纳米孔的序列内。在这类实施例中,纳米孔和酶典型地在两个点处,即经由酶的氨基和羧基末端氨基酸附接。如果将酶插入纳米孔的序列内,优选的是,酶的氨基和羧基末端氨基酸非常接近并且各自附接到纳米孔或其变体的序列中的相邻氨基酸。在优选实施例中,将酶插入纳米孔的环区域。
可将纳米孔化学融合到多核苷酸处理酶。如果两个部分例如经由接头分子化学附接,那么纳米孔化学融合到酶。
纳米孔可通过hex-his标签或Ni-NTA短暂地附接到多核苷酸处理酶(例如,如WO2010/004265中所讨论的)。纳米孔和酶也可被修饰,使得它们彼此短暂地附接。
可将纳米孔直接附接到多核苷酸处理酶。纳米孔优选地使用一种或多种(如两种或三种)接头附接到酶。一个或多个接头可被设计成限制酶的移动性。接头可附接到纳米孔和/或酶中的一个或多个反应性半胱氨酸残基、反应性赖氨酸残基或非天然氨基酸。合适的接头在本领域中为众所周知的。合适的接头包括但不限于化学交联剂和肽接头。优选的接头为氨基酸序列(即,肽接头)。肽接头的长度、柔性和亲水性典型地被设计为使得其不干扰纳米孔和酶的功能。优选的柔性肽接头是2个到20个,如4个、6个、8个、10个或16个丝氨酸和/或甘氨酸的延伸段。更优选的柔性接头包括(SG)
接头可首先附接到纳米孔并且然后附接到多核苷酸处理酶,首先附接到酶并且然后附接到纳米孔,或者同时附接到酶和纳米孔。当接头附接到纳米孔时,其可为单体纳米孔、两种或更多种单体的寡聚物的一部分或完全寡聚孔的一部分。优选的是,在任何纯化步骤之前,使接头反应以去除任何未结合的接头。
分子制动器
如上文所讨论,分子制动器可为与多核苷酸结合并且减慢多核苷酸通过孔的移动的任何化合物或分子。分子制动器可以是上文讨论的任何一种。分子制动器优选地包含与多核苷酸结合的化合物。所述化合物优选地是大环化合物。合适的大环包括但不限于环糊精、杯芳烃、环肽、冠醚、葫芦脲、柱芳烃、其衍生物或其组合。环糊精或其衍生物可以是在Eliseev,A.V.和Schneider,H-J.(1994)《美国化学协会期刊(J.Am.Chem.Soc)》116:6081-6088。环糊精更优选地为七-6-氨基-β-环糊精(am
封闭的复合物
酶可以是修饰的或未修饰的。可以修饰酶以形成封闭的复合物。封闭的复合物是其中多核苷酸结合位点被修饰使得该酶以这样的方式封闭在多核苷酸周围,以使酶到达多核苷酸的端时不会从多核苷酸上脱落的酶。封闭的结构可防止不想要的马达解结合,从而使得能够加工更长的多核苷酸。封闭的结构还使得马达能够穿过非天然多核苷酸区域(如无碱基位点)而不需要解结合。用于修饰酶以产生封闭的复合物的合适的封闭的复合酶的实例和方法在例如WO 2014/013260和WO 2015/055981中公开。
酶-孔构建体
在一些实施例中,对于活性或非活性酶控制,酶在纳米孔的顺式和反式入口中的任一个或两个上与纳米孔连接。如果纳米孔足够大以将马达容纳在内部通道中,那么可将马达连接在纳米孔内部。
使用热量控制多核苷酸的移动
在纳米孔上时,可通过各种手段控制马达的移动。举例来说,在一些实施例中,可期望暂停或减慢马达,以便进行反应以修饰多核苷酸,并且然后再次重启或加速马达以沿多核苷酸移动至连续区域。
马达的速度可通过修饰围绕纳米孔的局部环境来控制,例如通过更改燃料或辅因子条件、pH值、温度等来控制。
举例来说,可通过直接照亮纳米孔或通过激发附近的纳米颗粒或等离子导向器来控制纳米孔中或附近的局部温度,例如连接到纳米孔的金纳米颗粒(参见Yamazaki等人,《纳米快报(Nano Letters)》2017 17(11),7067-7074和Reiner等人l,《美国化学会志(J AmChem Soc.)》2013年2月27日;135(8):3087-94)。当在大面积上照亮系统时,可使用这些方法来增强局部区域的温度改变。当照亮时,系统可产生局部加热,可通过系统的设计和照亮强度来控制局部加热的程度和范围,而其余整体环境的环境温度没有显著更改。当光线断开时,随着热量散发,局部温度升高迅速返回到环境温度(例如,在不到1秒内)。通过控制如环境温度、具有或不具有光学增强剂的纳米孔系统的特性以及照亮条件的方面,可以严格控制纳米反应器所经历的局部温度。这可用于控制例如多核苷酸的移动或用于修饰多核苷酸的反应条件。
局部温度改变可用于控制多核苷酸通过纳米孔的移动。举例来说,温度控制可用于控制加工燃料(如ATP)沿多核苷酸移动的酶的反应动力学。本领域已知多核苷酸加工酶的酶促循环中的各个步骤(包括NTP结合、NTP水解、酶异构化、产物解结合的步骤)的动力学速率取决于温度。如果事先不知道,那么可通过本领域中已知的各种实验手段来确定酶促循环中的子步骤的速率和/或整个NTP周转循环的平均速率。由于NTP水解严格调节许多多核苷酸酶沿多核苷酸移动的速度,因此温度改变可用于控制多核苷酸马达沿多核苷酸移动的平均速度,并且因此控制多核苷酸移动通过纳米孔的速度。因此,例如,可照亮酶马达附近的等离子导向器以控制局部温度以控制酶的速度。举例来说,当不照亮时,可设置环境条件,以使马达的速度减慢或停止。照亮状态可被配置成加热马达,然后启动或增加移动的速度。照亮的程度和持续时间可用于分别控制酶沿多核苷酸移动的速度改变的程度以及多核苷酸的近似长度。
温度控制还可用于控制活性或非活性马达的结合或滑动。举例来说,在低温下,马达可与多核苷酸强结合,而在高温下,马达可与多核苷酸弱结合。因此,在对多核苷酸施加近似恒定力的固定施加电压下,可通过调节酶-多核苷酸结合相互作用的强度来调节多核苷酸的移动。举例来说,可控制条件,使得在低环境温度下酶将强结合,并且多核苷酸的移动可减慢或停止。然后经由等离子导向器的照亮来提高温度可用于降低酶-多核苷酸相互作用的强度,从而使多核苷酸更快地滑过纳米孔。
温度也可用于熔化二级结构。因此,在使用二级结构控制移动的情况下,施加热量可用于熔化二级结构,以使多核苷酸在施加电压场中向前移动。
系统可被配置成用附接的等离子导向器照亮纳米孔的阵列,以规则或不规则的间隔照亮阵列的部分或整个阵列以控制多核苷酸的移动。举例来说,可以固定的周期性间隔充分照亮纳米孔的阵列,使得每个多核苷酸-纳米孔复合物中的每个多核苷酸同步向前移动。这可与异步修饰(例如通过更改电压的化学手段)偶联以选择性修饰期望区域中的每个多核苷酸。
使用电压控制多核苷酸的移动
电压可用于控制多核苷酸通过纳米孔的移动。施加电压的幅度与施加到带电多核苷酸的力的大小成正比。施加的力的幅度取决于电压的大小、系统条件(盐浓度、pH、温度)和纳米孔。
反应条件
本发明的方法包含选择性修饰多核苷酸链的部分。在一些实施例中,这类方法包含选择性控制在多核苷酸链的每个部分内被修饰的核苷酸的数量。举例来说,在一些实施例中,可选择性修饰1个核苷酸。在其它实施例中,可选择性修饰多于一个核苷酸;可选择性修饰例如1至约1000个核苷酸,如约10至约500,例如约50至约250个核苷酸。多核苷酸链的不同部分可具有不同数量的修饰的核苷酸,从而加以区分。
在其它实施例中,方法包含选择性控制对在多核苷酸链的每个部分内被修饰的核苷酸进行的修饰的程度。举例来说,在一些实施例中,当部分在纳米反应器内一段延长的时间段时,可对在纳米反应器内的多核苷酸链的一部分内的核苷酸进行广泛修饰,而多核苷酸链的其它部分可在纳米反应器内较短的时段并且不太广泛地修饰。因此,可将多核苷酸链的不同部分修饰至不同程度,从而加以区别。
在一些实施例中,选择性修饰多核苷酸链的部分包含(i)多核苷酸链的一部分的断裂,例如多核苷酸链上的一个或多个侧链的断裂;(ii)链的修饰,例如链上的一个或多个侧链的修饰;和/或(iii)添加到链上,例如在多核苷酸链上的残基的主链或侧链上的附加侧接化学基团。当选择性修饰多核苷酸链包含断裂反应时,反应典型地不是多核苷酸主链的断裂,使得整个链长度保持不被修饰反应更改。
在本发明中,选择性修饰多核苷酸链的部分典型地包含使纳米反应器中的多核苷酸链的部分经受包含以下的反应条件:(i)一种或多种化学试剂的存在、不存在或浓度;(ii)在酶修饰多核苷酸链内的核苷酸的条件下使酶与多核苷酸链接合;(iii)电磁辐射的存在或不存在;和/或(iv)施加热量的存在或不存在。
在一些实施例中,纳米反应器中多核苷酸链的修饰可通过跨越纳米反应器施加电位或化学电位来控制纳米反应器中一种或多种化学试剂的存在、不存在或浓度来控制。举例来说,当使用带电荷的试剂时,则化学电位可用于控制这类物质向纳米反应器中的移动,并且因此控制这类试剂在纳米反应器中的浓度。可通过改变施加电压来更改通过纳米孔的离子通量条件,因此可使用化学电位或电压控制,而不管化学试剂是否带电。可使用化学电位和电位。
典型地,这类化学试剂至少包含第一试剂和第二试剂。第一试剂和第二试剂与纳米反应器中的多核苷酸链的部分反应。然而,本发明不限于其中使用多种试剂的实施例。本发明可涉及仅使用一种化学试剂来修饰多核苷酸,或者可使用多种试剂。在示例性实施例中,使用两种试剂。
存在许多合适的用于修饰多核苷酸的反应的试剂组合,如金属离子和氧化剂如过氧化物等的组合。在本发明中,可检测到任何合适的修饰。举例来说,可对纳米反应器中的多核苷酸的主链、糖和/或碱基进行修饰。
在一些实施例中,通过点击化学反应来修饰纳米反应器中的多核苷酸。在一些实施例中,点击反应是在多核苷酸上的反应性基团与溶液中或附接到纳米反应器的反应性分子之间。在纳米孔纳米反应器内进行的点击化学已在例如Haugland等人,“《合成多样化蛋白纳米孔:解决点击反应机制(Synthetically Diversified Protein Nanopores:Resolving Click Reaction Mechanisms)》”《美国化学学会·纳米(ACS Nano)》2019中进行描述。点击化学反应和试剂的实例在本文中更详细描述。
在本发明的方法中,典型地期望不修饰在纳米反应器外部的多核苷酸,而如本文所述修饰在纳米反应器内的多核苷酸的部分。这可通过将化学试剂定位在纳米反应器中来实现。可通过将试剂精确地提供给纳米反应器或通过在纳米反应器中合成试剂来实现化学试剂在纳米反应器中的定位。也可通过使用保护剂从在纳米反应器外部的环境中去除化学试剂来实现化学试剂在纳米反应器中的定位。因此,典型地在纳米反应器外部提供一种或多种保护剂,以最小化或防止在纳米反应器外部的一种或多种化学试剂对多核苷酸的修饰。
合适的保护剂为本领域已知的,并且可使用任何合适的保护剂,这取决于期望靶向的化学试剂的性质,例如螯合剂、抗氧化剂、除氧剂、还原剂等。特别合适的保护剂包括螯合剂。合适的螯合剂已知用于各种化学试剂,包括阳离子和阴离子。举例来说,螯合剂如EDTA可用于从在纳米反应器外部的环境(例如从纳米孔的内腔外部的环境)去除金属离子。其它合适的螯合剂包括维生素B12、柠檬酸、冠醚、杯芳烃等。
当在本发明的方法中使用保护剂时,典型地相对于所讨论的化学试剂的量过量使用保护剂。保护剂通常以所讨论的化学试剂浓度的至少两倍,如至少5倍、至少10倍、至少100倍或至少1000倍的量存在。
保护剂通常位于系统的与旨在隔离的大部分化学试剂的隔室不同的隔室中。举例来说,在本发明的方法中,其中金属离子用于修饰多核苷酸,金属离子通常位于纳米反应器如膜中的纳米孔的反式,使得当将正电压施加到纳米孔的反侧时,金属离子通过纳米孔从反式隔室流向顺式隔室。在这种情况下,典型地在顺式隔室中存在保护剂如EDTA,以便隔离流过纳米孔的金属离子,使得顺式隔室中的多核苷酸除了在纳米孔中时以外没有被修饰。
在一些实施例中,化学敏化剂用于促进纳米反应器中多核苷酸链的氧化还原修饰。在一些实施例中,氧化还原介体用作化学敏化剂。实例包括过氧化物、抗坏血酸等。
在其它实施例中,可通过使用多核苷酸修饰酶在纳米反应器中修饰多核苷酸。许多不同的多核苷酸修饰酶为本领域已知的,并且适用于本文公开的方法。多核苷酸修饰酶在本文中更详细讨论。
典型地,在使用多核苷酸加工酶的本发明的实施例中,多核苷酸加工酶修饰多核苷酸链内核苷酸的碱基部分。然而,可对多核苷酸链的“主链”进行修饰,例如对磷酸二酯键和/或糖进行修饰。
在一些实施例中,多核苷酸加工酶对多核苷酸的修饰通过控制用于酶的燃料和/或底物的存在、不存在或浓度来控制。举例来说,对于NTP驱动的核酸修饰酶,控制纳米反应器中NTP(例如ATP)的浓度可允许多核苷酸加工酶对多核苷酸进行修饰。
一些多核苷酸加工酶响应于在多核苷酸底物上施加的物理力诱导的构象改变。因此,可通过控制施加在多核苷酸上的力来控制多核苷酸的修饰或其他。合适的力包括通过跨越纳米反应器例如跨越膜中的纳米孔施加电压而施加的电泳力。变化施加的电压导致施加在多核苷酸加工酶上的力的变化,并且控制酶在修饰多核苷酸中的活性。
一些多核苷酸加工酶仅对单链或双链多核苷酸选择性起作用。纳米反应器可用于控制多核苷酸的杂交结构,以使得能够在需要时进行选择性结合和修饰。举例来说,易位通过纳米孔的DNA链可根据需要暂停足够长的时间,用于使短的二级多核苷酸杂交以形成dsDNA区域,ds-DNA选择酶可与其结合以修饰DNA(例如,修饰特定DNA碱基的DNA-甲基转移酶)。
在一些实施例中,方法包含使纳米反应器中的多核苷酸链的部分与呈光,优选地可见光或紫外光形式的电磁辐射接触。可使用任何适合手段将光施加到纳米反应器。光纤可用于将光传递到纳米反应器。激光可用于照射纳米反应器。
在一些实施例中,方法涉及在纳米反应器中照射光敏剂以修饰多核苷酸链。可使用任何合适的光敏剂。合适的光敏剂包括卟啉等。在一些实施例中,敏化剂为光激发分子。在一些实施例中,敏化剂在激发下为稳定的。
在一些实施例中,敏化剂为基于无机的纳米颗粒或基于有机的染料。敏化剂可根据其特定特性来选择,包括:尺寸、激发波长、发射波长、暴露时的反应性特性、表面化学性质等。敏化剂可为本领域已知的任何重新发射光源,其在全局照亮时将局部重新发光。众所周知的实例包括有机染料和荧光团、颗粒这类纳米点等。
在一些实施例中,方法涉及在纳米反应器中照射敏化剂并且将辐射从敏化剂转移至纳米反应器中的多核苷酸链以修饰多核苷酸链。举例来说,敏化剂可为金属纳米颗粒,和/或其中所述辐射为电磁辐射或热辐射。
在一些实施例中,光敏剂可包含氧化还原酶或其辅因子。在一些实施例中,光敏剂可包含纳米颗粒。在一些实施例中,光敏剂可包含有机或无机染料。合适的染料包括吖啶橙、亚甲基蓝等。
在一些实施例中,敏化剂为有机分子,如核黄素。
在一些实施例中,敏化剂附接到纳米反应器。在一些实施例中,纳米反应器为纳米孔,并且敏化剂附接到纳米孔的表面。
在一些实施例中,敏化剂附接到纳米孔的外部部分,因此在进入或离开纳米孔的多核苷酸附近。
在一些实施例中,敏化剂附接到纳米孔的内表面,例如穿过纳米孔的通道的表面。这可为有益的,因为它增加仅选择性修饰附近的可光裂解元件,而不是沿典型地非常柔性的多核苷酸分子定位的其它可光裂解元件的机会,否则它们可短暂地接近敏化剂,除非堵塞。将敏化剂放置在纳米孔内的附加优点是,如果放置正确,那么反应可在阅读器上或附近发生,使得可原位检测到修饰后的电流改变。
在一些实施例中,敏化剂被放置在纳米孔的入口或出口附近,或在收缩区域中。举例来说,已知许多具有广泛范围的内部尺寸的生物学衍生的纳米孔,其内腔的直径范围为<1nm至>10nm。众所周知的实例包括α-溶血素、MspA、CsgG、气溶素、Phi29门户等。同样,一系列小的敏化剂在本领域中为众所周知的(典型地直径<10nm,优选1-4nm)。
在一些实施例中,例如采用二硫化物或马来酰亚胺化学,例如通过共价附接到反应性氨基酸上,将敏化剂直接附接到纳米孔上。
在一些实施例中,敏化剂为纳米颗粒,并且附接到纳米孔纳米反应器。纳米颗粒与α-溶血素的附接在Reiner等人,《美国化学协会期刊》,27(135)2013中证明。纳米孔中小纳米颗粒的内化在Chavis等人,《美国化学学会传感器(ACS Sensors)》,2017(doi:10.1021/acssensors.7b00362)中证明
在一些实施例中,敏化剂在与要修饰的多核苷酸链上的可光裂解基团接合的位置上附接到纳米孔。举例来说,在一些实施例中,敏化剂定位在链上的可光裂解基团的约10nm内,例如约5nm内,如约3nm内,例如约2nm内,如约1nm内。
在一些实施例中,通过马来酰亚胺化学(例如通过附接到纳米孔中的半胱氨酸)将敏化剂附接到纳米反应器(例如纳米孔)。举例来说,在一些实施例中,纳米反应器为CsgG纳米孔,并且敏化剂与在CsgG纳米孔中的合适残基处引入的半胱氨酸突变缀合。本领域技术人员也可容易地鉴定其它蛋白质纳米孔上的合适位置。
纳米反应器中多核苷酸的修饰可使用加热来实现。可使用任何合适的手段施加热量。举例来说,可通过将热量从照射的敏化剂转移至多核苷酸来施加局部热量。敏化剂可为等离子导向器,如连接到纳米孔的金纳米颗粒。如上文所讨论,当在大面积上照亮系统时,可使用等离子导向器来增强局部区域的温度改变。当照亮时,等离子导向器产生局部加热(在等离子导向器的几十纳米之内),而其余整体环境的环境温度没有显著更改。当光线断开时,随着热量散发,局部温度升高迅速返回到环境温度(通常在不到几秒内)。因此,与纳米孔或马达连接或邻近的等离子导向器可用于更改局部温度,例如至多数十度。因此,纳米反应器中局部温度的控制可用于控制纳米反应器内多核苷酸的修饰。
在一些实施例中,纳米反应器设置,例如纳米反应器阵列,可全局经受反应条件以修饰阵列中每个纳米反应器内的多核苷酸的部分。全局反应条件可包括例如(如本文中更详细描述的)用光照射、加热、与一种或多种化学试剂接触(例如,通过用含有反应性组分的缓冲液冲洗流通池)。每个反应暴露的持续时间和模式可变化以控制修饰模式。
在一些实施例中,反应条件为在特定频率下的照射脉冲。举例来说,如本文中更详细描述的,光脉冲可用于激发纳米孔上的敏化剂,其局部地重新发射辐射以裂解纳米孔中DNA单元上的相邻可光裂解的侧链。
数据读取
本发明的方法可另外包含以下步骤:
(C)确定在多核苷酸链上的选择性修饰的模式。
如上文所解释,这类方法典型地涉及通过确定对多核苷酸链进行的修饰的存在、不存在、程度或特性来确定在多核苷酸链上的选择性修饰的模式。
在一些实施例中,方法包含表征修饰的多核苷酸链。这类表征不同于确定对多核苷酸链进行的修饰的存在、不存在、程度或特性。本发明的方法可包含确定对多核苷酸链进行的修饰的存在、不存在、程度或特性,但不另外表征修饰的多核苷酸链。本发明的方法可包含表征修饰的多核苷酸链,但不确定对多核苷酸链进行的修饰的存在、不存在、程度或特性。本发明的方法可有益地包含确定对多核苷酸链进行的修饰的存在、不存在、程度或特性,和表征修饰的多核苷酸链。
如以上所解释的,表征修饰的多核苷酸链可允许确定关于多核苷酸链“主链”的信息,例如其序列或任何一种或多种特定核苷酸的百分比含量。确定对多核苷酸链进行的修饰的存在、不存在、程度或特性可允许读取被编码为其上的单独“层”的数据。例如通过测序来表征修饰的多核苷酸链,在允许确定对多核苷酸链进行的修饰的位置方面可为有用的。当对在链上编码的数据进行解码时,这可为有用的。
典型地,在这些方法中,确定在多核苷酸链上的选择性修饰的模式和/或表征修饰的多核苷酸链包含:
i)使检测器与修饰的多核苷酸链接触,使得多核苷酸链相对于检测器移动;和
ii)当多核苷酸链相对于检测器移动时进行指示修饰的多核苷酸链的一个或多个特性的一个或多个测量。
在本发明的方法中,检测器可为任何合适的检测器。举例来说,如本文中更详细描述的,可使用修饰的多核苷酸的电或光学检测。通常,检测器为跨膜孔。有利地,使用纳米孔系统读取在多核苷酸链上编码的数据允许使用不可使用非纳米孔测序方法读取的多核苷酸修饰。
在这类实施例中,方法通常包含:
a)使孔与修饰的多核苷酸链接触;
b)跨越孔施加电位差;和
c)进行指示修饰的多核苷酸链相对于孔移动的一个或多个特性的一个或多个测量并且由此确定在多核苷酸链上的选择性修饰的模式和/或表征修饰的多核苷酸链。
在这类方法期间可测量任何合适的特性。通常,指示修饰的多核苷酸的特性的测量为电流测量。因此,本发明的方法可包含在修饰的多核苷酸链相对于跨膜孔移动时测量穿过跨膜孔的电流。
通常,在本发明的方法中,纳米反应器包含纳米孔;并且确定在多核苷酸链上的选择性修饰的模式和/或表征修饰的多核苷酸包含(i)使同一纳米孔与修饰的多核苷酸链接触,使得多核苷酸链相对于纳米孔移动;和(ii)当多核苷酸链相对于纳米孔移动时进行指示修饰的多核苷酸链的一个或多个特性的一个或多个测量。因此,本领域技术人员将认识到,在这些实施例中,将同一纳米孔用作纳米反应器和检测器。换句话说,纳米孔(同一纳米孔)既可充当“写头”以用于在多核苷酸链相对于纳米孔移动时在多核苷酸链上编码数据,也可充当“读头”以用于读取由此在多核苷酸链上编码的数据。可在对多核苷酸链进行修饰时(即在编码数据时)或在后续阶段(例如在存储修饰的多核苷酸链之后)读取数据。
应当理解,在检测之前,修饰的多核苷酸可必须使用本领域众所周知的手段进行加工。举例来说,对于一些纳米孔读出方法,可必需将测序衔接子与马达附接,以控制多核苷酸通过纳米孔的移动。
其它测序技术也可用于表征根据本发明的修饰的多核苷酸。举例来说,可使用Sanger测序来表征修饰的多核苷酸。更经常地,使用并行化的下一代测序技术来表征修饰的多核苷酸。可使用任何合适的测序技术。多核苷酸可必须在读出之前用一些技术进行加工。举例来说,可需要使用常规聚合酶扩增技术来扩增多核苷酸。如果被扩增或复制,那么修饰的多核苷酸中编码的信息需要直接或间接地传播至原始链的拷贝。
DNA的加工
在一些实施例中,多核苷酸保持不更改,并且保持捕集在纳米孔中以在稍后的点处在同一纳米孔中读出。可替代地,将修饰的多核苷酸从纳米孔中去除,并且然后不经另外加工即以小体积例如以水性液滴或微孔进行存储。
在一些实施例中,修饰的多核苷酸经历另外的加工步骤。举例来说,可将多核苷酸扩增、切割成链段、连接到其它多核苷酸、从单链改变为双链形式(例如,通过聚合酶填充)等。
可加工多核苷酸以另外修饰链。举例来说,通过使多核苷酸暴露于与修饰的或未修饰的部分反应的条件。加工多核苷酸可例如用于稳定修饰化学的目的,如在最初修饰对于延长的长期存储不稳定的情况下。
可使用本领域众所周知的常规聚合酶扩增技术通过扩增来加工多核苷酸。如果被扩增或复制,那么修饰的多核苷酸中编码的信息应直接或间接地传播至原始链的拷贝。为了产生在修饰的链中编码的原始信息的拷贝,可采用扩增。可替代地,可采用扩增来更改多核苷酸或放大其数量,以使其处于适于下游过程的状态,例如在一些技术如Sanger测序上读出。
系统和用途
还提供一种用于在多核苷酸链上编码数据的系统,系统包含纳米反应器,纳米反应器被配置成当多核苷酸链移动通过纳米反应器时选择性修饰多核苷酸链的部分。在一些实施例中,系统包含用于控制多核苷酸链穿过纳米反应器的移动的纳米孔和/或用于在纳米反应器中修饰的多核苷酸。
还提供一种用于读取在多核苷酸链上编码的数据的系统;系统包含检测器,检测器被配置成当多核苷酸链相对于检测器移动时确定在多核苷酸链上的选择性修饰的模式。在一些实施例中,系统包含修饰的多核苷酸链用于由所述检测器进行分析。
还提供一种数据编码/数据读取平台,其包含:
i)纳米反应器,其被配置成当多核苷酸链移动通过纳米反应器时选择性修饰多核苷酸链的部分;
ii)任选的存储装置,其用于存储在纳米反应器中修饰后的多核苷酸链;和
iii)检测器,其被配置成当多核苷酸链相对于检测器移动时确定在多核苷酸链上的选择性修饰的模式。
在一些实施例中,纳米反应器和/或检测器包含纳米孔。通常,纳米反应器和检测器包含同一纳米孔。
还提供一种纳米孔和/或围绕纳米孔的纳米体积作为纳米反应器的用途,其用于当多核苷酸链相对于纳米孔移动时选择性修饰多核苷酸链的部分。典型地,在这类用途中选择性修饰多核苷酸链用于在所述多核苷酸链上编码数据。
还提供一种数据存储介质,其包含选择性修饰的多核苷酸,其中所述修饰的多核苷酸可使用如本文所述的方法获得。
平台
本文中还提供一种数据编码/数据读取平台,其包含:
i)纳米反应器;
ii)使位于纳米反应器中的多核苷酸经受反应条件以修饰多核苷酸的装置;
iii)用于存储在纳米反应器中修饰后的多核苷酸的任选存储装置;和
iii)检测器,其被配置成检测对修饰的多核苷酸进行的修饰的存在、不存在、程度或特性。
在平台中,纳米反应器典型地为如本文所述的纳米反应器。平台包括用于使纳米反应器中的多核苷酸经受反应条件以修饰多核苷酸的装置。反应条件可为本文所述的任何条件。装置可包括用于向纳米反应器施加光、热、电压或化学试剂的装置。
平台优选地含有单个或全局可寻址的纳米孔或纳米反应器的阵列。纳米反应器阵列的合适实例包括零模波导的阵列、纳米孔的阵列或水性液滴的阵列。
平台可包含用于存储在纳米反应器中修饰后的多核苷酸的存储装置。可使用任何适合的存储装置。修饰的多核苷酸可被存储在其中它们也被修饰的纳米孔中,并且可根据需要在同一纳米孔中读出或在稍后阶段释放。修饰的多核苷酸可通过将它们完全易位至芯片上的反式孔体积来存储。修饰的多核苷酸可例如被存储在水性液滴阵列中。优选地,将修饰的多核苷酸存储在可移动的液滴中,使得它们能够移动到用于存储的位置,和/或根据需要进行加工,和/或重新连接到具有纳米孔的新液滴以供稍后读出。任何单个存储体积可含有单个修饰的多核苷酸或多个差异修饰的多核苷酸。
膜
在膜中存在纳米孔的本发明的方法中,可使用任何合适的膜。
膜优选是两亲层或固态层。
两亲层是由两亲分子形成的层,所述两亲分子如磷脂,其具有亲水性和亲脂性两种特性。两亲分子可以是合成的或天然存在的。非天然存在的两亲物和形成单层的两亲物在所属领域中是已知的,且包括例如嵌段共聚物(Gonzalez-Perez等人,《朗缪尔(Langmuir)》,2009,25,10447-10450)。
嵌段共聚物是聚合在一起的两个或更多个单体亚基产生单一聚合物链的聚合材料。嵌段共聚物通常具有通过每个单体亚基贡献的性质。然而,嵌段共聚物可具有由个别子单元形成的聚合物不拥有的独特特性。嵌段共聚物可进行工程改造,使得单体子单元中的一个在水性介质中是疏水性的(即亲脂性),而其它子单元是亲水性的。在这种情况下,嵌段共聚物可拥有两亲特性,且可形成模拟生物膜的结构。嵌段共聚物可以是二嵌段的(其由两个单体子单元组成),但也可由超过两个的单体子单元来构建,形成表现为两亲物的更复杂的排列。共聚物可以是三嵌段、四嵌段或五嵌段共聚物。膜优选是三嵌段共聚物膜。
古细菌双极性四醚脂质是天然存在的脂质,其被构建成使得脂质形成单层膜。这些脂质一般发现于在苛刻生物环境中存活的嗜极生物、嗜热生物、嗜盐生物和嗜酸生物中。认为其稳定性是源于最终双层的融合性质。直接了当的做法是,通过产生具有一般基序亲水性-疏水性-亲水性的三嵌段聚合物来构建模拟这些生物实体的嵌段共聚物材料。这种材料可形成表现类似于脂质双层并且涵盖从囊泡到层状膜的一系列阶段表现的单体膜。由这些三嵌段共聚物形成的膜在生物脂质膜上保持若干优势。因为合成三嵌段共聚物,所以可小心地控制准确的构建,以提供形成膜和与孔和其它蛋白质相互作用所需的正确链长度和特性。
还可由不分类为脂质亚材料的子单元来构建嵌段共聚物;例如可由硅氧烷或其它非基于烃的单体来制成疏水性聚合物。嵌段共聚物的亲水性亚区段还可以具备低蛋白质结合特性,这允许产生当暴露于原始生物样品时具有高度抗性的膜。这种头基单元还可来源于非经典的脂质头基。
与生物脂质膜进行比较,三嵌段共聚物膜还具有增加的机械和环境稳定性,例如高许多的操作温度或pH范围。嵌段共聚物的合成性质提供定制用于广泛范围应用的基于聚合物的膜的平台。
膜最优选地是国际申请第WO2014/064443号或第WO2014/064444号中所公开的膜中的一个。
两亲分子可进行化学修饰或官能化,以便于偶联聚核苷酸。两亲层可以是单层或双层。两亲层通常是平面的。两亲层可以是弯曲的。两亲层可以是支撑式的。
两亲膜通常天然地是可移动的,基本上以大致10
膜可以是脂质双层。脂质双层是细胞膜的模型,且用作一系列实验研究的极佳平台。举例来说,脂质双层可用于通过单通道记录对膜蛋白的活体外研究。替代地,脂质双层可用作检测一系列物质的存在的生物传感器。脂质双层可以是任何脂质双层。合适的脂质双层包括但不限于平面脂质双层、支持双层或脂质体。脂质双层优选地是平坦脂质双层。合适脂质双层公开于WO2008/102121、WO 2009/077734和WO 2006/100484中。
用于形成脂质双层的方法在所属领域中是已知的。脂质双层通常通过Montal和Mueller的方法(《美国国家科学学院院报(Proc.Natl.Acad.Sci.USA.)》,1972;69:3561-3566)来形成,其中脂质单层携载于通过开孔两侧的水溶液/空气界面上,所述开孔垂直于所述界面。通常通过首先将脂质溶解在有机溶剂中,且接着使在开孔两侧上的水溶液的表面上蒸发一滴溶剂,来将脂质添加到水性电解质溶液的表面。一旦有机溶剂已蒸发,那么开孔两侧上的溶液/空气界面来回物理地移动通过开孔,直到形成双层为止。可跨越膜中的开孔或跨越凹槽中的开口形成平坦脂质双层。
Montal和Mueller的方法是常用的,这是因为是节约成本的,且是形成适合于蛋白孔插入的良好品质脂质双层的相对直接了当的方法。双层形成的其它常见方法包括脂质体双层的尖端浸没、双层涂刷和贴片夹持。
尖端浸没双层形成需要使开孔表面(例如移液管尖端)接触到携载脂质单层的测试溶液的表面。同样,通过将溶解于有机溶剂中的一滴脂质在溶液表面处蒸发来首先在溶液/空气界面处产生脂质单层。接着,通过朗缪尔-沙佛(Langmuir-Schaefer)过程形成双层,且需要机械自动以使开孔相对于溶液表面移动。
对于涂刷的双层,将溶解于有机溶剂中的一滴脂质直接应用于开孔,所述开孔浸没在水性测试溶液中。使用笔刷或等效物,使脂质溶液稀薄地扩散在开孔内。溶剂的薄化使得形成脂质双层。然而,从双层完全去除溶剂是非常困难的,且因此通过这种方法形成的双层较不稳定且更倾向于在电化学测量期间具有噪声。
贴片夹持是在生物细胞膜研究中常用的。通过抽汲将细胞膜夹持到移液管的末端,且膜贴片变为附接在开孔内。所述方法适用于通过夹持接着爆裂以离开密封在移液管的开孔内的脂质双层的脂质体来产生脂质双层。所述方法需要稳定的、巨大的且单层脂质体和在具有玻璃表面的材料中制造小开孔。
可通过超声处理、挤压或Mozafari方法来形成脂质体(Colas等人(2007)《Micron》38:841-847)。
在一优选实施例中,如国际申请第WO 2009/077734号中所描述形成脂质双层。在此方法中有利的是,由干燥脂质形成脂质双层。在一最优选实施例中,跨越开口形成脂质双层,如WO2009/077734中所描述。
由脂质的两个相对层形成脂质双层。两个脂质层被布置成使得其疏水尾部基团面朝彼此,形成疏水性的内部。脂质的亲水性头基朝外面向双层每侧上的水性环境。双层可存在于多种脂质阶段中,所述阶段包括(但不限于)液体无序阶段(液体片层)、液体有序阶段、固体有序阶段(片层凝胶阶段、交错结合的凝胶阶段)和平坦双层晶体(片层亚凝胶阶段、片层结晶阶段)。
可使用形成脂质双层的任何脂质组合物。选择脂质组合物,使得脂质双层具有所需的特性,例如表面电荷、支持膜蛋白的能力、充填密度或所形成的机械特性。脂质组合物可包含一种或多种不同脂质。举例来说,脂质组合物可含有最多100种脂质。脂质组合物优选地含有1到10种脂质。脂质组合物可包含天然存在的脂质和/或人工脂质。
脂质通常包含头基、界面部分和可相同或不同的两个疏水尾部基团。合适的头基包括(但不限于):中性头基,例如二酰基甘油酯(DG)和脑酰胺(CM);两性离子头基,例如磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)和鞘磷脂(SM);带负电头基,例如磷脂酰甘油(PG);磷脂酰丝氨酸(PS)、磷脂酰肌醇(PI)、磷脂酸(PA)和心磷脂(CA);和带正电头基,例如三甲基铵丙烷(TAP)。合适界面部分包括(但不限于)天然存在的界面部分,例如基于甘油或基于脑酰胺的部分。合适的疏水尾部基团包括(但不限于):饱和烃链,例如月桂酸(正十二烷酸)、肉豆蔻酸(正十四烷酸)、棕榈酸(正十六烷酸)、硬脂酸(正十八烷酸)和花生酸(正二十烷酸);不饱和烃链,例如油酸(顺-9-十八烷酸);和分支链烃链,例如植烷酰基。链的长度和不饱和烃链中的双键的位置与数量可变化。链的长度和分支链烃链中的分支(如甲基)的位置和数量可变化。疏水尾部基团可作为醚或酯连接到界面部分。脂质可以是分枝菌酸。
脂质还可以进行化学修饰。脂质的头基或尾部基团可以进行化学修饰。头基已进行化学修饰的合适脂质包括(但不限于):PEG修饰的脂质,例如1,2-二酰基-sn-甘油-3-磷酸乙醇胺-N-[甲氧基(聚乙二醇)-2000];官能化的PEG脂质,例如1,2-二硬脂酰基-sn-甘油-3磷酸乙醇胺-N-[生物素基(聚乙二醇)2000];和针对缀合修饰的脂质,例如1,2-二油酰基-sn-甘油-3-磷酸乙醇胺-N-(丁二酰基)和1,2-二棕榈酰基-sn-甘油-3-磷酸乙醇胺-N-(生物素基)。尾部基团已进行化学修饰的合适脂质包括(但不限于):可聚合脂质,例如1,2-双(10,12-三辅二炔基)-sn-甘油-3-磷酸胆碱;氟化脂质,例如1-软脂酰基-2-(16-氟软脂酰基)-sn-甘油-3-磷酸胆碱;氘化脂质,例如1,2-二棕榈酰基-D62-sn-甘油-3-磷酸胆碱;和醚连接的脂质,例如1,2-二-O-植烷基-sn-甘油-3-磷酸胆碱。脂质可以进行化学修饰或官能化,以便于偶联多核苷酸。
两亲层,例如脂质组合物,通常包含将影响层的特性的一种或多种添加剂。合适的添加剂包括(但不限于):脂肪酸,例如棕榈酸、肉豆蔻酸和油酸;脂肪醇,例如棕榈醇、肉豆蔻醇和油醇;固醇,例如胆固醇、麦角固醇、羊毛固醇、谷固醇和豆固醇;溶血磷脂,例如1-酰基-2-羟基-sn-甘油-3-磷酸胆碱;和脑酰胺。
在另一优选实施例中,膜包含固态层。固态层可由两个有机和无机材料形成,所述材料包括(但不限于):微电子材料;绝缘材料,例如Si
典型地使用以下来进行所述方法:(i)包含孔的人工两亲层;或(ii)包含孔的分离的天然存在的脂质双层。通常使用人工两亲层(例如人工三嵌段共聚物层)来实行方法。层可包含其它跨膜和/或膜内蛋白质以及除孔以外的其它分子。
测量设备和过程
本文公开的方法可涉及检测多核苷酸的存在、不存在或对其进行的修饰,或例如表征在本文公开的方法中获得的修饰的多核苷酸。
当检测多核苷酸的特征时可进行各种不同类型的测量。这包括但不限于:电测量和光学测量。一种涉及荧光测量的合适的光学方法公开于《美国化学会志(J.Am.Chem.Soc.)》2009,1311652-1653中。可能的电测量包括:电流测量、阻抗测量、隧穿测量(Ivanov AP等人,《纳米快报(Nano Lett.)》2011年1月12日;11(1):279-85)以及FET测量(国际申请WO 2005/124888)。光学测量可以与电测量组合(Soni GV等人,《科学仪器综述》2010年1月;81(1):014301)。测量可以是跨膜电流测量,如对流过孔的离子电流的测量。
电测量可以使用标准信号通道记录设备来进行,如下所述:Stoddart D等人,《美国国家科学院院刊》(Proc Natl Acad Sci),12;106(19):7702-7;Lieberman KR等人,《美国化学会志(J Am Chem Soc.)》2010;132(50):17961-72;以及国际申请WO 2000/28312。可替代地,可以使用多通道系统进行电测量,例如如国际申请WO 2009/077734和国际申请WO2011/067559中所述。
表征修饰的多核苷酸的方法优选在跨越膜施加电位的情况下进行。外加电位可以是电压电位。或者,外加电位可以是化学电位。化学电位的实例是跨膜,如跨两亲层使用盐梯度。盐梯度公开于Holden等人《美国化学会志》2007年7月11日;129(27):8650-5
表征修饰的多核苷酸的方法可涉及测量在多核苷酸相对于孔移动时穿过孔的电流。用于测量通过跨膜蛋白孔的离子电流的适当条件在本领域中是已知的并且在实例中公开。通常通过跨膜和孔施加的电压来实行所述方法。所用电压通常是+5V到-5V,例如+4V到-4V、+3V到-3V,或+2V到-2V。所用电压通常是-600mV到+600mV或-400mV到+400mV。所用电压优选地在具有下限和上限的范围内,下限选自:-400mV、-300mV、-200mV、-150mV、-100mV、-50mV、-20mV和0mV,上限独立地选自:+10mV、+20mV、+50mV、+100mV、+150mV、+200mV、+300mV和+400mV。所用电压更优选地在100mV到240mV的范围内,并且最优选在120mV到220mV的范围内。通过使用增加的外加电位,可以增加孔对不同核苷酸的区分。
通常在存在任何电荷载流子的情况下进行所述方法,所述电荷载流子如金属盐,例如碱金属盐;卤盐,例如氯化物盐,如碱金属氯化物盐。电荷载流子可以包括离子液体或有机盐,例如四甲基氯化铵、三甲基苯基氯化铵、苯基三甲基氯化铵或1-乙基-3-甲基氯化咪唑鎓。在下文论述的示范性设备中,盐在腔室中的水溶液中存在。通常使用氯化钾(KCl)、氯化钠(NaCl)、氯化铯(CsCl),或亚铁氰化钾和铁氰化钾的混合物。优选的是KCl、NaCl,以及亚铁氰化钾和铁氰化钾的混合物。电荷载流子可以是跨膜不对称的。举例来说,电荷载流子的类型和/或浓度可在膜的每侧上不同。
盐浓度可以是饱和的。盐浓度可以是3M或更低,并且通常是0.1至2.5M、0.3至1.9M、0.5至1.8M、0.7至1.7M、0.9至1.6M或1M至1.4M。盐浓度优选是150mM至1M。所述方法优选使用至少0.3M的盐浓度进行,例如至少0.4M、至少0.5M、至少0.6M、至少0.8M、至少1.0M、至少1.5M、至少2.0M、至少2.5M或至少3.0M。高盐浓度提供高信噪比并允许相对于正常电流波动的背景鉴定指示核苷酸的存在的电流。
通常在存在缓冲液的情况下进行所述方法。在上文论述的示例性设备中,缓冲液存在于腔室中的水溶液中。在本发明的方法中可以使用任何缓冲液。通常,缓冲液是磷酸盐缓冲液。其它合适的缓冲液是HEPES和Tris-HCl缓冲液。通常在以下的pH下来实行方法:4.0到12.0、4.5到10.0、5.0到9.0、5.5到8.8、6.0到8.7或7.0到8.8或7.5到8.5。使用的pH优选地是约7.5。
可以在以下温度下进行所述方法:0℃至100℃、15℃至95℃、16℃至90℃、17℃至85℃、18℃至80℃、19℃至70℃或20℃至60℃。通常在室温下进行所述方法。任选地在支持酶功能的温度下进行所述方法,如在约37℃下进行。
方法可包含使用膜中存在的纳米反应器(例如纳米孔)的阵列。本文所述的系统可包含纳米反应器的阵列,例如膜中的纳米孔的阵列。
在优选实施例中,阵列中的每个膜包含一个纳米孔。由于其中形成阵列的方式,例如,阵列可包含一个或多个不包含纳米孔的膜,和/或一个或多个包含两个或更多个纳米孔的膜。阵列可包含约2至约1000,例如约10至约800,约20至约600或约30至约500个膜。在其它实施例中,每个可单独寻址的膜可含有多个纳米孔,例如多于数百或多于数千个纳米孔。在这类实施例中,每个纳米孔编码具有相同信息的单链。这类实施例使得能够在多个多核苷酸链上编码数据的多个拷贝,而无需一个或多个单独的扩增步骤。
膜可以被包含在具有电隔离膜阵列的设备中,每个膜使用其自己的电极单独寻址,使得阵列等同于从测试样品平行测量的许多单独传感器。膜可以相对密集地填充,允许大量的膜用于给定体积的测试样品。在本领域中,例如在WO 2009/077734和WO2012/042226中描述了合适的膜阵列和设备。例如,WO 2009/077734公开了在微孔开孔阵列上形成的多个可单独寻址的脂质双层,每个微孔含有电极和与脂质双层接触的水性介质。
本文所描述的系统典型地以即用’状态提供给最终用户,其中膜和跨膜孔是预先插入的。系统在本文中也称为设备。以‘即用’状态提供的典型设备包含两亲膜阵列,每个膜包含跨膜孔并且跨越含有液体的孔设置。WO2014/064443公开了这样的设备和其制造方法。将待分析的测试液体施加到两亲膜的上表面。
然而,以‘即用’状态提供的设备还需要考虑另外的因素,即传感器不会变干,即液体不会通过两亲膜而从孔中损失,那样的话会导致性能损失或损坏传感器。解决传感器变干问题的一种解决方案是在两亲膜的表面上设置含缓冲液的装置,使得通过膜表面的任何蒸发最小化,并且在膜的任一侧提供的液体可以具有相同的离子强度以减少任何渗透效应。在使用中,可以从两亲膜表面去除缓冲液,并引入待分析的测试液体以接触表面。
一些应用可以使用跨膜电特性的测量,例如离子电流。为了提供这样的测量,所述设备可以进一步在每个隔室中包含相应的电极,使其与包含极性介质的体积电接触。可以进行其它类型的测量,例如光学测量,例如荧光测量和FET测量。光学测量和电测量可以同时进行(Heron AJ等人,《美国化学会志》2009;131(5):1652-3)。
所述设备可以进一步包含公共电极。所述设备可以进一步包含连接在公共电极与每个隔室中的相应电极之间的电路,布置所述电路是为了进行电测量。这种电测量可以取决于在膜处或穿过膜发生的过程。
设备可以包含用于测量纳米孔阵列的FET阵列。
在本文提供的方法中,检测器可以选自以下:(i)零模波导、(ii)场效应晶体管,任选地纳米线场效应晶体管;(iii)AFM尖端;(iv)纳米管,任选地碳纳米管;以及(v)纳米孔。优选地,所述检测器是纳米孔。
在一个实施例中,设备包含:
传感器装置,其能够支撑多个孔和膜且能够操作以使用孔和膜来执行分析物表征;和
至少一个通口,其用于递送执行表征用的材料。
在一个实施例中,设备包含:
传感器装置,其能够支撑所述多个孔和膜,所述传感器装置能够操作以使用所述孔和所述膜来执行分析物表征;和
至少一个储槽,其用于盛放执行表征用的材料。
在一个实施例中,设备包含:
传感器装置,其能够支撑多个孔和膜,所述传感器装置能够操作以使用孔和膜来执行分析物表征;
至少一个储槽,其用于盛放执行表征用的材料;
流控系统,其被配置成可控地将材料从所述至少一个储槽供应到所述传感器装置;和
一个或多个容器,其用于容纳相应样品,所述流控系统配置成选择性地将样品从一个或多个容器供应到传感器装置。
设备还可包含能够跨越膜和孔复合物施加电位并且测量电信号的电路。
设备可为在WO 2008/102120、WO 2009/077734、WO 2010/122293、WO 2011/067559或WO00/28312中描述的那些设备中的任一个。
本文还提供选择性修饰纳米反应器内的多核苷酸链的方法。在一些实施例中,多核苷酸链在相对于纳米反应器移动时被修饰。在一些实施例中,多核苷酸链上的选择性修饰的模式在链上编码数据。在一些实施例中,多核苷酸链和纳米反应器如本文所述。
应理解尽管此处已经对根据本发明的方法论述特定实施例、具体配置以及材料和/或分子,但可在不脱离本发明的范围和精神的情况下进行形式和细节中的不同改变或修改。提供前述实施例和以下实例仅用于说明,并且不应被认为限制本申请。
实例
实例1
此实例证明在保持在纳米孔中的电位下的同时通过可光裂解的接头部分的光裂解来修饰半轮烷多核苷酸链(“静态链”)。此实例证明可实时修饰纳米孔纳米反应器内的多核苷酸链。
含有可光裂解间隔子部分的三条引发生物素化的多核苷酸链(“Int PC Spacer”;集成DNA技术(Integrated DNA Technologies)(IDT);可在
“静态链”通过在室温下将500nM的每条多核苷酸链与500nM单体traptavidin(链霉亲和素-N23A/S27D/S45A:traptavidin-S52G/R53D的3:1混合物)在含有HEPES-KOH(pH8.0)、KCl的缓冲液中孵育来制备。
使用FLO-MIN106流通池(牛津纳米孔技术)执行实验。每个孔含有磷酸钾(pH8.0)、铁氰化钾、亚铁氰化钾(“介体缓冲液”)的溶液,并且顺式腔室含有介体缓冲液+10nM凝血酶结合适体。使用预先编程的脚本,使用牛津纳米孔技术的MinION收集电数据,所述脚本按以下序列跨越膜施加电位:[0mV,5秒;-100mV,2秒;0mV,2秒;+180mV,60秒;0mV,2秒]。方括号中的电压序列重复至多50次。
如图8中示意性所示,由于生物素-traptavidin键,最初防止静态链完全易位通过纳米孔。正电位用于捕获纳米孔中的链,而负电位用于从纳米孔中弹出捕获的静态链。多核苷酸的捕获导致特征性的电流阻断,其可用于鉴定依赖于位于纳米孔的收缩部中的核苷酸碱基的多核苷酸。当以正电位保持在纳米孔中时,使用365nm光原位光裂解多核苷酸预期将多核苷酸裂解为两个片段,导致多核苷酸的非生物素化部分易位通过孔,然而顺式腔室中剩余的生物素化DNA片段根据片段的长度将预期保持被捕获(即电流阻断无改变)或从纳米孔自发解离(即返回开放孔电流),而这又取决于可光裂解键的位置。
根据以下时间表,将试剂引入流通池中如下运行上述电压脚本,其中一个“循环”为电压序列的重复:
·循环1:介体缓冲液+10nM凝血酶结合适体,用于阳性鉴定选择的通道中纳米孔的存在。
·循环2:根据制造商的说明书,经由入口和灌注SpotON口,用2mL运行缓冲液冲洗顺式腔室。
·循环5:添加75μL“静态链”的制备。将与上表不同的静态链添加到每个流通池。
·循环8:在整个循环中,使用365nm UV光对MinION流通池进行脉冲照射(约0.17J/cm
每条“静态链”都在单独的MinION流通池上运行,但是在流通池之间添加的时序和UV脉冲的时序相同。
从原始测序文件中分析电流与时间的数据。来自上述循环的代表性迹线绘制在图9和10中,其中叠加UV脉冲的时序。数据示出捕获链的阻断不同于开放孔。由于电化学介体的光氧化/光水化作用,流通池的UV照射导致测量电流向上漂移,这充当流通池上特定通道是否接收UV光的内部控制。
在没有UV照射的情况下,除非通过电压反向而弹出,否则任何样品的捕获链都将仍然永久地保持在纳米孔中。图9示出不含可光裂解部分的样品在UV照射下不释放,指示未发生反应。相比之下,图10示出,对于含有可光裂解部分的样品,在短暂照射样品后,立即返回到开放孔电流的可能性很高,这指示由于光裂解反应而导致链损失。然后返回到开放孔,随后不久从溶液中捕获另一条未裂解的链。因此,这指示检测到纳米孔内的可光裂解部分。
因此,实例1示出可实时实现纳米孔内多核苷酸的光修饰,指示可实现多核苷酸链的光修饰以在多核苷酸链上编码数据。
实例2
此实例证明可如何经由夹板连接组装ssDNA寡核苷酸以产生DNA串联体链,其可用于在纳米孔系统中以另外应用于DNA数据存储。
有许多众所周知的方法从较小的定义的DNA链段,例如从小于100nt的合成DNA的小区段中产生长的DNA底物。举例来说,可以通过连接例如将DNA或RNA的小区段串接在一起,从而产生具有许多较小单元的重复序列的较长分子。通过控制用于连接的粘性末端,可按定义的方式连接较小单元的组合。举例来说,链(A)
图11示出具有定义的重复序列的长DNA链的实例,所述重复序列通过连接和夹板将较小的DNA链段串接在一起而产生。
串联体组装件通过在95℃下将0.25μL DW089和DW111(10μM)、2.5μL DW141(100μM)、5μL DW088(100μM)和2μL无核酸酶双链缓冲液(集成DNA技术有限公司(Integrated DNATechnologies,Inc.),目录号11-01-03-01)孵育5分钟,然后缓慢冷却至室温(-0.1摄氏度/秒)来生成。
串联体组装件通过将5μL串联体组装件(最终浓度为125nM)与2.5μL LNB(来自Oxford Nanopore LSK-109)、1μL T4连接酶(来自新英格兰生物实验室快速连接试剂盒(NEB Quick Ligation Kit),#M2200)在10μL的最终体积中孵育来连接在一起。将混合物在室温下孵育30分钟。经由向每个管中添加1μL RAP,将测序衔接子((来自SQK-RAD004的“RAP”))单击到种子链上,并且将混合物在室温下孵育15分钟。
单体抗生物素蛋白琼脂糖(赛默飞世尔科学(ThermoFisher Scientific)目录号20267)根据制造商的说明书制备。按照制造商的说明书,使用50μL的50%浆料单体琼脂糖与kilobaseBINDER结合缓冲液(赛默飞世尔科学目录号60101)纯化串联体链。在室温下,用1x生物素洗脱缓冲液(IBA生命科学(IBALifesciences)目录号2-1019-025)洗脱样品15分钟。
将25μL SQB(来自Oxford Nanopore LSK-109)添加到样品中。根据牛津纳米孔的说明书在流通池上加载,并且测序进行6小时。
在将定制电压改变施加到平台,在高电压V1(+180mV)和较低保持电压V2(+60mV)之间切换电压时,获取离子电流对时间的数据。获取芯片上所有纳米孔通道的离子电流对时间的电数据并且进行分析。串接的DNA样品通过纳米孔的移动的代表性数据在图13中示出。数据示出底物通过纳米孔的捕获和受控移动,清楚地示出穿过孔的底物中的多个B单元。当电压下降到较低的保持电压V2时,由于马达蛋白不能够克服停滞位点,因此通过纳米孔的移动停止。仅在电压增加到V1后才恢复移动。此数据说明可如何使用电压来控制DNA底物通过纳米孔的移动,并且根据需要通过调整施加电压的幅度来暂停和恢复移动。这类受控移动允许定向修饰纳米孔纳米反应器内的多核苷酸链,因为修饰可根据需要对在纳米反应器内的多核苷酸的特定部分进行,以在链上编码数据。
实例3
此实例证明通过用紫外线照射来氧化和检测半轮烷多核苷酸链(“静态链”)中的鸟嘌呤DNA碱基。
如下合成在poly(dT)背景下含有G碱基的三条引发生物素化的多核苷酸链。
“静态链”通过在室温下将500nM多核苷酸链与500nM单体traptavidin在含有HEPES-KOH(pH 8.0)、KCl的缓冲液中孵育来制备。任选地,包括50μM核黄素(作为UV敏化剂),并且“静态链”(75μL,在1.5mL埃彭道夫管中)任选地通过使用365nm UV光(约6.4J/cm
使用FLO-MIN106流通池(牛津纳米孔技术)执行实验。使用预先编程的脚本,使用牛津纳米孔技术的MinION收集电数据,所述脚本按以下序列跨越膜施加电位:[0mV,5秒;-100mV,2秒;0mV,2秒;+180mV,60秒;0mV,2秒]。方括号中的电压序列重复至多50次。由于生物素-traptavidin键,防止静态链通过纳米孔完全易位。正电位用于捕获和测试纳米孔中的链,而负电位用于从纳米孔中弹出捕获的静态链。多核苷酸的捕获导致特征性的电流阻断,其可用于鉴定依赖于位于纳米孔的收缩部中的核苷酸碱基的多核苷酸。
通过运行上述电压脚本,将试剂引入流通池中如下执行实验:
·静态链(DW080)在纳米孔收缩部中含有三个碱基;
·在纳米孔收缩部中分别含有三个、两个或一个8-氧代-2'-脱氧鸟苷(8-氧代-dG)碱基的对照静态链(DW113、DW114或DW115);
·在50μM核黄素敏化剂的存在下,用UV(6.4J/cm
·在纳米孔收缩部中分别含有三个8-氧代-2'-脱氧鸟苷(8-氧代-dG)碱基的对照静态链(DW113);
从原始测序文件中分析电流与时间的数据。来自上述循环的代表性迹线绘制在图14中,其示出在含有三个用UV+敏化剂照射的dG碱基的链与在等效位置含有8-氧代-dG碱基的链之间的相似阻滞水平。
实例4
此实例描述多核苷酸链的侧链的实时光裂解,以便在链上编码数据。
合成包含可光裂解的侧链的多核苷酸底物。可光裂解的侧链化学在图15中示出,并且可使用已知的化学反应进行合成(《应用化学国际英文版(Angew Chem Int EdEngl.)》2015年11月9日;54(46):13635-13638)。多核苷酸链包含如链上所示的重复的可光裂解基团。
如上所述,通过在低电压下暂停将链保持在CsgG纳米孔中。使链与马达蛋白接触以控制链通过纳米孔的移动。链使用位于通过马来酰亚胺化学附接到CsgG纳米孔的附近光敏剂(标记为S)的3nm内,典型地1nm内的可光裂解的侧链R来保持。
整个纳米孔系统被例如UV光照射。在照射整个纳米孔系统后,敏化剂吸收入射辐射并且以不同的波长局部重新发射辐射。可光裂解的侧链不吸收入射的全局波长,并且仅对来自敏化剂的局部重新发射辐射敏感,这导致如所指示的光裂解和侧链分子的损失。纳米孔中此单元之外的底物的其余部分上的其它可光裂解的R基团(未示出)距离敏化剂更远,并且没有暴露于足以使得能够光裂解的辐射。因此,侧链分子的选择性去除修饰在选择性位点处的多核苷酸,以例如编码修饰模式以存储数据。
当例如通过在纳米孔系统上测序来表征时,修饰的DNA与未修饰的起始材料产生不同的信号。以这种方式,利用在链上编码的数据来检测和鉴定修饰。
实例5
此实例证明1)DNA链借助于马达蛋白通过纳米孔的受控移动;2)借助于电压控制纳米孔中含有哪部分DNA,和3)选择性修饰纳米孔中DNA的选定部分。实例证明组合的所有元素,以定义的模式修饰DNA的选定部分以编码数据,这些数据可在同一纳米孔上原位读回。在此,光被用于切除从DNA主链延伸的支链庞大基团,从而在将基团保持在蛋白纳米孔中时产生可检测的改变。
链制备
亚磷酰胺基于七甲川菁染料R制备(《应用化学国际英文版》2015年11月9日;54(46):13635-13638)。制备的DNA寡核苷酸DW141R含有四个内部间隔子18(图15),其中R并入到近端间隔子18的5'侧的4-10个碱基之间。R的断裂预期在690nm的光照亮下发生,从而在相同位置产生羟基(图15C)。
含有DW141R的多个重复序列的“串联组装件”多核苷酸链如下生成:在95℃下0.25μL DW089(“A单元”)和DW111(“C单元”),两者均为10μM,2.5μL DW141R(“B单元”,100μM),5μL DW088(“夹板”,100μM)和2μL无核酸酶双链缓冲液(集成DNA技术有限公司,目录号11-01-03-01)持续5分钟,然后缓慢冷却至室温(-0.1摄氏度/秒)。
通过将5μL串联组装件(最终浓度为125nM)与2.5μL LNB(来自Oxford NanoporeLSK-109)、1μL T4连接酶(来自新英格兰生物实验室(NEB)目录号M2200)在10μL的最终体积中孵育来连接以上物质。将混合物在室温下孵育30分钟。通过向每个管中添加1μL RAP,将测序衔接子(来自SQK-RAD004的“RAP”)单击到种子链上,并且将混合物在室温下孵育15分钟。
单体抗生物素蛋白琼脂糖(赛默飞世尔科学目录号20267)根据制造商的说明书制备。按照制造商的说明书,使用50μL的50%浆料单体琼脂糖与kilobaseBINDER结合缓冲液(赛默飞世尔科学,目录号60101)纯化串联体链。在室温下,用25μL的1x生物素洗脱缓冲液(IBA生命科学,目录号2-1019-025)洗脱样品15分钟。
纳米孔制备
在一个或多个残基处带有半胱氨酸突变的CsgG蛋白纳米孔被纯化并且用生物素马来酰亚胺(默克(Merck)目录号B1267)标记,与QDot 705链霉亲和素缀合物(赛默飞世尔科学,目录号Q10161MP)一起孵育,并且插入牛津纳米孔技术的FLO-MIN106流通池中。
根据制造商的说明书,冲洗Oxford Nanopore MinION FLO-MIN106流通池,并且用来自SQK-LSK109的FLB和FLT灌注SpotON口。将25μL SQB添加到样品中,并且经由SpotON口加载所得的50μL。CoolLED pE-4000LED光源的光导位于SpotON口上方约0.5cm处。使用预先编程的脚本,使用牛津纳米孔技术的MinION收集电数据,所述脚本按以下序列跨越膜施加电位:[V1=+180mV,10秒;V2=+60mV,10秒]。LED源(16个可选波长)的发射通过计算机控制快速激活和去激活。在这种情况下,405nm或435nm的光激发光敏剂(量子点),但不激发目标分子。重复方括号中的电压序列,直到实验停止。
设置
图16示出当马达蛋白遇到停滞位点时,用光敏剂(S)标记的蛋白纳米孔系统。在此之前,跨越膜施加+180mV(V1)的电位,但是当马达遇到停滞时,检测到记录电流的改变,并且电压降低到保持电位V2(+60mV)。此时照射光敏剂(S)产生庞大基团R的光裂解,如果成功,那么产生可检测到的电流改变。
图17示出后续“B单元”之间的移动可如何通过马达蛋白和保持电位的组合来控制,每个“B单元”含有一个可修饰基团(“R”)。跨越纳米孔阵列中每个通道(Ch.1、Ch.2、…、Ch.n)的膜的施加电压可单独寻址。电压模式用于使马达蛋白沿串联多核苷酸前进任何期望数量的单位,直到遇到期望的修饰位置,随后整个阵列被同步照亮。马达蛋白防止另外的易位,直到其被施加电压的力推过第一停滞。在停滞时的短暂暂停后,将马达推过停滞,并且当马达蛋白在ATP燃料受控移动下将DNA进料到纳米孔中时,观察到“RAP+A”信号穿过纳米孔。当电压保持在V1时,马达蛋白在每个停滞的短暂暂停后继续行进通过“Bn”单元中的后续停滞位点。所述图示出,例如,在Ch.1中的马达蛋白可如何在进行修饰之前前进四个位置,然后前进一个位置(编码00011…);而Ch.2的位置可前进一个位置,然后再前进三个位置(编码1001…)。
数据写入
在MinION芯片(牛津纳米孔技术)的通道阵列中选择三个代表性通道。每个通道使用电极和电路系统独立寻址,从而使得能够单独控制到所述通道的施加电压。解锁电路系统用于根据需要在保持电压(V2)和全局电压(V1)之间独立地切换每个通道。如具有主动监视和反馈控制的Oxford Nanopore MinKNOW软件的软件用于独立地实时监视电流水平。软件监视电流水平以对每个通道中的DNA底物的向前移动进行测序和检测,并且根据需要切换电压,以便编码预定的数据模式。
为了证明将数据写入多核苷酸链,通道1被设置为将[000110…]编码到多核苷酸链中。通道2被设置为编码[10010…]并且通道n被设置为编码[01010…]。
如图15所示,每个通道都与DNA底物接触,所述底物在马达蛋白的控制下移动通过纳米孔。当重复单元穿过纳米孔时,底物通过纳米孔的移动产生特征性的电流信号。监视每个通道的软件在施加的全局电压V1(例如,+180mV)下实时测量特征性的电流,并且确定是否将修饰写入下一个单元。在要写入的单元开始之后和下一个单元开始之前,软件将电压下降到保持电压V2,以使马达蛋白停滞在下一个停滞位点,其将要修饰的单元保持在敏化剂附近,用于执行修饰反应(图17)。
对于通道1,需要修饰第4个单元,因此在其开始后,软件降低电压,如在图17-A1处所示。对于通道2和通道n,第1个和第2个单元分别需要修饰,因此电压在点A2和An处下降,如图指示。以这种方式,每个通道被独立控制,以移动通过所需数量的未修饰单元(写码为0),并且在下一个单元上暂停以进行修饰(写码为1)。修饰为由以期望频率的照射脉冲引起的,辐射激发纳米孔上的敏化剂,所述敏化剂局部重新发射辐射,从而裂解纳米孔中DNA单元上相邻的可光裂解的侧链。
反应条件的时序如图17所说明。脉冲之间的等待时段的持续时间(E1、E2、…En)被设置为使得所有通道都能够传递必要数量的未修饰的链,并且堆叠下一个要修饰的链。时段可为固定的或可变的,并且由全局软件控制,因此,允许每个单通道到达期望的阶段,包括那些具有较长区段的未修饰单元的通道。反应的持续时间(F1,F2,..Fn)被设置为使得能够实现高百分比的修饰成功。在不可原位观察修饰的情况下,这可基于单独的实验事先固定和确定。可替代地,如果将修饰定位在纳米孔中,使得在修饰时观察到电流改变,那么软件不可根据需要监视、记录和控制系统以确保成功写入。
在修饰阶段之后,每个通道中的电压返回到全局电压V1(例如,+180mV,图17中循环1的点B和循环2的点D),以便将马达蛋白推过下一个停滞位点,以继续写入DNA中的后续单元。当链通过每个纳米孔行进时,传递期望数量的未修饰单元、检测要修饰的单元、使电压下降(图17上的点A和C)以堆叠要修饰的单元并且等待,然后全局照射的整个过程以[E1/F1、E2/F2、…En/Fn]的环进行,将期望的修饰模式写入每个链中。
在写入阶段结束时,将修饰的DNA读回。可将修饰的DNA转移至另一个读取系统,例如另一个纳米孔测序仪中的另一个纳米孔。可替代地,修饰的DNA可在通过保留它而进行修饰的同一纳米孔上原位读回。举例来说,链可用阻滞剂(例如,链霉亲和素)封端,以防止通过纳米孔的完全易位。然后,例如,可通过反向电压使链通过纳米孔返回并且重新加载新的马达蛋白,并且然后再次通过孔传回以读出序列。可替代地,可使用本领域已知的方法装载将DNA从纳米孔中拉出的马达蛋白,并且用于通过纳米孔将DNA从孔中拉出以读回信号。
实例6
此实例证明通过光照射修饰天然存在的DNA链来编码数据。
提供3.5kb的λ噬菌体DNA区段(可商购)。图18示出代表性的离子电流对时间的数据,其通过使用根据制造商的说明书操作的MinION流通池(牛津纳米孔技术)对λ噬菌体DNA进行测序而获得。鸟嘌呤碱基为使用标准的碱基判读算法鉴定的,并且在图18中突出显示(下图)。
λ噬菌体DNA区段在马达蛋白控制下穿过CsgG纳米孔,修饰以包括光敏剂,如量子点或金基纳米颗粒。系统用UV光照亮。在照亮下的敏化剂在一定条件下产生高度局部改变,介导附近鸟嘌呤碱基的反应,所述鸟嘌呤碱基比其它碱基对化学氧化更敏感。反应溶液含有一种或多种选自过氧化氢、吖啶橙、亚甲基蓝的敏化剂分子,它们介导还原-氧化化学反应以更有效地修饰鸟嘌呤。λ噬菌体DNA在不规则照射下以近似恒定的速率移动通过孔,从而在链中产生独特的修饰模式(图19中示意性示出)。修饰模式(图20)在链上编码数据。
- 在多核苷酸链上编码数据的方法
- 上链模块、上链设备以及上链方法
