用于抗癌免疫治疗的肽
文献发布时间:2023-06-19 11:59:12
本申请是申请日为2019年4月12日、申请号为201980032539.6、发明名称为:“用于抗癌免疫治疗的肽”的发明专利申请的分案申请。
本发明涉及用于免疫治疗方法的肽、蛋白质、核酸和细胞。特别是,本发明涉及癌症的免疫疗法。本发明还涉及单独使用或与其他肿瘤相关肽(刺激抗肿瘤免疫反应或体外刺激T 细胞和转入患者的疫苗复合物的活性药物成分)联合使用的肿瘤相关T细胞(CTL)肽表位。与主要组织相容性复合体(MHC)分子结合的肽或与此同类的肽也可能是抗体、可溶性T细胞受体和其他结合分子的靶标。
本发明涉及数种新型肽序列及其变体,它们源自人肿瘤细胞的HLA-I类分子,可用于引发抗肿瘤免疫反应的疫苗组合物中或作为开发药物/免疫活性化合物和细胞的目标。
发明背景
根据世界卫生组织(WHO)的数据,癌症是2012年全球范围内四大非传染性致命疾病之一。同年,结直肠癌、乳腺癌和呼吸道癌症在高收入国家被列为前10位死亡原因内。
考虑到与治疗癌症常用策略相关的严重副作用和费用,有必要确定可用于治疗一般癌症,尤其是急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌的因素。
还需要确定代表一般癌症,尤其是急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌生物标志物的因素,从而可以更好地诊断癌症、评估预后、预测治疗成功率。
癌症免疫治疗代表了癌症细胞特异性靶向作用的一个选项,同时最大限度地减少副作用。癌症免疫疗法利用存在的肿瘤相关抗原。
肿瘤相关抗原(TAA)的目前分类主要包括以下几组:
a)癌-睾丸抗原:T细胞能够识别的最先确认的TAA属于这一类抗原,由于其成员表达于组织学相异的人肿瘤中、正常组织中、仅在睾丸的精母细胞/精原细胞中、偶尔在胎盘中,因此,它最初被称为癌-睾丸(CT)抗原。由于睾丸细胞不表达HLA I类和II类分子,所以,在正常组织中,这些抗原不能被T细胞识别,因此在免疫学上可考虑为具有肿瘤特异性。CT抗原大家熟知的例子是MAGE家族成员和NY-ESO-1。
b)分化抗原:肿瘤和正常组织(肿瘤源自该组织)都含有TAA。大多数已知的分化抗原发现于黑色素瘤和正常黑色素细胞中。许多此类黑色素细胞谱系相关蛋白参与黑色素的生物合成,因此这些蛋白不具有肿瘤特异性,但是仍然被广泛用于癌症的免疫治疗。例子包括,但不仅限于,黑色素瘤的酪氨酸酶和Melan-A/MART-1或前列腺癌的PSA。
c)过量表达的TAA:在组织学相异的肿瘤中以及许多正常组织中都检测到了基因编码被广泛表达的TAA,一般表达水平较低。有可能许多由正常组织加工和潜在提呈的表位低于T细胞识别的阈值水平,而它们在肿瘤细胞中的过量表达能够透过打破先前确立的耐受性而引发抗癌反应。这类TAA的典型例子为Her-2/neu、生存素、端粒酶或WT1。
d)肿瘤特异性抗原:这些独特的TAA产生于正常基因(如β-catenin、CDK4等)的突变。这些分子变化中有一些与致瘤性转化和/或进展相关。肿瘤特异性抗原一般可在不对正常组织带来自体免疫反应风险的情况下诱导很强的免疫反应。另一方面,这些TAA在多数情况下只与其上确认了有TAA的确切肿瘤相关,并且通常在许多个体肿瘤之间并不都共用TAA。在含有肿瘤特定(相关)同种型蛋白的情况下,如果肽源自肿瘤(相关) 外显子也可能出现肽肿瘤特异性(或相关性)。
e)由异常翻译后修饰产生的TAA:此类TAA可能由肿瘤中既不具有特异性也不过量表达的蛋白产生,但其仍然具有肿瘤相关性(该相关性由主要对肿瘤具有活性的翻译后加工所致)。此类TAA产生于变糖基化模式的改变,导致肿瘤产生针对MUC1的新型表位或在降解过程中导致诸如蛋白拼接的事件,这可能具有也可能不具有肿瘤特异性。
f)肿瘤病毒蛋白:这些TTA是病毒蛋白,可在致癌过程中发挥关键作用,并且由于它们是外源蛋白(非人源蛋白),所以能够激发T细胞反应。这类蛋白的例子有人乳头状瘤16型病毒蛋白、E6和E7,它们在宫颈癌中表达。
基于T细胞的免疫治疗靶向作用于主要组织相容性复合体(MHC)分子提呈的来源于肿瘤相关蛋白或肿瘤特异性蛋白的肽表位。肿瘤特异性T淋巴细胞所识别的抗原,即其表位,可以是源自所有蛋白类型的分子,如酶、受体、转录因子等,它们在相应肿瘤的细胞中被表达,并且与同源未变的细胞相比,其表达通常上调。
MHC分子有两类:MHC I类和MHC II类。MHC I类分子由一条α重链和β-2-微球蛋白,MHC II类分子由一条α和一条β链组成。其三位构造形成一个结合槽,用于与肽进行非共价相互作用。
大部分有核细胞上都可发现MHC-I类分子。它们提呈主要为内源性的蛋白、缺陷核糖体产物(DRIP)和较大肽裂解生成的肽。然而,源自内体结构或外源性来源的肽也经常在MHC-I类分子上发现。这种I-类分子非经典提呈方式在文献中被称为交叉提呈(Brossartand Bevan,1997;Rock et al.,1990)。MHC II类分子主要发现于专业抗原提呈细胞 (APC)上,并且主要提呈,例如,在内吞作用过程中由APC占据并且随后被加工的外源性或跨膜蛋白的肽。
肽和MHC I类的复合体由负载相应T细胞受体(TCR)的CD8阳性T细胞进行识别,而肽和MHC II类分子的复合体由负载相应TCR的CD4阳性辅助T细胞进行识别。因此, TCR、肽和MHC按照1∶1∶1的化学计量呈现,这一点已是共识。
CD4阳性辅助T细胞在诱导和维持CD8阳性细胞毒性T细胞的有效反应中发挥重要作用。肿瘤相关抗原(TAA)衍生的CD4阳性T细胞表位的识别对开发能引发抗肿瘤免疫反应的药物产品非常重要(Gnjatic et al.,2003)。在肿瘤部位,T辅助细胞维持着对细胞毒性T细胞(CTL)友好的细胞因子环境(Mortara et al.,2006)并吸引效应细胞,如CTL、天然杀伤(NK)细胞、巨噬细胞和粒细胞(Hwang et al.,2007)。
在没有炎症的情况下,MHC II类分子的表达主要局限于免疫系统细胞,尤其是专业抗原提呈细胞(APC),例如,单核细胞、单核细胞源性细胞、巨噬细胞、树突状细胞。在癌症患者的肿瘤细胞中发现有MHC II类分子的表达(Dengjel et al.,2006)。
本发明的拉长(较长)肽可作为MHC-II类活性表位。MHC-II类表位活化的辅助T细胞在编排抗肿瘤免疫的CTL效应子功能中发挥着重要作用。触发TH1细胞反应的辅助T 细胞表位支援CD8阳性杀伤T细胞的效应子功能,其中包括直接作用于肿瘤细胞的细胞毒性功能(该类肿瘤细胞表面显示有肿瘤相关肽/MHC复合体)。这样,肿瘤相关T辅助细胞表位单独使用或与其他肿瘤相关肽结合使用可作为刺激抗肿瘤免疫反应的疫苗化合物的活性药物成分。
哺乳动物(如小鼠)模型显示,即使没有CD8阳性T淋巴细胞,CD4阳性T细胞也能透过分泌干扰素-γ(IFNγ)抑制血管生成而足以抑制肿瘤的表现(Beatty and Paterson,2001; Mumberg et al.,1999)。没有CD4T细胞作为直接抗肿瘤效应因子的证据(Braumuller et al.,2013;Tran et al.,2014)。
由于HLA II类分子的组成性表达通常仅限于免疫细胞,因此,直接从原发肿瘤中分离II 类肽之前被认为是不可能的事。然而,Dengjel等人成功地在肿瘤中直接识别了多个 MHC II类表位(WO 2007/028574,EP 1 760 088 B1)。
由于CD8依赖型和CD4依赖型这两种反应共同并协同地促进抗肿瘤作用,因此,确定和表征由CD8+ T细胞(配体:MHC I类分子+肽表位)或CD4阳性T辅助细胞(配体: MHC II类分子)识别的肿瘤相关抗原对开发肿瘤疫苗非常重要。
对于MHC I类肽触发(引发)细胞免疫反应的肽,它也必须与MHC分子结合。这一过程依赖于MHC分子的等位基因以及肽氨基酸序列的特异性多态性。MHC-I类-结合肽的长度通常为8-12个氨基酸残基,并且在其与MHC分子相应结合沟槽相互作用的序列中通常包含两个保守残基(“锚”)。这样,每个MHC的等位基因都有“结合基序”,从而确定哪些肽能与结合沟槽特异性结合。
在MHC-I类依赖性免疫反应中,肽不仅能与肿瘤细胞表达的某些MHC-I类分子结合,而且它们之后还必须能被T细胞负载的特异性T细胞受体(TCR)识别。
对于被T淋巴细胞识别为肿瘤特异性抗原或相关性抗原以及用于治疗的蛋白质,必须具备一些特别条件。该抗原应主要由肿瘤细胞表达,而不由正常健康组织表达,或表达数量相对较少。在一个优选的实施方案中,与正常健康组织相比,所述肽应在肿瘤细胞中过度提呈。更为适宜的情况是,该相应抗原不仅出现于一种肿瘤中,而且浓度(即每个细胞的相应肽拷贝数目)高。肿瘤特异性抗原和肿瘤相关抗原往往是源自直接参与因细胞周期控制或凋亡抑制中的其功能而发生的正常细胞向肿瘤细胞转化的蛋白。另外,这些直接导致转化事件的蛋白的下游靶标可能会被上调,因此可能与肿瘤间接相关。这些间接肿瘤相关抗原也可能是预防接种方法的靶标(Singh-Jasuja et al.,2004)。至关重要的是,表位存在于抗原氨基酸序列中,以确保这种来自肿瘤相关抗原的肽(“免疫原性肽”)可导致体外或体内T细胞反应。
基本上,任何能与MHC分子结合的肽都可能充当一个T细胞表位。诱导体外或体内T细胞反应的前提是存在具有相应TCR的T细胞并且不存在对该特定表位的免疫耐受性。
因此,TAA是基于T细胞疗法(包括但不限于肿瘤疫苗)研发的起点。识别和表征TAA的方法通常基于对患者或健康受试者T细胞的使用情况,或基于肿瘤与正常组织肽之间差别转录特性或差别表达模式的产生。然而,对肿瘤组织或人肿瘤细胞株中过量表达或选择性表达的基因的识别并不提供在免疫疗法中使用这些基因所转录抗原的准确资讯。这是因为,有着相应TCR的T细胞必须要存在而且对这个特定表位的免疫耐受性必须不存在或为最低水平,因此,这些抗原的表位只有一部分适合这种应用。因此,在本发明的一非常优选的实施例中,只选择那些针对可发现功能性和/或增殖性T细胞情况的过量提呈或选择性提呈肽,这一点非常重要。这种功能性T细胞被定义为在以特异性抗原刺激后能够克隆地扩展并能够执行效应子功能(“效应子T细胞”)的T细胞。
在透过根据本发明的特定TCR(例如可溶性TCR)和抗体或其他结合分子(支架)靶向作用于肽-MHC的情况下,潜在肽的免疫原性是次要的。在这些情况下,提呈是决定因素。
在本发明的第一方面,本发明涉及一种肽,包含选自包括SEQ ID NO:1至SEQ IDNO:387和SEQ ID NO.463至SEQ ID NO.464的组的一个氨基酸序列、或该序列的与 SEQ IDNO:1至SEQ ID NO:387和SEQ ID NO.463至SEQ ID NO.464具有至少 77%,优选至少88%同源(优选至少77%或至少88%相同)的一种变体序列(其中所述变体与MHC结合和/或诱导T细胞与所述肽发生交叉反应),或其药用盐(其中所述肽不是潜在全长多肽)。
本发明还涉及本发明的一种肽,包含选自包括SEQ ID NO:1至SEQ ID NO:387和SEQ ID NO.463至SEQ ID NO.464的组的一个序列、或与SEQ ID NO:1至SEQ ID NO:387 和SEQ ID NO.463至SEQ ID NO.464具有至少77%、优选至少88%同源性(优选为至少77%或至少88%相同)的一种变体,其中所述肽或其变体的总长度为8至100个、优选为8至30个、最优选为8至14个氨基酸。
下表显示了根据本发明的肽、它们各自的SEQ ID NO、以及这些肽的可能源(潜在)基因。表1a中含有SEQ ID NO:1至SEQ ID NO:382的肽以及表1b中含有SEQ ID NO: 463至SEQ ID NO:464的肽与HLA-A*24结合。表2中的肽之前在大型列表中披露,作为高通量筛查结果,错误率高,或使用演算法计算出,但之前与癌症毫无关联。表2 中,含有SEQ ID NO:383至SEQ ID NO:387的肽与HLA-A*24结合。表3中的肽是可与本发明其它肽组合使用的其他肽。表3中,含有SEQ ID NO:388至SEQ ID NO:460 的肽与HLA-A*24结合。
表1a:本发明的肽。
表1b:本发明的肽。
表2:本发明的其他肽,之前与癌症无已知的关联。
表3:用于例如个人化癌症疗法的本发明肽。
本发明一般还涉及根据本发明的肽,其用于治疗增殖性疾病,例如癌症,例如急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌。
特别优选的是根据本发明的肽(单独或组合),其选自由SEQ ID NO:1至SEQ IDNO: 387以及SEQ ID NO:463至SEQ ID:464所组成的组。更优选的是所述肽(单独或组合)选自由SEQ ID NO:1至SEQ ID NO:89以及SEQ ID NO:463至SEQ ID:464所组成的组(见表1a和表1b)以及彼等在急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌,优选为急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌免疫治疗中的用途。
本发明的另一方面涉及根据本发明肽的用途-优选联合用于治疗选自急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌组中的增殖性疾病。
本发明还涉及本发明的肽,其具有与主要组织相容性复合体(MHC)I或以拉长形式存在的例如长度变化的-MHC-II类分子结合的能力。
本发明进一步涉及本发明中的肽,其中所述肽(每种肽)系由或基本系由根据SEQID NO:1至SEQ ID NO:387和SEQ ID NO.463至SEQ ID NO.464的一个氨基酸序列组成。
本发明进一步涉及本发明的肽,其中所述肽被修饰和/或包含非肽键。
本发明进一步涉及本发明的肽,其中所述肽为融合蛋白的一部分,特别是与HLA-DR抗原相关不变链(li)的N-端氨基酸融合,或与抗体(例如,树突状细胞特定抗体)或抗体的序列融合。
本发明进一步涉及一种核酸,其编码本发明的肽。本发明进一步涉及一种本发明的核酸,为DNA、cDNA、PNA、RNA,也可能为其组合物。
本发明进一步涉及一种能表达和/或表达本发明核酸的表达载体。
本发明进一步涉及本发明的一种肽、本发明的一种核酸或本发明的一种治疗疾病的药用表达载体,特别是用于治疗癌症。
本发明进一步涉及本发明中肽或本发明中所述肽复合体(含有MHC)的特定抗体以及制造这些抗体的方法。
本发明进一步涉及本发明的T细胞受体(TCR),特别是可溶性TCR(sTCRs)和加工为自体或异体T细胞的克隆TCR,以及制造这些TCR的方法和载有所述TCR或所述TCR交叉反应的NK细胞的制造方法。
抗体和TCR是根据目前发明的肽免疫治疗用途的另外实施方案。
本发明进一步涉及含本发明核酸或前述表达载体的一种宿主细胞。本发明进一步涉及本发明的宿主细胞,其为抗原提呈细胞,优选为树突细胞。
本发明进一步涉及配制本发明一种肽的一种方法,所述方法包括培养本发明的宿主细胞和从所述宿主细胞或其培养基中分离肽。
本发明进一步涉及本发明中的所述方法,其中抗原透过与足够量的含抗原提成细胞的抗原结合被载入表达于合适抗原提呈细胞或人工抗原呈递细胞表面的I或II类MHC分子。
本发明进一步涉及本发明的方法,其中抗原提呈细胞由能表达含SEQ ID NO.1至SEQ ID NO.387和SEQ ID NO:463至SEQ ID NO:464、优选为含SEQ ID NO.1至SEQ ID NO.89和SEQ ID NO:463至SEQ ID NO:464所述肽的一个表达载体、或一个变体氨基酸序列组成。
本发明进一步涉及以本发明方法制造的启动T细胞,其中所述T细胞有选择性地识别一种细胞,该细胞表达含一种本发明氨基酸序列的多肽。
本发明进一步涉及一种杀伤患者靶细胞的方法,其中患者的靶细胞异常表达含本发明任何氨基酸序列的多肽,该方法包括给予患者按本发明方法制造的有效量T细胞。
本发明进一步涉及任何所述肽、本发明的核酸、本发明的表达载体、本发明的细胞、本发明的作为药剂或制造药剂的启动T淋巴细胞、T细胞受体或抗体或其他肽-和/或肽-MHC 结合分子的用途。所述药剂优选为具有抗癌活性。
优选情况为,所述药剂为基于可溶性TCR或抗体的细胞治疗药物、疫苗或蛋白质。
本发明进一步涉及根据本发明的用途,其中所述癌细胞为急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌,优选为急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌细胞。
本发明进一步涉及一种基于本发明肽的生物标志物,本文中称为“靶标”,其可用于诊断癌症,优选为急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌。所述标志物可以肽本身过度提呈或相应基因过度表达。标志物也可以用于预测治疗成功的可能性,优选为免疫疗法,最优选为靶向作用于该生物标志物识别的相同靶标的免疫疗法。例如,抗体或可溶性TCR可用于染色肿瘤切片以检测是否存在相关肽与MHC复合。
或者,抗体具有进一步的效应子功能,如免疫刺激域或毒素。
本发明还涉及这些癌症治疗中新靶点的用途。
是否能刺激免疫反应取决于是否存在被宿主免疫系统视为异物的抗原。发现肿瘤相关抗原的存在增加了运用宿主免疫系统干预肿瘤生长的可能性。目前,针对癌症免疫治疗,正在探索利用免疫系统的体液和细胞进行免疫的各种机制。
细胞免疫反应的特定元素能特异性地识别和破坏肿瘤细胞。从肿瘤浸润细胞群或外周血中分离出的T-细胞表明,这些细胞在癌症的天然免疫防御中发挥了重要作用。尤其是CD8 阳性T细胞在这种反应中发挥重要作用,TCD8+能识别通常8至10个源自蛋白或位于细胞质的缺损核糖体产物(DRIP)的氨基酸残基的主要组织相容性复合体(MHC)所载的肽中所含的I类分子。人MHC分子也称为人白细胞-抗原(HLA)。
更具体地,本申请提供下列各项:
1.一种肽,其包括选自SEQ ID No.1至SEQ ID No.387和SEQ ID No.463至SEQ IDNo.464组成群组的一个氨基酸序列、以及与SEQ ID No.1至SEQ ID No.387 和SEQ IDNo.463至SEQ ID No.464具有至少88%同源性的其变体序列、其中所述变体与主要组织相容性复合体(MHC)结合和/或诱导与该变体肽发生T细胞交叉反应,及其一种药用盐,其中所述肽不是一种全长多肽。
2.根据项1中所述的肽,其中所述肽有能力与MHC-I或-II类分子结合,其中所述肽与 MHC结合时能够被CD4和/或CD8 T细胞识别。
3.根据项1或2中所述的肽或其变体,其中氨基酸序列包括任意SEQ ID No.1至SEQID No.387和SEQ ID No.463至SEQ ID No.464的一个连续的氨基酸延伸区。
4.根据项1至3任一项中所述的肽或其变体,其中所述肽或其变体的总长度为8至100 个氨基酸、优选为8至30个氨基酸、更优选为8至16个氨基酸、最优选为该肽该肽系由或基本系由根据任一SEQ ID No.1至SEQ ID No.387和SEQ ID No.463至 SEQ ID No.464的氨基酸序列组成。
5.根据项1至4任一项中所述的肽或其变体,其中所述肽被修饰和/或包含非肽键。
6.根据项1至5任一项所述的肽或其变体,其中所述肽为融合蛋白的一部分,尤其包含 HLA-DR抗原相关不变链(li)的N-端氨基酸。
7.一种抗体,特别是可溶性或膜结合性抗体,优选为单克隆抗体或其片段,其特异性地识别根据项1至5任一项所述的肽或其变体,与MHC分子结合时优选为根据项1至 5中任一项所述的肽或变体。
8.一种T细胞受体,优选为可溶性或膜结合性受体或其片段,其与HLA配体反应,其中所述配体是根据项1至5任一项所述的肽或其变体,与MHC分子结合时优选为根据项1至5中任一项所述的肽或变体。
9.根据项8所述的T细胞受体,其中所述配体氨基酸序列与SEQ ID No.1至SEQ IDNo.387和SEQ ID No.463至SEQ ID No.464中任一个至少88%相同,或其中所述配体氨基酸序列包括SEQ ID No.1至SEQ ID No.387和SEQ ID No.463至 SEQ ID No.464任何之一。
10.根据项8或9中任何一项所述的T细胞受体,其中所述T细胞受体作为可溶性分子提供并任选具有进一步的效应子功能,如免疫刺激结构域或毒素。
11.一种适体,其特异性地识别根据项1至5中的肽或其变体,优选为根据项1至5中任一项所述的、与MHC分子结合的肽或变体。
12.一种核酸,其编码根据项1至5中任一项所述的肽或其变体,根据项7所述的抗体或其片段,根据项8或9所述的T细胞受体或其片段,任选连接到异源启动子序列或表达所述核酸的表达载体。
13.一种重组宿主细胞,其包含根据项1至6中任一项所述的肽,根据项7所述的抗体或其片段,根据项8或9所述的T细胞受体或其片段,或根据项12所述的核酸或表达载体,其中所述宿主细胞优选为选自抗原提呈细胞,例如树突细胞、T细胞或NK 细胞。
14.一种体外制备启动的T淋巴细胞的方法,该方法包括将T细胞与载有抗原的人I或II 类MHC分子进行体外连接,这些分子在合适的抗原提呈细胞表面或人工类比的抗原提呈细胞结构表面上表达足够的一段时间从而以抗原特异性方式启动T细胞,其中所述抗原为项1至4任一项中所述的肽。
15.根据项14中所述的方法制成的启动T淋巴细胞,其有选择性地识别一种细胞,该细胞提呈含项1至4任一项中给定氨基酸序列的多肽。
16.一种药物组合物,其包括至少一种活性成分,该成分选自根据项1至6任一项中所述的肽、根据项7中所述的抗体或其片段、根据项8或9中所述的T细胞受体或其片段、根据项11中所述的适体、根据项12中所述的核酸或表达载体、根据项13中所述的宿主细胞或根据项15中所述的活化T淋巴细胞,或共轭或标记的活性成分以及一种药用载体和任选的药用赋形剂和/或稳定剂。
17.一种用于制备根据项1至6任一项中所述的肽或其变体、根据项7所述的抗体或其片段或根据项8或9所述的T细胞受体或其片段的方法,所述方法包括培养根据项 13所述的宿主细胞以及从所述宿主细胞和/或其培养基中分离出所述肽或其变体、所述抗体或其片段或所述T细胞受体或其片段。
18.根据项1至6任一项中所述的肽、根据项7中所述的抗体或其片段、根据项8或9中所述的T细胞受体或其片段、根据项11中所述的适体、根据项12中所述的核酸或表达载体、根据项13中所述的宿主细胞或根据项15中所述的活化T淋巴细胞在药物中的用途。
19.一种杀灭患者体内靶向细胞的方法,其中靶向细胞提呈一种多肽,该多肽含项1至4 任一项中给定的氨基酸序列;一种给药方法,其中包括给予患者项15中定义的有效量T细胞。
20.根据项1至6任一项中所述的肽、根据项7中所述的抗体或其片段、根据项8或9中所述的T细胞受体或其片段、根据项11中所述的适体、根据项12中所述的核酸或表达载体、根据项13中所述的宿主细胞或根据项15中所述的活化T淋巴细胞在癌症诊断和/或治疗或制造抗癌药物中的用途。
21.根据项20所述的用途,其中所述癌症为选自急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌和其他肿瘤的组,这些肿瘤显示过量表达SEQ ID No.1至SEQ ID No.387和SEQ IDNo.463至SEQ ID No.464的肽所衍生自的蛋白。
22.一种套件,包括:
a)包含药物组合物的容器,所述药物组合物包含根据项1至6任一项中所述的肽、根据项7中所述的抗体或其片段、根据项8或9中所述的T细胞受体或其片段、根据项 11中所述的适体、根据项12中所述的核酸或表达载体、根据项13中所述的宿主细胞或根据项15中所述的溶液或冻干形式的活化T淋巴细胞。
b)可选地,第二个容器,其含有冻干粉剂型的稀释剂或重组溶液;
c)可选的至少一种以上肽,选自由SEQ ID No.1至SEQ ID No.460和SEQ ID No.463至SEQ ID No.464基团,以及
d)可选地,(i)使用溶液或(ii)重组和/或使用冻干粉剂型的说明书。
23.根据项22所述的药盒套件,进一步包括一个或多个(iii)缓冲剂,(iv)稀释剂,(v)过滤液,(vi)针,或(v)注射器。
24.一种用于生产用作个体患者的个性化抗癌疫苗或基于化合物的和/或细胞疗法,所述方法包括:
a)识别所述个体患者肿瘤样本提呈的肿瘤相关肽(TUMAP);
b)将a)中确定的肽与已经接受过免疫原性预筛查和/或与正常组织相比在肿瘤中过度提呈的存储库的肽进行比较。
c)选择与患者中识别的TUMAP匹配的存储库中的至少一种肽;和
d)生产和/或构想基于步骤c)的所述个性化疫苗或基于化合物的和/或细胞疗法。
25.根据项24中所述的方法,其中所述TUMAP透过以下方法识别:
a1)将肿瘤样本的表达资料与肿瘤样本组织类型相应的正常组织样本的表达资料进行比较,以识别在肿瘤样本中过度表达或异常表达的蛋白;和
a2)将表达资料与肿瘤样本中MHC I类和/或II类分子结合的MHC配体序列相关联,以识别肿瘤过度表达或异常的蛋白质衍生的MHC配体。
26.根据项24或25所述的方法,其中MHC配体的序列的确定方法是:洗脱来自肿瘤样本分离的MHC分子结合肽,并测序洗脱配体。
27.根据项24至26任一项所述的方法,其中该类型肿瘤样本相应的正常组织样本获得自同一患者。
28.根据项24至27任一项中所述的方法,其中存储库包含的肽用基于以下步骤进行识别:
aa.透过高度并行的方法,例如微阵列或基于测序的表达谱,进行全基因组信使核糖核酸(mRNA)表达分析,其包括识别相较于正常组织在恶性组织中过度表达的基因;
ab.选择步骤aa检测到的特异性表达或过量表达的基因所编码的肽,以及
ac.透过选定的肽确定诱导体内T细胞反应,包括使用健康供体或所述患者的人类T 细胞的体外免疫原性测定;或
ba.用质谱法识别来自所述肿瘤样本的HLA配体;
bb.透过高度并行的方法,例如微阵列或基于测序的表达谱,进行全基因组信使核糖核酸(mRNA)表达分析,其包括识别相较于正常组织在恶性组织中过度表达的基因;
bc.比较识别的HLA配体与所述基因表达资料;
bd.选择步骤bc检测到的特异性表达或过量表达的基因所编码的肽;
be.重新检测肿瘤组织上来自步骤bd的选定TUMAP、其在健康组织上缺乏或不经常检测到,并确定在mRNA水平上过度表达的相关性;以及
bf.透过选定的肽确定诱导体内T细胞反应,包括使用健康供体或所述患者的人类T 细胞的体外免疫原性测定。
29.根据项24至28任一项所述的方法,其中存储库是否包括肽免疫原性由含有体外免疫原性实验、个体HLA结合性患者免疫监测、MHC多聚体染色、ELISPOT分析和/或细胞内细胞因子染色的一种方法确定。
30.根据项24至29任一项所述的方法,其中所述存储库包括选自SEQ ID No.1至SEQ ID No.460和SEQ ID No.463至SEQ ID No.464组成的组团的多个肽。
31.根据项24至30任一项所述的方法,其进一步包括以下步骤:识别与该个体患者相应正常组织相比对所述肿瘤样本具有唯一性的至少一种突变,以及选择与突变相关并包含于疫苗或用于产生细胞疗法的一种肽。
32.根据项31中所述的方法,其中所述至少一种突变使用全基因组测序鉴定。
除非另有说明,否则本文使用的所有术语定义如下。
术语“T细胞反应”是指由一种肽在体外或体内诱导的效应子功能的特异性扩散和启动。对于MHC I类限制性细胞毒性T细胞,效应子功能可能为溶解肽脉冲的、肽前体脉冲的或天然肽提呈的靶细胞、分泌细胞因子,优选为肽诱导的干扰素-γ,TNF-α或IL-2,分泌效应分子,优选为肽诱导的颗粒酶或穿孔素,或脱颗粒。
本文所用“肽”这一术语,系指一系列氨基酸残基,通常透过相邻氨基酸的α-氨基和羰基之间的肽键来连接。这些肽的长度优选为9个氨基酸,但至短可为8个氨基酸长度,至长可为10、11、或12个氨基酸或更长,如果为MHC-II类肽时(本发明肽的拉长变体),至长可为13、14、15、16、17、18、19或20个氨基酸长度或更长。
此外,“肽”这一术语应包括一系列氨基酸残基的盐,通常透过相邻氨基酸的α-氨基和羰基之间的肽键来连接。优选的情况是,盐为肽的药用盐,例如:氯化物或乙酸(三氟乙酸) 盐。必须注意的是,本发明肽的盐与其体内状态的肽基本上不同,因为该不是体内的盐。
术语“肽”应也包括“寡肽”。本文使用的术语“寡肽”是指一系列氨基酸残基,通常透过相邻氨基酸的α-氨基和羰基之间的肽键来连接。寡肽的长度对于本发明来说并不十分关键,只要在寡肽中保持正确的表位即可。通常,寡肽长度约小于30个氨基酸残基,约长于15个氨基酸。
“多肽”这一术语是指一系列氨基酸残基,通常透过相邻氨基酸的α-氨基和羰基之间的肽键来连接。多肽的长度对于本发明来说并不十分关键,只要保持正确的表位即可。与术语肽或寡肽相对,“多肽”这一术语是指包含多于约30个氨基酸残基的分子。
一种肽、寡肽、蛋白质或编码该分子的核苷酸如果能诱导免疫反应,则具有“免疫原性” (因此是本发明中的一种“免疫原”)。在本发明的情况下,免疫原性的更具体定义是诱导 T细胞反应的能力。因此,“免疫原”是一种能够诱导免疫反应的分子,并且在本发明的情况下,是一种能诱导T细胞反应的分子。在另一方面,所述免疫原可以是肽,肽与MHC 的复合体、和/或用于提高特异性抗体或TCR抗性的蛋白。
I类T细胞“表位”要求的是一种结合至MHC I类受体上的短肽,从而形成一种三元复合体 (MHC I类α链、β-2-微球蛋白和肽),其可以透过T细胞负载匹配T细胞受体与具有适当亲和力的MHC/肽复合物结合来识别。结合至MHC I类分子的肽的典型长度为8-14个氨基酸,最典型为9个氨基酸长度。
在人类中,有三种编码MHC I类分子的不同基因位点(人MHC分子也是指定的人白细胞抗原(HLA)):HLA-A、HLA-B和HLA-C。HLA-A*01、HLA-A*02和HLA-B*07是可从这些基因位点表达的不同MHC I类等位元基因的实例。
表4:HLA-A*02、HLA-A*01、HLA-A*03、HLA-A*24、HLA-B*07、HLA-B*08和HLA-B*44血清类型的表达频率F。单体型频率Gf来源于一项研究,该研究使用了来自美国超过650万名志愿捐献者登记的HLA分型资料(Gragert et al.,2013)。该单体型频率是个体染色体上独特等位元基因的频率。由于哺乳动物细胞内的二倍体染色体组,该等位元基因的基因型出现频率较高,可以使用Hardy-Weinberg定律(F=1-(1-Gf)2)进行计算。
本发明的肽,优选当如本文描述纳入本发明的疫苗时与A*24。疫苗还可能包括泛结合 MHC lI类肽。因此,本发明的疫苗可用于治疗A*24阳性患者中的癌症,但不因为这些肽的广泛结核性而必须选择II类MHC同种异型。
如果本发明的A*24肽与结合至另一等位基因例如A*02的肽组合,与单独的MHCI类等位基因相比,可治疗更高比例的患者群体。虽然在大多数人群中,低于50%的患者可由单独的等位基因来解决问题,但是本发明中一种含HLA-A*24和HLA-A*02表位的疫苗可以治疗任何相关人群中至少60%的患者。具体来说,各区域中,以下比例的患者这些等位基因中的至少一个有肯定效果:美国61%、西欧62%、中国75%、韩国77%、日本 86%(根据www.allelefrequencies.net计算)。
表5:欧洲白人人群中HLA等位元基因覆盖(根据(Gragert et al.,2013)中所述的方法计算)。
在一项优选的实施方案中,术语“核苷酸序列”系指去氧核苷酸的杂聚物。
编码特定肽、寡肽或多肽的核苷酸序列可为天然核苷酸序列,也可为合成核苷酸序列。一般来说,编码肽、多肽以及本发明蛋白的DNA片段由cDNA片段和短寡核苷酸衔接物,或一系列寡核苷酸组成,以提供一种合成基因,该基因能够在包含源自微生物或病毒操纵子的调节元素的重组转录单元中被表达。
如本文所用的术语“肽的核苷酸编码”系指对肽进行核苷酸序列编码,其中该肽包括与将由用于产生TCR的树突细胞或另一细胞系统所表达该序列的生物系统相容的人工(人造) 启动和停止密码子。
本文提到的核酸序列既包括单链核酸也包括双链核酸。因此,除非本文另有所指,否则,例如对于DNA,具体的序列是该序列的单链DNA、该序列与其互补序列的双工(双链DNA)以及该序列的互补序列。
“编码区”这一术语是指在基因的天然基因组环境中天然或正常编码该基因的表达产物的那部分基因,即,体内编码该基因的天然表达产物的区域。
编码区可来自非突变(“正常”)基因、突变基因或异常基因,甚至还可以来自DNA序列,完全可在实验室中使用本领域熟知的DNA合成方法合成。
“表达产物”这一术语是指多肽或蛋白,它是基因和遗传码退化并因而编码同样的氨基酸所造成的任何核酸序列编码同等物的翻译产物。
“片断”这一术语,当指的是一种编码序列时,表示包含非完整编码区的DNA的一部分,其表达产物与完整编码区表达产物基本上具有相同的生物学功能或活性。
“DNA片段”这一术语是指一种DNA聚合物,以单独的片段形式或一种较大DNA结构的组分形式存在,它们从至少分离过一次的DNA中以基本纯净的形式获得,即不含污染性内源性材料,并且获得的数量或浓度能够使用标准生化方法,例如使用克隆载体,进行识别、操纵和回收该片段及其组分核苷酸序列。此类片段以开放阅读框架(未被内部未翻译序列打断)或内含子(通常提呈于真核基因中)的形式存在。未翻译DNA序列可能存在于开放阅读框架的下游,在那里其不会干预编码区的操纵或表达。
“引物”这一术语表示一种短核酸序列,其可与一个DNA链配对,并在DNA聚合酶开始合成去氧核糖核酸链之处提供一个游离的3′-OH末端。
“启动子”这一术语表示参与RNA聚合酶的结合从而启动转录的DNA区域。
术语“分离”表示一种物质从其原来的环境(例如,如果是天然发生的则是天然环境)中被移走。例如,活体动物中的天然核苷酸或多肽不是分离的,但是,从天然系统中一些或所有共存物质中分离出来的核苷酸或多肽是分离的。此类多核苷酸可能是载体的一部分和/ 或此类多核苷酸和多肽可能是一种组合物的一部分,并且由于该载体或组合物不是其天然环境的一部分,因此它仍然是分离的。
本发明中披露的多核苷酸和重组或免疫原性多肽也可能以“纯化”的形式存在。术语“纯化”并非要求绝对的纯度;它只是一个相对的定义,可以包括高度纯化或部分纯化的制剂,相关领域技术人员能理解这些术语。例如,各个从已用传统方法纯化为具有电泳同质性的cDNA库中分离出的各种克隆物。明确考虑到将起始材料或天然物质纯化至少一个数量级,优选为两或三个数量级,更优选为四或五个数量级。此外,明确涵盖所述多肽的纯度优选为99.999%,或至少为99.99%或99.9%;甚而适宜为以重量计99%或更高。
根据本发明公开的核酸和多肽表达产物,以及包含此类核酸和/或多肽的表达载体可能以“浓缩的形式”存在。本文使用的术语“浓缩”是指材料的浓度至少是其自然浓度的大约2、 5、10、100或1000倍,有优势的是,按重量计为0.01%,优选为至少0.1%。也明确考虑到,按重量计约为0.5%、1%、5%、10%和20%的浓缩制剂。序列、构型、载体、克隆物以及包含本发明的其他材料可有优势地以浓缩或分离的形式存在。“活性片段”这一术语是指产生免疫反应的片段(即具有免疫原性活性),通常是一种肽、多肽或核酸序列的片段,不论是单独或可选地与合适的佐剂一起或在载体中给予一种动物,比如哺乳动物,例如兔子或小鼠,也包括人;这种免疫反应采用的形式是在接受动物(如:人)体内刺激T细胞反应。或者,“活性片段”也可用于诱导体外T细胞反应。
本文使用的“部分”(portion)、“节段”(segment)、“片段”(fragment)这几个术语,当与多肽相关地使用时是指残基的连续序列,比如氨基酸残基,其序列形成一个较大序列的子集。例如,如果一个多肽以任一种肽链内切肽酶(如胰蛋白酶或糜蛋白酶)进行处理,则该处理获得的寡肽会代表起始多肽的部分、节段或片段。当与多核苷酸相关地使用时,这些术语系指用任何核酸内切酶处理所述多核苷酸产生的产物。
根据本发明,术语“等同度百分比”或“等同百分比”,如果指的是序列,则表示在待对比序列(“被对比序列”)与所述序列或权利要求的序列(“参考序列”)对准之后将被对比序列与所述序列或权利要求的序列进行比较。然后根据下列公式计算等同度百分比:
等同度百分比=100[1-(C/R)]
其中C是参考序列与被对比序列之间对准长度上参考序列与被对比序列之间的差异数量,其中
(i)参考序列中每个碱基或氨基酸序列在被对比序列中没有对应的对准碱基或氨基酸;
(ii)参考序列中每个空隙,以及
(iii)参考序列中每个对准碱基或氨基酸与被比对比序列中对准碱基或氨基酸不同,即构成一个差异以及
(iiii)必须在对准序列的第1位置开始对准;
并且R是参考序列与被对比序列对准长度上在参考序列中产生任何空隙也计算为一个碱基或氨基酸的参考序列中的碱基或氨基酸数目。
如果“被对比序列”和“参考序列”之间存在的一个对准按上述计算的等同度百分比大致等于或大于指定的最低等同度百分比,则被对比序列与参考序列具有指定的最低等同度百分比,虽然可能存在按本文上述计算的等同度百分比低于指定等同度百分比的对准。
因此,如上所述,本发明提出了一种肽,其包括选自SEQ ID NO:1至SEQ ID NO:387和 SEQ ID NO.463至SEQ ID NO.464群组的一个序列、或与SEQ ID NO:1至SEQ ID NO:387和SEQ ID NO.463至SEQ ID NO.464具有88%同源性的其变体、或诱导与该肽发生T细胞交叉反应的一个变体。本发明所述的肽具有与主要组织相容性复合体(MHC) I或所述肽拉长版本的lI类分子结合的能力。
在本发明中,“同源性”一词系指两个氨基酸序列之间的同一度(参见上文的等同度百分比,如肽或多肽序列。前文所述的“同源”是透过将理想条件下调整的两个序列与待比较序列进行比对后确定的。此类序列同源性可透过使用ClustalW等演算法创建一个排列而进行计算。也可用使用一般序列分析软件,更具体地说,是Vector NTI、GENETYX或由公共资料库提供的其他工具。
本领域技术人员能评估特定肽变体诱导的T细胞是否可与该肽本身发生交叉反应(Appay et al.,2006;Colombetti et al.,2006;Fong et al.,2001;Zaremba et al.,1997)。
发明人用给定氨基酸序列的“变体”表示,一个或两个氨基酸残基等的侧链透过被另一个天然氨基酸残基的侧链或其他侧链取代而发生改变,这样,这种肽仍然能够以含有给定氨基酸序列(由SEQ ID NO:1至SEQ ID NO:387和SEQ ID NO.463至SEQ ID NO.464组成)的肽大致同样的方式与HLA分子结合。例如,一种肽可能被修饰以便至少维持(如没有提高)其能与HLA-A*02或-DR等合适MHC分子的结合槽相互作用和结合,以及至少维持(如没有提高)其与启动T细胞的TCR结合的能力。
随后,这些T细胞可与细胞和杀伤细胞发生交叉反应,这些细胞表达多肽(其中包含本发明中定义的同源肽的天然氨基酸序列)。正如科学文献和资料库(Rammensee etal., 1999;Godkin et al.,1997)中所述,HLA-A结合肽的某些位点通常为锚定残基,可形成一种与HLA结合槽的结合模序相称的核心序列,其定义由构成结合槽的多肽链的极性、电物理、疏水性和空间特性确定。因此,本领域技术人员能够透过保持已知的锚残基来修饰SEQ ID NO:1至SEQ ID NO:387和SEQ ID NO.463至SEQ ID NO.464提出的氨基酸序列,并且能确定这些变体是否保持与MHC I或II类分子结合的能力。本发明的变体保持与启动T细胞的TCR结合的能力,随后,这些T细胞可与表达一种包含本发明定义的同源肽的天然氨基酸序列的多肽的细胞发生交叉反应并杀死该等细胞。
如果无另有说明,那么本文公开的原始(未修饰)肽可以透过在肽链内的不同(可能为选择性)位点上取代一个或多个残基而被修饰。优选情况是,这些取代位于氨基酸链的末端。此取代可能是保守性的,例如,其中一个氨基酸被具有类似结构和特点的另一个氨基酸所取代,比如其中一个疏水性氨基酸被另一个疏水性氨基酸取代。更保守的取代是具有相同或类似的大小和化学性质的氨基酸间的取代,例如,亮氨酸被异亮氨酸取代。在天然同源蛋白质家族序列变异的研究中,某些氨基酸的取代往往比其他氨基酸更具有耐受性,这些氨基酸往往表现出与原氨基酸的大小、电荷、极性和疏水性之间的相似性相关,这是确定“保守取代”的基础。
在本文中,保守取代定义为在以下五种基团之一的内部进行交换:基团1-小脂肪族、非极性或略具极性的残基(Ala,Ser,Thr,Pro,Gly);基团2-极性、带负电荷的残基及其醯胺(Asp,Asn,Glu,Gln);基团3-极性、带正电荷的残基(His,Arg,Lys);基团4-大脂肪族非极性残基(Met,Leu,lle,Val,Cys)以及基团5-大芳香残基(Phe,Tyr,Trp)。
较不保守的取代可能涉及一个氨基酸被另一个具有类似特点但在大小上有所不同的氨基酸所取代,如:丙氨酸被异亮氨酸残基取代。高度不保守的取代可能涉及一个酸性氨基酸被另一个具有极性或什至具有碱性性质的氨基酸所取代。然而,这种“激进”取代不能认为是无效的而不予考虑,因为化学作用是不完全可预测的,激进的取代可能会带来其简单化学原理中无法预见的偶然效果。
当然,这种取代可能涉及普通L-氨基酸之外的其他结构。因此,D-氨基酸可能被本发明的抗原肽中常见的L-氨基酸取代,也仍在本公开的范围之内。此外,非标准氨基酸(即,除了常见的天然蛋白原氨基酸)也可以用于取代之目的,以生产根据本发明的免疫原和免疫原性多肽。
如果在一个以上位置上的取代发现导致肽的抗原活性基本上等于或大于以下定义值,则对这些取代的组合进行测试,以确定组合的取代是否产生对肽抗原性的叠加或协同效应。肽内被同时取代的位置最多不能超过4个。
基本上由本文所指氨基酸序列组成的一种肽可能有一个或两个非锚定氨基酸(见下面锚基序相关内容)被交换,而不存在这种情况,即相比于未修饰的肽,与人类主要组织相容性复合体(MHC)-I或II类分子的能力基本上被改变或受到不利影响。在另一实施方案中,在基本上由本文所述氨基酸序列组成的肽中,一个或两个氨基酸可与其保守交换伙伴交换 (见下文),而不存在这种情况,即相比于未修饰的肽,与人类主要组织相容性复合体(MHC)-I或II类分子的能力基本上被改变或受到不利影响。
这些基本不与T细胞受体互动的氨基酸残基可透过取代其他几乎不影响T细胞反应并不妨碍与相关MHC结合的氨基酸而得到修饰。因此,除了特定限制性条件外,本发明的肽可能为任何包括给定氨基酸序列或部分或其变体的肽(发明人所用的这个术语包括寡肽或多肽)。
表6:根据SEQ ID NO:7、10、23和40的肽的变体和基序
较长(拉长)的肽也可能适合。MHC I类表位(通常长度为8至11个氨基酸)可能由肽从较长的肽或包含实际表位的蛋白中加工而产生。两侧有实际表位的残基优选为在加工过程中几乎不影响暴露实际表位所需蛋白裂解的残基。
本发明的肽可被拉长多达四个氨基酸,即1、2、3或4个氨基酸,可按照4∶0与0∶4之间的任何组合添加至任意一端。本发明的拉长组合可见表7。
表7:本发明肽的拉长组合
拉伸/延长的氨基酸可以是所述蛋白或任何其他氨基酸的原序列肽。拉长可用于增强所述肽的稳定性或溶解性。
因此,本发明所述的表位可能与天然肿瘤相关表位或肿瘤特异性表位相同,也可能包括来自参考肽的不超过四个残基的不同肽,只要它们有基本相同的抗原活性。
在一项替代实施方案中,肽的一边或双边被拉长4个以上的氨基酸,优选最多30个氨基酸的总长度。这可形成MHC-II类结合肽。结合至MHC II类肽可透过本领域中已知的方法进行测试。
因此,本发明提出了MHC I类表位的肽和变体,其中所述肽或变体的总长度为8至100,优选为8至30,最优选为8至14,即8、9、10、11、12、13、14个氨基酸,为伸长II类结合肽时,所述长度也可为15、16、17、18、19、20、21或22个氨基酸。
当然,本发明的肽或变体能与人主要组织相容性复合体(MHC)I或II类分子结合。肽或变体与MHC复合物的结合可用本领域内的已知方法进行测试。
优选情况是,当本发明的肽特异性T细胞相比于取代肽受到检测时,如果取代肽在相对于背景肽溶解度增加达到最大值的一半,则该肽浓度不超过约1mM,优选为不超过约1μM,更优选为不超过约1nM,再优选为不超过约100pM,最优选为不超过约10pM。也优选为,取代肽被一个以上的T细胞识别,最少为2个,更优选为3个。
在本发明的一个特别优选实施方案中,肽系由或基本系由根据SEQ ID NO:1至SEQID NO:387和SEQ ID NO:463至SEQ ID NO:464所选的氨基酸序列组成。
基本由“…组成”系指本发明的肽,除了根据SEQ ID NO:1至SEQ ID NO:387和SEQID NO:463至SEQ ID NO:464中的任一序列或其变体组成外,还含有位于其他N和/或C端延伸处的氨基酸,而它们不一定能形成作为MHC分子表位的肽。
但这些延伸区域对有效将本发明中的肽引进细胞具有重要作用。在本发明的一实施例中,该肽为融合蛋白的一部分,含来自NCBI、GenBank登录号X00497的HLA-DR抗原相关不变链(p33,以下称为“li”)的80个N-端氨基酸等。在其他的融合中,本发明的肽可以被融合到本文所述的抗体、或其功能性部分,特别是融合入抗体的序列,以便所述抗体进行特异性靶向作用,或者,例如进入本文所述的树突状细胞特异性抗体。
此外,该肽或变体可进一步修饰以提高稳定性和/或与MHC分子结合,从而引发更强的免疫反应。肽序列的该类优化方法是本领域内所熟知的,包括,例如,反式肽键和非肽键的引入。
在反式肽键氨基酸中,肽(-CO-NH-)并未连接其残基,但是其肽键是反向的。这种逆向反向模拟肽(retro-inverso peptidomimetics)可透过本领域已知的方法制备,例如:Meziere等人在(Meziere et al.,1997)中所述的方法,以引用的方式并入本文。这种方法涉及制备包含骨架(而并非侧链)改变的模拟肽。Meziere等人(Meziere et al.,1997)的研究显示,这些类比肽有利于MHC的结合和辅助性T细胞的反应。以NH-CO键替代 CO-NH肽键的逆向反向肽大大地提高了抗水解性能。
非肽键为-CH
含上述序列的肽可与其氨基和/或羧基末端的其他化学基团进行合成,从而提高肽的稳定性、生物利用度、和/或亲和力等。例如,苄氧羰基、丹醯基等疏水基团或叔丁氧羰基团可加入肽的氨基末端。同样,乙醯基或9-芴甲氧羰基可能位于肽的氨基末端。此外,疏水基团、叔丁氧羰基团或氨基团都可能被加入肽的羧基末端。
另外,本发明中的所有肽都可能经合成而改变其空间构型。例如,可能使用这些肽的一个或多个氨基酸残基的右旋体,通常不是其左旋体。更进一步地,本发明中肽的至少一个氨基酸残基可被熟知的一个非天然氨基酸残基取代。诸如此类的改变可能有助于增加本发明肽的稳定性、生物利用度和/或结合作用。
同样,本发明中的肽或变体可在合成肽之前或之后透过特异氨基酸的反应而进行化学修饰。此类修饰的实施例为本领域所熟知,例如,在R.Lundblad所著的《ChemicalReagents for Protein Modification》(3rd ed.CRC Press,2004)(Lundblad,2004)中有概述,以参考文献的方式并入本文。虽然氨基酸的化学修饰方法无限制,但其包括(但不限于)透过以下方法修饰:醯基化、脒基化、赖氨酸吡哆基化、还原烷基化、以2,4,6-三硝基苯磺酸(TNBS)三硝基苯基化氨基团、透过将半胱氨酸过甲酸氧化为磺基丙氨酸而对羧基团和巯基进行氨基修饰、形成易变衍生物、与其他巯基化合物形成混合二硫化合物、与马来醯亚胺反应,与碘乙酸或碘乙醯胺羧甲基化、在碱性pH值下与氰酸盐甲氨醯化。在这方面,技术人员参考了《Current Protocols In Protein Science》(Eds.Coligan et al. (JohnWiley and Sons NY 1995-2000))(Coligan et al.,1995)中第15章所述的在蛋白质化学修饰相关的广泛方法。
简言之,修饰蛋白质的精氨醯残基等往往基于于邻二羰基化合物(如苯甲醯甲醛、2,3- 丁二酮以及1,2-烯巳二酮)的反应而形成加合物。另一个实施例是丙酮醛与精氨酸残基的反应。半胱氨酸可在赖氨酸和组氨酸等亲核位点不作随同修饰的情况下就得到修饰。因此,有大量试剂可进行半胱氨酸的修饰。Sigma-Aldrich(http://www.sigma-aldrich.com) 等公司的网站含有具体试剂的资讯。
蛋白质中二硫键的选择性还原也很普遍。二硫键可在生物制药热处理中形成和氧化。伍德沃德氏试剂K可用于修饰特定的谷氨酸残基。N-(3-二甲氨基丙基)-N′-乙基-碳二亚胺可用于形成赖氨酸残基和谷氨酸残基的分子内交联。例如:焦碳酸二乙酯是修饰蛋白质组氨酸残基的试剂。组氨酸也可使用4-羟基-2-壬烯醛进行修饰。赖氨酸残基与其他α-氨基团的反应,例如,有利于肽结合到蛋白/肽的表面或交联处。赖氨酸聚是多(乙烯)乙二醇的附着点,也是蛋白质糖基化的主要修饰位点。蛋白质的蛋氨酸残基可透过碘乙醯胺、溴乙胺、氯胺T等被修饰。
四硝基甲烷和N-乙醯基咪唑可用于酪氨酸残基的修饰。经二酪氨酸形成的交联可透过过氧化氢/铜离子完成。
对色氨酸修饰的最近研究中使用了N-溴代琥珀醯亚胺、2-羟基-5-硝基苄溴或3-溴-3-甲基- 2-(2-硝苯巯基)-3H-吲哚(BPNS-粪臭素)。
当蛋白与戊二醛、聚乙二醇二丙烯酸酯和甲醛的交联用于配制水凝胶时,治疗性蛋白和含聚乙二醇的肽的成功修饰往往可延长回圈半衰期。针对免疫治疗的变态反应原化学修饰往往透过氰酸钾的氨基甲醯化实现。
一种肽或变体,其中肽被修饰或含非肽键,优选为本发明的实施例。
本发明的另一实施方案涉及一种非天然肽,其中所述肽系由或基本系由根据SEQID NO: 1至SEQ ID NO:387和SEQ ID NO:463至SEQ ID NO:464的一个氨基酸序列组成,并经合成产生(即,合成)为一种药用盐。合成产生肽的方法是本领域公知的。本发明肽的盐与其体内状态的肽基本上不同,因为这些体内产生的肽不是盐。该肽的非天然盐形式介导肽的溶解度,特别是包含所述肽的药物组合物的情况下,例如,本文所公开的肽疫苗。为了向需治疗的受试者有效地提供肽,需要肽具有充分、至少基本的溶解度。优选地,盐为肽的药用盐。本发明的这些盐包括碱和碱土盐类,诸如Hofmeister系列的盐,包含阴离子PO
一般来说,肽和变体(至少含氨基酸残基之间的肽联接)可使用Lukas等人(Lukaset al., 1981)以及此处引用的参考文献所披露的固相肽合成Fmoc-聚醯胺模式进行合成。芴甲氧羰基(Fmoc)团对N-氨基提供临时保护。使用N,N-二甲基甲醯胺中的20%二甲基呱啶中对这种碱高度敏感的保护基团进行重复分裂。由于它们的丁基醚(在丝氨酸苏氨酸和酪氨酸的情况下)、丁基酯(在谷氨酸和天门冬氨酸的情况下)、叔丁氧羰基衍生物(在赖氨酸和组氨酸的情况下)、三苯甲基衍生物(在半胱氨酸的情况下)及4-甲氧基-2,3,6-三甲基苯磺醯基衍生物(在精氨酸的情况下),侧链功能可能会受到保护。只要谷氨醯胺和天冬醯胺为 C-末端残基,侧链氨基功能保护所使用的是由4,4′-二甲氧基二苯基团。固相支撑基于聚二甲基丙烯醯胺聚合物,其由三个单体二甲基丙烯醯胺(骨架单体)、双丙烯醯乙烯二胺(交联剂)和N-丙烯醯肌胺酸甲酯(功能剂)构成。使用的肽-树脂联剂为酸敏感的4-羟甲基苯氧乙酸衍生物。所有的氨基酸衍生物均作为其预制对称酸酐衍生物加入,但是天冬醯胺和谷氨醯胺除外,它们使用被逆转的N,N-二环己基碳二亚胺/1-羟基苯并三唑介导的耦合程序而加入。所有的耦合和脱保护反应用茚三酮、硝基苯磺酸或isotin测试程序监测。合成完成后,用浓度为95%含50%清道夫混合物的三氟醋酸,从伴随去除侧链保护基团的树脂支承物中裂解肽。常用的清道夫混合物包括乙二硫醇、苯酚、苯甲醚和水,准确的选择依据合成肽的氨基酸组成。此外,固相和液相方法结合使用对肽进行合成是可能的(例如,请参阅(Bruckdorfer et al.,2004)以及本文引用的参考文献)
三氟乙酸用真空中蒸发、随后用承载粗肽的二乙基乙醚滴定进行去除。用简单萃取程序 (水相冻干后,该程序制得不含清道夫混合物的肽)清除任何存在的清道夫混合物。肽合成试剂一般可从Calbiochem-Novabiochem(诺丁汉,英国)获得。
纯化可透过以下技术的任何一种或组合方法进行,如:再结晶法、体积排阻色谱法、离子交换色谱法、疏水作用色谱法以及(通常)反相高效液相色谱法(如使用乙腈/水梯度分离)。
可以使用薄层色谱法、电泳特别是毛细管电泳、固相萃取(CSPE)、反相高效液相色谱法、酸解后的氨基酸分析、快原子轰击(FAB)质谱分析以及MALDI和ESI-Q-TOF质谱分析进行肽分析。
为了选择过度提呈的肽,计算了提呈图,其显示样本中位元提呈量以及复制变化。该特点使相关肿瘤实体的样本与正常组织样本的基线值并列。可透过计算调节线性混合效应模型 (Pinheiro et al.,2015)的p值将以上每个特点并入过度提呈分数中,从而透过假发现率 (Benjamini and Hochberg,1995)调整多项检验(参考实施例1、图1)。
对于透过质谱法对HLA配体的识别和相对定量,对来自冲击冷冻组织样本的HLA分子进行纯化并对HLA相关肽进行分离。分离的肽分开,并透过线上纳米-电喷雾-电离(nanoESI)液相色谱-谱(LC-MS)实验进行鉴定。由此产生的肽序列的验证方法是,将急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌样本(N=263个样本)中记录的自然肿瘤相关肽(TUMAP)的片段模式与相同序列相应合成参考肽的片段模式进行比较。由于这些肽被直接鉴定为原发肿瘤HLA分子的配体,因此这些结果为来自263名急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌患者的原发性癌组织上确定肽的自然加工和提呈提供了直接证据。
发现管道
为每种肽和样本确立了提呈水平,包括误差估计值。肿瘤组织大量提呈的肽以及肿瘤与非肿瘤组织和器官中过量提呈的肽已经得到确定。
对来自急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌组织样本的HLA肽复合物进行纯化,并且对HLA相关肽使用LC-MS进行分离和分析(见实施例1)。本申请中包含的所有TUMAP使用急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌样本的方法进行鉴定,确认其在急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌上的提呈。
在多个急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌和正常组织上确定的 TUMAP用无标记LC-MS资料的离子计数方法进行量化。该方法假定肽的LC-MS信号区域与样本中其丰度相关。各种LC-MS实验中肽的所有量化信号在集中趋势基础上进行正常化,根据每个样品进行平均,并且合并入柱状图(被称为提呈图)。提呈图整合了不同分析方法,如:蛋白资料库检索、谱聚类、充电状态卷积(除电)和保留时间校准和正态化。
除了过量提呈肽之外,也测试了潜在基因的mRNA表达。mRNA资料透过RNA测序分析正常组织和癌组织获得(参考实施例2、图2)。获得自蛋白的肽在癌组织中显示高表达编码mRNA,但是在重要正常组织中非常低或不存在,这些肽作为优选肽纳入本发明。
本发明提出了有利于治疗癌症/肿瘤的肽,优选为治疗过度提呈或只提呈本发明肽的急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌。这些肽由质谱分析法显示出,由HLA 分子自然提呈于原发性人急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌样本中。与正常组织相比,癌症中高度过量表达肽来源的许多源基因/蛋白质(也称为“全长蛋白”或“潜在蛋白”)-本发明相关的“正常组织”应是指健康血细胞、血管、大脑、心脏、肝脏、肺、脂肪组织、肾上腺、胆管、膀胱、骨髓、食道、眼、胆囊、头颈、大肠、小肠、肾、淋巴结、周围神经、胰腺、甲状旁腺、腹膜、垂体、胸膜、骨骼肌、皮肤、脾、胃、甲状腺、气管、输尿管细胞或其他正常组织细胞,这表明肿瘤与这些源基因的高度关联性(见实施例2)。此外,这些肽本身也在肿瘤组织中大量过度提呈(本发明相关的“肿瘤组织”应是指来自急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌患者的样本),但不在正常组织中大量过度提呈(见实施例1)。
HLA结合肽能够被免疫系统识别,特别是T淋巴细胞。T细胞可破坏提呈被识别HLA/肽复合体的细胞(如:提呈衍生肽的急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌细胞)。
本发明的所有肽已被证明具有刺激T细胞反应的能力,并过量提呈,因而可用于制备本发明的抗体和/或TCR,例如可溶性TCR(参见实施例3和实施例4)。此外,肽与相应的MHC组合时,也可用于制备本发明的抗体和/或TCR,特别是sTCR。各个方法均为技术人员所熟知,并在各个文献中可找到(也参见下文)。因此,本发明的肽可用于在患者中产生免疫反应,从而能够毁灭肿瘤细胞。患者的免疫反应能够透过直接给予患者所述肽或前体物质(如,加长肽、蛋白或编码这些肽的核酸),较理想是与加强免疫原性的制剂相结合,而进行诱导。源自该治疗性疫苗的免疫反应预期能够高度特异性地对抗肿瘤细胞,因为本发明的目标肽在正常组织上提呈的复制数目较少,防止患者发生对抗正常细胞的不良自体免疫反应的风险。
本说明书还涉及包含一个α链和一个β链(“α/β TCR”)的T细胞受体(TCR)。还提供了由 MHC分子提呈时可与TCR和抗体结合的本发明的肽。
本说明书还涉及由HLA分子提呈能够与本发明的肽抗原结合的本发明的TCR片段。该术语特别涉及可溶性TCR片段,例如缺失跨膜部分和/或恒定区的TCR、单链TCR及其与例如Ig的融合物。
本说明书还涉及核酸、载体和用于表达TCR的宿主细胞和本说明书的肽;以及使用它们的方法。
术语“T细胞受体”(缩写TCR)是指一种异二聚体分子,其包含一个α多肽链(α链)和一个β多肽链(β链),其中所述异二聚体受体能够结合由HLA分子提呈的肽抗原。该术语还包括所谓的γ/δTCR。
在一个实施方案中,本说明书提供了如本文中所描述的产生TCR的方法,该方法包括在适于促进TCR表达的条件下培养能够表达TCR的宿主细胞。
另一个方面,本说明书涉及一种根据本说明书的方法,其中所述抗原透过与足够量的含抗原提成细胞的抗原结合被载入表达于合适抗原提呈细胞或人工抗原呈递细胞表面的I或II 类MHC分子,或该抗原透过四聚化被载入I或II类MHC四聚体/I或II类MHC复合单体。
α/βTCR的α和β链和γ/δTCR的Y和δ链通常被视为各自有两个“结构域”,即可变和恒定结构域。可变结构域由可变区(V)和连接区(J)的组合。可变结构域还可能包括一个前导区 (L)。β和δ链还可能包括一个多样区(D)。α和β恒定结构域还可能包括锚定α和β链至细胞膜的C末端跨膜(TM)结构域。
相对于γ/δ的TCR,如本文所用的术语“TCR γ可变域”是指无前导区(L)的TCR γV(TRGV) 区与TCR γ(TRGJ)区的组合,术语TCR γ恒定结构域是指细胞外TRGC区域,或C-末端截短TRGC序列。同样地,“TCRδ可变域”是指无前导区(L)的TCRδV(TRDV)区与 TCRδD/J(TRDD/TRDJ)区的组合,术语“TCRδ恒定结构域”是指细胞外TRDC区域,或 C-末端截短TRDC序列。
本说明书的TCR优选结合至肽HLA分子复合体,其具有约100μM或更小、约50μM或更小、约25μM或更小或约10μM或更小的结合亲和力(KD)。更为优选的情况是具有约 1μM或更小、约100nM或更小、约50nM或更小或约25nM或更小结合亲和力的高亲和力TCR。本发明TCR优选结合亲和力范围的非限制性示例包括约1nM至约10nM;约 10nM至约20nM;约20nM至约30nM;约30nM至约40nM;约40nM至约50nM;约50nM至约60nM;约60nM至约70nM;约70nM至约80nM;约80nM至约90 nM;以及约90nM至约100nM。
与本说明书TCR相关,本文使用的“特异性结合”及其语法变体用于表示对100μM或更小的肽-HLA分子复合体有结合亲和力(KD)的TCR。
本说明书的α/β异二聚体TCR可能具有其恒定结构域之间的引入二硫键。这种类型的优选 TCR包括那些具有一个TRAC恒定域序列和TRBC1或TRBC2恒定域序列的TCR,除非TRAC的苏氨酸48和TRBC1或TRBC2的丝氨酸57被半胱氨酸残基取代,所述半胱氨酸形成TRAC恒定域序列和TCR的TRBC1或TRBC2恒定区序列之间的二硫键。
不论具有或不具有上述的引入链间键,本说明书的α/β杂二聚体TCR可能具有一个TRAC 恒定域序列和一个TRBC1或TRBC2恒定结构域序列,并且TRAC恒定结构域序列和 TCR的TRBC1或TRBC2恒定结构域序列可能透过TRAC外显子2的Cys4和TRBC1或 TRBC2外显子2的Cys4之间的天然二硫键相连。
本说明书的TCR可能包括选自由放射性核素、萤光团和生物素组成组中的可检测标记。
本说明书的TCR可能共轭至治疗活性剂,如放射性核素、化学治疗剂或毒素。
在一个实施方案中,具有在α链中至少一个突变和/或具有在β链中至少一个突变的TCR 与未突变的TCR相比,已经修改了糖基化。
在一个实施方案中,在TCRα链和/或TCRβ链中包括至少一个突变的TCR对肽HLA分子复合体有结合亲和力和/或结合半衰期,其是包含未突变TCRα链和/或未突变TCRβ链的TCR的结合亲和力的至少两倍。肿瘤特异性TCR亲和力增强及其开发依赖于存在最佳 TCR亲和力的窗口。这样窗口的存在是根据观察结果:HLA-A限制性病原体特异性TCR 与HLA-A限制性肿瘤相关自身抗原特异性TCR相比,KD值通常大约低10倍。现已知,尽管肿瘤抗原可能具有免疫原性,但是因为肿瘤来自个体自身的细胞,因此仅突变蛋白质或翻译加工改变的蛋白将被免疫系统视为外来物质。上调或过度表达(所谓的自体抗原)的抗原不一定诱导针对肿瘤的功能免疫应答:表达对这些抗原具有高度反应性的 TCR的T细胞会在一种称为中枢耐受的程序中在胸腺内被不利选择,也就是说只有对自身抗原具有低亲和力TCR的细胞才仍然存在。因此,本说明书的TCR或变体对肽的亲和力可透过本领域熟知的方法来增强。
本说明书还涉及一种识别和分离本发明TCR的一种方法,所述方法包括:用A24/肽单体孵育来自HLA-A*024阴性的健康捐赠者的PBMC,用四聚体-藻红蛋白(PE)孵育PBMC 并透过萤光启动细胞分选(FACS)-Calibur方法分析分离高亲和力T细胞。
本说明书还涉及一种识别和分离本发明TCR的一种方法,所述方法包括:获得含整个人体TCRαβ基因位点(1.1and0.7Mb)的转基因小鼠(其T细胞表达多样化人类TCR,用于补偿小鼠TCR缺乏),用肽对小鼠进行免疫处理,用四聚体-藻红蛋白(PE)孵育从转基因小鼠中获得的PBMC,并透过萤光启动细胞分选(FACS)-Calibur方法分析分离高亲和力T细胞。
一方面,为了获得表达本说明书TCR的T细胞,编码本说明书TCR-α和/或TCR-β链的核酸被克隆入表达载体,诸如γ反转录病毒或慢病毒。重组病毒产生,然后测试功能,如抗原专一性和功能性亲合力。然后,最终产品的等分试样被用于转导靶T细胞群体(一般纯化自患者的PBMC),在输入患者前展开。另一方面,为了获得表达本说明书TCR 的T细胞,TCRRNA透过本领域中已知的技术(例如,体外转录系统)合成。然后,体外合成的TCR RNA透过电穿孔来重新表达肿瘤特异性TCR-α和/或TCR-β链被引入获得自健康供体的初级CD8+ T细胞。
为了增加表达,编码本说明书TCR的核酸在操作上可连接到强启动子,例如逆转录病毒长末端重复序列(LTR)、巨细胞病毒(CMV)、鼠干细胞病毒(MSCV)U3、磷酸甘油酸激酶(PGK)、β肌动蛋白、泛素蛋白和猿猴病毒40(SV40)/CD43复合启动子、延伸因子(EF)- 1a和脾脏病灶形成病毒(SFFV)启动子。在一优选实施方案中,启动子与被表达的核酸异源。除了强启动子外,本说明书的TCR表达盒可能含有附加的元素,可提高转基因表达,包括中枢多聚嘌呤区(CPPT),其促进了慢病毒构建体的核易位(Follenzi et al., 2000),和土拨鼠肝炎病毒转录后调控元素(WPRE),其透过提高RNA稳定性增加转基因表达水平(Zufferey etal.,1999)。
本发明TCR的α和β链可由位于分开的载体核酸进行编码,或者可透过位于同一载体的多核苷酸编码。
实现高水平的TCR表面表达需要引入TCR的TCR-α和TCR-β链高水平转录。为了实现它,本说明书的TCR-α和TCR-β链可在单一的载体中被克隆入双顺反子构建体,其已被证明能够克服这一障碍。使用TCR-α和TCR-β链在之间的病毒核糖体间进入位元点 (IRES)导致两链的协同表达,因为TCR-α和TCR-β链均由在翻译过程中分成两个蛋白质的单一转录物产生,从而确保了产生TCR-α和TCR-β链的相等摩尔比。(Schmitt et al. 2009)。
编码本说明书TCR的核酸可以是被优化以从宿主细胞增加表达的密码子。遗传密码冗余让一些氨基酸被一个以上的密码子编码,但某些密码子没有其他密码子“优化”,因为匹配 tRNA以及其他因子的相对可用性(Gustafsson et al.,2004)。修改TCR-α和TCR-β基因序列使得每个氨基酸被用于哺乳动物基因表达的最佳密码子编码,以及消除mRNA不稳定性基序或隐蔽剪接位元点,已显示可显著提高TCR-α和TCR-β基因表达(Scholten etal.,2006)。
此外,引入的和内源性TCR链之间的错配可能会导致获得特异性,其构成自身免疫的显著风险。例如,混合TCR二聚体的形成可能会减少可用以形成正确配对TCR复合体的CD3分子数目,因此,可以显著降低表达所引入TCR的细胞的功能性亲合力(Kuball et al.,2007)。
为了减少错配,本说明书引入的TCR链的C-末端结构域可以进行修改以促进链间亲和力,同时降低引入链与内源TCR配对的能力。这些策略可能包括用鼠配对物取代人类TCR-α和TCR-βC端结构域(鼠化C端结构域);透过引入第二个半胱氨酸残基到引入 TCR的TCR-α和TCR-β链产生C末端结构域的第二个链间二硫键(半胱氨酸修饰);交换TCR-α和TCR-β链C端结构域的相互作用残基(“杵臼结构”);直接融合TCR-α和 TCR-β链可变结构域至CD3ζ(CD3ζ融合)(Schmitt et al.2009)。
在一实施方案中,宿主细胞被改变结构以表达本说明书的TCR。在一优选实施方案中,宿主细胞为人T细胞或T细胞祖细胞。在一些实施方案中,T细胞或T细胞祖细胞从癌症患者中获得。在另一些实施方案中,T细胞或T细胞祖细胞从健康供体中获得。本说明书的宿主细胞相对于待治疗的患者可以为同种异体或自体的。在一实施方案中,宿主是被转化以表达α/βTCR的γ/δT细胞。
“药物组合物”是指适合在医疗机构用于人体的组合物。优选地,药物组合物为无菌状态,并根据GMP指南生产。
药物组合物包括游离形式或以一种药用盐形式存在的肽(也参见上文)。此处使用的“药用盐”系指所公开的肽的一种衍生物,其中该肽由制酸或药剂的碱盐进行改性。例如,用与适合的酸反应的游离碱(通常其中的中性药物有一个中性-NH2基团)制备酸式盐。适合制备酸盐的酸包括有机酸,如:乙酸、丙酸、羟基酸、丙酮酸、草酸、苹果酸、丙二酸、丁二酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸酸、肉桂酸、扁桃酸、甲磺酸、甲磺酸、苯磺酸、水杨酸等等、以及无机酸,如:盐酸、氢溴酸、硫酸、硝酸和磷酸等。相反,可在一种肽上提呈的酸性基团的碱盐制剂使用药用碱基进行制备,如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙、三甲胺等等。
在特别优选的实施方案中,药物组合物包括乙酸(醋酸盐),三氟乙酸盐或盐酸(氯化物)形式的肽。
本发明中所述的药剂优选为一种免疫治疗药剂,例如,一种疫苗。该疫苗可直接给到患者的受影响器官,也可id、im、sc、ip和iv注射方式全身给药,或体外应用到来自患者或其细胞株的细胞(随后再将这些细胞注入到患者中),或体外用于从来自患者的免疫细胞的一个细胞亚群(然后再将细胞重新给予患者)。如果核酸体外注入细胞,可能有益于细胞转染,以共同表达免疫刺激细胞因子(如白细胞介素-2)。肽可完全单独给药,也可与免疫刺激佐剂相结合(见下文)、或与免疫刺激细胞因子联合使用、或以适当的输送系统给药(例如脂质体)。该肽也可共轭形成一种合适的载体(如钥孔虫戚血蓝蛋白(KLH)或甘露)到合适的载体(参阅WO 95/18145及(Longenecker et al.,1993))。肽也可能被标记,可能是融合蛋白,或可能是杂交分子。在本发明中给出序列的肽预计能刺激CD4 或CD8 T细胞。然而,在有CD4T-辅助细胞的帮助时,CD8 T细胞刺激更加有效。因此,对于刺激CD8 T细胞的MHC-I类表位,一种杂合分子的融合伙伴或片段提供了刺激 CD4阳性T细胞的适当表位。CD4-和CD8刺激表位为本领域所熟知、并包括本发明中确定的表位。
一方面,疫苗包括至少含有SEQ ID NO:1至SEQ ID NO:387和SEQ ID NO.463至SEQID NO.464中提出的一种肽以及至少另外一种肽,优选为2至50个、更优选为2至25 个、再优选为2至20个、最优选为2、3、4、5、6、7、8、9、10、11、12、13、14、 15、16、17或18个肽。肽可能从一个或多个特定TAA中衍生,并且可能与MHC I类分子结合。
另一方面,本发明提出了一种编码本发明中肽或肽变体的核酸(如多聚核苷酸)。多聚核苷酸可能为,例如,DNA、cDNA、PNA、RNA或其组合物,它们可为单链和/或双链、或多聚核苷酸的原生或稳定形式(如:具有硫代磷酸骨架的多聚核苷酸),并且只要它编码肽,就可能包含也可能不包含内含子。当然,多聚核苷酸只能编码加入天然肽键并含有天然氨基酸残基的肽。另一个方面,本发明提出了一种可根据本发明表达多肽的表达载体。
对于连接多核苷酸,已经开发出多种方法,尤其是针对DNA,可透过向载体补充可连接性末端等方法进行连接。例如,可向DNA片段加入补充性均聚物轨道,之后DNA片段被插入到载体DNA。然后,透过补充性均聚物尾巴的氢键结合,将载体和DNA片段结合,从而形成重组DNA分子。
含有一个或多个酶切位点的合成接头为DNA片段与载体连接提供了另一种方法。含各种限制性核酸内切酶的合成接头可透过多种管道购得,其中包括从国际生物技术公司(International Biotechnologies Inc,New Haven,CN,美国)购得。
编码本发明多肽的DNA理想修饰方法是使用Saiki等人(Saiki et al.,1988)所采用的聚合酶链反应方法。此方法可用于将DNA引入合适的载体(例如,透过设计合适的酶切位点),也可用于本领域已知的其他有用方法修饰DNA。如果使用病毒载体,痘病毒载体或腺病毒载体为优选。
之后,DNA(或在逆转录病毒载体情况下,RNA)可能表达于合适的宿主,从而制成含本发明肽或变体的多肽。因此,可根据已知技术使用编码本发明肽或变体的DNA,用本文所述方法适当修饰后,构建表达载体,然后表达载体用于转化合适宿主细胞,从而表达和产生本发明中的多肽。此类技术包括那些公开于,例如,美国专利4,440,859、 4,530,901、4,582,800、4,677,063、4,678,751、4,704,362、4,710,463、4,757,006、 4,766,075和4,810,648。
编码含本发明化合物多肽的DNA(或在逆转录病毒载体情况下,RNA)可能被加入到其他多种DNA序列,从而引入到合适的宿主中。同伴DNA将取决于宿主的性质、DNA引入宿主的方式、以及是否需要保持为游离体还是要相互结合。
一般来说,DNA可以适当的方向和正确的表达阅读框架附着到一种表达载体(如质粒) 中。如有必要,该DNA可能与所需宿主所识别的相应转录和翻译调节控制核苷酸序列连接,尽管表达载体中一般存在此类控制功能。然后,该载体透过标准方法被引入宿主。一般来说,并不是所有的宿主都会被载体转化。因此,有必要选择转化过的宿主细胞。选择方法包括用任何必要的控制元素向表达载体插入一个DNA序列,该序列对转化细胞中的可选择性属性(如抗生素耐药性)进行编码。
另外,有这种选择属性的基因可在另外一个载体上,该载体用来协同转化所需的宿主细胞。
然后,本发明中的重组DNA所转化的宿主细胞在本文中所述本领域技术人员熟悉的合适条件下培养足够长的时间,从而表达之后可回收的肽。
有许多已知的表达系统,包括细菌(如大肠杆菌和枯草芽孢杆菌)、酵母(如酵母菌)、丝状真菌(如曲霉菌)、植物细胞、动物细胞及昆虫细胞。该系统可优选为哺乳动物细胞,如来自ATCC细胞生物学库(Cell Biology Collection)中的CHO细胞。
典型的哺乳动物细胞组成型表达载体质粒包括CMV或含一个合适的多聚A尾巴的SV40 启动子以及抗性标志物(如新霉素)。一个实例为从Pharmacia公司(Piscataway,新泽西,美国)获得的pSVL。一种可诱导型哺乳动物表达载体的例子是pMSG,也可以从Pharmacia公司获得。有用的酵母质粒载体是pRS403-406和pRS413-416,一般可从Stratagene Cloning Systems公司(La Jolla,加州92037,美国)获得。质粒pRS403、pRS404、pRS405和pRS406是酵母整合型质粒(Ylp),并插入了酵母可选择性标记物 HIS3、TRP1、LEU2和URA3。pRS413-416质粒为酵母着丝粒质粒(Ycp)。基于CMV 启动子的载体(如,来自于Sigma-Aldrich公司)提供了暂态或稳定的表达、胞浆表达或分泌,以及FLAG、3xFLAG、c-myc或MATN不同组合物中的N-端或C-端标记。这些融合蛋白可用于检测、纯化及分析重组蛋白。双标融合为检测提供了灵活性。
强劲的人巨细胞病毒(CMV)启动子调控区使得COS细胞中的组成蛋白表达水平高达1 mg/L。对于较弱的细胞株,蛋白水平一般低于0.1mg/L。SV40复制原点的出现将导致DNA在SV40复制容纳性COS细胞中高水平复制。例如,CMV载体可包含细菌细胞中的pMB1(pBR322的衍生物)复制原点、细菌中进行氨苄青霉素抗性选育的钙-内醯胺酶基因、hGHpolyA和f1的原点。含前胰岛素原引导(PPT)序列的载体可使用抗FLAG 抗体、树脂和板引导FLAG融合蛋白分泌到进行纯化的培养基中。其他与各种宿主细胞一起应用的载体和表达系统是本领域熟知众所周知的。
在另一个实施方案中,对本发明的两个或更多的肽或肽变体进行编码,因此,以一个连续顺序(类似于“一串珠子”的构建体)表达。在达到目标,所述肽或肽变体可能透过连接子氨基酸的延伸处(例如LLLLLL)连接或融合一起,也可能它们之间没有任何附加的肽而被连接。这些构建体也可用于癌症治疗,可诱导涉及MHC I和MHC II类分子的免疫应答。
本发明还涉及一种宿主细胞,其以本发明的多核苷酸载体构建转化而来。宿主细胞可为原核细胞,也可为真核细胞。在有些情况下,细菌细胞为优选原核宿主细胞,典型为大肠杆菌株,例如,大肠杆菌菌株DH5(从Bethesda Research Laboratories公司(Bethesda,马里兰州,美国)获得)和RR1(从美国菌种保藏中心(ATCC,Rockville,马里兰州,美国),ATCC编号31343获得)。首选的真核宿主细胞包括酵母、昆虫和哺乳动物细胞,优选为脊椎动物细胞,如:小鼠、大鼠、猴子或人成纤维细胞和结肠癌细胞株中的细胞。酵母宿主细胞包括YPH499、YPH500和YPH501,一般可从Stratagene Cloning Systems公司(LaJolla,CA 92037,美国)获得。首选哺乳动物宿主细胞包括中国仓鼠卵巢(CHO)细胞为ATCC中的CCL61细胞、NIH瑞士小鼠胚胎细胞NIH/3T3为ATCC中的CRL 1658细胞、猴肾源性COS-1细胞为ATCC中的CRL 1650细胞以及人胚胎肾细胞的293号细胞。首选昆虫细胞为Sf9细胞,可用杆状病毒表达载体转染。有关针对表达选择合适宿主细胞的概要,可从教科书(Paulina Balbás and Argelia Lorence《Methods in Molecular Biology RecombinantGene Expression,Reviews and Protocols》Part One, Second Edition,ISBN 978-1-58829-262-9)和技术人员知道的其他文献中查到。
含本发明DNA结构的适当宿主细胞的转化可使用大家熟知的方法完成,通常取决于使用载体的类型。关于原核宿主细胞的转化,请参见,例如,Cohen等人的文献(Cohen etal.,1972)和(Green and Sambrook,2012)。酵母细胞的转化在Sherman等人的文章(Sherman et al.,1986)中进行了描述。Beggs(Beggs,1978)中所述的方法也很有用。对于脊椎动物细胞,转染这些细胞的试剂等,例如,磷酸钙和DEAE-葡聚糖或脂质体配方,可从Stratagene Cloning Systems公司或Life Technologies公司(Gaithersburg,马里兰州20877,美国)获得。电穿孔也可用于转化和/或转染细胞,是本领域用于转化酵母细胞、细菌细胞、昆虫细胞和脊椎动物细胞大家熟知的方法。
被成功转化的细胞(即含本发明DNA结构的细胞)可用大家熟知的方法(如PCR)进行识别。另外,上清液存在的蛋白可使用抗体进行检测。
应了解,本发明中的某些宿主细胞用于制备本发明中的肽,例如细菌细胞、酵母细胞和昆虫细胞。但是,其他宿主细胞可能对某些治疗方法有用。例如,抗原提呈细胞(如树突状细胞)可用于表达本发明中的肽,使它们可以加载入相应的MHC分子中。因此,本发明提出了含本发明中核酸或表达载体的一种宿主细胞。
在一个优选实施方案中,宿主细胞为抗原提呈细胞,尤其是树突状细胞或抗原提呈细胞。 2010年4月29日,美国食品和药物管理局(FDA)批准载有含前列腺酸性磷酸酶(PAP)的重组融合蛋白可用于治疗无症状或症状轻微的转移性HRPC(Rini et al.,2006;Small et al.,2006)。
另一方面,本发明提出了一种配制一种肽及其变体的方法,该方法包括培养宿主细胞和从宿主细胞或其培养基中分离肽。
在另一个实施方案中,本发明中的肽、核酸或表达载体用于药物中。例如,肽或其变体可制备为静脉(i.v)注射剂、皮下(s.c.)注射剂、皮内(i.d.)注射剂、腹膜内(i.p.)注射剂、肌肉(i.m.)注射剂。肽注射的优选方法包括s.c.、i.d.、i.p.、i.m.和i.v注射。DNA注射的优选方法为i.d.、i.m.、s.c.、i.p.和i.v注射。例如,给予50μg至1.5mg,优选为 125μg至500μg的肽或DNA,这取决于具体的肽或DNA。上述剂量范围在以前的试验中成功使用(Walter et al.,2012)。
用于主动免疫接种的多聚核苷酸可为基本纯化形式,也可包被于载体或输送系统。核酸可能为DNA、cDNA、PNA、RNA,也可能为其组合物。这种核酸的设计和引入方法为本领域所熟知。例如,文献中有其概述(Teufel et al.,2005)。多核苷酸疫苗很容易制备,但这些载体诱导免疫反应的作用模式尚未完全了解。合适的载体和输送系统包括病毒DNA和/或RNA,如基于腺病毒、牛痘病毒、逆转录病毒、疱疹病毒、腺相关病毒或含一种以上病毒元素的混合病毒的系统。非病毒输送系统包括阳离子脂质体和阳离子聚合物,是 DNA输送所属领域内熟知的系统。也可使用物理输送系统,如透过“基因枪”。肽或核酸编码的肽可以是一种融合蛋白,例如,含刺激T细胞进行上述CDR的表位。
本发明的药剂也可能包括一种或多种佐剂。佐剂是那些非特异性地增强或加强免疫反应的物质(例如,透过CD8-阳性T细胞和辅助T(TH)细胞介导的对一种抗原的免疫应答,因此被视为对本发明的药剂有用。适合的佐剂包括(但不仅限于)1018ISS、铝盐、
据报告,CpG免疫刺激寡核苷酸可提高佐剂在疫苗中的作用。如果没有理论的约束, CpG寡核苷酸可透过Toll样受体(TLR)(主要为TLR9)启动先天(非适应性)免疫系统从而起作用。CpG引发的TLR9活化作用提高了对各种抗原的抗原特异性体液和细胞反应,这些抗原包括肽或蛋白抗原、活病毒或被杀死的病毒、树突状细胞疫苗、自体细胞疫苗以及预防性和治疗性疫苗中的多糖结合物。更重要的是,它会增强树突状细胞的成熟和分化,导致TH1细胞的活化增强以及细胞毒性T淋巴细胞(CTL)生成加强,甚至CD4 T细胞说明的缺失。甚至有疫苗佐剂的存在也能维持TLR9活化作用诱发的TH1偏移,这些佐剂如:正常促进TH2偏移的明矾或弗氏不完全佐剂(IFA)。CpG寡核苷酸与以下其他佐剂或配方一起制备或联合给药时,表现出更强的佐剂活性,如微粒、纳米粒子、脂肪乳或类似制剂,当抗原相对较弱时,这些对诱发强反应尤为必要。它们还能加速免疫反应,使抗原剂量减少约两个数量级,在有些实验中,对不含CpG的全剂量疫苗也能产生类似的抗体反应(Krieg,2006)。美国7726705 B1号专利对CpG寡核苷酸、非核酸佐剂和抗原结合使用促使抗原特异性免疫反应进行了描述。一种CpG TLR9拮抗剂为 Mologen公司(德国柏林)的dSLIM(双干环免疫调节剂),这是本发明药物组合物的优选成分。也可使用其他如TLR结合分子,如:RNA结合TLR7、TLR8和/或TLR9。
其他有用的佐剂例子包括(但不限于)化学修饰性CpG(如CpR、Idera)、dsRNA模拟物,如,Poly(I:C)及其衍生物(如:AmpliGen、Hiltonol、多聚-(ICLC)、多聚(IC- R)、多聚(I:C12U))、非CpG细菌性DNA或RNA以及免疫活性小分子和抗体,如:环磷醯胺、舒尼替单抗、
首选佐剂是抗-CD40、咪喹莫特、瑞喹莫德、GM-CSF、环磷醯胺、舒尼替尼、贝伐单抗、干扰素α、CpG寡核苷酸及衍生物、多聚(I:C)及衍生物、RNA、西地那非和PLG或病毒颗粒的微粒制剂。
本发明药物组合物的一个优选实施方案中,佐剂从含集落刺激因子制剂中选择,如粒细胞巨噬细胞集落刺激因子(GM-CSF,沙格司亭)、环磷醯胺、咪喹莫特、resiquimod和干扰素-α。
本发明药物组合物的一个优选实施方案中,佐剂从含集落刺激因子制剂中选择,如粒细胞巨噬细胞集落刺激因子(GM-CSF,沙格司亭)、环磷醯胺、咪喹莫特和resimiquimod。在本发明药物组合物的一个优选实施方案中,佐剂为环磷醯胺、咪喹莫特或resiquimod。更优选的佐剂是Montanide IMS 1312、Montanide ISA 206、Montanide ISA50V、Montanide ISA-51、聚-ICLC
此组合药物为非肠道注射使用,如皮下、皮内、肌肉注射,也可口服。为此,肽和其他选择性分子在药用载体中分解或悬浮,优选为水载体。此外,组合物可包含辅料,如:缓冲剂、结合剂、冲击剂、稀释剂、香料、润滑剂等。这些肽也可与免疫刺激物质合用,如:细胞因子。可用于此类组合物的更多辅料可在从A.Kibbe所著的Handbook of PharmaceuticalExcipients(Kibbe,2000)等书中获知。此组合药物可用于阻止、预防和/ 或治疗腺瘤或癌性疾病。例如,EP2112253中有示例制剂。
重要的是要认识到,透过本发明的疫苗引发的免疫应答在不同的细胞阶段和开发的不同阶段攻击癌症。而且不同的癌症相关信号通路被攻击。这相对于其他疫苗的优势,这些疫苗只针对一个或几个靶标,这可能会导致肿瘤很容易适应于攻击(肿瘤逃逸)。此外,并非所有的个体肿瘤都表达相同模式的抗原。因此,几个肿瘤相关肽的组合确保了每个肿瘤都承担至少一些靶标。该组合物以这样的方式设计,预期每个肿瘤可表达几种抗原并覆盖肿瘤生长和维持所需要的几种独立的途径。因此,疫苗可易于“现成的”用于较大患者群体。这意味着,预选择接受疫苗治疗的患者可限制为HLA分型,无需抗原表达的任何额外的生物标志物评估,但仍然确保多个靶标同时被诱导的免疫应答攻击,这对于疗效很重要(Banchereau et al.,2001;Walter et al.,2012)。
本文所用的“支架”一词是指与(如抗原)决定因子特异性结合的分子。在一项实施方案中,支架是能够引导其所连接的实体(例如,(第二)抗原结合部分)至目标靶点,例如,至特定类型的肿瘤细胞或承载抗原决定簇的肿瘤基质(如根据目前申请中肽和MHC 的复合体)。在另一项实施例中,支架能够透过其靶抗原(例如T细胞受体复合体抗原)启动信号通路。支架包括但不限于抗体及其片段,抗体的抗原结合区,其包含抗体重链可变区和抗体轻链可变区,结合的蛋白包括至少一个锚蛋白重复序列基元和单域抗原结合(SDAB)分子、适体、(可溶)TCR和(经修饰的)细胞,例如同种异体或自体T细胞。为了评估某个分子是否是结合至靶点的支架,可进行结合测定。
“特定”结合系指,与其他天然肽-MHC复合体相比,该支架与感兴趣的肽-MHC复合体更好地结合,结合程度为,拥有能够杀死承载特定靶点细胞的活性分子的支架不能够杀死无特定靶点但提呈一个或多个其他肽-MHC复合体的另一细胞。如果交叉反应性肽-MHC的肽并不是天然的,即,并非来自人HLA-多肽组,则结合至其他肽-MHC复合体是无关紧要的。评估靶细胞杀伤的测试在本领域中是公知的。它们应该含有未改变的肽-MHC提呈的靶细胞(原发细胞或细胞系)或载有肽的细胞进行,以便达到天然肽-MHC的水平。
各支架可包括一个标记,其透过确定是否存在或不存在标签所提供的信号可检测到结合支架。例如,该支架可用萤光染料或任何其他适用的细胞标记分子进行标记。此类标记分子是本领域中公知的。例如,透过萤光染料进行的萤光标记可透过萤光或镭射扫描显微术或流式细胞术提供结合适体的视觉化。
各支架可与第二个活性分子(例如IL-21、抗CD3、抗CD28)共轭。
关于多肽支架的进一步资讯,可参阅,例如,在WO 2014/071978A1背景技术部分,并作为参考文献引用。
本发明还涉及适体。适体(例如,参见WO 2014/191359及其中引用的文献)是短的单链核酸分子,其可以折叠为所定义的三维结构并识别特定的靶标结构。它们似乎是开发靶向治疗的合适替代方法。适体已显示可选择性与具有高亲和力和特异性的复合体靶标相结合。
识别细胞表面分子的适体在过去十年内已经确定,并为开发诊断和治疗方法提供了手段。由于适体已显示几乎无毒性和免疫原性,因此,它们是生物医学应用中有前景的候选物质。事实上适体,例如前列腺特异性膜抗原识别适体,已被成功地用于靶向治疗并在体内模型的异种移植物中显示出功能。此外,认识到特定肿瘤细胞系的适体也已确定。
可选择DNA适体来揭示各种癌细胞的广谱识别属性,特别是那些来自于实体瘤的细胞,而非致瘤和主要健康细胞不被识别。如果所识别的适体不仅识别肿瘤特异性子类型,而且与一系列肿瘤相互作用,这使适体适用于作为所谓的广谱诊断和治疗手段。
此外,用流式细胞仪对细胞结合行为的研究显示,适体在纳摩尔范围内显示出很好的亲和力。
适体用于诊断和治疗目的。此外,也可能显示,一些适体被肿瘤细胞吸取,因而可作为抗癌剂靶向递送的分子赋形剂,例如siRNA进入肿瘤细胞。
可选择适体针对复合体的靶标,如细胞和组织以及包含、优选包括根据任何SEQID NO 1至SEQ ID NO 387和SEQ ID No.463至SEQ ID No.464的一个序列、根据目前发明的肽复合体与MHC分子,使用细胞SELEX(透过指数富集的配体系统进化)技术。
本发明中的肽可用于生成和开发出针对MHC/肽复合物的特定抗体。这些抗体可用于治疗,将毒素或放射性物质靶向病变组织。这些抗体的另一用途是为了成像之目的(如PET)将放射性核素靶向病变组织。这可有助于检测小转移灶或确定病变组织的大小和准确位置。
因此,本发明的另一方面是提出产生特异性结合至与HLA限制性抗原络合的I或II类人主要组织相容性复合体(MHC)的一种重组抗体的方法,该方法包括:用可溶形式的与HLA 限制性抗原(优选为根据本发明的肽)络合的(MHC)I或II类分子对包含表达所述主要组织相容性说复合体(MHC)I或II类的基因工程非人哺乳动物进行免疫;将mRNA分子与产生所述非人哺乳动物细胞的抗体分离;产生一个噬菌体显示库,显示由所述mRNA分子编码的蛋白分子;以及将至少一个噬菌体与所述噬菌体显示库分离,所述的至少一个噬菌体显示所述抗体特异性地结合至与HLA限制性抗原络合的所述人主要组织相容性说复合体(MHC)I或II类。
因此,本发明的另一方面提出一种抗体,其特异性结合至与一种HLA限制性抗原络合的I 或II类人主要组织相容性说复合体(MHC),其中该抗体优选为多克隆抗体、单克隆抗体、双特异性抗体和/或嵌合抗体。
产生这种抗体和单链I类主要组织相容性复合物的相应方法,以及产生这些抗体的其他工具在WO 03/068201、WO 2004/084798、WO 01/72768、WO 03/070752以及出版物(Cohen et al.,2003a;Cohen et al.,2003b;Denkberg et al.,2003)中进行了披露,为了本发明之目的,所有参考文献透过引用被完整地并入本文。
优选地,该抗体与复合体的结合亲和力低于20纳摩尔,优选为低于10纳摩尔,这在本发明情况下也被视为具有“特异性”。
本发明涉及一种肽,包含选自SEQ ID NO:1至SEQ ID NO:387和SEQ ID NO.463至SEQ ID NO.464组成的组的一个序列或该序列的与SEQ ID NO:1至SEQ ID NO:387和 SEQID NO.463至SEQ ID NO.464具有88%同源性(优选为相同)的一种变体,或诱导与所述变异肽发生T细胞交叉反应的一种变体,其中,所述肽不是基本的全长多肽。
本发明进一步涉及一种肽,包含选自SEQ ID NO:1至SEQ ID NO:387和SEQ ID NO.463至SEQ ID NO.464组成的组的一个序列、或与SEQ ID NO:1至SEQ ID NO:387和 SEQ IDNO.463至SEQ ID NO.464具有至少88%同源性(优选为相同)的一种变体,其中所述肽或变体的总长度为8至100个、优选为8至30个、最优选为8至14个氨基酸。
本发明进一步涉及本发明的肽,其具有与主要组织相容性复合体(MHC)I或II类分子结合的能力。
本发明进一步涉及本发明中的肽,其中肽系由或基本系由根据SEQ ID NO:1至SEQID NO:387和SEQ ID NO.463至SEQ ID NO.464的一个氨基酸序列组成。
本发明进一步涉及本发明的肽,其中该肽(在化学上)被修饰和/或包含非肽键。
本发明进一步涉及本发明的肽,其中该肽为融合蛋白的一部分,特别包括HLA-DR抗原相关不变链(li)的N-端氨基酸,或其中该肽与一种抗体(例如,树突状细胞特定抗体)融合。
本发明进一步涉及一种核酸,其编码本发明所述肽,前提是该肽并非完整(完全)的人蛋白。
本发明进一步涉及一种本发明的核酸,为DNA、cDNA、PNA、RNA,也可能为其组合物。
本发明进一步涉及一种能表达本发明核酸的表达载体。
本发明进一步涉及本发明的一种肽、本发明的一种核酸或本发明的一种药用表达载体,特别是用于治疗急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌。
本发明进一步涉及含本发明核酸或本发明表达载体的一种宿主细胞。
本发明进一步涉及本发明的宿主细胞,其为抗原提呈细胞,优选为树突细胞。
本发明进一步涉及配制本发明一种肽的一种方法,所述方法包括培养本发明的宿主细胞和从所述宿主细胞或其培养基中分离肽。
本发明进一步涉及本发明中的方法,其中抗原透过与足够量的含抗原提成细胞的抗原结合被载入表达于合适抗原提呈细胞表面的I或II类MHC分子。
本发明进一步涉及本发明的方法,其中该抗原提呈细胞包括一个表达载体,该载体有能力表达含SEQ ID NO:1至SEQ ID NO:387和SEQ ID NO.463至SEQ ID NO.464的肽或所述变体氨基酸序列。
本发明进一步涉及以本发明方法制造的启动T细胞,其中所述T细胞有选择性地识别一种细胞,该细胞异常表达含一种本发明氨基酸序列的多肽。
本发明进一步涉及一种杀伤患者靶细胞的方法,其中患者的靶细胞异常表达含本发明任何氨基酸序列的多肽,该方法包括给予患者本发明的有效量T细胞。
本发明进一步涉及任何所述肽、本发明的一种核酸、本发明的一种表达载体、本发明的一种细胞、本发明一种作为药剂或制造药剂的启动细胞毒性T淋巴细胞的用途。本发明进一步涉及一种本发明的用途,其中药剂可有效抗癌。
本发明进一步涉及一种本发明的用途,其中该药剂为一种疫苗。本发明进一步涉及一种本发明的用途,其中药剂可有效抗癌。
本发明进一步涉及根据本发明的用途,其中所述癌细胞为急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌细胞或其他实体或血液肿瘤细胞,如:急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌。
本发明进一步涉及一种基于本发明肽的特定标志物蛋白和生物标志物,在此称为“靶标”,其可用于诊断和/或判断急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌的预后。本发明还涉及这些供癌症治疗使用的新靶点。
本文中术语“抗体”为广义上的定义,既包括多克隆也包括单克隆抗体。除了完整或“全”免疫球蛋白分子,“抗体”这一术语还包括这些免疫球蛋白分子和人源化免疫球蛋白分子的片段(如,CDR、Fv、Fab和Fc片段)或聚合物,只要它们表现出本发明的任何期望属性(例如,急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌标志物(多)肽的特异性结合、将毒素传递给癌症标志物基因表达水平增加的急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌细胞和/或抑制急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌标志物多肽的活性)。
只要有可能,本发明的抗体可从商业来源购买。本发明的抗体也可能使用已知的方法制得。技术人员会了解全长急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌标志物多肽或其片段可用于制备本发明的抗体。用于产生本发明抗体的多肽可部分或全部地由天然源经纯化而得,也可利用重组DNA技术生产。
例如,本发明的编码肽的cDNA,例如,该肽为根据SEQ ID NO:1至SEQ ID NO:387和SEQ ID NO.463至SEQ ID NO.464多肽的肽,或其中一个变体或片段,可在原核细胞中(如:细菌)或真核细胞(如:酵母、昆虫或哺乳动物细胞)中表达,之后,可纯化重组蛋白,并用于产生一种特异性结合用于产生本发明抗体的急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌标志物多肽的单克隆或多克隆抗体制剂。
本领域的技术人员会认识到,两种或两种以上不同集合的单克隆抗体或多克隆抗体能最大限度地增加获得一种含预期用途所需的特异性和亲和力(例如,ELISA法、免疫组织化学、体内成像、免疫毒素疗法)的抗体的可能性。根据抗体的用途,用已知的方法对其期望活性进行测试(例如,ELISA法、免疫组织化学、免疫治疗等;要获取产生和测试抗体的进一步指导,请参阅,例如,Greenfield,2014(Greenfield,2014))。例如,该抗体可用ELISA法或免疫印迹法、免疫组织化学染色福马林固定的癌组织或冰冻的组织切片进行检测。在初次体外表征后,用于治疗或体内诊断用途的抗体根据已知的临床测试方法进行检测。
此处使用的术语“单克隆抗体”系指从大量同质抗体中获得的一种抗体,即,由相同的抗体组成的抗体群,但可能少量提呈的自然突变除外。此处所述的单克隆抗体具体包括“嵌合”抗体,其中一部分重链和/或轻链与从特定物种中获得的抗体或属于特定抗体类型和分类型抗体的相应序列相同(同质),同时,剩余链与从其他物种中获得的抗体或属于特定抗体类型和子类型抗体的相应序列以及这些抗体的片段相同(同质),只要它们表现出预期的拮抗活性(美国4816567号专利,其在此以其整体并入)。
本发明的单克隆抗体可能使用杂交瘤方法制得。在杂交瘤方法中,老鼠或其他适当的宿主动物,通常用免疫制剂以引发产生或能产生将特异性结合至免疫制剂的抗体。或者,淋巴细胞可在体外进行免疫。
单克隆抗体也可由DNA重组方法制得,如:美国4816567号专利所述。编码本发明单克隆抗体的DNA可很容易地使用传统程序进行分离和测序(例如:透过使用能与编码鼠抗体重链和轻链的基因特异性结合的寡核苷酸探针)。
体外方法也适用于制备单价抗体。抗体消化以产生抗体的片段,尤其是Fab片段,可以透过使用本领域已知的常规技术完成。例如,可以透过使用木瓜蛋白酶完成消化。木瓜蛋白酶消化的实施例在WO 94/29348和美国4342566号专利中有描述。抗体的木瓜蛋白酶消化通常产生两种相同的抗原结合性片段,称为Fab片段(每个片段都有一个抗原结合点)和残余Fc片段。胃蛋白酶处理产生一个F(ab′)2片段和一个pFc′片段。
抗体片段,不论其是否附着于其他序列,均可包括特定区域或特定氨基酸残基的插入、删除、替换、或其他选择性修饰,但前提是,片段的活性与非修饰的抗体或抗体片段相比没有显著的改变或损害。这些修饰可提供一些额外的属性,如:删除/添加可与二硫键结合的氨基酸,以增加其生物寿命、改变其分泌特性等。在任何情况下,抗体片段必须拥有生物活性的特性,如:结合活性、调节结合域的结合力等。抗体的功能性或活性区域可透过蛋白特定区域的基因突变、随后表达和测试所表达的多肽进行确定。这些方法为本行业技术人员所熟知,可包括编码抗体片段的核酸的特定位点基因突变。
本发明的抗体可进一步包括人源化抗体或人抗体。非人(如:鼠)抗体的人源化形式为嵌合抗体免疫球蛋白、免疫球蛋白链或其片段(如:Fv、Fab、Fab′或抗体的其他抗原结合序列),其中包含从非人免疫球蛋白中获得的最小序列。人源化抗体包括人免疫球蛋白(受体抗体),其中来自受体互补决定区(CDR)的残基被来自非人物种(供体抗体) (如具有与其特异性、亲和力和能力的小鼠、大鼠或兔子)CDR的残基取代。在某些情况下,人类免疫球蛋白的Fv框架(FR)残基被相应的非人残基取代。人源化抗体可能还包括既非受体抗体、也非输入CDR或框架序列中发现的残基。一般来说,人源化抗体将包括几乎所有的至少一个、通常为二个可变域,其中,全部或几乎全部的CDR区域均对应于非人免疫球蛋白的区域并且全部或几乎全部的FR区域均为人免疫球蛋白相同序列的区域。理想情况是,人源化抗体还将包括至少免疫球蛋白恒定区(Fc)的一部分,通常是人免疫球蛋白的恒定区的一部分。
人源化非人抗体的方法为本行业所熟知。一般来说,人源化抗体具有一个或多个从非人源头引入的氨基酸残基。这些非人氨基酸残基往往被称为“输入”残基,通常从“输入”可变域中获得。人源化基本上可以透过将啮齿动物CDR或CDR序列取代为相应的人抗体序列而完成。因此,这种“人源化”抗体为嵌合抗体(美国4816567号专利),其中大大少于完整的人可变域被来自于非人物种的相应序列取代。在实践中,人源化抗体通常为人抗体,其中有些CDR残基以及可能的一些FR残基被来自啮齿动物抗体中的类似位点的残基取代。
可使用免疫后在内源性免疫球蛋白产生缺失时能产生完整人抗体的转基因动物(如:小鼠)。例如,它被描述为,嵌合和种系突变小鼠中的抗体重链连接区域基因的纯合性缺失导致内源性抗体生成的完全抑制。在此种系变种小鼠中人种系免疫球蛋白基因阵列的转移在抗原挑战后将导致人抗体的生成。人抗体也可在噬菌体展示库中产生。
本发明的抗体优选为透过药用载体的形式给予受试者。通常,在制剂中使用适量的药用盐,以使制剂等渗。药用载体的例子包括生理盐水、林格氏液和葡萄糖溶液。溶液的pH 值优选为约5至8,更优选为约7至7.5。此外,载体还包括缓释制剂,如:含有抗体的固体疏水性聚合物半透性基质,其中基质为有形物品形式,如:薄膜、脂质体或微粒。本行业的技术人员熟知,某些载体可能为更优选,取决于例如,抗体的给药途径和浓度。
该抗体可透过注射(如:静脉内、腹腔内、皮下、肌肉内)或透过输注等其他方法给予受试者、患者或细胞,确保其以有效的形式传输到血液中。这些抗体也可以透过瘤内或瘤周途径给予,从而发挥局部和全身的治疗作用。局部或静脉注射为优选。
抗体给药的有效剂量和时间表可根据经验确定,并且作出此类决定属本行业的技术范围内。本行业的技术人员会明白,必须给予的抗体剂量根据以下因素会有所不同,例如:接受抗体的受试者、给药途径、使用的抗体以及其他正在使用的药物的特定类型。单独使用的抗体的通常日剂量可能为约1μg/kg至最多100mg/kg体重或更多,这取决于上述因素。给予抗体,优选为急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌后,治疗抗体的疗效可透过技术人员熟知的不同方法评估。例如:接受治疗的受试者癌症的大小、数量和/或分布可使用标准肿瘤成像技术进行监测。因治疗而给予的抗体与不给予抗体时的病程相比,可阻止肿瘤生长、导致肿瘤缩小、和/或阻止新肿瘤的发展,这样的抗体是一种有效治疗癌症的抗体。
本发明的另一方面提出了制备识别特异性肽-MHC复合物的可溶性T细胞受体(sTCR)的一种方法。这种可溶性T细胞受体可从特异性T细胞克隆中产生,并且它们的亲和力可以透过互补决定区靶向诱变而增加。为了T细胞受体选择之目的,可以使用噬菌体展示(美国2010/0113300,(Liddy et al.,2012))。为了在噬菌体展示期间以及实际使用为药物时稳定T细胞受体之目的,可透过非天然二硫键、其他共价键(单链T细胞受体)或透过二聚化结构域连接α和β链(Boulter et al.,2003;Card et al.,2004;Willcox et al.,1999)。T细胞受体可以连接到毒素、药物、细胞因子(参见US 2013/0115191)、域招募效应细胞,如抗CD3域等,以便对靶细胞执行特定的功能。此外,它可能表达于用于过继转移的T细胞。进一步的资讯可在WO 2004/033685A1和WO 2004/074322A1中找到。sTCR的组合在WO2012/056407A1中进行了描述。WO 2013/057586A1中公开了制备的进一步的方法。
此外,可用本发明的肽和/或TCR或抗体或其他结合分子在活检样本的基础上验证病理师对癌症的诊断。
该抗体或TCR也可用于体内诊断实验。一般来说,抗体用放射性核素标记(如:
诊断用抗体可透过各种影像学方法使用适合检测的探针进行标记。探针检测方法包括但不限于,萤光、光、共聚焦和电镜方法;磁共振成像和光谱学技术;透视、电脑断层扫描和正电子发射断层扫描。合适的探针包括但不限于,萤光素、罗丹明、曙红及其它萤光团、放射性同位素、黄金、釓和其他稀土、顺磁铁、氟-18和其他正电子发射放射性核素。此外,探针可能是双功能或多功能的,并且用一种以上的上述方法可进行检测。这些抗体可用所述的探针直接或间接进行标记。抗体探针的连接,包括探针的共价连接、将探针融合入抗体、以及螯合化合物的共价连接从而结合探针、以及其他本行业熟知的方法。对于免疫组织化学方法,疾病组织样本可能是新鲜或冷冻或可能包埋于石蜡中以及用福马林等防腐剂固定。固定或包埋的切片包括与标记一抗和二抗接触的样本,其中该抗体用于检测原位蛋白的表达。
本发明的另一方面包括一种体外制备启动的T细胞的方法,该方法包括将T细胞与载有抗原的人MHC分子进行体外连接,这些分子在合适的抗原提呈细胞表面表达足够的一段时间从而以抗原特异性方式启动T细胞,其中所述抗原为根据本发明所述的一种肽。优选情况是足够量的抗原与抗原提呈细胞一同使用。
优选情况是,哺乳动物细胞的TAP肽转运载体缺乏或水平下降或功能降低。缺乏TAP肽转运载体的适合细胞包括T2、RMA-S和果蝇细胞。TAP是与抗原加工相关的转运载体。
人体肽载入的缺陷细胞株T2从属美国菌种保藏中心(ATCC,12301ParklawnDrive, Rockville,马里兰州20852,美国)目录号CRL1992;果蝇细胞株Schneider 2号株从属ATCC目录CRL 19863;小鼠RMA-S细胞株Ljunggren等人描述过(Ljunggren and Karre,1985)。
优选情况是,宿主细胞在转染前基本上不表达MHC I类分子。刺激因子细胞还优选为表达对T细胞共刺激信号起到重要作用的分子,如,B7.1、B7.2、ICAM-1和LFA 3中的任一种分子。大量MHC I类分子和共刺激分子的核酸序列可从GenBank和EMBL资料库中公开获得。
当MHC I类表位用作一种抗原时,T细胞为CD8阳性T细胞。
如果抗原提呈细胞受到转染而表达这种表位,则优选的细胞包括一个表达载体,该载体有能力表达含SEQ ID NO:1至SEQ ID NO:387和SEQ ID NO.463至SEQ ID NO.464的肽或变体氨基酸序列。
可使用其他一些方法来体外生成T细胞。例如,自体肿瘤浸润性淋巴细胞可用于生成 CTL。Plebanski等人在(Plebanski et al.,1995)使用自体外周血淋巴细胞(PLB)制得T细胞。另外,也可能用肽或多肽脉冲处理树突状细胞或透过与重组病毒感染而制成自体T细胞。此外,B细胞可用于制备自体T细胞。此外,用肽或多肽脉冲处理或用重组病毒感染的巨噬细胞可用于配制自体T细胞。S.Walter等人在(Walter et al.,2003)中描述了透过使用人工抗原提呈细胞(aAPC)体外启动T细胞,这也是生成作用于所选肽的T细胞的一种合适方法。在本发明中,根据生物素:链霉素生物化学方法透过将预制的MHC:肽复合物耦合到聚苯乙烯颗粒(微球)而生成aAPC。该系统实现了对aAPC上的MHC 密度进行精确调节,这使得可以在血液样本中选择地引发高或低亲合力的高效抗原特异性 T细胞反应。除了MHC:肽复合物外,aAPC还应携运含共刺激活性的其他蛋白,如耦合至表面的抗-CD28抗体。此外,此类基于aAPC的系统往往需要加入适当的可溶性因子,例如,诸如白细胞介素12的细胞因子。
也可用同种异体细胞制得T细胞,在WO 97/26328中详细描述了一种方法,以参考文献方式并入本文。例如,除了果蝇细胞和T2细胞,也可用其他细胞来提呈肽,如CHO细胞、杆状病毒感染的昆虫细胞、细菌、酵母、牛痘感染的靶细胞。此外,也可使用植物病毒(例如,参阅Porta等人在(Porta et al.,1994)中描述了将豇豆花叶病毒开发为一种提呈外来肽的高产系统。
被启动的T细胞直接针对本发明中的肽,有助于治疗。因此,本发明的另一方面提出了用本发明前述方法制得的启动T细胞。
按上述方法制成的启动T细胞将会有选择性地识别异常表达含SEQ ID NO:1至SEQID NO:387和SEQ ID NO.463至SEQ ID NO.464氨基酸序列的多肽。
优选情况是,T细胞透过与其含HLA/肽复合物的TCR相互作用(如,结合)而识别该细胞。T细胞是杀伤患者靶细胞方法中有用的细胞,其靶细胞异常表达含本发明中氨基酸序列的多肽。此类患者给予有效量的启动T细胞。给予患者的T细胞可能源自该患者,并按上述方法启动(即,它们为自体T细胞)。或者,T细胞不是源自该患者,而是来自另一个人。当然,优选情况是该供体为健康人。发明人使用“健康个人”系指一个人一般状况良好,优选为免疫系统合格,更优选为无任何可很容易测试或检测到的疾病。
根据本发明,CD8-阳性T细胞的体内靶细胞可为肿瘤细胞(有时表达MHC-II类抗原)和/ 或肿瘤周围的基质细胞(肿瘤细胞)(有时也表达MHC-II类抗原;(Dengjel et al.,2006))。
本发明所述的T细胞可用作治疗性组合物中的活性成分。因此,本发明也提出了一种杀伤患者靶细胞的方法,其中患者的靶细胞异常表达含本发明中氨基酸序列的多肽,该方法包括给予患者上述有效量的T细胞。
发明人所用的“异常表达”的意思还包括,与正常表达水平相比,多肽过量表达,或该基因在源自肿瘤的组织中不表达但在肿瘤中表达。“过量表达”系指多肽水平至少为正常组织中的1.2倍;优选为至少为正常组织中的2倍,更优选为至少5或10倍。
T细胞可用本领域已知的方法制得(如,上述方法)。
T细胞继转移方案为本领域所熟知的方案。综述可发现于:Gattioni et al.和Morgan et al. (Gattinoni et al.,2006;Morgan et al.,2006)。
本发明的另一个方面包括使用与MHC复合的肽,以生成T细胞受体,其核酸被克隆并被引入至宿主细胞,优选为T细胞。然后,该透过基因工程改变的T细胞可转给患者用于癌症治疗。
本发明的任一分子(即肽、核酸、抗体、表达载体、细胞,启动T细胞、T细胞受体或编码核酸)都有益于治疗疾病,其特点在于细胞逃避免疫反应的打击。因此,本发明的任一分子都可用作药剂或用于制造药剂。这种分子可单独使用也可与本发明中的其他分子或已知分子联合使用。
本发明还涉及一种套件,其包括:
(a)一个容器,包含上述溶液或冻干粉形式的药物组合物;
(b)可选的第二个容器,其含有冻干粉剂型的稀释剂或重组溶液;和
(c)可选的(i)溶液使用或(ii)重组和/或冻干制剂使用的说明。
该套件还步包括一个或多个(iii)缓冲剂,(iv)稀释剂,(v)过滤液,(vi)针,或(v)注射器。容器最好是瓶子、小瓶、注射器或试管,可以为多用途容器。药物组合物最好是冻干的。
本发明中的套件优选包含一种置于合适容器中的冻干制剂以及重组和/或使用说明。适当的容器包括,例如瓶子、西林瓶(如双室瓶)、注射器(如双室注射器)和试管。该容器可能由多种材料制成,如玻璃或塑胶。试剂盒和/或容器最好有容器或关于容器的说明书,指明重组和/或使用的方向。例如,标签可能表明冻干剂型将重组为上述肽浓度。该标签可进一步表明制剂用于皮下注射。
存放制剂的容器可使用多用途西林瓶,使得可重复给予(例如,2-6次)重组剂型。该套件可进一步包括装有合适稀释剂(如碳酸氢钠溶液)的第二个容器。
稀释液和冻干制剂混合后,重组制剂中的肽终浓度优选为至少0.15mg/mL/肽(=75μg),不超过3mg/mL/肽(=1500μg)。该套件还可包括商业和用户角度来说可取的其他材料,包括其他缓冲剂、稀释剂,过滤液、针头、注射器和带有使用说明书的包装插页。
本发明中的套件可能有一个单独的容器,其中包含本发明所述的药物组合物制剂,该制剂可有其他成分(例如,其他化合物或及其药物组合物),也可无其他成分,或者每种成分都有其不同容器。
优选情况是,本发明的套件包括与本发明的一种制剂,包装后与第二种化合物(如佐剂 (例如GM-CSF)、化疗药物、天然产品、激素或拮抗剂、抗血管生成剂或抑制剂、凋亡诱导剂或螯合剂)或其药物组合物联合使用。该套件的成分可进行预络合或每种成分在给予患者之前可放置于单独的不同容器。该套件的成分可以是一种或多种溶液,优选为水溶液,更优选为无菌水溶液。该套件的成分也可为固体形式,加入合适的溶剂后转换为液体,最好放置于另一个不同的容器中。
治疗套件的容器可能为西林瓶、试管、烧瓶、瓶子、注射器、或任何其他盛装固体或液体的工具。通常,当成分不只一种时,套件将包含第二个西林瓶或其他容器,使之可以单独定量。该套件还可能包含另一个装载药用液体的容器。优选情况是,治疗套件将包含一个设备(如,一个或多个针头、注射器、滴眼器、吸液管等),使得可注射本发明的药物 (本套件的组合物)。
本发明的药物配方适合以任何可接受的途径进行肽给药,如口服(肠道)、鼻内、眼内、皮下、皮内、肌内,静脉或经皮给药。优选为皮下给药,最优选为皮内给药,也可透过输液泵给药。
由于本发明的肽分离自急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌,因此,本发明的药剂优选用于治疗急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌。
本发明进一步涉及为个体患者制备个体化药物的一种方法,其中包括:制造含选自预筛选 TUMAP存储库至少一种肽的药物组合物,其中药物组合物中所用的至少一种肽选择为适合于个体患者。在一项实施方案中,药物组合物为一种疫苗。该方法也可以改动以产生下游应用的T细胞克隆物,如:TCR隔离物或可溶性抗体和其他治疗选择。
“个体化药物”系指专门针对个体患者的治疗,将仅用于该等个体患者,包括个体化活性癌症疫苗以及使用自体组织的过继细胞疗法。
如本文所述,“存储库”应指已经接受免疫原性预筛查和/或在特定肿瘤类型中过量提呈的一组或一系列肽。“存储库”一词并不暗示,疫苗中包括的特定肽已预先制造并储存于物理设备中,虽然预期有这种可能性。明确预期所述肽可以用于新制造每种个体化疫苗,也可能被预先制造和储存。存储库(例如,资料库形式)由肿瘤相关肽组成,其在各种HLA-A HLA-B和HLA-C等位元基因急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌患者的肿瘤组织中高度过度表达。其可能含有包括MHC I类和MHC II类肽或拉长的MHC I类肽。除了从几种急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌组织中采集的肿瘤相关肽外,存储库还可能包含HLA-A*02、HLA-A*01、HLA-A*03、HLA-A*24、 HLA-B*07、HLA-B*08和HLA-A*24B*44标记肽。这些肽可对TUMAP诱导的T细胞免疫进行量化比较,从而可得出疫苗抗肿瘤反应能力的重要结论。其次,在没有观察到来自患者“自身”抗原TUMAP的任何疫苗诱导的T细胞反应时,它们可作为来自“非自身”抗原的重要阳性对照肽。第三,它还可对患者的免疫功能状态得出结论。
存储库的TUMAP透过使用一种功能基因组学方法进行鉴定,该方法结合了基因表达分析、质谱法和T细胞免疫学
1.恶性材料的HLA配体用质谱法确定
2.使用全基因组信使核糖核酸(mRNA)表达分析法用于确定恶性肿瘤组织(急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌)与一系列正常器官和组织相比过度表达的基因。
3.确定的HLA配体与基因表达资料进行比较。肿瘤组织上过量表达或选择性提呈的肽,优选为第2步中检测到的选择性表达或过量表达基因所编码的考虑为多肽疫苗的合适候选TUMAP。
4.文献检索以确定更多证据以支持确认为TUMP的肽的相关性
5.过度表达在mRNA水平的相关性由肿瘤组织第3步选定的TUMAP重新检测而确定,并且在健康组织上缺乏(或不经常)检测。
6.为了评估透过选定的肽诱导体内T细胞反应是否可行,使用健康供体以及急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌患者的人T细胞进行体外免疫原性测定。
一方面,在将所述肽加入存储库之前,对其进行筛查以了解免疫原性。举例来说(但不限于此),纳入存储库的肽的免疫原性的确定方法包括体外T细胞启动,具体为:用装载肽 /MHC复合物和抗CD28抗体的人工抗原提呈细胞反复刺激来自健康供体的CD8+ T细胞。
这种方法优选用于罕见癌症以及有罕见表达谱的患者。与含目前开发为固定组分的多肽鸡尾酒相反的是,存储库可将肿瘤中抗原的实际表达于疫苗进行更高程度的匹配。在多目标方法中,每名患者将使用几种“现成”肽的选定单一肽或组合。理论上来说,基于从50抗原肽库中选择例如5种不同抗原肽的一种方法可提供大约170万种可能的药物产品(DP) 组分。
在一方面,选择所述肽用于疫苗,其基于个体患者的适合性,并使用本发明此处或后文所述的方法。
HLA表型、转录和肽组学资料从患者的肿瘤材料和血液样本中收集,以确定最合适每名患者且含有“存储库”和患者独特(即突变)TUMAP的肽。将选择的那些肽选择性地或过度表达于患者肿瘤中,并且可能的情况下,如果用患者个体PBMC进行检测,则表现出很强的体外免疫原性。
优选的情况是,疫苗所包括的肽的一种确定方法包括:(a)识别由来自个体患者肿瘤样本提呈的肿瘤相关肽(TUMAP);(b)将(a)中鉴定的肽与上述肽的存储库(资料库)进行比对;且(c)从与患者中确定的肿瘤相关肽相关的存储库(资料库)中选择至少一种肽。例如,肿瘤样本提呈的TUMAP的鉴定方法有:(a1)将来自肿瘤样本的表达资料与所述肿瘤样本组织类型相对应的正常组织样本的表达资料相比对,以识别肿瘤组织中过量表达或异常表达的蛋白;以及(a2)将表达资料与结合到肿瘤样本中I类MHC和/或II类分子的MHC 配体序列想关联,以确定来源于肿瘤过量表达或异常表达的蛋白质的MHC配体。优选情况是,MHC配体的序列的确定方法是:洗脱来自肿瘤样本分离的MHC分子结合肽,并测序洗脱配体。优选情况是,肿瘤样本和正常组织从同一患者获得。
除了使用存储库(资料库)模型选择肽以外,或作为一种替代方法,TUMAP可能在新患者中进行鉴定,然后列入疫苗中。作为一种实施例,患者中的候选TUMAP可透过以下方法进行鉴定:(a1)将来自肿瘤样本的表达资料与所述肿瘤样本组织类型相对应的正常组织样本的表达资料相比对,以识别肿瘤组织中过量表达或异常表达的蛋白;以及(a2)将表达资料与结合到肿瘤样本中I类MHC和/或II类分子的MHC配体序列想关联,以确定来源于肿瘤过量表达或异常表达的蛋白质的MHC配体。作为另一实施例,蛋白的鉴定方法为可包含突变,其对于肿瘤样本相对于个体患者的相应正常组织是独特的,并且TUMAP 可透过特异性靶向作用于变异来鉴定。例如,肿瘤以及相应正常组织的基因组可透过全基因组测序方法进行测序:为了发现基因蛋白质编码区域的非同义突变,从肿瘤组织中萃取基因组DNA和RNA,从外周血单核细胞(PBMC)中提取正常非突变基因组种系DNA。运用的NGS方法只限于蛋白编码区的重测序(外显子组重测序)。为了这一目的,使用供应商提供的靶序列富集试剂盒来捕获来自人样本的外显子DNA,随后使用HiSeq2000 (Illumina公司)进行测序。此外,对肿瘤的mRNA进行测序,以直接定量基因表达,并确认突变基因在患者肿瘤中表达。得到的数以百万计的序列读数透过软件演算法处理。输出列表中包含突变和基因表达。肿瘤特异性体突变透过与PBMC衍生的种系变化比较来确定,并进行优化。然后,为了存储库可能测试新确定的肽了解如上所述的免疫原性,并且选择具有合适免疫原性的候选TUMAP用于疫苗。
在一个示范实施方案中,疫苗中所含肽透过以下方法确定:(a)用上述方法识别由来自个体患者肿瘤样本提呈的肿瘤相关肽(TUMAP);(b)将(a)中鉴定的肽与进行肿瘤(与相应的正常组织相比)免疫原性和过量提呈预筛查肽的存储库进行比对;(c)从与患者中确定的肿瘤相关肽相关的存储库中选择至少一种肽;及(d)可选地在(a)中选择至少一种新确定的肽,确认其免疫原性。
在一个示范实施方案中,疫苗中所含肽透过以下方法确定:(a)识别由来自个体患者肿瘤样本提呈的肿瘤相关肽(TUMAP);以及(b)在(a)中选择至少一种新确定的肽,并确认其免疫原性。
一旦选定了用于个体化肽疫苗的肽时,则产生疫苗。该疫苗优选为一种液体制剂,包括溶解于20-40%DMSO之间,优选为约30-35%DMSO,例如,约33%DMSO中的个体肽。
列入产品的每种肽都溶于DMSO中。单个肽溶液浓度的选择取决于要列入产品中的肽的数量。单肽-DMSO溶液均等混合,以实现一种溶液中包含所有的肽,且浓度为每肽~2.5mg/ml。然后该混合溶液按照1∶3比例用注射用水进行稀释,以达到在33%DMSO中每肽0.826mg/ml的浓度。稀释的溶液透过0.22μm无菌筛检程序进行过滤。从而获得最终本体溶液。
最终本体溶液填充到小瓶中,在使用前储存于-20℃下。一个小瓶包含700μL溶液,其中每种肽含有0.578mg。其中的500μL(每种肽约400μg)将用于皮内注射。
本发明的肽除了用于治疗癌症,也可用于诊断。由于肽由急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌细胞产生,并且已确定这些肽在正常组织中不存在或水平较低,因此这些肽可用于诊断癌症是否存在。
血液样本中组织活检物含权利要求的肽,可有助于病理师诊断癌症。用抗体、质谱或其他本领域内已知的方法检测某些肽可使病理师判断该组织样本为恶性的还是炎症或一般病变,也可用作急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌的生物标志物。肽基团的提呈使得能对病变组织进行分类或进一步分成子类。
对病变标本中肽的检测使得能对免疫系统治疗方法的利益进行判断,特别是如果T-淋巴细胞已知或预计与作用机制有关。MHC表达的缺失是一种机制,充分说明了哪些受感染的恶性细胞逃避了免疫监视。因此,肽的提呈表明,分析过的细胞并没有利用这种机制。
本发明的肽可用于分析淋巴细胞对肽的反应(如T细胞反应),或抗体对肽或MHC分子络合的肽发生的反应。这些淋巴细胞反应可以作为预后指标,决定是否采取进一步的治疗。这些反应也可以用作免疫疗法中的替代反应指标,旨在以不同方式诱导淋巴细胞反应,如接种蛋白疫苗、核酸、自体材料、淋巴细胞过继转移。基因治疗中,淋巴细胞对肽发生的反应可以在副作用的评估中考虑。淋巴细胞反应监测也可能成为移植疗法随访检查中的一种有价值的工具,如,用于检测移植物抗宿主和宿主抗移植物疾病。
下列描述优选方案的实施例将对本发明进行说明,并参照随附图表(但是不仅限于此)。
考虑到本发明的目的,文中引用的所有参考文献透过引用的方式并入在本文中。
图表
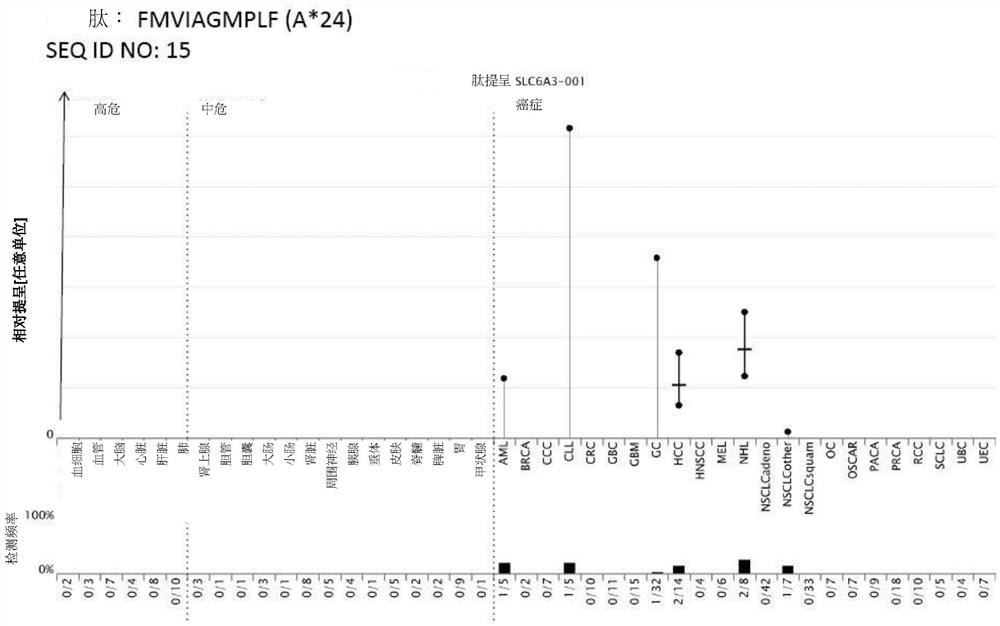
图1A至1J显示了各种肽在不同癌症组织中的过度提呈(黑点)。上面部分:根据技术重复测量值的中值MS信号强度绘制为点,单一HLA-A*24阳性正常组织为灰色点(左图),检测到该肽的肿瘤样本为黑点(右图)。盒显示了标准化信号强度的中位值、第 25和第75百分位数,而须延伸到最低数据点仍在下四分位数的1.5四分位数范围(IQR) 内,最高数据点仍在上四分位数的1.5IQR。正常器官根据风险类别排列顺序(血细胞、血管、脑、肝、肺:高风险,灰色点;生殖器官、乳腺、前列腺:低风险,灰色点;所有其他器官:中等风险;灰色点)。下面部分:每个器官的相对肽检测频率显示为脊柱图。图表下面的数字表示每个器官分析的总样本数中检测到肽的样本数(正常样本N=75,肿瘤样本N=263)。如果在一个样本上检测到肽,但因技术原因无法量化,则该样本纳入检测频率图中,但图表上部分不显示任何点。组织(从左到右):正常样本:血细胞; bloodvess(血管);脑;心;肝;肺;adrenal gl(肾上腺);胆管;gall bl(胆囊); intest.la(大肠);intest.sm(小肠);肾;nerve perith(周围神经);胰腺;pituit (垂体);皮肤;脊髓;脾;胃;甲状腺。肿瘤样本:AML(急性髓性白血病);BRCA (乳腺癌);CCC(胆管细胞癌);CLL(慢性淋巴细胞性白血病);CRC(结直肠癌);GBC(胆囊癌);GBM(胶质母细胞瘤);GC(胃癌);HCC(肝细胞癌); HNSCC(头颈部鳞状细胞癌);MEL(黑色素瘤);NHL(非霍奇金淋巴瘤);NSCLCadeno(非小细胞肺癌腺癌);NSCLCother(NSCLC样本,不能明确分配为 NSCLCadeno或NSCLCsquam);NSCLCsquam(鳞状细胞非小细胞肺癌);OC(卵巢癌);OSCAR(食管癌);PACA(胰腺癌);PRCA(前列腺癌);RCC(肾细胞癌);SCLC(小细胞肺癌);UBC(膀胱癌);UEC(子宫和子宫内膜癌)。图1A) 基因符号:SLC6A3,肽:FMVIAGMPLF(SEQ ID NO.:15),图1B)基因符号: KLHDC7B,肽:RYSPVKDAW(SEQ ID NO.:60),图1C)基因符号:CAPN6,肽: NYVLVPTMF(SEQ ID NO.:74),图1D)基因符号:SYT12,肽:SYLPTAERL(SEQID NO.:86),图1E)基因符号:PTPRZ1,肽:VYDTMIEKFA(SEQ ID NO.:202),图1F) 基因符号:PTPRZ1,肽:EYSLPVLTF(SEQ ID NO.:274),图1G)基因符号: LOC100124692,肽:NYMDTDNLMF(SEQ ID NO.:362),图1H)基因符号:AR,肽:YQSRDYYNF(SEQ ID NO.:386),图1I)基因符号:CT45A4、CT45A5,肽: VGGNVTSNF(SEQ ID NO.:463,图1J)基因符号:CT45A1、CT45A2、CT45A3、 CT45A4、CT45A6、LOC101060208、LOC101060210、LOC101060211,肽: VGGNVTSSF(SEQ ID NO.:464)。
图2A至2Q显示了本发明的源基因的代表性表达特征,其在不同癌症样本中过度表达。肿瘤(黑点)和正常(灰点)样本根据器官起源进行分组。盒须图代表中位FPKM值、第25和第75百分位数(盒)+须,延伸到最低数据点仍在下四分位数的1.5四分位数范围(IQR)内,最高数据点仍在上四分位数的1.5IQR。正常器官根据风险类别排列顺序。 FPKM:每百万映射读数每千碱基片段。组织(从左到右):正常样本:血细胞;bloodvess(血管);脑;心;肝;肺;脂肪(脂肪组织);adrenal gl(肾上腺);胆管;膀胱;骨髓;esoph(食管);眼;gall bl(胆囊);头颈部;intest.la(大肠); intest.sm(小肠);肾;淋巴结;nerve perith(外周神经);胰腺;parathyr(甲状旁腺);perit(腹膜);pituit(垂体);胸膜;skel.mus skel(骨骼肌);皮肤;脾;胃;甲状腺;气管;输尿管;乳房;卵巢;胎盘;前列腺;睾丸;胸腺;子宫。肿瘤样本:AML(急性髓性白血病);BRCA(乳腺癌);CCC(胆管细胞癌);CLL(慢性淋巴细胞性白血病);CRC(结直肠癌);GBC(胆囊癌);GBM(胶质母细胞瘤); GC(胃癌);HCC(肝细胞癌);HNSCC(头颈部鳞状细胞癌);MEL(黑色素瘤);NHL(非霍奇金淋巴瘤);NSCLCadeno(非小细胞肺癌腺癌);NSCLCother (NSCLC样本,不能明确分配为NSCLCadeno或NSCLCsquam);NSCLCsquam(鳞状细胞非小细胞肺癌);OC(卵巢癌);OSCAR(食管癌);PACA(胰腺癌); PRCA(前列腺癌);RCC(肾细胞癌);SCLC(小细胞肺癌);UBC(膀胱癌); UEC(子宫和子宫内膜癌)。图2A)基因符号:MAGEA4,肽:IFPKTGLLII(SEQ ID NO.:1),图2B)基因符号:TRPM8,肽:KFLTHDVLTELF(SEQ IDNO.:3),图2C)基因符号:CHRNA9,肽:KYYIATMAL(SEQ ID NO.:13),图2D)基因符号:MMP12,肽:KYVDINTFRL(SEQ ID NO.:18),图2E)基因符号:SPINK2,肽:LYMRFVNTHF (SEQ ID NO.:21),图2F)基因符号:OR51E2,肽:FWFDSREISF(SEQ ID NO.:28),图2G)基因符号:MMP1,肽:KQMQEFFGL(SEQ ID NO.:31),图2H)基因符号: MAGEC1,肽:FSSTLVSLF(SEQ ID NO.:35),图2I)基因符号:ENPP3,肽: KTYLPTFETTI(SEQ ID NO.:39),图2J)基因符号:POTEG、POTEH,肽:MVLQPQPQLF(SEQ ID NO.:4),图2K)基因符号:OR51E2,肽:TQMFFIHAL(SEQ ID NO.:97),图2L)基因符号:MMP11,肽:FFFKAGFVWR(SEQ ID NO.:107),图 2M)基因符号:MMP11,肽:YFLRGRLYW(SEQ ID NO.:122),图2N)基因符号: SLC24A5,肽:EYFLPSLEII(SEQ ID NO.:194),图2O)基因符号:SLC24A5,肽: MSAIWISAF(SEQ ID NO.:277),图2P)基因符号:ELP4、EXOSC7、KCNG2、 TM4SF19、TOP2A,肽:HHTQLIFVF(SEQ ID NO.:286),图2Q)基因符号:LAMA3,肽:YFGNPQKF(SEQ ID NO.:304)。
图3A至3G显示了健康HLA-A*24+供体的肽特异性CD8+ T细胞体外反应的示例性结果。CD8+ T细胞制备的方法为:使用抗CD28 mAb和HLA-A*24涂层的人工APC分别与SEQID NO:420肽(VYEKNGYIYF,Seq ID NO:420)(A,左图)、SEQ ID NO:411 肽(VYPPYLNYL,SeqID NO:411)(B,左图)、SEQ ID NO:5肽(LQPQPQLFFSF,Seq ID NO:5)(C,左图)、SEQ ID NO:77肽(LYGFFFKI,Seq ID NO:77)(D,左图)、 SEQ ID NO:76肽(IYIYPFAHW,Seq ID NO:76)(E,左图)、SEQ ID NO:32肽 (FYPEVELNF,Seq ID NO:32)(F,左图)、SEQ ID NO:23肽(VYSSFVFNLF,Seq ID NO:23)(G,左图)合成。经过3个周期的刺激后,分别用A*24/SEQ IDNO:420(A)、 A*24/SEQ ID NO:411(B)、A*24/SEQ ID NO:5(C)、A*24/SEQ ID NO:77(D)、A*24/SEQ ID NO:76(E)、A*24/SEQ ID NO:32(F)、A*24/SEQ ID NO:23(G)的2D多聚体染色法对肽反应性细胞进行检测。右图(A)显示了用不相关A*24/肽复合体刺激的细胞对照染色。活单细胞在CD8+淋巴细胞上得到门控。Boolean门控帮助排除用不同肽特定的多聚体检测的假阳性事件。提示了特异性多聚体+细胞和CD8+淋巴细胞的频率。
实施例
实施例1
患者的肿瘤组织获得自:Asterand Bioscience(密西根州,美国&Royston,赫特福德郡,英国)、BioServe(Beltsville,马里兰州,美国)、Conversant Bio(Huntsville,阿拉巴马州,美国)、Geneticist Inc.(Glendale,加州,美国)、海德堡大学医院(神经外科,海德堡,德国)、海德堡大学医院(普通内脏和移植外科,海德堡,德国)、海德堡大学医院(Thoraxklinik,海德堡,德国)、Istituto Nazionale Tumori″Pascale″(分子生物学和病毒肿瘤学部,那不勒斯,意大利)、京都府立医科大学(京都,日本)、莱顿大学医学中心(LUMC)(莱顿,荷兰)、大阪市立大学(大阪,日本)、ProteoGenex Inc.(Culver City,加州,美国)、圣萨瓦斯医院(雅典,希腊)、Tissue Solutions(格拉斯哥,英国)、波恩大学医院(内科III,血液学和肿瘤学,波恩,德国)、蒂宾根大学医院(普通内脏和移植外科,蒂宾根,德国)、蒂宾根大学医院(免疫科,蒂宾根,德国)、蒂宾根大学医院(泌尿外科,蒂宾根,德国)、日内瓦大学(肿瘤科,日内瓦,瑞士)
正常组织获得自:Asterand Bioscience(密西根州,美国&Royston,赫特福德郡,英国)、 BioServe(Beltsville,马里兰州,美国)、Capital BioScience Inc.(Rockville,马里兰州,美国)、蒂宾根临床输血医学中心(蒂宾根,德国)、Geneticist Inc.(Glendale,加州,美国)、海德堡大学医院(Thoraxklinik,海德堡,德国)、京都府立医科大学(京都,日本)、ProteoGenex Inc.(Culver City,加州,美国)、蒂宾根大学医院(普通内脏和移植外科,海德堡,德国)、蒂宾根大学医院(泌尿外科,海德堡,德国)
蒂宾根大学医院(蒂宾根,德国)、慕尼克大学医院(慕尼克,德国)。所有患者在手术或尸检前都获得了书面知情同意。切除后组织立即进行急速冷冻处理,在分离TUMAP前储存于-70℃或以下。
根据方案(Falk et al.,1991;Seeger et al.,1999)略加修改,使用HLA-A*02特异性抗体 BB7.2、HLA-A、HLA-B、HLA-
获得的HLA肽库根据其疏水性用反相色谱(nanoAcquity UPLC system,Waters)分离,洗脱肽用装有电喷雾源的LTQ-velos融合杂交质谱(ThermoElectron)进行了分析。肽库被直接载入填充有1.7μm C18反相材料(Waters)的分析用熔炼石英微毛细管柱(75μm 内径x250mm),应用流速为400nL每分钟。随后,使用来自流速为300nL每分钟、浓度为10%至33%溶剂B中的两步180分钟二元梯度法对肽进行分离。梯度由溶剂A (含0.1%甲酸的水)和溶剂B(含0.1%甲酸的乙腈)。金镀膜玻璃毛细管(PicoTip, New Objective)用于引入到纳升电喷雾源。使用前5(TOP5)策略在资料依赖模式下操作 LTQ-Orbitrap质谱仪。简言之,首先以高精确品质完全扫描在orbitrap开始一个扫描周期 (R=30000),之后用先前选定离子的动态排除技术在orbitrap中对5种含量最为丰富的前体离子进行MS/MS扫描(R=7500)。串联质谱由SEQUEST以固定的错误发现率 (q≤0.05)和额外的手动控制器进行解读。在确定的肽序列不确定的情况下,透过比较生成的天然肽片段化模式与合成序列相同参考肽的片段化模式,进一步验证所述肽序列。
无标记相对LC-MS定量透过离子计数(即透过LC-MS功能提取和分析)来进行(Mueller et al.,2007)。该方法假定肽的LC-MS信号区域与样本中其丰度相关。提取的特征透过充电状态去卷积和保留时间校准进行进一步处理(Mueller et al.,2008;Sturm etal.,2008)。最后,所有的LC-MS特征与序列鉴定结果交叉引用,以将不同样本和组织的定量资料与肽呈递特征结合。定量资料根据集中资料以两层方式进行正态化处理,以说明技术和生物学复制变异。因此,每个被识别的肽均可与定量资料相关,从而可得出样本和组织之间的相对定量。此外,对候选肽获得的所有定量资料进行手动检查,以确保资料的一致性,并验证自动化分析的准确度。对于每种肽,计算了提呈图,其显示样本平均提呈量以及复制变化。这些特征使急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌样本与正常组织样本的基线值并列。示范性过度提呈肽的提呈谱示于图1中。
表8a和表8b显示了选定肽在各种癌症实体中的提呈,因此显示所提及的肽用于诊断和/ 或治疗所示的癌症的特别相关性(例如:肽SEQ ID No.3用于前列腺癌(PRCA),肽SEQ ID No.20用于卵巢癌(OC)和胰腺癌(PACA))。
表8a:本发明选定肿瘤相关肽在各实体中提呈概述。
AML:急性髓性白血病;BRCA:乳腺癌;CCC:胆管细胞癌;CLL:慢性淋巴细胞白血病;CRC:结直肠癌;GBC:胆囊癌;GBM:胶质细胞瘤;GC:胃癌;HCC:肝细胞癌;HNSCC:头颈部鳞状细胞癌;MEL:黑色素瘤;NHL:非霍奇金淋巴瘤; NSCLCadeNO:非小细胞肺癌腺癌;NSCLCother:无法明确分配至NSCLCadeno或 NSCLCsquam的NSCLC样本;NSCLCsquam:鳞状细胞非小细胞肺癌;OC:卵巢癌;OSCAR:食管癌;PACA:胰腺癌;PRCA:前列腺癌;RCC:肾细胞癌;SCLC:小细胞肺癌;UBC:膀胱癌;UEC:子宫和子宫内膜癌。
表8b:本发明选定肿瘤相关肽在各实体中提呈概述。
AML:急性髓性白血病;BRCA:乳腺癌;GBC:胆囊癌;GC:胃癌;HCC:肝细胞癌;HNSCC:头颈部鳞状细胞癌;NSCLCadeNO:非小细胞肺癌腺癌; NSCLCsquam:鳞状细胞非小细胞肺癌;OC:卵巢癌。
实施例2
与正常细胞相比在肿瘤细胞上一种肽过度提呈或特定提呈足够其在免疫治疗中有效使用,一些肽为肿瘤特异性的,尽管存在其源蛋白也存在于正常组织中。但是,mRNA表达谱增加了免疫治疗目标肽选择中其他级别的安全性。特别是对于具有高安全性风险的治疗选择,诸如亲和力成熟的TCR,理想的目标肽将来源于对该肿瘤独一无二且不出现于正常组织中的蛋白。
手术切除组织标本按如上所述(参见实施例1)在获得每名患者的书面知情同意后提供。手术后立即速冻肿瘤组织标本,之后在液态氮中用杵臼匀浆。使用TRI试剂(Ambion公司,达姆施塔特,德国)之后用RNeasy(QIAGEN公司,希尔登,德国)清理从这些样本中制备总RNA;这两种方法都根据制造商的方案进行。
用于RNASeq实验来自健康人体组织的总RNA获得自:Asterand(Detroit,密西根州,美国&Royston,赫特福德郡,英国)、Bio-Options Inc.(Brea,加州,美国)、GeneticistInc. (Glendale,加州,美国)、ProteoGenex Inc.(Culver City,加州,美国)、TissueSolutions Ltd(格拉斯哥,英国)。用于RNASeq实验来自肿瘤组织的总RNA获得自:Asterand(Detroit,密西根州,美国&Royston,赫特福德郡,英国)、BioCat GmbH(海德堡,德国)、BioServe(Beltsville,马里兰州,美国)、Geneticist Inc.(Glendale,加州,美国)、Istituto Nazionale Tumori″Pascale″(那不勒斯,意大利)、ProteoGenex Inc. (CulverCity,加州,美国)、海德堡大学医院(海德堡,德国)。
所有RNA样本的品质和数量都在Agilent 2100 Bioanalyzer分析仪(Agilent公司,瓦尔德布龙,德国)上使用RNA 6000 Pico LabChip Kit试剂盒(Agilent公司)进行评估。
透过新一代测序技术(RNAseq)由CeGaT(蒂宾根,德国)对肿瘤和正常组织的RNA样本进行基因表达分析。简言之,根据供应商的方案(Illumina Inc.,San Diego,加州,美国),其中包括RNA碎片化、cDNA转化和测序适配器的加入,利用Illumina HiSeq v4 试剂盒准备测序文库。从多个样本获得的文库根据制造商的说明等摩尔混合并在Illumina HiSeq2500定序器上测序,产生50bp的单端读数。处理的读数使用STAR软件映射至人类基因组(GRCh38)。根据ENSEMBL序列资料库的说明(Ensembl77),表达资料在转录水平设置为RPKM(每百万映射读数每千碱基读数,由Cufflinks软件生成)并在外显子水平上设置(总读数,由Bedtools软件生成)。外显子读数被归为外显子长度和校准尺寸,以获得RPKM值。
在急性髓性白血病、乳腺癌、胆管细胞癌、慢性淋巴细胞白血病、结直肠癌、胆囊癌、胶质母细胞瘤、胃癌、肝细胞癌、头颈部鳞状细胞癌、黑色素瘤、非霍奇金淋巴瘤、肺癌(包括非小细胞肺癌腺癌、鳞状细胞非小细胞肺癌、小细胞肺癌)、卵巢癌、食管癌、胰腺癌、前列腺癌、肾细胞癌、膀胱癌、子宫癌和子宫内膜癌中高度过量表达或排他表达的本发明的源基因的代表性表达谱如图2所示。进一步代表性基因的表达分数见表9a和表 9b。
表9a:表达分数。该表列出了来自与一系列正常组织相比其外显子在肿瘤中非常高度过量表达(+++)、与一系列正常组织相比在肿瘤中高度过量表达(++)或与一系列正常组织相比在肿瘤中过量表达(+)的肿瘤类型的每种肽。本基线得分根据以下相关正常组织的测量值计算:血细胞、血管、脑、心脏、肝脏、肺、脂肪组织、肾上腺、胆管、骨髓、食道、眼、胆、头颈、肾、大肠、淋巴结、胰腺、甲状旁腺、周围神经、腹膜、垂体、胸膜、骨骼肌、皮肤、小肠、脾、胃、甲状腺、气管、输尿管、膀胱。如果获得同一组织类型几个样本的表达数据,则使用各样本的算术平均值进行计算。AML:急性髓性白血病; BRCA:乳腺癌;CCC:胆管细胞癌;CLL:慢性淋巴细胞白血病;CRC:结直肠癌; GBC:胆囊癌;GBM:胶质细胞瘤;GC:胃癌;HCC:肝细胞癌;HNSCC:头颈部鳞状细胞癌;MEL:黑色素瘤;NHL:非霍奇金淋巴瘤;NSCLCadeNO:非小细胞肺癌腺癌;NSCLCother:无法明确分配至NSCLCadeno或NSCLCsquam的NSCLC样本;NSCLCsquam:鳞状细胞非小细胞肺癌;OC:卵巢癌;OSCAR:食管癌;PACA:胰腺癌;PRCA:前列腺癌;RCC:肾细胞癌;SCLC:小细胞肺癌;UBC:膀胱癌; UEC:子宫和子宫内膜癌。
表9b:表达分数。该表列出了来自与一系列正常组织相比其外显子在肿瘤中非常高度过量表达(+++)、与一系列正常组织相比在肿瘤中高度过量表达(++)或与一系列正常组织相比在肿瘤中过量表达(+)的肿瘤类型的每种肽。本基线得分根据以下相关正常组织的测量值计算:血细胞、血管、脑、心脏、肝脏、肺、脂肪组织、肾上腺、胆管、骨髓、食道、眼、胆、头颈、肾、大肠、淋巴结、胰腺、甲状旁腺、周围神经、腹膜、垂体、胸膜、骨骼肌、皮肤、小肠、脾、胃、甲状腺、气管、输尿管、膀胱。如果获得同一组织类型几个样本的表达数据,则使用各样本的算术平均值进行计算。AML:急性髓性白血病;GBC:胆囊癌;HNSCC:头颈部鳞状细胞癌;MEL:黑色素瘤;NHL:非霍奇金淋巴瘤;NSCLCsquam:鳞状细胞非小细胞肺癌;OC:卵巢癌;OSCAR:食管癌。
实施例3
为了获得关于本发明TUMAP的免疫原性资讯,发明人使用体外T细胞扩增分析方法进行了研究,其中该分析方法基于使用装载肽/MHC复合物和抗CD28抗体的人工抗原提呈细胞(aAPC)进行反复刺激。用这种方法,发明人可显示出本发明的HLA-A*24:02限制 TUMAP具有免疫原性,这表明这些肽为对抗人CD8+前体T细胞的T细胞表位(表 10)。
为了用载有肽-MHC复合物(pMHC)和抗CD28抗体的人工抗原提呈细胞进行体外刺激,发明人首先从德国曼海姆大学诊所获取健康供体CD8微珠(Miltenyi Biotec,贝尔吉施格拉德巴赫,德国)透过积极选择白细胞清除术后新鲜HLA-A*24产物而分离出CD8+ T细胞。
PBMC和分离出的CD8+淋巴细胞使用前在T细胞培养基(TCM)中培养,培养基包括RPMI-Glutamax(Invitrogen公司,卡尔斯鲁厄,德国)并补充10%热灭活人AB血清 (PAN-Biotech公司,艾登巴赫,德国)、100U/ml青霉素/100μg/ml链霉素 (Cambrex公司,科隆,德国),1mM丙酮酸钠(CC Pro公司,Oberdorla,德国) 和20μg/ml庆大霉素(Cambrex公司)。在此步骤,2.5ng/ml的IL-7(PromoCell公司,海德堡,德国)和10U/ml的IL-2(NovartisPharma公司,纽伦堡,德国)也加入TCM。
对于pMHC/抗-CD28涂层珠的生成、T细胞的刺激和读出,使用每刺激条件四个不同pMHC分子以及每个读出条件8个不同的pMHC分子在高度限定的体外系统中进行。
纯化的共刺激小鼠IgG2a抗人CD28抗体9.3(Jung et al.,1987)使用制造商(Perbio公司,波恩,德国)推荐的N-羟基琥珀醯亚胺生物素进行化学生物素化处理。所用珠为 5.6μm的链霉抗生物素蛋白包裹的多聚苯乙烯颗粒(Bangs Labooratories,伊利诺州,美国)。
用于阳性和阴性对照刺激物的pMHC分别为A*0201/MLA-001(从Melan-A/MART-1中修饰制得的肽ELAGIGILTV(SEQ ID NO.461))和A*0201/DDX5-001(从DDX5中获得的YLLPAIVHI(SEQ ID NO.462))。
800.000珠/200μl包裹于含有4x12.5ng不同生物素-pMHC的96孔板、进行洗涤,随后加入体积为200μl的600 ng生物素抗-CD28。在37℃下,在含5 ng/ml lL-12 (PromoCell)的200μl TCM中共培养1x10
对于受到测试的HLA-I类肽,可透过肽特异性T细胞株的生成证明其体外免疫原性。 TUMAP特异性多聚体对本发明的2种肽染色后流式细胞仪检测的典型结果如图3所示,同时也含有相应的阴性对照资讯。本发明47种肽的结果汇总于表10a和表10b。
表10a:本发明中HLA I类肽的体外免疫原性
申请人对本发明的肽所做的体外免疫原性实验的示例性结果。
<20%=+;20%-49%=++;50%-69%=+++;>=70%=++++
表10b:本发明中HLA I类肽的体外免疫原性
申请人对本发明的肽所做的体外免疫原性实验的示例性结果。
<20%=+;20%-49%=++;50%-69%=+++;>=70%=++++
实施例4
所有的肽透过使用Fmoc策略以标准、广为接受的固相肽合成法合成。每个肽的身份和纯度已使用质谱和RP-HPLC分析法确定。用冻干法(三氟乙酸盐)获得白色至类白色的肽,纯度为>50%。所有的TUMAP优选作为三氟乙酸盐或乙酸盐进行给药,其他药用盐形式也可以。
实施例5
本发明基于T细胞疗法的候选肽进一步测试其MHC结合能力(亲和性)。单个肽-MHC复合体透过UV-配体交换产生,其中,紫外线敏感肽经紫外线照射后裂解,与分析的相关肽交换。只有能够有效地结合并稳定肽接受MHC分子的候选肽才能阻止MHC复合物的解离。为了确定交换反应的产率,将基于稳定MHC复合物轻链(β2m)的检测结果进行ELISA测定。检测总体上按照Rodenko等人在(Rodenko et al.,2006)中描述的方法进行。
96孔Maxisorp板(NUNC)在室温下在PBS中以2ug/ml链霉包被过夜,用4倍洗涤并在37℃下在含封闭缓冲液的2%BSA中封闭1小时。折叠的HLA-A*02:01/MLA-001单体作为标准品,涵盖15-500ng/ml的范围。紫外线交换反应的肽-MHC单体在封闭缓冲液中稀释100倍。样本在37℃下孵育1小时,洗涤四次,在37℃下以2ug/ml HRP缀合抗-β2m温育1小时,再次洗涤,并以NH
表11:MHC-I类结合分数。HLA-I类限制肽与HLA-A*24的结合根据肽交换产量分类:>10%=+;>20%=++;>50=+++;>75%=++++
参考文献列表
Allison,J.P.et al.,Science.270(1995):932-933
Andersen,R.S.et al.,Nat Protoc.7(2012):891-902
Appay,V.et al.,Eur J Immunol.36(2006):1805-1814
Banchereau,J.et al.,Cell.106(2001):271-274
Beatty,G.et al.,J Immunol.166(2001):2276-2282
Beggs,J.D.,Nature.275(1978):104-109
Benjamini,Y.et al.,Journal of the Royal Statistical Society Series B(Methodological),.
Vol.57(1995):289-300
Boulter,J.M.et al.,Protein Eng.16(2003):707-711
Braumuller,H.et al.,Nature.(2013)
Brossart,P.et al.,Blood.90(1997):1594-1599
Bruckdorfer,T.et al.,Curr Pharm Biotechnol.5(2004):29-43
Card,K.F.et al.,Cancer Immunol Immunother.53(2004):345-357
Cohen,C.J.et al.,J Mol Recognit.16(2003a):324-332
Cohen,C.J.et al.,J Immunol.170(2003b):4349-4361
Cohen,S.N.et al.,Proc Natl Acad Sci U S A.69(1972):2110-2114
Coligan,J.E.et al.,Current Protocols in Protein Science.(1995)
Colombetti,S.et al.,J Immunol.176(2006):2730-2738
Dengjel,J.et al.,Clin Cancer Res.12(2006):4163-4170
Denkberg,G.et al.,J Immunol.171(2003):2197-2207
Falk,K.et al.,Nature.351(1991):290-296
Follenzi,A.et al.,Nat Genet.25(2000):217-222
Fong,L.et al.,Proc Natl Acad Sci U S A.98(2001):8809-8814
Gabrilovich,D.I.et al.,Nat Med.2(1996):1096-1103
Gattinoni,L.et al.,Nat Rev Immunol.6(2006):383-393
Gnjatic,S.et al.,Proc Natl Acad Sci U S A.100(2003):8862-8867
Godkin,A.et al.,Int Immunol.9(1997):905-911
Gragert,L.et al.,Hum Immunol.74(2013):1313-1320
Green,M.R.et al.,Molecular Cloning,A Laboratory Manual.4th(2012)
Greenfield,E.A.,Antibodies:A Laboratory Manual.2nd(2014)
Gustafsson,C.et al.,Trends Biotechnol.22(2004):346-353
Hwang,M.L.et al.,J Immunol.179(2007):5829-5838
Jung,G.et al.,Proc Natl Acad SciU S A.84(1987):4611-4615
Kibbe,A.H.,Handbook of Pharmaceutical Excipients.rd(2000)
Krieg,A.M.,Nat Rev Drug Discov.5(2006):471-484
Kuball,J.et al.,Blood.109(2007):2331-2338
Liddy,N.et al.,Nat Med.18(2012):980-987
Ljunggren,H.G.et al.,J Exp Med.162(1985):1745-1759
Longenecker,B.M.et al.,Ann N Y Acad Sci.690(1993):276-291
Lukas,T.J.et al.,Proc Natl Acad Sci U S A.78(1981):2791-2795
Lundblad,R.L.,Chemical Reagents for Protein Modification.3rd(2004)
Meziere,C.et al.,J Immunol.159(1997):3230-3237
Morgan,R.A.et al.,Science.314(2006):126-129
Mortara,L.et al.,Clin Cancer Res.12(2006):3435-3443
Mueller,L.N.et al.,J Proteome Res.7(2008):51-61
Mueller,L.N.et al.,Proteomics.7(2007):3470-3480
Mumberg,D.et al.,Proc Natl Acad Sci U S A.96(1999):8633-8638
Pinheiro,J.et al.,nlme:Linear and Nonlinear Mixed Effects Models(http://CRANR- projectorg/package=nlme)(2015)
Plebanski,M.et al.,Eur J Immunol.25(1995):1783-1787
Porta,C.et al.,Virology.202(1994):949-955
Rammensee,H.et al.,Immunogenetics.50(1999):213-219
Rini,B.I.et al.,Cancer.107(2006):67-74
Rock,K.L.et al.,Science.249(1990):918-921
Rodenko,B.et al.,Nat Protoc.1(2006):1120-1132
Saiki,R.K.et al.,Science.239(1988):487-491
Schmitt,T.M.et al.,Hum Gene Ther.20(2009):1240-1248
Scholten,K.B.et al.,Clin Immunol.119(2006):135-145
Seeger,F.H.et al.,Immunogenetics.49(1999):571-576
Sherman,F.et al.,Laboratory Course Manual for Methods in YeastGenetics.(1986)
Singh-Jasuja,H.et al.,Cancer Immunol Immunother.53(2004):187-195
Small,E.J.et al.,J Clin Oncol.24(2006):3089-3094
Sturm,M.et al.,BMC Bioinformatics.9(2008):163
Teufel,R.et al.,Cell Mol Life Sci.62(2005):1755-1762
Tran,T.T.et al.,Photochem Photobiol.90(2014):1136-1143
Walter,S.et al.,J Immunol.171(2003):4974-4978
Walter,S.et al.,Nat Med.18(2012):1254-1261
Willcox,B.E.et al.,Protein Sci.8(1999):2418-2423
Zaremba,S.et al.,Cancer Res.57(1997):4570-4577
Zufferey,R.et al.,J Virol.73(1999):2886-2892。
序列表
<110> 伊玛提克斯生物技术有限公司
<120> 用于抗癌免疫治疗的肽
<130> I33190WO
<150> DE 10 2018 111 819.8
<151> 2018-05-16
<150> US 62/672,411
<151> 2018-05-16
<160> 464
<170> PatentIn版本3.5
<210> 1
<211> 10
<212> PRT
<213> 智人
<400> 1
Ile Phe Pro Lys Thr Gly Leu Leu Ile Ile
1 5 10
<210> 2
<211> 9
<212> PRT
<213> 智人
<400> 2
Leu Tyr Ala Pro Thr Ile Leu Leu Trp
1 5
<210> 3
<211> 12
<212> PRT
<213> 智人
<400> 3
Lys Phe Leu Thr His Asp Val Leu Thr Glu Leu Phe
1 5 10
<210> 4
<211> 10
<212> PRT
<213> 智人
<400> 4
Met Val Leu Gln Pro Gln Pro Gln Leu Phe
1 5 10
<210> 5
<211> 11
<212> PRT
<213> 智人
<400> 5
Leu Gln Pro Gln Pro Gln Leu Phe Phe Ser Phe
1 5 10
<210> 6
<211> 12
<212> PRT
<213> 智人
<400> 6
Ile Val Thr Phe Met Asn Lys Thr Leu Gly Thr Phe
1 5 10
<210> 7
<211> 9
<212> PRT
<213> 智人
<400> 7
Gly Tyr Pro Leu Arg Gly Ser Ser Ile
1 5
<210> 8
<211> 9
<212> PRT
<213> 智人
<400> 8
Ile Met Lys Pro Leu Asp Gln Asp Phe
1 5
<210> 9
<211> 9
<212> PRT
<213> 智人
<400> 9
Thr Tyr Ile Asn Ser Leu Ala Ile Leu
1 5
<210> 10
<211> 9
<212> PRT
<213> 智人
<400> 10
Gln Tyr Pro Glu Phe Ser Ile Glu Leu
1 5
<210> 11
<211> 9
<212> PRT
<213> 智人
<400> 11
Arg Ala Met Cys Ala Met Met Ser Phe
1 5
<210> 12
<211> 10
<212> PRT
<213> 智人
<400> 12
Lys Tyr Met Ser Arg Val Leu Phe Val Tyr
1 5 10
<210> 13
<211> 9
<212> PRT
<213> 智人
<400> 13
Lys Tyr Tyr Ile Ala Thr Met Ala Leu
1 5
<210> 14
<211> 9
<212> PRT
<213> 智人
<400> 14
Tyr Tyr Ile Ala Thr Met Ala Leu Ile
1 5
<210> 15
<211> 10
<212> PRT
<213> 智人
<400> 15
Phe Met Val Ile Ala Gly Met Pro Leu Phe
1 5 10
<210> 16
<211> 9
<212> PRT
<213> 智人
<400> 16
Gly Tyr Phe Leu Ala Gln Tyr Leu Met
1 5
<210> 17
<211> 9
<212> PRT
<213> 智人
<400> 17
Ile Tyr Pro Glu Ala Ile Ala Thr Leu
1 5
<210> 18
<211> 10
<212> PRT
<213> 智人
<400> 18
Lys Tyr Val Asp Ile Asn Thr Phe Arg Leu
1 5 10
<210> 19
<211> 10
<212> PRT
<213> 智人
<400> 19
Ile Leu Leu Cys Met Ser Leu Leu Leu Phe
1 5 10
<210> 20
<211> 9
<212> PRT
<213> 智人
<400> 20
Glu Leu Met Ala His Pro Phe Leu Leu
1 5
<210> 21
<211> 10
<212> PRT
<213> 智人
<400> 21
Leu Tyr Met Arg Phe Val Asn Thr His Phe
1 5 10
<210> 22
<211> 9
<212> PRT
<213> 智人
<400> 22
Val Tyr Ser Ser Phe Val Phe Asn Leu
1 5
<210> 23
<211> 10
<212> PRT
<213> 智人
<400> 23
Val Tyr Ser Ser Phe Val Phe Asn Leu Phe
1 5 10
<210> 24
<211> 10
<212> PRT
<213> 智人
<400> 24
Lys Met Leu Pro Glu Ala Ser Leu Leu Ile
1 5 10
<210> 25
<211> 9
<212> PRT
<213> 智人
<400> 25
Met Leu Pro Glu Ala Ser Leu Leu Ile
1 5
<210> 26
<211> 10
<212> PRT
<213> 智人
<400> 26
Thr Tyr Phe Phe Val Asp Asn Gln Tyr Trp
1 5 10
<210> 27
<211> 9
<212> PRT
<213> 智人
<400> 27
Leu Ser Cys Thr Ala Thr Pro Leu Phe
1 5
<210> 28
<211> 10
<212> PRT
<213> 智人
<400> 28
Phe Trp Phe Asp Ser Arg Glu Ile Ser Phe
1 5 10
<210> 29
<211> 9
<212> PRT
<213> 智人
<400> 29
Ile Tyr Leu Leu Leu Pro Pro Val Ile
1 5
<210> 30
<211> 9
<212> PRT
<213> 智人
<400> 30
Arg Gln Ala Tyr Ser Val Tyr Ala Phe
1 5
<210> 31
<211> 9
<212> PRT
<213> 智人
<400> 31
Lys Gln Met Gln Glu Phe Phe Gly Leu
1 5
<210> 32
<211> 9
<212> PRT
<213> 智人
<400> 32
Phe Tyr Pro Glu Val Glu Leu Asn Phe
1 5
<210> 33
<211> 11
<212> PRT
<213> 智人
<400> 33
Phe Tyr Gln Pro Asp Leu Lys Tyr Leu Ser Phe
1 5 10
<210> 34
<211> 10
<212> PRT
<213> 智人
<400> 34
Leu Ile Phe Ala Leu Ala Leu Ala Ala Phe
1 5 10
<210> 35
<211> 9
<212> PRT
<213> 智人
<400> 35
Phe Ser Ser Thr Leu Val Ser Leu Phe
1 5
<210> 36
<211> 9
<212> PRT
<213> 智人
<400> 36
Val Tyr Leu Ala Ser Val Ala Ala Phe
1 5
<210> 37
<211> 10
<212> PRT
<213> 智人
<400> 37
Ile Ser Phe Ser Asp Thr Val Asn Val Trp
1 5 10
<210> 38
<211> 12
<212> PRT
<213> 智人
<400> 38
Arg Tyr Ala His Thr Leu Val Thr Ser Val Leu Phe
1 5 10
<210> 39
<211> 11
<212> PRT
<213> 智人
<400> 39
Lys Thr Tyr Leu Pro Thr Phe Glu Thr Thr Ile
1 5 10
<210> 40
<211> 10
<212> PRT
<213> 智人
<400> 40
Asn Tyr Pro Glu Gly Ala Ala Tyr Glu Phe
1 5 10
<210> 41
<211> 9
<212> PRT
<213> 智人
<400> 41
Ile Tyr Phe Ala Thr Gln Val Val Phe
1 5
<210> 42
<211> 9
<212> PRT
<213> 智人
<400> 42
Val Tyr Asp Ser Ile Trp Cys Asn Met
1 5
<210> 43
<211> 9
<212> PRT
<213> 智人
<400> 43
Lys Tyr Lys Asp His Phe Thr Glu Ile
1 5
<210> 44
<211> 9
<212> PRT
<213> 智人
<400> 44
Phe Tyr His Glu Asp Met Pro Leu Trp
1 5
<210> 45
<211> 9
<212> PRT
<213> 智人
<400> 45
Tyr Gly Gln Ser Lys Pro Trp Thr Phe
1 5
<210> 46
<211> 9
<212> PRT
<213> 智人
<400> 46
Ile Tyr Pro Asp Ser Ile Gln Glu Leu
1 5
<210> 47
<211> 11
<212> PRT
<213> 智人
<400> 47
Ser Tyr Leu Trp Thr Asp Asn Leu Gln Glu Phe
1 5 10
<210> 48
<211> 11
<212> PRT
<213> 智人
<400> 48
Ala Trp Ser Pro Pro Ala Thr Leu Phe Leu Phe
1 5 10
<210> 49
<211> 11
<212> PRT
<213> 智人
<400> 49
Gln Tyr Leu Ser Ile Ala Glu Arg Ala Glu Phe
1 5 10
<210> 50
<211> 10
<212> PRT
<213> 智人
<400> 50
Arg Tyr Phe Asp Glu Asn Ile Gln Lys Phe
1 5 10
<210> 51
<211> 9
<212> PRT
<213> 智人
<400> 51
Tyr Phe Asp Glu Asn Ile Gln Lys Phe
1 5
<210> 52
<211> 9
<212> PRT
<213> 智人
<400> 52
Ser Trp His Lys Ala Thr Phe Leu Phe
1 5
<210> 53
<211> 10
<212> PRT
<213> 智人
<400> 53
Leu Phe Gln Arg Val Ser Ser Val Ser Phe
1 5 10
<210> 54
<211> 9
<212> PRT
<213> 智人
<400> 54
Ser Tyr Gln Glu Ala Ile Gln Gln Leu
1 5
<210> 55
<211> 9
<212> PRT
<213> 智人
<400> 55
Ala Val Leu Arg His Leu Glu Thr Phe
1 5
<210> 56
<211> 9
<212> PRT
<213> 智人
<400> 56
Phe Tyr Lys Leu Ile Gln Asn Gly Phe
1 5
<210> 57
<211> 9
<212> PRT
<213> 智人
<400> 57
Arg Tyr Leu Gln Val Val Leu Leu Tyr
1 5
<210> 58
<211> 9
<212> PRT
<213> 智人
<400> 58
Ile Tyr Tyr Ser His Glu Asn Leu Ile
1 5
<210> 59
<211> 9
<212> PRT
<213> 智人
<400> 59
Val Phe Pro Leu Val Thr Pro Leu Leu
1 5
<210> 60
<211> 9
<212> PRT
<213> 智人
<400> 60
Arg Tyr Ser Pro Val Lys Asp Ala Trp
1 5
<210> 61
<211> 9
<212> PRT
<213> 智人
<400> 61
Arg Ile Phe Thr Ala Arg Leu Tyr Phe
1 5
<210> 62
<211> 9
<212> PRT
<213> 智人
<400> 62
Val Tyr Ile Val Pro Val Ile Val Leu
1 5
<210> 63
<211> 9
<212> PRT
<213> 智人
<400> 63
Leu Tyr Ile Asp Lys Gly Gln Tyr Leu
1 5
<210> 64
<211> 10
<212> PRT
<213> 智人
<400> 64
Gln Phe Ser His Val Pro Leu Asn Asn Phe
1 5 10
<210> 65
<211> 10
<212> PRT
<213> 智人
<400> 65
Glu Tyr Leu Leu Met Ile Phe Lys Leu Val
1 5 10
<210> 66
<211> 10
<212> PRT
<213> 智人
<400> 66
Ile Tyr Lys Asp Tyr Tyr Arg Tyr Asn Phe
1 5 10
<210> 67
<211> 9
<212> PRT
<213> 智人
<400> 67
Ser Tyr Val Leu Gln Ile Val Ala Ile
1 5
<210> 68
<211> 9
<212> PRT
<213> 智人
<400> 68
Val Tyr Lys Glu Asp Leu Pro Gln Leu
1 5
<210> 69
<211> 10
<212> PRT
<213> 智人
<400> 69
Lys Trp Phe Asp Ser His Ile Pro Arg Trp
1 5 10
<210> 70
<211> 9
<212> PRT
<213> 智人
<400> 70
Arg Tyr Thr Gly Gln Trp Ser Glu Trp
1 5
<210> 71
<211> 11
<212> PRT
<213> 智人
<400> 71
Arg Tyr Leu Pro Asn Pro Ser Leu Asn Ala Phe
1 5 10
<210> 72
<211> 10
<212> PRT
<213> 智人
<400> 72
Arg Trp Leu Asp Gly Ser Pro Val Thr Leu
1 5 10
<210> 73
<211> 10
<212> PRT
<213> 智人
<400> 73
Tyr Phe Cys Ser Thr Lys Gly Gln Leu Phe
1 5 10
<210> 74
<211> 9
<212> PRT
<213> 智人
<400> 74
Asn Tyr Val Leu Val Pro Thr Met Phe
1 5
<210> 75
<211> 9
<212> PRT
<213> 智人
<400> 75
Val Tyr Glu His Asn His Val Ser Leu
1 5
<210> 76
<211> 9
<212> PRT
<213> 智人
<400> 76
Ile Tyr Ile Tyr Pro Phe Ala His Trp
1 5
<210> 77
<211> 8
<212> PRT
<213> 智人
<400> 77
Leu Tyr Gly Phe Phe Phe Lys Ile
1 5
<210> 78
<211> 11
<212> PRT
<213> 智人
<400> 78
Thr Tyr Ser Lys Thr Ile Ala Leu Tyr Gly Phe
1 5 10
<210> 79
<211> 10
<212> PRT
<213> 智人
<400> 79
Phe Tyr Ile Val Thr Arg Pro Leu Ala Phe
1 5 10
<210> 80
<211> 9
<212> PRT
<213> 智人
<400> 80
Ser Tyr Ala Thr Pro Val Asp Leu Trp
1 5
<210> 81
<211> 9
<212> PRT
<213> 智人
<400> 81
Ala Tyr Leu Lys Leu Leu Pro Met Phe
1 5
<210> 82
<211> 9
<212> PRT
<213> 智人
<400> 82
Ser Tyr Leu Glu Asn Ser Ala Ser Trp
1 5
<210> 83
<211> 9
<212> PRT
<213> 智人
<400> 83
Val Leu Gln Gly Glu Phe Phe Leu Phe
1 5
<210> 84
<211> 9
<212> PRT
<213> 智人
<400> 84
Tyr Thr Ile Glu Arg Tyr Phe Thr Leu
1 5
<210> 85
<211> 10
<212> PRT
<213> 智人
<400> 85
Lys Tyr Leu Ser Ile Pro Thr Val Phe Phe
1 5 10
<210> 86
<211> 9
<212> PRT
<213> 智人
<400> 86
Ser Tyr Leu Pro Thr Ala Glu Arg Leu
1 5
<210> 87
<211> 9
<212> PRT
<213> 智人
<400> 87
Asn Tyr Thr Arg Leu Val Leu Gln Phe
1 5
<210> 88
<211> 9
<212> PRT
<213> 智人
<400> 88
Thr Tyr Val Pro Ser Thr Phe Leu Val
1 5
<210> 89
<211> 11
<212> PRT
<213> 智人
<400> 89
Thr Tyr Val Pro Ser Thr Phe Leu Val Val Leu
1 5 10
<210> 90
<211> 9
<212> PRT
<213> 智人
<400> 90
Thr Asp Leu Val Gln Phe Leu Leu Phe
1 5
<210> 91
<211> 9
<212> PRT
<213> 智人
<400> 91
Lys Gln Gln Val Val Lys Phe Leu Ile
1 5
<210> 92
<211> 9
<212> PRT
<213> 智人
<400> 92
Arg Ala Leu Thr Glu Thr Ile Met Phe
1 5
<210> 93
<211> 10
<212> PRT
<213> 智人
<400> 93
Thr Asp Trp Ser Pro Pro Pro Val Glu Phe
1 5 10
<210> 94
<211> 9
<212> PRT
<213> 智人
<400> 94
Thr His Ser Gly Gly Thr Asn Leu Phe
1 5
<210> 95
<211> 9
<212> PRT
<213> 智人
<400> 95
Ile Gly Leu Ser Val Val His Arg Phe
1 5
<210> 96
<211> 9
<212> PRT
<213> 智人
<400> 96
Ser His Ile Gly Val Val Leu Ala Phe
1 5
<210> 97
<211> 9
<212> PRT
<213> 智人
<400> 97
Thr Gln Met Phe Phe Ile His Ala Leu
1 5
<210> 98
<211> 9
<212> PRT
<213> 智人
<400> 98
Leu Gln Ile Pro Val Ser Pro Ser Phe
1 5
<210> 99
<211> 10
<212> PRT
<213> 智人
<400> 99
Ala Ser Ala Ala Leu Thr Gly Phe Thr Phe
1 5 10
<210> 100
<211> 11
<212> PRT
<213> 智人
<400> 100
Lys Val Trp Ser Asp Val Thr Pro Leu Thr Phe
1 5 10
<210> 101
<211> 9
<212> PRT
<213> 智人
<400> 101
Val Tyr Ala Val Ser Ser Asp Arg Phe
1 5
<210> 102
<211> 10
<212> PRT
<213> 智人
<400> 102
Val Leu Ala Ser Ala His Ile Leu Gln Phe
1 5 10
<210> 103
<211> 9
<212> PRT
<213> 智人
<400> 103
Glu Met Phe Phe Ser Pro Gln Val Phe
1 5
<210> 104
<211> 10
<212> PRT
<213> 智人
<400> 104
Gly Tyr Gly Leu Thr Arg Val Gln Pro Phe
1 5 10
<210> 105
<211> 9
<212> PRT
<213> 智人
<400> 105
Ile Thr Pro Ala Thr Ala Leu Leu Leu
1 5
<210> 106
<211> 9
<212> PRT
<213> 智人
<400> 106
Leu Tyr Ala Phe Leu Gly Ser His Phe
1 5
<210> 107
<211> 10
<212> PRT
<213> 智人
<400> 107
Phe Phe Phe Lys Ala Gly Phe Val Trp Arg
1 5 10
<210> 108
<211> 9
<212> PRT
<213> 智人
<400> 108
Trp Phe Phe Gln Gly Ala Gln Tyr Trp
1 5
<210> 109
<211> 9
<212> PRT
<213> 智人
<400> 109
Ala Gln His Ser Leu Thr Gln Leu Phe
1 5
<210> 110
<211> 9
<212> PRT
<213> 智人
<400> 110
Val Tyr Ser Asn Pro Asp Leu Phe Trp
1 5
<210> 111
<211> 9
<212> PRT
<213> 智人
<400> 111
Ile Arg Pro Asp Tyr Ser Phe Gln Phe
1 5
<210> 112
<211> 11
<212> PRT
<213> 智人
<400> 112
Leu Tyr Pro Asp Ser Val Phe Gly Arg Leu Phe
1 5 10
<210> 113
<211> 9
<212> PRT
<213> 智人
<400> 113
Ala Leu Met Ser Ala Phe Tyr Thr Phe
1 5
<210> 114
<211> 10
<212> PRT
<213> 智人
<400> 114
Lys Ala Leu Met Ser Ala Phe Tyr Thr Phe
1 5 10
<210> 115
<211> 9
<212> PRT
<213> 智人
<400> 115
Ile Met Gln Gly Phe Ile Arg Ala Phe
1 5
<210> 116
<211> 9
<212> PRT
<213> 智人
<400> 116
Thr Tyr Phe Phe Val Ala Asn Lys Tyr
1 5
<210> 117
<211> 11
<212> PRT
<213> 智人
<400> 117
Arg Ser Met Glu His Pro Gly Lys Leu Leu Phe
1 5 10
<210> 118
<211> 9
<212> PRT
<213> 智人
<400> 118
Ile Phe Leu Pro Phe Phe Ile Val Phe
1 5
<210> 119
<211> 10
<212> PRT
<213> 智人
<400> 119
Val Trp Ser Cys Glu Gly Cys Lys Ala Phe
1 5 10
<210> 120
<211> 9
<212> PRT
<213> 智人
<400> 120
Val Tyr Ala Phe Met Asn Glu Asn Phe
1 5
<210> 121
<211> 10
<212> PRT
<213> 智人
<400> 121
Arg Arg Tyr Phe Gly Glu Lys Val Ala Leu
1 5 10
<210> 122
<211> 9
<212> PRT
<213> 智人
<400> 122
Tyr Phe Leu Arg Gly Arg Leu Tyr Trp
1 5
<210> 123
<211> 9
<212> PRT
<213> 智人
<400> 123
Phe Phe Leu Gln Glu Ser Pro Val Phe
1 5
<210> 124
<211> 9
<212> PRT
<213> 智人
<400> 124
Glu Tyr Asn Val Phe Pro Arg Thr Leu
1 5
<210> 125
<211> 9
<212> PRT
<213> 智人
<400> 125
Leu Tyr Tyr Gly Ser Ile Leu Tyr Ile
1 5
<210> 126
<211> 9
<212> PRT
<213> 智人
<400> 126
Tyr Ser Leu Leu Asp Pro Ala Gln Phe
1 5
<210> 127
<211> 9
<212> PRT
<213> 智人
<400> 127
Phe Leu Pro Arg Ala Tyr Tyr Arg Trp
1 5
<210> 128
<211> 9
<212> PRT
<213> 智人
<400> 128
Ala Phe Gln Asn Val Ile Ser Ser Phe
1 5
<210> 129
<211> 9
<212> PRT
<213> 智人
<400> 129
Ile Tyr Val Ser Leu Ala His Val Leu
1 5
<210> 130
<211> 8
<212> PRT
<213> 智人
<400> 130
Arg Pro Glu Lys Val Phe Val Phe
1 5
<210> 131
<211> 9
<212> PRT
<213> 智人
<400> 131
Met His Arg Thr Trp Arg Glu Thr Phe
1 5
<210> 132
<211> 9
<212> PRT
<213> 智人
<400> 132
Thr Phe Glu Gly Ala Thr Val Thr Leu
1 5
<210> 133
<211> 9
<212> PRT
<213> 智人
<400> 133
Phe Phe Tyr Val Thr Glu Thr Thr Phe
1 5
<210> 134
<211> 9
<212> PRT
<213> 智人
<400> 134
Ile Tyr Ser Ser Gln Leu Pro Ser Phe
1 5
<210> 135
<211> 9
<212> PRT
<213> 智人
<400> 135
Lys Tyr Lys Gln His Phe Pro Glu Ile
1 5
<210> 136
<211> 8
<212> PRT
<213> 智人
<400> 136
Tyr Leu Lys Ser Val Gln Leu Phe
1 5
<210> 137
<211> 10
<212> PRT
<213> 智人
<400> 137
Ala Leu Phe Ala Val Cys Trp Ala Pro Phe
1 5 10
<210> 138
<211> 9
<212> PRT
<213> 智人
<400> 138
Met Met Val Thr Val Val Ala Leu Phe
1 5
<210> 139
<211> 11
<212> PRT
<213> 智人
<400> 139
Ala Tyr Ala Pro Arg Gly Ser Ile Tyr Lys Phe
1 5 10
<210> 140
<211> 9
<212> PRT
<213> 智人
<400> 140
Ile Phe Gln His Phe Cys Glu Glu Ile
1 5
<210> 141
<211> 10
<212> PRT
<213> 智人
<400> 141
Gln Tyr Ala Ala Ala Ile Thr Asn Gly Leu
1 5 10
<210> 142
<211> 10
<212> PRT
<213> 智人
<400> 142
Pro Tyr Trp Trp Asn Ala Asn Met Val Phe
1 5 10
<210> 143
<211> 9
<212> PRT
<213> 智人
<400> 143
Lys Thr Lys Arg Trp Leu Trp Asp Phe
1 5
<210> 144
<211> 10
<212> PRT
<213> 智人
<400> 144
Leu Phe Asp His Gly Gly Thr Val Phe Phe
1 5 10
<210> 145
<211> 9
<212> PRT
<213> 智人
<400> 145
Met Tyr Thr Ile Val Thr Pro Met Leu
1 5
<210> 146
<211> 9
<212> PRT
<213> 智人
<400> 146
Asn Tyr Phe Leu Asp Pro Val Thr Ile
1 5
<210> 147
<211> 10
<212> PRT
<213> 智人
<400> 147
Phe Pro Tyr Pro Ser Ser Ile Leu Ser Val
1 5 10
<210> 148
<211> 10
<212> PRT
<213> 智人
<400> 148
Met Leu Pro Gln Ile Pro Phe Leu Leu Leu
1 5 10
<210> 149
<211> 9
<212> PRT
<213> 智人
<400> 149
Thr Gln Phe Phe Ile Pro Tyr Thr Ile
1 5
<210> 150
<211> 9
<212> PRT
<213> 智人
<400> 150
Phe Ile Pro Val Ala Trp Leu Ile Phe
1 5
<210> 151
<211> 9
<212> PRT
<213> 智人
<400> 151
Arg Arg Leu Trp Ala Tyr Val Thr Ile
1 5
<210> 152
<211> 11
<212> PRT
<213> 智人
<400> 152
Met His Pro Gly Val Leu Ala Ala Phe Leu Phe
1 5 10
<210> 153
<211> 9
<212> PRT
<213> 智人
<400> 153
Ala Trp Ser Pro Pro Ala Thr Leu Phe
1 5
<210> 154
<211> 9
<212> PRT
<213> 智人
<400> 154
Asp Tyr Ser Lys Gln Ala Leu Ser Leu
1 5
<210> 155
<211> 11
<212> PRT
<213> 智人
<400> 155
Pro Tyr Ser Ile Tyr Pro His Gly Val Thr Phe
1 5 10
<210> 156
<211> 10
<212> PRT
<213> 智人
<400> 156
Ile Tyr Pro His Gly Val Thr Phe Ser Pro
1 5 10
<210> 157
<211> 9
<212> PRT
<213> 智人
<400> 157
Ser Ile Tyr Pro His Gly Val Thr Phe
1 5
<210> 158
<211> 9
<212> PRT
<213> 智人
<400> 158
Ser Tyr Leu Lys Asp Pro Met Ile Val
1 5
<210> 159
<211> 8
<212> PRT
<213> 智人
<400> 159
Val Phe Gln Pro Asn Pro Leu Phe
1 5
<210> 160
<211> 9
<212> PRT
<213> 智人
<400> 160
Tyr Ile Ala Asn Leu Ile Ser Cys Phe
1 5
<210> 161
<211> 9
<212> PRT
<213> 智人
<400> 161
Ile Leu Gln Ala Pro Leu Ser Val Phe
1 5
<210> 162
<211> 9
<212> PRT
<213> 智人
<400> 162
Tyr Tyr Ile Gly Ile Val Glu Glu Tyr
1 5
<210> 163
<211> 10
<212> PRT
<213> 智人
<400> 163
Tyr Tyr Ile Gly Ile Val Glu Glu Tyr Trp
1 5 10
<210> 164
<211> 9
<212> PRT
<213> 智人
<400> 164
Met Phe Gln Glu Met Leu Gln Arg Leu
1 5
<210> 165
<211> 10
<212> PRT
<213> 智人
<400> 165
Lys Asp Gln Pro Gln Val Pro Cys Val Phe
1 5 10
<210> 166
<211> 10
<212> PRT
<213> 智人
<400> 166
Met Met Ala Leu Trp Ser Leu Leu His Leu
1 5 10
<210> 167
<211> 9
<212> PRT
<213> 智人
<400> 167
Leu Gln Pro Pro Trp Thr Thr Val Phe
1 5
<210> 168
<211> 9
<212> PRT
<213> 智人
<400> 168
Leu Ser Ser Pro Val His Leu Asp Phe
1 5
<210> 169
<211> 9
<212> PRT
<213> 智人
<400> 169
Met Tyr Asp Leu His His Leu Tyr Leu
1 5
<210> 170
<211> 9
<212> PRT
<213> 智人
<400> 170
Ile Phe Ile Pro Ala Thr Ile Leu Leu
1 5
<210> 171
<211> 9
<212> PRT
<213> 智人
<400> 171
Leu Tyr Thr Val Pro Phe Asn Leu Ile
1 5
<210> 172
<211> 11
<212> PRT
<213> 智人
<400> 172
Arg Tyr Phe Ile Ala Ala Glu Lys Ile Leu Trp
1 5 10
<210> 173
<211> 9
<212> PRT
<213> 智人
<400> 173
Arg Tyr Leu Ser Val Cys Glu Arg Leu
1 5
<210> 174
<211> 10
<212> PRT
<213> 智人
<400> 174
Thr Tyr Gly Glu Glu Met Pro Glu Glu Ile
1 5 10
<210> 175
<211> 9
<212> PRT
<213> 智人
<400> 175
Ser Tyr Phe Glu Tyr Arg Arg Leu Leu
1 5
<210> 176
<211> 9
<212> PRT
<213> 智人
<400> 176
Thr Gln Ala Gly Glu Tyr Leu Leu Phe
1 5
<210> 177
<211> 9
<212> PRT
<213> 智人
<400> 177
Lys Tyr Leu Ile Thr Thr Phe Ser Leu
1 5
<210> 178
<211> 9
<212> PRT
<213> 智人
<400> 178
Ala Tyr Pro Gln Ile Arg Cys Thr Trp
1 5
<210> 179
<211> 8
<212> PRT
<213> 智人
<400> 179
Met Tyr Asn Met Val Pro Phe Phe
1 5
<210> 180
<211> 9
<212> PRT
<213> 智人
<400> 180
Ile Tyr Asn Lys Thr Lys Met Ala Phe
1 5
<210> 181
<211> 9
<212> PRT
<213> 智人
<400> 181
Ile His Gly Ile Lys Phe His Tyr Phe
1 5
<210> 182
<211> 9
<212> PRT
<213> 智人
<400> 182
Ala Gln Gly Ser Gly Thr Val Thr Phe
1 5
<210> 183
<211> 9
<212> PRT
<213> 智人
<400> 183
Tyr Gln Val Ala Lys Gly Met Glu Phe
1 5
<210> 184
<211> 8
<212> PRT
<213> 智人
<400> 184
Val Tyr Val Arg Pro Arg Val Phe
1 5
<210> 185
<211> 9
<212> PRT
<213> 智人
<400> 185
Leu Tyr Ile Cys Lys Val Glu Leu Met
1 5
<210> 186
<211> 9
<212> PRT
<213> 智人
<400> 186
Arg Arg Val Thr Trp Asn Val Leu Phe
1 5
<210> 187
<211> 11
<212> PRT
<213> 智人
<400> 187
Lys Trp Phe Asn Val Arg Met Gly Phe Gly Phe
1 5 10
<210> 188
<211> 10
<212> PRT
<213> 智人
<400> 188
Ser Leu Pro Gly Ser Phe Ile Tyr Val Phe
1 5 10
<210> 189
<211> 10
<212> PRT
<213> 智人
<400> 189
Phe Tyr Pro Asp Glu Asp Asp Phe Tyr Phe
1 5 10
<210> 190
<211> 9
<212> PRT
<213> 智人
<400> 190
Ile Tyr Ile Ile Met Gln Ser Cys Trp
1 5
<210> 191
<211> 10
<212> PRT
<213> 智人
<400> 191
Met Ser Tyr Ser Cys Gly Leu Pro Ser Leu
1 5 10
<210> 192
<211> 9
<212> PRT
<213> 智人
<400> 192
Cys Tyr Ser Phe Ile His Leu Ser Phe
1 5
<210> 193
<211> 11
<212> PRT
<213> 智人
<400> 193
Lys Tyr Lys Pro Val Ala Leu Gln Cys Ile Ala
1 5 10
<210> 194
<211> 10
<212> PRT
<213> 智人
<400> 194
Glu Tyr Phe Leu Pro Ser Leu Glu Ile Ile
1 5 10
<210> 195
<211> 10
<212> PRT
<213> 智人
<400> 195
Ile Tyr Asn Glu His Gly Ile Gln Gln Ile
1 5 10
<210> 196
<211> 9
<212> PRT
<213> 智人
<400> 196
Val Gly Arg Ser Pro Val Phe Leu Phe
1 5
<210> 197
<211> 9
<212> PRT
<213> 智人
<400> 197
Tyr Tyr His Ser Gly Glu Asn Leu Tyr
1 5
<210> 198
<211> 9
<212> PRT
<213> 智人
<400> 198
Val Leu Ala Pro Val Ser Gly Gln Phe
1 5
<210> 199
<211> 9
<212> PRT
<213> 智人
<400> 199
Met Phe Gln Phe Glu His Ile Lys Trp
1 5
<210> 200
<211> 9
<212> PRT
<213> 智人
<400> 200
Leu Tyr Met Ser Val Glu Asp Phe Ile
1 5
<210> 201
<211> 9
<212> PRT
<213> 智人
<400> 201
Val Phe Pro Ser Val Asp Val Ser Phe
1 5
<210> 202
<211> 10
<212> PRT
<213> 智人
<400> 202
Val Tyr Asp Thr Met Ile Glu Lys Phe Ala
1 5 10
<210> 203
<211> 9
<212> PRT
<213> 智人
<400> 203
Val Tyr Pro Ser Glu Ser Thr Val Met
1 5
<210> 204
<211> 9
<212> PRT
<213> 智人
<400> 204
Trp Gln Asn Val Thr Pro Leu Thr Phe
1 5
<210> 205
<211> 10
<212> PRT
<213> 智人
<400> 205
Ile Ser Trp Glu Val Val His Thr Val Phe
1 5 10
<210> 206
<211> 9
<212> PRT
<213> 智人
<400> 206
Glu Val Val His Thr Val Phe Leu Phe
1 5
<210> 207
<211> 9
<212> PRT
<213> 智人
<400> 207
Ile Tyr Lys Phe Ile Met Asp Arg Phe
1 5
<210> 208
<211> 9
<212> PRT
<213> 智人
<400> 208
Gln Tyr Leu Gln Gln Gln Ala Lys Leu
1 5
<210> 209
<211> 10
<212> PRT
<213> 智人
<400> 209
Asp Ile Tyr Val Thr Gly Gly His Leu Phe
1 5 10
<210> 210
<211> 10
<212> PRT
<213> 智人
<400> 210
Glu Ala Tyr Ser Tyr Pro Pro Ala Thr Ile
1 5 10
<210> 211
<211> 10
<212> PRT
<213> 智人
<400> 211
Met Leu Tyr Phe Ala Pro Asp Leu Ile Leu
1 5 10
<210> 212
<211> 9
<212> PRT
<213> 智人
<400> 212
Val Tyr Phe Val Gln Tyr Lys Ile Met
1 5
<210> 213
<211> 9
<212> PRT
<213> 智人
<400> 213
Phe Tyr Asn Arg Leu Thr Lys Leu Phe
1 5
<210> 214
<211> 9
<212> PRT
<213> 智人
<400> 214
Tyr Ile Pro Met Ser Val Met Leu Phe
1 5
<210> 215
<211> 9
<212> PRT
<213> 智人
<400> 215
Lys Ala Ser Lys Ile Thr Phe His Trp
1 5
<210> 216
<211> 9
<212> PRT
<213> 智人
<400> 216
Arg His Tyr His Ser Ile Glu Val Phe
1 5
<210> 217
<211> 10
<212> PRT
<213> 智人
<400> 217
Gln Arg Tyr Gly Phe Ser Ser Val Gly Phe
1 5 10
<210> 218
<211> 9
<212> PRT
<213> 智人
<400> 218
Phe Tyr Phe Tyr Asn Cys Ser Ser Leu
1 5
<210> 219
<211> 9
<212> PRT
<213> 智人
<400> 219
Lys Val Val Ser Gly Phe Tyr Tyr Ile
1 5
<210> 220
<211> 9
<212> PRT
<213> 智人
<400> 220
Thr Tyr Ala Thr His Val Thr Glu Ile
1 5
<210> 221
<211> 9
<212> PRT
<213> 智人
<400> 221
Val Phe Tyr Cys Leu Leu Phe Val Phe
1 5
<210> 222
<211> 9
<212> PRT
<213> 智人
<400> 222
His Tyr His Ala Glu Ser Phe Leu Phe
1 5
<210> 223
<211> 9
<212> PRT
<213> 智人
<400> 223
Lys Leu Arg Ala Leu Ser Ile Leu Phe
1 5
<210> 224
<211> 9
<212> PRT
<213> 智人
<400> 224
Ala Tyr Leu Gln Phe Leu Ser Val Leu
1 5
<210> 225
<211> 10
<212> PRT
<213> 智人
<400> 225
Ile Ser Met Ser Ala Thr Glu Phe Leu Leu
1 5 10
<210> 226
<211> 9
<212> PRT
<213> 智人
<400> 226
Thr Tyr Ser Thr Asn Arg Thr Met Ile
1 5
<210> 227
<211> 10
<212> PRT
<213> 智人
<400> 227
Tyr Leu Pro Asn Pro Ser Leu Asn Ala Phe
1 5 10
<210> 228
<211> 8
<212> PRT
<213> 智人
<400> 228
Val Tyr Leu Arg Ile Gly Gly Phe
1 5
<210> 229
<211> 9
<212> PRT
<213> 智人
<400> 229
Cys Ala Met Pro Val Ala Met Glu Phe
1 5
<210> 230
<211> 9
<212> PRT
<213> 智人
<400> 230
Arg Trp Leu Ser Lys Pro Ser Leu Leu
1 5
<210> 231
<211> 10
<212> PRT
<213> 智人
<400> 231
Lys Tyr Ser Val Ala Phe Tyr Ser Leu Asp
1 5 10
<210> 232
<211> 9
<212> PRT
<213> 智人
<400> 232
Ile Trp Pro Gly Phe Thr Thr Ser Ile
1 5
<210> 233
<211> 10
<212> PRT
<213> 智人
<400> 233
Leu Tyr Ser Arg Arg Gly Val Arg Thr Leu
1 5 10
<210> 234
<211> 8
<212> PRT
<213> 智人
<400> 234
Arg Tyr Lys Met Leu Ile Pro Phe
1 5
<210> 235
<211> 9
<212> PRT
<213> 智人
<400> 235
Val Tyr Ile Ser Asp Val Ser Val Tyr
1 5
<210> 236
<211> 9
<212> PRT
<213> 智人
<400> 236
Leu His Leu Tyr Cys Leu Asn Thr Phe
1 5
<210> 237
<211> 9
<212> PRT
<213> 智人
<400> 237
Arg Gln Gly Leu Thr Val Leu Thr Trp
1 5
<210> 238
<211> 10
<212> PRT
<213> 智人
<400> 238
Tyr Thr Cys Ser Arg Ala Val Ser Leu Phe
1 5 10
<210> 239
<211> 9
<212> PRT
<213> 智人
<400> 239
Ile Tyr Thr Phe Ser Asn Val Thr Phe
1 5
<210> 240
<211> 9
<212> PRT
<213> 智人
<400> 240
Arg Val His Ala Asn Pro Leu Leu Ile
1 5
<210> 241
<211> 12
<212> PRT
<213> 智人
<400> 241
Gln Lys Tyr Tyr Ile Thr Gly Glu Ala Glu Gly Phe
1 5 10
<210> 242
<211> 9
<212> PRT
<213> 智人
<400> 242
Ser Tyr Thr Pro Leu Leu Ser Tyr Ile
1 5
<210> 243
<211> 10
<212> PRT
<213> 智人
<400> 243
Ala Leu Phe Pro Met Gly Pro Leu Thr Phe
1 5 10
<210> 244
<211> 10
<212> PRT
<213> 智人
<400> 244
Thr Tyr Ile Asp Thr Arg Thr Val Phe Leu
1 5 10
<210> 245
<211> 9
<212> PRT
<213> 智人
<400> 245
Val Leu Pro Leu His Phe Leu Pro Phe
1 5
<210> 246
<211> 11
<212> PRT
<213> 智人
<400> 246
Lys Ile Tyr Thr Thr Val Leu Phe Ala Asn Ile
1 5 10
<210> 247
<211> 9
<212> PRT
<213> 智人
<400> 247
Val His Ser Tyr Leu Gly Ser Pro Phe
1 5
<210> 248
<211> 9
<212> PRT
<213> 智人
<400> 248
Cys Trp Gly Pro His Cys Phe Glu Met
1 5
<210> 249
<211> 10
<212> PRT
<213> 智人
<400> 249
His Gln Tyr Gly Gly Ala Tyr Asn Arg Val
1 5 10
<210> 250
<211> 10
<212> PRT
<213> 智人
<400> 250
Val Tyr Ser Asp Arg Gln Ile Tyr Leu Leu
1 5 10
<210> 251
<211> 9
<212> PRT
<213> 智人
<400> 251
Asp Tyr Leu Leu Ser Trp Leu Leu Phe
1 5
<210> 252
<211> 9
<212> PRT
<213> 智人
<400> 252
Arg Tyr Leu Ile Ile Lys Tyr Pro Phe
1 5
<210> 253
<211> 9
<212> PRT
<213> 智人
<400> 253
Gln Tyr Tyr Cys Leu Leu Leu Ile Phe
1 5
<210> 254
<211> 10
<212> PRT
<213> 智人
<400> 254
Lys Gln His Ala Trp Leu Pro Leu Thr Ile
1 5 10
<210> 255
<211> 10
<212> PRT
<213> 智人
<400> 255
Val Tyr Leu Asp Glu Lys Gln His Ala Trp
1 5 10
<210> 256
<211> 9
<212> PRT
<213> 智人
<400> 256
Gln His Ala Trp Leu Pro Leu Thr Ile
1 5
<210> 257
<211> 9
<212> PRT
<213> 智人
<400> 257
Met Leu Ile Leu Phe Phe Ser Thr Ile
1 5
<210> 258
<211> 10
<212> PRT
<213> 智人
<400> 258
Val Cys Trp Asn Pro Phe Asn Asn Thr Phe
1 5 10
<210> 259
<211> 8
<212> PRT
<213> 智人
<400> 259
Phe Phe Leu Phe Ile Pro Phe Phe
1 5
<210> 260
<211> 10
<212> PRT
<213> 智人
<400> 260
Phe Leu Phe Ile Pro Phe Phe Ile Ile Phe
1 5 10
<210> 261
<211> 10
<212> PRT
<213> 智人
<400> 261
Ile Met Phe Cys Leu Lys Asn Phe Trp Trp
1 5 10
<210> 262
<211> 9
<212> PRT
<213> 智人
<400> 262
Tyr Ile Met Phe Cys Leu Lys Asn Phe
1 5
<210> 263
<211> 9
<212> PRT
<213> 智人
<400> 263
Ala Tyr Val Thr Glu Phe Val Ser Leu
1 5
<210> 264
<211> 11
<212> PRT
<213> 智人
<400> 264
Ala Tyr Ala Ile Pro Ser Ala Ser Leu Ser Trp
1 5 10
<210> 265
<211> 10
<212> PRT
<213> 智人
<400> 265
Leu Tyr Gln Gln Ser Asp Thr Trp Ser Leu
1 5 10
<210> 266
<211> 9
<212> PRT
<213> 智人
<400> 266
Thr Gln Ile Ile Thr Phe Glu Ser Phe
1 5
<210> 267
<211> 10
<212> PRT
<213> 智人
<400> 267
Gln His Met Leu Pro Phe Trp Thr Asp Leu
1 5 10
<210> 268
<211> 9
<212> PRT
<213> 智人
<400> 268
Tyr Gln Phe Gly Trp Ser Pro Asn Phe
1 5
<210> 269
<211> 10
<212> PRT
<213> 智人
<400> 269
Phe Ser Phe Ser Thr Ser Met Asn Glu Phe
1 5 10
<210> 270
<211> 9
<212> PRT
<213> 智人
<400> 270
Gly Thr Gly Lys Leu Phe Trp Val Phe
1 5
<210> 271
<211> 9
<212> PRT
<213> 智人
<400> 271
Ile Asn Gly Asp Leu Val Phe Ser Phe
1 5
<210> 272
<211> 8
<212> PRT
<213> 智人
<400> 272
Ile Tyr Phe Asn His Arg Cys Phe
1 5
<210> 273
<211> 9
<212> PRT
<213> 智人
<400> 273
Val Thr Met Tyr Leu Pro Leu Leu Leu
1 5
<210> 274
<211> 9
<212> PRT
<213> 智人
<400> 274
Glu Tyr Ser Leu Pro Val Leu Thr Phe
1 5
<210> 275
<211> 10
<212> PRT
<213> 智人
<400> 275
Pro Glu Tyr Ser Leu Pro Val Leu Thr Phe
1 5 10
<210> 276
<211> 9
<212> PRT
<213> 智人
<400> 276
Lys Phe Leu Gly Ser Lys Cys Ser Phe
1 5
<210> 277
<211> 9
<212> PRT
<213> 智人
<400> 277
Met Ser Ala Ile Trp Ile Ser Ala Phe
1 5
<210> 278
<211> 10
<212> PRT
<213> 智人
<400> 278
Thr Tyr Glu Ser Val Val Thr Gly Phe Phe
1 5 10
<210> 279
<211> 8
<212> PRT
<213> 智人
<400> 279
Lys Tyr Lys Asn Pro Tyr Gly Phe
1 5
<210> 280
<211> 11
<212> PRT
<213> 智人
<400> 280
Thr Ile Tyr Ser Leu Glu Met Lys Met Ser Phe
1 5 10
<210> 281
<211> 10
<212> PRT
<213> 智人
<400> 281
Met Asp Gln Asn Gln Val Val Trp Thr Phe
1 5 10
<210> 282
<211> 11
<212> PRT
<213> 智人
<400> 282
Ala Ser Tyr Gln Gln Ser Thr Ser Ser Phe Phe
1 5 10
<210> 283
<211> 9
<212> PRT
<213> 智人
<400> 283
Ser Tyr Ile Val Asp Gly Lys Ile Ile
1 5
<210> 284
<211> 10
<212> PRT
<213> 智人
<400> 284
Gln Phe Tyr Ser Thr Leu Pro Asn Thr Ile
1 5 10
<210> 285
<211> 9
<212> PRT
<213> 智人
<400> 285
Tyr Phe Leu Pro Gly Pro His Tyr Phe
1 5
<210> 286
<211> 9
<212> PRT
<213> 智人
<400> 286
His His Thr Gln Leu Ile Phe Val Phe
1 5
<210> 287
<211> 9
<212> PRT
<213> 智人
<400> 287
Leu Val Gln Pro Gln Ala Val Leu Phe
1 5
<210> 288
<211> 10
<212> PRT
<213> 智人
<400> 288
Met Gly Lys Gly Ser Ile Ser Phe Leu Phe
1 5 10
<210> 289
<211> 9
<212> PRT
<213> 智人
<400> 289
Arg Thr Leu Asn Glu Ile Tyr His Trp
1 5
<210> 290
<211> 9
<212> PRT
<213> 智人
<400> 290
Val Thr Pro Lys Met Leu Ile Ser Phe
1 5
<210> 291
<211> 8
<212> PRT
<213> 智人
<400> 291
Tyr Thr Arg Leu Val Leu Gln Phe
1 5
<210> 292
<211> 9
<212> PRT
<213> 智人
<400> 292
Lys Met Phe Pro Lys Asp Phe Arg Phe
1 5
<210> 293
<211> 9
<212> PRT
<213> 智人
<400> 293
Met Tyr Ala Tyr Ala Gly Trp Phe Tyr
1 5
<210> 294
<211> 9
<212> PRT
<213> 智人
<400> 294
Lys Met Gly Arg Ile Val Asp Tyr Phe
1 5
<210> 295
<211> 9
<212> PRT
<213> 智人
<400> 295
Lys Tyr Asn Arg Gln Ser Met Thr Leu
1 5
<210> 296
<211> 9
<212> PRT
<213> 智人
<400> 296
Tyr Gln Arg Pro Asp Leu Leu Leu Phe
1 5
<210> 297
<211> 9
<212> PRT
<213> 智人
<400> 297
Leu Lys Ser Pro Arg Leu Phe Thr Phe
1 5
<210> 298
<211> 9
<212> PRT
<213> 智人
<400> 298
Thr Tyr Glu Thr Val Met Thr Phe Phe
1 5
<210> 299
<211> 9
<212> PRT
<213> 智人
<400> 299
Phe Leu Pro Ala Leu Tyr Ser Leu Leu
1 5
<210> 300
<211> 9
<212> PRT
<213> 智人
<400> 300
Leu Phe Ala Leu Pro Asp Phe Ile Phe
1 5
<210> 301
<211> 10
<212> PRT
<213> 智人
<400> 301
Arg Thr Ala Leu Ser Ser Thr Asp Thr Phe
1 5 10
<210> 302
<211> 9
<212> PRT
<213> 智人
<400> 302
Tyr Gln Gly Ser Leu Glu Val Leu Phe
1 5
<210> 303
<211> 9
<212> PRT
<213> 智人
<400> 303
Arg Phe Leu Asp Arg Gly Trp Gly Phe
1 5
<210> 304
<211> 8
<212> PRT
<213> 智人
<400> 304
Tyr Phe Gly Asn Pro Gln Lys Phe
1 5
<210> 305
<211> 9
<212> PRT
<213> 智人
<400> 305
Arg Asn Ala Phe Ser Ile Tyr Ile Leu
1 5
<210> 306
<211> 9
<212> PRT
<213> 智人
<400> 306
Arg Tyr Ile Leu Glu Pro Phe Phe Ile
1 5
<210> 307
<211> 9
<212> PRT
<213> 智人
<400> 307
Arg Ile Leu Thr Glu Phe Glu Leu Leu
1 5
<210> 308
<211> 10
<212> PRT
<213> 智人
<400> 308
Ala Ala Phe Ile Ser Val Pro Leu Leu Ile
1 5 10
<210> 309
<211> 9
<212> PRT
<213> 智人
<400> 309
Ala Phe Ile Ser Val Pro Leu Leu Ile
1 5
<210> 310
<211> 9
<212> PRT
<213> 智人
<400> 310
Glu Phe Ile Asn Gly Trp Tyr Val Leu
1 5
<210> 311
<211> 9
<212> PRT
<213> 智人
<400> 311
Ile Gln Asn Ala Ile Leu His Leu Phe
1 5
<210> 312
<211> 9
<212> PRT
<213> 智人
<400> 312
Tyr Leu Cys Met Leu Tyr Ala Leu Phe
1 5
<210> 313
<211> 9
<212> PRT
<213> 智人
<400> 313
Ile Phe Met Glu Asn Ala Phe Glu Leu
1 5
<210> 314
<211> 9
<212> PRT
<213> 智人
<400> 314
Ser Gln His Phe Asn Leu Ala Thr Phe
1 5
<210> 315
<211> 9
<212> PRT
<213> 智人
<400> 315
Val Tyr Asp Tyr Ile Pro Leu Leu Leu
1 5
<210> 316
<211> 8
<212> PRT
<213> 智人
<400> 316
Ile Trp Ala Glu Arg Ile Met Phe
1 5
<210> 317
<211> 10
<212> PRT
<213> 智人
<400> 317
Asp Trp Ile Trp Arg Ile Leu Phe Leu Val
1 5 10
<210> 318
<211> 9
<212> PRT
<213> 智人
<400> 318
Val Gln Ala Asp Ala Lys Leu Leu Phe
1 5
<210> 319
<211> 9
<212> PRT
<213> 智人
<400> 319
Ala Thr Ala Thr Leu His Leu Ile Phe
1 5
<210> 320
<211> 10
<212> PRT
<213> 智人
<400> 320
Glu Val Tyr Gln Lys Ile Ile Leu Lys Phe
1 5 10
<210> 321
<211> 9
<212> PRT
<213> 智人
<400> 321
Val Tyr Thr Val Gly His Asn Leu Ile
1 5
<210> 322
<211> 11
<212> PRT
<213> 智人
<400> 322
Ser Phe Ile Ser Pro Arg Tyr Ser Trp Leu Phe
1 5 10
<210> 323
<211> 9
<212> PRT
<213> 智人
<400> 323
Asn Tyr Ser Pro Val Thr Gly Lys Phe
1 5
<210> 324
<211> 9
<212> PRT
<213> 智人
<400> 324
Arg Tyr Phe Val Ser Asn Ile Tyr Leu
1 5
<210> 325
<211> 9
<212> PRT
<213> 智人
<400> 325
Ile Phe Met Gly Ala Val Pro Thr Leu
1 5
<210> 326
<211> 9
<212> PRT
<213> 智人
<400> 326
Val His Met Lys Asp Phe Phe Tyr Phe
1 5
<210> 327
<211> 9
<212> PRT
<213> 智人
<400> 327
Lys Trp Lys Pro Ser Pro Leu Leu Phe
1 5
<210> 328
<211> 9
<212> PRT
<213> 智人
<400> 328
Ile Tyr Leu Val Gly Gly Tyr Ser Trp
1 5
<210> 329
<211> 8
<212> PRT
<213> 智人
<400> 329
Tyr Leu Gly Lys Asn Trp Ser Phe
1 5
<210> 330
<211> 9
<212> PRT
<213> 智人
<400> 330
Asp Tyr Ile Gln Met Ile Pro Glu Leu
1 5
<210> 331
<211> 9
<212> PRT
<213> 智人
<400> 331
Glu Tyr Ile Asp Glu Phe Gln Ser Leu
1 5
<210> 332
<211> 10
<212> PRT
<213> 智人
<400> 332
Val Tyr Cys Ser Leu Asp Lys Ser Gln Phe
1 5 10
<210> 333
<211> 10
<212> PRT
<213> 智人
<400> 333
Arg Tyr Ala Asp Leu Leu Ile Tyr Thr Tyr
1 5 10
<210> 334
<211> 9
<212> PRT
<213> 智人
<400> 334
Lys Val Phe Gly Ser Phe Leu Thr Leu
1 5
<210> 335
<211> 9
<212> PRT
<213> 智人
<400> 335
Arg Tyr Gln Ser Val Ile Tyr Pro Phe
1 5
<210> 336
<211> 9
<212> PRT
<213> 智人
<400> 336
Val Tyr Ser Asp Leu His Ala Phe Tyr
1 5
<210> 337
<211> 9
<212> PRT
<213> 智人
<400> 337
Ser His Ser Asp His Glu Phe Leu Phe
1 5
<210> 338
<211> 9
<212> PRT
<213> 智人
<400> 338
Val Tyr Leu Thr Trp Leu Pro Gly Leu
1 5
<210> 339
<211> 9
<212> PRT
<213> 智人
<400> 339
Lys Gln Val Ile Gly Ile His Thr Phe
1 5
<210> 340
<211> 8
<212> PRT
<213> 智人
<400> 340
Phe Pro Pro Thr Pro Pro Leu Phe
1 5
<210> 341
<211> 9
<212> PRT
<213> 智人
<400> 341
Arg Tyr Glu Asn Val Ser Ile Leu Phe
1 5
<210> 342
<211> 9
<212> PRT
<213> 智人
<400> 342
Met Tyr Gly Ile Val Ile Arg Thr Ile
1 5
<210> 343
<211> 9
<212> PRT
<213> 智人
<400> 343
Glu Tyr Gln Gln Tyr His Pro Ser Leu
1 5
<210> 344
<211> 9
<212> PRT
<213> 智人
<400> 344
Tyr Ala Tyr Ala Thr Val Leu Thr Phe
1 5
<210> 345
<211> 9
<212> PRT
<213> 智人
<400> 345
Arg Tyr Leu Glu Glu His Thr Glu Phe
1 5
<210> 346
<211> 9
<212> PRT
<213> 智人
<400> 346
Thr Tyr Ile Asp Phe Val Pro Tyr Ile
1 5
<210> 347
<211> 9
<212> PRT
<213> 智人
<400> 347
Ala Trp Leu Ile Val Leu Leu Phe Leu
1 5
<210> 348
<211> 10
<212> PRT
<213> 智人
<400> 348
Arg Ser Trp Glu Asn Ile Pro Val Thr Phe
1 5 10
<210> 349
<211> 9
<212> PRT
<213> 智人
<400> 349
Ile Tyr Met Thr Thr Gly Val Leu Leu
1 5
<210> 350
<211> 9
<212> PRT
<213> 智人
<400> 350
Val Tyr Lys Trp Thr Glu Glu Lys Phe
1 5
<210> 351
<211> 9
<212> PRT
<213> 智人
<400> 351
Gly Tyr Phe Gly Thr Ala Ser Leu Phe
1 5
<210> 352
<211> 9
<212> PRT
<213> 智人
<400> 352
Asn Ala Phe Glu Ala Pro Leu Thr Phe
1 5
<210> 353
<211> 9
<212> PRT
<213> 智人
<400> 353
Ala Ala Phe Pro Gly Ala Phe Ser Phe
1 5
<210> 354
<211> 9
<212> PRT
<213> 智人
<400> 354
Gln Tyr Ile Pro Thr Phe His Val Tyr
1 5
<210> 355
<211> 9
<212> PRT
<213> 智人
<400> 355
Val Tyr Asn Asn Asn Ser Ser Arg Phe
1 5
<210> 356
<211> 9
<212> PRT
<213> 智人
<400> 356
Tyr Ser Leu Glu His Leu Thr Gln Phe
1 5
<210> 357
<211> 9
<212> PRT
<213> 智人
<400> 357
Arg Ala Leu Leu Pro Ser Pro Leu Phe
1 5
<210> 358
<211> 10
<212> PRT
<213> 智人
<400> 358
Ile Tyr Ala Asn Val Thr Glu Met Leu Leu
1 5 10
<210> 359
<211> 9
<212> PRT
<213> 智人
<400> 359
Thr Gln Leu Pro Ala Pro Leu Arg Ile
1 5
<210> 360
<211> 9
<212> PRT
<213> 智人
<400> 360
Leu Tyr Ile Thr Lys Val Thr Thr Ile
1 5
<210> 361
<211> 9
<212> PRT
<213> 智人
<400> 361
Lys Gln Pro Ala Asn Phe Ile Val Leu
1 5
<210> 362
<211> 10
<212> PRT
<213> 智人
<400> 362
Asn Tyr Met Asp Thr Asp Asn Leu Met Phe
1 5 10
<210> 363
<211> 9
<212> PRT
<213> 智人
<400> 363
Gln Tyr Gly Phe Asn Tyr Asn Lys Phe
1 5
<210> 364
<211> 9
<212> PRT
<213> 智人
<400> 364
Lys Gln Ser Gln Val Val Phe Val Leu
1 5
<210> 365
<211> 9
<212> PRT
<213> 智人
<400> 365
Lys Asp Leu Met Lys Ala Tyr Leu Phe
1 5
<210> 366
<211> 9
<212> PRT
<213> 智人
<400> 366
Arg Leu Gly Glu Phe Val Leu Leu Phe
1 5
<210> 367
<211> 9
<212> PRT
<213> 智人
<400> 367
His Trp Ser His Ile Thr His Leu Phe
1 5
<210> 368
<211> 9
<212> PRT
<213> 智人
<400> 368
Ala Tyr Phe Val Ala Met His Leu Phe
1 5
<210> 369
<211> 9
<212> PRT
<213> 智人
<400> 369
Asn Phe Tyr Leu Phe Pro Thr Thr Phe
1 5
<210> 370
<211> 9
<212> PRT
<213> 智人
<400> 370
Thr Gln Met Asp Val Lys Leu Val Phe
1 5
<210> 371
<211> 9
<212> PRT
<213> 智人
<400> 371
Phe Arg Ser Trp Ala Val Gln Thr Phe
1 5
<210> 372
<211> 9
<212> PRT
<213> 智人
<400> 372
Leu Tyr His Asn Trp Arg His Ala Phe
1 5
<210> 373
<211> 9
<212> PRT
<213> 智人
<400> 373
Ile Trp Asp Ala Leu Glu Arg Thr Phe
1 5
<210> 374
<211> 9
<212> PRT
<213> 智人
<400> 374
Met Ile Phe Ala Val Val Val Leu Phe
1 5
<210> 375
<211> 9
<212> PRT
<213> 智人
<400> 375
Tyr Tyr Ala Ala Asp Gln Trp Val Phe
1 5
<210> 376
<211> 9
<212> PRT
<213> 智人
<400> 376
Lys Tyr Val Gly Glu Val Phe Asn Ile
1 5
<210> 377
<211> 9
<212> PRT
<213> 智人
<400> 377
Ser Leu Trp Arg Glu Val Val Thr Phe
1 5
<210> 378
<211> 9
<212> PRT
<213> 智人
<400> 378
Val Tyr Ala Val Ile Ser Asn Ile Leu
1 5
<210> 379
<211> 9
<212> PRT
<213> 智人
<400> 379
Lys Leu Pro Thr Glu Trp Asn Val Leu
1 5
<210> 380
<211> 9
<212> PRT
<213> 智人
<400> 380
Phe Tyr Ile Arg Arg Leu Pro Met Phe
1 5
<210> 381
<211> 9
<212> PRT
<213> 智人
<400> 381
Ile Tyr Thr Asp Ile Thr Tyr Ser Phe
1 5
<210> 382
<211> 9
<212> PRT
<213> 智人
<400> 382
Ser Tyr Pro Lys Glu Leu Met Lys Phe
1 5
<210> 383
<211> 9
<212> PRT
<213> 智人
<400> 383
Pro Tyr Phe Ser Pro Ser Ala Ser Phe
1 5
<210> 384
<211> 9
<212> PRT
<213> 智人
<400> 384
Arg Thr Arg Gly Trp Val Gln Thr Leu
1 5
<210> 385
<211> 9
<212> PRT
<213> 智人
<400> 385
Gly Tyr Phe Gly Asn Pro Gln Lys Phe
1 5
<210> 386
<211> 9
<212> PRT
<213> 智人
<400> 386
Tyr Gln Ser Arg Asp Tyr Tyr Asn Phe
1 5
<210> 387
<211> 9
<212> PRT
<213> 智人
<400> 387
Thr His Ala Gly Val Arg Leu Tyr Phe
1 5
<210> 388
<211> 11
<212> PRT
<213> 智人
<400> 388
Leu Phe His Pro Glu Asp Thr Gly Gln Val Phe
1 5 10
<210> 389
<211> 9
<212> PRT
<213> 智人
<400> 389
Ala Tyr Ser Glu Lys Val Thr Glu Phe
1 5
<210> 390
<211> 9
<212> PRT
<213> 智人
<400> 390
Lys Tyr Lys Asp Tyr Phe Pro Val Ile
1 5
<210> 391
<211> 9
<212> PRT
<213> 智人
<400> 391
Val Tyr Gly Glu Pro Arg Glu Leu Leu
1 5
<210> 392
<211> 9
<212> PRT
<213> 智人
<400> 392
Ser Tyr Glu Lys Val Ile Asn Tyr Leu
1 5
<210> 393
<211> 9
<212> PRT
<213> 智人
<400> 393
Ser Tyr Asn Asp Ala Leu Leu Thr Phe
1 5
<210> 394
<211> 9
<212> PRT
<213> 智人
<400> 394
Val Tyr Leu Pro Lys Ile Pro Ser Trp
1 5
<210> 395
<211> 9
<212> PRT
<213> 智人
<400> 395
Asn Tyr Glu Asp His Phe Pro Leu Leu
1 5
<210> 396
<211> 9
<212> PRT
<213> 智人
<400> 396
Ser Tyr Val Lys Val Leu His His Leu
1 5
<210> 397
<211> 9
<212> PRT
<213> 智人
<400> 397
Arg Met Pro Thr Val Leu Gln Cys Val
1 5
<210> 398
<211> 9
<212> PRT
<213> 智人
<400> 398
Gly Tyr Leu Gln Gly Leu Val Ser Phe
1 5
<210> 399
<211> 10
<212> PRT
<213> 智人
<400> 399
Val Trp Ser Asn Val Thr Pro Leu Lys Phe
1 5 10
<210> 400
<211> 9
<212> PRT
<213> 智人
<400> 400
Arg Tyr Leu Glu Lys Phe Tyr Gly Leu
1 5
<210> 401
<211> 8
<212> PRT
<213> 智人
<400> 401
Tyr Leu Glu Lys Phe Tyr Gly Leu
1 5
<210> 402
<211> 10
<212> PRT
<213> 智人
<400> 402
Thr Tyr Lys Tyr Val Asp Ile Asn Thr Phe
1 5 10
<210> 403
<211> 9
<212> PRT
<213> 智人
<400> 403
Leu Tyr Phe Glu Lys Gly Glu Tyr Phe
1 5
<210> 404
<211> 9
<212> PRT
<213> 智人
<400> 404
Ser Tyr Leu Lys Ala Val Phe Asn Leu
1 5
<210> 405
<211> 9
<212> PRT
<213> 智人
<400> 405
Asn Tyr Pro Lys Ser Ile His Ser Phe
1 5
<210> 406
<211> 9
<212> PRT
<213> 智人
<400> 406
Lys Tyr Leu Glu Lys Tyr Tyr Asn Leu
1 5
<210> 407
<211> 9
<212> PRT
<213> 智人
<400> 407
Arg Ile Leu Arg Phe Pro Trp Gln Leu
1 5
<210> 408
<211> 10
<212> PRT
<213> 智人
<400> 408
Val Trp Ser Asp Val Thr Pro Leu Thr Phe
1 5 10
<210> 409
<211> 9
<212> PRT
<213> 智人
<400> 409
Val Tyr Thr Phe Leu Ser Ser Thr Leu
1 5
<210> 410
<211> 9
<212> PRT
<213> 智人
<400> 410
Ile Tyr Ile Ser Asn Ser Ile Tyr Phe
1 5
<210> 411
<211> 9
<212> PRT
<213> 智人
<400> 411
Val Tyr Pro Pro Tyr Leu Asn Tyr Leu
1 5
<210> 412
<211> 10
<212> PRT
<213> 智人
<400> 412
Ser Thr Ile Arg Gly Glu Leu Phe Phe Phe
1 5 10
<210> 413
<211> 9
<212> PRT
<213> 智人
<400> 413
Arg Tyr Met Lys Lys Asp Tyr Leu Ile
1 5
<210> 414
<211> 9
<212> PRT
<213> 智人
<400> 414
Thr Asp Ser Ile His Ala Trp Thr Phe
1 5
<210> 415
<211> 9
<212> PRT
<213> 智人
<400> 415
Lys Tyr Glu Lys Ile Phe Glu Met Leu
1 5
<210> 416
<211> 10
<212> PRT
<213> 智人
<400> 416
Val Phe Met Lys Asp Gly Phe Phe Tyr Phe
1 5 10
<210> 417
<211> 9
<212> PRT
<213> 智人
<400> 417
Gly Tyr Ile Asp Lys Val Arg Gln Leu
1 5
<210> 418
<211> 12
<212> PRT
<213> 智人
<400> 418
Val His Phe Glu Asp Thr Gly Lys Thr Leu Leu Phe
1 5 10
<210> 419
<211> 9
<212> PRT
<213> 智人
<400> 419
Arg Tyr Val Phe Pro Leu Pro Tyr Leu
1 5
<210> 420
<211> 10
<212> PRT
<213> 智人
<400> 420
Val Tyr Glu Lys Asn Gly Tyr Ile Tyr Phe
1 5 10
<210> 421
<211> 9
<212> PRT
<213> 智人
<400> 421
Arg Tyr Ile Leu Glu Asn His Asp Phe
1 5
<210> 422
<211> 10
<212> PRT
<213> 智人
<400> 422
Val Trp Ser Asp Val Thr Pro Leu Asn Phe
1 5 10
<210> 423
<211> 9
<212> PRT
<213> 智人
<400> 423
Ile Tyr Pro Asp Val Thr Tyr Ala Phe
1 5
<210> 424
<211> 9
<212> PRT
<213> 智人
<400> 424
Val Gln Gln Trp Ser Val Ala Val Phe
1 5
<210> 425
<211> 9
<212> PRT
<213> 智人
<400> 425
Gly Tyr Ile Asp Asn Val Thr Leu Ile
1 5
<210> 426
<211> 9
<212> PRT
<213> 智人
<400> 426
Ser Val His Lys Ile Thr Ser Thr Phe
1 5
<210> 427
<211> 9
<212> PRT
<213> 智人
<400> 427
Val Tyr Phe Val Ala Pro Ala Lys Phe
1 5
<210> 428
<211> 9
<212> PRT
<213> 智人
<400> 428
Trp Tyr Val Asn Gly Val Asn Tyr Phe
1 5
<210> 429
<211> 11
<212> PRT
<213> 智人
<400> 429
Tyr Tyr Ser Lys Ser Val Gly Phe Met Gln Trp
1 5 10
<210> 430
<211> 9
<212> PRT
<213> 智人
<400> 430
Val Tyr Ile Ala Glu Leu Glu Lys Ile
1 5
<210> 431
<211> 9
<212> PRT
<213> 智人
<400> 431
Lys Thr Pro Thr Asn Tyr Tyr Leu Phe
1 5
<210> 432
<211> 9
<212> PRT
<213> 智人
<400> 432
Thr Arg Thr Gly Leu Phe Leu Arg Phe
1 5
<210> 433
<211> 9
<212> PRT
<213> 智人
<400> 433
Asn Tyr Thr Ser Leu Leu Val Thr Trp
1 5
<210> 434
<211> 9
<212> PRT
<213> 智人
<400> 434
Val Tyr Asp Thr Met Ile Glu Lys Phe
1 5
<210> 435
<211> 9
<212> PRT
<213> 智人
<400> 435
Ile Tyr Val Thr Gly Gly His Leu Phe
1 5
<210> 436
<211> 9
<212> PRT
<213> 智人
<400> 436
Lys Tyr Leu Gln Val Val Gly Met Phe
1 5
<210> 437
<211> 9
<212> PRT
<213> 智人
<400> 437
Val Phe Lys Ala Ser Lys Ile Thr Phe
1 5
<210> 438
<211> 8
<212> PRT
<213> 智人
<400> 438
Ser Tyr Ser Ser Cys Tyr Ser Phe
1 5
<210> 439
<211> 9
<212> PRT
<213> 智人
<400> 439
Val Tyr Ala Leu Lys Val Arg Thr Ile
1 5
<210> 440
<211> 9
<212> PRT
<213> 智人
<400> 440
Asn Tyr Gly Val Leu His Val Thr Phe
1 5
<210> 441
<211> 9
<212> PRT
<213> 智人
<400> 441
Asn Tyr Leu Val Asp Pro Val Thr Ile
1 5
<210> 442
<211> 9
<212> PRT
<213> 智人
<400> 442
Lys Tyr Leu Asn Ser Val Gln Tyr Ile
1 5
<210> 443
<211> 9
<212> PRT
<213> 智人
<400> 443
Val Phe Ile His His Leu Pro Gln Phe
1 5
<210> 444
<211> 9
<212> PRT
<213> 智人
<400> 444
Ile Tyr Leu Ser Asp Leu Thr Tyr Ile
1 5
<210> 445
<211> 9
<212> PRT
<213> 智人
<400> 445
Thr Tyr Ile Asp Thr Arg Thr Val Phe
1 5
<210> 446
<211> 9
<212> PRT
<213> 智人
<400> 446
Ile Tyr Gly Phe Phe Asn Glu Asn Phe
1 5
<210> 447
<211> 9
<212> PRT
<213> 智人
<400> 447
Glu Tyr Ile Arg Ala Leu Gln Gln Leu
1 5
<210> 448
<211> 10
<212> PRT
<213> 智人
<400> 448
Pro Phe Leu Pro Pro Ala Ala Cys Phe Phe
1 5 10
<210> 449
<211> 9
<212> PRT
<213> 智人
<400> 449
Gln Tyr Ile Glu Glu Leu Gln Lys Phe
1 5
<210> 450
<211> 9
<212> PRT
<213> 智人
<400> 450
Gln Tyr Asp Pro Thr Pro Leu Thr Trp
1 5
<210> 451
<211> 9
<212> PRT
<213> 智人
<400> 451
Phe Gly Leu Ala Arg Ile Tyr Ser Phe
1 5
<210> 452
<211> 9
<212> PRT
<213> 智人
<400> 452
Val Tyr Lys Asp Ser Ile Tyr Tyr Ile
1 5
<210> 453
<211> 9
<212> PRT
<213> 智人
<400> 453
Tyr Tyr Thr Val Arg Asn Phe Thr Leu
1 5
<210> 454
<211> 9
<212> PRT
<213> 智人
<400> 454
Thr Leu Pro Asn Thr Ile Tyr Arg Phe
1 5
<210> 455
<211> 9
<212> PRT
<213> 智人
<400> 455
Lys Tyr Leu Ser Ile Pro Thr Val Phe
1 5
<210> 456
<211> 13
<212> PRT
<213> 智人
<400> 456
Pro Tyr Asp Pro Ala Leu Gly Ser Pro Ser Arg Leu Phe
1 5 10
<210> 457
<211> 9
<212> PRT
<213> 智人
<400> 457
Leu Ile Phe Met Leu Ala Asn Val Phe
1 5
<210> 458
<211> 10
<212> PRT
<213> 智人
<400> 458
Asp Tyr Leu Asn Glu Trp Gly Ser Arg Phe
1 5 10
<210> 459
<211> 8
<212> PRT
<213> 智人
<400> 459
Ser Tyr Glu Val Arg Ser Thr Phe
1 5
<210> 460
<211> 9
<212> PRT
<213> 智人
<400> 460
Val Tyr Pro Trp Leu Gly Ala Leu Leu
1 5
<210> 461
<211> 10
<212> PRT
<213> 智人
<400> 461
Glu Leu Ala Gly Ile Gly Ile Leu Thr Val
1 5 10
<210> 462
<211> 9
<212> PRT
<213> 智人
<400> 462
Tyr Leu Leu Pro Ala Ile Val His Ile
1 5
<210> 463
<211> 9
<212> PRT
<213> 智人
<400> 463
Val Gly Gly Asn Val Thr Ser Asn Phe
1 5
<210> 464
<211> 9
<212> PRT
<213> 智人
<400> 464
Val Gly Gly Asn Val Thr Ser Ser Phe
1 5
- A*01限制肽和肽组合物在抗癌免疫治疗中的用途和相关方法
- B*07限制肽和肽组合的抗癌免疫治疗和相关方法
