表征疾病活动性的系统性红斑狼疮(SLE)疾病活动性免疫指数的生物标志物
文献发布时间:2023-06-19 12:02:28
技术领域
本发明总体涉及用于计算表征系统性红斑狼疮(SLE)的疾病活动性的狼疮疾病活动性免疫指数的生物标志物的领域。
联邦资助研究的声明
不适用。
对序列表的引用
不适用。
背景技术
在不限制本发明范围的情况下,结合系统性红斑狼疮(SLE)描述了其背景。
包括SLE在内的系统性自身免疫疾病对很大一部分美国人口造成困扰。近期基于人口的研究反映出73/100,000的患病率(1、2),而美国狼疮基金会估计常规临床实践中可能的SLE患者人数高达470/100,000。SLE呈现出一系列临床症状;疾病分类取决于是否满足11项美国风湿病学会(ACR)标准中的4项(3、4)。超过90%的受影响患者是15-45岁的女性。少数族裔人口患病率较高并且社会经济地位较低(5)。持续活跃性临床疾病及其治疗使患者处于器官损伤的风险中(6-8),包括中枢神经系统、肺、心血管和肾损伤(9-12)、狼疮性肾炎和终末期肾病(11、13)。患有渐增/渐减(waxing/waning)疾病和临床活跃性或静止性疾病的患者各自处于临床疾病突发的风险中(14、15)。
SLE是临床和血清学异质性系统性自身免疫疾病,其导致显著的发病率和早期死亡率,尤其是在年轻女性和少数族裔中。致病性自身抗体和慢性炎症形式的免疫失调导致广泛多种临床表现,包括皮疹、关节炎和威及生命的肾和/或中枢神经系统损伤。已经显示在SLE患者中积累了许多抗核自身抗体(ANA)特异性;羟氯喹的使用可消除自身抗体积累并抵消临床疾病活动性。早期干预是有吸引力的SLE治疗方法。然而,我们对SLE疾病活动性的致病机制了解不足。弥合这一知识缺口将提高我们鉴定处于增加的疾病活动性和永久性器官损伤风险的个体的能力,限定早期干预的机会窗口,并促进途径靶向性治疗的开发。
识别并早期治疗以预防组织和器官损伤具有挑战性,因为高疾病活动性的体征和症状在其出现后才被捕获。尽管存在经过验证的临床疾病活动性仪器(16-18)和改善的治疗策略,但持续活跃性疾病仍然是SLE患者的负担(19)。与管理活跃性疾病所需的治疗(尤其是类固醇(20-23))相关的增加的发病率和早期死亡率以及永久性器官损伤(24、25)(包括肾损伤(26))进一步使费用上涨。此外,类固醇(23)和管理疾病活动性所需的其他免疫抑制剂(27)的长期使用与增加的发病率相关。无法积极主动地管理临床疾病使医疗护理局限于反应性治疗,从而阻碍了添加或增加类固醇节用性(steroid-sparing)免疫调节剂以防止终末器官损伤(6-8)并减轻SLE的致病和社会经济负担(29)的积极主动策略(28)。
目前SLE中的生物标志物在预测永久性器官损伤方面的实用性有限。尽管SLE患者中积累了SLE相关自身抗体特异性,诸如抗dsDNA、抗剪接体和抗Ro/SSA,但它们的存在不足以预测持续活跃性疾病和永久性器官损伤的进展。ANA还存在于来自患有其他系统性风湿病的患者,以及未继续发展为SLE的健康个体(包括SLE患者的一些未受影响的家庭成员),以及高达14%的总人口的血清中。由于个体在为ANA阳性时仍可保持健康,所以仅ANA阳性可能不是SLE的唯一致病性驱动因素。除ANA阳性外,由可溶性介质驱动的各种免疫途径的失调也可促进临床疾病的发展。任何单一因素或机制可能不足以解释SLE发病机理的复杂性和异质性;因此,有必要采用多变量的纵向方法来描述早期疾病发病机理的机制并辨别预测SLE分类的独特参数。
尽管存在多种针对性免疫途径治疗(包括50多年来首个经FDA批准的SLE药物贝利单抗(Belimumab)(30))的临床试验,但绝大多数这些研究还是失败了,部分原因是缺乏对在给定患者中失调的免疫途径的了解。对于作为临床疾病活动性的替代终点的提供免疫信息的(immune-informed)生物标志物的需求日益迫切。行政负担限制了经过验证的SLE临床疾病活动性测量在常规实践中的使用(31)。经过验证的疾病活动性仪器,诸如目前使用的混合系统性红斑狼疮疾病活动性指数(hSLEDAI)(32、33)和不列颠群岛狼疮评估组(BILAG)指数(17),是劳动密集型的并且因为这些临床仪器的更新而需要持续的专门培训(34)。仅依靠医生的经验来评估临床疾病活动性会带来不希望的变化性和不幸结果的风险(31、35)。
SLE的临床异质性是根据以下科学前提:异质性免疫失调是临床疾病活动性的基础。发明人先前已经表明,患者在临床SLE发作之前表现出免疫失调,其随着患者遭受组织损伤、发展临床后遗症并最终达到疾病分类而以前馈机制放大(36、37)。发明人还描述了多种SLE相关自身抗体(AutoAb)的积累以及失调的炎性和调节性免疫途径(36、37)。然而,迄今为止,SLE中提供免疫机制信息的疾病管理测试的缺乏源于没有充当同时或未来临床疾病活动性的通用替代物的提供免疫途径信息的单独生物标志物(38)。
因此,仍然需要用于检测、跟踪和评估具有分类SLE的患者的疾病活动性和进展的新型方法。
发明内容
在一个实施方案中,本发明包括一种用于表征系统性红斑狼疮(SLE)患者的疾病活动性的方法,其包括:(a)获得与来自患者的血液、血清、血浆或尿液样品相关的数据集,其中数据集包括来自(b)至(g)中的每一个的代表血液、血清、血浆或尿液样品中的一种或多种生物标志物的水平的数据;(b)评估选自以下的至少一种固有性血清或血浆介质生物标志物的蛋白质表达的存在或量的数据集:IL-1α、IL-1β、IL-1RA、IFN-α、IL-12p70、IL-6和IL-23p19;(c)评估选自以下的至少一种适应性血清或血浆介质生物标志物的蛋白质表达的存在或量的数据集:IL-2、IFN-γ、IL-5、IL-13、IL-17A、IL-21、IL-10和TGF-β;(d)评估选自以下的至少一种趋化因子/粘附分子生物标志物的存在或量的数据集:IL-8/CXCL8、IP-10/CXCL10、MIG/CXCL9、MIP-1α/CCL3、MIP-1β/CCL4、MCP-1/CCL2、MCP-3/CCL7和ICAM-1;(e)评估选自以下的至少一种可溶性TNF超家族生物标志物的存在或量的数据集:TNFRI、TNFRII、TRAIL、TWEAK、CD40L/CD154、BLyS和APRIL;(f)评估炎性介质生物标志物干细胞因子(SCF)的存在或量的数据集;(g)评估选自以下的至少一种SLE相关自身抗体特异性生物标志物的存在或量的数据集:dsDNA、染色质、RiboP、Ro/SSA、La/SSB、Sm、SmRNP和RNP;以及(h)计算狼疮疾病活动性免疫指数(LDAII)评分。在一个方面,在LDAII的计算中使用至少7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38或39种生物标志物。在另一方面,对数据集进行:对数变换;标准化;通过与第二数据集中的自身抗体特异性的Spearman r相关性进行加权;并且可溶性蛋白标志物的总和等于LDAII评分。在另一方面,至少一种免疫测定的执行包括:获得第一样品,其中第一样品包含蛋白质标志物;使第一样品与多种不同的试剂接触;在试剂与标志物之间生成多种不同的复合物;以及检测复合物以生成数据。在另一方面,至少一种免疫测定包括多重测定。在另一方面,LDAII将SLE的严重程度或进展的水平分为临床活跃性(CA)或静止性(CQ)疾病,所述疾病是血清学(dsDNA结合和低补体)活跃性(SA)或血清学静止性(SQ)疾病。在另一方面,LDAII评分区分开活跃性与低狼疮疾病活动性。在另一方面,所述方法还包括在确定患者具有转变为分类SLE的预后之后,在达到临床疾病分类之前向患者施用治疗,其中治疗包括以下中的至少一种:羟氯喹(HCQ)、贝利单抗、非类固醇抗炎药、类固醇或改善疾病的抗风湿药(DMARD)。
在另一个实施方案中,本发明包括一种评估患者的系统性红斑狼疮(SLE)临床疾病的疾病活动性和进展的方法,其包括:从患者中获得血液、血清、血浆或尿液样品;对来自患者的样品执行至少一种免疫测定,以生成来自(1)至(6)中的每一个的包括至少一种生物标志物的数据集:(1)评估选自以下的至少一种固有性血清或血浆介质生物标志物的蛋白质表达的存在或量的数据集:IL-1α、IL-1β、IL-1RA、IFN-α、IL-12p70、IL-6和IL-23p19;(2)评估选自以下的至少一种适应性血清或血浆介质生物标志物的蛋白质表达的存在或量的数据集:IL-2、IFN-γ、IL-5、IL-13、IL-17A、IL-21、IL-10和TGF-β;(3)评估选自以下的至少一种趋化因子/粘附分子生物标志物的存在或量的数据集:IL-8/CXCL8、IP-10/CXCL10、MIG/CXCL9、MIP-1α/CCL3、MIP-1β/CCL4、MCP-1/CCL2、MCP-3/CCL7和ICAM-1;(4)评估选自以下的至少一种可溶性TNF超家族生物标志物的存在或量的数据集:TNFRI、TNFRII、TRAIL、TWEAK、CD40L/CD154、BLyS和APRIL;(5)评估炎性介质生物标志物SCF的存在或量的数据集;以及(6)评估选自以下的至少一种SLE相关自身抗体特异性生物标志物的存在或量的数据集:dsDNA、染色质、RiboP、Ro/SSA、La/SSB、Sm、SmRNP和RNP;以及计算LDAII评分。在一个方面,在LDAII的计算中使用至少7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38或39种生物标志物。在另一方面,对数据集进行:对数变换;标准化;通过与第二数据集中的自身抗体特异性的Spearman r相关性进行加权;并且可溶性蛋白标志物的总和等于狼疮疾病活动性免疫指数(LDAII)评分。在另一方面,至少一种免疫测定的执行包括:获得第一样品,其中第一样品包含蛋白质标志物;使第一样品与多种不同的试剂接触;在试剂与标志物之间生成多种不同的复合物;以及检测复合物以生成数据。在另一方面,至少一种免疫测定包括多重测定。在另一方面,LDAII将SLE的严重程度或进展的水平分为临床活跃性(CA)或静止性(CQ)疾病,所述疾病是血清学(dsDNA结合和低补体)活跃性(SA)或血清学静止性(SQ)疾病。在另一方面,LDAII评分区分开活跃性与低狼疮疾病活动性。在另一方面,所述方法还包括在确定患者具有转变为分类SLE的预后之后,在达到临床疾病分类之前向SLE患者施用治疗,其中治疗包括以下中的至少一种:羟氯喹(HCQ)、贝利单抗、非类固醇抗炎药、类固醇或改善疾病的抗风湿药(DMARD)。在另一方面,获得与样品相关的第一数据集包括获得样品并处理样品以便以实验方式确定第一数据集,或其中获得与样品相关的第一数据集包括从已经处理样品以便以实验方式确定第一数据集的第三方接收第一数据集。在另一方面,SCF、TNFRII和MCP-1生物标志物的增加指示肾器官受累。
在另一个实施方案中,本发明包括一种通过测量受试者的一组生物标志物的表达水平来计算狼疮疾病活动性免疫指数(LDAII)的方法,其包括:通过免疫测定在生理样品中确定一组生物标志物的生物标志物测量值,其中生物标志物是肽、蛋白质、携带翻译后修饰的肽、携带翻译后修饰的蛋白质,或其组合;其中生理样品是全血、血浆、血清或其组合;其中所述生物标志物组包括选自各类生物标志物中的至少一种的测量结果的数据集,其选自:至少一种固有性血清或血浆介质生物标志物的蛋白质表达的存在或量的数据集,所述生物标志物选自:IL-1α、IL-1β、IL-1RA、IFN-α、IL-12p70、IL-6和IL-23p19;至少一种适应性血清或血浆介质生物标志物的蛋白质表达的存在或量的数据集,所述生物标志物选自:IL-2、IFN-γ、IL-5、IL-13、IL-17A、IL-21、IL-10和TGF-β;至少一种趋化因子/粘附分子生物标志物的存在或量的数据集,所述生物标志物选自:IL-8/CXCL8、IP-10/CXCL10、MIG/CXCL9、MIP-1α/CCL3、MIP-1β/CCL4、MCP-1/CCL2、MCP-3/CCL7和ICAM-1;至少一种可溶性TNF超家族生物标志物的存在或量的数据集,所述生物标志物选自:TNFRI、TNFRII、TRAIL、TWEAK、CD40L/CD154、BLyS和APRIL;炎性介质生物标志物SCF的存在或量;以及至少一种SLE相关自身抗体特异性生物标志物的存在或量的数据集,所述生物标志物选自:dsDNA、染色质、RiboP、Ro/SSA、La/SSB、Sm、SmRNP和RNP;以及计算LDAII评分,由此对数据集进行:对数变换;标准化;通过与第二数据集中的自身抗体特异性的Spearman r相关性进行加权,并且可溶性蛋白标志物的总和等于LDAII评分。在另一方面,所述方法还包括在分类系统中使用生物标志物测量值集合在受试者中相对于系统性红斑狼疮(SLE)的存在或发展将样品分类为临床活跃性(CA)或静止性(CQ)疾病,所述疾病为血清学(dsDNA结合和低补体)活跃性(SA)或血清学静止性(SQ)疾病,其中分类系统是机器学习系统,其包括选自由以下组成的组的分类和回归树:Fisher精确检验、Mann-Whitney检验、Kruskal-Wallis检验、Kruskal-Wallis检验与Dunn多重比较、Spearman等级相关或其系综(ensemble);以及计算狼疮疾病活动性免疫指数(LDAII),其中LDAII评分区分开活跃性SLE与低SLE疾病活动性(低度临床疾病(SLEDAI<4))。在另一方面,所述方法还包括与健康对照相比区分临床和血清学静止性(CQSQ)SLE患者。在另一方面,所述方法还包括在LDAII的计算中使用一定量的至少7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38或39种生物标志物。在另一方面,免疫测定是多重免疫测定。在另一方面,LDAII进一步计算如下:确定受试者的生物标志物浓度并对其进行对数变换,并且对针对受试者样品确定的每个对数变换的可溶性介质水平如下进行标准化:(观察值)-(所有SLE患者和健康对照随访者(visits)的平均值)/(所有SLE患者和健康对照随访者的标准差);由线性回归模型生成Spearman系数,所述模型测试与健康对照相比,在SLE患者中评估的一种或多种自身抗体(AutoAb)特异性针对各可溶性介质之间的关联(Spearman r);将受试者的可溶性介质水平的值变换并标准化,并将值通过(乘以)其相应的Spearman系数(Spearmanr)进行加权;并且对于每名参与随访者,将四种或更多种可溶性介质中的每一种的对数变换、标准化且加权的值相加,以计算LDAII。在另一方面,LDAII的增加指示以下中的至少一个:SLE疾病进展、自身免疫疾病活动性增加或器官损伤。
附图说明
为了更完整地理解本发明的特征和优点,现在连同附图参考具体实施方式,并且在附图中:
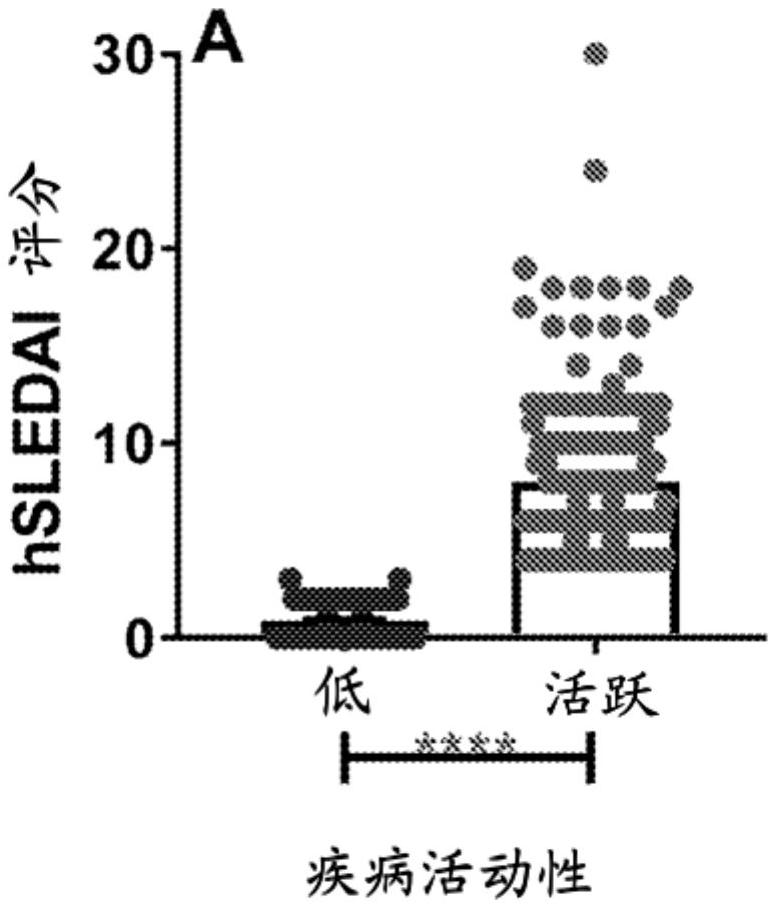
图1A和1B示出具有活跃性疾病的SLE患者中增加的hSLEDAI和AutoAb特异性数量。(图1A)具有低度(hSLEDAI<4;n=132)和活跃性(hSLEDAI≥4;n=179)疾病的SLE患者随访者中的混合SLEDAI(SELENAI-SLEDAI,伴蛋白尿,如通过SLEDAI-2K所限定);平均值±SEM,p<0.0001,通过非配对t检验。(图1B)具有低度或活跃性疾病的SLE患者相对于相匹配的健康对照(Ctls;n=48)中的SLE相关AutoAb特异性的数量(针对dsDNA、染色质、Ro/SSA、La/SSB、Sm、SmRNP和RNP的抗体)。水平表示为平均值±SEM。**p<0.01;****p<0.0001,通过Kruskal-Wallis检验与Dunn多重比较。
图2A至2I示出SLE低度相对于活跃性疾病和对照中的改变的可溶性介质。将随访期间具有低(n=132)疾病活动性的SLE患者的血浆样品与随访期间获取的具有活跃性疾病的SLE患者样品(n=179)相对于相匹配的对照(n=48)进行比较。所检查的因子包括:(图2A)IFN-α、(图2B)IP-10、(图2C)IL-6、(图2D)IL-1α、(图2E)IL-8、(图2F)IL-21、(图2G)BLyS、(图2H)IL-10和(图2I)总TGF-β。水平表示为平均值±SEM。*p<0.05;**p<0.01,***p<0.001,***p<0.0001,通过Kruskal-Wallis检验与Dunn多重比较。
图3A至3D示出随疾病活动性/AutoAb阳性改变的IFN相关介质。将具有AutoAb阴性(Neg)/低疾病活动性(Low)的SLE患者随访者样品(n=56)与AutoAb Neg/活跃性疾病(Active;n=52)、AutoAb阳性(Pos)/Low(n=76)和AutoAb Pos/Active样品相比较。另外将SLE患者样品与相匹配的对照样品(n=48)相比较。所检查的因子包括:(图3A)IFN-α、(图3B)IFN-γ、(图3C)IP-10和(图3D)MIG。水平表示为平均值±SEM*p<0.05;**p<0.01,***p<0.001,***p<0.0001,通过Kruskal-Wallis检验与Dunn多重比较。通过Mann-Whitney检验将病例(SLE患者组)与对照相比较。
图4A至4D示出随疾病活动性/AutoAb阳性改变的TNF超家族介质。将具有AutoAb阴性(Neg)/低疾病活动性(Low)的SLE患者随访者样品(n=56)与AutoAb Neg/活跃性疾病(Active;n=52)、AutoAb阳性(Pos)/Low(n=76)和AutoAb Pos/Active样品相比较。另外将SLE患者样品与相匹配的对照样品(n=48)相比较。所检查的因子包括:(图4A)BLyS、(图4B)APRIL、(图4C)TRAIL和(图4D)TNFRII。水平表示为平均值±SEM。*p<0.05;**p<0.01,***p<0.0001,通过Kruskal-Wallis检验与Dunn多重比较。通过Mann-Whitney检验将病例(SLE患者组)与对照相比较。
图5A至5D示出随疾病活动性/AutoAb阳性改变的固有性和适应性介质。将具有AutoAb阴性(Neg)/低疾病活动性(Low)的SLE患者随访者样品(n=56)与AutoAb Neg/活跃性疾病(Active;n=52)、AutoAb阳性(Pos)/Low(n=76)和AutoAb Pos/Active样品相比较。另外将SLE患者样品与相匹配的对照样品(n=48)相比较。所检查的因子包括:(图5A)IL-1a、(图5B)IL-6、(图5C)IL-2和(图5D)IL-21。水平表示为平均值±SEM;*p<0.05;**p<0.01,***p<0.0001,通过Kruskal-Wallis检验与Dunn多重比较。通过Mann-Whitney检验将病例(SLE患者组)与对照相比较。
图6A至6D示出随疾病活动性/AutoAb阳性改变的炎性和调节性介质。将具有AutoAb阴性(Neg)/低疾病活动性(Low)的SLE患者随访者样品(n=56)与AutoAb Neg/活跃性疾病(Active;n=52)、AutoAb阳性(Pos)/Low(n=76)和AutoAb Pos/Active样品相比较。另外将SLE患者样品与相匹配的对照样品(n=48)相比较。所检查的因子包括:(图6A)SCF、(图6B)IL-8、(图6C)IL-10和(图6D)总TGF-β。水平表示为平均值±SEM;*p<0.05;**p<0.01,***p<0.001,***p<0.0001,通过Kruskal-Wallis检验与Dunn多重比较。通过Mann-Whitney检验将病例(SLE患者组)与对照相比较。
图7A和7B示出狼疮疾病活动性免疫指数(LDAII)相对于对照区分具有低度和活跃性疾病的SLE患者。(图7A)相对于对照,针对具有低度或活跃性疾病的SLE患者计算LDAII。LDAII示出为平均值±SEM;*p<0.05;**p<0.01,***p<0.0001,通过Kruskal-Wallis检验与Dunn多重比较。(图7B)用于区分SLE患者(低度或活跃性疾病)与对照的曲线下面积(AUC)
图8A至8F示出狼疮疾病活动性免疫指数(LDAII)相对于对照区分具有临床和血清学活跃性相对于静止性疾病的SLE患者。(图8A)相对于对照,针对具有临床和血清学静止性(CQSQ;n=73)或临床和血清学活跃性(CASA;n=115)疾病的SLE患者计算LDAII。LDAII示出为平均值±SEM;*p<0.05;**p<0.01,***p<0.0001,通过Kruskal-Wallis检验与Dunn多重比较。(图8B)用于区分SLE患者(低度或活跃性疾病)与对照的曲线下面积(AUC)
图9A至9E示出狼疮疾病活动性免疫指数(LDAII)相比于低疾病活动性区分具有肾或非肾活跃性疾病的SLE患者。(图9A)相对于具有低疾病活动性的SLE患者随访者(n=132),针对具有肾(n=24)或非肾(n=155)活跃性疾病的SLE患者随访者计算LDAII。LDAII示出为平均值±SEM;*p<0.05;**p<0.01,***p<0.0001,通过Kruskal-Wallis检验与Dunn多重比较。(图9B)用于区分具有肾表现的SLE患者的曲线下面积(AUC)
具体实施方式
虽然下文详细论述本发明的各种实施方案的制备和使用,但应认识到,本发明提供许多可适用的发明构思,所述发明构思可以体现在广泛多种特定场合。本文论述的具体实施方案仅说明制备和使用本发明的特定方式并且不划定本发明范围的界限。
为了有助于理解本发明,在下文定义多个术语。本文定义的术语具有本发明相关领域中的普通技术人员通常所理解的含义。诸如“一个”、“一种”和“所述”之类的术语并非旨在仅指单一实体,而是包括一般类别,其具体实例可用于举例说明。本文的术语用于描述本发明的具体实施方案,但是它们的使用不限制本发明,除非在权利要求中概述。
发明人购买了从俄克拉荷马狼疮小组(Oklahoma Lupus Cohort)的系统性红斑狼疮(SLE)患者中连续收集的血浆样品,以与相匹配的健康对照相比,比较具有低度或活跃性疾病的SLE患者中自身抗体和来自多个免疫途径的免疫介质的水平,并确定它们之间的时间关系。本发明揭示了与临床疾病活动性相关的免疫发病机理的潜在机制,由此免疫介质的失调与自身抗体的积累同时发生且与其无关。此外,本发明包括设计和验证可靠且灵敏的工具,以评估与临床疾病活动性相关的狼疮患者的免疫状态。本发明可以用于在前瞻性的临床前干预研究中鉴定需要风湿病转诊和登记的高危患者,以及提供关于开发用以避免或延缓组织损伤的新型治疗策略的信息。
如本文所用,术语“数据集”是指在期望条件下由样品(或样品的群体)的评估得到的数值的集合。数据集的值可以,例如,通过以实验方式从诸如患者样品的样品中获得测量值并由这些测量结果建立数据集来获得。可替代地,可以从已存储数据集的数据库或服务器,或甚至服务提供方(诸如内部或第三方实验室)获得数据集。
如本文所用,在本发明的上下文中,术语“疾病”是指以例如引起例如SLE的功能失调或功能失常的免疫系统的形式表现出来的任何病症、病状、不适或病痛。
如本文所用,术语“样品”是指从受试者中分离的任何生物样品,其可以包括但不限于单个细胞或多个细胞、细胞片段、体液的等分试样、全血、血小板、血清、血浆、红细胞、白血细胞或白细胞、内皮细胞、组织活检物、滑液、淋巴液、腹水液以及间质或细胞外液。术语“样品”还涵盖细胞之间的空间中的流体,包括牙龈沟液、骨髓、脑脊液、唾液、粘液、痰、精液、汗液、尿液或任何其他体液。
如本文所用,术语“血液样品”是指全血或其任何级分,包括血细胞、红细胞、白血细胞或白细胞、血小板、血清和血浆。可以通过多种手段从受试者中获得样品,包括但不限于静脉穿刺、排泄、射精、按摩、活检、针吸、灌洗、刮拭、手术切口或干预或本领域已知的其他手段。
如本文所用,术语“受试者”或“患者”通常是指哺乳动物,包括但不限于人、非人灵长类动物、狗、猫、小鼠、大鼠、牛、马和猪,而不考虑性别或年龄。受试者可以是先前已被诊断或鉴定为患有自身免疫和/或炎性疾病,并且可能已经或正在进行针对自身免疫和/或炎性疾病的治疗性干预的受试者。然而,受试者还可以包括先前未诊断为患有自身免疫和/或炎性疾病的患者,例如,表现出自身免疫和/或炎性疾病的一种或多种症状或风险因素的受试者,或未表现出自身免疫和/或炎性疾病的症状或风险因素的受试者,或对于自身免疫和/或炎性疾病无症状的受试者。
如本文所用,短语“一种或多种固有性血清或血浆介质生物标志物”是指以下生物标志物中的一种或多种:IL-1α、IL-1β、IL-1RA、IFN-α、IL-15、IL-12p70、IL-6和IL-23pl9。这些生物标志物可以在RNA或蛋白质水平上测量,并且可以从样品中获得,所述样品例如来自作为哺乳动物的患者,例如人患者的血液、血清、血浆和/或尿液样品。本文使用的所有生物标志物的缩写是技术人员众所周知的,例如,IL-1是白介素-1等等。缩写可以与蛋白质相匹配,例如在www.genecards.org上。
如本文所用,短语“一种或多种适应性血清或血浆介质生物标志物”是指以下生物标志物中的一种或多种:IL-2、IFN-γ、IL-4、IL-5、IL-13、IL-17A、IL-21、IL-10和TGF-β。这些生物标志物可以在RNA或蛋白质水平上测量,并且可以从样品中获得,所述样品例如来自作为哺乳动物的患者,例如人患者的血液、血清、血浆和/或尿液样品。
如本文所用,短语“一种或多种趋化因子生物标志物”是指以下生物标志物中的一种或多种:IL-8/CXCL8、IP-10/CXCL10、MIG/CXCL9、MIP-lα/CCL3、MIP-lβ/CCL4、MCP-1/CCL2和MCP-3/CCL7。这些生物标志物可以从样品中测量,所述样品例如来自作为哺乳动物的患者,例如人患者的血液、血清、血浆和/或尿液样品。
如本文所用,短语“一种或多种可溶性TNF超家族生物标志物”是指以下生物标志物中的一种或多种:TNF-α、TNFRI、TNFRII、Fas、CD40L/CD154、BLyS和APRIL或肿瘤坏死因子配体超家族成员13(TNFSF13)。这些生物标志物可以在RNA或蛋白质水平上测量,并且可以从样品中获得,所述样品例如来自作为哺乳动物的患者,例如人患者的血液、血清、血浆和/或尿液样品。
如本文所用,短语“一种或多种炎性介质生物标志物”是指以下生物标志物中的一种或多种:干细胞因子(SCF)、纤溶酶原激活物抑制剂1(PAI-1)和抵抗素(Resistin)。这些生物标志物可以在RNA或蛋白质水平上测量,并且可以从样品中获得,所述样品例如来自作为哺乳动物的患者,例如人患者的血液、血清、血浆和/或尿液样品。
如本文所用,短语“一种或多种SLE相关自身抗体特异性生物标志物”是指作为针对以下靶标的自身抗体的以下生物标志物中的一种或多种:dsDNA、染色质、RiboP、Ro/SSA、La/SSB、Sm、SmRNP和RNP,所有这些都是SLE领域的技术人员众所周知的。这些生物标志物可以在RNA或蛋白质水平上测量,并且可以从样品中获得,所述样品例如来自作为哺乳动物的患者,例如人患者的血液、血清、血浆和/或尿液样品。
如本文所用,“健康对照”是指没有SLE临床证据的不是SLE患者的健康对照。
本发明包括用于鉴定SLE患者并改变其治疗的方法,所述SLE患者与如通过狼疮国家评估中的雌激素的安全性-系统性红斑狼疮疾病活动性指数(Safety of Estrogens inLupus National Assessment-Systemic Lupus Erythematosus Disease ActivityIndex,SELENA-SLEDAI,伴蛋白尿,如通过SLEDAI-2K所定义,称为混合SLEDAI(hSLEDAI))所定义的临床疾病活动性相关联。由于SLE的临床表现在其出现后导致hSLEDAI中的疾病活动性,因此本发明用于确定受试者是否可表现出可导致使SLE患者处于永久性器官损伤和早期死亡风险中的疾病活动性的生物标志物。
按照用于SLE分类的ACR标准,患者必须满足至少4项针对SLE的ACR标准才能达到疾病分类(诊断),包括:蝶形皮疹、盘状皮疹、阳光过敏、口腔溃疡、关节炎、浆膜炎(胸膜炎或心包炎)、肾病症(蛋白尿或细胞管型)、神经系统病症(癫痫发作或精神病)、血液系统病症(溶血性贫血、白细胞减少、淋巴细胞减少或血小板减少)、免疫病症(抗DNA、抗Sm或抗磷脂抗体)以及阳性ANA(HEp-2IIF测定)。如技术人员已知的,还可使用其他标准,例如,使用系统性狼疮国际合作诊所(SLICC)的SLE分类规则,患者必须满足至少4项标准,包括至少一项临床标准和一项免疫学标准,或患者必须在抗核抗体或抗双链DNA抗体的存在下经活检证实患有狼疮性肾炎。
生物标志物检测。存在多种可以用于评估蛋白质表达的方法。一种这样的方法是使用抗体进行蛋白质鉴定。
如本文所用,术语“抗体”广义上是指任何免疫结合剂,诸如IgG、IgM、IgA、IgD和IgE抗体或其亚类,或其结合片段,包括单链片段。通常,使用IgG和/或IgM,因为它们是生理情况下最常见的抗体并且是在实验室环境中通常且容易制备的。如本文所用,术语“抗体片段”是指具有抗原结合区的任何抗体样分子,并且包括抗体片段,诸如Fab'、Fab、F(ab')
根据本发明,提供了免疫检测方法的实例。举几个例子,一些免疫检测方法包括酶联免疫吸附测定(ELISA)、放射免疫测定(RIA)、免疫放射测定、荧光免疫测定、化学发光测定、生物发光测定以及蛋白质印迹。各种有用的免疫检测方法的步骤在科学文献CurrentProtocols in Immunology,Wiley&Sons Press,2017中已有描述,相关部分通过引用并入本文。
通常,免疫结合方法包括获得怀疑包含相关多肽的样品,并在有效允许形成免疫复合物的条件下使样品与第一抗体接触。就抗原检测而言,所分析的生物样品可以是怀疑包含抗原的任何样品,例如组织切片或试样、均质化组织提取物、细胞或甚至生物流体。
使所选择的生物样品与抗体在有效条件下接触并持续足以允许形成免疫复合物(初级免疫复合物)的时间段总体上是这样一件事:简单地将抗体组合物添加到样品中,并且孵育混合物足够长的时间段,以便抗体与所存在的任何抗原形成免疫复合物(即,与所述抗原结合)。这段时间之后,通常将洗涤样品-抗体组合物,诸如组织切片、ELISA板、斑点印迹或蛋白质印迹,以除去任何非特异性结合的抗体种类,从而仅仅允许检测特异性结合在初级免疫复合物内的那些抗体。
一般来说,免疫复合物形成的检测在本领域是众所周知的并且可通过应用多种方法实现。这些方法通常基于标记或标志物的检测,诸如那些放射性、荧光、生物和酶标签中的任一种。关于此类标记的使用的专利包括美国专利3,817,837;3,850,752;3,939,350;3,996,345;4,277,437;4,275,149和4,366,241,其各自通过引用并入本文。当然,通过使用如本领域已知的二级结合配体诸如第二抗体和/或生物素/抗生物素蛋白配体结合安排,可发现另外的优点。
在检测中可以采用的抗体或其结合片段本身可与可检测标记连接,其中然后将简单地检测此标记,从而允许确定组合物中初级免疫复合物的量。可替代地,变得结合在初级免疫复合物内的第一抗体可通过对抗体具有结合亲和力的第二结合配体来检测。在这些情况下,第二结合配体可与可检测标记连接。第二结合配体本身常常是抗体,因此它可被称为“二级”抗体。使初级免疫复合物与标记的二级结合配体或抗体在有效条件下接触并持续足以允许形成次级免疫复合物的时间段。然后通常洗涤二级免疫复合物以除去任何非特异性结合的标记的二级抗体或配体,并且接着检测二级免疫复合物中的其余标记。
另外的方法包括通过两步方法检测初级免疫复合物。如上文所述,使用对抗体具有结合亲和力的第二结合配体诸如抗体来形成二级免疫复合物。洗涤之后,使二级免疫复合物与对第二抗体具有结合亲和力的第三结合配体或抗体再次在有效条件下接触并持续足以允许形成免疫复合物(三级免疫复合物)的时间段。使第三配体或抗体与可检测标记连接,以允许检测因此形成的三级免疫复合物。如果期望,此系统可提供信号放大。
一种免疫检测方法使用两种不同的抗体。将第一步骤生物素化的单克隆或多克隆抗体用于检测一种或多种靶抗原,并且然后将第二步骤抗体用于检测连接于复合生物素的生物素。在所述方法中,待测试的样品首先在包含第一步骤抗体的溶液中孵育。如果存在靶抗原,则一些抗体结合抗原以形成生物素化的抗体/抗原复合物。然后通过在链霉抗生物素蛋白(或抗生物素蛋白)、生物素化的DNA和/或互补的生物素化的DNA的连续溶液中孵育来扩增抗体/抗原复合物,其中每个步骤将另外的生物素位点添加到抗体/抗原复合物中。重复扩增步骤直到实现合适水平的扩增,此时将样品在包含针对生物素的第二步骤抗体的溶液中孵育。此第二步骤抗体例如用酶标记,所述酶可以通过使用发色团底物的组织酶学用于检测抗体/抗原复合物的存在。在合适扩增的情况下,可以产生肉眼可见的缀合物。
另一种已知的免疫检测方法利用免疫-PCR(聚合酶链反应)方法。PCR方法类似于Cantor方法,直至与生物素化的DNA一起孵育,然而,DNA/生物素/链霉抗生物素蛋白/抗体复合物用释放抗体的低pH或高盐缓冲液洗掉,而不是使用多轮链霉抗生物素蛋白和生物素化的DNA孵育。然后将所得的洗涤溶液用于执行采用合适引物且处于适当控制下的PCR反应。至少在理论上,PCR的巨大扩增能力和特异性可以用于检测单个抗原分子。
如上文所详述,免疫测定本质上是结合测定。某些免疫测定是本领域已知的各种类型的ELISA和RIA。然而,将容易理解的是,检测不限于此类技术,并且也可使用蛋白质印迹、斑点印迹、FACS分析等。
在一种示例性ELISA中,将本发明的抗体固定到表现出蛋白质亲和性的选定表面上,诸如聚苯乙烯微量滴定板中的孔。然后,将怀疑包含抗原的测试组合物(诸如临床样品)添加到孔中。在结合并洗涤以除去非特异性结合的免疫复合物后,可检测结合的抗原。通常通过添加与可检测标记连接的另一抗体来实现检测。这种类型的ELISA是简单的“夹心ELISA”。还可通过添加第二抗体,随后添加对第二抗体具有结合亲和力的第三抗体来实现检测,其中第三抗体与可检测标记连接。
在另一种示例性ELISA中,将怀疑包含抗原的样品固定到孔表面上,然后使其与本发明的抗ORF信息和抗ORF翻译产物抗体接触。在结合并洗涤以除去非特异性结合的免疫复合物后,检测结合的抗ORF信息和抗ORF翻译产物抗体。当初始抗ORF信息和抗ORF翻译产物抗体与可检测标记连接时,可直接检测免疫复合物。同样,可使用对第一抗ORF信息和抗ORF翻译产物抗体具有结合亲和力的第二抗体来检测免疫复合物,其中第二抗体与可检测标记连接。
其中固定抗原的另一类型的ELISA涉及在检测中使用抗体竞争。在此ELISA中,将针对抗原的标记抗体添加至孔,使其结合,并通过其标记进行检测。然后通过在与包被的孔孵育期间将样品与针对抗原的标记抗体混合来确定未知样品中抗原的量。样品中抗原的存在用于降低可用于与孔结合的抗原的抗体的量,并从而降低最终信号。这也适用于检测未知样品中抗原的抗体,其中未标记抗体与抗原包被的孔结合,并且还降低可用于结合标记抗体的抗原的量。
如本文所用,短语“在有效允许免疫复合物(抗原/抗体)形成的条件下”是指还可包括用溶液(诸如BSA、牛丙种球蛋白(BGG)或磷酸盐缓冲盐水(PBS)/Tween)对抗原和/或抗体进行稀释的那些条件,在所述条件下,抗体或其结合片段与作为抗体的特异性靶标的抗原相互作用。这些添加的剂还倾向于有助于降低非特异性背景。“合适的”条件使得孵育在足以允许有效结合的温度下或时间段内进行。孵育步骤通常为约1至2至4小时左右,温度优选约25℃,或可在约4℃左右过夜。
用以评估生物标志物表达的另一基于抗体的方法是荧光活化细胞分选(Fluorescence-Activated Cell Sorting,FACS),其为专业型的流式细胞术。它提供了用于基于每个细胞的特定光散射和荧光特征将生物细胞的异质性混合物分选到两个或更多个容器中的方法,每次一个细胞。它提供来自单独细胞的荧光信号的快速、客观和定量记录以及特别感兴趣的细胞的物理分离。细胞悬浮液夹带在狭窄、快速流动的液体料流的中心。流动被布置成使得细胞之间相对于它们的直径存在大的间隔。振动机制使细胞料流破裂成单独的液滴。对系统进行调整,使得每个液滴多于一个细胞的概率很低。就在料流破裂成液滴之前,所述流通过荧光测量站,在那里测量每个细胞的目标荧光特征。将充电环恰好置于料流破裂成液滴的位置。基于紧临之前的荧光强度测量,在环上放置电荷,并且当液滴从料流中破裂时,相反的电荷被捕捉在所述液滴上。然后带电的液滴通过静电偏转系统落下,所述系统基于其电荷将液滴转移到容器中。在一些系统中,电荷直接施加至料流,并且破裂的液滴保留与料流相同符号的电荷。在液滴破裂后,料流则回到中性。使用FACS的一种常见方式是使用荧光标记的抗体,其与细胞上或细胞中的靶标结合,从而鉴定具有给定靶标的细胞。此技术可以定量地使用,其中荧光活性的量与靶标的量相关,从而允许人们基于荧光的相对量以及因此靶标的相对量进行分选。
基于珠粒的xMAP技术也可结合目前要求保护的发明应用于免疫学检测。此技术将先进的流体、光学和数字信号处理与专有的微球技术组合,以实现多重测定能力。以灵活的开放式架构设计为特色的xMAP技术可以被配置用于快速、成本有效且准确地执行广泛多种生物测定。
荧光编码的微球以最多至500个不同的组排列。每个珠粒组可以包被有对特定生物测定具有特异性的试剂(例如抗体),从而允许捕获和检测来自样品的特定分析物,诸如本申请的生物标志物。在xMAP多重分析仪内部,光源激发鉴定每个微球颗粒的内部染料,以及在测定过程中捕获的任何报告染料。在每个珠粒组上进行多次读取,这进一步验证结果。使用此过程,xMAP技术允许在单个样品内既快速又精确地多路复用最多至500种独特的生物测定。与使用不同大小和颜色强度的组合来鉴定单独微球的其他基于流式细胞仪微球的测定不同,xMAP技术使用通过专有染色工艺在内部用红色和红外荧光团染色的5.6微米大小的微球,以产生用于鉴定每个单独微球的500种独特的染料混合物。
xMAP的一些优点包括多路复用(降低成本和劳动力),用更少的样品生成更多的数据,更少的劳动力和更低的成本,比固体平面阵列更快、更可重现性的结果,以及集中、灵活多路复用1至500种分析物以满足多种应用。
核酸检测。在用于检测蛋白质表达的其他实施方案中,可测定基因转录。例如,用于检测蛋白质表达的间接方法是检测产生蛋白质的mRNA转录物。
核酸的扩增。由于许多mRNA以相对低的丰度存在,因此核酸扩增大大地增强了评估表达的能力。一般概念是可以使用位于目标区域侧翼的配对引物来扩增核酸。如本文所用,术语“引物”是指能够在模板依赖性过程中引发新生核酸合成的任何核酸。通常,引物是长度为10至20和/或30个碱基对的寡核苷酸,但可以采用更长的序列。引物可以双链和/或单链形式提供,但通常使用单链形式。
使被设计成选择性地与对应于选定基因的核酸杂交的引物对在允许选择性杂交的条件下与模板核酸接触。取决于期望应用,可选择高严格性杂交条件,其将仅允许与和引物完全互补的序列杂交。在其他实施方案中,杂交可在降低的严格性下发生,以允许使用引物序列扩增包含一个或多个错配的核酸。一旦杂交,就使模板-引物复合物与促进模板依赖性核酸合成的一种或多种酶接触。进行多轮扩增,也称为“循环”,直到产生足够量的扩增产物。
可对扩增产物进行检测或定量。在某些应用中,可通过视觉方法进行检测。可替代地,检测可包括通过化学发光、掺入的放射性标记或荧光标记的放射性闪烁扫描或甚至通过使用电和/或热脉冲信号的系统间接鉴定产物。
许多模板依赖性方法可用于扩增给定模板样品中存在的寡核苷酸序列。最著名的扩增方法之一是聚合酶链反应(PCR),其在美国专利4,683,195、4,683,202和4,800,159中有详细描述,其各自通过引用整体并入本文。
可执行逆转录酶-PCR扩增程序以对扩增的mRNA的量进行定量。将RNA逆转录为cDNA的方法是熟知的(参见Sambrook等,Molecular Cloning:A Laboratory Manual,2001)。用于逆转录的替代方法利用热稳定的DNA聚合酶。这些方法描述于WO 90/07641中。聚合酶链反应方法是本领域中熟知的。RT-PCR的代表性方法描述于美国专利5,882,864中。标准PCR通常使用一对引物来扩增特定序列,而多重PCR(MPCR)使用多对引物同时扩增许多序列。在单个管中存在许多PCR引物可能引起许多问题,诸如错误引发的PCR产物和“引物二聚体”的形成增加、较长DNA片段的扩增鉴别等等。通常,MPCR缓冲液包含Taq聚合酶添加剂,其降低了MPCR期间扩增子之间的竞争和较长DNA片段的扩增鉴别。MPCR产物可以进一步与基因特异性探针杂交以进行验证。从理论上讲,人们应该能够根据需要使用尽可能多的引物。然而,由于在MPCR期间引起的副作用(引物二聚体、错误引发的PCR产物等),对于可以在MPCR反应中使用的引物的数量存在限制(少于20)。另外参见欧洲申请0 364 255,相关部分通过引用并入本文。
用于扩增的另一种方法是连接酶链反应(ligase chain reaction,“LCR”),其公开于通过引用全文并入本文的欧洲申请320 308中。美国专利4,883,750描述了与用于使探针对与靶序列结合的LCR类似的方法。还可使用美国专利5,912,148中公开的基于PCR和寡核苷酸连接酶测定(OLA)的方法。可在本发明的实践中使用的用于扩增靶核酸序列的替代方法公开于美国专利5,843,650、5,846,709、5,846,783、5,849,546、5,849,497、5,849,547、5,858,652、5,866,366、5,916,776、5,922,574、5,928,905、5,928,906、5,932,451、5,935,825、5,939,291和5,942,391、GB申请2 202 328以及PCT申请PCT/US89/01025中,其各自的相关部分通过引用并入本文。
核酸的检测。在任何扩增后,可期望将扩增产物与模板和/或过多的引物分离。在一个实施方案中,使用标准方法通过琼脂糖、琼脂糖-丙烯酰胺或聚丙烯酰胺凝胶电泳分离扩增产物(Sambrook等,Molecular Cloning:A Laboratory Manual,2001)。可切下分离的扩增产物并从凝胶洗脱以进一步操作。使用低熔点琼脂糖凝胶,可通过加热凝胶移除分离的条带,然后提取核酸。核酸的分离也可通过本领域已知的色谱技术实现。存在许多种可用于本发明的实践的色谱,包括吸附、分配、离子交换、羟基磷灰石、分子筛、反相、柱、纸、薄层和气相色谱以及HPLC。
在某些实施方案中,扩增产物是可视化的。典型的可视化方法涉及用溴化乙锭对凝胶染色并在UV光下使条带可视化。可替代地,如果将扩增产物用放射性或荧光标记的核苷酸整体标记,则分离的扩增产物可以暴露于x射线胶片或在适当的激发光谱下可视化。
在一个实施方案中,在扩增产物分离之后,使标记的核酸探针与扩增的标志物序列接触。探针优选地与发色团缀合,但可被放射性标记。在另一个实施方案中,使探针与结合配偶体(诸如抗体或生物素),或携带可检测部分的另一结合配偶体缀合。
在特定实施方案中,通过DNA印迹(Southern blotting)和与标记探针的杂交进行检测。DNA印迹中涉及的技术是本领域技术人员熟知的(参见Sambrook等.,MolecularCloning:A Laboratory Manual,2001)。前述的一个实例描述于通过引用并入本文的美国专利5,279,721中,其公开了用于核酸的自动化电泳和转移的装置和方法。所述装置允许无需凝胶的外部操作即可进行电泳和印迹,并且理想地适于进行根据本发明的方法。
可在本发明的实践中使用的其他核酸检测方法公开于美国专利5,840,873、5,843,640、5,843,651、5,846,708、5,846,717、5,846,726、5,846,729、5,849,487、5,853,990、5,853,992、5,853,993、5,856,092、5,861,244、5,863,732、5,863,753、5,866,331、5,905,024、5,910,407、5,912,124、5,912,145、5,919,630、5,925,517、5,928,862、5,928,869、5,929,227、5,932,413和5,935,791中,其各自通过引用并入本文。
核酸阵列。微阵列包括多个聚合分子,所述聚合分子在空间上分布在基本上平面基底(例如生物芯片)的表面上并且与其稳定缔合。已经开发了多核苷酸的微阵列,并且应用于多种应用中,诸如筛选和DNA测序。微阵列特别适用的一个领域是基因表达分析。
在使用微阵列的基因表达分析中,使“探针”寡核苷酸的阵列与目标核酸样品(即,靶标,诸如来自特定组织类型的polyA mRNA)接触。在杂交条件下进行接触,然后去除未结合的核酸。所得的杂交核酸图谱(pattern)提供了关于所测试样品的遗传特征谱的信息。微阵列上的基因表达分析方法能够提供定性和定量信息两者。
可与本发明一起使用的多种不同阵列是本领域中已知的。能够与靶核酸进行序列特异性杂交的阵列的探针分子可以是多核苷酸或其杂交类似物或模拟物,包括:其中磷酸二酯键被替代键(诸如硫代磷酸酯、甲基亚氨基、甲基膦酸酯、氨基磷酸酯、胍等)替换的核酸;其中核糖亚基被取代的核酸,例如己糖磷酸二酯;肽核酸;等等。探针的长度将通常在10至1,000个核苷酸的范围内,其中在一些实施方案中,探针将为寡核苷酸并且长度通常在15至150个核苷酸的范围内并且更通常在15至100个核苷酸的范围内,并且在其他实施方案中,探针将更长,长度通常在150至1,000个核苷酸的范围内,其中多核苷酸探针可以是单链或双链的,通常是单链的,并且可以是由cDNA扩增的PCR片段。
基底表面上的探针分子将对应于所分析的选定基因并定位在已知位置的阵列上,使得阳性杂交事件可与靶核酸样品所来源的生理来源中的特定基因的表达相关。与探针分子稳定缔合的基底可由多种材料,包括塑料、陶瓷、金属、凝胶、膜、玻璃等制成。阵列可根据任何便利的方法产生,诸如预先形成探针并随后将它们与支持物的表面稳定缔合或使探针直接在支持物上生长。许多不同的阵列构造及其产生方法是本领域技术人员已知的并公开于美国专利5,445,934、5,532,128、5,556,752、5,242,974、5,384,261、5,405,783、5,412,087、5,424,186、5,429,807、5,436,327、5,472,672、5,527,681、5,529,756、5,545,531、5,554,501、5,561,071、5,571,639、5,593,839、5,599,695、5,624,711、5,658,734、5,700,637和6,004,755中,相关部分通过引用并入本文。
杂交后,其中非杂交的标记核酸能够在检测步骤期间发出信号,采用洗涤步骤,其中从支持物表面除去未杂交的标记核酸,从而在基底表面上产生杂交核酸的图谱。多种洗涤溶液及其使用方案是本领域技术人员已知的并且可使用。在靶核酸上的标记不可直接检测的情况下,则使现在包含结合靶标的阵列与正在使用的信号产生系统的一个或多个其他成员接触。例如,在靶标上的标记是生物素的情况下,则在足以发生特异性结合成员对之间的结合的条件下,使阵列与链霉抗生物素蛋白-荧光缀合物接触。接触后,则将例如通过洗涤除去信号产生系统的任何未结合成员。所采用的具体洗涤条件必然将取决于所采用的信号产生系统的具体性质,并且对于熟悉所采用的特定信号产生系统的本领域技术人员来说将是已知的。标记核酸的所得杂交图谱可以多种方式可视化或检测,其中基于核酸的特定标记选择特定检测方式,其中代表性检测手段包括闪烁计数、放射自显影、荧光测量、量热测量、发光测量等。
在检测或可视化之前,当期望降低错配杂交事件在图谱上产生假阳性信号的可能性时,可在一定条件下用内切核酸酶处理杂交的靶标/探针复合物的阵列,所述条件足以使得内切核酸酶降解单链但不降解双链DNA。已知并且可使用多种不同的内切核酸酶,其中此类核酸酶包括:绿豆核酸酶、S1核酸酶等。当在靶核酸未用可直接检测的标记进行标记的测定中(例如在具有生物素化的靶核酸的测定中)采用此类处理时,内切核酸酶处理通常将在阵列与信号产生系统的一个或多个其他成员(例如,荧光-链霉抗生物素蛋白缀合物)接触之前进行。如上所述,内切核酸酶处理确保在杂交图谱中仅检测到在探针的3’末端具有基本上完全杂交的末端标记的靶标/探针复合物。如上所述,在杂交和一个或多个任何洗涤步骤和/或后续处理之后,检测所得杂交图谱。在检测或可视化杂交图谱时,标记的强度或信号值不仅将被检测而且被定量,这意味着将测量来自杂交的每个斑点的信号并将其与对应于由已知数量的末端标记的靶核酸发射的信号的单位值进行比较,以获得在杂交图谱中与阵列上的特定斑点杂交的每个末端标记的靶标的拷贝数的计数或绝对值。
RNA测序。RNA-seq(RNA测序),也称为全转录组鸟枪测序(Whole TranscriptomeShotgun Sequencing,WTSS),是利用下一代测序(NGS)的能力揭示在给定时刻来自基因组的RNA存在和量的快照的技术。细胞的转录组是动态的;与静态基因组相反,它不断变化。下一代测序的最新发展允许增加的DNA序列碱基覆盖以及更高的样品通量。这有利于细胞中RNA转录物的测序,提供了查看(look at)替代基因剪接转录物、转录后变化、基因融合、突变/SNP和基因表达变化的能力。除mRNA转录物之外,RNA-Seq还可以查看不同的RNA群体以包括总RNA、小RNA诸如miRNA、tRNA和核糖体特征谱分析。RNA-Seq还可以用于确定外显子/内含子边界并验证或修正先前注释的5’和3’基因边界,正在进行的RNA-Seq研究包括观察感染期间的细胞途径改变,以及癌症研究中的基因表达水平变化。在NGS之前,先前使用表达微阵列进行转录组学和基因表达研究,所述表达微阵列包含探测靶序列中的匹配的数千个DNA序列,从而可获得所表达的所有转录物的特征谱。这在后期通过基因表达的系列分析(SAGE)完成。
用于SLE的治疗。因此,本发明设想了某些生物标志物的检测,随后是SLE治疗的变化,其可包括在指明时使用标准治疗方法。通常,SLE的治疗涉及治疗升高的疾病活动性并试图使可能与增加的炎症和增加的免疫复合物形成/沉积/补体激活相关的器官损伤最小化。基础治疗可以包括皮质类固醇和/或抗疟疾药物。某些类型的狼疮性肾炎(诸如弥漫增生性肾小球性肾炎)需要大量的细胞毒性药物。这些药物最通常包括环磷酰胺和霉酚酸酯。羟氯喹(HCQ)于1955年被FDA批准用于狼疮。一些经批准用于其他疾病的药物被用于SLE“标签外(off-label)”。贝利单抗(Benlysta)可以用作用于见于自身抗体阳性狼疮患者中的疾病活动性升高的治疗。
由于多种症状和器官系统受SLE所累,必须评估其在个体中的严重程度以便成功治疗SLE。有时,轻度或间歇性疾病可安全地仅用羟氯喹在最小程度上治疗。如果需要,也可使用非类固醇抗炎药和低剂量类固醇。羟氯喹(HCQ)是FDA批准的抗疟药,用于体质、皮肤和关节表现。羟氯喹的副作用相对较少,并且有证据表明,其改善了患有SLE的人的存活,并且在稳定的SLE患者中停止HCQ导致加拿大狼疮患者的疾病突发增加。改善疾病的抗风湿药(DMARD)通常标签外用于SLE,以降低疾病活动性并降低对类固醇使用的需要。常用的DMARD是甲氨蝶呤和硫唑嘌呤。在更严重的情况下,使用积极抑制免疫系统的药物(主要是高剂量皮质类固醇和主要免疫抑制剂)控制疾病和防止损伤。环磷酰胺用于严重的肾小球性肾炎,以及其他危及生命或损伤器官的并发症,诸如血管炎和狼疮性脑炎。霉酚酸也用于治疗狼疮性肾炎,但未经FDA批准用于此适应证。
取决于剂量,需要类固醇的人可能出现库欣躯干肥胖的症状(Cushing’ssymptoms of truncal obesity)、紫纹、水牛背和其他相关症状。如果以及当大的初始剂量降低时,这些可能消退,但即使是低剂量的长期使用也可导致血压升高、葡萄糖耐受不良(包括代谢综合征和/或糖尿病)、骨质疏松、失眠、缺血性坏死和白内障。
正在积极地对将许多新的免疫抑制药物用于SLE进行测试。它们不像皮质类固醇那样非特异性地抑制免疫系统,而是靶向单独类型的免疫细胞的应答。贝利单抗或针对B淋巴细胞刺激因子(BlyS或BAFF)的人源化单克隆抗体被FDA批准用于狼疮治疗并降低SLE疾病活动性,特别是在具有基线升高的疾病活动性和存在自身抗体的患者中。在SLE患者中正积极研究添加药物诸如阿巴西普(abatacept)、依帕珠单抗(epratuzimab)、依那西普等,并且这些药物中的一些已经被FDA批准用于治疗类风湿性关节炎或其他病症。由于大部分患有SLE的人患有不同程度的慢性疼痛,如果非处方药物(主要是非类固醇抗炎药)不提供有效缓解,则可使用更强的处方镇痛药(止痛药)。对于患有SLE的患者,强效NSAID(诸如吲哚美辛和双氯芬酸)是相对禁忌的,因为它们增加肾脏衰竭和心脏衰竭的风险。
中度疼痛通常用温和的处方阿片类药物诸如右旋丙氧芬和co-codamol来治疗。中度至重度慢性疼痛用较强的阿片类药物(诸如氢可酮)或长效连续释放阿片类药物(诸如羟考酮、美施康定(MS Contin)或美沙酮)来治疗。由于其长效定时释放和易于使用,芬太尼多瑞吉(fentanyl duragesic)经皮贴剂也是由并发症引起的慢性疼痛的广泛使用的治疗选择。当阿片类药物长期使用时,可能出现药物耐受性、化学依赖性和成瘾性。阿片成瘾通常不引起关注,因为这种状况不太可能完全消失。因此,使用阿片类药物终身治疗慢性疼痛症状是相当常见的,并伴有周期性滴定,这是任何长期阿片方案的典型特征。
静脉内免疫球蛋白可用于控制具有器官受累或血管炎的SLE。据信它们减少抗体产生或促进免疫复合物从体内清除,即使它们的作用机制还没有被很好地了解。与免疫抑制剂和皮质类固醇不同,IVIG不抑制免疫系统,因此使用这些药物存在较小的严重感染风险。
避免阳光是SLE患者生活方式的主要变化,因为已知阳光加剧该疾病,与强烈疲劳的衰弱作用一样。这两个问题可能导致患者长时间居家不出。与SLE无关的药物只有在已知不加剧该疾病时才应被开具处方。职业性暴露于二氧化硅、杀虫剂和汞也可使疾病恶化。
肾移植是狼疮性肾炎的并发症之一的终末期肾病的治疗选择,但是在最高至30%的患者中,移植肾脏中完全疾病的复发是常见的。
抗磷脂综合征还与脑中神经性狼疮症状的发作有关。在这种疾病形式中,病因与狼疮非常不同:血管中形成血栓(血凝块或“粘稠血液”),如果它们在血流中移动被证明是致命的。如果血栓迁移至大脑,则它们可能通过阻断大脑的血液供应而引起中风。如果患者被怀疑患有此病症,则早期检测通常需要脑部扫描。这些扫描可以显示出其中血液供应已不足的大脑的局部区域。这些患者的治疗计划需要抗凝。通常,为此目的开具低剂量阿司匹林的处方,但是对于涉及血栓形成的病例,使用抗凝剂,诸如华法林(warfarin)。
药物制剂和递送。设想了治疗应用的变化,将有必要制备适合于预期应用的形式的药物组合物。一般来说,这将使得需要制备基本上不含热原以及可能对人或动物有害的其他杂质的组合物。
通常,采用适当的盐和缓冲剂,以使递送载体稳定并且允许被靶细胞摄取。当将重组细胞引入患者时,还将采用缓冲剂。本发明的水性组合物包含溶解或分散在药学上可接受的载剂或水性介质中的有效量的用于细胞的载体。此类组合物也称为接种物(inocula)。
如本文所用,短语“药学上可接受的”或“药理学上可接受的”是指当施用于动物或人时不产生不利反应、变应性反应或其他不良反应的分子实体和组合物。如本文所用,“药学上可接受的载剂”包括任何和所有溶剂、分散介质、包衣剂、抗细菌剂和抗真菌剂、等张剂和吸收延迟剂等。此类介质和剂针对药物活性物质的使用在本领域中是熟知的。除非任何常规介质或剂与本发明的载体或细胞不相容,否则预期其在治疗组合物中的使用。补充的活性成分也可以掺入组合物中。
本公开的活性组合物可包括经典药物制剂。根据本发明施用这些组合物将通过任何常见途径,只要可通过所述途径达到靶组织即可。此类途径包括经口、鼻、颊、直肠、阴道或表面途径。可替代地,可通过原位、皮内、皮下、肌内、腹膜内或静脉内注射施用。此类组合物通常将作为药学上可接受的组合物施用。活性化合物也可肠胃外或腹膜内施用。呈游离碱或药理学上可接受的盐形式的活性化合物的溶液可以在适当地与表面活性剂(诸如羟丙基纤维素)混合的水中制备。分散体也可以在甘油、液体聚乙二醇和其混合物中以及油中制备。在普通的储存和使用条件下,这些制剂包含防腐剂以防止微生物的生长。
适用于可注射用途的药物形式包括无菌水溶液或分散体以及用于临时制备无菌可注射溶液或分散体的无菌粉末。在所有情况下,所述形式必须是无菌的并且必须是存在易注射性的程度上的流体。其在制造和储存条件下必须是稳定的,并且必须被保护以免于微生物(诸如细菌和真菌)的污染作用。载剂可以是包含以下的溶剂或分散介质:例如水、乙醇、多元醇(例如,甘油、丙二醇和液体聚乙二醇,等等)、其合适的混合物,以及植物油。可以例如通过使用包衣(诸如卵磷脂),在分散体的情况下通过维持所需粒度,以及通过使用表面活性剂来维持适当的流动性。可以通过各种抗细菌剂和抗真菌剂,例如对羟基苯甲酸酯、氯丁醇、苯酚、山梨酸、硫柳汞等来防止微生物的作用。在许多情况下,将优选包括等张剂,例如糖或氯化钠。通过在组合物中使用延迟吸收的剂(例如单硬脂酸铝和明胶),可以实现可注射组合物的延长吸收。
通过根据需要将所需量的活性化合物与以上列举的各种其他成分一起掺入到适当的溶剂中,随后过滤灭菌来制备无菌可注射溶液。通常,通过将各种经过灭菌的活性成分掺入到包含基础分散介质和来自以上列举的那些的所需的其他成分的无菌媒介物中来制备分散体。在用于制备无菌可注射溶液的无菌粉末的情况下,优选的制备方法是真空干燥和冷冻干燥技术,其产生来自其先前无菌过滤溶液的活性成分加上任何另外的期望成分的粉末。
如本文所用,短语“药学上可接受的载剂”是指任何和所有溶剂、分散介质、包衣剂、抗细菌剂和抗真菌剂、等张剂和吸收延迟剂等。此类介质和剂用于药物活性物质的使用是本领域众所周知的。除非任何常规介质或剂与活性成分不相容,否则预期其在治疗组合物中的使用。补充的活性成分也可掺入组合物中。
对于经口施用,本发明的多肽可与赋形剂合并并且以不可摄取的漱口水和洁齿剂的形式使用。可将所需量的活性成分掺入到适当的溶剂(诸如硼酸钠溶液(Dobell溶液))中来制备漱口水。可替代地,可将活性成分掺入含有硼酸钠、甘油和碳酸氢钾的防腐洗液中。活性成分也可分散于洁齿剂中,包括:凝胶、糊剂、粉末和浆液。活性成分可以治疗有效量添加至可包括水、粘合剂、研磨剂、调味剂、发泡剂和湿润剂的糊状洁齿剂中。
用于与本发明一起使用的组合物可以中性或盐形式配制。药学上可接受的盐包括酸加成盐(与蛋白质的游离氨基形成),以及与例如盐酸或磷酸的无机酸或者与诸如乙酸、草酸、酒石酸、扁桃酸等有机酸形成的盐。与游离羧基形成的盐也可以衍生自例如氢氧化钠、氢氧化钾、氢氧化铵、氢氧化钙或氢氧化铁的无机碱,以及诸如异丙胺、三甲胺、组氨酸、普鲁卡因等的有机碱。在配制后,溶液将以与剂量制剂相容的方式并以诸如治疗有效的量施用。制剂容易地以多种剂型(诸如可注射溶液、药物释放胶囊等)施用。对于在水溶液中的肠胃外施用,例如,如果需要,溶液应适当缓冲,并且首先用足够的盐水或葡萄糖使液体稀释剂等张。在这一点上,根据本公开,可以采用的无菌水性介质将是本领域技术人员已知的。例如,可将一次剂量溶解在1ml的等张NaCl溶液中,并且将其添加至1,000ml的皮下灌注流体中或注射在建议的输注部位(参见例如,“Remington’s Pharmaceutical Sciences,”第15版,第1035-1038页和第1570-1580页),相关部分通过引用并入。取决于所治疗受试者的病状,将必然发生剂量的一些变化。在任何情况下,负责施用的人员将确定个体受试者的适当剂量。此外,对于人施用,制剂应满足FDA生物制品标准办公室(FDA Office ofBiologics standards)所要求的无菌性、致热原性、一般安全性和纯度标准。
试剂盒。为了在本文所述的应用中使用,试剂盒也在本发明的范围内。此类试剂盒可以包括载剂、包装或容器,其被分隔以接纳一个或多个容器(诸如小瓶、管等),一个或多个容器中的每一个包含待在该方法中使用的单独要素中的一种,特别是光亮抑制剂。本发明的试剂盒将通常包括上述容器和一个或多个其他容器,其包含从商业最终使用者角度可期望的材料,包括缓冲剂、稀释剂、过滤器和具有使用说明的包装插页。另外,可以在容器上提供标签以指示组合物用于特定治疗应用,并且还可以指示体内或体外使用的用法说明书,诸如上文所述的那些。用法说明书和或其他信息也可以包括在试剂盒所包括的插页中。特别地,根据本发明的试剂盒设想了用于评估以上所讨论的生物标志物的水平的剂与一种或多种SLE治疗剂的组合,和/或用于ANA测试和/或抗ENA的试剂,以及用于其评估的对照。
狼疮疾病活动性测量中的当前生物标志物在反映增强的临床疾病活动性方面实用性有限。它们既不是对临床疾病活动性的最早,也不是信息量最大的测量。尽管在分类之前数年,在SLE患者体内积累了SLE相关自身抗体特异性,诸如抗dsDNA、抗剪接体和抗Ro/SSA,但它们的存在不足以反映临床疾病活动性和永久性器官损伤的风险。ANA还存在于来自患有其他系统性风湿病的患者,以及未继续发展为SLE的健康个体(包括SLE患者的一些未受影响的家庭成员),以及高达14%的总人口的血清中。由于个体在为ANA阳性时仍可保持健康,所以仅ANA阳性可能不是SLE的唯一致病性驱动因素。除ANA阳性外,由可溶性介质驱动的各种免疫途径的失调也可促进临床疾病活动性。
实施例。包括以下实施例以进一步说明本发明的各个方面。本领域技术人员应理解,以下实施例中公开的技术代表发明人发现的在本发明的实践中很好地发挥作用的技术和/或组合物,并因此可以视为构成其实践的优选模式。然而,根据本公开,本领域技术人员应理解,在不脱离本发明的精神和范围的情况下,可以对所公开的具体实施方案进行许多改变并仍然获得相同或相似的结果。
SLE是以免疫失调为特征的复杂的自身免疫疾病。用以跟踪改变的疾病活动性的相关介质的全面但成本有效的工具将有助于改善疾病管理并预防器官损伤。此实施例的目标是鉴定实用生物特征识别(practical biometric)的关键组分,以将活跃性狼疮与低狼疮疾病活动性区分开。
本发明包括鉴定某些免疫介质,包括SLE相关自身抗体特异性以及可能随SLE疾病活动性的变化而失调的炎性和调节性可溶性介质途径。使用多重方法,与相匹配的健康对照(HC)相比,具有低(hSLEDAI<4)或活跃性(hSLEDAI≥4)疾病活动性的SLE患者随访者表现出自身抗体特异性积累以及炎性和调节性介质的血浆水平的疾病活动性依赖性变化。这些结果使得能够开发组合的狼疮疾病活动性免疫指数(LDAII),其反映了随着临床疾病活动性的变化而产生的免疫改变。
在来自在获取的日期具有低度临床疾病(系统性红斑狼疮疾病活动性指数(SLEDAI)<4,范围0-3,n=132)或更加活跃性疾病(SLEDAI≥4,范围4-30,n=179)的具有分类SLE的198名患者的311份血浆样品以及种族、性别和年龄相匹配的健康对照(HC)(n=48)中评估SLE相关的免疫介质和自身抗体。通过基于珠粒的多重测定或夹心ELISA(BLyS、APRIL和TGF-β)评估32种可溶性介质和SLE相关自身抗体特异性,包括dsDNA、染色质、Ro/SSA、La/SSB、Sm、SmRNP和RNP。结合自身抗体的存在,对可溶性介质水平和临床疾病活动性水平进行交叉比较。
具有低度或活跃性疾病的患者具有相似的年龄、种族和性别。在针对多重比较调整之后(Bonferroni校正的p<0.0018),IL-6、IL-1α、IP-10和IL-8与SLEDAI评分显著相关(Spearman r=0.179-0.253),而22/32可溶性介质与累积的SLE相关自身抗体(包括上文列出的那些,以及SCF、IFN-α、IFN-γ、IL-17A、IL-10、MIG、MIP-1β、TNFRII和BLyS)的数量显著相关(r=0.318[IL-17A]-0.468[IP-10])。调节性介质IL-10在来自具有低疾病活动性的患者的样品中最高(p<0.05),而炎性介质在具有累积的自身抗体特异性的活跃性疾病样品中最高(p<0.001)。发明人整合这些发现以建立狼疮疾病活动性免疫指数(LDAII),其利用通过每个个体中的SLE相关自身抗体数量加权的标准化的(病例相对于对照)可溶性介质水平(n=32)计算得到。LDAII将具有临床活跃性(CA)相对于静止性(CQ)疾病的患者区分开,所述患者是血清学(dsDNA结合和低补体)活跃性(SA)或静止性(SQ)患者(p<0.0001),由此积累的自身抗体的数量(p<0.0001)以及IL-6、IL-8和IP-10水平(p≤0.0006)最显著地改变。此外,LDAII能够将临床和血清学静止性(CQSQ)SLE患者相对于HC区分开(p=0.019)。最后,LDAII与患者的SLEDAI评分显著相关(p<0.0001),并鉴定具有肾器官受累的患者(p=0.002),在所述患者中,SCF、TNFRII和MCP-1也最显著地改变(p≤0.005)。
研究群体、临床数据和样品收集。研究按照赫尔辛基宣言(HelsinkiDeclaration)进行,并通过俄克拉荷马医学研究基金会和俄克拉荷马大学健康科学中心的机构审查委员会批准。未稀释的血浆和血清样品获自俄克拉荷马狼疮小组中的198名适当同意的SLE患者(满足>4项ACR分类标准(39))和俄克拉荷马免疫小组中的48名种族和性别匹配的健康个体(对照或Ctls),表1。将样品储存在俄克拉荷马风湿性疾病研究核心中心(ORDRCC)(OMRF的CAP认证的生物库),-80℃。针对确定来自SLE患者和对照的样品中的可溶性介质和SLE相关AutoAb的水平的能力,已相对于装运时间和方法、处理程序、储存条件以及储存时间长度对生物库中的样品进行测试(33、36、37、40-45)。
表1.研究参与者人口统计
显著性(p≤0.05)
如先前所述(39)收集人口统计和临床信息(39),包括药物使用、临床实验室值和临床疾病活动性。器官系统受累的存在通过施行混合系统性红斑狼疮疾病活动性指数(hSLEDAI;SELENA-SLEDAI伴蛋白尿,如通过SLEDAI-2K所定义)进行评估(32、33),包括以下的存在:涉及中枢神经系统的疾病表现(CNS;癫痫发作、精神病、器质性脑综合征、视觉障碍、颅神经病症或狼疮性头痛)、血管炎、关节炎、肌炎、肾炎(尿管型、血尿、蛋白尿或脓尿)、皮肤粘膜损伤(皮疹、脱发或粘膜溃疡)、浆膜炎(胸膜炎或心包炎),或血液学表现(低补体、增加的DNA结合、发烧、血小板减少或白细胞减少)(16)。hSLEDAI评分<4的患者随访者被视为“低”疾病活动性,而hSLEDAI评分≥4的患者随访者被视为“活跃性”疾病。在每次临床随访时从每个参与者中获取血液样品。将血浆和血清样品储存在-20℃,直到测定时间。对新鲜解冻的样品执行测定。
可溶性介质和自身抗体特异性的测量。使用经过验证的基于珠粒的多重测定或ELISA(BLyS、APRIL和TGF-β)检查血浆可溶性介质(n=32,表2),包括细胞因子、趋化因子和可溶性受体(46)。在Bio-Rad BioPlex
表2.在SLE患者和对照样品中评估的血浆介质
使用BioPlex 2200多重系统(Bio-Rad Technologies,Hercules,CA)针对自身抗体特异性对血清样品进行筛选。BioPlex 2200ANA试剂盒使用荧光染色的磁珠用于同时检测11种自身抗体特异性水平,包括对dsDNA、染色质、核糖体P、Ro/SSA、La/SSB、Sm、Sm/RNP复合物、RNP、Scl-70、着丝粒B和Jo-1的反应性(49)。在本研究中使用对dsDNA、染色质、Ro/SSA、La/SSB、Sm、Sm/RNP复合物和RNP的SLE相关自身抗体特异性进行分析。抗dsDNA(IU/mL)具有先前确定的10IU/mL的正截止值;制造商报告了抗体指数(AI)值(范围为0-8)以反映具有AI=1.0的正截止值的每种其他自身抗体特异性的荧光强度。AI标度是相对于制造商提供的校准物和对照样品进行标准化的。
统计学分析。通过Fisher精确检验比较分类变量。使用未配对t检验比较低度相对于活跃性疾病临床随访者的疾病活动性评分。通过Mann-Whitney检验在具有低度或活跃性疾病的SLE患者随访者之间比较自身抗体特异性数量和血浆可溶性介质浓度。通过Kruskal-Wallis检验与Dunn多重比较在具有低度和活跃性疾病的SLE患者随访者与种族/性别匹配的对照样品之间比较血浆介质浓度和自身抗体特异性数量。通过Spearman等级相关,将血浆介质浓度与hSLEDAI评分或自身抗体特异性数量相关。除非另有说明,否则使用GraphPad Prism 6.02(GraphPad Software,San Diego,CA)进行分析。
开发狼疮疾病活动性免疫指数(LDAII)计算以相对于对照,比较具有不同疾病活动性水平的患者随访者的总体炎症水平。LDAII的计算遵循了发明人已类似地用于开发用于SLE患者的狼疮突发预测指数(LFPI)的方法(42、45)。LDAII总结了在当临床随访时具有低度和活跃性疾病的SLE患者以及相匹配的对照中评估的所有32种血浆介质的失调,通过它们与从同一次随访时获取的样品中检测到的AutoAb特异性数量的相关性进行加权。LDAII计算如下:1.对于每名SLE患者或对照随访者,对所有32种基线血浆介质的浓度(表2)进行对数变换。2.对每名参与随访者的每个对数变换的可溶性介质水平进行标准化:(观察值)-(所有SLE患者和对照随访者的平均值)/(所有SLE患者和对照随访者的标准差)3.由线性回归模型生成Spearman系数,所述模型测试在所有SLE患者和对照随访者中评估的AutoAb特异性数量针对各可溶性介质之间的关联(Spearman r);4.将变换且标准化的可溶性介质水平通过(乘以)其相应的Spearman系数(Spearman r)进行加权。5.对于每名参与随访者,将32种可溶性介质中的每一种的对数变换、标准化且加权的值相加以计算总LDAII。
通过Mann-Whitney检验在具有低度和活跃性疾病的SLE患者随访者之间比较LDAII,并且另外通过Kruskal-Wallis检验与Dunn多重比较将其与对照相比较。分别针对具有活跃性疾病相对于低疾病活动性(或对照)的SLE患者随访者具有正或负LDAII评分的可能性确定优势比(OR);通过Fisher精确检验确定显著性。
在临床活跃性疾病的情况下增加的AutoAb特异性数量和改变的选定介质水平。
发明人先前已经证明,转变为分类SLE(满足>4项ACR分类标准(39))的患者表现出多个水平的免疫失调,包括SLE相关AutoAb特异性的积累(36、37、50)以及炎性和调节性可溶性介质的改变(36、37)。基于这种免疫失调也将在具有临床活跃性疾病的SLE患者中反映出来的这一假设,发明人比较了在临床随访期间获取的样品中的血清自身抗体和血浆可溶性介质特征谱,其中198名SLE患者表现出低疾病活动性(hSLEDAI<4,范围0-3,n=132)或活跃性疾病(hSLEDAI≥4,范围4-30,n=179),图1A和1B以及表3。如同预期的那样,具有活跃性疾病的SLE患者具有显著较高的hSLEDAI评分(图1A),并且与具有低疾病活动性的SLE患者相比,更可能表现出各种器官系统表现(表3)。此外,与低疾病活动性期间检测到的数量相比,具有活跃性疾病的SLE患者表现出SLE相关AutoAb特异性数量的显著增加(p=0.0038,图1B),而与相匹配的对照相比,无论疾病活动性如何,SLE患者均具有显著更多的AutoAb特异性(p<0.0001)。在活跃性疾病期期间,针对dsDNA(p<0.0001)、染色质(p=0.0005)和Sm(p=0.0380)的AutoAb更有可能呈阳性,而Ro/SSA、La/SSB、SmRNP和RNPAutoAb特异性的频率在低度和活跃性疾病中是类似的,表3。具有活跃性疾病的SLE患者更可能被开具类固醇的处方(p<0.0001),并与具有低疾病活动性的患者类似地被开具羟氯喹和/或免疫抑制剂的处方,表3。
表3.SLE患者的药物、自身抗体和临床特征
除了AutoAb特异性的变化之外,发明人还评估了具有活跃性疾病的SLE患者是否也具有SLE相关的可溶性介质的改变,表4和图2A至2I。针对多重比较进行调整后,包括IL-8、IP-10、IL-1a和IL-6在内的选定介质的血浆水平与和样品获取同时的临床随访时的hSLEDAI评分直接相关,表4。具有活跃性疾病的SLE患者的血浆介质水平的增加进一步反映了这一点。与低疾病活动性相比,来自活跃性疾病期的SLE患者样品中的I型IFN,即IFN-α(图2A)连同IFN驱动的趋化因子IP-10(图2B)以及固有性介质IL-6(图2C)均显著更高,并且无论临床疾病活动性如何,SLE患者的这些介质的水平均高于对照(p<0.05)。固有性介质IL-1a(图2D)、趋化因子IL-8(图2E)和Th17型介质IL-21(图2F)在具有活跃性疾病的SLE患者中最高(p<0.05),而具有低疾病活动性的患者的水平与对照相似。无论疾病活动性如何,SLE患者均表现出比对照更高的BLyS水平(p<0.001),其在具有活跃性疾病的SLE患者中最高,尽管不显著,图2G。调节性介质IL-10(图2H)在具有低疾病活动性的SLE患者中最高(SLE患者具有比对照显著更高的水平,p<0.01),而TGF-β水平在对照中最高(p<0.01)并且在具有低度和活跃性疾病的SLE患者之间是相似的,图2I。这些数据表明,许多选定介质可以与临床活跃性SLE直接关联的方式改变。
表4.不同的血浆介质与疾病活动性相关
可溶性介质水平以与AutoAb的存在和临床疾病活动性关联的方式改变。鉴于在具有活跃性疾病的SLE患者中检测到的AutoAb特异性数量的增加和选定血浆介质水平的改变,发明人对可溶性介质水平是否与检测到的AutoAb特异性的数量相关产生疑问,表5。发明人发现,多种另外的可溶性介质(评估的22/32)与SLE患者和相匹配的健康对照中存在的积累的SLE相关AutoAb的数量显著相关(p≤0.0010),包括固有性和适应性介质、趋化因子以及TNF超家族成员。这促使我们评估如何在具有低度或活跃性疾病,同时还是AutoAb阴性(Neg)或阳性(Pos)的SLE患者相对于对照之间比较这些可溶性介质的水平(图3-6)。I型(IFN-α,图3A)和II型(IFN-γ,图3B)IFN在AutoAb Pos SLE患者中增加,其中在具有活跃性疾病的AutoAb Neg与Pos患者之间存在显著差异;与对照相比,具有活跃性疾病的AutoAb阳性SLE患者的这些介质的血浆水平最高(p<0.001)。对于IFN趋化因子IP-10(图3C)和MIG(图3D),在具有低度(p<0.05)或活跃性(p<0.0001)疾病的AutoAb Pos和Neg SLE患者之间存在这些介质的显著增加,并且与对照相比,具有活跃性疾病的AutoAb Pos SLE患者中的水平最高(p<0.001)。这些数据表明,除了可能与改变的疾病活动性直接关联(图2)之外,IFN相关介质也可与AutoAb特异性的积累有关(图3A至3D)。
表5.血浆介质与SLE相关自身抗体特异性的数量相关
p=0.0018
B淋巴细胞刺激因子(BLyS)是TNF超家族成员,其响应于I型(51)和II型(52)IFN而分泌并支持B细胞存活和分化,从而有助于自身抗体的产生和类别转换(53)。与IFN相关介质类似,BLyS(图4A)在具有低度或活跃性疾病的AutoAb Pos SLE患者中增加(p<0.01),由此与对照相比,AutoAb Pos SLE患者具有最高水平(p<0.0001)。作为在B淋巴细胞激活和AutoAb产生方面与BLyS相关的另一TNF超家族成员的增殖诱导配体(APRIL,图4B)(53)在具有活跃性疾病的AutoAb Pos SLE患者中类似地增加(p<0.0001)。有趣的是,在比较具有低度相对于活跃性疾病的SLE患者时,发现相对于其AutoAb阳性对应物,具有活跃性疾病的AutoAb Neg SLE患者中的APRIL水平较低,其中发现具有活跃性疾病的SLE患者中的APRIL最高(p<0.05)。在具有活跃性疾病的AutoAb Pos SLE患者中,所评估的其他TNF超家族成员(包括TRAIL(图4C)和TNFRII(图4D))也有所增加(p<0.0001)。鉴于这两种介质在某种程度上也与疾病活动性相关(表4),TNF超家族成员可能促成AutoAb的产生和临床疾病活动性的增强。
发明人先前的研究已表明,其他固有性和适应性介质在SLE发病机理中改变并加重临床疾病(36、42、45)。发明人观察到,包括IL-1a(图5A,p<0.01)和IL-6(图5B,p<0.05)在内的固有性介质在具有低度或活跃性疾病的AutoAb Pos SLE患者中增加。另外,IL-1a在AutoAb Pos SLE患者中区分开低度与活跃性疾病(图5A,p=0.0206)。在具有活跃性疾病的AutoAb Pos SLE患者中,包括Thl型介质IL-2(图5C)和Th17型介质IL-21(图5D)在内的适应性介质的增加的水平也显著升高(p<0.05)。其他炎性介质也升高,包括SCF(图6A,p=0.0356)和IL-8(图6B,p<0,0001)。尽管IL-10的血浆水平(图6C)在具有低疾病活动性的AutoAb Neg SLE患者中最高,这可能反映了其调节属性,但IL-10水平在具有活跃性疾病的AutoAb Neg与Pos SLE患者之间存在显著差异(p=0.0089),其中AutoAb Pos SLE患者中的水平较高,表明IL-10也可在其能力范围内充当B淋巴细胞激活和AutoAb产生的促炎性正调节物(54、55)。类似地,尽管TGF-β(图6D)在对照中最高,反映了SLE患者中的调节受到抑制(36、42、45),但相对于具有活跃性疾病的AutoAb Neg SLE患者,在AutoAb Pos SLE患者中的水平更高(p=0.0066)。这可能反映了TGF-β在分泌时与IL-6结合(图5B)驱动促炎性Th17型应答的能力(56、57)。
加权的狼疮疾病活动性免疫指数(LDAII)在SLE患者中区分活跃性疾病。鉴于与SLE患者中的活跃性临床疾病相关联的多种免疫途径的显著改变,发明人开发了狼疮疾病活动性免疫指数(LDAII)来总结个体患者的免疫失调,从而相对于在健康个体或对照(Ctls)中发现的免疫特征谱,比较SLE患者中的低度和活跃性疾病,图7A和7B。使用基于其与所检测的SLE相关AutoAb特异性的数量的相关性进行加权的对数变换的标准化的各可溶性介质水平来计算LDAII。各分析物的加权的、对数变换的、标准化的水平的总和产生全局LDAII(详细信息参见材料和方法(Materials and Methods))。此方法的一个明显优势是,它不需要每种细胞因子/趋化因子的截止值来确立阳性,并且对将在具有活跃性疾病的SLE患者中发现的与AutoAb特异性的积累具有更强(Spearman)相关性的那些未变换介质产生影响。与具有低疾病活动性的SLE患者和对照样品相比,具有活跃性临床疾病的SLE患者的LDAII(计算为由各可溶性介质贡献的子评分的总和)显著更高(图7A)。在算法中包括健康个体允许具有低疾病活动性的SLE患者的最佳区分。重要的是,LDAII与hSLEDAI评分显著相关(r=0.226,p<0.0001),区分开具有活跃性疾病或低疾病活动性的SLE患者与对照(AUC=0.671,p=0.0001),并带来0.94的阳性预测值(PPV),其中特异性为79%并且敏感性为49%,图7B。这些数据表明,另外的免疫失调与临床疾病活动性相关联,并且这种异质性失调可以用以形成具有影响临床护理潜力的LDAII。
LDAII将具有临床和血清学活跃性和静止性疾病的SLE患者区分开。除了基于临床疾病活动性(hSLEDAI)评分评估免疫失调的差异外,发明人还评估了LDAII是否可以相对于对照区分开临床活跃性(CA)与静止性(CQ)疾病,以及血清学活跃性(SA)与静止性(SQ)疾病,其定义为满足免疫学疾病活动性标准(结合AutoAb的抗dsDNA和/或低补体水平)(14、15)(图8A至8F)。具有临床活跃性疾病(CASA)的那些SLE患者的LDAII评分显著高于具有临床静止性疾病(CQSQ)的患者。两个SLE患者组均与对照具有显著差异(图8A),其中PPV为0.88,特异性为79%,并且敏感性为71%(AUC=0.804[p<0.0001]),图8B。这些数据表明,由SLE患者的多种异质性改变的免疫途径提供信息的免疫指数可以鉴定出临床疾病活动增强的患者。另外,发明人观察到CASA SLE患者中增加的介质水平(p<0.01),包括IL-6(图8C)、IL-8(图8D)和IP-10(图8E),以及增加的SLE相关AutoAb特异性数量(图8F)。有趣的是,尽管在临床和血清学上均是静止性的,但许多CQSQ患者仍具有至少一种AutoAb特异性呈阳性,并且炎性介质高于对照。
LDAII区分具有疾病活动性的肾器官表现的SLE患者。慢性免疫失调,包括致病性自身抗体的产生和炎性介质水平的增加,都导致进行性终末器官损伤。肾脏损伤和狼疮性肾炎是SLE最严重的后遗症,在很大程度上导致SLE相关的发病率和死亡率(58)。肾脏损伤的早期检测和治疗是必要的,以最大程度地减少永久性器官损伤的风险并保护肾功能。发明人评估了LDAII是否可以区分具有肾受累的SLE患者(图9A至9E),所述肾受累在具有活跃性疾病的SLE患者中存在(表3)。发明人发现,具有活跃性疾病和肾表现的SLE患者的LDAII评分显著高于具有活跃性疾病而没有肾表现的SLE患者(p=0.0099),图9A。具有(p=0.0002)或没有(p=0.0359)肾表现的具有活跃性疾病的SLE患者的LDAII评分高于具有低疾病活动性的SLE患者(图9A),其中NPV为0.96,特异性为49%,并且敏感性为88%(AUC=0.689[p=0.0029]),图9B。与未表现出疾病活动性的肾表现的那些患者相比,具有活跃性疾病和肾表现的SLE患者的SCF(图9C)和TNFRII(图9D)以及AutoAb特异性数量(图9E)均有增加(相对于非肾/活跃性疾病,p<0.001;相对于低疾病活动性随访者,p<0.01)。此外,具有活跃性疾病但无肾表现的SLE患者比具有低疾病活动性的SLE患者存在更多的SLE相关AutoAb特异性(p=0.0261,图9E)。这些数据表明,利用免疫失调来提供LDAII的信息可用于鉴定具有肾表现的SLE患者,所述患者将可能受益于更密切的临床监测,以预防由狼疮性肾炎和终末期肾病(ESRD)造成的发展、发病率和早期死亡率。
持续活跃性疾病对SLE患者来说是沉重的负担,并且影响生活质量(59),即使对于那些患有长期病的患者(19)。已显示疾病活动性随时间增加,并且大多数具有低疾病活动性的患者将发展为活跃性疾病(19),其与器官损伤和早期死亡率(24、25、60)相关,并突出了最佳管理SLE的差距。最终目标是使患者朝着低疾病活动性的方向发展,其中已显示其改善结果和预后(61),器官表现更少并且永久性器官损伤更少,带来明显副作用和发病率的治疗更少,并且死亡率更低。
识别并早期治疗以预防组织和器官损伤具有挑战性,因为疾病活动性的体征和症状在其出现后才被捕获。此外,类固醇(23)和管理疾病活动性所需的其他免疫抑制剂(27)的长期使用与增加的发病率相关。无法积极主动地管理临床疾病使医疗护理局限于反应性治疗,从而阻碍了添加或增加类固醇节用性免疫调节剂以防止终末器官损伤(6-8)并减轻SLE的致病和社会经济负担(29)的积极主动策略(28)。发明人先前已经证明,多种免疫途径的失调(36、37),连同SLE相关AutoAb特异性的积累(36、37、50)一起,是发展和转变为分类SLE的基础。发明人已进一步表明,在临床疾病突发之前发生的另外的免疫失调以及免疫途径失调和临床疾病的异质性可以被狼疮突发预测指数的出现利用(42、45)。有趣的是,此指数并不提供同时的临床疾病活动性的信息(42、45)。
发明人力图确定反映正在进行的临床疾病活动性的潜在免疫失调,并利用该信息来提供补充当前临床疾病活动性仪器的免疫指数的信息。在当前的研究中,发明人观察到来自活跃性相对于低疾病活动性的SLE患者样品中改变的免疫途径的数量和类型的异质性。这可部分解释具有活跃性疾病的SLE患者的炎性介质的先前报告的变化性(62-64),以及与单独或组合的疾病活动性的建议血清学标志物的不一致的相关性以及其受限的临床实用性,所述血清学标志物包括抗dsDNA、补体、补体分裂产物和炎性标志物(ESR和CRP)(65-67)。尽管免疫途径参与存在异质性,但每名患者均展示出来自至少一种途径的炎性介质的升高。鉴于SLE患者中存在的充分描述的IFN标记,毫不奇怪的是IFN相关介质受到影响,包括I型IFN(IFN-α)、II型IFN(IFN-γ)和IFN相关趋化因子(IP-10)的改变(68)。IFN相关介质以与疾病活动性(低相对于活跃性、临床/血清学上静止性相对于活跃性)相关,以及与患者子组中SLE相关AutoAb的存在相关的方式直接受到影响。先前的研究支持这一发现,其表明IFN途径可以反映疾病活动性(69),取决于患者子组中AutoAb的存在(70),但不能普遍解释同时的临床疾病活动性(71)。
存在多种介质,所述介质不与疾病活动性测量直接相关,而与AutoAb特异性的积累相关,并且能够区分开AutoAb阳性与阴性SLE患者内的低度与活跃性疾病临床随访者。在此类别中值得注意的是促进B淋巴细胞激活和AutoAb产生的TNF超家族介质BLyS和APRIL(72-74)。BLyS水平可以由I型(51)和II型(52)IFN介质的早期失调与狼疮相关自身抗体特异性积累的相互作用引起(37)。发明人观察到,与IFN相关介质类似,BLyS以及APRIL区分开具有活跃性疾病的AutoAb阴性与阳性SLE患者(图3-4)。然而,APRIL还能够区分AutoAb阴性患者(活跃性<低疾病活动性)和AutoAb阳性患者(活跃性>低疾病活动性)中的疾病活动性(低度相对于活跃性)。在一些情况下(AutoAb阴性样品)与BLyS的这种趋异和在其他情况下(AutoAb阳性样品)的趋同得到SLE中的其他研究的支持(72、75-78),并且可由BLyS和APRIL利用的独特且重叠的受体解释(72、73、79-82),BLyS和APRIL共享的那些受体/途径可能导致会聚的下游事件(AutoAb产生),而趋异的受体信号传导途径机制(例如APRIL-TACI相互作用(80))可有助于APRIL在负调节中的明显作用,正如发明人在AutoAb阴性SLE样品中看到的那样(图4A至4D)。
相对于狼疮疾病活动性,表面上具有双重抗炎和促炎功能的另一对可溶性介质是IL-10和TGF-β。已显示这两种介质均具有调节功能(83-88),并且发明人发现IL-10在具有低疾病活动性的AutoAb阴性SLE患者中最高(图6A至6D),而TGF-β在健康对照中最高,表明SLE患者中调节的丧失(87、88)。相反,具有活跃性疾病的SLE患者的AutoAb阳性(相对于阴性)样品中的IL-10和TGF-β水平增加(图6A至6D)。已显示IL-10相对于B淋巴细胞激活和AutoAb产生具有促炎特性(89),同时已显示TGF-β在IL-6的存在下促进Th17型应答(90、91),其导致IL-21分泌并刺激B淋巴细胞,从而促进AutoAb的产生和SLE的发病机理(92、93)。
这些免疫系统变化,结合从狼疮突发预测指数中吸取的经验教训(42,45),引导我们开发了狼疮疾病活动性免疫指数(LDAII),其通过可溶性介质改变提供信息并且通过其与SLE相关AutoAb积累的相关性进行加权。为最小化疾病活动性评估中的变化性而进行专门培训的时间和需要(31、35)通常限制经过验证的SLE疾病活动性测量在常规临床实践中的使用。用于提供LDAII的信息的与正在进行的临床疾病活动性相关的免疫系统变化的检测将允许鉴定需要更密切监测的患者,并能够使用免疫修饰治疗进行早期干预,以防止终末器官损伤(6-8)。正评分将指示在新的或恶化的临床表现发作之前需要进行更频繁的监测(94)和/或更换药物,以干涉(tamper)正在进行的炎症。负评分将表明维持了正在进行的监测和药物时间表(它们正在工作),需要更低频率的监测(尤其是在至少每季度进行随访的情况下)和/或考虑逐渐减少类固醇(23)或带来明显副作用的其他免疫调节剂(27)。已显示,更积极地参与临床护理的SLE患者具有较少的永久性器官损伤(95)。LDAII允许监测患者的免疫活动性(不包括临床疾病活动性),并警告他们及其医疗护理提供者需要进行进一步的临床评估。
临床静止性SLE患者处于增强的疾病活动性的风险中并且必须定期监测(14)。尽管具有活跃性疾病的SLE患者更可能满足hSLEDAI血清学标准(增加的DNA结合和/或低补体血症)并且抗dsDNA AutoAb呈阳性(表3),但这些因素中的任一者均未被显示是增强的临床疾病活动性的预测因素(14、42、45)。重要的是,与仅使用hSLEDAI疾病活动性评分(图1-2)相比,通过在CQSQ与CASA SLE患者之间存在的IL-6、IL-8和IP-10水平以及SLE相关AutoAb数量的较大差异,LDAII能够区分具有临床和血清学静止性(CQSQ)与活跃性(CASA)疾病的患者(图8A至8F)。此外,LDAII能够区分表现出肾表现的具有活跃性疾病的SLE患者(图9A至9E)。本发明允许分析途径特异性免疫失调,以实现针对具有肾表现和狼疮性肾炎(LN)的SLE患者的个性化的精准医疗。此外,本发明允许鉴定发展LN的风险最大的个体,并限定途径特异性免疫失调的量度,以选择最适当的LN患者进行给定的途径特异性生物治疗。在具有肾受累的SLE患者的当前评估中改变的两种介质是SCF和TNFRII(图9A至9E)。先前已表明SCF及其与受体c-kit的相互作用促进肾脏损伤,包括肾小球性肾炎和肾衰竭(96、97)。通常存在于淋巴细胞上的TNFRII(98-100)在慢性炎症的背景文中异常上调(包括在肾脏中),从而促进炎症、肾脏损伤和肾脏衰竭(101-104)。
检测作为临床疾病活动性的反映的免疫状态的变化的能力允许改善的疾病监控和治疗,从而可以改善患者结果并减轻SLE的致病性和社会经济负担(29)。本发明的特殊技术效应是计算患者的LDAII的优点,其不需要各可溶性介质的截止值来确立阳性,和/或不需要对在特定患者中促进疾病活动性的炎性途径有先验知识。本发明可以在SLE临床试验和疾病管理中的前瞻性多种族研究中进一步验证。取决于个体患者的综合临床征象,增强的临床疾病活动性和器官损伤风险的早期检测促进更密切的监测、一种或多种预防性治疗的选择,或在临床试验中包括与在LDAII内改变的途径相关的靶向生物学。
预期本说明书中讨论的任何实施方案可以相对于本发明的任何方法、试剂盒、试剂或组合物实施,并且反之亦然。此外,本发明的组合物可以用于实现本发明的方法。
应当理解,本文所述的具体实施方案以例证的方式示出并且不为本发明的限制。本发明的主要特征可以被应用于各种实施方案中而不背离本发明的范围。本领域技术人员将认识到或仅仅使用常规实验即能够确定本文所述的具体程序的许多等效方案。此类等效方案被认为在本发明的范围内并且由权利要求所涵盖。
本说明书中提到的所有公布和专利申请都指示本发明所属领域技术人员的技术水平。所有公布和专利申请都以引用方式并入本文,其程度如同每个个别公布或专利申请被特定且个别地指示以引用方式并入一般。
当在权利要求和/或说明书中与术语“包括”结合使用时,措辞“一个(a)”或“一种(an)”的使用可意指“一个/种”,但它也符合“一个/种或多个/种”、“至少一个/种”以及“一个/种或多于一个/种”的含义。除非明确指出仅指替代物或替代物是相互排斥的,否则在权利要求中使用术语“或”是用于指“和/或”,但是本公开支持仅指替代物的定义以及“和/或”。在整个本申请中,术语“约”用于指示值包括装置、用于确定所述值的方法的误差的固有变化,或研究受试者中存在的变化。
如本说明书和权利要求中所用,措辞“包含(comprising)”(和任何形式的包含,诸如“包含(comprise和comprises)”)、“具有(having)”(和任何形式的具有,诸如“具有(have和has)”)、“包括(including)”(和任何形式的包括,诸如“包括(includes和include)”)或“含有(containing)”(和任何形式的含有,诸如“含有(contains和contain)”)是包括性的或开放性的并且不排除另外的未叙述的要素或方法步骤。在本文提供的任何组合物和方法的实施方案中,“包含”可用“基本上由......组成”或“由......组成”代替。如本文所用,短语“基本上由......组成”需要指定的整数或步骤以及不实质影响所要求保护的发明的特征或功能的那些。如本文所用,术语“组成”用于仅指示所列举的整数(例如,特征结构、元件、特征、特性、方法/工艺步骤或限制)或整数组(例如,一个或多个特征结构、元件、特征、特性、方法/工艺步骤或限制)的存在。
如本文所用的术语“或其组合”是指该术语前面所列项目的所有排列和组合。例如,“A、B、C或其组合”旨在包括以下中的至少一个:A、B、C、AB、AC、BC或ABC,并且如果顺序在特定情况下很重要,那么还包括BA、CA、CB、CBA、BCA、ACB、BAC或CAB。继续此实例,明确包括的是包含一个或多个项目或术语的重复的组合,诸如BB、AAA、AB、BBC、AAABCCCC、CBBAAA、CABABB等。技术人员应理解,除非以其他方式从上下文明显看出,否则通常对任何组合中的项目或术语的数量没有限制。
如本文所用,近似词,诸如但不限于“约”、“基本上(substantial)”或“基本上(substantially)”是指这样的状况:当如此修饰时,理解为不一定是绝对的或完美的,而是将被视为对于本领域普通技术人员足够接近以保证将所述状况指定为存在。描述可变化的程度将取决于可以进行多大的改变并且仍然使本领域普通技术人员将修改的特征结构识别为仍然具有未修改的特征结构的所需特征和能力。一般来说,但以前面的讨论为准,本文通过诸如“约”的近似词修饰的数值可与指定值相差至少±1%、2%、3%、4%、5%、6%、7%、10%、12%或15%。
本文所公开和要求保护的所有组合物和/或方法可以根据本公开在无不当实验的情况下制备和执行。虽然本发明的组合物和方法已经根据优选的实施方案加以描述,但对本领域技术人员将显而易见的是,在不偏离本发明的概念、精神和范围的情况下,可使本文所述的组合物和/或方法以及本文所述方法的步骤或步骤的顺序发生变化。对于本领域技术人员显而易见的是,所有此类类似的替代和修改被认为处于由随附权利要求所限定的本发明的精神、范围和概念内。
为了帮助专利局和根据本申请发布的任何专利的任何读者解释本申请所附的权利要求,申请人希望注意到,他们并不意图使用所附权利要求中的任一者来援引美国法典第35篇第112条段落6、美国法典第35篇第112条段落(f)或等效物,因为它在其提交日期存在,除非在特定权利要求中明确使用措辞“用于……的装置”或“用于……的步骤”。
对于每个权利要求,每个从属权利要求既可以从属于独立权利要求,又可以从属于每个和每一个权利要求的每个先前从属权利要求,只要先前权利要求为权利要求项或要素提供了适当的前提基础即可。
参考文献
1.Lim SS,Bayakly AR,Helmick CG,Gordon C,Easley KA,Drenkard C.Theincidence and prevalence of systemic lupus erythematosus,2002-2004:TheGeorgia Lupus Registry.Arthritis&rheumatology.2014;66(2):357-68.
2.Somers EC,Marder W,Cagnoli P,Lewis EE,DeGuire P,Gordon C,etal.Population-based incidence and prevalence of systemic lupus erythematosus:the Michigan Lupus Epidemiology and Surveillance program.Arthritis&rheumatology.2014;66(2):369-78.
3.Tan EM,Cohen AS,Fries JF,Masi AT,McShane DJ,Rothfield NF,et al.The1982revised criteria for the classification of systemic lupuserythematosus.Arthritis and Rheumatism.1982;25(11):1271-7.
4.Hochberg MC.Updating the American College of Rheumatology revisedcriteria for the classification of systemic lupus erythematosus.Arthritis andRheumatism.1997;40(9):1725.
5.Feldman CH.Hiraki LT,Liu J,Fischer MA,Solomon DH,Alarcon GS,etal.Epidemiology and sociodemographics of systemic lupus erythematosus andlupus nephritis among US adults with Medicaid coverage,2000-2004.ArthritisRheum.2013;65(3):753-63.
6.Kasitanon N,Intaniwet T,Wangkaew S,Pantana S,Sukitawut W,LouthrenooW.The clinically quiescent phase in early-diagnosed SLE patients:inceptioncohort study.Rheumatology(Oxford).2015;54(5):868-75.
7.Oglesby A,Korves C,Laliberte F,Dennis G,Rao S,Suthoff ED,etal.Impact of early versus late systemic lupus erythematosus diagnosis onclinical and economic outcomes.Appl Health Econ Health Policy.2014;12(2):179-90.
8.Thong B,Olsen NJ.Systemic lupus erythematosus diagnosis andmanagement.Rheumatology(Oxford).2017;56(suppl_1):i3-i13.
9.Conti F,Ceccarelli F.Perricone C,Leccese I,Massaro L,Pacucci VA,etal.The chronic damage in systemic lupus erythematosus is driven by flares,glucocorticoids and antiphospholipid antibodies:results from a monocentriccohort.Lupus.2016;25(7):719-26.
10.Barral PM,Sarkar D,Su ZZ.Barber GN,DeSalle R,Racaniello VR,etal.Fnnctions of the cytoplasmic RNA sensors RIG-I and MDA-5:key regulators ofinnate immunity.Pharmacol Ther.2009;124(2):219-34.
11.Faurschou M,Starklint H,Halberg P,Jacobsen S.Prognostic factors inlupus nephritis:diagnostic and therapeutic delay increases the risk ofterminal renal failure.J Rheumatol.2006;33(8):1563-9.
12.Bruce IN,O′Keeffe AG.Farewell V,Hanly JG.Manzi S.Su L,etal.Factors associated with damage accrual in patients with systemic lupuserythematosus:results from the Systemic Lupus International CollaboratingClinics(SLICC)Inception Cohort.Ann Rheum Dis.2015;74(9):1706-13.
13.Alarcon GS,McGwin G,Jr.,Petri M,Ramsey-Goldman R,Fessler BJ,VilaLM,et al.Time to renal disease and end-stage renal disease in PROFILE:amultiethnic lupus cohort.PLoS Med.2006;3(10):e396.
14.Steiman AJ,Gladman DD,Ibanez D,Urowitz MB.Prolonged serologicallyactive clinically quiescent systemic lupus erythematosus:frequency andoutcome.J Rheumatol.2010;37(9):1822-7.
15.Ng KP,Manson JJ,Rahman A,Isenberg DA.Association of antinucleosomeantibodies with disease flare in serologically active clinically quiescentpatients with systemic lupus erythematosus.Arthritis Rheum.2006;55(6):900-4.
16.Petri M,Kim MY,Kalunian KC,Grossman J,Hahn BH,Sammaritano LR.etal.Combined oral contraceptives in women with systemic lupus erythematosus.NEngl J Med.2005;353(24):2550-8.
17.Hay EM,Bacon PA,Gordon C,Isenberg DA,Maddison P,Snaith ML,etal.The BILAG index:a reliable and valid instrument for measuring clinicaldisease activity in systemic lupus erythematosus.Q J Med.1993;86(7):447-58.
18.Lam GK,Petri M.Assessment of systemic lupus erythematosus.Clin ExpRheumatol.2005;23(5 Suppl 39):S120-32.
19.Peschken CA,Wang Y,Abrahamowicz M,Pope J,Silverman E,Sayani A,etal.Persistent Disease Activity Remains a Burden for Patients with SystemicLupus Erythematosus.J Rheumatol.2018.
20.Sheane BJ,Gladman DD,Su J,Urowitz MB.Disease Outcomes inGlucocorticosteroid-Naive Patients With Systemic LupusErythematosus.Arthritis care&research.2017;69(2):252-6.
21.Zonana-Nacach A,Barr SG,Magder LS.Petri M.Damage in systemic lupuserythematosus and its association with corticosteroids.Arthritis Rheum.2000;43(8):1801-8.
22.Thamer M,Hernan MA,Zhang Y,Cotter D,Petri M.Prednisone,lupusactivity,and permanent organ damage.J Rheumatol.2009;36(3):560-4.
23.A1 Sawah S,Zhang X,Zhu B,Magder LS,Foster SA,Iikuni N,et al.Effectof corticosteroid use by dose on the risk of developing organ damage overtime in systemic lupus erythematosus-the Hopkins Lupus Cohort.Lupus science&medicine.2015;2(1):e000066.
24.Petri M,Purvey S,Fang H,Magder LS.Predictors of organ damage insystemic lupus erythematosus:the Hopkins Lupus Cohort.Arthritis Rheum.2012;64(12):4021-8.
25.Lopez R,Davidson JE,Beeby MD,Egger PJ,Isenberg DA.Lupus diseaseactivity and the risk of subsequent organ damage and mortality in a largelupus cohort.Rheumatology(Oxford).2012;51(3):491-8.
26.Maroz N,Segal MS.Lupus nephritis and end-stage kidney disease.TheAmerican journal of the medical sciences.2013;346(4):319-23.
27.Durcan L,Petri M.Why targeted therapies are necessary for systemiclupus erythematosus.Lupus.2016;25(10):1070-9.
28.Doria A,Gatto M,Zen M,Iaccarino L,Punzi L.Optimizing outcome inSLE:treating-to-target and definition of treatment goals.Autoimmun Rev.2014;13(7):770-7.
29.Lau CS,Mak A.The socioeconomic burden of SLE.Nat RevRheumatol.2009;5(7):400-4.
30.Manzi S,Sanchez-Guerrero J,Merrill JT,Furie R,Gladman D,NavarraSV,et al.Effects of belimumab,a B lymphocyte stimulator-specific inhibitor,ondisease activity across multiple organ domains in patients with systemiclupus erythematosus:combined results from two phase III trials.Ann RheumDis.2012;71(11):1833-8.
31.Mikdashi J,Nived O.Measuring disease activity in adults withsystemic lupus erythematosus:the challenges of administrative burden andresponsiveness to patient concerns in clinical research.Arthritis ResTher.2015;17:183.
32.Thanou A,Chakravarty E,James JA,Merrill JT.Which outcome measuresin SLE clinical trials best reflect medical judgment?Lupus science&medicine.2014;1(1):e000005.
33.Thanou A,Stavrakis S,Dyer JW,Munroe ME,James JA,Merrill JT.Impactof heart rate variability,a marker for cardiac health,on lupus diseaseactivity.Arthritis Res Ther.2016;18:197.
34.Isenberg DA,Rahman A,Allen E,Farewell V,Akil M,Bruce IN,etal.BILAG 2004.Development and initial validation of an updated version of theBritish Isles Lupus Assessment Group′s disease activity index for patientswith systemic lupus erythematosus.Rheumatology(Oxford).2005;44(7):902-6.
35.Mosca M,Tani C,Aringer M,Bombardieri S,Boumpas D,Cervera R,etal.Development of quality indicators to evaluate the monitoring of SLEpatients in routine clinical practice.Autoimmun Rev.2011;10(7):383-8.
36.Lu R,Munroe ME,Guthridge JM,Bean KM,Fife DA,Chen H,etal.Dysregulation of Innate and Adaptive Serum Mediators Precedes SystemicLupus Erythematosus Classification and Improves Prognostic Accuracy ofAutoantibodies J Autoimmun.2016;74:182-93.
37.Munroe ME,Lu R,Zhao YD,Fife DA,Robertson JM,Guthridge JM,etal.Altered type II interferon precedes autoantibody accrual and elevated typeI interferon activity prior to systemic lupus ervthematosusclassification.Ann Rheum Dis.2016;75(11):2014-21.
38.Arriens C,Wren JD,Munroe ME,Mohan C.Systemic lupus erythematosusbiomarkers:the challenging quest.Rheumatology(Oxford).2016.
39.Crowe SR,Merrill JT,Vista ES,Dedeke AB,Thompson DM,Stewart S,etal.Influenza vaccination responses in human systemic lupus crythematosus:impact of clinical and demographic features.Arthritis Rheum.2011;63(8):2396-406.
40.Kheir JM,Guthridge CJ,Johnston JR,Adams LJ,Rasmussen A,Gross TF,etal.Unique clinical characteristics,autoantibodies and medication use inNative American patients with systemic lupus erythematosus.Lupus science&medicine.2018;5(1):c000247.
41.Munroe ME,Young KA,Kamen DL,Guthridge JM,Niewold TB,CostenbaderKH,et al.Discerning Risk of Disease Transition in Relatives of Systemic LupusErythematosus Patients Utilizing Soluble Mediators and ClinicalFeatures.Arthritis&rheumatology.2017;69(3):630-42.
42.Munroe ME,Vista ES.Merrill JT,Guthridge JM,Roberts VC,JamesJA.Pathways of impending disease flare in African-American systemic lupuserythematosus patients.J Autoimmun.2017;78:70-8.
43.Aberle T,Bourn RL,Munroe ME,Chen H,Roberts VC,Guthridge JM,etal.Clinical and serological features distinguish patients with incompletelupus classification from systemic lupus erythematosus patients andcontrols.Arthritis care&research.2017.
44.Slight-Webb S,Lu R,Ritterhouse LL,Munroe ME,Maecker HT,Fathman CG,et al.Autoantibody-Positive Healthy Individuals Display Unique ImmuneProfiles That May Regulate Autoimmunity.Arthritis&rheumatology.2016;68(10):2492-502.
45.Munroe ME,Vista ES,Guthridge JM,Thompson LF.Merrill JT,JamesJA.Pro-inflammatory adaptive cytokines and shed tumor necrosis factorreceptors are elevated preceding systemic lupus erythematosus diseaseflare.Arthritis&rheumatology.2014;66(7):1888-99.
46.Stringer EA,Baker KS,Carroll IR,Montoya JG,Chu L,Maecker HT,etal.Daily cytokine fluctuations,driven by leptin,are associated with fatigueseverity in chronic fatigue syndrome:evidence of inflammatorypathology.Journal of translational medicine.2013;11(1):93.
47.Dupont NC,Wang K,Wadhwa PD,Culhane JF,Nelson EL.Validation andcomparison of luminex multiplex cytokine analysis kits with ELISA:determinations of a panel of nine cytokines in clinical sample culturesupernatants.J Reprod Immunol.2005;66(2):175-91.
48.Dossus L,Becker S,Achaintre D,Kaaks R,Rinaldi S.Validity ofmultiplex-based assays for cytokine measurements in serum and plasma from″non-diseased″subjects:comparison with ELISA.J Immunol Methods.2009;350(1-2):125-32.
49.Bruner BF,Guthridge JM,Lu R,Vidal G,Kelly JA,Robertson JM,etal.Comparison of autoantibody specificities between traditional and bead-based assays in a large,diverse collection of patients with systemic lupuserythematosus and family members.Arthritis Rheum.2012;64(11):3677-86.
50.Arbuckle MR,McClain MT,Rubertone MV,Scofield RH,Dennis GJ,JamesJA.et al.Development of autoantibodies before the clinical onset of systemiclupus erythematosus.N Engl J Med.2003;349(16):1526-33.
51.Lopez P,Scheel-Toellner D,Rodriguez-Carrio J,Caminal-Montero L,Gordon C,Suarez A.Interferon-alpha-induced B-lymphocyte stimulator expressionand mobilization in healthy and systemic lupus erthymatosusmonocvtes.Rheumatology(Oxford).2014;53(12):2249-58.
52.Harigai M,Kawamoto M,Hara M,Kubota T,Kamatani N,MivasakaN.Excessive production of IFN-gamma m patients with systemic lupuserythematosus and its contribution to induction of B lymphocyte stimulator/Bcell-activating factor/TNF ligand superfamily-13B.J Immunol.2008;181(3):2211-9.
53.Vincent FB,Morand EF,Schneider P,Mackay F.The BAFF/APRIL system inSLE pathogenesis.Nat Rev Rheumatol.2014.
54.Kawamoto M,Harigai M,Hara M,Kawaguchi Y,Tezuka K,Tanaka M,etal.Expression and function of inducible co-stimulator in patients withsystemic lnpus erythematosus:possible involvement in excessive interferon-gamma and anti-double-stranded DNA antibody production.Arthritis ResTher.2006;8(3):R62.
55.Sim JH,Kim HR,Chang SH,Kim IJ,Lipsky PE,Lee J.Autoregulatoryfunction of interleukin-10-producing pre-naive B cells is defective insystemic lupus crythematosus.Arthritis Res Ther.2015;17:190.
56.Wang D,Huang S,Yuan X,Liang J,Xu R,Yao G,,et al.The regulation ofthe Treg/Th17balance by mesenchymal stem cells in human systemic lupuserythematosus.Cellular&molecular immunology.2017;14(5):423-31.
57.Shah K,Lee WW,Lee SH,Kim SH.Kang SW.Craft J,et al.Dysregulatedbalance of Thl7 and Thl cells in systemic lupus erythematosus.Arthritis ResTher.2010;12(2):R53.
58.Borchers AT,Leibushor N,Naguwa SM,Cheema GS,Shoenfeld Y,GershwinME.Lupus nephritis:a critical review.Autoimmun Rev.2012;12(2):174-94.
59.Mok CC,Ho LY,Cheung MY,Yu KL.To CH.Effect of disease activity anddamage on quality of life in patients with systemic lupus erythematosus:a 2-year prospective study.Scand J Rheumatol.2009;38(2):121-7.
60.Eder L,Urowitz MB,Gladman DD.Damage in lupus patients--what havewe learned so far?Lupus.2013;22(12):1225-31.
61.Polachek A,Gladman DD,Su J,Urowitz MB.Defining Low DiseaseActivity in Systemic Lupus Erythematosus.Arthritis care&research.2017;69(7):997-1003.
62.Tokano Y,Morimoto S,Kaneko H,Amano H,Nozawa K,Takasaki Y,etal.Levels of IL-12 in the sera ofpatients with systemic lupus ervthematosus(SLE)--relation to Th1-and Th2-derived cytokines.Clin Exp Immunol.1999;116(1):169-73.
63.Gomez D,Correa PA,Gomez LM,Cadena J,Molina JF,Anaya JM.Th1/Th2cytokines in patients with systemic lupus erythematosus:is tumor necrosisfactor alpha protective?Semin Arthritis Rheum.2004;33(6):404-13.
64.Mok MY,Wu HJ,Lo Y,Lau CS.The Relation of Interleukin 17(IL-17)andIL-23 to Th1/Th2 Cytokines and Disease Activity in Systemic LupusErvthematosus.J Rheumatol.2010;37(10):2046-52.
65.Liu CC,Ahearn JM.The search for lupus biomarkers.Best practice&research Clinical rheumatology.2009;23(4):507-23.
66.Petri MA,van Vollenhoven RF,Buyon J,Levy RA,Navarra SV,Cervera R,et al.Baseline Predictors of Systemic Lupus Erythematosus Flares:Data Fromthe Combined Placebo Groups in the Phase III Belimumab Trials.ArthritisRheum.2013;65(8):2143-53.
67.Villegas-Zambrano N,Martinez-Taboada VM,Bolivar A,San Martin M,Alvarez L,Marin MJ,et al.Correlation between clinical activity andserological markers in a wide cohort of patients with systemic lupuservthematosus:an eight-year prospective study.Ann N Y Acad Sci.2009;1173:60-6.
68.Chiche L,Jourde-Chiche N,Whalen E,Presnell S,Gersuk V,Dang K,etal.Modular transcriptional repertoire analyses of adults with systemic lupuserythematosus reveal distincttype I and type II interferonsignatures.Arthritis&rheumatology.2014;66(6):1583-95.
69.Rose T,Grutzkau A,Hirseland H,Huscher D,Dahnrich C,Dzionek A,etal.IFNalpha and its response proteins,IP-10and SIGLEC-I,are biomarkers ofdisease activity in systemic lupus erythematosus.Ann Rheum Dis.2013;72(10):1639-45.
70.Ko K,Koldobskaya Y,Rosenzweig E,Niewold TB.Activation of theInterferon Pathway is Dependent Upon Autoantibodies in African-American SLEPatients,but Not in European-American SLE Patients.Frontiers inimmunology.2013;4:309.
71.Kennedy WP,Maciuca R,Wolslegel K,Tew W,Abbas AR,Chaivorapol C,etal.Association of the interferon signature metric with serological diseasemanifestations but not global activity scores in multiple cohorts of patientswith SLE.Lupus science&medicine,2015;2(1):e000080.
72.Kim J,Gross JA,Dillon SR,Min JK,Elkon KB.Increased BCMA expressionin lupus marks activated B cells,and BCMA receptor engagement enhances theresponse to TLR9 stimulation.Autoimmunity.2011;44(2):69-81.
73.Schneider P.The role of APRIL and BAFF in lymphocyteactivation.Curr Opin Immunol.2005;17(3):282-9.
74.Roschke V,Sosnovtseva S,Ward CD,Hong JS,Smith R,Albert V,etal.BLyS and APRIL form biologically active heterotrimers that are expressedin patients with systemic immune-based rheumatic diseases.J Immnunol.2002;169(8):4314-21.
75.Gordon C,Wofsy D,Wax S,Li Y,Pena Rossi C,Isenberg D.Post-hocanalysis of the Phase II/III APRIL-SLE study:Association between response toatacicept and serum biomarkers including BLyS and APRIL.Arthritis&rheumatology.2017;69(1):122-30.
76.Parodis I,Zickert A,Sundelin B,Axelsson M,Gerhardsson J,Svenungsson E,et al.Evaluation of B lymphocyte stimulator and a proliferationinducing ligand as candidate biomarkers in lupus nephritis based on clinicaland histopathological outcome following induction therapy.Lupus science&medicine.2015;2(1):e000061.
77.Morel J,Roubille C,Planelles L,Rocha C,Fernandez L,Lukas C,etal.Serum levels of tumour necrosis factor family members a proliferation-inducing ligand(APRIL)and B lymphocyte stimulator(BLyS)are inverselycorrelated in systemic lupus erythematosus.Ann Rheum Dis.2009;68(6):997-1002.
78.Stohl W,Metyas S,Tan SM,Cheema GS,Oamar B,Roschke V,et al.Inverseassociation between circulating APRIL levels and serological and clinicaldisease activity in patients with systemic lupus erythematosus.Ann RheumDis.2004;63(9):1096-103.
79.Salazar-Camarena DC,Ortiz-Lazareno PC,Cruz A,Oregon-Romero E,Machado-Contreras JR,Munoz-Valle JF,et al.Association of BAFF,APRIL serumlevels,BAFF-R,TACI and BCMA expression on peripheral B-cell subsets withclinical manifestations in systemic lupus erythematosus.Lupus.2016;25(6):582-92.
80.Tai YT,Lin L,Xing L,Cho SF,Yu T,Acharya C,et al.APRIL signalingvia TACI mediates immunosuppression byT regulatory cells in multiple myeloma:therapeutic implications.Leukemia.2018.
81.Davidson A.Targeting BAFF in autoimmunity.Curr Opin Immunol.2010;22(6):732-9.
82.Day ES,Cachero TG,Qian F,Sun Y,Wen D,Pelletier M,et al.Selectivityof BAFF/BLyS and APRIL for binding to the TNF family receptors BAFFR/BR3 andBCMA.Biochemistry.2005;44(6):1919-31.
83.Fujio K,Okamura T,Sumitomo S,Yamamoto K.Regulatory T cell-mediatedcontrol of autoantibodv-induced inflammation.Frontiers in immunology.2012;3:28.
84.Carter NA,Rosser EC,Mauri C.Interlcukin-10 produced by B cells iscrucial for the suppression of Th17/Th1 responses,induction of T regulatorytype 1 cells and reduction of collagen-induced arthritis.Arthritis ResTher.2012;14(1):R32.
85.Okamoto A,Fujio K,Okamura T,Yamamoto K.Regulatory T-cell-associated cytokines in systemic lupus erythematosus.J BiomedBiotechnol.2011;2011:463412.
86.Chen Q,Kim YC,Laurence A,Punkosdy GA,Shevach EM.IL-2 controls thestabiliry of Foxp3 expression in TGF-beta-induced Foxp3+T cells in vivo.JImmunol.2011;186(11):6329-37.
87.Barreto M,Ferreira RC,Lourenco L,Moraes-Fontes MF,Santos E,AlvesM,et al.Low frequency of CD4+CD25+Treg in SLE patients:a heritable traitassociated with CTLA4 and TGFbeta gene variants.BMC Immunol.2009;10:5.
88.Atfy M.Amr GE,Elnaggar AM,Labib HA,Esh A,Elokely AM.Impact of CD4+CD25high regulatory T-cells and FoxP3 expression in the peripheral blood ofpatients with systemic lupus erythematosus.The Egyptian journal ofimmunology/Egyptian Association of Immunologists.2009;16(1):117-26.
89.Llorente L,Zou W,Levy Y,Richaud-Patin Y,Wijdenes J,Alcocer-VarelaJ,et al.Role of interleukin 10 in the B lymphocyte hyperactivity andautoantibody production of human systemic lupus erythematosus.J Exp Med.1995;181(3):839-44.
90.Striz I,Brabcova E,Kolesar L
91.Lee Y,Awasthi A,Yosef N,Quintana FJ,Xiao S,Peters A,etal.Induction and molecular signature of pathogenic TH17 cells.NatImmunol.2012;13(10):991-9.
92.Sarra M,Monteleone G.Interleukin-21:a new mediator of inflammationin systemic lupus erythematosus.J Biomed Biotechnol.2010;2010:294582.
93.Nalbandian A,Crispin JC,Tsokos GC.Interleukin-17and systemic lupuserythematosus:current concepts.Clin Exp Immunol.2009;157(2):209-15.
94.Ibanez D,Gladman DD,Touma Z,Nikpour M,Urowitz MB.Optimal frequencyof visits for patients with systemic lupus erythematosus to measure diseaseactivity over time.J Rheumatol.2011;38(1):60-3.
95.Ward MM,Sundaramurthy S,Lotstein D,Bush TM,Neuwelt CM,Street RL,Jr.Participatory patient-physician communication and morbidity in patientswith systemic lupus erythematosus.Arthritis Rheum.2003;49(6):810-8.
96.El-Koraie AF,Baddour NM,Adam AG,El Kashef EH,El Nahas AM.Role ofstem cell factor and mast cells in the progression of chronicglomerulonephritides.Kidney Int.2001;60(1):167-72.
97.Kitoh T,Ishikawa H,Ishii T,Nakagawa S.Elevated SCF levels in theserum of patients with chronic renal failure.Br J Haematol.1998;102(5):1151-6.
98.Kim EY,Priatel JJ,Teh SJ,Teh HS.TNF receptor type 2(p75)functionsas a costimulator for antigen-driven T cell responses in vivo.J Immunol.2006;176(2):1026-35.
99.Kim EY,Teh HS.TNF type 2 receptor(p75)lowers the threshold of Tcell activation.J Immumol.2001;167(12):6812-20.
100.Munroe ME.Bishop GA.Role of tumor necrosis factor(TNF)receptor-associated factor 2(TRAF2)in distinct and overlapping CD40 and TNF receptor2/CD120b-mediated B lymphocyte activation.J Biol Chem.2004:279(51):53222-31.
101.Speeckaert MM,Speeckaert R,Laute M,Vanholder R,Delanghe JR.Tumornecrosis factor receptors:biology and therapeutic potential in kidneydiseases.American journal of nephrology.2012;36(3):261-70.
102.Kurashina T,Nagasaka S,Watanabe N,Yabe D,Sugi N,Nin K,etal.Circulating TNF receptor 2 is closely associated with the kidney functionin non-diabetic Japanese subjects.Journal of atherosclerosis andthrombosis.2014;21(7):730-8.
103.AI-Lamki RS,Mayadas TN.TNF receptors:signaling pathways andcontribution to renal dysfunction.Kidney Int.2015;87(2):281-96.
104.Upadhyay A,Larson MG,Guo CY,Vasan RS,Lipinska I,O′Donnell CJ,etal.Inflammation,kidney function and albuminuria in the Framingham Offspringcohort.Nephrol Dial Transplant.2011;26(3):920-6.
- 表征疾病活动性的系统性红斑狼疮(SLE)疾病活动性免疫指数的生物标志物
- 一种反映IgG4相关性疾病的疾病活动性的生物标志物及其用途
