安罗替尼及其药学上可接受的盐在制备治疗多发性骨髓瘤药物中的应用
文献发布时间:2023-06-19 12:16:29
技术领域
本发明涉及肿瘤药物技术领域,尤其涉及安罗替尼及其药学上可接受的盐在制备治疗多发性骨髓瘤药物中的应用。
背景技术
多发性骨髓瘤(multiple myeloma,MM)是一种起源于浆细胞的异常增殖性的恶性肿瘤,常伴有单克隆免疫球蛋白或轻链(M蛋白)过度生成。恶变的浆细胞及其分泌的M蛋白均可导致相关器官或组织损伤。MM的临床表现可以概况为CRAB现象:高钙血症、肾脏损害、贫血以及多发性溶骨性损害。MM好发于老年人,中位发病年龄为69岁,随着年龄增加死亡率显著增加。近年来,随着蛋白酶体抑制剂、免疫调节剂以及新的靶向治疗药物的问世,MM的预后得到了改善。尽管如此,MM仍然是不可治愈的疾病,根据美国SEER数据库的最新统计,MM患者5年存活率为52.2%,患者在缓解后达到平台期,之后会迅速复发及进展,大多数患者在整个疾病过程中接受过四种或更多种不同的疗法。所以如何使患者受益,延长其生存期,仍然是临床医生面临的棘手问题。临床上亟需发现更多新药进一步改善预后。
盐酸安罗替尼(AL3818,Anlotinib),作为一种口服的新型小分子多靶点酪氨酸激酶抑制剂(TKI)药物,相比于其他TKI类药物,它具有高效和选择性,能有效抑制血管内皮生长因子受体(VEGFR)、血小板衍生生长因子受体(PDGFR)、成纤维细胞生长因子受体(FGFR)、c-Kit等多种激酶,具有明显的抗肿瘤血管生成和抑制肿瘤生长的作用,同时对成纤维细胞的生长也有抑制作用,并且能有效抑制肿瘤的侵袭,延缓肿瘤的转移。2018年,国家食品药品监督管理总局(CFDA)已正式批准盐酸安罗替尼用于晚期非小细胞肺癌(NSCLC)患者的三线治疗。目前针对安罗替尼的多种癌症临床试验正在开展当中,包括软组织肉瘤、结直肠癌、甲状腺髓样癌、分化型甲状腺癌以及食管鳞癌。但是关于安罗替尼在多发性骨髓瘤中的应用尚未见报道。
发明内容
本发明的目的在于,提供安罗替尼及其药学上可接受的盐在制备治疗多发性骨髓瘤药物中的应用。
为了实现上述目的,本发明提供了安罗替尼及其药学上可接受的盐在制备治疗多发性骨髓瘤药物中的应用。
作为一个优选方案,所述安罗替尼药学上可接受的盐为盐酸安罗替尼。
作为一个优选方案,所述多发性骨髓瘤包括对硼替佐米敏感以及对硼替佐米耐药的多发性骨髓瘤。
安罗替尼可以以它的游离碱形式给药,也可以以其盐、水合物和前药的形式给药,该前药在体内转化成安罗替尼的游离碱形式。安罗替尼的药学上可接受的盐在本发明的范围内,可按照本领域公知的方法由不同的有机酸和无机酸产生所述盐。包括但不限于与无机酸如盐酸、氢溴酸、硫酸、硝酸、磷酸等等形成的酸加成盐;或者与有机酸如乙酸、三氟乙酸、丙酸、己酸、庚酸、环戊烷丙酸、乙醇酸、丙酮酸、乳酸、丙二酸、琥珀酸、苹果酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、1,2-乙二磺酸、2-羟基乙磺酸、苯磺酸、对氯苯磺酸、对甲苯磺酸、3-苯基丙酸、三甲基乙酸、叔丁基乙酸、十二烷基硫酸、葡糖酸、谷氨酸、羟基萘甲酸、水杨酸、硬脂酸等形成的酸加成盐。
在本发明的一些具体实施方案中,以安罗替尼的盐酸盐的形式给药。在一些具体的实施方案中,以安罗替尼的一盐酸盐或二盐酸盐的形式给药。在一些具体的实施方案中,以安罗替尼的盐酸盐的晶体形式给药。在一些具体的实施方案中,以安罗替尼的二盐酸盐的晶体形式给药。
安罗替尼或其药学上可接受的盐可通过多种途径给药,该途径包括但不限于:口服、肠胃外、腹膜内、静脉内、动脉内、透皮、舌下、肌内、直肠、透颊、鼻内、经吸入、阴道、眼内、经局部、皮下、脂肪内、关节内和鞘内。在一些具体的实施方案中,通过口服给药,具体剂型包括但不限于片剂、胶囊剂、粉剂、颗粒剂、滴丸、糊剂、散剂等,优选片剂和胶囊剂。其中片剂可以是普通片剂、分散片、泡腾片、缓释片、控释片或肠溶片,胶囊剂可以是普通胶囊、缓释胶囊、控释胶囊或肠溶胶囊。所述的口服制剂可使用本领域公知的药学上可接受的载体通过常规方法制得。药学上可接受的载体包括但不限于填充剂、吸收剂、润湿剂、粘合剂、崩解剂、润滑剂等。填充剂包括淀粉、乳糖、甘露醇、微晶纤维素等;吸收剂包括但不限于硫酸钙、磷酸氢钙、碳酸钙等;润湿剂包括水、乙醇等;粘合剂包括但不限于羟丙甲纤维素、聚维酮、微晶纤维素等;崩解剂包括但不限于交联羧甲基纤维素钠、交联聚维酮、表面活性剂、低取代羟丙基纤维素等;润滑剂包括但不限于硬脂酸镁、滑石粉、聚乙二醇、十二烷基硫酸钠、微粉硅胶、滑石粉等。药用辅料还包括着色剂、甜味剂等。
安罗替尼抑制多种重要的信号通路(包括MAPK、PI3K/Akt/mTOR、JAK/STAT和NF-κB通路),并通过增强癌基因c-Myc的泛素化作用促进c-Myc的降解。此外,安罗替尼还通过干扰MM细胞中纺锤体的正常形成、染色体排列/分离和胞质分裂,引起有丝分裂阻滞。重要的是,安罗替尼对于硼替佐米耐药的MM细胞也显示强大的细胞毒性。
本发明的优点在于,安罗替尼在多种MM细胞系、原代细胞以及MM小鼠模型中具有显著的抗MM效应,同时能够克服骨髓微环境对MM细胞的保护作用,并且抑制MM小鼠体内肿瘤的生长,同时显示良好的安全性。对于硼替佐米耐药的MM细胞也显示强大的细胞毒性。此外,安罗替尼与硼替佐米联合可产生协同相加作用,预示安罗替尼治疗MM具有很好的治疗前景。
附图说明
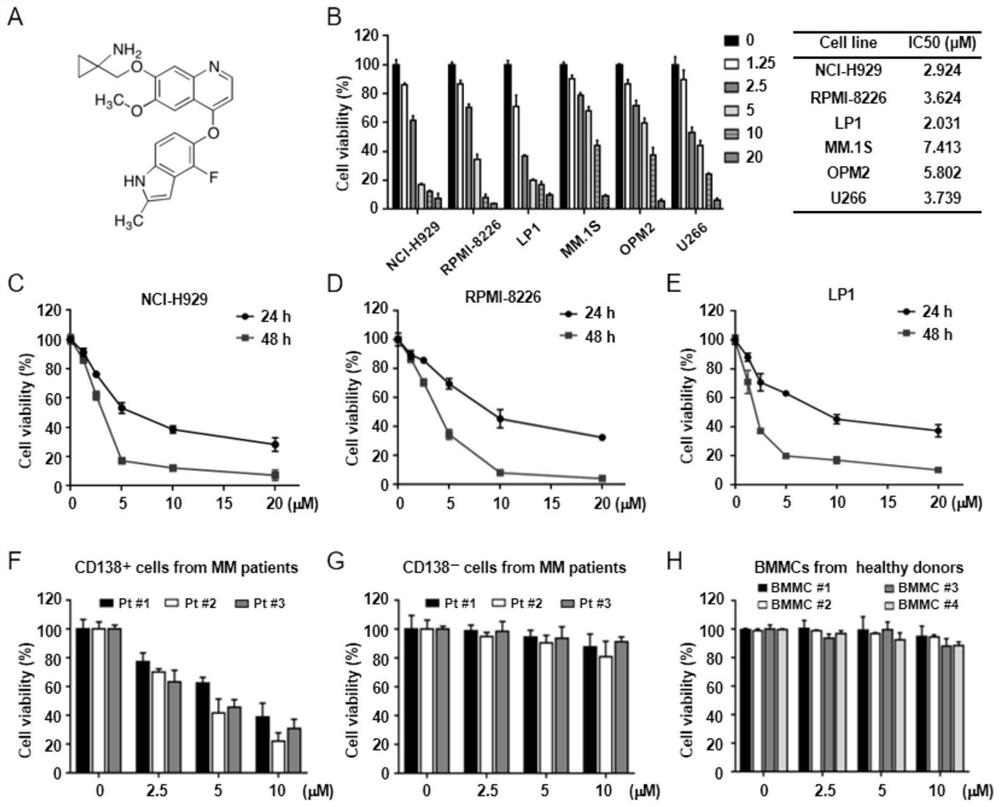
图1为安罗替尼抑制MM细胞系和原代细胞的增殖。(A)安罗替尼的分子结构式,分子量为407.4。(B)用安罗替尼(0-20μM)处理MM细胞株NCI-H929、RPMI-8226、LP1、MM.1S、OPM2和U266,48h后用CCK8检测细胞活力,计算IC50值。(C-E)用安罗替尼处理NCI-H929、RPMI-8226和LP1细胞24和48小时,然后CCK8检测细胞活力。(F-G)从三名MM患者的BMMCs中分离出的CD138+以及CD138-细胞,用安罗替尼(0-10μM)处理24小时,CCK8检测细胞活力。(H)用安罗替尼(0-10μM)处理4名健康供体的正常BMMCs,24小时后采用CCK8检测细胞活力。以上实验均至少重复三次并且得到相近结果。
图2为安罗替尼可以拮抗骨髓微环境对MM细胞的保护作用。(A-B)先从患者BM中分选出骨髓间充质干细胞,然后将NCI-H929或RPMI-8226细胞单独培养,或者与BMSCs共培养,再给予安罗替尼(0-10M)处理48小时,最后用流式细胞仪检测细胞的凋亡。(C-D)在加入或不加入IL-6(10ng/ml)的情况下,给予安罗替尼(0-10μM)处理NCI-H929和RPMI-8226细胞,48小时后CCK-8法检测细胞增殖。
图3为安罗替尼在MM皮下移植瘤模型中的抗肿瘤效应。(A)将NCI-H929以1×10
图4为安罗替尼诱导MM细胞周期阻滞和细胞凋亡。(A)将NCI-H929和RPMI-8226细胞用5μM安罗替尼处理12小时,通过流式细胞术分析细胞周期。(B)NCI-H929和RPMI-8226经过安罗替尼(5μM,12小时)处理后,流式细胞仪检测ΔΨm(JC-1红色荧光/绿色荧光比值)的变化。(C)通过Wright染色观察了安罗替尼(5μM,24μh)处理后NCI-H929和RPMI-8226细胞的形态变化。比例尺:20μm。(D)NCI-H929和RPMI-8226经安罗替尼(5μM,24μh)处理后,进行TUNEL和DAPI染色。绿点表示TUNEL染色阳性,比例尺:20μm。(E)将NCI-H929和RPMI-8226细胞用安罗替尼(0-10μM)处理24小时。Western blotting检测caspase 3、caspase9以及PARP-1的活化水平。(F)NCI-H929和RPMI-8226经安罗替尼(5μM,24μh)处理后,通过流式细胞术检测细胞的凋亡。每个实验重复三次,***p<0.001。
图5为安罗替尼抑制MAPK、PI3K/Akt/mTOR、JAK/STAT和NF-κB通路。(A)差异表达基因的火山图(对照组vs.安罗替尼组,p<0.05,Foldchang>1.5)。(B)对差异表达基因进行生物信息学分析。(C)KEGG信号通路分析。(D-E)用安罗替尼(5μM)处理NCI-H929和RPMI-8226细胞,并在不同时间收集细胞,进行Western blotting实验检测相关蛋白的表达变化。
图6为安罗替尼促进c-Myc的泛素化降解。(A)对动物实验中获得的肿瘤切片进行IHC染色,检测c-Myc的表达。(B)将肿瘤组织裂解,用Western blotting检测c-Myc的水平。(C)用不同浓度的安罗替尼处理NCI-H929和RPMI-8226细胞24小时或5μM安罗替尼处理不同时间,Western blotting检测c-Myc的水平。(D)用安罗替尼(5μM,4h)或DMSO处理稳定表达c-Myc或空体的NCI-H929细胞,然后用Western blotting检测c-Myc蛋白。(E-F)用CHX与安罗替尼共处理NCI-H929细胞,Western blotting检测c-Myc蛋白,然后对c-My c的蛋白水平进行定量,计算出半衰期。(G)用安罗替尼和/或MG132处理NCI-H929和RPMI-8226细胞,然后用Western blotting法检测c-Myc蛋白。(H)如G图所述处理NCI-H929细胞。免疫沉淀c-Myc蛋白并检测泛素化水平。(I)安罗替尼对MM细胞多种USPs表达的影响。
图7为安罗替尼诱导M M细胞M期阻滞和纺锤体异常形成。(A)将NCI-H929和RPMI-8226细胞用5μM安罗替尼处理不同时间,使用PI染色通过流式细胞术分析细胞周期,显示的数字百分比表示G2/M比例。(B)将安罗替尼(5μM,8h)处理后NCI-H929细胞,进行Wright染色。比例尺:20μm。(C)免疫印迹法检测安罗替尼对MM细胞周期相关蛋白表达的影响。(D)安罗替尼(5μM,8h)处理NCI-H929、RPMI-8226以及Hela细胞,对Tubulin和p-Histone H3进行免疫荧光染色。比例尺:20μm。
图8为安罗替尼对硼替佐米耐药的MM细胞的杀伤作用。(A)用不同浓度的硼替佐米处理NCI-H929、NCI-H929-BR、MM.1S和MM.1S-BR细胞24小时,CCK8法测定细胞活力。(B)安罗替尼处理NCI-H929-BR和MM.1S-BR细胞24和48小时,然后评估细胞活力。(C)用5μM安罗替尼处理NCI-H929-BR和MM.1S-BR细胞8小时后,流式细胞术分析细胞周期。(D)用瑞氏染色法观察安罗替尼(5μM,8h)处理后,NCI-H929-BR和MM.1S-BR细胞的形态学变化。(E)用5μm安罗替尼处理NCI-H929-BR和MM.1S-BR细胞24h后,Annexin V/PI染色方法检测细胞凋亡情况。(F)安罗替尼(5μM)处理NCI-H929-BR和MM.1S-BR细胞不同时间后,Western blotting检测c-Myc蛋白的变化。(G)使用不同浓度安罗替尼和硼替佐米处理NCI-H929细胞,CCK8法测定细胞活力,CompuSyn软件计算CI指数。
具体实施方式
以下,结合具体实施方式对本发明的技术进行详细描述。应当知道的是,以下具体实施方式仅用于帮助本领域技术人员理解本发明,而非对本发明的限制。
细胞处理
人MM细胞系NCI-H929、RPMI-8226、MM.1S和U266购自ATCC(Manassas,VA,USA)。LP1和OPM2购自German Collection of Microorganisms and Cell Cultures(Braunschweig,Germany)。细胞均在含有10%灭活胎牛血清(FBS,Gibco BRL,Gaithersburg,ML)、青霉素(100U/ml)和链霉素(100g/ml)的DMEM培养基(Sigma-Aldrich,St Louis,MO)中培养,放置于37℃,含有5%CO
蛋白印迹分析
不同浓度的安罗替尼处理细胞后,离心收集细胞并裂解提取蛋白。将蛋白等量上样至6-12%SDS-PAGE胶,进行电泳,并转移印迹至NC膜上。用5%脱脂牛奶封闭膜之后,一抗孵育(4℃过夜),洗膜,二抗孵育(2h),洗膜,显影,后期图像采集分析。
RNA抽提分析
根据TRIzol试剂盒(Invitrogen公司)说明书提取细胞内总RNA:收集5×10
统计分析
用于统计的数据均来自于每次3个样本共3次试验的结果,Student’s t-test用于评价两组之间的差异,p<0.05被认为具有显著性统计学差异。
实施例1.安罗替尼抑制MM细胞系和原代细胞的增殖
安罗替尼分子量为407.4,分子结构式如图1A所示。我们将安罗替尼以不同浓度处理一系列MM细胞株(包括NCI-H929、RPMI-8226、LP1、MM.1S、OPM2和U266),48h后采用CCK8检测细胞活率。如图1B所示,安罗替尼以剂量依赖性的方式抑制所有MM细胞系的增殖,计算得到的IC50值在2.0到7.4μM之间。此外,我们选取NCI-H929、RPMI-8226和LP1三个细胞系,用安罗替尼(0-20μM)处理24和48h,发现安罗替尼还以时间依赖的方式抑制MM细胞系的增殖(图1C-E)。接着,我们从3例MM患者的BMMCs中分离的CD138+MM细胞(图1F-G),并且从4名健康供者体内分离出BMMCs(图1H),以不同浓度安罗替尼处理24h,发现安罗替尼呈剂量依赖性(0-20μM)的方式抑制病人CD138+MM细胞的活率,相比之下,安罗替尼对MM患者体内分离的CD138-细胞或健康供体的BMMC的细胞毒性较低。这些结果表明,安罗替尼对体外培养的MM细胞系以及原代的MM病人细胞有较强的细胞毒性,但对正常细胞的毒性很小。
实施例2.安罗替尼可以拮抗骨髓微环境对MM细胞的保护作用
大量研究证实,骨髓微环境可以促进了MM细胞的增殖、存活,甚至介导MM的耐药,因此我们进一步研究安罗替尼能否能够克服骨髓微环境的保护作用。首先,我们将患者来源的骨髓间充质干细胞与MM细胞系NCI-H929或RPMI-8226共培养,然后给予安罗替尼不同浓度处理48h,流式细胞仪检测细胞的凋亡。我们发现,即使在BMSCs存在的情况下,安罗替尼也能诱导MM细胞发生明显的凋亡(图2A-B),而安罗替尼对BMSCs本身的细胞毒性较低(附图1A)。此外,我们还在细胞陪液中加入IL-6,从而模拟BM微环境。如图2C-D所示,与预期的一样,IL-6的确可以促进MM细胞的增殖,值得注意的是,即使在IL-6存在的情况下,安罗替尼仍能有效地抑制NCI-H929和RPMI-8226细胞的增殖。这些数据表明,安罗替尼不仅能够直接作用于MM细胞,而且能够克服骨髓微环境对MM细胞的保护作用。
实施例3.安罗替尼在MM皮下移植瘤模型中的抗肿瘤效应
我们在6周龄的雌性BALB/c裸鼠的皮下,种植1×10
实施例4.安罗替尼诱导MM细胞周期阻滞和细胞凋亡
安罗替尼在体内和体外均可发挥抑制MM细胞增殖的效应,由于细胞生长与细胞周期进程密切相关,我们检测了安罗替尼处理后的NCI-H929和RPMI-8226细胞的周期分布情况。结果表明,安罗替尼可以引起G2/M期细胞的增多(图4A)。此外,我们用流式细胞术分析了安罗替尼对线粒体膜电位的影响。如图4B所示,安罗替尼可以降低NCI-H929和RPMI-8226细胞的线粒体膜电位,提示安罗替尼可能激活线粒体凋亡途径。因此,我们接着观察了安罗替尼对细胞凋亡的影响。瑞氏染色观察形态学的改变,发现安罗替尼处理后,NCI-H929和RPMI-8226的破碎细胞增多(图4C)。同时,我们用DAPI染色观察细胞核形态,结果显示,对照细胞的细胞核呈圆形,而安罗替尼处理后的细胞中,可以观察到点状的凋亡小体(图4D)。此外,安罗替尼处理后,NCI-H929和RPMI-8226细胞中,TUNEL阳性的细胞显著增加(图4D)。Western blotting的结果进一步证实,安罗替尼可以诱导凋亡相关蛋白caspase 3、caspase9以及PARP-1的活化(图4E)。然后流式细胞术实验发现,安罗替尼以剂量依赖性的方式(0-20μM),诱导MM细胞发生凋亡(图4F)。因此,这些数据表明,安罗替尼可诱导MM细胞周期阻滞和细胞凋亡。
实施例5.安罗替尼抑制MAPK、PI3K/Akt/mTOR、JAK/STAT和NF-κB通路
鉴于安罗替尼在体内和体外均发挥有效的抗MM效应,我进一步采用mRNA-Seq技术探索其潜在的分子机制。如图5A,我们在NCI-H929细胞中给予安罗替尼处理,收集RNA,进行RNA-Seq,经过生物信息学分析,我们从58243个基因中,共筛选出842个差异表达基因,包括638个上调基因和204个下调基因。然后对这些差异表达基因进行GO富集和KEGG分析,结果显示这些差异表达基因参与多种重要的生物过程和信号通路(图5B-C)。有趣的是,在这些富集的信号通路中,MAPK、PI3K/Akt/mTOR、JAK/STAT和NF-κB通路对MM细胞的增殖和存活具有重要意义。为了验证mRNA-Seq的结果,我们将安罗替尼处理NCI-H929和RPMI-8226细胞,Western blotting检测ERK1/2、Akt、mTOR、STAT3和p65的磷酸化活化形式(图5D-E)。结果显示,在NCI-H929和RPMI-8226处理后,p-ERK1/2,p-Akt,p-mTOR,p-STAT3和p-p65明显降低。这些数据提示安罗替尼能够抑制MM细胞中MAPK、PI3K/Akt/mTOR、JAK/STAT和NF-κB信号通路。
实施例6.安罗替尼促进c-Myc的泛素化降解
癌基因c-Myc在MM的整个发生和发展过程中,都起着至关重要的作用。研究显示c-Myc受到多种信号通路的调控,这些通路涉及MAPK、PI3K/Akt/mTOR、JAK/STAT和NF-κB通路。因此,我们接下来检测了在安罗替尼处理后的MM细胞中c-Myc的表达变化。对动物实验中获得的肿瘤组织进行免疫组化和Western blotting分析显示,安罗替尼在体内显著抑制c-myc的表达(图6A-B)。在NCI-H929和RPMI-8226细胞系的体外实验也证实,安罗替尼能以剂量(0-10μM)和时间(0-16h)依赖性的方式,显著降低了c-Myc的蛋白水平(图6C)。此外,若将外源性c-Myc稳定地转染到NCI-H929细胞中,安罗替尼仍然可以降低外源表达的c-Myc,这表明安罗替尼是从转录后水平下调c-Myc(图6D)。为了测定安罗替尼对c-Myc半衰期的影响,我们用CHX处理NCI-H929细胞,以阻断蛋白质的从头合成途径。结果表明,安罗替尼可将c-Myc蛋白的半衰期缩短1倍,从64min降到30min(图6E-F)。而这种c-Myc蛋白的下调,可以被蛋白酶体抑制剂MG-132逆转,这表明c-Myc的降解是由于泛素化增强所致(图6G)。接着我们进行了蛋白免疫沉淀实验,发现安罗替尼的确促进泛素结合的c-Myc(图6H)。进一步实验,发现安罗替尼降低了c-Myc的去泛素蛋白酶,包括USP36、USP22和USP28,可能促使了c-Myc泛素化水平的提高,从而促进其降解(图6I)。综上,这些结果表明安罗替尼通过促进c-Myc的泛素化,促进了c-Myc的降解。
实施例7.安罗替尼通过抑制纺锤体的正常形成引起MM细胞M期阻滞
我们进一步研究安罗替尼诱导周期阻滞的具体机制。如图7A所示,在NCI-H929和RPMI-8226细胞中,给予5μM安罗替尼处理不同时间后,观察到安罗替尼能够以时间(0-16h)依赖性的方式引起G2/M期细胞的聚集。随后我们做了瑞氏染色,观察细胞有丝分裂的进程,如图7B所示,在对照细胞中,在对照细胞中可以识别出细胞周期的各个阶段,包括间期,前期,中期,后期,末期和胞质分裂期;而在安罗替尼处理后的细胞中,可以观察到极度混乱的染色体列队和异常的染色体分离,这提示安罗替尼诱导细胞发生M期阻滞。Westernblotting检测了G2/M期相关蛋白,发现安罗替尼增加了p-Aurora A,PLK1,Cyclin B和p-Histone-H3的水平,表明G2/M检查点没有被抑制,提示在安罗替尼处理的情况下,细胞仍然可以进入M期的(图7C)。我们接下来评估了安罗替尼处理后细胞中的纺锤体形成情况。如图7D所示,在对照细胞发生有丝分裂时,形成的是双极纺锤体;而在安罗替尼处理的有丝分裂的细胞中,出现了大量紊乱的多极纺锤体。这些数据表明安罗替尼抑制了MM细胞的纺锤体的正常形成,引起异常的染色体队列/分离,导致胞质不能正常分裂,最终诱导MM细胞发生M期阻滞。
实验例8.安罗替尼对硼替佐米耐药的MM细胞的杀伤作用
为了研究安罗替尼对硼替佐米耐药细胞的杀伤作用,我们采用浓度递增法自NCI-H929和MM.1S细胞,成功建立对硼替佐米耐药的NCI-H929-BR和MM.1S-BR两株细胞。首先我们验证了这两株细胞的耐药性,分别在NCI-H929和MM.1S对硼替佐米敏感和耐药的细胞中,给予不同浓度的硼替佐米处理24小时,检测细胞的活率。我们发现,相比于敏感的NCI-H929和MM.1S细胞,硼替佐米对NCI-H929-BR和MM.1S-BR细胞基本没有杀伤作用,验证了NCI-H929-BR和MM.1S-BR细胞对硼替佐米的耐药性(图8A)。随后,我们用安罗替尼处理耐药细胞系,CCK8的实验结果表明安罗替尼可以显著抑制NCI-H929-BR和MM.1S-BR的活性,且呈剂量(0-20μM)和时间(0-48h)依赖性(图8B)。另外,与硼替佐米敏感细胞相似,经过5μM浓度的安罗替尼作用后,NCI-H929-BR和MM.1S-BR细胞中也检测到M期阻滞、细胞凋亡以及c-myc蛋白的下调(图8C-F)。这些数据表明,安罗替尼对硼替佐米耐药的MM细胞也显示出强烈的细胞毒性。此外,我们将安罗替尼与硼替佐米联合,通过CompuSyn软件计算,证实两药联合可以达到相加的作用(CI指数≈1),提示临床上两药联合有望进一步改善患者预后(图8G)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 安罗替尼及其药学上可接受的盐在制备治疗多发性骨髓瘤药物中的应用
- 哌非尼酮或其药学上可接受的盐在制备预防和/或治疗新型冠状病毒炎症药物中的应用
