包含两个彼此连接的抗原结合结构域的抗原结合分子
文献发布时间:2023-06-19 12:16:29
[技术领域]
本公开涉及包含彼此连接的第一抗原结合结构域和第二抗原结合结构域的抗原结合分子,用于生产这种抗原结合分子的方法,使用这种抗原结合分子的方法,以及含有这种抗原结合分子的药物组合物。本公开还涉及用于增加抗原结合分子对蛋白酶切割的抗性的方法。
[背景技术]
抗体是以高亲和力特异性结合抗原的蛋白质。已知从低分子化合物到蛋白质的各种分子可以是抗原。由于开发了产生单克隆抗体的技术,因此抗体修饰技术得到了发展,使得易于获得识别特定分子的抗体。现在,抗体修饰技术不仅用于修饰蛋白质本身,而且已扩展到旨在增加新功能的领域,其中可考虑与低分子化合物缀合。例如,将在重链或轻链中包含游离半胱氨酸氨基酸的半胱氨酸工程化抗体用作用于医学目的的抗体-药物缀合物(ADC)(PTL 1)。
同时,抗体修饰技术不仅有助于开发抗体工程作为用于检测、分析和纯化蛋白质的工具,而且有助于一般的蛋白质工程的发展,例如使用抗体分子本身作为模型蛋白来改善非抗体蛋白质的功能。
抗体作为药物引起了人们的注意,因为它们在血浆中高度稳定且副作用较小。抗体不仅与抗原结合并表现出激动作用或拮抗作用,而且还诱导由效应细胞介导的细胞毒性活性(也称为效应功能),包括ADCC(抗体依赖性细胞毒性),ADCP(抗体依赖性细胞吞噬作用),和CDC(补体依赖性细胞毒性)。利用这些抗体的功能,已经开发出用于癌症,免疫疾病,慢性疾病,感染等的药物(NPL 1)。
例如,已经开发了利用针对促进细胞毒性T细胞活化的共刺激分子的激动剂抗体的药物作为抗癌剂(NPL 2)。最近,发现对共抑制分子具有拮抗活性的免疫检查点抑制抗体可用作抗癌剂。这一发现导致一系列抑制CTLA4/CD80或PD-1/PD-L1相互作用的抗体药物的推出:伊匹单抗,纳武单抗,派姆单抗和阿替利珠单抗(NPL 1)。
但是,此类抗体有时无法以其原始天然IgG形式充分发挥预期效果。因此,已经开发了第二代抗体药物,其中根据使用目的,人为地增强或添加了天然IgG抗体的功能,或者减少了或缺失了天然IgG抗体的功能。第二代抗体药物包括,例如,具有增强或缺失的效应子功能的抗体(NPL 3),以pH依赖方式与抗原结合的抗体(NPL 4)和每个分子与两个或多个不同抗原结合的抗体(与两个不同抗原结合的抗体通常称为“双特异性抗体”)(NPL 5)。
双特异性抗体有望成为更有效的药物。例如,已经开发出具有增强的抗肿瘤活性的抗体,该抗体通过与作为一种抗原的T细胞的细胞膜上表达的蛋白质和作为另一种抗原的癌症抗原结合而使细胞毒性T细胞与癌细胞交联(NPL 7,NPL 8和PTL 2)。先前报道的双特异性抗体包括具有两个抗体Fab结构域的分子,每个抗体Fab结构域具有不同的序列(常见的轻链双特异性抗体和杂种杂交瘤),具有附着于抗体N或C末端的额外抗原结合位点的分子(DVD-Ig和scFv-IgG),具有结合两种抗原的一个Fab结构域的分子(二合一IgG),其中CH3结构域的环区已被改造以形成新的抗原结合位点(Fcab)的分子(NPL 9),以及具有串联Fab-Fab的分子(NPL 10)。
同时,具有效应子功能的抗体通过甚至作用于以低水平表达靶抗原的正常细胞而容易引起副作用。因此,人们已经努力使抗体药物特异性地对靶组织发挥其效应子功能。以前报道的实例是在与细胞代谢物结合时结合活性改变的抗体(PTL 3),在蛋白酶切割时变得能够与抗原结合的抗体(PTL 4),和通过加入化合物调节嵌合抗原受体T细胞和癌细胞之间的抗体介导的交联的技术(ABT-737)(NPL 11)。
取决于靶标,可能难以获得激动剂抗体。特别是,对于膜蛋白(例如G蛋白偶联受体),已经开发出许多不同的技术(NPL 12)。因此,需要用于增强抗体对这些靶标的激动作用的简单方法。已知的现有方法包括,例如,使抗DR4(死亡受体4)或抗DR5(死亡受体5)抗体交联的方法(NPL13)、使抗DR5(死亡受体5)抗体的纳米抗体多聚化的方法(NPL 14)、使抗血小板生成素受体抗体转化为共价双抗体(diabody)sc(Fv)
[引文列表]
[专利文献]
[PTL 1]WO 2016/040856
[PTL 2]WO 2008/157379
[PTL 3]WO 2013/180200
[PTL 4]WO 2009/025846
[PTL 5]WO 2017/191101
[PTL 6]WO 2018/027204
[非专利文献]
[NPL 1]Nature Reviews Drug Discovery(2018)17,197-223
[NPL 2]Clinical and Experimental Immunology(2009)157,9-19
[NPL 3]Current Pharmaceutical Biotechnology(2016)17,1298-1314
[NPL 4]Nature Biotechnology(2010)28,1203-1208
[NPL 5]MAbs(2012)4,182-197
[NPL 6]Nature Reviews Immunology(2010)10,301-316
[NPL 7]Sci Transl Med(2017)9(410),eaal4291
[NPL 8]Blood(2011)117(17):4403-4404
[NPL 9]Protein Eng Des Sel(2010)23(4),289-297
[NPL 10]J Immunol(2016)196(7):3199-3211
[NPL 11]Nature Chemical Biology(2018)14,112-117
[NPL 12]Exp Mol Med(2016)48(2):e207
[NPL 13]Nature Reviews Drug Discovery(2008)7,1001-1012
[NPL 14]MAbs(2014)6(6):1560-1570
[NPL 15]Blood(2005)105(2):562-566
[NPL 16]J Biol Chem(2008)283(23):16206-16215
[NPL 17]PLoS Biol(2016)14(1):e1002344
[NPL 18]Proc Natl Acad Sci U S A(2012)109(39):15728-15733
[NPL 19]Scientific Reports(2018)8,Article number:766
[NPL 20]PLoS One(2012)7(12):e51817
[NPL 21]Nucleic Acids Res(2010)38(22):8188-8195
发明概述
[技术问题]
增强或减少抗体药物的激动作用或效应子功能的上述努力仍在开发中,并且期望有更多的努力。在这些情况下完成了本发明。本发明的目的是提供具有调节两个或更多个抗原分子之间的相互作用的活性的新型抗原结合分子,或提供用于制备或使用这种抗原结合分子的方法。本发明可用于抗体药物的筛选和开发,并且还可适用于其他各种蛋白质工程技术。
解决问题的方案
在一个非限制性方面,本发明人通过将氨基酸突变引入抗原结合结构域中来修饰具有激动剂活性并包含两个抗原结合结构域(例如Fab部分)的抗原结合分子(例如抗体),并制备了其中抗原结合结构域彼此连接的分子。结果,发明人发现分子的激动剂活性大大提高。另外,在一个非限制性方面,本发明人发现了抗原结合分子,其通过抗原结合结构域之间的连接而获得了对蛋白酶消化的抗性。
本公开基于这些发现,并且具体地包括以下示例的实施方案。
[1]抗原结合分子,其包含第一抗原结合结构域和第二抗原结合结构域,其中所述两个抗原结合结构域通过一个或多个键彼此连接。
[2][1]所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键是共价键。
[3][2]所述的抗原结合分子,其中所述共价键是通过所述第一抗原结合结构域中的氨基酸残基与所述第二抗原结合结构域中的氨基酸残基的直接交联而形成的。
[4][3]所述的抗原结合分子,其中所述交联的氨基酸残基是半胱氨酸。
[5][4]所述的抗原结合分子,其中所述形成的共价键是二硫键。
[6][2]所述的抗原结合分子,其中所述共价键是通过所述第一抗原结合结构域中的氨基酸残基与所述第二抗原结合结构域中的氨基酸残基经由交联剂交联而形成的。
[7][6]所述的抗原结合分子,其中所述交联剂是胺反应性交联剂。
[8][7]所述的抗原结合分子,其中所述交联的氨基酸残基是赖氨酸。
[9][1]所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键是非共价键。
[10][9]所述的抗原结合分子,其中所述非共价键是离子键,氢键或疏水键。
[11][10]所述的抗原结合分子,其中所述离子键在酸性氨基酸和碱性氨基酸之间形成。
[12][11]所述的抗原结合分子,其中所述酸性氨基酸是天冬氨酸(Asp)或谷氨酸(Glu),所述碱性氨基酸是组氨酸(His),赖氨酸(Lys)或精氨酸(Arg)。
[13][1]至[12]中任一项所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基中的至少一个是人工引入的突变氨基酸残基。
[14][13]所述的抗原结合分子,其中所述突变氨基酸残基是半胱氨酸残基。
[15][1]至[14]中任一项所述的抗原结合分子,其中所述第一和第二抗原结合结构域中的至少一个自身具有与抗原结合的活性。
[16][1]至[15]中任一项所述的抗原结合分子,其中所述第一和第二抗原结合结构域均为相同类型的抗原结合结构域。
[17][1]至[16]中任一项所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键通过将存在于所述第一抗原结合结构域和所述第二抗原结合结构域上的相同位置处的氨基酸残基彼此连接而形成。
[18][1]至[16]中任一项所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键通过将存在于所述第一抗原结合结构域和所述第二抗原结合结构域上的不同位置处的氨基酸残基彼此连接而形成。
[19][1]至[18]中任一项所述的抗原结合分子,其中所述第一和第二抗原结合结构域中的至少一个包含与特定抗原结合的抗体片段。
[20][19]所述的抗原结合分子,其中所述抗体片段是Fab,Fab',scFab,Fv,scFv或单结构域抗体。
[21][19]或[20]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的至少一个氨基酸残基存在于所述抗体片段内。
[22][21]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于恒定区内。
[23][22]所述的抗原结合分子,其中所述恒定区来源于人。
[24][22]或[23]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于CH1区域内。
[25][24]所述的抗原结合分子,其中所述CH1区域的亚类为γ1,γ2,γ3,γ4,α1,α2,μ,δ或ε。
[26][24]或[25]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于CH1区域中根据EU编号位置119至123、131至140、148至150、155至167、174至178、188至197、201至214,和218至219中的任意一个位置。
[27][26]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于CH1区域中根据EU编号选自由以下各项组成的组的位置:位置119,122,123,131,132,133,134,135,136,137,138,139,140,148,150,155,156,157,159,160,161,162,163,164,165,167,174,176,177,178,188,189,190,191,192,193,194,195,196,197,201,203,205,206,207,208,211,212,213,214,218和219。
[28][27]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于CH1区域中根据EU编号的位置134,135,136,137,191,192,193,194,195或196。
[29][28]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于CH1区域中根据EU编号的位置135,136或191。
[30][24]至[29]中任一项所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键是通过将所述第一抗原结合结构域的CH1区域中的氨基酸残基和所述第二抗原结合结构域的CH1区域中的氨基酸残基连接而形成的。
[31][30]所述的抗原结合分子,其中所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置119、120、121、122和123。
[32][30]所述的抗原结合分子,其中所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置131,132,133,134,135,136,137,138,139和140。
[33][30]所述的抗原结合分子,其中所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置148,149和150。
[34][30]所述的抗原结合分子,其中在所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置155,156,157,158,159,160,161,162,163,164,165,166和167。
[35][30]所述的抗原结合分子,其中在所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置174、175、176、177和178。
[36][30]所述的抗原结合分子,其中在所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置188,189,190,191,192,193,194,195,196和197。
[37][30]所述的抗原结合分子,其中在所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置201,202,203,204,205,206,207,208,209,210,211,212,213和214。
[38][30]所述的抗原结合分子,其中在所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置218和219。
[39][30]至[38]中任一项所述的抗原结合分子,其中在所述第一抗原结合结构域和所述第二抗原结合结构域中的氨基酸残基的位置之间的差异为三个氨基酸或更少。
[40][39]所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键是通过将第一抗原结合结构域的CH1区域中根据EU编号在位置135处的氨基酸残基与第二抗原结合结构域的CH1区域中根据EU编号在位置132至138中的任何一个位置处的氨基酸残基连接而形成的。
[41][39]所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键是通过将第一抗原结合结构域的CH1区域中根据EU编号在位置136处的氨基酸残基与第二抗原结合结构域的CH1区域中根据EU编号在位置133至139中的任何一个位置处的氨基酸残基连接而形成的。
[42][39]所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键是通过将第一抗原结合结构域的CH1区域中根据EU编号在位置191处的氨基酸残基与第二抗原结合结构域的CH1区域中根据EU编号在位置188至194中的任何一个位置处的氨基酸残基连接而形成的。
[43][40]所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键是通过将两个抗原结合结构域的CH1区域中根据EU编号在位置135处的氨基酸残基彼此连接而形成的。
[44][41]所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键是通过将两个抗原结合结构域的CH1区域中根据EU编号在位置136处的氨基酸残基彼此连接而形成的。
[45][42]所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键是通过将两个抗原结合结构域的CH1区域中根据EU编号在位置191处的氨基酸残基彼此连接而形成的。
[46][22]或[23]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于CL区域内。
[47][46]所述的抗原结合分子,其中所述CL区域的亚类是κ或λ。
[48][46]或[47]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于CL区域中根据Kabat编号位置108至112、121至128、151至156、184至190、195至196、200至203,和208至213中的任意一个位置。
[49][48]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于CL区域中选自由以下各项组成的组的位置:根据Kabat编号位置108,109,112,121,123,126,128,151,152,153,156,184,186,188,189,190,195,196,200,201,202,203,208,210,211,212和213。
[50][49]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于CL区域中根据Kabat编号的位置126处。
[51][46]至[50]中任一项所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键是通过将所述第一抗原结合结构域的CL区域中的氨基酸残基和所述第二抗原结合结构域的CL区域中的氨基酸残基连接而形成的。
[52][51]所述的抗原结合分子,其中在所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据Kabat编号位置108、109、110、111和112。
[53][51]所述的抗原结合分子,其中在所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据Kabat编号位置121,122,123,124,125,126,127和128。
[54][51]所述的抗原结合分子,其中在所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据Kabat编号位置151,152,153,154,155和156。
[55][51]所述的抗原结合分子,其中在所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据Kabat编号位置184,185,186,187,188,189和190。
[56][51]所述的抗原结合分子,其中在所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据Kabat编号位置195和196。
[57][51]所述的抗原结合分子,其中在所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据Kabat编号位置200,201,202和203。
[58][51]所述的抗原结合分子,其中在所述第一抗原结合结构域和所述第二抗原结合结构域中的所述氨基酸残基各自独立地选自由以下各项组成的组:根据Kabat编号位置208,209,210,211,212和213。
[59][51]至[58]中任一项所述的抗原结合分子,其中在所述第一抗原结合结构域和所述第二抗原结合结构域中的氨基酸残基的位置之间的差异为三个氨基酸或更少。
[60][59]所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键是通过将两个抗原结合结构域的CL区域中根据Kabat编号在位置126处的氨基酸残基彼此连接而形成的。
[61][24]至[29]和[46]至[50]中任一项所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键是通过将所述第一抗原结合结构域的CH1区域中的氨基酸残基和所述第二抗原结合结构域的CL区域中的氨基酸残基连接而形成的。
[62][61]所述的抗原结合分子,其中在所述CH1区域中的所述氨基酸残基选自由以下各项组成的组:根据EU编号的位置188,189,190,191,192,193,194,195,196和197,并且在所述CL区域中的所述氨基酸残基选自由以下各项组成的组:根据Kabat编号的位置121,122,123,124,125,126,127和128。
[63][62]所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键是通过将第一抗原结合结构域的CH1区域中根据EU编号在位置191处的氨基酸残基与第二抗原结合结构域的CL区域中根据Kabat编号在位置126处的氨基酸残基连接而形成的。
[64][21]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于可变区内。
[65][64]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于VH区内。
[66][65]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于VH区内选自由以下各项组成的组的位置:根据Kabat编号的位置6,8,16,20,25,26,28,74和82b。
[67][64]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于VL区内。
[68][67]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于VL区(κ亚类)内选自由以下各项组成的组的位置:根据Kabat编号位置21,27,58,77,100,105和107。
[69][67]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于VL区(λ亚类)内选自由以下各项组成的组的位置:根据Kabat编号位置6,19,33和34。
[70][64]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于VHH区内。
[71][70]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于VHH区选自由以下各项组成的组的位置:根据Kabat编号位置4,6,7,8,9,10,11,12,14,15,17,20,24,27,29,38,39,40,41,43,44,45,46,47,48,49,67,69,71,78,80,82,82c,85,88,91,93,94和107。
[72][1]至[18]中任一项所述的抗原结合分子,其中所述第一和第二抗原结合结构域中的至少一个包含与特定抗原结合的非抗体蛋白,或其片段。
[73][72]所述的抗原结合分子,其中所述非抗体蛋白是一对彼此特异性结合的配体和受体中的任一个。
[74][1]至[73]中任一项所述的抗原结合分子,其中所述抗原结合结构域包含铰链区。
[75][74]所述的抗原结合分子,其中存在于野生型铰链区内的至少一个半胱氨酸残基被另一个氨基酸残基置换。
[76][75]所述的抗原结合分子,其中所述半胱氨酸残基存在于所述铰链区内根据EU编号的位置226和/或229。
[77][74]或[76]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的至少一个氨基酸残基存在于所述铰链区内。
[78][77]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于铰链区选自由以下各项组成的组的位置:根据EU编号位置216,218和219。
[79][1]至[78]中任一项所述的抗原结合分子,其中所述第一抗原结合结构域和所述第二抗原结合结构域通过两个或更多个键彼此连接。
[80][79]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的至少一个氨基酸残基是存在于野生型序列中的氨基酸残基。
[81][80]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基存在于铰链区内。
[82][81]所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的氨基酸残基是铰链区中的半胱氨酸残基。
[83][80]至[82]中任一项所述的抗原结合分子,其中连接所述两个抗原结合结构域的至少一个键是通过存在于铰链区中的半胱氨酸残基彼此交联而形成的二硫键。
[84][83]所述的抗原结合分子,其中所述半胱氨酸残基存在于所述铰链区内根据EU编号的位置226和/或229。
[85][79]至[84]中任一项所述的抗原结合分子,其中所述抗原结合结构域之间的键所起源的至少一个氨基酸残基存在于所述抗体片段内,并且至少一个氨基酸残基存在于所述铰链区内。
[86][85]所述的抗原结合分子,其中所述第一和第二抗原结合结构域各自包含Fab和铰链区,并且其中包含所述两个抗原结合结构域的抗原结合分子是F(ab')2。
[87][1]至[86]中任一项所述的抗原结合分子,其中所述抗原结合结构域包含Fc区。
[88][87]所述的抗原结合分子,其中将促进Fc区多聚化的一个或多个氨基酸突变引入所述Fc区中。
[89][88]所述的抗原结合分子,其中促进多聚化的所述氨基酸突变包括在选自由以下各项组成的组的至少一个位置处的氨基酸突变:根据EU编号,位置247,248,253,254,310,311,338,345,356,359,382,385,386,430,433,434,436,437,438,439,440和447。
[90][88]或[89]所述的抗原结合分子,其中所述多聚化是六聚化。
[91][87]至[90]中任一项所述的抗原结合分子,其为全长抗体。
[92][1]至[91]中任一项所述的抗原结合分子,其中所述第一和第二抗原结合结构域二者均结合相同的抗原。
[93][92]所述的抗原结合分子,其中所述第一和第二抗原结合结构域二者均结合到所述抗原上的相同表位。
[94][92]所述的抗原结合分子,其中所述第一和第二抗原结合结构域各自结合至所述抗原上的不同表位。
[95][1]至[91]中任一项所述的抗原结合分子,其中所述第一和第二抗原结合结构域各自结合至不同的抗原。
[96][93]所述的抗原结合分子,其中所述第一和第二抗原结合结构域具有相同的氨基酸序列。
[97][93]至[95]中任一项所述的抗原结合分子,其中所述第一和第二抗原结合结构域各自具有不同的氨基酸序列。
[98][1]至[91]中任一项所述的抗原结合分子,其中所述第一和第二抗原结合结构域所结合的两个抗原中的至少一个是可溶性蛋白。
[99][1]至[91]中任一项所述的抗原结合分子,其中所述第一和第二抗原结合结构域所结合的两个抗原中的至少一个是膜蛋白。
[100][1]至[99]中任一项所述的抗原结合分子,其具有调节两个抗原分子之间相互作用的活性。
[101][100]所述的抗原结合分子,与对照抗原结合分子相比,其能够增强或减少两个抗原分子之间的相互作用,其中所述对照抗原结合分子和[100]所述的抗原结合分子的区别之处仅在于对照抗原结合分子在两个抗原结合结构域之间少一个键。
[102][100]或[101]所述的抗原结合分子,其中所述两个抗原分子分别是配体和其受体,并且其中所述抗原结合分子具有促进所述配体激活所述受体的活性。
[103][100]或[101]所述的抗原结合分子,其中所述两个抗原分子分别是酶和其底物,并且其中所述抗原结合分子具有促进所述酶与所述底物的催化反应的活性。
[104][100]或[101]所述的抗原结合分子,其中所述两个抗原分子都是存在于细胞表面上的蛋白质,并且其中所述抗原结合分子具有促进表达所述第一抗原的细胞与表达所述第二抗原的细胞之间的相互作用的活性。
[105][104]所述的抗原结合分子,其中表达所述第一抗原的细胞是具有细胞毒性活性的细胞,并且表达所述第二抗原的细胞是其靶细胞,并且其中所述抗原结合分子促进具有细胞毒性活性的所述细胞对所述靶细胞的损伤。
[106][105]所述的抗原结合分子,其中所述具有细胞毒性活性的细胞是T细胞,NK细胞,单核细胞或巨噬细胞。
[107][1]至[99]中任一项所述的抗原结合分子,其具有调节通过彼此缔合而被激活的两个抗原分子的激活的活性。
[108][107]所述的抗原结合分子,其与对照抗原结合分子相比,增强或减少两个抗原分子的活化,其中所述对照抗原结合分子和[107]所述的抗原结合分子的区别之处仅在于对照抗原结合分子在两个抗原结合结构域之间少一个键。
[109][107]或[108]所述的抗原结合分子,其中所述抗原分子选自由以下各项组成的组:属于细胞因子受体超家族的受体,G蛋白偶联受体,离子通道受体,酪氨酸激酶受体,免疫检查点受体,抗原受体,CD抗原,共刺激分子和细胞粘附分子。
[110][1]至[99]中任一项所述的抗原结合分子,其具有将两个抗原分子保持在空间上接近位置的活性。
[111][110]所述的抗原结合分子,其能够将两个抗原分子保持在比对照抗原结合分子更近的位置,其中所述对照抗原结合分子和[110]所述的抗原结合分子的区别之处仅在于对照抗原结合分子在两个抗原结合结构域之间少一个键。
[112][1]至[99]中任一项所述的抗原结合分子,其中所述两个抗原结合结构域处于在空间上接近的位置,和/或所述两个抗原结合结构域的迁移率降低。
[113][112]所述的抗原结合分子,其中,相比于对照抗原结合分子,所述两个抗原结合结构域位于更近的位置和/或所述两个抗原结合结构域具有更小的迁移率,其中所述对照抗原结合分子和[112]所述的抗原结合分子的区别之处仅在于对照抗原结合分子在两个抗原结合结构域之间少一个键。
[114][1]至[99]中任一项所述的抗原结合分子,其对蛋白酶切割具有抗性。
[115][114]所述的抗原结合分子,其与对照抗原结合分子相比,对蛋白酶切割的抗性增强,其中所述对照抗原结合分子和[114]所述的抗原结合分子的区别之处仅在于对照抗原结合分子在所述两个抗原结合结构域之间少一个键。
[116][115]所述的抗原结合分子,其中与对照抗原结合分子相比,蛋白酶处理后剩余的全长分子的比例增加。
[117][115]或[116]所述的抗原结合分子,其中与对照抗原结合分子相比,蛋白酶处理后产生的特定片段的比例降低。
[118][1]至[99]中任一项所述的抗原结合分子,其中当用蛋白酶处理所述分子时,所述抗原结合结构域或其片段的二聚体被切除。
[119][118]所述的抗原结合分子,其中当所述对照抗原结合分子用所述蛋白酶处理时,所述抗原结合结构域或其片段的单体被切除,并且其中所述对照抗原结合分子和[118]所述的抗原结合分子的区别之处仅在于对照抗原结合分子在两个抗原结合结构域之间少一个键。
[120][118]或[119]所述的抗原结合分子,其中所述蛋白酶切割铰链区。
[121][101]至[106],[108]至[109],[111],[113],[115]至[117]和[119]至[120]中任一项所述的抗原结合分子,其中所述少一个的键是起源于突变的氨基酸残基而形成的键。
[122][121]所述的抗原结合分子,其中所述突变的氨基酸残基是半胱氨酸残基。
[123]一种药物组合物,其包含[1]至[122]中任一项的抗原结合分子和药学上可接受的载体。
[124]用于调节两个抗原分子之间相互作用的方法,包括:
(a)提供包含两个抗原结合结构域的抗原结合分子,
(b)向所述抗原结合分子添加至少一个将所述两个抗原结合结构域彼此连接的键,和
(c)使(b)中产生的所述抗原结合分子与所述两个抗原分子接触。
[125]用于调节通过彼此缔合而被激活的两个抗原分子的活性的方法,所述方法包括:
(a)提供包含两个抗原结合结构域的抗原结合分子,
(b)向所述抗原结合分子添加至少一个将所述两个抗原结合结构域彼此连接的键,和
(c)使(b)中产生的所述抗原结合分子与所述两个抗原分子接触。
[126]用于将两个抗原分子保持在空间上接近的位置处的方法,包括:
(a)提供包含两个抗原结合结构域的抗原结合分子,
(b)向所述抗原结合分子添加至少一个将所述两个抗原结合结构域彼此连接的键,和
(c)使(b)中产生的所述抗原结合分子与所述两个抗原分子接触。
[127]一种将两个抗原结合结构域放置在空间上接近的位置处和/或降低所述两个抗原结合结构域的迁移率的方法,包括:
(a)提供包含两个抗原结合结构域的抗原结合分子,和
(b)向所述抗原结合分子添加至少一个将所述两个抗原结合结构域彼此连接的键。
[128]用于增加抗原结合分子对蛋白酶切割的抗性的方法,包括:
(a)提供包含两个抗原结合结构域的抗原结合分子,和
(b)向所述抗原结合分子添加至少一个将所述两个抗原结合结构域彼此连接的键。
[129]用于制备具有调节两个抗原分子之间相互作用的活性的抗原结合分子的方法,包括:
(a)提供编码包含第一抗原结合结构域的多肽的核酸和编码包含第二抗原结合结构域的多肽的核酸,
(b)将突变引入编码所述两个抗原结合结构域的核酸中,从而添加至少一个连接所述两个抗原结合结构域的键,
(c)将(b)中产生的核酸引入宿主细胞,
(d)培养所述宿主细胞从而表达所述两种多肽,和
(e)获得抗原结合分子,所述抗原结合分子是包含第一和第二抗原结合结构域的多肽,其中所述两个抗原结合结构域通过一个或多个键彼此连接。
[130]用于制备抗原结合分子的方法,所述抗原结合分子具有调节通过彼此缔合而被激活的两个抗原分子的激活的活性,该方法包括:
(a)提供编码包含第一抗原结合结构域的多肽的核酸和编码包含第二抗原结合结构域的多肽的核酸,
(b)将突变引入编码所述两个抗原结合结构域的核酸中,从而添加至少一个连接所述两个抗原结合结构域的键,
(c)将(b)中产生的核酸引入宿主细胞,
(d)培养所述宿主细胞以表达所述两种多肽,和
(e)获得抗原结合分子,所述抗原结合分子是包含第一和第二抗原结合结构域的多肽,其中所述两个抗原结合结构域通过一个或多个键彼此连接。
[131]用于制备抗原结合分子的方法,该抗原结合分子具有将两个抗原分子保持在空间上接近的位置处的活性,所述方法包括:
(a)提供编码包含第一抗原结合结构域的多肽的核酸和编码包含第二抗原结合结构域的多肽的核酸,
(b)将突变引入编码所述两个抗原结合结构域的核酸中,从而添加至少一个连接所述两个抗原结合结构域的键,
(c)将(b)中产生的核酸引入宿主细胞,
(d)培养所述宿主细胞以表达所述两种多肽,和
(e)获得抗原结合分子,所述抗原结合分子是包含第一和第二抗原结合结构域的多肽,其中所述两个抗原结合结构域通过一个或多个键彼此连接。
[132]用于制备抗原结合分子的方法,其中两个抗原结合结构域存在于空间上接近的位置处和/或两个抗原结合结构域的迁移率降低,所述方法包括:
(a)提供编码包含第一抗原结合结构域的多肽的核酸和编码包含第二抗原结合结构域的多肽的核酸,
(b)将突变引入编码所述两个抗原结合结构域的核酸中,从而添加至少一个连接所述两个抗原结合结构域的键,
(c)将(b)中产生的核酸引入宿主细胞,
(d)培养所述宿主细胞以表达所述两种多肽,和
(e)获得抗原结合分子,所述抗原结合分子是包含第一和第二抗原结合结构域的多肽,其中所述两个抗原结合结构域通过一个或多个键彼此连接。
[133]用于制备对蛋白酶切割具有增强的抗性的抗原结合分子的方法,其包括:
(a)提供编码包含第一抗原结合结构域的多肽的核酸和编码包含第二抗原结合结构域的多肽的核酸,
(b)将突变引入编码所述两个抗原结合结构域的核酸中,从而添加至少一个连接所述两个抗原结合结构域的键,
(c)将(b)中产生的核酸引入宿主细胞,
(d)培养所述宿主细胞以表达所述两种多肽,和
(e)获得抗原结合分子,所述抗原结合分子是包含第一和第二抗原结合结构域的多肽,其中所述两个抗原结合结构域通过一个或多个键彼此连接。
[134]用于鉴定通过彼此缔合而被激活的新的蛋白质分子对的方法,该方法包括:
(a)提供两个任意的蛋白质分子,
(b)通过[129]至[133]中任一项所述的方法制备抗原结合分子,所述抗原结合分子包含分别与所述两个蛋白分子结合的两个抗原结合结构域,
(c)使(b)中制备的所述抗原结合分子与所述两个蛋白质分子接触,和
(d)评估所述两个蛋白质分子是否被激活。
[135][134]所述的方法,其中至少一种所述蛋白质分子选自由以下各项组成的组:属于细胞因子受体超家族的受体,G蛋白偶联受体,离子通道受体,酪氨酸激酶受体,免疫检查点受体,抗原受体,CD抗原,共刺激分子和细胞粘附分子。
附图简述
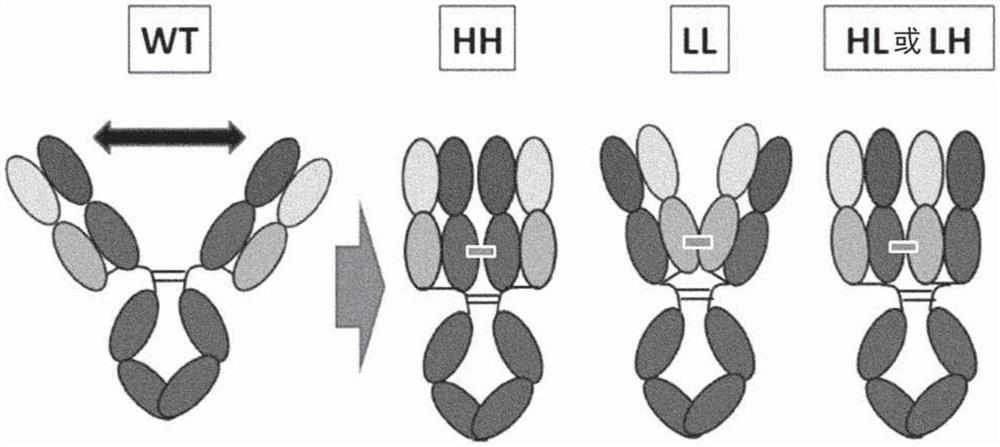
图1描绘了如实施例1中所述的Fab彼此交联的修饰抗体的实例。该图示意性地显示了野生型抗体(WT)和以下修饰抗体之间的结构差异:其中抗体H链的CH1区相互交联的修饰抗体(HH型),其中抗体L链的CL区相互交联的修饰抗体(LL型),和其中抗体H链的CH1区与抗体L链的CL区交联的修饰抗体(HL或LH型)。
图2显示了测定野生型抗CD3ε抗体分子(CD3-G4s)和修饰抗体分子(CD3-G4sLL,CD3-G4sHH)的CD3介导的激动剂活性的结果,其中所述修饰抗体分子是经由另外的二硫键通过将所述野生型分子的Fab-Fab连接而制备的,如实施例4-3中所述。
图3显示了测定野生型抗CD3ε抗体分子(OKT3-G1s)和修饰抗体分子(OKT3-G1sLL,OKT3-G1sHH)的CD3介导的激动剂活性的结果,其中所述修饰抗体分子是经由另外的二硫键通过将所述野生型分子的Fab-Fab连接而制备的,如实施例4-3中所述。
图4显示了测定野生型抗CD3ε抗体分子(CD3-G1s),抗CD28抗体分子(CD28-G1s)和抗CD3εx抗CD28双特异性抗体(CD3//CD28-G1s)和修饰抗体分子(CD3//CD28-G1sLL,CD3//CD28-G1sHH,CD3//CD28-G1sLH,CD3//CD28-G1sHL)的CD3和/或CD28介导的激动剂活性的结果,其中所述修饰抗体分子是经由另外的二硫键通过将所述双特异性抗体的Fab-Fab连接而制备的,如实施例4-3中所述。
图5显示了测定野生型抗CD3ε抗体分子(OKT3-G1s),抗CD28抗体分子(CD28-G1s)和抗CD3εx抗CD28双特异性抗体(OKT3//CD28-G1s)和修饰抗体分子(OKT3//CD28-G1sHH,OKT3//CD28-G1sHL)的CD3和/或CD28介导的激动剂活性的结果,其中所述修饰抗体分子是经由另外的二硫键通过将所述双特异性抗体的Fab-Fab连接而制备的,如实施例4-3中所述。
图6显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的重链可变区而制备的修饰抗体(MRAH.xxx-G1T4),和通过将半胱氨酸置换引入抗IL6R抗体的重链恒定区而制备的修饰抗体(MRAH-G1T4.xxx),如实施例5-2(1/8)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图7显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的重链可变区而制备的修饰抗体(MRAH.xxx-G1T4),和通过将半胱氨酸置换引入抗IL6R抗体的重链恒定区而制备的修饰抗体(MRAH-G1T4.xxx),如实施例5-2(2/8)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图8显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的重链可变区而制备的修饰抗体(MRAH.xxx-G1T4),和通过将半胱氨酸置换引入抗IL6R抗体的重链恒定区而制备的修饰抗体(MRAH-G1T4.xxx),如实施例5-2(3/8)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图9显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的重链可变区而制备的修饰抗体(MRAH.xxx-G1T4),和通过将半胱氨酸置换引入抗IL6R抗体的重链恒定区而制备的修饰抗体(MRAH-G1T4.xxx),如实施例5-2(4/8)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图10显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的重链可变区而制备的修饰抗体(MRAH.xxx-G1T4),和通过将半胱氨酸置换引入抗IL6R抗体的重链恒定区而制备的修饰抗体(MRAH-G1T4.xxx),如实施例5-2(5/8)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图11显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的重链可变区而制备的修饰抗体(MRAH.xxx-G1T4),和通过将半胱氨酸置换引入抗IL6R抗体的重链恒定区而制备的修饰抗体(MRAH-G1T4.xxx),如实施例5-2(6/8)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图12显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的重链可变区而制备的修饰抗体(MRAH.xxx-G1T4),和通过将半胱氨酸置换引入抗IL6R抗体的重链恒定区而制备的修饰抗体(MRAH-G1T4.xxx),如实施例5-2(7/8)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图13显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的重链可变区而制备的修饰抗体(MRAH.xxx-G1T4),和通过将半胱氨酸置换引入抗IL6R抗体的重链恒定区而制备的修饰抗体(MRAH-G1T4.xxx),如实施例5-2(8/8)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图14显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的轻链可变区而制备的修饰抗体(MRAL.xxx-k0),和通过将半胱氨酸置换引入抗IL6R抗体的轻链恒定区而制备的修饰抗体(MRAL-k0.xxx),如实施例6-2(1/10)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图15显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的轻链可变区而制备的修饰抗体(MRAL.xxx-k0),和通过将半胱氨酸置换引入抗IL6R抗体的轻链恒定区而制备的修饰抗体(MRAL-k0.xxx),如实施例6-2(2/10)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图16显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的轻链可变区而制备的修饰抗体(MRAL.xxx-k0),和通过将半胱氨酸置换引入抗IL6R抗体的轻链恒定区而制备的修饰抗体(MRAL-k0.xxx),如实施例6-2(3/10)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图17显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的轻链可变区而制备的修饰抗体(MRAL.xxx-k0),和通过将半胱氨酸置换引入抗IL6R抗体的轻链恒定区而制备的修饰抗体(MRAL-k0.xxx),如实施例6-2(4/10)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图18显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的轻链可变区而制备的修饰抗体(MRAL.xxx-k0),和通过将半胱氨酸置换引入抗IL6R抗体的轻链恒定区而制备的修饰抗体(MRAL-k0.xxx),如实施例6-2(5/10)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图19显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的轻链可变区而制备的修饰抗体(MRAL.xxx-k0),和通过将半胱氨酸置换引入抗IL6R抗体的轻链恒定区而制备的修饰抗体(MRAL-k0.xxx),如实施例6-2(6/10)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图20显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的轻链可变区而制备的修饰抗体(MRAL.xxx-k0),和通过将半胱氨酸置换引入抗IL6R抗体的轻链恒定区而制备的修饰抗体(MRAL-k0.xxx),如实施例6-2(7/10)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图21显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的轻链可变区而制备的修饰抗体(MRAL.xxx-k0),和通过将半胱氨酸置换引入抗IL6R抗体的轻链恒定区而制备的修饰抗体(MRAL-k0.xxx),如实施例6-2(8/10)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图22显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的轻链可变区而制备的修饰抗体(MRAL.xxx-k0),和通过将半胱氨酸置换引入抗IL6R抗体的轻链恒定区而制备的修饰抗体(MRAL-k0.xxx),如实施例6-2(9/10)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图23显示了抗IL6R抗体(MRA)和以下修饰抗体的蛋白酶处理的结果:通过将半胱氨酸置换引入抗IL6R抗体的轻链可变区而制备的修饰抗体(MRAL.xxx-k0),和通过将半胱氨酸置换引入抗IL6R抗体的轻链恒定区而制备的修饰抗体(MRAL-k0.xxx),如实施例6-2(10/10)中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体进行条带检测。
图24显示了抗IL6R抗体(MRA)和通过将半胱氨酸置换引入抗IL6R抗体的轻链恒定区而制备的修饰抗体(MRAL-k0.K126C)的蛋白酶处理的结果,如实施例7-2中所述。将每种蛋白酶处理的抗体应用于非还原毛细管电泳,然后使用抗κ链抗体或抗人Fc抗体进行条带检测。
图25显示了通过抗体样品的蛋白酶处理获得的每个条带的分子量与其推定结构之间的对应性,如实施例7-2中所述。在每个分子的结构下方还应注意该分子是否可以与抗κ链抗体或抗Fc抗体反应(在图24的电泳中是否检测到条带)。
图26显示了测定抗CD3抗体分子(OKT3)、经由另外的二硫键通过将所述抗体分子的Fab-Fab连接而制备的修饰抗体分子(H_T135C,H_S136C,H_S191C,和L_K126C)和抗KLH抗体分子(IC17)(阴性对照)的CD3介导的激动剂活性的结果,如实施例13-4中所述。
图27显示了测定抗CD3抗体分子(OKT3)、通过将易于异源二聚化的杵臼(Knobs-in-Holes)(KiH)修饰引入OKT3的重链恒定区而制备的修饰抗体分子(OKT3_KiH)、经由另外的二硫键通过将所述抗体分子的Fab-Fab连接而制备的修饰抗体分子(H_S191C_KiH,H_S191C/V188C_KiH,H_S191C/P189C_KiH,H_S191C/S190C_KiH,H_S191C/S192C_KiH,H_S191C/L193C_KiH,H_S191C/G194C_KiH)和抗KLH抗体(IC17)(阴性对照)的CD3介导的激动剂活性的结果,如实施例14-4中所述。
图28显示了测定以下各抗体分子的CD3介导的激动剂活性的结果:抗CD3抗体分子(OKT3)、经由另外的二硫键通过将所述抗体分子的Fab-Fab连接而制备的修饰抗体分子(H_S191C)、通过将易于异源二聚化的杵臼(KiH)修饰引入OKT3的重链恒定区而制备的修饰抗体分子(OKT3_KiH)、经由另外的二硫键通过将所述抗体分子的Fab-Fab连接而制备的修饰抗体分子(H_S191C_KiH)、通过将带正电的氨基酸置换引入OKT3_KiH的一个重链恒定区并将带负电的氨基酸置换引入另一个重链恒定区而制备的修饰抗体分子(0004//0004,0004//0006)、通过将带正电荷或带负电荷的氨基酸置换引入OKT3_KiH的一个重链恒定区而制备的修饰抗体分子(0004//OKT3,OKT3//0004,OKT3//0006)和抗KLH抗体分子(IC17)(阴性对照),如实施例15-4中所述。
图29显示了测定以下各抗体分子的CD3介导的激动剂活性的结果:抗CD3抗体分子(OKT3),通过去除该抗体分子的铰链区内的二硫键而制备的修饰抗体分子(dh1,dh2,dh3),经由额外的二硫键通过将那些分子的Fab-Fab连接而制备的修饰抗体分子(H_S191C_dh1,H_S191C_dh2,H_S191C_dh3),和抗KLH抗体分子(IC17)(阴性对照),如实施例16-4中所述。
图30显示了测定以下各抗体分子的CD3介导的激动剂活性的结果:抗CD3单特异性抗体分子(OKT3-G1s),经由额外的二硫键通过将该抗体分子的Fab-Fab连接而制备的修饰抗体分子(OKT3-G1sHH),经由额外的二硫键通过将抗CD3单特异性抗体(CD3-G1s)的Fab-Fab连接而制备的修饰抗体分子(CD3-G1sLL),抗CD3双互补位抗体分子(CD3//OKT3-G1s),经由额外的二硫键通过将该抗体分子的Fab-Fab连接而制备的修饰抗体分子(CD3//OKT3-G1sHH,CD3//OKT3-G1sLH),以及CD3-G1sLL和OKT3-G1s的组合(CD3-G1sLL+OKT3-G1s),如实施例20中所述。
图31A-D显示了测定以下各抗体的CD3和/或PD1介导的激动剂活性的结果:抗CD3x抗PD1双特异性抗体和通过经由额外的二硫键将那些抗体的Fab-Fab连接而制备的修饰抗体分子,如实施例22-1中所述。图31A示出了以下各项的激动剂活性:由抗CD3抗体(OKT3)和抗PD1抗体(117)组成的抗CD3x抗PD1双特异性抗体分子(OKT3//117-G1silent),以及通过经由额外的二硫键将该抗体分子的Fab-Fab连接而制备的修饰抗体分子(OKT3//117-G1silentHH,OKT3//117-G1silentHL,OKT3//117-G1silentLL)。
图31B示出了以下各抗体分子的激动剂活性:由抗CD3抗体(OKT3)和抗PD1抗体(10)组成的抗CD3x抗PD1双特异性抗体分子(OKT3//10-G1silent),以及通过经由额外的二硫键将该抗体分子的Fab-Fab连接而制备的修饰抗体分子(OKT3//10-G1silentHH,OKT3//10-G1silentHL)。
图31C示出了以下各项的激动剂活性:由抗CD3抗体(CD3)和抗PD1抗体(949)组成的抗CD3x抗PD1双特异性抗体分子(CD3//949-G1silent),以及通过经由额外的二硫键将该抗体分子的Fab-Fab连接而制备的修饰抗体分子(CD3//949-G1silentLH,CD3//949-G1silentHH,CD3//949-G1silentLL,CD3//949-G1silentHL)。
图31D示出了以下各项的激动剂活性:由抗CD3抗体(OKT3)和抗PD1抗体(949)组成的抗CD3x抗PD1双特异性抗体分子(OKT3//949-G1silent),以及通过经由额外的二硫键将该抗体分子的Fab-Fab连接而制备的修饰抗体分子(OKT3//949-G1silentHL,OKT3//949-G1silentHH,OKT3//949-G1silentLL)。
图32示出了测定以下各项的CD3和/或PD1介导的激动剂活性的结果:由抗CD3抗体(OKT3)和抗PD1抗体(949)组成的抗CD3x抗PD1双特异性抗体分子(OKT3//949-G1silent),以及通过经由额外的二硫键将该抗体分子的Fab-Fab连接而制备的修饰抗体分子(OKT3//949-G1silentHH,OKT3//949-G1silentHL,OKT3//949-G1silentLH,OKT3//949-G1silentLL),如实施例22-2中所述。
图33A和B显示了当组合使用CD28/CD3钳制双特异性抗体和GPC3/结合减弱的CD3双特异性抗体时,评估对癌细胞生长的T细胞依赖性抑制作用的结果,如实施例23-1所述。当将上述CD28/CD3钳制双特异性抗体和GPC3/结合减弱的CD3双特异性抗体组合并允许其在靶细胞(表达GPC3的癌细胞)和效应细胞(T细胞)存在下起作用时,GPC3/结合减弱的CD3双特异性抗体使靶细胞和效应细胞靠近,并且CD28/CD3钳制双特异性抗体激活效应细胞。图33A显示了当GPC3/结合减弱的CD3双特异性抗体分子(GPC3/attCE115)用作将T细胞靶向癌细胞的抗体,以及GPC3/CD3钳制双特异性抗体分子(GPC3/clamp CD3)、KLH/CD3钳制双特异性抗体分子(KLH/clamp CD3)、CD28/CD3钳制双特异性抗体分子(CD28/clamp CD3)或通过经由额外的二硫键将该抗体分子的Fab-Fab连接而制备的修饰抗体分子(CD28/clampCD3_HH)用作激活T细胞的抗体时,对癌细胞生长的抑制作用。
图33B显示了当通过经由额外的二硫键将GPC3/结合减弱的CD3双特异性抗体的Fab-Fab连接而制备的修饰抗体分子(GPC3/attCE115_LL)用作将T细胞靶向癌细胞的抗体,并且GPC3/CD3钳制双特异性抗体分子(GPC3/clamp CD3)、KLH/CD3钳制双特异性抗体分子(KLH/clamp CD3)、CD28/CD3钳制双特异性抗体分子(CD28/clamp CD3)或通过经由额外的二硫键将该抗体分子的Fab-Fab连接而制备的修饰抗体分子(CD28/clamp CD3_HH)用作激活T细胞的抗体时,对癌细胞生长的抑制作用。
图34A-C显示了如实施例23-2中所述组合使用CD28/CD3钳制双特异性抗体和GPC3/结合减弱的CD3双特异性抗体时,评估T细胞产生细胞因子的结果。当在靶细胞(表达GPC3的癌细胞)和效应细胞(T细胞)存在下,将上述CD28/CD3钳制双特异性抗体和GPC3/结合减弱的CD3双特异性抗体组合使用时,GPC3/结合减弱的CD3双特异性抗体使靶细胞和效应细胞靠近,并且CD28/CD3钳制双特异性抗体激活效应细胞。图34A显示了在靶细胞(表达GPC3的癌细胞)和效应细胞(T细胞)的存在下,当GPC3/结合减弱的CD3双特异性抗体分子(GPC3/attCE115)和经由额外的二硫键通过将CD28/CD3钳制双特异性抗体的Fab-Fab连接而制备的修饰抗体分子(CD28/clamp CD3_HH)单独或组合使用时的IL-6产生水平。
图34B显示了在仅效应细胞(T细胞)的存在下,当GPC3/结合减弱的CD3双特异性抗体分子(GPC3/attCE115)和经由额外的二硫键通过将CD28/CD3钳制双特异性抗体的Fab-Fab连接而制备的修饰抗体分子(CD28/clamp CD3_HH)单独或组合使用时的IL-6产生水平。
图34C显示了在靶细胞(表达GPC3的癌细胞)和效应细胞(T细胞)的存在下,当GPC3/结合减弱的CD3双特异性抗体分子(GPC3/attCE115)和经由额外的二硫键通过将CD28/CD3钳制双特异性抗体的Fab-Fab连接而制备的修饰抗体分子(CD28/clamp CD3_HH)单独或组合使用时的癌细胞生长抑制作用。
图35A和35B是示意图,显示了如实施例23-1所述当组合使用CD28/CD3钳制双特异性抗体和GPC3/结合减弱的CD3双特异性抗体时,T细胞依赖性癌细胞生长抑制的作用机制(图中的“ε”表示CD3ε)。图35A显示了在靶细胞(表达GPC3的癌细胞)和效应细胞(T细胞)存在下,当组合使用CD28/CD3钳制双特异性抗体和GPC3/结合减弱的CD3双特异性抗体时癌细胞生长抑制的作用机制。
图35B显示了在靶细胞(表达GPC3的癌细胞)和效应细胞(T细胞)存在下,当组合使用通过向CD28/CD3钳制双特异性抗体的Fab-Fab中引入额外的二硫键而被修饰的修饰抗体分子和GPC3/结合减弱的CD3双特异性抗体时癌细胞生长抑制的作用机制。
图36A和36B是示意图,显示了如实施例23-2所述当组合使用CD28/CD3钳制双特异性抗体和GPC3/结合减弱的CD3双特异性抗体时,T细胞产生细胞因子的作用机制(图中的“ε”表示CD3ε)。图36A显示了在靶细胞(表达GPC3的癌细胞)和效应细胞(T细胞)存在下,当组合使用通过向CD28/CD3钳制双特异性抗体的Fab-Fab中引入额外的二硫键而被修饰的修饰抗体分子和GPC3/结合减弱的CD3双特异性抗体时细胞因子产生的作用机制。
图36B显示了在仅效应细胞(T细胞)存在下,当组合使用通过向CD28/CD3钳制双特异性抗体的Fab-Fab中引入额外的二硫键而被修饰的修饰抗体分子和GPC3/结合减弱的CD3双特异性抗体时细胞因子产生的作用机制。
图37A和图37B显示了测定以下各项的激动剂活性的结果:CD8/CD28双特异性抗体分子(CD8/CD28-P587),和经由额外的二硫键通过将该抗体的Fab-Fab连接而产生的修饰抗体分子(CD8/CD28-P587(HH),CD8/CD28-P587(LL),CD8/CD28-P587(HL),CD8/CD28-P587(LH)),如实施例24中所述。抗KLH抗体分子(KLH-P587)被用作阴性对照。显示了通过使用来自两个不同供体的外周血单核细胞(PBMC)获得的结果(上图:供体A,下图:供体B)。图37A显示了PBMC中分裂的调节性T细胞(Treg)的比例。
图37B示出了PBMC中分裂的CD8α阳性T细胞的比例。
[具体实施方案]
I.定义
在本文中,术语“抗原结合分子”在最广泛的意义上是指与抗原决定簇(表位)特异性结合的分子。在一个实施方案中,抗原结合分子是抗体,抗体片段或抗体衍生物。在一个实施方案中,抗原结合分子是非抗体蛋白或其片段或其衍生物。
在本文中,“抗原结合结构域”是指与抗原的全部或部分特异性结合并互补的区域。在本文中,抗原结合分子包含抗原结合结构域。当抗原的分子量大时,抗原结合结构域只能结合到抗原的特定部分。该特定部分称为“表位”。在一个实施方案中,抗原结合结构域包含与特定抗原结合的抗体片段。抗原结合结构域可以由一个或多个抗体可变结构域提供。在非限制性实施方案中,抗原结合结构域包含抗体轻链可变区(VL)和抗体重链可变区(VH)二者。此类抗原结合结构域的实例包括“单链Fv(scFv)”,“单链抗体”,“Fv”,“单链Fv2(scFv2)”,“Fab”和“Fab’”。在其他实施方案中,抗原结合结构域包含与特定抗原结合的非抗体蛋白,或其片段。在具体的实施方案中,抗原结合结构域包含铰链区。
在本发明中,“特异性结合”是指在一种状态下的结合,在该状态下,参与特异性结合的分子之一不显示与除单个或多个结合伴侣分子以外的分子的任何显著结合。此外,当抗原结合结构域对抗原中包含的多个表位中的特定表位具有特异性时,也可以使用该术语。当由抗原结合结构域结合的表位包含在多个不同的抗原中时,包含该抗原结合结构域的抗原结合分子可以与具有该表位的各个抗原结合。
在本公开中,“结合到相同表位”是指两个抗原结合结构域所结合的表位至少彼此部分重叠。重叠的程度为但不限于至少10%或更多,优选20%或更多,30%或更多,40%或更多,50%或更多,60%或更多,70%或更多,80%或更多,特别优选90%或更多,最优选100%。
本文的术语“抗体”以最广义使用,包括各种抗体结构,包括但不限于单克隆抗体、多克隆抗体、多特异性抗体(例如双特异性抗体)和抗体片段,只要它们表现出所需的抗原结合活性即可。
术语“单克隆抗体”在用于本文时指从一群基本上同质的抗体中获得的抗体,即,除了可能的变体抗体(例如,含有天然存在的突变或在单克隆抗体制剂的生产过程中出现的变体抗体,这样的变体通常以少量存在)之外,构成该群体的个体抗体是相同的和/或结合相同的表位。与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂相反,单克隆抗体制剂中的每个单克隆抗体针对抗原上的单一决定簇。因此,修饰语“单克隆”表明抗体从基本上同质的抗体群获得的特征,不应解释为要求通过任何特定方法来产生抗体。例如,根据本发明使用的单克隆抗体可以通过多种技术制备,包括但不限于杂交瘤方法、重组DNA方法、噬菌体展示方法和利用含有全部或部分的人免疫球蛋白基因座的转基因动物的方法,这样的方法和用于制备单克隆抗体的其它示例性方法在本文描述。
“天然抗体”指具有变化的结构的天然存在的免疫球蛋白分子。例如,天然IgG抗体是约150,000道尔顿的异源四聚体糖蛋白,其由两条相同的轻链和两条相同的重链组成,所述链通过二硫键结合。从N端至C端,每条重链具有可变区(VH),也称为可变重结构域或重链可变结构域,其后是三个恒定结构域(CH1、CH2和CH3)。类似地,从N端到C端,每条轻链具有可变区(VL),也称为可变轻结构域或轻链可变结构域,其后是恒定轻(CL)结构域。基于其恒定结构域的氨基酸序列,抗体的轻链可以被分配给称为kappa(κ)和lambda(λ)的两个类型中的一个。
术语“嵌合”抗体是指这样的抗体,其中重链和/或轻链的一部分来源于特定来源或物种,而重链和/或轻链的其余部分来源于不同来源或物种。
抗体的“类别”是指其重链所具有的恒定结构域或恒定区的类型。抗体主要分为五类:IgA,IgD,IgE,IgG和IgM,其中一些可以进一步分为亚类(同种型),例如IgG
在本发明的一个实施方案中,恒定区优选为抗体恒定区,更优选为IgG1,IgG2,IgG3和IgG4型抗体恒定区,甚至更优选为人IgG1,IgG2,IgG3和IgG4型抗体恒定区。此外,在本发明的另一个实施方案中,恒定区优选为重链恒定区,更优选为IgG1,IgG2,IgG3和IgG4型重链恒定区,甚至更优选为人IgG1,IgG2,IgG3和IgG4型重链恒定区。人IgG1恒定区,人IgG2恒定区,人IgG3恒定区和人IgG4恒定区的氨基酸序列是已知的。对于人IgG1,人IgG2,人IgG3和人IgG4的恒定区,Sequences of proteins of immunological interest(具有免疫学意义的蛋白质序列)(NIH出版号91-3242)中描述了多个具有遗传多态性的同种异型序列,它们中的任何一个都可用于本发明中。本发明的氨基酸修饰的恒定区可以包含其他氨基酸突变或修饰,只要它们包括本发明的氨基酸突变即可。
术语“铰链区”表示野生型抗体重链中的抗体重链多肽部分,其连接CH1结构域和CH2结构域,例如根据EU编号系统从约位置216至约位置230,或根据Kabat编号系统从约位置226到约位置243。已知在天然IgG抗体中,铰链区中根据EU编号的位置220处的半胱氨酸残基与抗体轻链中位置214处的半胱氨酸残基形成二硫键。还已知在两个抗体重链之间,在铰链区中根据EU编号,在位置226处的半胱氨酸残基和位置229处的半胱氨酸残基之间形成二硫键。本文的铰链区包括野生型铰链区以及变体,在所述变体中,野生型铰链区中的氨基酸残基通过置换,添加或缺失而被改变。
术语“Fc区”在本文中用于定义含有至少部分恒定区的免疫球蛋白重链的C-末端区。该术语包括天然序列Fc区和变体Fc区。在一个实施方案中,人IgG重链Fc区从Cys226或从Pro230延伸至重链的羧基末端。然而,Fc区的C-末端赖氨酸(Lys447)或甘氨酸-赖氨酸(残基446-447)可以存在或不存在。除非本文另有说明,否则Fc区或恒定区中氨基酸残基的编号是根据EU编号系统(也称为EU索引)进行的,如在Kabat等,Sequences of Proteins ofImmunological Interest,第5版.Public Health Service,National Institutes ofHealth,Bethesda,MD,1991中所述。
“效应子功能”是指归因于抗体的Fc区的那些生物活性,其随抗体同种型而变化。抗体效应子功能的实例包括:C1q结合和补体依赖性细胞毒性(CDC);Fc受体结合;抗体依赖性细胞介导的细胞毒性(ADCC);吞噬作用;细胞表面受体(例如B细胞受体)的下调;和B细胞活化。
术语“Fc受体”或“FcR”是指与抗体的Fc区结合的受体。在一些实施方案中,FcR是天然人FcR。在一些实施方案中,FcR是结合IgG抗体的FcR(γ受体),并且包括FcγRI,FcγRII和FcγRIII亚类的受体,包括那些受体的等位基因变体和选择性剪接形式。FcγRII受体包括FcγRIIA(“激活受体”)和FcγRIIB(“抑制受体”),其具有相似的氨基酸序列,其主要区别在于其胞质结构域。激活受体FcγRIIA在其胞质结构域中包含基于免疫受体酪氨酸的激活基序(ITAM)。抑制受体FcγRIIB在其胞质结构域中包含基于免疫受体酪氨酸的抑制基序(ITIM)。(参见,例如,
术语“Fc受体”或“FcR”还包括新生儿受体FcRn,其负责将母体IgG转移至胎儿(Guyer等人,J.Immunol.117:587(1976)和Kim等人,J.Immunol.24:249(1994))以及免疫球蛋白稳态的调节。测量与FcRn结合的方法是已知的(参见例如Ghetie和Ward.,Immunol.Today 18(12):592-598(1997);Ghetie等人,Nature Biotechnology,15(7):637-640(1997);Hinton等人,J.Biol.Chem.279(8):6213-6216(2004);WO 2004/92219(Hinton等人)。
术语“可变区”或“可变结构域”是指参与抗体与抗原结合的抗体重链或轻链的结构域。天然抗体的重链和轻链的可变结构域(分别为VH和VL)通常具有相似的结构,其中每个结构域包含四个保守构架区(FR)和三个高变区(HVR)。(参见,例如Kindt等人KubyImmunology,第6版,W.H.Freeman和Co.,第91页(2007).)单个VH或VL结构域可足以赋予抗原结合特异性。此外,结合特定抗原的抗体可以使用VH或VL结构域从结合抗原的抗体分离,以分别筛选互补的VL或VH结构域的文库。参见,例如,Portolano等人,J.Immunol.150:880-887(1993);Clarkson等人,Nature 352:624-628(1991)。
如本文所用的术语“高变区”或“HVR”是指抗体可变结构域中的序列上高度可变的(“互补决定区”或“CDR”)和/或形成结构上确定环的(“高变环”)和/或含有抗原接触残基的(“抗原接触”)每个区域。通常,抗体包含六个HVR:VH中三个(H1,H2,H3)和VL中三个(L1,L2,L3)。本文中的示例性HVR包括:
(a)在氨基酸残基26-32(L1)、50-52(L2)、91-96(L3)、26-32(H1)、53-55(H2)和96-101(H3)处出现的高变环(Chothia和Lesk,J.Mol.Biol.196:901-917(1987));
(b)在氨基酸残基24-34(L1)、50-56(L2)、89-97(L3)、31-35b(H1)、50-65(H2)和95-102(H3)处出现的CDR(Kabat等人,Sequences of Proteins of ImmunologicalInterest,第5版Public Health Service,National Institutes of Health,Bethesda,MD(1991));
(c)在氨基酸残基27c-36(L1)、46-55(L2)、89-96(L3)、30-35b(H1)、47-58(H2)和93-101(H3)处出现的抗原接触(MacCallum等人J.Mol.Biol.262:732-745(1996));和
(d)(a)、(b)和/或(c)的组合,包括HVR氨基酸残基46-56(L2)、47-56(L2)、48-56(L2)、49-56(L2)、26-35(H1)、26-35b(H1)、49-65(H2)、93-102(H3)和94-102(H3)。
除非另有说明,可变结构域中的HVR残基和其它残基(例如FR残基)在本文中根据Kabat等人(见上文)进行编号。
“构架”或“FR”是指除高变区(HVR)残基之外的可变结构域残基。可变结构域的FR通常由四个FR结构域组成:FR1,FR2,FR3和FR4。HVR和FR序列通常以下述顺序出现在VH(或VL)中:FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4。
术语“全长抗体”、“完整抗体”和“全抗体”在本文可互换地用于指具有与天然抗体结构基本相似的结构或具有包含如本文所定义的Fc区的重链的抗体。
术语“宿主细胞”、“宿主细胞系”和“宿主细胞培养物”可互换地使用,并且是指其中引入外源核酸的细胞,包括这种细胞的后代。宿主细胞包括“转化体”和“转化的细胞”,其包括原代转化的细胞和来源于其的后代,而不考虑传代的次数。后代在核酸含量上可能与亲本细胞不完全相同,但可以包含突变。本文中包括具有与在最初转化的细胞中筛选或选择的相同功能或生物学活性的突变体后代。
本文所用的术语”载体”是指能够使与其相连的另一个核酸增殖的核酸分子。该术语包括作为自我复制核酸结构的载体以及掺入到已引入该载体的宿主细胞的基因组中的载体。某些载体能够指导与它们可操作连接的核酸的表达。这样的载体在本文中称为“表达载体”。
“人抗体”指具有这样的氨基酸序列的抗体,所述氨基酸序列对应于由人或人细胞生成或来源于利用人抗体库或其它人抗体编码序列的非人来源的抗体的氨基酸序列。人抗体的这种定义明确排除包含非人抗原结合残基的人源化抗体。
“人源化”抗体是指包含来自非人HVR的氨基酸残基和来自人FR的氨基酸残基的嵌合抗体。在某些实施方案中,人源化抗体将包含基本上所有的至少一个且通常是两个可变结构域,其中所有或基本上所有的HVR(例如CDR)对应于非人抗体的那些,并且所有或基本上所有的FR都与人抗体的FR相对应。人源化抗体可任选地包含源自人抗体的抗体恒定区的至少一部分。抗体例如非人抗体的“人源化形式”是指已经历人源化的抗体。
“抗体片段”指不同于完整抗体的分子,其包含完整抗体的部分,所述部分与完整抗体所结合的抗原相结合。抗体片段的实例包括但不限于Fv、Fab、Fab’、Fab’-SH、F(ab’)
可变片段(Fv)
在此,术语“可变片段(Fv)”是指由一对抗体轻链可变区(VL)和抗体重链可变区(VH)构成的抗体来源的抗原结合结构域的最小单位。1988年,Skerra和Pluckthun发现,通过在细菌信号序列的下游插入抗体基因并在大肠杆菌中诱导该基因的表达,可以从大肠杆菌周质级分制备均质且具有活性的抗体(Science(1988)240(4855),1038-1041)。在由周质级分制备的Fv中,VH以便于与抗原结合的方式与VL缔合。
scFv,单链抗体和sc(Fv)2
在本文中,术语“scFv”,“单链抗体”和“sc(Fv)2”均指包含衍生自重链和轻链的可变区而不是恒定区的单多肽链的抗体片段。通常,单链抗体还在VH和VL结构域之间包含多肽接头,从而能够形成所需的结构,该结构被认为允许抗原结合。Pluckthun在“ThePharmacology of Monoclonal Antibodies,Vol.113,Rosenburg and Moore,eds.,Springer-Verlag,New York,269-315(1994)”中详细讨论了单链抗体。还可参见国际专利公开WO1988/001649;美国专利号4,946,778和5,260,203。在特定的实施方案中,单链抗体可以是双特异性的和/或人源化的。
scFv是抗原结合结构域,其中形成Fv的VH和VL通过肽接头连接在一起(Proc.Natl.Acad.Sci.U.S.A.(1988)85(16),5879-5883)。VH和VL可以通过肽接头保留在接近的位置处。
sc(Fv)2是单链抗体,其中两个VL和两个VH的四个可变区通过接头(例如肽接头)连接以形成单链(J Immunol.Methods(1999)231(1-2),177-189)。两个VH和两个VL可以源自不同的单克隆抗体。此类sc(Fv)2优选包括例如识别单抗原中存在的两个表位的双特异性sc(Fv)2,如Journal of Immunology(1994)152(11),5368-5374中所公开的。sc(Fv)2可以通过本领域技术人员已知的方法来制备。例如,sc(Fv)2可以通过经由接头例如肽接头连接scFv来制备。
在本文中,形成sc(Fv)2的抗原结合结构域的形式包括这样的抗体,其中两个VH单元和两个VL单元以VH,VL,VH和VL([VH]-接头-[VL]-接头-[VH]-接头-[VL])的顺序从单链多肽的N末端开始进行排列。两个VH单元和两个VL单元的顺序不限于上述形式,并且它们可以以任何顺序排列。形式的示例顺序如下所示。
[VL]-接头-[VH]-接头-[VH]-接头-[VL]
[VH]-接头-[VL]-接头-[VL]-接头-[VH]
[VH]-接头-[VH]-接头-[VL]-接头-[VL]
[VL]-接头-[VL]-接头-[VH]-接头-[VH]
[VL]-接头-[VH]-接头-[VL]-接头-[VH]
“Fab”由单条轻链以及来自单条重链的CH1区和可变区组成。野生型Fab分子的重链不能与另一个重链分子形成二硫键。在本文中,除了野生型Fab分子之外,还包括Fab变体,其中野生型Fab分子中的氨基酸残基通过置换,添加或缺失而改变。在具体的实施方案中,Fab变体中包含的突变的氨基酸残基(例如,在置换,添加或插入后的半胱氨酸残基或赖氨酸残基)可与另一个重链分子或其部分(例如Fab分子)形成二硫键。
scFab是抗原结合结构域,其中单个轻链以及形成Fab的来自单个重链的CH1区和可变区通过肽接头连接在一起。轻链以及来自重链的CH1区和可变区可以通过肽接头保持紧密相邻。
“F(ab’)2”或“Fab”是通过用诸如胃蛋白酶和木瓜蛋白酶的蛋白酶处理免疫球蛋白(单克隆抗体)而产生的,并且是指通过在两条H链各自的铰链区之间存在的二硫键附近消化免疫球蛋白(单克隆抗体)而产生的抗体片段。例如,木瓜蛋白酶在两条H链各自的铰链区之间存在的二硫键上游切割IgG,以产生两个同源抗体片段,其中包含VL(L链可变区)和CL(L链恒定区)的L链通过在其C端区域的二硫键连接到包含VH(H链可变区)和CHγ1(H链恒定区的γ1区)的H链片段。这两个同源抗体片段中的每一个都称为Fab'。
“F(ab’)2”由两条轻链和两条重链组成,所述两条轻链和两条重链包括CH1结构域的恒定区和一部分CH2结构域,从而在两条重链之间形成二硫键。本文公开的F(ab′)2可优选如下制备。用诸如胃蛋白酶的蛋白酶部分消化包含所需抗原结合结构域的完整单克隆抗体等;并且Fc片段通过吸附到Protein A柱上而被去除。蛋白酶没有特别限制,只要它能够在适当的设定酶反应条件下(例如pH)以选择性的方式切割整个抗体以产生F(ab′)2即可。这样的蛋白酶包括例如胃蛋白酶和无花果蛋白酶。
单结构域抗体
在本文中,术语“单结构域抗体”所指的那些在其结构上不受特别限制,只要该结构域可以自身发挥抗原结合活性即可。以IgG抗体为例的普通抗体在通过VH和VL的配对形成可变区的状态下发挥抗原结合活性。相反,已知单结构域抗体能够通过其自身的结构域结构单独发挥抗原结合活性,而无需与另一个结构域配对。单结构域抗体通常具有相对较低的分子量,并以单体形式存在。
单结构域抗体的实例包括但不限于天然缺乏轻链的抗原结合分子,例如骆驼科动物的VHH和鲨鱼的V
单结构域抗体可以从能够产生单结构域抗体的动物获得或通过免疫能够产生单结构域抗体的动物来获得。能够产生单结构域抗体的动物的实例包括但不限于骆驼科动物和转基因动物,其中已向所述动物中引入了具有产生单结构域抗体的能力的基因。骆驼科动物包括骆驼,美洲驼,羊驼,单峰驼,原驼等。已经引入了具有产生单结构域抗体的能力的基因的转基因动物的实例包括但不限于国际公开号WO2015/143414或美国专利公开号US2011/0123527A1中所述的转基因动物。人源化的单链抗体也可以通过用人种系序列或与其相似的序列替换从动物获得的单结构域抗体的框架序列来获得。人源化单结构域抗体(例如,人源化VHH)是本发明的单结构域抗体的一个实施方案。
或者,可以通过ELISA,淘选等从含有单结构域抗体的多肽文库获得单结构域抗体。包含单结构域抗体的多肽文库的例子包括但不限于从各种动物或人类获得的天然抗体文库(例如,Methods in Molecular Biology 2012 911(65-78)and Biochimica etBiophysica Acta-Proteins and Proteomics 2006 1764:8(1307-1319)),通过免疫各种动物获得的抗体文库(例如Journal of Applied Microbiology 2014 117:2(528-536))和从各种动物或人的抗体基因制备的合成抗体文库(例如Journal of BiomolecularScreening 2016 21:1(35-43),Journal of Biological Chemistry 2016 291:24(12641-12657),和AIDS 2016 30:11(1691-1701))。
“结合活性”是指分子(例如抗体)的一个或多个结合位点与其结合伴侣(例如抗原)之间的非共价相互作用的总和的强度。在此,结合活性不严格限于结合对的成员(例如抗体和抗原)之间的1:1相互作用。例如,当结合对的成员反映单价1:1相互作用时,结合活性是指固有结合亲和力(亲和力)。当结合对的一个成员能够单价结合和多价结合时,结合活性是每个结合强度的总和。分子X对其伴侣Y的结合活性通常可以用解离常数(KD)或“每单位量的配体结合的分析物的量”来表示。结合活性可以通过本领域已知的常规方法,包括本文所述的那些方法来测量。
如本文所用,“激动剂”抗原结合分子或“激动剂”抗体是显著增强其所结合的抗原的生物学活性的抗原结合分子或抗体。
如本文所用,“阻断”抗原结合分子或“阻断”抗体或“拮抗剂”抗原结合分子或“拮抗剂”抗体是显著抑制(部分或完全)其所结合的抗原的生物学活性的抗原结合分子或抗体。
本文所用的短语“实质上减少”或“实质上不同”是指两个数值之间的差异程度足够高(通常一个数值与分子关联,另一个数值与参考/比较分子关联),使得本领域技术人员将认为在由所述值(例如,KD值)测量的生物学特征的背景下,两个值之间的差异具有统计学显著性。
如本文所用,术语“实质上相似”或“实质上相同”是指两个数值之间足够高的相似度(例如,一个数值与本发明的抗体相关联,另一个数值与参考/比较抗体相关联),以便本领域技术人员会认为在由所述值(例如,KD值)测量的生物学特征的背景下,两个值之间的差异有很小或没有生物学和/或统计学显著性。
术语“药物制剂”和“药物组合物”指这样的制剂,其形式为允许包含在其中的活性成分的生物学活性有效,并且不包含对待施用所述制剂的受试者具有不可接受的毒性的另外的成分。
“药学上可接受的载体”是指药物制剂中除活性成分以外对受试者无毒的成分。药学上可接受的载体包括但不限于缓冲剂,赋形剂,稳定剂或防腐剂。
“个体”或“受试者”是哺乳动物。哺乳动物包括但不限于家养动物(例如,牛、绵羊、猫、狗和马)、灵长类动物(例如,人和非人灵长类动物如猴)、兔以及啮齿类动物(例如,小鼠和大鼠)。在某些实施方案中,个体或受试者是人。
II.抗原结合分子
一方面,本公开部分基于以下发现:相比于含有不连接或通过较少键连接的抗原结合结构域的对照抗原结合分子,包含通过一个或多个键彼此连接的第一抗原结合结构域和第二抗原结合结构域的抗原结合分子的各种活性增强或减少。在某些实施方案中,提供了具有将两个或更多个抗原分子保持在空间上接近的位置处的活性的抗原结合分子。本公开的抗原结合分子是有用的,例如,因为它能够调节通过彼此缔合而被激活的两个抗原分子的激活。在某些其他实施方案中,提供了通过抗原结合结构域之间的连接而获得对蛋白酶消化的抗性的抗原结合分子。
A.示例性抗原结合分子
<抗原结合分子的结构>
一方面,本公开提供了包含第一抗原结合结构域和第二抗原结合结构域的抗原结合分子,并且所述抗原结合结构域通过一个或多个键彼此连接。
在上述方面的实施方案中,连接两个抗原结合结构域的一个或多个键中的至少一个是共价键。在某些实施方案中,所述共价键是通过第一抗原结合结构域中的氨基酸残基与第二抗原结合结构域中的氨基酸残基的直接交联而形成的。交联的氨基酸残基为例如半胱氨酸,并且形成的共价键为例如二硫键。
在某些其他实施方案中,所述共价键是通过第一抗原结合结构域中的氨基酸残基与第二抗原结合结构域中的氨基酸残基经由交联剂交联而形成的。交联剂是例如胺反应性交联剂,并且交联的氨基酸残基是例如赖氨酸。
在以上方面的一个实施方案中,连接抗原结合结构域的一个或多个键中的至少一个是非共价键。在某些实施方案中,非共价键是离子键,氢键或疏水键。离子键例如在酸性氨基酸和碱性氨基酸之间形成。酸性氨基酸是例如天冬氨酸(Asp)或谷氨酸(Glu)。碱性氨基酸是例如组氨酸(His),赖氨酸(Lys)或精氨酸(Arg)。
抗原结合结构域之间的键(连接两个抗原结合结构域的键)所起源的氨基酸残基分别存在于第一和第二抗原结合结构域中,并且抗原结合结构域之间的键是通过连接这些氨基酸残基形成的。在上述方面的一个实施方案中,抗原结合结构域之间的键所起源的氨基酸残基中的至少一个是人工引入的突变氨基酸残基,并且例如是人工引入的半胱氨酸残基。可以通过例如氨基酸置换的方法将这样的突变氨基酸残基引入野生型抗原结合结构域。本说明书公开了当抗原结合结构域包含例如抗体片段时,对于作为恒定区的CH1,CL和铰链区以及作为可变区的VH,VL和VHH区中的每一个,抗原结合结构域之间的键所起源的氨基酸残基的位点,并且例如可以将半胱氨酸残基引入这样的位点。
在上述方面的一个实施方案中,第一和第二抗原结合结构域中的至少一个自身具有与抗原结合的活性(即,单个抗原结合结构域独立地具有抗原结合活性)。在某些实施方案中,第一和第二抗原结合结构域中的每一个本身具有结合抗原的活性。
在上述方面的一个实施方案中,所述第一和第二抗原结合结构域均为相同类型的抗原结合结构域。如下所述,构成抗原结合结构域的蛋白质的实例包括衍生自抗体或非抗体蛋白质的多肽及其片段(例如,Fab,Fab',scFab,Fv,scFv和单结构域抗体)。从这种分子形式的观点来看,当构成第一和第二抗原结合结构域的蛋白质的结构相同时,确定抗原结合结构域为相同类型。
在上述方面的一个实施方案中,连接第一抗原结合结构域和第二抗原结合结构域的至少一个键可以通过将存在于第一抗原结合结构域和第二抗原结合结构域中相同位置的氨基酸残基彼此连接而形成,或者可以通过将分别位于不同位置的氨基酸残基彼此连接而形成。
抗原结合结构域中氨基酸残基的位置可以根据Kabat编号或EU编号系统(也称为EU索引)来显示,该编号系统描述于Kabat等,Sequences of Proteins of ImmunologicalInterest,5th Ed.Public Health Service,National Institutes of Health,Bethesda,MD,1991。例如,如果第一抗原结合结构域和第二抗原结合结构域之间的键所起源的氨基酸残基存在于抗原结合结构域中对应的相同位置,则根据Kabat编号或EU编号系统,这些氨基酸残基的位置可以表示为相同的编号。或者,如果第一抗原结合结构域和第二抗原结合结构域之间的键所起源的氨基酸残基存在于抗原结合结构域中不对应的不同位置,则根据Kabat编号或EU编号系统,这些氨基酸残基的位置可以表示为不同的数字。
在上述方面的一个实施方案中,第一和第二抗原结合结构域中的至少一个包含与特异性抗原结合的抗体片段。在某些实施方案中,抗体片段是Fab,Fab',scFab,Fv,scFv或单结构域抗体。在某些实施方案中,抗原结合结构域之间的键所源自的至少一个氨基酸残基存在于所述抗体片段内。
在上述方面的一个实施方案中,抗原结合结构域之间的键所起源的氨基酸残基中的至少一个存在于恒定区内。在某些实施方案中,氨基酸残基存在于CH1区内,例如,其存在于CH1区内根据EU编号位置119至123、131至140、148至150、155至167、174至178、188至197、201至214,以及218至219的任何位置处。在某些实施方案中,氨基酸残基存在于CH1区域中选自由以下各项组成的组的位置:根据EU编号位置119,122,123,131,132,133,134,135,136,137,138,139,140,148,150,155,156,157,159,160,161,162,163,164,165,167,174,176,177,178,188,189,190,191,192,193,194,195,196,197,201,203,205,206,207,208,211,212,213,214,218和219。在某些实施方案中,氨基酸残基存在于CH1区内根据EU编号位置134,135,136,137,191,192,193,194,195或196处。在某些实施方案中,氨基酸残基存在于CH1区内根据EU编号位置135,136或191处。
在上述方面的一个实施方式中,恒定区衍生自人。在某些实施方案中,重链恒定区的亚类是IgG1,IgG2,IgG3,IgG4,IgA1,IgA2,IgM,IgD和IgE中的任何一个。在某些实施方案中,CH1区的亚类是γ1,γ2,γ3,γ4,α1,α2,μ,δ和ε中的任何一个。
在上述方面的一个实施方案中,连接第一抗原结合结构域和第二抗原结合结构域的至少一个键是通过将所述第一抗原结合结构域的CH1区内的氨基酸残基和所述第二抗原结合结构域的CH1区内的氨基酸残基连接而形成的。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置119、120、121、122和123。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置131,132,133,134,135,136,137,138,139和140。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置148,149和150。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置155,156,157,158,159,160,161,162,163,164,165,166和167。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置174、175、176、177和178。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置188,189,190,191,192,193,194,195,196和197。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置201,202,203,204,205,206,207,208,209,210,211,212,213和214。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据EU编号位置218和219。
在上述方面的一个实施方案中,在第一抗原结合结构域和第二抗原结合结构域的每一个中,键所起源的氨基酸残基的位置差异是三个氨基酸或更少。这意味着,当在第一抗原结合结构域的CH1区内键所起源的氨基酸残基的位置和在第二抗原结合结构域的CH1区内键所起源的氨基酸残基的位置分别根据EU编号进行比较时,差异是三个或更少的氨基酸。在某些实施方案中,连接第一抗原结合结构域和第二抗原结合结构域的至少一个键是通过将第一抗原结合结构域的CH1区域中根据EU编号在位置135处的氨基酸残基与第二抗原结合结构域的CH1区域中根据EU编号在位置132至138中的任何一个位置处的氨基酸残基连接而形成的。在某些实施方案中,连接第一抗原结合结构域和第二抗原结合结构域的至少一个键是通过将第一抗原结合结构域的CH1区域中根据EU编号在位置136处的氨基酸残基与第二抗原结合结构域的CH1区域中根据EU编号在位置133至139中的任何一个位置处的氨基酸残基连接而形成的。
在某些实施方案中,连接第一抗原结合结构域和第二抗原结合结构域的至少一个键是通过将第一抗原结合结构域的CH1区域中根据EU编号在位置191处的氨基酸残基与第二抗原结合结构域的CH1区域中根据EU编号在位置188至194中的任何一个位置处的氨基酸残基连接而形成的。在示例性实施方案中,连接第一抗原结合结构域和第二抗原结合结构域的至少一个键是通过将两个抗原结合结构域的CH1区域中根据EU编号在位置135处的氨基酸残基彼此连接而形成的。在示例性实施方案中,连接第一抗原结合结构域和第二抗原结合结构域的至少一个键是通过将两个抗原结合结构域的CH1区域中根据EU编号在位置136处的氨基酸残基彼此连接而形成的。在示例性实施方案中,连接第一抗原结合结构域和第二抗原结合结构域的至少一个键是通过将两个抗原结合结构域的CH1区域中根据EU编号在位置191处的氨基酸残基彼此连接而形成的。
在上述方面的一个实施方案中,抗原结合结构域之间的键所起源的氨基酸残基中的至少一个存在于CL区域内,例如,存在于CL区域内根据Kabat编号位置108至112、121至128、151至156、184至190、195至196、200至203以及208至213的任何位置处。在某些实施方案中,氨基酸残基存在于CL区域中选自由以下各项组成的组的位置:根据Kabat编号位置108,109,112,121,123,126,128,151,152,153,156,184,186,188,189,190,195,196,200,201,202,203,208,210,211,212和213。在某些实施方案中,氨基酸残基存在于CL区内根据Kabat编号位置126处。
在上述方面的实施方案中,恒定区衍生自人。在某些实施方案中,CL区的亚类是κ或λ。
在上述方面的一个实施方案中,连接第一抗原结合结构域和第二抗原结合结构域的至少一个键是通过将所述第一抗原结合结构域的CL区内的氨基酸残基和所述第二抗原结合结构域的CL区内的氨基酸残基连接而形成的。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据Kabat编号位置108、109、110、111和112。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据Kabat编号位置121,122,123,124,125,126,127和128。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据Kabat编号位置151,152,153,154,155和156。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据Kabat编号位置184,185,186,187,188,189和190。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据Kabat编号位置195和196。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据Kabat编号位置200,201,202和203。在某些实施方案中,在第一抗原结合结构域和第二抗原结合结构域中的氨基酸残基各自独立地选自由以下各项组成的组:根据Kabat编号位置208,209,210,211,212和213。
在上述方面的一个实施方案中,在第一抗原结合结构域和第二抗原结合结构域的每一个中,键所起源的氨基酸残基的位置差异是三个氨基酸或更少。这意味着,当在第一抗原结合结构域的CL区内键所起源的氨基酸残基的位置和在第二抗原结合结构域的CL区内键所起源的氨基酸残基的位置分别根据EU编号进行比较时,差异是三个或更少的氨基酸。在示例性实施方案中,连接第一抗原结合结构域和第二抗原结合结构域的至少一个键是通过将两个抗原结合结构域的CL区域中根据Kabat编号在位置126处的氨基酸残基彼此连接而形成的。
在上述方面的一个实施方案中,连接第一抗原结合结构域和第二抗原结合结构域的至少一个键是通过将所述第一抗原结合结构域的CH1区内的氨基酸残基和所述第二抗原结合结构域的CL区内的氨基酸残基连接而形成的。在某些实施方案中,第一抗原结合结构域的CH1区内的氨基酸残基选自由以下各项组成的组:根据EU编号的位置188,189,190,191,192,193,194,195,196和197,并且第二抗原结合结构域的CL区内的氨基酸残基选自由以下各项组成的组:根据Kabat编号的位置121,122,123,124,125,126,127和128。在示例性实施方案中,连接第一抗原结合结构域和第二抗原结合结构域的至少一个键是通过将第一抗原结合结构域的CH1区域中根据EU编号在位置191处的氨基酸残基与第二抗原结合结构域的CL区域中根据Kabat编号在位置126处的氨基酸残基连接而形成的。
在上述方面的一个实施方案中,抗原结合结构域之间的键所起源的氨基酸残基中的至少一个存在于可变区内。在某些实施方案中,氨基酸残基存在于VH区内,例如,其存在于VH区内选自由以下各项组成的组的位置:根据Kabat编号位置6、8、16、20、25、26、28、74和82b。在某些实施方案中,氨基酸残基存在于VL区内,并且例如,其存在于选自由以下各项组成的组的位置:VL区内根据Kabat编号的位置21、27、58、77、100、105和107(κ亚类),以及VL区内根据Kabat编号的位置6、19、33和34(λ亚类)。在某些实施方案中,氨基酸残基存在于VHH区内,例如,其存在于VHH区内选自由以下各项组成的组的位置:根据Kabat编号位置4,6,7,8,9,10,11,12,14,15,17,20,24,27,29,38,39,40,41,43,44,45,46,47,48,49,67,69,71,78,80,82,82c,85,88,91,93,94和107。
在上述方面的一个实施方案中,第一和第二抗原结合结构域中的至少一个包含与特定抗原结合的非抗体蛋白,或其片段。在某些实施方案中,所述非抗体蛋白是一对彼此特异性结合的配体和受体中的任一个。这样的受体包括例如属于细胞因子受体超家族的受体,G蛋白偶联受体,离子通道受体,酪氨酸激酶受体,免疫检查点受体,抗原受体,CD抗原,共刺激分子和细胞粘附分子。
在上述方面的实施方案中,第一和/或第二抗原结合结构域包含铰链区。在某些实施方案中,存在于野生型铰链区中的至少一个半胱氨酸残基被置换为另一个氨基酸残基。这种半胱氨酸残基存在于例如野生型铰链区中根据EU编号的位置226和/或229处。在某些实施方案中,抗原结合结构域之间的键所起源的氨基酸残基中的至少一个存在于铰链区内,并且例如存在于铰链区内选自由以下各项组成的组的位置:根据EU编号位置216、218和219。
在上述方面的一个实施方案中,所述第一抗原结合结构域和所述第二抗原结合结构域通过两个或更多个键彼此连接。
在某些实施方案中,抗原结合结构域之间的键所起源的氨基酸残基中的至少一个是存在于野生型序列中的氨基酸残基,例如,是野生型铰链区中的半胱氨酸残基。在某些实施方案中,连接第一抗原结合结构域和第二抗原结合结构域的至少一个键是通过存在于野生型铰链区中的半胱氨酸残基彼此交联而形成的二硫键。这种半胱氨酸残基存在于例如野生型铰链区的根据EU编号的位置226和/或229处。
在某些实施方案中,抗原结合结构域之间的键所源自的至少一个氨基酸残基存在于抗体片段内,并且至少一个氨基酸残基存在于铰链区内。在示例性实施方案中,本公开的抗原结合分子是F(ab’)2,其中第一和第二抗原结合结构域均包含Fab和铰链区。
在上述方面的实施方案中,本公开的抗原结合分子还包含Fc区,并且例如,它是全长抗体。在某些实施方案中,将促进Fc区多聚化的一个或多个氨基酸突变引入本公开的抗原结合分子的Fc区中。这样的氨基酸突变包括,例如在选自由以下各项组成的组的至少一个位置处的氨基酸突变:根据EU编号,位置247,248,253,254,310,311,338,345,356,359,382,385,386,430,433,434,436,437,438,439,440和447(参见例如WO2016/164480)。在某些实施方案中,多聚化是六聚化。
<抗原结合分子结合的抗原>
在上述方面的实施方案中,第一和第二抗原结合结构域二者都结合相同的抗原。在某些实施方案中,第一和第二抗原结合结构域二者都结合相同抗原上的相同表位。在某些其他实施方案中,第一和第二抗原结合结构域中的每一个结合相同抗原上的不同表位。在某些实施方案中,本公开的抗原结合分子是靶向一种特异性抗原的双互补位抗原结合分子(例如,双互补位抗体)。
在上述方面的另一个实施方案中,第一和第二抗原结合结构域各自结合不同的抗原。
在上述方面的另一个实施方案中,本公开的抗原结合分子是钳制抗原结合分子(例如,钳制抗体)。在本说明书中,钳制抗原结合分子是指与抗原/抗原结合分子复合物特异性结合的抗原结合分子,其中,所述复合物是在给定抗原A和与抗原A结合的抗原结合分子之间形成的,并且所述钳制抗原结合分子增加与抗原A结合的抗原结合分子对抗原A的结合活性(或者,稳定由抗原A和与抗原A结合的抗原结合分子形成的抗原/抗原结合分子复合物)。例如,CD3钳制抗体特异性结合抗原-抗体复合物,所述复合物是在CD3和对CD3的结合能力降低的抗体(结合减弱的CD3抗体)之间形成的复合物,从而能够增加结合减弱的CD3抗体对CD3的结合活性(或者,稳定由CD3和结合减弱的CD3抗体形成的抗原-抗体复合物)。在某些实施方案中,本公开的抗原结合分子中的第一和/或第二抗原结合结构域可以是来自钳制抗原结合分子的抗原结合结构域(钳制抗原结合结构域)。
在上述方面的实施方案中,第一和第二抗原结合结构域二者均具有相同的氨基酸序列。在另一个实施方案中,第一和第二抗原结合结构域各自具有不同的氨基酸序列。
在上述方面的实施方案中,第一和第二抗原结合结构域所结合的两个抗原中的至少一个是可溶性蛋白或膜蛋白。
<抗原结合分子的功能>
在上述方面的实施方案中,本公开的抗原结合分子具有将两个抗原分子保持在空间上接近的位置处的活性。在某些实施方案中,本公开的抗原结合分子能够将两个抗原分子保持在比对照抗原结合分子更近的位置,并且对照抗原结合分子与本公开的抗原结合分子的区别之处仅在于对照抗原结合分子在两个抗原结合结构域之间少一个键。在进一步的实施方案中,少的一个键可以选自这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
在上述方面的另一个实施方案中,本公开的抗原结合分子具有调节两个抗原分子之间的相互作用的活性。不受特定理论的束缚,认为调节相互作用的活性是由于通过本公开的抗原结合分子将两个抗原分子保持在空间上更近的位置而引起的。在某些实施方案中,与对照抗原结合分子相比,本公开的抗原结合分子能够增强或减少两个抗原分子之间的相互作用,并且对照抗原结合分子与本公开的抗原结合分子的区别之处仅在于对照抗原结合分子在两个抗原结合结构域之间少一个键。在进一步的实施方案中,少的一个键可以选自这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
在某些实施方案中,被本公开的抗原结合分子结合的两个抗原分子分别是配体和受体,并且本公开的抗原结合分子具有促进配体激活受体的活性。在某些其他实施方案中,被本公开内容的抗原结合分子结合的两个抗原分子分别是酶和其底物,并且本公开内容的抗原结合分子具有促进酶与底物的催化反应的活性。
此外,在某些其他实施方案中,被本公开的抗原结合分子结合的两个抗原分子都是存在于细胞表面上的抗原(例如蛋白质),并且本公开的抗原结合分子具有促进表达第一抗原的细胞与表达第二抗原的细胞之间的相互作用的活性。例如,表达第一抗原的细胞和表达第二抗原的细胞分别是具有细胞毒性活性的细胞和其靶细胞,并且本公开的抗原结合分子促进具有细胞毒性活性的细胞对靶细胞的损伤。具有细胞毒性活性的细胞是例如T细胞,NK细胞,单核细胞或巨噬细胞。
在上述方面的实施方案中,本公开的抗原结合分子具有调节通过彼此缔合而被激活的两个抗原分子的激活的活性。不受特定理论的束缚,认为调节激活的活性是由于通过本公开的抗原结合分子将两个抗原分子保持在空间上更近的位置而引起的。在某些实施方案中,与对照抗原结合分子相比,本公开的抗原结合分子能够增强或减少两个抗原分子之间的激活,并且对照抗原结合分子与本公开的抗原结合分子的区别之处仅在于对照抗原结合分子在两个抗原结合结构域之间少一个键。在进一步的实施方案中,少的一个键可以选自这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。例如,这种抗原分子选自由以下各项组成的组:属于细胞因子受体超家族的受体,G蛋白偶联受体,离子通道受体,酪氨酸激酶受体,免疫检查点受体,抗原受体,CD抗原,共刺激分子和细胞粘附分子。
在上述方面的实施方案中,在本公开的抗原结合分子中,两个抗原结合结构域存在于空间上接近的位置和/或两个抗原结合结构域的迁移率降低。在某些实施方案中,与对照抗原结合分子相比,本公开的抗原结合分子具有存在于较近位置的两个抗原结合结构域和/或所述两个抗原结合结构域的迁移率进一步降低;并且,对照抗原结合分子与本公开的抗原结合分子的不同之处仅在于它在两个抗原结合结构域之间少一个键。在进一步的实施方案中,少的一个键可以选自这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
在上述方面的实施方案中,本公开的抗原结合分子具有对蛋白酶切割的抗性。在某些实施方案中,与对照抗原结合分子相比,本公开内容的抗原结合分子具有增加的对蛋白酶切割的抗性,并且对照抗原结合分子与本公开的抗原结合分子的区别之处仅在于对照抗原结合分子在两个抗原结合结构域之间少一个键。在进一步的实施方案中,少的一个键可以选自这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。在某些实施方案中,在本公开的抗原结合分子中,与对照抗原结合分子相比,蛋白酶处理后剩余的全长分子(例如,全长IgG分子)的比例增加。在某些实施方案中,在本公开的抗原结合分子中,与对照抗原结合分子相比,蛋白酶处理后产生的特定片段(例如,Fab单体)的比例降低。
在上述方面的实施方案中,当本发明的抗原结合分子用蛋白酶处理时,抗原结合结构域或其片段的二聚体(例如,交联的Fab二聚体)被切除。在某些实施方案中,当对照抗原结合分子(其与本公开的抗原结合分子的不同之处仅在于它在两个抗原结合结构域之间少一个键)用蛋白酶处理时,抗原结合结构域或其片段的单体被切除。在进一步的实施方案中,少的一个键可以选自这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。在这些实施方案中,蛋白酶可以切割抗原结合分子的铰链区。
在进一步的实施方案中,对照抗原结合分子与本公开的抗原结合分子的不同之处仅在于它在两个抗原结合结构域之间少一个键,并且少的一个键是由突变的氨基酸残基形成的。突变的氨基酸残基是例如人工引入的半胱氨酸残基。
<药物组合物>
一方面,本公开提供了一种药物组合物,其包含本公开的抗原结合分子和药学上可接受的载体。
<抗原结合分子的用途>
一方面,本公开提供了用于将两个抗原分子保持在空间上接近的位置处的方法,包括:
(a)提供包含两个抗原结合结构域的抗原结合分子,
(b)向所述抗原结合分子添加至少一个将所述两个抗原结合结构域彼此连接的键,和
(c)使(b)中产生的所述抗原结合分子与所述两个抗原分子接触。在某些实施方案中,以上(a)中所述的抗原结合分子中的两个抗原结合结构域可以通过一个或多个键彼此连接,并且在这种情况下,一个或多个键中的一些或全部是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中存在的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的所述至少一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。本公开还提供了将两个抗原分子保持在空间上接近的位置处的方法,该方法包括使两个抗原分子与本公开的抗原结合分子或药物组合物接触。本公开进一步提供了本公开的抗原结合分子或药物组合物,其用于将两个抗原分子保持在空间上接近的位置处。
另一方面,本发明提供了用于调节两个抗原分子之间相互作用的方法,包括:
(a)提供包含两个抗原结合结构域的抗原结合分子,
(b)向所述抗原结合分子添加至少一个将所述两个抗原结合结构域彼此连接的键,和
(c)使(b)中产生的所述抗原结合分子与所述两个抗原分子接触。在某些实施方案中,以上(a)中所述的抗原结合分子中的两个抗原结合结构域可以通过一个或多个键彼此连接,并且在这种情况下,一个或多个键中的一些或全部是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中存在的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的所述至少一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。本公开还提供了用于调节两个抗原分子之间的相互作用的方法,该方法包括使两个抗原分子与本公开的抗原结合分子或药物组合物接触。本公开进一步提供了本公开的抗原结合分子或药物组合物,其用于调节两个抗原分子之间的相互作用。
此外,在另一方面,本公开提供了用于调节通过彼此缔合而被激活的两个抗原分子的活性的方法,所述方法包括:
(a)提供包含两个抗原结合结构域的抗原结合分子,
(b)向所述抗原结合分子添加至少一个将所述两个抗原结合结构域彼此连接的键,和
(c)使(b)中产生的所述抗原结合分子与所述两个抗原分子接触。在某些实施方案中,以上(a)中所述的抗原结合分子中的两个抗原结合结构域可以通过一个或多个键彼此连接,并且在这种情况下,一个或多个键中的一些或全部是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中存在的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的所述至少一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。本公开还提供了用于调节通过彼此缔合而被激活的两个抗原分子的活性的方法,该方法包括使两个抗原分子与本公开的抗原结合分子或药物组合物接触。本公开进一步提供了本公开的抗原结合分子或药物组合物,其用于调节通过彼此缔合而被激活的两个抗原分子的活性。
此外,在另一方面,本公开提供了用于将两个抗原结合结构域放置在空间上接近的位置处和/或降低所述两个抗原结合结构域的迁移率的方法,包括:
(a)提供包含两个抗原结合结构域的抗原结合分子,和
(b)向所述抗原结合分子添加至少一个将所述两个抗原结合结构域彼此连接的键。在某些实施方案中,以上(a)中所述的抗原结合分子中的两个抗原结合结构域可以通过一个或多个键彼此连接,并且在这种情况下,一个或多个键中的一些或全部是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中存在的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的所述至少一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
此外,在另一方面,本公开提供了用于增加抗原结合分子对蛋白酶切割的抗性的方法,包括:
(a)提供包含两个抗原结合结构域的抗原结合分子,和
(b)向所述抗原结合分子添加至少一个将所述两个抗原结合结构域彼此连接的键。在某些实施方案中,以上(a)中所述的抗原结合分子中的两个抗原结合结构域可以通过一个或多个键彼此连接,并且在这种情况下,一个或多个键中的一些或全部是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中存在的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的所述至少一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
在这些各种方法中使用的抗原结合分子可以具有本文所述的抗原结合分子的特征。
<制备抗原结合分子的方法>
一方面,本公开提供了用于制备抗原结合分子的方法,该抗原结合分子具有将两个抗原分子保持在空间上接近的位置处的活性,所述方法包括:
(a)提供编码包含第一抗原结合结构域的多肽的核酸和编码包含第二抗原结合结构域的多肽的核酸,
(b)将突变引入编码所述两个抗原结合结构域的核酸中,从而添加至少一个连接所述两个抗原结合结构域的键,
(c)将(b)中产生的核酸引入宿主细胞,
(d)培养所述宿主细胞以表达所述两种多肽,和
(e)获得抗原结合分子,所述抗原结合分子是包含第一和第二抗原结合结构域的多肽,其中所述两个抗原结合结构域通过一个或多个键彼此连接。在某些实施方案中,以上(a)中所述的两个抗原结合结构域各自可包含用于连接两个抗原结合结构域的键所起源的一个或多个氨基酸残基,并且在这种情况下,抗原结合结构域之间的键所起源的一个或多个氨基酸残基的一些或全部是存在于野生型Fab或铰链区中的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的所述至少一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
在另一方面,本公开提供了用于制备具有调节两个抗原分子之间相互作用的活性的抗原结合分子的方法,包括:
(a)提供编码包含第一抗原结合结构域的多肽的核酸和编码包含第二抗原结合结构域的多肽的核酸,
(b)将突变引入编码所述两个抗原结合结构域的核酸中,从而添加至少一个连接所述两个抗原结合结构域的键,
(c)将(b)中产生的核酸引入宿主细胞,
(d)培养所述宿主细胞以表达所述两种多肽,和
(e)获得抗原结合分子,所述抗原结合分子是包含第一和第二抗原结合结构域的多肽,其中所述两个抗原结合结构域通过一个或多个键彼此连接。在某些实施方案中,以上(a)中所述的两个抗原结合结构域各自可包含用于连接两个抗原结合结构域的键所起源的一个或多个氨基酸残基,并且在这种情况下,抗原结合结构域之间的键所起源的一个或多个氨基酸残基的一些或全部是存在于野生型Fab或铰链区中的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的所述至少一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
此外,在另一方面,本公开提供了用于制备抗原结合分子的方法,所述抗原结合分子具有调节通过彼此缔合而被激活的两个抗原分子的激活的活性,该方法包括:
(a)提供编码包含第一抗原结合结构域的多肽的核酸和编码包含第二抗原结合结构域的多肽的核酸,
(b)将突变引入编码所述两个抗原结合结构域的核酸中,从而添加至少一个连接所述两个抗原结合结构域的键,
(c)将(b)中产生的核酸引入宿主细胞,
(d)培养所述宿主细胞以表达所述两种多肽,和
(e)获得抗原结合分子,所述抗原结合分子是包含第一和第二抗原结合结构域的多肽,其中所述两个抗原结合结构域通过一个或多个键彼此连接。在某些实施方案中,以上(a)中所述的两个抗原结合结构域各自可包含用于连接两个抗原结合结构域的键所起源的一个或多个氨基酸残基,并且在这种情况下,抗原结合结构域之间的键所起源的一个或多个氨基酸残基的一些或全部是存在于野生型Fab或铰链区中的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的所述至少一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
此外,另一方面,本公开提供了用于制备抗原结合分子的方法,所述抗原结合分子中两个抗原结合结构域存在于空间上接近的位置处和/或两个抗原结合结构域的迁移率降低,所述方法包括:
(a)提供编码包含第一抗原结合结构域的多肽的核酸和编码包含第二抗原结合结构域的多肽的核酸,
(b)将突变引入编码所述两个抗原结合结构域的核酸中,从而添加至少一个连接所述两个抗原结合结构域的键,
(c)将(b)中产生的核酸引入宿主细胞,
(d)培养所述宿主细胞以表达所述两种多肽,和
(e)获得抗原结合分子,所述抗原结合分子是包含第一和第二抗原结合结构域的多肽,其中所述两个抗原结合结构域通过一个或多个键彼此连接。在某些实施方案中,以上(a)中所述的两个抗原结合结构域各自可包含用于连接两个抗原结合结构域的键所起源的一个或多个氨基酸残基,并且在这种情况下,抗原结合结构域之间的键所起源的一个或多个氨基酸残基的一些或全部是存在于野生型Fab或铰链区中的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的所述至少一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
此外,在另一方面,本公开提供了用于制备对蛋白酶切割具有增加的抗性的抗原结合分子的方法,其包括:
(a)提供编码包含第一抗原结合结构域的多肽的核酸和编码包含第二抗原结合结构域的多肽的核酸,
(b)将突变引入编码所述两个抗原结合结构域的核酸中,从而添加至少一个连接所述两个抗原结合结构域的键,
(c)将(b)中产生的核酸引入宿主细胞,
(d)培养所述宿主细胞以表达所述两种多肽,和
(e)获得抗原结合分子,所述抗原结合分子是包含第一和第二抗原结合结构域的多肽,其中所述两个抗原结合结构域通过一个或多个键彼此连接。在某些实施方案中,以上(a)中所述的两个抗原结合结构域各自可包含用于连接两个抗原结合结构域的键所起源的一个或多个氨基酸残基,并且在这种情况下,抗原结合结构域之间的键所起源的一个或多个氨基酸残基的一些或全部是存在于野生型Fab或铰链区中的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的所述至少一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
在这些各个方面中制备的抗原结合分子可以具有本文所述的抗原结合分子的特征。
<筛选抗原结合分子的方法>
在另一方面,本公开提供了用于鉴定通过彼此缔合而被激活的新的蛋白质分子对的方法,该方法包括:
(a)提供两个任意的蛋白质分子,
(b)通过本发明的制备方法制备抗原结合分子,所述抗原结合分子包含分别与所述两个蛋白分子结合的两个抗原结合结构域,
(c)使(b)中制备的所述抗原结合分子与所述两个蛋白质分子接触,和
(d)评估所述两个蛋白质分子是否被激活。
在某些实施方案中,两个蛋白质分子中的至少一个选自由以下各项组成的组:属于细胞因子受体超家族的受体,G蛋白偶联受体,离子通道受体,酪氨酸激酶受体,免疫检查点受体,抗原受体,CD抗原,共刺激分子和细胞粘附分子。
A.示例性抗原结合分子
<抗原结合分子的结构>
一方面,本公开提供了包含第一抗原结合结构域和第二抗原结合结构域的抗原结合分子,并且所述抗原结合结构域通过两个或多个键彼此连接。在实施方案中,第一和第二抗原结合结构域中的至少一个自身具有与抗原结合的活性(即,单个抗原结合结构域独立地具有抗原结合活性)。在某些实施方案中,第一和第二抗原结合结构域中的每一个本身具有结合抗原的活性。
在上述方面的一个实施方案中,第一和第二抗原结合结构域中的至少一个包含与特定抗原结合的抗体片段。在某些实施方案中,第一和/或第二抗原结合结构域包含铰链区。抗原结合结构域之间的键所起源的氨基酸残基分别存在于第一和第二抗原结合结构域中,并且抗原结合结构域之间的键是通过连接这些氨基酸残基形成的。在某些实施方案中,抗原结合结构域之间的键所起源的至少一个氨基酸残基存在于抗体片段内。在某些实施方案中,抗原结合结构域之间的键所起源的至少一个氨基酸残基存在于铰链区内。在某些实施方案中,抗原结合结构域之间的键所起源的至少一个氨基酸残基存在于抗体片段内,并且至少一个氨基酸残基存在于铰链区内。
在上述方面的一个实施方案中,在第一和第二抗原结合结构域的至少一个中,抗原结合结构域之间的键所起源的多个氨基酸残基存在于一级结构中彼此间隔七个或更多个氨基酸的位置处。这意味着在上述多个氨基酸残基的任何两个氨基酸残基之间,存在六个或多个不是所述氨基酸残基的氨基酸残基。在某些实施方案中,抗原结合结构域之间的键所起源的多个氨基酸残基的组合包括氨基酸残基对,其存在于一级结构中距离小于七个氨基酸的位置处。在某些实施方案中,如果第一和第二抗原结合结构域通过三个或更多个键彼此连接,则抗原结合结构域之间的键可源自三个或更多个氨基酸残基,所述氨基酸残基包括存在于一级结构中距离七个或更多个氨基酸的位置处的氨基酸残基对。
在某些实施方案中,存在于第一抗原结合结构域和第二抗原结合结构域中相同位置处的氨基酸残基彼此连接以形成键。在某些实施方案中,存在于第一抗原结合结构域和第二抗原结合结构域中不同位置处的氨基酸残基彼此连接以形成键。
抗原结合结构域中氨基酸残基的位置可以根据Kabat编号或EU编号系统(也称为EU索引)来显示,该编号系统描述于Kabat等,Sequences of Proteins of ImmunologicalInterest,5th Ed.Public Health Service,National Institutes of Health,Bethesda,MD,1991。例如,如果第一抗原结合结构域和第二抗原结合结构域之间的键所起源的氨基酸残基存在于抗原结合结构域中对应的相同位置,则根据Kabat编号或EU编号系统,这些氨基酸残基的位置可以表示为相同的编号。或者,如果第一抗原结合结构域和第二抗原结合结构域之间的键所起源的氨基酸残基存在于抗原结合结构域中不对应的不同位置,则根据Kabat编号或EU编号系统,这些氨基酸残基的位置可以表示为不同的数字。
在以上方面的一个实施方案中,连接抗原结合结构域的两个或多个键中的至少一个是共价键。在某些实施方案中,所述共价键是通过第一抗原结合结构域中的氨基酸残基与第二抗原结合结构域中的氨基酸残基的直接交联而形成的。交联的氨基酸残基为例如半胱氨酸,并且形成的共价键为例如二硫键。至少一个交联的半胱氨酸残基可以存在于铰链区内。
在某些其他实施方案中,所述共价键是通过第一抗原结合结构域中的氨基酸残基与第二抗原结合结构域中的氨基酸残基经由交联剂交联而形成的。交联剂是例如胺反应性交联剂,并且交联的氨基酸残基是例如赖氨酸。
在以上方面的实施方案中,连接抗原结合结构域的两个或多个键中的至少一个是非共价键。在某些实施方案中,非共价键是离子键,氢键或疏水键。
在上述方面的实施方案中,抗体片段是Fab,Fab’,scFab,Fv,scFv或单结构域抗体。
在上述方面的实施方案中,抗原结合结构域之间的键所起源的氨基酸残基中的至少一个存在于恒定区内。在某些实施方案中,氨基酸残基存在于CH1区内,并且例如,其存在于CH1区内选自由以下各项组成的组的位置:根据EU编号位置119,122,123,131,132,133,134,135,136,137,139,140,148,150,155,156,157,159,160,161,162,163,165,167,174,176,177,178,190,191,192,194,195,197,213和214。在示例性的实施方案中,氨基酸残基存在于CH1区中根据EU编号的位置191处,并且在两个抗原结合结构域的CH1区中根据EU编号的位置191处的氨基酸残基彼此连接以形成键。
在某些实施方案中,抗原结合结构域之间的键所起源的氨基酸残基中的至少一个存在于铰链区内,并且例如存在于铰链区内选自由以下各项组成的组的位置:根据EU编号位置216、218和219。
在某些实施方案中,抗原结合结构域之间的键所起源的氨基酸残基中的至少一个存在于CL区域内,并且例如,存在于CL区域内选自由以下各项组成的组的位置:根据EU编号位置109,112,121,126,128,151,152,153,156,184,186,188,190,200,201,202,203,208,210,211,212和213。在示例性的实施方案中,氨基酸残基存在于CL区中根据EU编号的位置126处,并且在两个抗原结合结构域的CL区中根据EU编号的位置126处的氨基酸残基彼此连接以形成键。
在某些实施方案中,第一抗原结合结构域的CH1区域中的氨基酸残基与第二抗原结合结构域的CL区域中的氨基酸残基连接以形成键。在示例性的实施方案中,在第一抗原结合结构域的CH1区域中根据EU编号的位置191处的氨基酸残基和在第二抗原结合结构域的CL区域中根据EU编号的位置126处的氨基酸残基连接以形成键。
在上述方面的实施方案中,恒定区衍生自人。在某些实施方案中,重链恒定区的亚类是IgG1,IgG2,IgG3,IgG4,IgA1,IgA2,IgM,IgD和IgE中的任何一个。在某些实施方案中,CH1区的亚类是γ1,γ2,γ3,γ4,α1,α2,μ,δ和ε中的任何一个。在某些实施方案中,CL区的亚类是κ或λ。
在上述方面的实施方案中,抗原结合结构域之间的键所起源的氨基酸残基中的至少一个存在于可变区内。在某些实施方案中,氨基酸残基存在于VH区内,并且例如,其存在于VH区内选自由以下各项组成的组的位置:根据Kabat编号位置8、16、28、74和82b。在某些实施方案中,氨基酸残基存在于VL区内,并且例如,其存在于VL区内选自由以下各项组成的组的位置:根据Kabat编号位置100、105和107。
在上述方面的一个实施方案中,第一和第二抗原结合结构域二者均包含Fab和铰链区。
在某些实施方案中,抗原结合结构域之间的键所起源的氨基酸残基中的至少一个是存在于野生型Fab或铰链区中的氨基酸残基,并且例如,是铰链区中的半胱氨酸残基。此类半胱氨酸残基的实例包括根据EU编号在位置226和229处的半胱氨酸残基。
在某些其他实施方案中,抗原结合结构域之间的键所起源的氨基酸残基中的至少一个是在野生型Fab或铰链区中不存在的突变氨基酸残基,并且例如,它是在野生型Fab或铰链区中不存在的半胱氨酸残基。可以通过例如氨基酸置换的方法将这种突变氨基酸残基引入野生型Fab或铰链区。本说明书公开了对于CH1,铰链,CL,VH和VL区域中的每一个,抗原结合结构域之间的键所起源的氨基酸残基的位点,例如,可以将半胱氨酸残基引入这样的位点中。
备选地,在另一个实施方案中,存在于野生型Fab或铰链区中并且参与抗原结合结构域之间的键的氨基酸残基(例如,半胱氨酸残基)可以被另一个氨基酸置换或缺失。这种半胱氨酸残基的实例包括在铰链区中根据EU编号在位置220、226和229处的半胱氨酸残基以及在CL区中位置214处的半胱氨酸残基。
在某些实施方案中,本公开的抗原结合分子是F(ab’)2,其中第一和第二抗原结合结构域二者均包含Fab和铰链区。
在上述方面的实施方案中,第一和第二抗原结合结构域中的至少一个包含与特定抗原结合的非抗体蛋白,或其片段。在某些实施方案中,所述非抗体蛋白是一对彼此特异性结合的配体和受体中的任一个。这样的受体包括例如属于细胞因子受体超家族的受体,G蛋白偶联受体,离子通道受体,酪氨酸激酶受体,免疫检查点受体,抗原受体,CD抗原,共刺激分子和细胞粘附分子。
在上述方面的实施方案中,本公开的抗原结合分子还包含Fc区,并且例如,它是全长抗体。在某些实施方案中,将促进Fc区多聚化的一个或多个氨基酸突变引入本公开的抗原结合分子的Fc区中。这样的氨基酸突变包括,例如在选自由以下各项组成的组的至少一个位置处的氨基酸突变:根据EU编号,位置247,248,253,254,310,311,338,345,356,359,382,385,386,430,433,434,436,437,438,439,440和447(参见例如WO2016/164480)。在某些实施方案中,多聚化是六聚化。
<抗原结合分子结合的抗原>
在上述方面的实施方案中,第一和第二抗原结合结构域二者都结合相同的抗原。在某些实施方案中,第一和第二抗原结合结构域二者都结合相同抗原上的相同表位。在某些其他实施方案中,第一和第二抗原结合结构域中的每一个结合相同抗原上的不同表位。在某些实施方案中,本公开的抗原结合分子是靶向一种特异性抗原的双互补位抗原结合分子(例如,双互补位抗体)。
在上述方面的实施方案中,第一和第二抗原结合结构域各自结合不同的抗原。
在上述方面的另一个实施方案中,本公开的抗原结合分子是钳制抗原结合分子(例如,钳制抗体)。在本文中,钳制抗原结合分子是指与抗原/抗原结合分子复合物特异性结合的抗原结合分子,其中,所述复合物是由某抗原A和与抗原A结合的抗原结合分子形成的,并且从而增加与抗原A结合的抗原结合分子结合抗原A的活性(或者,稳定由抗原A和与抗原A结合的抗原结合分子形成的抗原/抗原结合分子复合物)。例如,CD3钳制抗体能够结合抗原-抗体复合物,所述复合物是由CD3和与CD3的结合能力减弱的抗体(结合减弱的CD3抗体)形成的,并且从而增加结合减弱的CD3抗体的CD3结合活性(或稳定由CD3和结合减弱的CD3抗体形成的抗原-抗体复合物)。在某些实施方案中,本公开的抗原结合分子中的第一和/或第二抗原结合结构域可以是衍生自钳制抗原结合分子的抗原结合结构域(钳制抗原结合结构域)。
在上述方面的实施方案中,第一和第二抗原结合结构域二者均具有相同的氨基酸序列。在另一个实施方案中,第一和第二抗原结合结构域各自具有不同的氨基酸序列。
在上述方面的实施方案中,第一和第二抗原结合结构域所结合的两个抗原中的至少一个是可溶性蛋白或膜蛋白。
<抗原结合分子的功能>
在上述方面的实施方案中,本公开的抗原结合分子具有将两个抗原分子保持在空间上接近的位置处的活性。在某些实施方案中,本公开的抗原结合分子能够将两个抗原分子保持在比对照抗原结合分子更近的位置,并且对照抗原结合分子与本公开的抗原结合分子的区别之处仅在于对照抗原结合分子在两个抗原结合结构域之间少一个键。在进一步的实施方案中,少的一个键可以选自这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
在上述方面的实施方案中,本公开的抗原结合分子具有调节两个抗原分子之间的相互作用的活性。不受特定理论的束缚,认为调节相互作用的活性是由于通过本公开的抗原结合分子将两个抗原分子保持在空间上更近的位置而引起的。在某些实施方案中,与对照抗原结合分子相比,本公开的抗原结合分子能够增强或减少两个抗原分子之间的相互作用,并且对照抗原结合分子与本公开的抗原结合分子的区别之处仅在于对照抗原结合分子在两个抗原结合结构域之间少一个键。在进一步的实施方案中,少的一个键可以选自这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
在某些实施方案中,被本公开的抗原结合分子结合的两个抗原分子分别是配体和受体,并且本公开的抗原结合分子具有促进配体激活受体的活性。在某些其他实施方案中,被本公开内容的抗原结合分子结合的两个抗原分子分别是酶和其底物,并且本公开内容的抗原结合分子具有促进酶与底物的催化反应的活性。
此外,在某些其他实施方案中,被本公开的抗原结合分子结合的两个抗原分子都是存在于细胞表面上的抗原(例如蛋白质),并且本公开的抗原结合分子具有促进表达第一抗原的细胞与表达第二抗原的细胞之间的相互作用的活性。例如,表达第一抗原的细胞和表达第二抗原的细胞分别是具有细胞毒性活性的细胞和其靶细胞,并且本公开的抗原结合分子促进具有细胞毒性活性的细胞对靶细胞的损伤。具有细胞毒性活性的细胞是例如T细胞,NK细胞,单核细胞或巨噬细胞。
在上述方面的实施方案中,本公开的抗原结合分子具有调节通过彼此缔合而被激活的两个抗原分子的激活的活性。不受特定理论的束缚,认为调节激活的活性是由于通过本公开的抗原结合分子将两个抗原分子保持在空间上更近的位置而引起的。在某些实施方案中,与对照抗原结合分子相比,本公开的抗原结合分子能够增强或减少两个抗原分子之间的激活,并且对照抗原结合分子与本公开的抗原结合分子的区别之处仅在于对照抗原结合分子在两个抗原结合结构域之间少一个键。在进一步的实施方案中,少的一个键可以选自这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。例如,这种抗原分子选自由以下各项组成的组:属于细胞因子受体超家族的受体,G蛋白偶联受体,离子通道受体,酪氨酸激酶受体,免疫检查点受体,抗原受体,CD抗原,共刺激分子和细胞粘附分子。
在上述方面的实施方案中,本公开的抗原结合分子具有对蛋白酶切割的抗性。在某些实施方案中,与对照抗原结合分子相比,本公开内容的抗原结合分子具有增加的对蛋白酶切割的抗性,并且对照抗原结合分子与本公开的抗原结合分子的区别之处仅在于对照抗原结合分子在两个抗原结合结构域之间少一个键。在进一步的实施方案中,少的一个键可以选自这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。在某些实施方案中,在本公开的抗原结合分子中,与对照抗原结合分子相比,蛋白酶处理后剩余的全长分子(例如,全长IgG分子)的比例增加。在某些实施方案中,在本公开的抗原结合分子中,与对照抗原结合分子相比,蛋白酶处理后产生的特定片段(例如,Fab单体)的比例降低。
在上述方面的实施方案中,当本发明的抗原结合分子用蛋白酶处理时,抗原结合结构域或其片段的二聚体(例如,交联的Fab二聚体)被切除。在某些实施方案中,当对照抗原结合分子(其与本公开的抗原结合分子的不同之处仅在于它在两个抗原结合结构域之间少一个键)用蛋白酶处理时,抗原结合结构域或其片段的单体被切除。在进一步的实施方案中,少的一个键可以选自这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。在这些实施方案中,蛋白酶可以切割抗原结合分子的铰链区。
<药物组合物>
一方面,本公开提供了一种药物组合物,其包含本公开的抗原结合分子和药学上可接受的载体。
<抗原结合分子的用途>
一方面,本公开提供了用于将两个抗原分子保持在空间上接近的位置处的方法,包括:
(a)提供包含两个抗原结合结构域的抗原结合分子,其中所述两个抗原结合结构域通过一个或多个键彼此连接。
(b)向所述抗原结合分子添加另一个将所述两个抗原结合结构域彼此连接的键,和
(c)使(b)中产生的抗原结合分子与所述两个抗原结合分子接触。
在某些实施方案中,以上(a)中所述的一个或多个键中的一些或全部是这样的键,其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中存在的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的另一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。本公开还提供了将两个抗原分子保持在空间上接近的位置处的方法,该方法包括使两个抗原分子与本公开的抗原结合分子或药物组合物接触。本公开进一步提供了本公开的抗原结合分子或药物组合物,其用于将两个抗原分子保持在空间上接近的位置处。
另一方面,本发明提供了用于调节两个抗原分子之间相互作用的方法,包括:
(a)提供包含两个抗原结合结构域的抗原结合分子,其中所述两个抗原结合结构域通过一个或多个键彼此连接。
(b)向所述抗原结合分子添加另一个将所述两个抗原结合结构域彼此连接的键,和
(c)使(b)中产生的抗原结合分子与所述两个抗原结合分子接触。
在某些实施方案中,以上(a)中所述的一个或多个键中的一些或全部是这样的键,其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中存在的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的另一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。本公开还提供了用于调节两个抗原分子之间的相互作用的方法,该方法包括使两个抗原分子与本公开的抗原结合分子或药物组合物接触。本公开进一步提供了本公开的抗原结合分子或药物组合物,其用于调节两个抗原分子之间的相互作用。
此外,在另一方面,本公开提供了用于调节通过彼此缔合而被激活的两个抗原分子的活性的方法,所述方法包括:
(a)提供包含两个抗原结合结构域的抗原结合分子,其中所述两个抗原结合结构域通过一个或多个键彼此连接。
(b)向所述抗原结合分子添加另一个将所述两个抗原结合结构域彼此连接的键,和
(c)使(b)中产生的抗原结合分子与所述两个抗原结合分子接触。
在某些实施方案中,以上(a)中所述的一个或多个键中的一些或全部是这样的键,其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中存在的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的另一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。本公开还提供了用于调节通过彼此缔合而被激活的两个抗原分子的活性的方法,该方法包括使两个抗原分子与本公开的抗原结合分子或药物组合物接触。本公开进一步提供了本公开的抗原结合分子或药物组合物,其用于调节通过彼此缔合而被激活的两个抗原分子的活性。
此外,在另一方面,本公开提供了用于增加抗原结合分子对蛋白酶切割的抗性的方法,包括:
(a)提供包含两个抗原结合结构域的抗原结合分子,其中所述两个抗原结合结构域通过一个或多个键彼此连接;和
(b)向所述抗原结合分子添加另一个将所述两个抗原结合结构域彼此连接的键。
在某些实施方案中,以上(a)中所述的一个或多个键中的一些或全部是这样的键,其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中存在的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的另一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
在这些各种方法中使用的抗原结合分子可以具有本文所述的抗原结合分子的特征。
<制备抗原结合分子的方法>
一方面,本公开提供了用于制备抗原结合分子的方法,该抗原结合分子具有将两个抗原分子保持在空间上接近的位置处的活性,所述方法包括:
(a)提供编码包含第一抗原结合结构域的多肽的核酸和编码包含第二抗原结合结构域的多肽的核酸,其中两个抗原结合结构域各自包含用于连接两个抗原结合结构域的键所起源的一个或多个氨基酸残基,
(b)将突变引入编码所述两个抗原结合结构域的核酸中,从而添加连接所述两个抗原结合结构域的另一个键,
(c)将(b)中产生的核酸引入宿主细胞,
(d)培养所述宿主细胞以表达所述两种多肽,和
(e)获得抗原结合分子,所述抗原结合分子是包含第一和第二抗原结合结构域的多肽,其中所述两个抗原结合结构域通过两个或多个键彼此连接。
在某些实施方案中,以上(a)中所述的抗原结合结构域之间的键所起源的一个或多个氨基酸残基中的一些或全部是存在于野生型Fab或铰链区中的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的另一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
在另一方面,本公开提供了用于制备具有调节两个抗原分子之间相互作用的活性的抗原结合分子的方法,包括:
(a)提供编码包含第一抗原结合结构域的多肽的核酸和编码包含第二抗原结合结构域的多肽的核酸,其中两个抗原结合结构域各自包含用于连接两个抗原结合结构域的键所起源的一个或多个氨基酸残基,
(b)将突变引入编码所述两个抗原结合结构域的核酸中,从而添加连接所述两个抗原结合结构域的另一个键,
(c)将(b)中产生的核酸引入宿主细胞,
(d)培养所述宿主细胞以表达所述两种多肽,和
(e)获得抗原结合分子,所述抗原结合分子是包含第一和第二抗原结合结构域的多肽,其中所述两个抗原结合结构域通过两个或多个键彼此连接。
在某些实施方案中,以上(a)中所述的抗原结合结构域之间的键所起源的一个或多个氨基酸残基中的一些或全部是存在于野生型Fab或铰链区中的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的另一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
此外,在另一方面,本公开提供了用于制备抗原结合分子的方法,所述抗原结合分子具有调节通过彼此缔合而被激活的两个抗原分子的激活的活性,该方法包括:
(a)提供编码包含第一抗原结合结构域的多肽的核酸和编码包含第二抗原结合结构域的多肽的核酸,其中两个抗原结合结构域各自包含用于连接两个抗原结合结构域的键所起源的一个或多个氨基酸残基,
(b)将突变引入编码所述两个抗原结合结构域的核酸中,从而添加连接所述两个抗原结合结构域的另一个键,
(c)将(b)中产生的核酸引入宿主细胞,
(d)培养所述宿主细胞以表达所述两种多肽,和
(e)获得抗原结合分子,所述抗原结合分子是包含第一和第二抗原结合结构域的多肽,其中所述两个抗原结合结构域通过两个或多个键彼此连接。
在某些实施方案中,以上(a)中所述的抗原结合结构域之间的键所起源的一个或多个氨基酸残基中的一些或全部是存在于野生型Fab或铰链区中的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的另一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
此外,在另一方面,本公开提供了用于制备对蛋白酶切割具有增加的抗性的抗原结合分子的方法,其包括:
(a)提供编码包含第一抗原结合结构域的多肽的核酸和编码包含第二抗原结合结构域的多肽的核酸,其中两个抗原结合结构域各自包含用于连接两个抗原结合结构域的键所起源的一个或多个氨基酸残基,
(b)将突变引入编码所述两个抗原结合结构域的核酸中,从而添加连接所述两个抗原结合结构域的另一个键,
(c)将(b)中产生的核酸引入宿主细胞,
(d)培养所述宿主细胞以表达所述两种多肽,和
(e)获得抗原结合分子,所述抗原结合分子是包含第一和第二抗原结合结构域的多肽,其中所述两个抗原结合结构域通过两个或多个键彼此连接。
在某些实施方案中,以上(a)中所述的抗原结合结构域之间的键所起源的一个或多个氨基酸残基中的一些或全部是存在于野生型Fab或铰链区中的氨基酸残基(例如,铰链区中的半胱氨酸残基)。在进一步的实施方案中,以上(b)中所述的另一个键是这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。
在这些各个方面中制备的抗原结合分子可以具有本文所述的抗原结合分子的特征。
<筛选抗原结合分子的方法>
在另一方面,本公开提供了用于鉴定通过彼此缔合而被激活的新的蛋白质分子对的方法,该方法包括:
(a)提供两个任意的蛋白质分子,
(b)通过本公开的制备方法,制备包含两个分别与两个蛋白分子结合的抗原结合结构域的抗原结合分子,其中所述抗原结合分子具有将两个蛋白质分子保持在接近位置处的活性,
(c)使(b)中制备的所述抗原结合分子与所述两个蛋白质分子接触,和
(d)评估所述两个蛋白质分子是否被激活。
在某些实施方案中,蛋白质分子中的至少一个选自由以下各项组成的组:属于细胞因子受体超家族的受体,G蛋白偶联受体,离子通道受体,酪氨酸激酶受体,免疫检查点受体,抗原受体,CD抗原,共刺激分子和细胞粘附分子。
<抗原结合结构域的连接>
在非限制性实施方案中,本公开内容的抗原结合分子中包含的两个或更多个抗原结合结构域是通过一个或多个键彼此连接的。在优选的实施方案中,本公开内容的抗原结合分子中包含的抗原结合结构域本身具有结合抗原的活性。在这样的实施方案中,本公开的包含两个抗原结合结构域的抗原结合分子能够结合两个或更多个抗原分子;本公开的包含三个抗原结合结构域的抗原结合分子能够结合三个或更多个抗原分子;本公开的包含四个抗原结合结构域的抗原结合分子能够结合四个或更多个抗原分子;并且本公开的包含N个抗原结合结构域的抗原结合分子能够结合N个或更多个抗原分子。
在某些实施方案中,本公开的抗原结合分子中包含的抗原结合结构域之间的至少一个键不同于在天然存在的抗体中发现的键(例如,在野生型Fab或铰链区)。在天然存在的抗体(例如天然存在的IgG抗体)的抗原结合结构域之间发现的键的实例包括铰链区中的二硫键。位于铰链区以外区域的氨基酸残基之间的键可以是抗体片段(例如Fab)内氨基酸残基之间的键,并且它们包括重链之间的键(HH),轻链之间的键(LL),以及重链和轻链之间的键(HL或LH)(见图1)。抗原结合结构域之间的键所起源的重链或轻链中的氨基酸残基的实例包括在可变区(VH区或VL区)或恒定区(CH1区,铰链区或CL区)内的上述位置处的氨基酸残基。
在非限制性实施方案中,抗原结合结构域之间的键可源自多个氨基酸残基,所述氨基酸残基存在于本公开的抗原结合分子中所包含的两个或多个抗原结合结构域中至少一个的一级结构中彼此分开的位置处。多个氨基酸残基之间的距离是这样的距离,其由于抗原结合结构域之间通过源自氨基酸残基的键的连接而得以实现两个或更多个足够接近的抗原结合结构域的结构。多个氨基酸残基之间的距离可以是例如4个或更多个氨基酸,5个或更多个氨基酸,6个或更多个氨基酸,7个或更多个氨基酸,8个或更多个氨基酸,9个或更多个氨基酸,10个或更多个氨基酸,11个或更多个氨基酸,12个或更多个氨基酸,13个或更多个氨基酸,14个或更多个氨基酸,15个或更多个氨基酸,20个或更多个氨基酸,25个或更多个氨基酸,30个或更多个氨基酸,35个或更多个氨基酸,40个或更多个氨基酸,45个或更多个氨基酸,50个或更多个氨基酸,60个或更多个氨基酸,70个或更多个氨基酸,80个或更多个氨基酸,90个或更多个氨基酸,100个或更多个氨基酸,110个或更多个氨基酸,120个或更多个氨基酸,130个或更多个氨基酸,140个或更多个氨基酸,150个或更多个氨基酸,160个或更多个氨基酸,170个或更多个氨基酸,180个或更多个氨基酸,190个或更多个氨基酸,200个或更多个氨基酸,210个或更多个氨基酸,或220个或更多个氨基酸。
此外,抗原结合结构域之间的键的数目和该键所起源的氨基酸残基的数目是这样的数目,其允许由于抗原结合结构域之间通过键的连接而得以实现两个或更多个足够接近的抗原结合结构域的结构。该数目可以是例如两个或更多个,三个或更多个,四个或更多个,五个或更多个,六个或更多个,七个或更多个,八个或更多个,九个或更多个,或十个或更多个。
在某些实施方案中,只要两个或更多个足够接近的抗原结合结构域的结构是由于抗原结合结构域之间通过三个或更多个分别源自抗原结合结构域中三个或更多个氨基酸残基的键的连接而实现的,选自三个氨基酸残基的任何两个氨基酸残基之间的一级结构的距离在至少一个氨基酸残基对中可以是七个氨基酸或更多,并且在剩余的氨基酸残基对中可以是少于七个氨基酸。
关于本公开的抗原结合分子中包含的抗原结合结构域,“足够接近”是指两个或更多个抗原结合结构域接近于足以实现本公开的抗原结合分子的期望功能(活性)的程度。期望功能(活性)的实例包括将两个抗原分子保持在空间上接近的位置处的活性;调节两个抗原分子之间相互作用的活性;促进配体激活受体的活性;促进酶与底物催化反应的活性;促进表达第一抗原的细胞与表达第二抗原的细胞之间相互作用的活性;促进具有细胞毒性活性的细胞(例如T细胞,NK细胞,单核细胞,巨噬细胞)损伤靶细胞的活性;调节通过彼此缔合而被激活的两个抗原分子的激活的活性;和对抗原结合分子的蛋白酶切割的抗性。
在非限制性实施方案中,本公开的抗原结合分子中包含的抗原结合结构域之间的键可以是共价键或非共价键。共价键可以是通过使第一抗原结合结构域中的氨基酸残基与第二抗原结合结构域中的氨基酸残基直接交联而形成的共价键,例如半胱氨酸残基之间的二硫键。直接交联的氨基酸残基可以存在于抗体片段如Fab中,或存在于铰链区中。
在另一个实施方案中,所述共价键是通过第一抗原结合结构域中的氨基酸残基与第二抗原结合结构域中的氨基酸残基经由交联剂交联而形成的。例如,当使用胺反应性交联剂进行交联时,可以通过抗原结合结构域的N末端氨基酸的游离氨基或抗原结合结构域中的赖氨酸残基侧链的伯胺进行交联。胺反应性交联剂包括与伯胺形成化学键的官能团,例如异硫氰酸酯,异氰酸酯,酰基叠氮化物,NHS酯,磺酰氯,醛,乙二醛,环氧化物,环氧乙烷,碳酸酯,芳基卤化物,酰亚胺酯,碳二亚胺,酸酐和氟代酯。代表性的例子包括DSG(戊二酸二琥珀酰亚胺酯),DSS(辛二酸二琥珀酰亚胺酯),BS3(二(磺基琥珀酰亚胺基)辛二酸酯),DSP(二硫代双(琥珀酰亚胺基丙酸酯)),DTSSP(3,3’-二硫代双(磺基琥珀酰亚胺基丙酸酯)),DST(酒石酸二琥珀酰亚胺酯),BSOCOES(双(2-(琥珀酰亚胺基氧基羰基氧基)乙基)砜,EGS(乙二醇双(琥珀酰亚胺基琥珀酸酯)),Sulfo-EGS(乙二醇双(磺基琥珀酰亚胺基琥珀酸酯)),DMA(己二亚胺酸二甲酯),DMP(庚二亚胺酸二甲酯),DMS(辛二亚胺酸二甲酯)和DFDNB(1,5-二氟-2,4-二硝基苯)。其他交联剂的实例包括羧基/胺反应性,巯基反应性,醛反应性和光反应性交联剂。
用于连接抗原结合结构域的非共价键可以是离子键,氢键或疏水键。
抗原结合结构域之间的键数目是否大于对照抗原结合分子(例如,具有与天然存在的抗体结构基本相似的结构的抗原结合分子)的键数目,可以通过例如以下方法进行评估。首先,将目标抗原结合分子和对照抗原结合分子用切掉抗原结合结构域的蛋白酶(例如,切割铰链区交联位点N末端的蛋白酶,如木瓜蛋白酶和Lys-C)处理,然后进行非还原电泳。接下来,识别部分抗原结合结构域的抗体(例如,抗κ链HRP标记的抗体)用于检测蛋白酶处理后存在的片段。当对于对照抗原结合分子仅检测到抗原结合结构域的单体(例如,Fab单体),并且对于目标抗原结合分子检测到抗原结合结构域的多聚体(例如,Fab二聚体)时,则可以评估目标抗原结合分子的抗原结合结构域之间的键数目大于对照抗原结合分子的键数目。
通过将半胱氨酸引入到对照抗原结合分子中而产生的修饰的抗原结合分子中的半胱氨酸之间的二硫键的形成可以通过例如以下方法来评估。首先,将目标抗原结合分子与胰凝乳蛋白酶在20mM磷酸盐缓冲液(pH7.0)中温育,然后通过LC/MS检测预期从每种抗体的氨基酸序列生成的肽的质量。如果检测到与当新引入的半胱氨酸形成二硫键时应产生的肽的理论质量相对应的成分,则可以将引入的半胱氨酸评估为已形成二硫键。此外,如果在向样品中添加用于还原二硫键的试剂(例如,三(2-羧乙基)膦)后分析包含上述抗原结合分子的样品时该成分变得不可检测,则上述评估的正确性将进一步得到强有力的验证。
<对蛋白酶切割的抗性>
在非限制性实施方案中,本公开的抗原结合分子具有对蛋白酶切割的抗性。在某些实施方案中,与对照抗原结合分子(例如,具有与天然存在的抗体结构基本相似的结构的抗原结合分子)相比,本公开的抗原结合分子对蛋白酶切割的抗性增加,其中与抗原结合分子相比,对照抗原结合分子的抗原结合结构域之间的键数目少一个或多个。在进一步的实施方案中,少的一个键可以选自这样的键:其中抗原结合结构域之间的键所起源的氨基酸残基源自野生型Fab或铰链区中不存在的突变氨基酸残基(例如,野生型Fab或铰链区中不存在的半胱氨酸残基)。相比于对照抗原结合分子,如果对于抗原结合分子,蛋白酶处理后剩余的全长分子(例如,全长IgG分子)的比例增加,或者蛋白酶处理后产生的特定片段(例如Fab单体)的比例减少,则可以评估对蛋白酶切割的抗性增加(蛋白酶抗性改善)。
在某些实施方案中,相对于所有抗原结合分子,蛋白酶处理后剩余的全长分子的比例可以是例如0.5%或更多,1%或更多,1.5%或更多,2%或更多,2.5%或更多,3%或更多,3.5%或更多,4%或更多,4.5%或更多,5%或更多,7.5%或更多,10%或更多,12.5%或更多,15%或更多,20%或更多,25%或更多,30%或更多,35%或更多,40%或更多,45%或更多,或50%或更多。在某些其他实施方案中,相对于所有的抗原结合分子,蛋白酶处理后产生的抗原结合结构域(例如,Fab)的单体的比例可以是例如99%或更少,98%或更少,97%或更少,96%或更少,95%或更少,94%或更少,93%或更少,92%或更少,91%或更少,90%或更少,85%或更少,80%或更少,75%或更少,70%或更少,60%或更少,50%或更少,40%或更少,30%或更少,20%或更少,或10%或更少。在某些其他实施方案中,相对于所有抗原结合分子,蛋白酶处理后产生的抗原结合结构域(例如,Fab)的二聚体的比例可以是例如0.5%或更多,1%或更多,1.5%或更多,2%或更多,2.5%或更多,3%或更多,3.5%或更多,4%或更多,4.5%或更多,5%或更多,7.5%或更多,10%或更多,12.5%或更多,15%或更多,20%或更多,25%或更多,30%或更多,35%或更多,40%或更多,45%或更多,或50%或更多。
蛋白酶的实例包括但不限于Lys-C,纤溶酶,人中性粒细胞弹性蛋白酶(HNE)和木瓜蛋白酶。
在进一步的方面,根据任何上述实施方案的抗原结合分子可单独或组合地掺入以下1-7节中所述的任何特征:
1.抗原结合分子亲和力
在某些实施方案中,本文提供的抗原结合分子的解离常数(KD)为1μM或更小,100nM或更小,10nM或更小,1nM或更小,0.1nM或更小,0.01nM或更小,或0.001nM或更小(例如10
2.抗体片段
在某些实施方案中,本文提供的抗原结合分子是抗体片段。抗体片段包括但不限于Fab,Fab′,Fab′-SH,F(ab′)
双抗体是具有两个抗原结合位点的抗体片段,其可以是二价或双特异性的。参见,例如,EP 404,097;WO 1993/01161;Hudson等人,Nat.Med.9:129-134(2003);和Hollinger等人.,Proc.Natl.Acad.Sci.USA 90:6444-6448(1993)。三抗体和四抗体也描述于Hudson等人,Nat.Med.9:129-134(2003)中。
3.嵌合和人源化抗体
在某些实施方案中,本文提供的抗原结合分子是嵌合抗体。某些嵌合抗体在例如美国专利号4,816,567;及Morrison等人,Proc.Natl.Acad.Sci.USA,81:6851-6855(1984)中描述。在一个实例中,嵌合抗体包含非人可变区(例如源自小鼠、大鼠、仓鼠、兔或例如猴的非人灵长类动物的可变区)和人恒定区。在另一实例中,嵌合抗体是其中类别或亚类已经从亲本抗体的类别或亚类改变的“类别转变”抗体。嵌合抗体包括其抗原结合片段。
在某些实施方案中,嵌合抗体是人源化抗体。通常,非人抗体被人源化,以降低对人类的免疫原性,同时保持亲本非人抗体的特异性和亲和力。一般而言,人源化抗体包含一个或多个可变结构域,其中HVR,例如CDR(或其部分)源自非人抗体,且FR(或其部分)源自人抗体序列。人源化抗体任选地也将包含人恒定区的至少一部分。在一些实施方案中,人源化抗体中的一些FR残基经来自非人抗体(例如HVR残基所源自的抗体)的相应残基置换,例如以恢复或提高抗体特异性或亲和力。
4.人抗体
在某些实施方案中,本文提供的抗原结合分子是人抗体。可使用本领域中已知的多种技术来制备人抗体。人抗体一般描述于van Dijk和van de Winkel,Curr.Opin.Pharmacol.5:368-74(2001)和Lonberg,Curr.Opin.Immunol.20:450-459(2008)中。
5.文库衍生的抗原结合分子
可通过筛选组合文库以获得具有一种或多种所需活性的抗原结合分子来分离本发明的抗原结合分子。例如,本领域已知多种方法用于产生噬菌体展示文库并筛选这些文库以获得具有所需结合特征的抗原结合分子。这些方法于例如Hoogenboom等人,Methodsin Molecular Biology 178:1-37(O’Brien等人编,Human Press,Totowa,NJ,2001)中评述,并且进一步于例如McCafferty等人,Nature 348:552-554;Clackson等人,Nature 352:624-628(1991);Marks等人,J.Mol.Biol.222:581-597(1992);Marks和Bradbury,inMethods in Molecular Biology 248:161-175(Lo编,Human Press,Totowa,NJ,2003);Sidhu等人,J.Mol.Biol.338(2):299-310(2004);Lee等人,J.Mol.Biol.340(5):1073-1093(2004);Fellouse,Proc.Natl.Acad.Sci.USA 101(34):12467-12472(2004);和Lee等人,J.Immunol.Methods 284(1-2):119-132(2004)中描述。
6.多特异性抗原结合分子
在某些实施方案中,本文提供的抗原结合分子是多特异性抗原结合分子,例如双特异性抗原结合分子。多特异性抗原结合分子是对至少两个不同位点具有结合特异性的单克隆抗原结合分子。在某些实施方案中,结合特异性之一是针对特定抗原(例如,CD3)的,而另一种是针对任何其他抗原(例如,CD28或癌症抗原)的。在某些实施方案中,双特异性抗原结合分子可以结合单个抗原上的两个不同表位。可以将双特异性抗原结合分子制备为全长抗体或抗体片段。
用于制备多特异性抗原结合分子的技术包括,但不限于,具有不同特异性的两个免疫球蛋白重链-轻链对的重组共表达(参见Milstein和Cuello,Nature 305:537(1983)),WO 93/08829,个Traunecker等人,EMBO J.10:3655(1991)),及“杵臼(knob-in-hole)”工程改造(参见,例如,美国专利号5,731,168)。也可通过以下方法制备多特异性抗原结合分子:用于制备抗体Fc-异二聚体分子的工程改造静电导引作用(WO 2009/089004A1);将两个或多个抗体或片段交联(参见例如美国专利号4,676,980,及Brennan等人,Science,229:81(1985));使用亮氨酸拉链来产生双特异性抗体(参见,例如Kostelny等人,J.Immunol.,148(5):1547-1553(1992));使用“双抗体”技术来制备双特异性抗体片段(参见,例如Hollinger等人,Proc.Natl.Acad.Sci.USA,90:6444-6448(1993));及使用单链Fv(sFv)二聚体(参见,例如Gruber等人,J.Immunol.,152:5368(1994));及如例如Tutt等人,J.Immunol.147:60(1991)中所述制备三特异性抗体。
本文中也包括具有三个或更多个功能性抗原结合位点的经工程改造抗体,包括“章鱼抗体(Octopus antibodies)”(参见例如US 2006/0025576A1)。
7.抗原结合分子变体
在某些实施方案中,考虑了本文提供的抗原结合分子的氨基酸序列变体。例如,可能需要改善抗原结合分子的结合亲和力和/或其他生物学特性。可通过在编码抗原结合分子的核苷酸序列中引入适当修饰或通过肽合成来制备抗原结合分子的氨基酸序列变体。这些修饰包括例如抗原结合分子氨基酸序列内的残基的缺失和/或向其中插入和/或对其置换。可以进行缺失、插入和置换的任何组合,以得到最终构建体,条件是最终构建体具有所需特征,例如抗原结合。
a)置换、插入和缺失变体
在某些实施方案中,提供了具有一个或多个氨基酸置换的抗原结合分子变体。用于置换性诱变的感兴趣的位点包括HVR和FR。保守性置换显示在下表的“优选置换”的标题下。更多实质性变化在下表中的“示例性置换”的标题下提供,且如下文关于氨基酸侧链类别进一步所描述的。可将氨基酸置换引入感兴趣的抗原结合分子中,并筛选产物以获得所需活性,例如保持/改善的抗原结合、降低的免疫原性、或改善的ADCC或CDC。
可根据常见侧链特性将氨基酸分组:
(1)疏水性:正亮氨酸,Met,Ala,Val,Leu,Ile;
(2)中性亲水性:Cys,Ser,Thr,Asn,Gln;
(3)酸性:Asp,Glu;
(4)碱性:His,Lys,Arg;
(5)影响链取向的残基:Gly,Pro;
(6)芳香族:Trp,Tyr,Phe。
非保守性置换将需要将这些类别之一的成员换成另一类别。
一种类型的置换变体涉及置换亲本抗原结合分子(例如人源化抗体或人抗体)的一个或多个高变区残基。一般而言,选择用于进一步研究的所得变体相对于亲本抗原结合分子在某些生物学特性方面将具有修饰(例如改善)(例如,增加的亲和力、降低的免疫原性),和/或将基本上保留亲本抗原结合分子的某些生物学特性。示例性置换变体是亲和力成熟的抗体,其可例如使用基于噬菌体展示的亲和力成熟技术(例如本文中所述的那些)方便地产生。简言之,一个或多个HVR残基被突变,且变体抗体展示在噬菌体上,并对其进行筛选以获得特定生物学活性(例如结合亲和力)。
可以在HVR中进行改变(例如置换),例如以改善抗原结合分子的亲和力。这些改变可在HVR“热点”(即,由在体细胞成熟过程中经历高频率突变的密码子编码的残基)中进行(参见例如Chowdhury,Methods Mol.Biol.207:179-196(2008));和/或在接触抗原的残基中进行,其中测试所得的变体VH或VL的结合亲和力。通过构建和从第二文库重新选择来进行的亲和力成熟已于例如Hoogenboom等人,Methods in Molecular Biology 178:1-37(O'Brien等人编,Human Press,Totowa,NJ,(2001))中描述。在亲和力成熟的一些实施方案中,通过多种方法(例如易错PCR(error-prone PCR)、链改组或寡核苷酸定向诱变)中的任一种将多样性引入经选择用于成熟的可变基因中。随后建立第二文库。随后筛选该文库以鉴别具有所需亲和力的任何抗原结合分子变体。另一引入多样性的方法涉及HVR定向方法,其中若干个HVR残基(例如每次4-6个残基)是随机的。可例如使用丙氨酸扫描诱变或建模来特异性地鉴别抗原结合中所涉及的HVR残基。特定地,通常靶向CDR-H3及CDR-L3。
在某些实施方案中,置换、插入或缺失可在一个或多个HVR内进行,只要这些改变不实质上降低抗原结合分子结合抗原的能力即可。举例来说,可在HVR中进行不实质上降低结合亲和力的保守性改变(例如,如本文中所提供的保守性置换)。这些改变可以例如在HVR中的抗原接触残基之外。在上文提供的变体VH和VL序列的某些实施方案中,每个HVR未经改变,或含有不超过一个、两个或三个氨基酸置换。
用于鉴别可被靶向诱变的抗原结合分子的残基或区域的有用方法称作“丙氨酸扫描诱变”,如Cunningham和Wells(1989)Science,244:1081-1085所述。在此方法中,鉴定残基或靶残基的组(例如,诸如arg、asp、his、lys和glu的带电残基),并用中性或带负电荷的氨基酸(例如丙氨酸或聚丙氨酸)取代,以确定抗原结合分子与抗原的相互作用是否受到影响。可在对初始置换显示功能敏感性的氨基酸位置处引入进一步的置换。备选地或另外地,可以分析抗原和抗原结合分子的复合物的晶体结构,以鉴定抗原结合分子和抗原之间的接触点。这些接触残基及邻近残基可以作为置换候选物被靶向或消除。可以筛选变体以确定其是否含有所需特性。
氨基酸序列插入包括从一个残基至含有一百个或更多个残基的多肽的长度范围内的氨基端和/或羧基端融合,以及单个或多个氨基酸残基的序列内插入。末端插入的实例包括具有N端甲硫氨酰基残基的抗原结合分子。抗原结合分子的其他插入变体包括酶(例如用于ADEPT的酶)或增加抗原结合分子的血浆半衰期的多肽融合至抗原结合分子的N-或C-末端。
b)糖基化变体
在某些实施方案中,本文所提供的抗原结合分子被改变,以增加或降低抗原结合分子被糖基化的程度。对抗原结合分子的糖基化位点的添加或缺失可通过改变氨基酸序列以便建立或移除一个或多个糖基化位点而方便地实现。
当抗原结合分子包含Fc区时,则附接于其上的碳水化合物可以被改变。由哺乳动物细胞产生的天然抗体通常包含一般通过N-键附接于Fc区CH2结构域的Asn297的支链双触角寡糖。参见,例如,Wright等人,TIBTECH 15:26-32(1997)。寡糖可包括多种糖类,例如甘露糖、N-乙酰葡糖胺(GlcNAc)、半乳糖及唾液酸,以及与双触角寡糖结构的“主干”中的GlcNAc附接的岩藻糖。在一些实施方案中,可对本发明抗原结合分子中的寡糖进行修饰,以产生具有某些改良特性的抗原结合分子变体。
在一个实施方案中,提供具有缺乏与Fc区附接(直接或间接)的岩藻糖的糖结构的抗原结合分子变体。举例来说,该抗原结合分子中岩藻糖的量可以是1%至80%、1%至65%、5%至65%或20%至40%。通过相对于如MALDI-TOF质谱法所测量的所有与Asn 297附接的糖结构(例如复合、杂合及高甘露糖结构)的总和,计算糖链内Asn297处岩藻糖的平均量来确定岩藻糖的量,例如如WO 2008/077546中所述。Asn297是指位于Fc区中约位置297处(Fc区残基的Eu编号)的天冬酰胺残基;然而,由于抗原结合分子中的微小序列变化,Asn297也可能位于位置297的上游或下游约±3个氨基酸处,即介于位置294与300之间。这些岩藻糖基化变体可具有改善的ADCC功能。参见例如美国专利公开号US 2003/0157108(Presta,L.);US 2004/0093621(Kyowa Hakko Kogyo Co.,Ltd)。与“去岩藻糖基化的”或“岩藻糖缺乏的”抗原结合分子变体有关的出版物的实例包括:US 2003/0157108;WO 2000/61739;WO2001/29246;US 2003/0115614;US 2002/0164328;US 2004/0093621;US 2004/0132140;US2004/0110704;US 2004/0110282;US 2004/0109865;WO 2003/085119;WO 2003/084570;WO2005/035586;WO 2005/035778;WO2005/053742;WO2002/031140;Okazaki等人J.Mol.Biol.336:1239-1249(2004);Yamane-Ohnuki等人Biotech.Bioeng.87:614(2004)。能够产生去岩藻糖基的抗原结合分子的细胞系的实例包括蛋白质岩藻糖基化缺乏的Lec13CHO细胞(Ripka等人,Arch.Biochem.Biophys.249:533-545(1986);美国专利申请号US2003/0157108 A1,Presta,L;和WO 2004/056312 A1,Adams等人,尤其实施例11);和敲除细胞系,例如敲除α1,6-岩藻糖基转移酶基因FUT8的CHO细胞(参见例如Yamane-Ohnuki等人,Biotech.Bioeng.87:614(2004);Kanda等人,Biotechnol.Bioeng,94(4):680-688(2006);和WO 2003/085107)。
进一步提供具有平分型寡糖(bisected oligosaccharide)的抗原结合分子变体,例如其中与抗原结合分子Fc区附接的双触角寡糖被GlcNAc平分。这些抗原结合分子变体可具有降低的岩藻糖基化和/或改善的ADCC功能。这些抗体变体的实例例如在WO 2003/011878(Jean-Mairet等人);美国专利号6,602,684(Umana等人);和US 2005/0123546(Umana等)中描述。也提供在与Fc区附接的寡糖中具有至少一个半乳糖残基的抗原结合分子变体。这些抗原结合分子变体可具有改善的CDC功能。这些抗原结合分子变体在例如WO1997/30087(Patel等人);WO 1998/58964(Raju,S.)和WO 1999/22764(Raju,S.)中描述。
C)Fc区变体
在某些实施方案中,可在本文所提供抗原结合分子的Fc区中引入一个或多个氨基酸修饰,以此产生Fc区变体。Fc区变体可包含人Fc区序列(例如,人IgG1、IgG2、IgG3或IgG4Fc区),所述人Fc区序列在一或多个氨基酸位置处包含氨基酸修饰(例如置换)。
在某些实施方案中,本发明涵盖具有一些但非所有效应子功能的抗原结合分子变体,这使其成为应用的理想候选物,在所述应用中抗原结合分子的体内半衰期是重要的,但某些效应子功能(例如补体及ADCC)是不必要或有害的。可进行体外和/或体内细胞毒性测定,以确认CDC和/或ADCC活性的降低/消耗。举例来说,可进行Fc受体(FcR)结合测定,以确保抗原结合分子缺乏FcγR结合(因此可能缺乏ADCC活性),但保持FcRn结合能力。用于介导ADCC的原代细胞,NK细胞,仅表达FcγRIII,而单核细胞表达FcγRI、FcγRII和FcγRIII。FcR在造血细胞上的表达总结于Ravetch和Kinet,Annu.Rev.Immunol.9:457-492(1991)的第464页上的表3中。评定感兴趣的分子的ADCC活性的体外测定的非限制性实例描述于美国专利号5,500,362(参见,例如Hellstrom,I.等人Proc.Nat’l Acad.Sci.USA 83:7059-7063(1986))和Hellstrom,I等人,Proc.Nat’l Acad.Sci.USA 82:1499-1502(1985);5,821,337(参见Bruggemann,M.等人,J.Exp.Med.166:1351-1361(1987))中。或者,可采用非放射性测定方法(参见,例如,用于流式细胞术的ACTI
具有降低的效应子功能的抗原结合分子包括具有Fc区残基238、265、269、270、297、327和329中一个或多个置换的那些抗原结合分子(美国专利号6,737,056)。这些Fc突变体包括在氨基酸位置265、269、270、297和327的两个或更多个位置处具有置换的Fc突变体,包括残基265和297置换为丙氨酸的所谓的“DANA”Fc突变体(美国专利号7,332,581)。
描述了与FcR的结合增加或减少的某些抗原结合分子变体。(参见,例如美国专利号6,737,056;WO 2004/056312,和Shields等人.,J.Biol.Chem.9(2):6591-6604(2001))。
在某些实施方案中,抗原结合分子变体包含具有一个或多个改善ADCC的氨基酸置换的Fc区,例如在Fc区的位置298、333和/或334(残基的EU编号)处的置换。
在一些实施方案中,在Fc区中进行改变,其导致C1q结合和/或补体依赖性细胞毒性(CDC)改变(即,增加或减少),例如,如美国专利号6,194,551,WO 99/51642和Idusogie等人.,J.Immunol.164:4178-4184(2000)中所述。
US2005/0014934A1(Hinton等人)中描述具有增加的半衰期及增加的与新生儿Fc受体(FcRn)的结合的抗体,其中FcRn负责将母体IgG转移至胎儿(Guyer等人,J.Immunol.117:587(1976)和Kim等人,J.Immunol.24:249(1994))。那些抗体包含具有一个或多个置换的Fc区,所述置换增加Fc区与FcRn的结合。这些Fc变体包括在Fc区残基238,256,265,272,286,303,305,307,311,312,317,340,356,360,362,376,378,380,382,413,424或434中的一处或多处具有置换(例如,Fc区残基434的置换)的那些Fc变体(美国专利号7,371,826)。
还参见Duncan&Winter,Nature 322:738-40(1988);美国专利号5,648,260;美国专利号5,624,821;和WO 94/29351,它们涉及Fc区变体的其他实例。
d)半胱氨酸工程改造的抗原结合分子变体
在某些实施方案中,可能需要建立半胱氨酸工程改造的抗原结合分子,例如“thioMAb”,其中抗原结合分子的一个或多个残基被半胱氨酸残基置换。在特定的实施方案中,置换的残基出现在抗原结合分子的可接近位点。通过用半胱氨酸置换那些残基,从而将反应性硫醇基团定位在抗原结合分子的可接近位点,并且该基团可用于将抗原结合分子与其他部分(例如药物部分或接头-药物部分)缀合,以建立如本文进一步所述的免疫缀合物。在某些实施方案中,以下残基中的任何一个或多个可被半胱氨酸置换:轻链的V205(Kabat编号);重链的A118(EU编号);和重链Fc区的S400(EU编号)。半胱氨酸工程改造的抗原结合分子可以如例如美国专利号7,521,541中所述产生。
e)抗原结合分子衍生物
在某些实施方案中,本文所提供的抗原结合分子可经进一步修饰,以含有本领域中已知且容易获得的另外的非蛋白质部分。适于抗原结合分子衍生化的部分包括,但不限于,水溶性聚合物。水溶性聚合物的非限制性实例包括,但不限于,聚乙二醇(PEG)、乙二醇/丙二醇共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇、聚乙烯吡咯烷酮、聚-1,3-二氧戊环、聚1,3,6-三噁烷、乙烯/马来酸酐共聚物、聚氨基酸(均聚物或无规共聚物)、及葡聚糖或聚(n-乙烯基吡咯烷酮)聚乙二醇、聚丙二醇均聚物、聚环氧丙烷/氧化乙烯共聚物、聚氧乙基化多元醇(例如甘油)、聚乙烯醇、及其混合物。聚乙二醇丙醛因其在水中的稳定性可能具有生产优势。聚合物可以是任何分子量的,且可有分支或无分支。与抗原结合分子附接的聚合物的数目可以变化,且若附接多于一个聚合物,则其可以是相同的或不同的分子。一般而言,用于衍生化的聚合物的数目和/或类型可以基于包括但不限于以下的考虑因素来确定:待改善的抗原结合分子的特定性质或功能、抗原结合分子衍生物是否将用于限定条件下的疗法等。
关于本公开中的抗原结合分子,所需性质(活性)的实例可包括但不特别限于结合活性,中和活性,细胞毒性活性,激动剂活性,拮抗剂活性和酶活性。激动剂活性是细胞内转导信号的活性,例如,通过抗体与抗原诸如受体的结合来诱导一些生理活性的改变。生理活性的实例可以包括但不限于增殖活性,存活活性,分化活性,转录活性,膜转运活性,结合活性,蛋白水解活性,磷酸化/去磷酸化活性,氧化还原活性,转移活性,溶核活性,脱水活性,细胞死亡诱导活性和细胞凋亡诱导活性。
在另一个实施方案中,提供了抗原结合分子与可通过暴露于辐射来选择性加热的非蛋白质部分的缀合物。在一个实施方案中,非蛋白质部分是碳纳米管(Kam等人.,Proc.Natl.Acad.Sci.USA 102:11600-11605(2005))。该辐射可具有任何波长,且包括但不限于,不损伤普通细胞但能将非蛋白质部分加热至可杀死抗原结合分子-非蛋白质部分附近的细胞的温度的波长。
B.重组方法和组合物
抗原结合分子可以使用重组方法和组合物制备,例如,如美国专利号4,816,567中所述。在一个实施方案中,提供了编码本公开中的抗原结合分子(包含本文所述的抗原结合结构域的多肽)的分离的核酸。该核酸可编码包含抗原结合分子VL的氨基酸序列和/或包含抗原结合分子VH的氨基酸序列(例如抗原结合分子的轻链和/或重链)。在进一步的实施方案中,提供了包含该核酸的一个或多个载体(例如表达载体)。在进一步的实施方案中,提供了包含该核酸的宿主细胞。在一个这样的实施方案中,宿主细胞包含以下各项(例如已经用以下各项转化):(1)包含核酸的载体,所述核酸编码包含抗原结合分子的VL的氨基酸序列和包含抗原结合分子的VH的氨基酸序列,或(2)包含编码含有抗原结合分子的VL的氨基酸序列的核酸的第一载体,和包含编码含有抗原结合分子的VH的氨基酸序列的核酸的第二载体。在一个实施方案中,宿主细胞是真核的,例如中国仓鼠卵巢(CHO)细胞或淋巴样细胞(例如,Y0,NS0,Sp2/0细胞)。在一个实施方案中,提供了制备本公开抗原结合分子的方法,其中所述方法包括,在适合抗原结合分子表达的条件下,培养包含编码所述抗原结合分子的核酸的宿主细胞,如上文所提供的,和任选地从宿主细胞(或宿主细胞培养基)回收所述抗原结合分子。
为了重组产生本公开的抗原结合分子,分离编码抗原结合分子(例如上文所描述的抗原结合分子)的核酸,并将其插入一个或多个载体中,用于在宿主细胞中进一步克隆和/或表达。此类核酸可以易于使用常规程序分离和测序(例如通过使用能够与编码抗原结合分子重链和轻链的基因特异性结合的寡核苷酸探针)。
用于克隆或表达编码抗原结合分子的载体的适当宿主细胞包括本文描述的原核或真核细胞。例如,抗原结合分子可在细菌中产生,特别当不需要糖基化和Fc效应子功能时。对于抗体片段和多肽在细菌中的表达,参见,例如,美国专利号5,648,237、5,789,199和5,840,523。(还参见Charlton,Methods in Molecular Biology,卷248(B.K.C.Lo,编辑,Humana Press,Totowa,NJ,2003),第245-254页,描述了抗体片段在大肠杆菌中的表达。)在表达后,抗原结合分子可以以可溶级分从细菌细胞糊状物中分离,并且可进一步纯化。
除了原核生物以外,真核微生物诸如丝状真菌或酵母也是用于编码抗原结合分子的载体的合适的克隆或表达宿主,包括其糖基化途径已经“人源化”的真菌和酵母菌株,导致产生具有部分或完全人糖基化模式的抗原结合分子。参见Gerngross,Nat.Biotech.22:1409-1414(2004),和Li等人,Nat.Biotech.24:210-215(2006)。
适于表达糖基化抗原结合分子的合适的宿主细胞也源自多细胞生物体(无脊椎动物和脊椎动物)。无脊椎动物细胞的实例包括植物和昆虫细胞。已经鉴定了许多杆状病毒株,其可与昆虫细胞联合使用,特别是用于草地贪夜蛾(Spodoptera frugiperda)细胞的转染。
还可利用植物细胞培养物作为宿主。参见,例如,美国专利号5,959,177,6,040,498,6,420,548,7,125,978和6,417,429(其描述了用于在转基因植物中产生抗原结合分子的PLANTIBODIES
也可将脊椎动物细胞用作宿主。例如,适应于在悬浮液中生长的哺乳动物细胞系可能是有用的。有用的哺乳动物宿主细胞系的其它实例是用SV40转化的猴肾CV1系(COS-7);人胚肾系(293或293细胞,如例如Graham等人,J.Gen Virol.36:59(1977)中所描述的);幼仓鼠肾细胞(BHK);小鼠支持细胞(TM4细胞,如例如在Mather,Biol.Reprod.23:243-251(1980)中描述的);猴肾细胞(CV1);非洲绿猴肾细胞(VERO-76);人宫颈癌细胞(HELA);犬肾细胞(MDCK);水牛鼠(buffalo rat)肝细胞(BRL 3A);人肺细胞(W138);人肝细胞(Hep G2);小鼠乳瘤(MMT 060562);TRI细胞,如例如Mather等人,Annals N.Y.Acad.Sci.383:44-68(1982)中所描述的;MRC 5细胞;和FS4细胞。其它有用的哺乳动物宿主细胞系包括中国仓鼠卵巢(CHO)细胞,包括DHFR
C.测定
本文提供的抗原结合分子可以通过本领域已知的各种测定法对其物理/化学特征和/或生物学活性进行鉴定、筛选或表征。
1.结合测定和其他测定
在一个方面中,例如通过已知方法如ELISA、蛋白质印迹法等,测试本公开的抗原结合分子的抗原结合活性。
2.活性测定
一方面,提供了用于鉴定具有生物学活性的其抗原结合分子的测定法。生物活性可以包括例如将两个抗原分子保持在空间上接近的位置处的活性,调节两个抗原分子之间相互作用的活性,通过配体促进受体激活的活性,促进酶与底物催化反应的活性,促进表达第一抗原的细胞与表达第二抗原的细胞之间相互作用,促进具有细胞毒性活性的细胞(例如T细胞,NK细胞,单核细胞或巨噬细胞)损伤靶细胞的活性,调节通过彼此缔合而被激活的两个抗原分子的激活的活性,和对蛋白酶切割的抗性。还提供了在体内和/或体外具有这种生物学活性的抗原结合分子。
此外,本公开中的抗原结合分子可以根据与抗原结合分子结合的抗原分子的类型发挥各种生物学活性。这样的抗原结合分子的实例包括与T细胞受体(TCR)复合物结合(例如,CD3)并具有诱导T细胞激活的活性(激动剂活性)的抗原结合分子;以及与TNF受体超家族分子(例如OX40或4-1BB)或其他共刺激分子(例如CD28或ICOS)结合并具有促进上述激活的活性(激动剂活动)的抗原结合分子。在某些实施方案中,通过本发明的抗原结合分子中包含的两个或更多个抗原结合结构域的连接,增强或减弱了通过与抗原分子结合而施加的这种生物学活性。不受理论的限制,在某些实施方案中,由于两个或多个抗原分子之间的相互作用是通过与本公开中抗原结合分子的结合来调节的(例如,促进两个或多个抗原之间的缔合),因此可以实现这种增强或减弱。
在某些实施方案中,测试本发明的抗原结合分子的这种生物学活性。可以使用由抗原和抗原结合分子组成的复合物的诸如晶体结构分析,电子显微镜和基于电子断层扫描的结构分析等技术来评估两个抗原分子是否在空间上保持接近。还可以通过上述技术评估两个抗原结合结构域在空间上是否彼此接近或者两个抗原结合结构域的迁移率是否降低。具体地,关于使用电子断层扫描分析IgG分子的三维结构的技术,请参见例如,Zhang等人,Sci.Rep.5:9803(2015)。在电子断层扫描中,可以通过直方图显示对象分子可能形成的结构的出现频率,从而可以对结构变化(例如降低的结构域迁移率)进行分布评估。例如,当直方图显示了与结构相关的参数(例如两个结构域之间的距离和角度)可以获取的值之间的关系以及它们的出现频率时,如果它们的分布面积减少,则可以确定两个结构域的迁移率降低。可以通过根据靶抗原分子的类型从已知的活性测量系统中选择并使用适当的活性测量系统来评估通过两个抗原分子的相互作用而发挥的活性。可以使用本领域技术人员已知的方法或以下实施例中描述的方法来评估对蛋白酶切割的作用。
D.药物制剂(药物组合物)
本文所述的抗原结合分子的药物制剂是通过以下制备的:将具有所需纯度的此类抗原结合分子与一种或多种任选的药学上可接受的载体混合(Remington’sPharmaceutical Sciences第16版,Osol,A.Ed.(1980)),所述药物制剂为冻干制剂或水溶液的形式。药学上可接受的载体通常在所用剂量和浓度下对接受者无毒,并且包括但不限于:缓冲剂,如磷酸盐、柠檬酸盐及其他有机酸;抗氧化剂,包括抗坏血酸及甲硫氨酸;防腐剂(如十八烷基二甲基苄基氯化铵;氯化六羟季铵;苯扎氯铵;苄索氯铵;苯酚、丁醇或苄醇;对羟基苯甲酸烷基酯(alkyl paraben),如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(少于约10个残基)多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他糖类,包括葡萄糖、甘露糖或糊精;螯合剂,如EDTA;糖类,例如蔗糖、甘露醇、海藻糖或山梨醇;成盐平衡离子,如钠;金属复合体(例如Zn-蛋白质复合体);和/或非离子表面活性剂,如聚乙二醇(PEG)。本文中的示例性药学上可接受的载体还包括间质药物分散剂,如可溶性中性-活性透明质酸酶糖蛋白(sHASEGP),例如人可溶性PH-20透明质酸酶糖蛋白,如rHuPH20(HYLENEX(注册商标),Baxter International,Inc.)。某些示例性sHASEGP及使用方法,包括rHuPH20,描述于美国专利公开号2005/0260186和2006/0104968中。在一方面中,sHASEGP与一个或多个另外的葡糖胺聚糖酶例如软骨素酶组合。
示例性的冻干抗原结合分子制剂描述于美国专利号6,267,958中。水性抗原结合分子制剂包括美国专利号6,171,586和WO2006/044908中所述的那些,后一种制剂包括组氨酸-乙酸盐缓冲剂。
本文的制剂还可以含有超过一种的活性成分,所述活性成分是被治疗的特定适应证所需的,优选具有不会不利地影响彼此的互补活性的那些活性成分。此类活性成分以对预期目的有效的量合适地组合存在。
可以将活性成分截留于例如通过凝聚技术或通过界面聚合所制备的微胶囊中,例如,分别是羟甲基纤维素或明胶微胶囊及聚-(甲基丙烯酸甲酯)微胶囊中、胶状药物递送系统(例如脂质体、白蛋白微球体、微乳液、纳米颗粒及纳米胶囊)中或粗乳液中。这些技术公开于Remington’s Pharmaceutical Sciences第16版,Osol,A.编(1980)中。
可以制备缓释制剂。缓释制剂的合适实例包括含有抗原结合分子的固体疏水性聚合物的半透性基质,该基质为定型制品的形式,例如,薄膜或微胶囊。
用于体内施用的制剂通常是无菌的。无菌性可以容易地实现,例如,通过经由无菌滤膜过滤实现。
[实施例]
以下是本公开的抗原结合分子和方法的实施例。应该理解,在上文提供的一般性描述下,可以实施多种其他的实施方案。
[实施例1]Fab交联抗体的概念
与天然配体及其融合蛋白相比,激动剂抗体在诸如稳定性,药代动力学和生产方法等方面具有优越的性能,并且它们的药物开发正在进行中。然而,通常,具有强活性的激动剂抗体比仅结合抗体或中和抗体更难获得。因此,需要解决该问题的方法。
激动剂抗体所需的性质可能取决于配体的类型。对于针对以死亡受体(DR),OX40、4-1BB,CD40等为代表的TNF受体超家族的激动剂抗体,据报道,抗体或配体的多聚化有助于激活。作为提高该效果的技术,据报道以下技术可以增强激动剂活性:使用天然配体,通过抗-Fc抗体的交联,通过FcγR的交联,抗体结合结构域的多聚化,通过抗体Fc的多聚化等。还已知的是,对于某些类型的抗原,使用抗体Fab结构或scFv调节抗原结合位点的距离会导致激动剂活性的增强,而与多聚化无关。
作为另一种技术,已经报道了针对细胞因子受体的激动剂抗体,该激动剂抗体是能够结合相同抗原内的不同表位的双特异性抗体。此外,已经报道了通过使用化学缀合以相似的方式交联两个不同的Fab来改善激动剂活性的方法。
除了以上提到的那些方法,还需要更多的方法来改善激动剂抗体的活性。但是,尚未报道实现这一目标的简单方法。因此,发明人开发了一种通过引入最小突变使Fab彼此交联的方法,并证明了这实际上增强了激动剂活性,从而完成了本发明。在图1中示出了示例性实施方案。
[实施例2]修饰抗体的表达载体的制备,以及修饰抗体的表达和纯化
使用PCR,In-Fusion Advantage PCR克隆试剂盒(TAKARA)等通过本领域技术人员已知的方法,对插入动物细胞表达载体中的抗体基因进行氨基酸残基序列置换,以构建修饰抗体的表达载体。通过本领域技术人员已知的方法确定所得表达载体的核苷酸序列。将产生的表达载体瞬时导入
通过本领域技术人员已知的方法,使用用于HPLC的Agilent 1260
表1显示了通过这种方法制备的抗体(抗CD3ε抗体,抗CD28抗体和抗CD3εx抗CD28双特异性抗体)。
[表1]
抗体名称,SEQ ID NOs
HH:在两个H链恒定区中将位置191(EU编号)更改为Cys
LL:在两个L链恒定区中将位置126(EU编号)更改为Cys
HL,LH:在一个H链恒定区中将位置191(EU编号)更改为Cys,并且在一个L链恒定区中将位置126(EU编号)更改为Cys
[实施例3]双特异性抗体的制备
将纯化的抗体透析到TBS(WAKO)缓冲液中,并将其浓度调整为1mg/mL。制备10x反应缓冲液250mM 2-MEA(SIGMA)。将实施例2中制备的两种不同的同型二聚体抗体等量混合。向该混合物中,加入1/10体积的10x反应缓冲液并混合。使混合物在37℃下静置90分钟。反应后,将混合物透析到TBS中以获得双特异性抗体的溶液,其中上述两种不同的抗体被异二聚化。通过上述方法测量抗体浓度,并将抗体进行后续实验。
[实施例4]激动剂活性的评估
实施例4-1 Jurkat细胞悬浮液的制备
从烧瓶中收集Jurkat细胞(TCR/CD3效应细胞(NFAT),Promega)。用测定缓冲液(RPMI 1640培养基(Gibco),10%FBS(HyClone),1%MEM非必需氨基酸(Invitrogen)和1mM丙酮酸钠(Invitrogen))洗涤细胞,然后以3x10
实施例4-2:发光试剂溶液的制备
将100mL的Bio-Glo萤光素酶测定缓冲液(Promega)添加到Bio-Glo萤光素酶测定底物(Promega)的瓶中,并颠倒混合。将瓶避光,并在-20℃冷冻。对该发光试剂溶液进行后续实验。
实施例4-3T细胞激活测定
基于萤光素酶发光的倍数变化,评估通过激动剂信号传导的T细胞激活。前述Jurkat细胞是用具有NFAT响应序列的萤光素酶报道基因转化的细胞。当细胞被抗TCR/CD3抗体刺激时,NFAT途径通过细胞内信号传导被激活,从而诱导萤光素酶表达。将如上所述制备的Jurkat细胞悬浮液以每孔10μL(3x10
结果,与野生型分子(未修饰的分子)相比,具有连接抗CD3ε抗体的Fab-Fab的额外的二硫键的修饰分子显示出变化的CD3介导的信号传导,如图2和3所示。此外,如图4和5所示,与野生型分子相比,由抗CD3ε抗体和抗CD28抗体组成的具有连接Fab-Fab的额外二硫键的双特异性抗体的修饰分子还显示出差异很大的CD3和/或CD28介导的信号传导。
这些结果表明,引入本发明的修饰可以增强或减少抗原结合分子例如抗体所具有的激动剂活性。
[实施例5]评估在重链的各个位置处具有半胱氨酸置换的抗体
实施例5-1:评估在重链的各个位置处具有半胱氨酸置换的抗体
对抗人IL6R中和抗体MRA(重链:MRAH-G1T4(SEQ ID NO:15),轻链:MRAL-k0MRAL-k0(SEQ ID NO:16))的重链可变区和恒定区进行研究,其中在结构上暴露于表面的任意氨基酸残基被半胱氨酸置换。
用半胱氨酸置换MRA重链可变区(MRAH,SEQ ID NO:17)中的氨基酸残基,以产生表2所示的MRA重链可变区变体。将这些MRA重链可变区变体各自与MRA的重链恒定区(G1T4,SEQ ID NO:18)连接以产生MRA重链变体,并且通过本领域技术人员已知的方法产生编码相应基因的表达载体。
另外,将MRA的重链恒定区(G1T4,SEQ ID NO:18)中的氨基酸残基置换为半胱氨酸,以产生表3中所示的MRA重链恒定区变体。将这些MRA重链恒定区变体各自与MRA的重链可变区(MRAH,SEQ ID NO:17)连接以产生MRA重链变体,并且通过本领域技术人员已知的方法产生编码相应基因的表达载体。
将以上产生的MRA重链变体与MRA轻链结合。表4中所示的所得MRA变体使用FreeStyle293细胞(Invitrogen)或Expi293细胞(Life Technologies)通过本领域技术人员已知的方法通过瞬时表达来表达,并通过本领域技术人员已知的方法用蛋白质A进行纯化。
[表2]
MRA重链可变区变体和半胱氨酸置换的位置
[表3]
MRA重链恒定区变体和半胱氨酸置换的位置
[表4]
MRA变体
实施例5-2:评估在重链的各个位置处具有半胱氨酸置换的抗体的蛋白酶介导的Fab片段化
使用切割抗体的重链铰链区以引起Fab片段化的蛋白酶,检查实施例5-1中制备的MRA变体是否获得蛋白酶抗性从而抑制其片段化。所用的蛋白酶是Lys-C(内切蛋白酶Lys-C测序级)(SIGMA;11047825001)。反应在2ng/μL蛋白酶、100μg/mL抗体、80%25mM Tris-HClpH 8.0、20%PBS和35℃的条件下进行2小时,或在2ng/μL蛋白酶、20μg/mL抗体、80%25mMTris-HCl pH 8.0、20%PBS和35℃的条件下进行1小时。然后将样品进行非还原毛细管电泳。Wes(Protein Simple)用于毛细管电泳,并且HRP标记的抗κ链抗体(abcam;ab46527)用于检测。结果示于图6至图13中。MRA的Lys-C处理导致重链铰链区的切割,导致IgG的条带在约150kDa处消失,并且Fab的条带在约50kDa处出现。对于实施例5-1中制备的MRA变体,在蛋白酶处理后,一些显示在大约96kDa处出现的Fab二聚体条带,并且一些显示在大约150kDa处检测到的未消化的IgG条带。使用专用于Wes的软件(Compass for SW;Protein Simple)输出蛋白酶处理后获得的每个条带的面积,以计算未消化的IgG、Fab二聚体等的条带面积百分比。每个条带的计算百分比显示在表5中。
[表5]
从该结果发现,在表6所示的MRA变体中,重链可变区或重链恒定区中的半胱氨酸置换改善了重链铰链区的蛋白酶抗性。备选地,该结果表明Fab二聚体是通过Fab-Fab之间的共价键形成的。
[表6]
MRA变体
[实施例6]评估在轻链的各个位置处具有半胱氨酸置换的抗体
实施例6-1:评估在轻链的各个位置处具有半胱氨酸置换的抗体
对抗人IL6R中和抗体MRA(重链:MRAH-G1T4(SEQ ID NO:15),轻链:MRAL-k0(SEQID NO:16))的轻链可变区和恒定区进行研究,其中在结构上暴露于表面的任意氨基酸残基被半胱氨酸置换。
用半胱氨酸置换MRA轻链可变区(MRAL,SEQ ID NO:19)中的氨基酸残基,以产生表7所示的MRA轻链可变区变体。将这些MRA轻链可变区变体各自与MRA的轻链恒定区(k0,SEQID NO:20)连接以产生MRA轻链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。
另外,将MRA的轻链恒定区(k0,SEQ ID NO:20)中的氨基酸残基置换为半胱氨酸,以制备表8中所示的MRA轻链恒定区变体。将这些MRA轻链恒定区变体各自与MRA的轻链可变区(MRAL,SEQ ID NO:19)连接以产生MRA轻链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。
将以上制备的MRA轻链变体与MRA重链组合。表9中所示的所得MRA变体是使用FreeStyle293细胞(Invitrogen)或Expi293细胞(Life Technologies)通过本领域技术人员已知的方法通过瞬时表达而表达的,并通过本领域技术人员已知的方法用蛋白质A进行纯化。
[表7]
MRA轻链可变区变体和半胱氨酸置换的位置
[表8]
MRA轻链恒定区变体和半胱氨酸置换的位置
[表9]
MRA变体
实施例6-2:评估在轻链的各个位置处具有半胱氨酸置换的抗体的蛋白酶介导的Fab片段化
使用切割抗体的重链铰链区以引起Fab片段化的蛋白酶,检查实施例6-1中制备的MRA变体是否获得蛋白酶抗性从而抑制其片段化。所用的蛋白酶是Lys-C(内切蛋白酶Lys-C测序级)(SIGMA;11047825001)。反应在2ng/μL蛋白酶、100μg/mL抗体、80%25mM Tris-HClpH 8.0、20%PBS和35℃的条件下进行2小时,或在2ng/μL蛋白酶、20μg/mL抗体、80%25mMTris-HCl pH 8.0、20%PBS和35℃的条件下进行1小时。然后将样品进行非还原毛细管电泳。Wes(Protein Simple)用于毛细管电泳,并且HRP标记的抗κ链抗体(abcam;ab46527)用于检测。结果示于图14至图23中。MRA的Lys-C处理导致重链铰链区的切割,导致IgG的条带在约150kDa处消失,并且Fab的条带在约50kDa处出现。对于实施例6-1中制备的MRA变体,在蛋白酶处理后,一些显示在大约96kDa处出现的Fab二聚体条带,并且一些显示在大约150kDa处检测到的未消化的IgG条带。使用专用于Wes的软件(Compass for SW;ProteinSimple)输出蛋白酶处理后获得的每个条带的面积,以计算未消化的IgG、Fab二聚体等的条带面积百分比。每个条带的计算百分比显示在表10中。
[表10]
从该结果发现,在表11所示的MRA变体中,轻链可变区或轻链恒定区中的半胱氨酸置换改善了重链铰链区的蛋白酶抗性。备选地,该结果表明Fab二聚体是通过Fab-Fab之间的共价键形成的。
[表11]
MRA变体
[实施例7]评估具有半胱氨酸取代的抗体的方法的研究
实施例7-1:制备在轻链中具有半胱氨酸置换的抗体
抗人IL6R中和抗体MRA(重链:MRAH-G1T4(SEQ ID NO:15),轻链:MRAL-k0(SEQ IDNO:16))MRA的轻链恒定区(k0,SEQ ID NO:20)中根据Kabat编号位置126处的氨基酸残基被半胱氨酸置换,以产生MRA轻链恒定区变体k0.K126C(SEQ ID No:231)。将该MRA轻链恒定区变体与MRA轻链可变区(MRAL,SEQ ID NO:19)连接以产生MRA轻链变体,并通过本领域技术人员已知的方法制备编码相应基因的表达载体。
将以上制备的MRA轻链变体与MRA重链
实施例7-2:评估轻链中具有半胱氨酸置换的抗体的蛋白酶介导的毛细管电泳
使用切割抗体的重链铰链区以引起Fab片段化的蛋白酶,检查实施例7-1中制备的MRA轻链变体是否获得蛋白酶抗性从而抑制其片段化。所用的蛋白酶是Lys-C(内切蛋白酶Lys-C测序级)(SIGMA;11047825001)。在0.1、0.4、1.6或6.4ng/μL蛋白酶,100μg/mL抗体,80%25mM Tris-HCl pH 8.0,20%PBS和35℃的条件下进行反应2小时。然后将样品进行非还原毛细管电泳。Wes(Protein Simple)用于毛细管电泳,并且HRP标记的抗κ链抗体(abcam;ab46527)或HRP标记的抗人Fc抗体(Protein Simple;043-491)用于检测。结果显示在图24中。对于用Lys-C处理的MRA,用抗kappa链抗体进行的检测显示在约150kDa处条带消失,在约50kDa处出现新条带,并且在低Lys-C浓度下也显示在113kDa处出现细条带。用抗人Fc抗体进行的检测显示在约150kDa处条带消失,在约61kDa处出现新条带,并且在低Lys-C浓度下也显示在113kDa处出现细条带。另一方面,对于实施例7-1中制备的MRA变体,在约150kDa处的条带几乎不消失,并且在约96kDa处出现新的条带。用抗人Fc抗体进行的检测显示,在约150kDa处的条带几乎没有消失,并且在约61kDa处出现新的条带,并且在低Lys-C浓度下在113kDa处也出现了细条带。以上结果表明,如图25所示,在约150kDa处的条带是IgG,在约113kDa处的条带是其中重链铰链被切割一次的单臂形式,在约96kDa处的条带是Fab二聚体,在约61kDa处的条带是Fc,并且在约50kDa处的条带是Fab。
[实施例8]评估在IgG1的各个位置处具有半胱氨酸置换的抗体
实施例8-1:制备在IgG1的各个位置处具有半胱氨酸置换的抗体
对抗人IL6R中和抗体MRA-IgG1(重链:MRAH-G1T4(SEQ ID NO:15),轻链:MRAL-k0(SEQ ID NO:16))的重链和轻链进行研究,其中在结构上暴露于表面的任意氨基酸残基被半胱氨酸置换。
用半胱氨酸置换MRA-IgG1重链可变区(MRAH,SEQ ID NO:17)中的氨基酸残基,以制备表12中所示的MRA-IgG1重链可变区变体。将这些MRA-IgG1重链可变区变体各自与MRA-IgG1重链恒定区(G1T4,SEQ ID NO:18)连接以制备MRA-IgG1重链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。此外,用半胱氨酸置换MRA-IgG1重链恒定区(G1T4,SEQ ID NO:18)中的氨基酸残基,以制备表13中所示的MRA-IgG1重链恒定区变体。将这些MRA-IgG1重链恒定区变体各自与MRA-IgG1重链可变区(MRAH,SEQ ID NO:17)连接以制备MRA-IgG1重链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。
[表12]
[表13]
类似地,用半胱氨酸置换MRA-IgG1轻链可变区(MRAL,SEQ ID NO:19)中的氨基酸残基,以制备表14中所示的MRA-IgG1轻链可变区变体。将这些MRA-IgG1轻链可变区变体各自与MRA-IgG1轻链恒定区(k0,SEQ ID NO:20)连接以制备MRA-IgG1轻链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。此外,用半胱氨酸置换MRA-IgG1轻链恒定区(k0,SEQ ID NO:20)中的氨基酸残基,以制备表15中所示的MRA-IgG1轻链恒定区变体。将这些MRA-IgG1重链恒定区变体各自与MRA-IgG1轻链可变区(MRAL,SEQ ID NO:19)连接以制备MRA-IgG1轻链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。
[表14]
[表15]
将以上制备的MRA-IgG1重链变体与MRA-IgG1轻链组合,或将MRA-IgG1重链与MRA-IgG1轻链变体组合。表16和17中所示的所得MRA-IgG1重链变体和MRA-IgG1轻链变体是使用FreeStyle293细胞(Invitrogen)或Expi293细胞(Life Technologies)通过本领域技术人员已知的方法通过瞬时表达而表达的,并通过本领域技术人员已知的方法用蛋白质A进行纯化。
[表16]
[表17]
实施例8-2:评估在IgG1的各个位置处具有半胱氨酸置换的抗体在聚丙烯酰胺凝胶中的电泳迁移率
用非还原性SDS-PAGE检查实施例8-1中制备的MRA-IgG1变体是否显示出与MRA-IgG1不同的电泳迁移率。使用样品缓冲液(2ME-)(x4)(Wako;198-13282)制备电泳样品,在样品浓度为50μg/mL和70℃的条件下处理样品10分钟,然后进行非还原SDS-PAGE。在非还原SDS-PAGE中,使用4%SDS-PAGE mini 15孔1.0mm 15孔(TEFCO;Cat#01-052-6)在125V下电泳90分钟。然后,将凝胶用CBB染料染色,用ChemiDocTouchMP(BIORAD)捕获凝胶图像,并用Image Lab(BIORAD)定量条带。
从获得的凝胶图像中,根据每种MRA-IgG1变体的条带模式,将变体分为7组:单条(与MRA-IgG1相似的分子量区域有一条带),双条(与MRA-IgG1相似的分子量区域有两条带),三条(与MRA-IgG1相似的分子量区域有三条带),多条(与MRA-IgG1相似的分子量区域有4个或更多的条带),LMW(分子量区域低于MRA-IgG1的条带),HMW(分子量区域高于MRA-IgG1的条带)和模糊(不清楚和难以确定的条带)。关于归类为“双条”的MRA-IgG1变体,两条带之一显示出与MRA-IgG1相同的电泳迁移率,而另一条带则显示出稍微更快或更慢的迁移率。因此,对于归类为“双条”的MRA-IgG1变体,还计算了相对于MRA-IgG1显示出不同迁移率的条带百分比(新条带的百分比(%))。表18和表19分别显示了MRA-IgG1重链变体和MRA-IgG1轻链变体的条带模式分组以及条带百分比的计算结果。从表18和表19中可以看出,分为双条组和三条组的变体在表20中显示。在这些变体中,半胱氨酸置换很可能引起结构变化,例如Fab的交联,从而导致电泳迁移率的变化。值得注意的是,尽管表19表示MRAL.K107C-IgG1“无数据”,但是在该变体中半胱氨酸置换的位置即位置107(Kabat编号)是结构上暴露于表面的残基在铰链区中所存在的位置。因此,在该变体中,半胱氨酸置换也很有可能引起结构变化,例如Fab的交联,并导致电泳迁移率变化。
[表18]
[表19]
[表20]
[实施例9]评估在IgG4的各个位置处具有半胱氨酸置换的抗体
实施例9-1:制备在IgG4的各个位置处具有半胱氨酸置换的抗体
对抗人IL6R中和抗体MRA-IgG4(重链:MRAH-G4T1(SEQ ID NO:310),轻链:MRAL-k0(SEQ ID NO:16))的重链和轻链进行研究,其中在结构上暴露于表面的任意氨基酸残基被半胱氨酸置换。
用半胱氨酸置换MRA-IgG4重链可变区(MRAH,SEQ ID NO:17)中的氨基酸残基,以制备表21中所示的MRA-IgG4重链可变区变体。将这些MRA-IgG4重链可变区变体各自与MRA-IgG4重链恒定区(G4T1,SEQ ID NO:311)连接以制备MRA-IgG4重链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。此外,用半胱氨酸置换MRA-IgG4重链恒定区(G4T1,SEQ ID NO:311)中的氨基酸残基,以制备表22中所示的MRA-IgG4重链恒定区变体。将这些MRA-IgG4重链恒定区变体各自与MRA-IgG4重链可变区(MRAH,SEQ ID NO:17)连接以制备MRA-IgG4重链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。
[表21]
[表22]
将以上制备的MRA-IgG4重链变体与MRA-IgG4轻链组合,或将MRA-IgG4重链与实施例8-1中制备的MRA-IgG4轻链变体组合。表23和24中所示的所得MRA-IgG4重链变体和MRA-IgG4轻链变体是使用FreeStyle293细胞(Invitrogen)或Expi293细胞(LifeTechnologies)通过本领域技术人员已知的方法通过瞬时表达而表达的,并通过本领域技术人员已知的方法用蛋白质A进行纯化。
[表23]
[表24]
实施例9-2:评估在IgG4的各个位置处具有半胱氨酸置换的抗体在聚丙烯酰胺凝胶中的电泳迁移率
类似于实施例8-2,用实施例9-1中制备的MRA-IgG4变体进行非还原性SDS-PAGE,捕获凝胶图像,并定量条带。
从获得的凝胶图像中,根据每种MRA-IgG4变体的条带模式,将变体分为7组:单条(与MRA-IgG4相似的分子量区域有一条带),双条(与MRA-IgG4相似的分子量区域有两条带),三条(与MRA-IgG4相似的分子量区域有三条带),多条(与MRA-IgG4相似的分子量区域有4个或更多的条带),LMW(分子量区域低于MRA-IgG4的条带),HMW(分子量区域高于MRA-IgG4的条带)和模糊(不清楚和难以确定的条带)。关于归类为“双条”的MRA-IgG4变体,两条带之一显示出与MRA-IgG4相同的电泳迁移率,而另一条带则显示出稍微更快或更慢的迁移率。因此,对于归类为“双条”的MRA-IgG4变体,还计算了相对于MRA-IgG4显示出不同迁移率的条带百分比(新条带的百分比(%))。表25和表26分别显示了MRA-IgG4重链变体和MRA-IgG4轻链变体的条带模式分组以及条带百分比的计算结果。从表25和表26中可以看出,分为双条组和三条组的变体在表27中显示。在这些变体中,半胱氨酸置换很可能引起结构变化,例如Fab的交联,从而导致电泳迁移率的变化。值得注意的是,尽管表26表示MRAL.K107C-IgG4“无数据”,但是在该变体中半胱氨酸置换的位置即位置107(Kabat编号)是结构上暴露于表面的残基在铰链区中所存在的位置。因此,在该变体中,半胱氨酸置换也很有可能引起结构变化,例如Fab的交联,并导致电泳迁移率变化。
[表25]
[表26]
[表27]
[实施例10]评估在IgG2的各个位置处具有半胱氨酸置换的抗体
实施例10-1:制备在IgG2的各个位置处具有半胱氨酸置换的抗体
对抗人IL6R中和抗体MRA-IgG2(重链:MRAH-G2d(SEQ ID NO:312),轻链:MRAL-k0(SEQ ID NO:16))的重链和轻链进行研究,其中在结构上暴露于表面的任意氨基酸残基被半胱氨酸置换。
用半胱氨酸置换MRA-IgG2重链可变区(MRAH,SEQ ID NO:17)中的氨基酸残基,以制备表28中所示的MRA-IgG2重链可变区变体。将这些MRA-IgG2重链可变区变体各自与MRA-IgG2重链恒定区(G2d,SEQ ID NO:313)连接以制备MRA-IgG2重链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。此外,用半胱氨酸置换MRA-IgG2重链恒定区(G2d,SEQ ID NO:313)中的氨基酸残基,以制备表29中所示的MRA-IgG2重链恒定区变体。将这些MRA-IgG2重链恒定区变体各自与MRA-IgG2重链可变区(MRAH,SEQ ID NO:17)连接以制备MRA-IgG2重链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。
[表28]
[表29]
将以上制备的MRA-IgG2重链变体与MRA-IgG2轻链组合,或将MRA-IgG2重链与实施例8-1中制备的MRA-IgG2轻链变体组合。表30和31中所示的所得MRA-IgG2重链变体和MRA-IgG2轻链变体是使用FreeStyle293细胞(Invitrogen)或Expi293细胞(LifeTechnologies)通过本领域技术人员已知的方法通过瞬时表达而表达的,并通过本领域技术人员已知的方法用蛋白质A进行纯化。
[表30]
[表31]
实施例10-2:评估在IgG2的各个位置处具有半胱氨酸置换的抗体在聚丙烯酰胺凝胶中的电泳迁移率
类似于实施例8-2,用实施例10-1中制备的MRA-IgG2变体进行非还原性SDS-PAGE,捕获凝胶图像,并分析条带。
从获得的凝胶图像中,根据每种MRA-IgG2变体的条带模式,将变体分为7组:单条(在140kDa附近的分子量区域有一个条带),双条(在140kDa附近的分子量区域有两条带),三条(在140kDa附近的分子量区域有三条带),多条(在140kDa附近的分子量区域有4个或更多的条带),LMW(分子量区域低于140kDa附近的条带),HMW(分子量区域高于140kDa附近的条带)和模糊(不清楚和难以确定的条带)。表32和表33分别显示了MRA-IgG2重链变体和MRA-IgG2轻链变体的条带模式分组结果。从表32和表33中可以看出,分为双条组和三条组的变体在表34中显示。值得注意的是,尽管表33表示MRAL.K107C-IgG2“无数据”,但是在该变体中半胱氨酸置换的位置即位置107(Kabat编号)是结构上暴露于表面的残基在铰链区中所存在的位置。因此,该变体也可以被分类为“双条”。
[表32]
[表33]
[表34]
[实施例11]评估在λ链的各个位置处具有半胱氨酸置换的抗体
实施例11-1:制备在λ链的各个位置处具有半胱氨酸置换的抗体
对抗人CXCL10中和抗体G7-IgG1(重链:G7H-G1T4(SEQ ID NO:314),轻链:G7L-LT0(SEQ ID NO:316))的轻链(λ链)进行了研究,其中在结构上暴露于表面的任意氨基酸残基被半胱氨酸置换。
用半胱氨酸置换G7-IgG1轻链可变区(G7L,SEQ ID NO:317)中的氨基酸残基,以制备表35中所示的G7-IgG1轻链可变区变体。将这些G7-IgG1轻链可变区变体各自与G7-IgG1轻链恒定区(LT0,SEQ ID NO:318)连接以制备G7-IgG1轻链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。此外,用半胱氨酸置换G7-IgG1轻链恒定区(LT0,SEQ ID NO:318)中的氨基酸残基,以制备表36中所示的G7-IgG1轻链恒定区变体。将这些G7-IgG1重链恒定区变体各自与G7-IgG1轻链可变区(G7L,SEQ ID NO:317)连接以制备G7-IgG1轻链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。
[表35]
[表36]
将以上制备的G7-IgG1轻链变体与G7-IgG1重链组合,并且表37中所示的所得G7-IgG1轻链变体是使用FreeStyle293细胞(Invitrogen)或Expi293细胞(LifeTechnologies)通过本领域技术人员已知的方法通过瞬时表达而表达的,并通过本领域技术人员已知的方法用蛋白质A进行纯化。
[表37]
实施例11-2:评估在λ链的各个位置处具有半胱氨酸置换的抗体在聚丙烯酰胺凝胶中的电泳迁移率
类似于实施例8-2,用实施例11-1中制备的G7-IgG1变体进行非还原性SDS-PAGE,捕获凝胶图像,并定量条带。
从获得的凝胶图像中,根据每种G7-IgG1变体的条带模式,将变体分为7组:单条(与G7-IgG1相似的分子量区域有一条带),双条(与G7-IgG1相似的分子量区域有两条带),三条(与G7-IgG1相似的分子量区域有三条带),多条(与G7-IgG1相似的分子量区域有4个或更多的条带),LMW(分子量区域低于G7-IgG1的条带),HMW(分子量区域高于G7-IgG1的条带)和模糊(不清楚和难以确定的条带)。关于归类为“双条”的G7-IgG1变体,两条带之一显示出与G7-IgG1相同的电泳迁移率,而另一条带则显示出稍微更快或更慢的迁移率。因此,对于归类为“双条”的G7-IgG1变体,还计算了相对于G7-IgG1显示出不同迁移率的条带百分比(新条带的百分比(%))。表38显示了G7-IgG1轻链变体的条带模式分组以及条带百分比的计算结果。从表38中可以看出,分类为双条组和三条组的变体在表39中显示。在这些变体中,半胱氨酸置换很可能引起结构变化,例如Fab的交联,从而导致电泳迁移率的变化。在该实施例中,没有评估其中在位置107a(Kabat编号)处的氨基酸残基被半胱氨酸置换的变体。然而,位置107a(Kabat编号)是结构上暴露于表面的残基在铰链区中所存在的位置。因此,在该变体中,半胱氨酸置换也很有可能引起结构变化,例如Fab的交联,并导致电泳迁移率变化。
[表38]
[表39]
[实施例12]评估在VHH的各个位置处具有半胱氨酸置换的抗体
实施例12-1:制备在VHH的各个位置处具有半胱氨酸置换的抗体
将抗人IL6R中和VHH,IL6R90(SEQ ID NO:319),与人IgG1 Fc区(G1T3dCH1dC,SEQID NO:320)融合以制备IL6R90-Fc(IL6R90-G1T3dCH1dC,SEQ ID NO:321),并且对其进行了研究,其中在结构上暴露于表面的IL6R90区域中的任意氨基酸残基被半胱氨酸置换。
用半胱氨酸置换IL6R90区域内的氨基酸残基,并通过本领域技术人员已知的方法制备编码表40所示的IL6R90-Fc VHH区变体的基因的表达载体。将这些IL6R90-Fc VHH区变体各自与人IgG1的Fc区(G1T3dCH1dC,SEQ ID NO:320)连接以制备IL6R90-Fc变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。
[表40]
以上制备的和表41中所示的IL6R90-Fc变体是使用FreeStyle293细胞(Invitrogen)或Expi293细胞(Life Technologies)通过本领域技术人员已知的方法通过瞬时表达而表达的,并通过本领域技术人员已知的方法用蛋白质A进行纯化。
[表41]
实施例12-2:评估在VHH的各个位置处具有半胱氨酸置换的抗体在聚丙烯酰胺凝胶中的电泳迁移率
用非还原性SDS-PAGE检查实施例12-1中制备的IL6R90-Fc变体是否显示出与IL6R90-Fc不同的电泳迁移率。使用样品缓冲液(2ME-)(x4)(Wako;198-13282)制备电泳样品,在样本浓度为50μg/mL和70℃的条件下处理样品10分钟,然后进行非还原SDS-PAGE。将Mini-PROTEAN TGX预制凝胶4-20%15孔(BIORAD;456-1096)用于非还原SDS-PAGE,并在200V下进行电泳2.5小时。然后,将凝胶用CBB染料染色,用ChemiDocTouchMP(BIORAD)捕获凝胶图像,并用Image Lab(BIORAD)定量条带。
从获得的凝胶图像中,根据每种IL6R90-Fc变体的条带模式,将变体分为7组:单条(与IL6R90-Fc相似的分子量区域有一条带),双条(与IL6R90-Fc相似的分子量区域有两条带),三条(与IL6R90-Fc相似的分子量区域有三条带),多条(与IL6R90-Fc相似的分子量区域有4个或更多的条带),LMW(分子量区域低于IL6R90-Fc的条带),HMW(分子量区域高于IL6R90-Fc的条带)和模糊(不清楚和难以确定的条带)。关于归类为“双条”的IL6R90-Fc变体,两条带之一显示出与IL6R90-Fc相同的电泳迁移率,而另一条带则显示出稍微更快或更慢的迁移率。因此,对于归类为“双条”的IL6R90-Fc变体,还计算了相对于IL6R90-Fc显示出不同迁移率的条带百分比(新条带的百分比(%))。表42显示了IL6R90-Fc变体的条带模式分组以及条带百分比的计算结果。从表42中可以看出,分类为双条组和三条组的变体在表43中显示。在这些变体中,半胱氨酸置换很可能引起结构变化,例如VHH的交联,从而导致电泳迁移率的变化。
[表42]
[表43]
[实施例13]评估在Fab内具有半胱氨酸置换的抗体的CD3激动剂活性
实施例13-1:制备在恒定区具有半胱氨酸置换的抗体
对抗人CD3激动剂抗体OKT3(重链:OKT3VH0000-G1T4(SEQ ID NO:1007),轻链:OKT3VL0000-KT0(SEQ ID NO:1008))进行了研究,其中在结构上暴露于表面的任意氨基酸残基被半胱氨酸置换。
用半胱氨酸置换OKT3重链恒定区(G1T4,SEQ ID NO:1009)中的氨基酸残基,以制备表44中所示的OKT3重链恒定区变体。将这些OKT3重链恒定区变体各自与OKT3重链可变区(OKT3VH0000,SEQ ID NO:1010)连接以制备OKT3重链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。
[表44]
类似地,用半胱氨酸置换OKT3轻链恒定区(KT0,SEQ ID NO:1011)中的氨基酸残基,以制备表45中所示的OKT3轻链恒定区变体。将该OKT3轻链恒定区变体与OKT3轻链可变区(OKT3VL0000,SEQ ID NO:1012)连接以制备OKT3轻链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。
[表45]
将以上制备的OKT3重链变体和OKT3轻链变体分别与OKT3轻链和OKT3重链组合,并且表46所示的OKT3变体是使用FreeStyle293细胞(Invitrogen)或Expi293细胞(LifeTechnologies)通过本领域技术人员已知的方法通过瞬时表达而表达的,并通过本领域技术人员已知的方法用蛋白质A进行纯化。进一步地,类似地制备抗KLH抗体IC17(重链:IC17HdK-G1T4(SEQ ID NO:1013),轻链:IC17L-k0(SEQ ID NO:1014))作为阴性对照。
[表46]
实施例13-2 Jurkat细胞悬浮液的制备
从烧瓶中收集Jurkat细胞(TCR/CD3效应细胞(NFAT),Promega)。用测定缓冲液(RPMI 1640培养基(Gibco),10%FBS(HyClone),1%MEM非必需氨基酸(Invitrogen)和1mM丙酮酸钠(Invitrogen))洗涤细胞,然后以3x10
实施例13-3:发光试剂溶液的制备
将100mL的Bio-Glo萤光素酶测定缓冲液(Promega)添加到Bio-Glo萤光素酶测定底物(Promega)的瓶中,并颠倒混合。将瓶避光,并在-20℃冷冻。对该发光试剂溶液进行后续实验。
实施例13-4:评估在恒定区具有半胱氨酸置换的抗体的T细胞激活
基于萤光素酶发光的倍数变化,评估通过激动剂信号传导的T细胞激活。前述Jurkat细胞是用具有NFAT响应序列的萤光素酶报道基因转化的细胞。当细胞被抗TCR/CD3抗体刺激时,NFAT途径通过细胞内信号传导被激活,从而诱导萤光素酶表达。将如上所述制备的Jurkat细胞悬浮液以每孔10μL(3x10
结果,如图26所示,在恒定区具有半胱氨酸置换的OKT3变体中,与OKT3相比,多个变体大大增加了T细胞的活化状态。该结果显示存在多个可以使Fab交联并增强CD3激动剂活性的半胱氨酸修饰。
[实施例14]评估在两个Fab中具有不同半胱氨酸置换的抗体的CD3激动剂活性
实施例14-1:制备在恒定区具有异源半胱氨酸置换的抗体
对抗人CD3激动剂抗体OKT3(重链:OKT3VH0000-G1T4(SEQ ID NO:1007),轻链:OKT3VL0000-KT0(SEQ ID NO:1008))进行了研究,其中在结构上暴露于表面的任意氨基酸残基被半胱氨酸置换。
用半胱氨酸置换OKT3重链恒定区1(G1T4k,SEQ ID NO:1015)中的氨基酸残基,以制备表47中所示的OKT3重链恒定区变体。将这些OKT3重链恒定区变体与OKT3重链可变区(OKT3VH0000,SEQ ID NO:1010)连接以制备OKT3重链变体1,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。类似地,用半胱氨酸置换OKT3重链恒定区2(G1T4h,SEQ ID NO:1016)中的氨基酸残基,以制备表48中所示的OKT3重链恒定区变体。将这些OKT3重链恒定区变体各自与OKT3重链可变区(OKT3VH0000,SEQ ID NO:1010)连接以制备OKT3重链变体2,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。应当注意的是,本实施例中的重链恒定区1和2在CH3区引入了杵臼(KiH)修饰,以促进异二聚化。
[表47]
[表48]
将以上制备的OKT3重链变体1和OKT3重链变体2与OKT3轻链组合,并且表49所示的OKT3变体是使用FreeStyle293细胞(Invitrogen)或Expi293细胞(Life Technologies)通过本领域技术人员已知的方法通过瞬时表达而表达的,并通过本领域技术人员已知的方法用蛋白质A进行纯化。进一步地,类似地制备抗KLH抗体IC17(重链:IC17HdK-G1T4(SEQ IDNO:1013),轻链:IC17L-k0(SEQ ID NO:1014))作为阴性对照。
[表49]
实施例14-2 Jurkat细胞悬浮液的制备
如实施例13-2那样制备Jurkat细胞悬浮液。
实施例14-3:发光试剂溶液的制备
如实施例13-3那样制备发光试剂溶液。
实施例14-4:评估在恒定区具有异源半胱氨酸置换的抗体的T细胞激活
如实施例13-4中那样评估T细胞激活。
结果,如图27所示,与OKT3相比,在抗体的两个恒定区具有不同半胱氨酸置换的OKT3变体大大增加了T细胞活化状态。该结果显示,即使Fab之间的不同半胱氨酸置换也能够使Fab交联并增强CD3激动剂活性。
[实施例15]评估在Fab内具有电荷修饰的抗体的CD3激动剂活性
实施例15-1:制备在恒定区具有带电荷氨基酸置换的抗体
对抗人CD3激动剂抗体OKT3(重链:OKT3VH0000-G1T4(SEQ ID NO:1007),轻链:OKT3VL0000-KT0(SEQ ID NO:1008))的重链进行了研究,其中在结构上暴露于表面的任意氨基酸残基被带电荷氨基酸置换。
用精氨酸(R)或赖氨酸(K)置换OKT3重链恒定区1(G1T4k,SEQ ID NO:1015)中的氨基酸残基,以制备表50中所示的OKT3重链恒定区变体。将这个OKT3重链恒定区变体与OKT3重链可变区(OKT3VH0000,SEQ ID NO:1010)连接以制备OKT3重链变体1,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。类似地,用天冬氨酸(D)或谷氨酸(E)置换OKT3重链恒定区2(G1T4h,SEQ ID NO:1016)中的氨基酸残基,以制备表51中所示的OKT3重链恒定区变体。将这些OKT3重链恒定区变体各自与OKT3重链可变区(OKT3VH0000,SEQ IDNO:1010)连接以制备OKT3重链变体2,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。应当注意的是,本实施例中的重链恒定区1和2的CH3区引入了杵臼(KiH)修饰,以促进异二聚化。
[表50]
[表51]
将以上制备的OKT3重链变体1和OKT3重链变体2与OKT3轻链组合,并且表52所示的OKT3变体是使用FreeStyle293细胞(Invitrogen)或Expi293细胞(Life Technologies)通过本领域技术人员已知的方法通过瞬时表达而表达的,并通过本领域技术人员已知的方法用蛋白质A进行纯化。进一步地,类似地制备抗KLH抗体IC17(重链:IC17HdK-G1T4(SEQ IDNO:1013),轻链:IC17L-k0(SEQ ID NO:1014))作为阴性对照。
[表52]
实施例15-2 Jurkat细胞悬浮液的制备
如实施例13-2那样制备Jurkat细胞悬浮液。
实施例15-3:发光试剂溶液的制备
如实施例13-3那样制备发光试剂溶液。
实施例15-4:评估在恒定区被除半胱氨酸以外的氨基酸置换的抗体的T细胞激活
如实施例13-4中那样评估T细胞激活。
结果,如图28所示,与OKT3相比,在一个恒定区引入带正电荷的氨基酸置换而在另一恒定区引入带负电荷的氨基酸置换的OKT3变体大大增加了T细胞的活化状态。同时,与OKT3相比,在一个恒定区引入带正电荷或负电荷的氨基酸置换而在另一恒定区没有修饰的OKT3变体几乎不改变T细胞活化状态。该结果显示,不仅半胱氨酸置换而且带电荷氨基酸置换也可以通过非共价键使Fab交联并增强CD3激动剂活性。
[实施例16]评估在Fab内具有半胱氨酸置换并且在铰链区中缺乏二硫键的抗体的CD3激动剂活性
实施例16-1:制备在Fab内具有半胱氨酸置换并且在铰链区中缺乏二硫键的抗体
对抗人CD3激动剂抗体OKT3(重链:OKT3VH0000-G1T4(SEQ ID NO:1007),轻链:OKT3VL0000-KT0(SEQ ID NO:1008))的重链进行了研究,其中除去了铰链区中的二硫键并且在结构上暴露于表面的氨基酸残基被半胱氨酸置换。
用丝氨酸置换OKT3重链恒定区(G1T4,SEQ ID NO:1009)的铰链区的半胱氨酸,以制备表53中所示的OKT3重链恒定区变体。用半胱氨酸置换这些OKT3重链恒定区变体的位置191(EU编号)处的氨基酸残基,以制备表54中所示的OKT3重链恒定区变体。将这些OKT3重链恒定区变体各自与OKT3重链可变区(OKT3VH0000,SEQ ID NO:1010)连接以制备OKT3重链变体,并且通过本领域技术人员已知的方法制备编码相应基因的表达载体。
[表53]
[表54]
将以上制备的OKT3重链变体与OKT3轻链组合,并且表55所示的OKT3变体是使用FreeStyle293细胞(Invitrogen)或Expi293细胞(Life Technologies)通过本领域技术人员已知的方法通过瞬时表达而表达的,并通过本领域技术人员已知的方法用蛋白质A进行纯化。进一步地,类似地制备抗KLH抗体IC17(重链:IC17HdK-G1T4(SEQ ID NO:1013),轻链:IC17L-k0(SEQ ID NO:1014))作为阴性对照。
[表55]
实施例16-2 Jurkat细胞悬浮液的制备
如实施例13-2那样制备Jurkat细胞悬浮液。
实施例16-3:发光试剂溶液的制备
如实施例13-3那样制备发光试剂溶液。
实施例16-4:评估在Fab内具有半胱氨酸置换并且在铰链区中缺乏二硫键的抗体的T细胞激活
如实施例13-4中那样评估T细胞激活。
结果,如图29所示,与OKT3相比,仅去除了铰链区中的二硫键的OKT3变体减少或几乎不改变T细胞活化状态。另一方面,与OKT3相比,去除了铰链区中的二硫键并在恒定区引入半胱氨酸置换的OKT3变体大大提高了T细胞活化状态。该结果表明,即使当铰链区中没有二硫键时,Fab内的半胱氨酸置换也能够使Fabs交联并增强CD3激动剂活性。
[实施例17]修饰抗体的表达载体的制备,以及修饰抗体的表达和纯化
使用PCR,In-Fusion Advantage PCR克隆试剂盒(TAKARA)等通过本领域技术人员已知的方法,对插入动物细胞表达载体中的抗体基因进行氨基酸残基序列置换,以构建修饰抗体的表达载体。通过本领域技术人员已知的方法确定所得表达载体的核苷酸序列。将产生的表达载体瞬时导入
[实施例18]双特异性抗体的制备
将纯化的抗体透析到TBS或PBS缓冲液中,并将其浓度调整为1mg/mL。制备10x反应缓冲液250mM 2-MEA(SIGMA)。将实施例17中制备的两种不同的同型二聚体抗体等量混合。向该混合物中,加入1/10体积的10x反应缓冲液并混合。使混合物在37℃下静置90分钟。反应后,将混合物透析到TBS或PBS中以获得双特异性抗体的溶液,其中上述两种不同的抗体被异二聚化。通过上述方法测量抗体浓度,并将抗体进行后续实验。
[实施例19]激动剂活性的评估
实施例19-1 Jurkat细胞悬浮液的制备
从烧瓶中收集Jurkat细胞(TCR/CD3效应细胞(NFAT),Promega)。用测定缓冲液(RPMI 1640培养基(Gibco),10%FBS(HyClone),1%MEM非必需氨基酸(Invitrogen)和1mM丙酮酸钠(Invitrogen))洗涤细胞,然后以3x10
实施例19-2:发光试剂溶液的制备
将100mL的Bio-Glo萤光素酶测定缓冲液(Promega)添加到Bio-Glo萤光素酶测定底物(Promega)的瓶中,并颠倒混合。将瓶避光,并在-20℃冷冻。对该发光试剂溶液进行后续实验。
实施例19-3 T细胞激活测定
基于萤光素酶发光的倍数变化,评估通过激动剂信号传导的T细胞激活。前述Jurkat细胞是用具有NFAT响应序列的萤光素酶报道基因转化的细胞。当细胞被抗TCR/CD3抗体刺激时,NFAT途径通过细胞内信号传导被激活,从而诱导萤光素酶表达。将如上所述制备的Jurkat细胞悬浮液以每孔10μL(3x10
[实施例20]使用Jurkat细胞评估CD3双互补位抗体的激动剂活性
根据实施例17、18和19制备抗体并评估其活性。该实施例中使用的抗体示于表56中。
[表56]
结果,与缺少额外二硫键的双特异性抗体相比,具有连接两种类型抗CD3双特异性抗体的Fab-Fab的额外二硫键的修饰分子显示出变化的CD3介导的信号传导,如图30所示。
该结果表明,引入本发明的修饰能够增强或减少具有针对相同靶标的不同表位的双特异性抗原结合分子所具有的激动剂活性。
[实施例21]使用Jurkat细胞评估CD137激动剂活性
根据实施例17、18和19制备抗体并评估其活性。在本实施例中使用的抗体如下:普通的抗CD137抗体,在其重链恒定区中引入了促进抗体缔合(六聚化)的突变的抗体,以及通过用额外二硫键将上述每个抗体的Fab-Fab相连而制备的修饰抗体。
基于萤光素酶发光的倍数变化,评估通过激动剂信号传导的T细胞激活。GloResponseTM NF-κB-Luc2/4-1BB Jurkat细胞系(Promega)的细胞是用具有NFAT响应序列的萤光素酶报道基因转化的细胞。当细胞被抗CD137抗体刺激时,NFAT途径通过细胞内信号传导被激活,从而诱导萤光素酶表达。将用测定培养基(99%RPMI,1%FBS)以2x10
结果,与普通的抗CD137抗体相比,引入了六聚化修饰的抗体显示出增加的激动剂活性。此外,在修饰的抗体(其中每个抗体都被引入了额外的二硫键)中,观察到了激动剂活性的协同增加。
该结果表明,引入本发明的修饰可以增强抗CD137激动剂抗体的活性。
[实施例22]使用Jurkat细胞评估CD3//PD1双特异性抗体的激动剂活性
实施例22-1
根据实施例17、18和19制备抗体并评估其活性。该实施例中使用的抗体示于表58中。
[表58]
结果,在由抗CD3抗体和抗PD1抗体的组合组成的多个双特异性抗体中,与缺少额外的二硫键的双特异性抗体相比,带有连接Fab-Fab的额外二硫键的修饰分子显示了CD3和/或PD1介导的信号传导的很大变化,如图31所示。
该结果表明,引入本发明的修饰能够增强或减少抗原结合分子例如抗体所具有的激动剂活性。
实施例22-2
根据实施例2、3和4制备抗体并评估其活性。该实施例中使用的抗体示于表59中。
[表59]
PD-1激动剂信号传导的存在与否是通过当PD-1在SHP2附近时来自BRET的荧光信号(618nm)与来自作为供体的SHP2的发光(460nm)之比来评估的。在测定前一天,将表达PD-L1的抗原呈递细胞(Promega,#J109A)以4.0x10
平均mBU
结果,在由抗CD3抗体和抗PD1抗体组成的双特异性抗体中,与缺少额外的二硫键的双特异性抗体相比,带有连接Fab-Fab的额外二硫键的修饰分子显示了CD3和/或PD1介导的信号传导的很大变化,如图32所示。
[实施例23]评估CD28/CD3钳制双特异性抗体的激动剂活性
实施例23-1:实时细胞生长抑制测定(xCELLigence测定)
抗体是根据实施例17和18制备的。该实施例中使用的抗体示于表60中。
[表60]
抗体的T细胞依赖性癌细胞生长抑制作用是使用xCELLigence RTCA MP仪器(ACEABiosciences)进行评估的。将被迫表达Glypican-3(GPC3)(SEQ ID NO:1241)的人肝癌细胞系SK-Hep-1的细胞(SK-pca31a)用作靶细胞,并将人外周血单核细胞(PBMC:CellularTechnology Limited(CTL))用作效应细胞。将1×10
CGI(%)=100-(CI
在以上等式中,“CIAb”是添加抗体后72小时的孔的细胞指数(用xCELLigence测量的细胞生长指数)。此外,“CI
实施例23-2:细胞因子产生测定
如下所述评估抗体从T细胞的细胞因子产生。
将SK-pca31a用作靶细胞,并将PBMC(Cellular Technology Limited(CTL))用作效应细胞。将1×10
结果
组合使用CD28/CD3钳制双特异性抗体和GPC3/结合减弱的CD3双特异性抗体不会导致细胞生长抑制作用。但是,通过在CD28/CD3钳制双特异性抗体的Fab-Fab之间引入额外的二硫键进行修饰,观察到了对癌细胞生长的抑制作用(图33和图35)。进一步地,当将引入有上述修饰的CD28/CD3钳制双特异性抗体和GPC3/结合减弱的CD3双特异性抗体与表达GPC3的株系和PBMC共培养时,观察到细胞因子的产生;然而,仅将引入有上述修饰的CD28/CD3钳制双特异性抗体和GPC3/结合减弱的CD3双特异性抗体添加到PBMC不会导致细胞因子的产生(图34和图36)。因此,表明了引入有上述修饰的CD28/CD3钳制双特异性抗体和GPC3/结合减弱的CD3双特异性抗体对抑制癌细胞生长和诱导T细胞中细胞因子产生的作用取决于癌抗原的表达。
[实施例24]评估CD8/CD28双特异性抗体的激动剂活性
抗体是根据实施例17和18制备的。该实施例中使用的抗体示于表61中。
[表61]
从健康志愿者血液样品中分离的人外周血单核细胞(PBMC)用于评估制备的样本。将肝素(0.5mL)与50mL血液混合,并进一步用50mL PBS稀释。通过以下两个步骤分离人PBMC。在步骤1中,将添加了Ficoll-Paque PLUS(GE Healthcare)的Leucosep(greinerbio-one)在室温下以1000xg离心1分钟,然后向其中加入用PBS稀释的血液,并将混合物在室温下以400xg离心30分钟。在步骤2中,离心后从管中收集血沉棕黄层,然后用60mL PBS(Wako)洗涤。用培养基(5%的人血清(SIGMA),95%的AIM-V(Thermo FischerScientific))将分离的人PBMC调整至1x 10
两天后,从接种的细胞中去除培养基,并用500μLPBS洗涤细胞,然后使用细胞消化液(accutase)(nacalai tesque)收集细胞。接下来,将细胞用经PBS稀释的ViaFluor 405(Biotium)溶液调节至1x 10
培养结束后,使用流式细胞仪(BD LSRFortessa(TM)X-20(BD Biosciences))(FCM)研究生长细胞的百分比。根据减少的ViaFluor 405荧光强度的百分比计算生长细胞的百分比。荧光标记的抗CD8α抗体,抗CD4抗体,抗Foxp3抗体等用于进行用CD8α阳性T细胞和调节性T(Treg)细胞的分析。结果,在一些样本中观察到活性增加,如图37所示。
[实施例25]评估引入的半胱氨酸之间的二硫键形成
通过将半胱氨酸引入人源化模型抗体的轻链和重链中来制备修饰的抗体,并评估新引入的半胱氨酸之间二硫键的形成。通过以下来进行评估:将样品抗体在20mM磷酸盐缓冲液(pH 7.0)中与胰凝乳蛋白酶一起温育,并使用LC/MS检测推测为由每种抗体的氨基酸序列产生的肽的质量。每种抗体是根据实施例17和18制备的。本实施例中使用的抗体示于表62中。
[表62]
首先,分析了其中轻链的位置126(Kabat编号)处的赖氨酸被半胱氨酸置换的不同亚类(IgG1,IgG2和IgG4)的修饰抗体。结果,在所有分析的抗体中,检测到了对应于在位置126处的半胱氨酸之间具有二硫键的肽的理论质量的成分,如表63所示。此外,当将具有二硫键还原作用的三(2-羧乙基)膦添加到IgG1样品中时,该成分消失,表明该肽中位置126处的半胱氨酸之间形成了二硫键。同时,表明亚类的差异不影响该二硫键的形成。
[表63]
n.d.:未检出
接下来,对修饰抗体进行分析,在所述修饰抗体中IgG1重链的位置162(EU编号)处的丙氨酸或位置191(EU编号)处的丝氨酸被半胱氨酸置换。结果,检测到与在导入的半胱氨酸之间具有二硫键的肽的理论质量相对应的成分,分别如表64和65所示。此外,当将三(2-羧乙基)膦添加到引入了191位半胱氨酸的修饰抗体的样品中时,该成分消失(表65)。以上表明了,在还引入了重链中的半胱氨酸之间形成了二硫键。
[表64]
[表65]
n.d.:未检出
尽管出于清楚理解的目的,已经通过图示和实施例的方式详细地描述了前述发明,但是描述和实施例不应被解释为限制本发明的范围。本文引用的所有专利和科学文献的公开内容明确地通过引用整体并入。
[工业适用性]
在非限制性实施方案中,本公开的抗原结合分子是有用的,因为它能够将多个抗原分子保持在空间上接近的位置,调节多个抗原分子之间的相互作用,和/或调节通过相互缔合而被激活的多个抗原分子的激活。在其他实施方案中,本公开的抗原结合分子是有用的,因为与常规的抗原结合分子相比,其具有增加的对蛋白酶切割抗性。
- 包含对抗原的结合活性因MTA而变化的抗原结合结构域的抗原结合分子及用于获得该抗原结合结构域的文库
- 包含两个彼此连接的抗原结合结构域的抗原结合分子
