包括类器官腔室的设备及其用于培养、维持、监测或测试类器官的用途
文献发布时间:2023-06-19 13:30:50
本申请要求2021年6月30日提交的美国临时申请63/046,435的权益,该美国临时申请的全部内容以引用方式并入本文。
技术领域
所公开的主题涉及用于培养、维持、监测或测试类器官和组织的设备领域。
背景技术
准确检测毒性和功效,特别是对心脏的毒性和功效的能力仍然是新药开发中的相当大的挑战。开发有效疗法需要人类心脏病模型,而现有模型是不完善的,正如在模型系统中显示出前景的化合物在临床试验中未能表现出功效的频率所证明的。此外,心脏毒性已导致候选化合物以及上市后药物的大量损耗,从而导致了药物开发的过高成本[1,2]。由于与传统的实验动物模型相比,人类心脏生理学存在固有的根本差异,所以研究人员已经致力于开发使用来自人类多能干细胞(human pluripotent stem cell)的心肌细胞的体外模型,所述体外模型能够更好地预测人类对感兴趣化合物的特异性反应[3]。
虽然多年来已经开发了许多此类体外人类干细胞模型,但是大多数都集中在最低限度地概括心脏功能的简单的设计。所述模型具有有限的输出,所述输出可能不足以研究对感兴趣化合物的反应。例如,单层心肌细胞可用于研究心脏电生理学,但在研究需要收缩力的量度的肌力药的能力方面受限。简单3D模型,例如心脏组织条,可用于研究发育力的变化,但缺乏更临床相关的输出,例如压力-体积关系、射血分数和搏出功。生理相关性的缺乏也限制了模型概括功效测试所需的许多疾病表型的能力,特别是因为心脏疾病往往不可避免地与心脏上的血液动力学负荷条件联系在一起。因此,需要生物学上更复杂的心脏模拟人类体外模型,所述模型可以在药物开发和疾病建模方面提供额外的见解[4]。
一种此类模型是心脏类器官腔室(cardiac organoid chamber,COC),所述心脏类器官腔室由具有中空中心的3D形状心脏组织组成。通过进入COC的内部体积,所述模型可以产生用于研究心脏生理学和病理生理学的临床相关输出。然而,COC的制造和培养是复杂且微妙的过程,并且使用COC执行实验呈现出重大的技术挑战。此外,当前的COC设计具有单一入口/出口,并且因此无法独立控制入口条件(前负荷)和出口条件(后负荷),这可能对研究各种形式的心衰是至关重要的。本文描述了一种生物反应器系统设计,所述生物反应器系统设计改善了类器官腔室(organoid chamber,OC)(包括心脏类器官腔室(COC))的制造、培养和测试。
发明内容
本公开提供了用于在促进类器官和组织,特别是那些来源于中空器官的类器官和组织的形成的环境中培养细胞的通用设备,其更接近地模拟在体内发现的天然存在的器官和组织。因此,所述设备可用于产生和维持类器官和组织,以及提供用于监测活体材料的发育和/或行为和用于测试该材料(例如通过观察添加的化合物的效应或生物物理刺激的效应,如,电、机械、pH、容量渗透摩尔浓度、温度、激素等)的包含环境(containedenvironment)。例如,电刺激可涉及递送至类器官和/或组织的起搏脉冲。模块化设计在将制造成本保持最低的同时增加了设备的多功能性。
用于制造和测试类器官腔室(OC)的生物反应器包括引导流体流进入和离开OC的顶部区段、保持OC的中间区段和用于保持包围和滋养OC的培养基的底部区段。附加部件可包括以下中的任一者:用于对OC进行电刺激的系统、用于测量OC的压力、体积和/或电生理学变化的系统,以及用于控制施加在OC上的前负荷和后负荷的系统。示例性的OC是心脏类器官腔室(COC)。
生物反应器的顶层包含入口和出口,所述入口和出口通过中间层向OC的内部体积进料。一个或多个瓣膜将入口和出口分开,这允许独立控制在入口处施加的压力(即,前负荷)和在出口处施加的压力(即,后负荷)。本领域中已知的与生物反应器配置相容的任何瓣膜类型都被认为适合于包含在生物反应器中。此类系统使得能够独立控制OC的前负荷和后负荷,这可用于研究病理状态,例如具有保留射血分数的心衰(heart failure withpreserved ejection fraction,HFpEF)。
在一些示例性实施方式中,集成瓣膜已被开发成将致动压力与OC的扩展压力(developed pressure)相匹配。每个瓣膜都由弹性体材料薄片组成,所述弹性体材料薄片经切割以允许所述片的局部位移,所述片夹在用作瓣膜层的背衬的两层刚性塑料片之间。刚性背衬具有切割开口,所述切割开口在瓣膜的一侧上相对于另一侧不同以使流体流动能够优先在一个方向上发生。瓣膜的特性和/或几何形状可经修改以研究病理状态,例如瓣膜狭窄。
生物反应器经设计为允许在没有附接顶层的情况下制造和培养OC。模块化设计允许通过培养多个无顶层的OC来增加生产量。通过使用简单的附接机构(例如,鲁尔接头(luer fittings),例如鲁尔滑动接头),当需要测试OC时,可容易地附接顶层。此类机构使得能够实现纵向研究,因为顶层可以脱离并且OC可以返回到培养箱达延长的培养时段。
在一个方面中,本公开提供了一种用于源自中空器官的类器官或组织的生物反应器,所述生物反应器包括:(a)顶层,所述顶层用于引导流体流进入和/或离开包括类器官或组织的类器官腔室;(b)中间层,其中所述中间层包括用于所述类器官腔室的附接点;以及(c)底层,所述底层包括用于培养流体的贮存器;其中所述顶层和所述中间层流体连通成能够交换内部流体(相对于类器官腔室),其中所述顶层、所述中间层和所述底层流体连通成能够交换外部流体(相对于类器官腔室);并且其中所述类器官或组织包括在内部流体与外部流体之间的阻挡层。在一些实施方式中,用于类器官腔室的附接点包括平头针,所述平头针的一个末端附接至中间层并且另一个末端附接至类器官腔室。在一些实施方式中,所述类器官腔室还包括弹性体衬里材料,所述弹性体衬里材料在所述内部流体与所述外部流体之间提供不可渗透的阻挡层。在一些实施方式中,弹性体材料是气囊。在一些实施方式中,类器官或组织来源于心脏、肺、胆囊、膀胱、血管、淋巴管、输尿管、尿道、小肠或结肠或其他中空器官或组织的细胞。在一些实施方式中,细胞来源于多能干细胞。在一些实施方式中,顶层包括底表面,所述底表面包括终止顶层中的流体通道的鲁尔接头(例如,公或母鲁尔滑动末端),其中所述鲁尔接头(例如,公或母鲁尔滑动末端)连接至中间层的顶表面(例如,互补的鲁尔滑动末端),从而提供用于顶层与中间层之间的流体连通的通道。在一些实施方式中,所述顶层中的所述流体通道终止于所述顶层的顶表面中的入口端口和出口端口。在一些实施方式中,所述生物反应器还包括用于将所述入口端口连接至外部流体管线的第一无凸缘接头和用于将所述出口端口连接至第二外部流体管线的第二无凸缘接头。在一些实施方式中,所述生物反应器还包括至少一个瓣膜,所述至少一个瓣膜用于控制所述顶层中的所述通道中的流体的流动。在一些实施方式中,所述至少一个瓣膜允许从所述入口端口至所述出口端口的单向流体流动。在一些实施方式中,生物反应器还包括两层塑料(例如,聚碳酸酯)或金属片,瓣膜层包含在其间,其中所述瓣膜层包括至少一个瓣膜以控制流体的流动。在一些实施方式中,垫圈插置在瓣膜层与每层塑料或金属片之间。在一些实施方式中,两层塑料或金属片和瓣膜层使用紧固件、溶剂、密封剂或胶水附接。在一些实施方式中,紧固件是单独使用或以任何组合使用的螺钉(screw)、螺纹嵌件(threaded insert)、螺母圈套(nut trap)、夹具(clamp)、闩锁(latch)、卡扣配件(snap fitting)或按压配件(pressfitting)。
在一些实施方式中,顶层还包括用于测量设备的测量通道,其中所述测量通道与顶层的内部流体通道流体连通,并且其中所述测量通道终止于测量端口中顶层的侧表面处。在一些实施方式中,测量通道包括测量设备。在一些实施方式中,测量设备是压力传感器。在一些实施方式中,活细胞在弹性气囊周围形成类器官或至少一个组织。在一些实施方式中,生物反应器还包括平头针,所述平头针终止于类器官腔室的内部体积中并且穿过生物反应器的中间层。在一些实施方式中,中间层的底表面包括凹槽。在一些实施方式中,中间层的底表面和底层的顶表面提供相对于彼此配准(register)表面的配合表面。在一些实施方式中,中间层的底表面包括凹槽并且底层的顶表面包括与包括凹槽的中间层的底表面互补的配合表面,或者其中底层的顶表面包括凹槽并且中间层的底表面包括与包括凹槽的底层的顶表面互补的配合表面。在一些实施方式中,中间层由单片塑料(例如,聚碳酸酯)或金属制成。在一些实施方式中,中间层还包括灌注入口端口和灌注出口端口。在一些实施方式中,中间层还包括电气系统,所述电气系统包括至少一个电极,其中每个电极被定位成向类器官腔室提供电刺激,电记录来自类器官腔室的信号,或两者。在一些实施方式中,至少一个电极与类器官腔室接触。在一些实施方式中,每个电极由碳、铂、金或本领域已知的与活细胞的电刺激相容的任何导电材料制成。在一些实施方式中,两个电极设置为彼此呈180度。在一些实施方式中,每个电极由至少一个O形环定位。在一些实施方式中,所述至少一个电极是双极电极,所述双极电极(a)与包括类器官或至少一个组织的类器官腔室的外表面接触,或者(b)集成到平头针附接到中间层的点中。在一些实施方式中,中间层还包括用于感测类器官腔室的类器官或组织中的电生理变化的系统。
在一些实施方式中,底层包括与类器官腔室的外部接触的培养流体。在一些实施方式中,底层由生物相容且光学透明的材料组成。在一些实施方式中,材料是丙烯酸类、聚苯乙烯、玻璃或聚碳酸酯。在一些实施方式中,底层还包括至少一个用于观察类器官腔室的平坦窗。应当理解的是,在底层中包括观察窗的生物反应器可以是透明的、半透明的或不透明的。在一些实施方式中,底层包括至少一个端口、至少一个瓣膜、或至少一个端口和至少一个瓣膜,其中所述至少一个端口和/或至少一个瓣膜允许交换流体或添加至少一种化合物。在一些实施方式中,底层包括用于刺激类器官或组织的电极。在一些实施方式中,不同层的流体通道使用鲁尔接头、螺纹连接器、磁性连接器或卡扣配合几何设计连接。在一些实施方式中,顶层的底表面处的公鲁尔滑动末端连接到中间层的顶表面处的母鲁尔锁定末端,并且可以设想切换公鲁尔锁定末端和母鲁尔锁定末端的实施方式。在一些实施方式中,中间层和底层足以在培养箱中培养类器官或组织。在一些实施方式中,生物反应器还包括用于测量类器官或组织的电生理特性的系统。在一些实施方式中,该系统包括至少一个感测电极,所述至少一个感测电极用于测量类器官腔室中的类器官或组织的细胞外电位。在一些实施方式中,感测电极与类器官腔室的内部或外部直接接触。在一些实施方式中,存在多个不直接接触类器官腔室的感测电极,其中所述多个感测电极检测来自类器官腔室的电信号。
本公开的另一个方面涉及本文所公开的生物反应器用于培养、维持、刺激、监测或测定类器官腔室中的类器官或组织的用途。在示例性实施方式中,生物反应器可用于通过使用与要建模的疾病(例如人类疾病,例如心脏病)相关联的细胞和组织发育类器官和组织来对疾病过程进行建模。包括患病类器官或组织的生物反应器可用于监测疾病进展以及测试或测定候选疗法的功效。在一些实施方式中,所述用途延伸至将化合物(已被证明对治疗疾病有效的候选治疗剂或化合物)添加到培养基中并观察对类器官或组织的效应,从而测定所述化合物的生物效应,例如毒性(例如,器官毒性)。
在一些实施方式中,效应是改变的类器官或组织刚性、压力、体积或生长率。在一些实施方式中,该效应是电生理学的改变。在一些实施方式中,类器官或组织是心脏类器官或组织。
本公开的又一方面是一种用于测量类器官腔室的体积或所经受的压力的系统,所述系统包括本文所公开的生物反应器和测量设备。在一些实施方式中,用于测量体积的设备是相机、放置到类器官腔室的内部体积中的压力-体积导管、用于测量内部流体流量的流量计、或用于对类器官腔室成像的超声波换能器。在一些实施方式中,用于测量体积的设备是相机,所述系统还包括至少一个附接到类器官腔室的表面的基准标记物。在一些实施方式中,光学地或磁性地跟踪至少一个基准标记物。
本公开的又一方面是一种用于控制类器官腔室内的压力的系统,所述系统包括本文所公开的生物反应器和压力控制器,所述压力控制器附接至顶层的入口端口、顶层的出口端口、或顶层的入口端口和出口端口两者,以调节施加至类器官腔室的流体压力。在一些实施方式中,类器官是心脏类器官,并且施加到类器官腔室的压力是自动控制的。在一些实施方式中,压力经动态控制以模拟心脏生理学。在一些实施方式中,使用流体静压或使用至少一个流体泵来控制压力。
通过参考以下详细描述,将更好地理解本公开的其他特征和优点。
附图说明
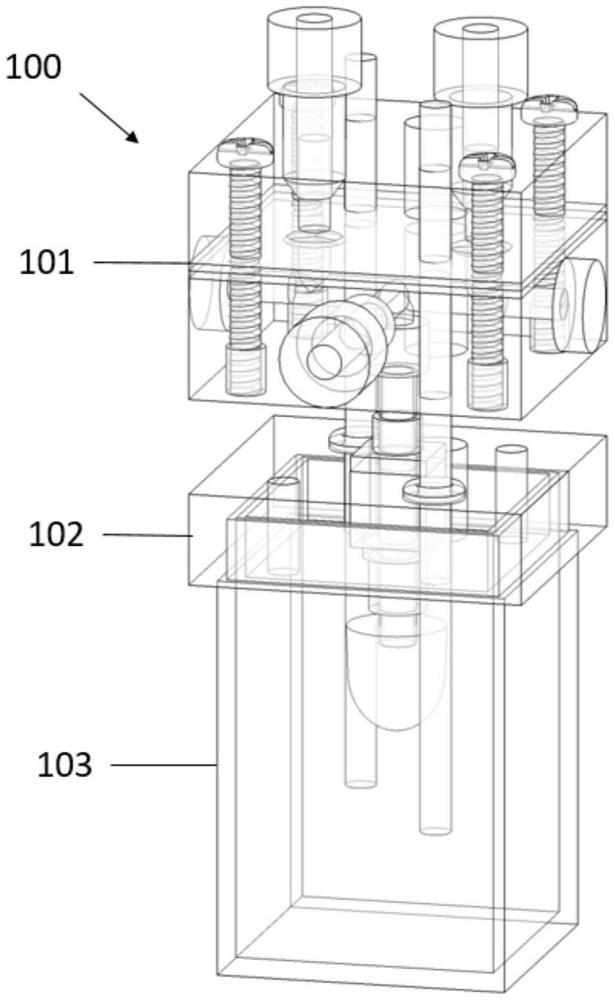
图1示出了组装形式的类器官腔室(OC)生物反应器。
图2示出了OC生物反应器的顶层。
图3示出了OC生物反应器的中间层。
图4示出了组装形式的OC生物反应器的横截面图。
图5示出了具有OC培养所需的最少部分的OC生物反应器。
具体实施方式
本公开提供了用于开发、监测和测试来源于中空器官的类器官和组织的通用、紧凑平台,所述平台通过保持类器官或组织的中空内部来模拟这些器官的自然环境。所述平台提供了设备,所述设备允许培养基改变;向被递送到类器官/组织的培养基进行添加;监测类器官/组织的外观、大小、收缩性、泵功能和电生理学;对类器官/组织进行电刺激;以及对类器官/组织中的机械和电生理学变化进行检测,所有这些都在可以经济且快速地生产以用于单次或多次使用的设备中实现。在本公开的各个方面的以下描述中,参考了附图。
图1示出了类器官腔室(OC)生物反应器100由以下3个主要层组成:顶层101,所述顶层引导流体流进入和离开OC 300(参见图3);中间层102,所述中间层保持OC 300;和底层103,所述底层保持用于在OC 300内培养类器官或一个或多个组织的培养基。所述生物反应器经设计用于制造、培养和测试心脏类器官或任何其他中空器官或组织(例如,心脏、肺、胆囊、膀胱、血管、淋巴管、小肠、结肠等),所述心脏类器官或任何其他中空器官或组织涉及类器官或组织的内部和外部体积的单独进入。
顶层101作为单元控制内部流体的流动。底层103用作流体400的贮存器(参见图4),所述流体在一些实施方式中是用于培养OC 300的类器官或组织的培养基。中间层102的主要功能是作为OC 300与生物反应器100的最终附接点。类器官在中间层102的底部处围绕平头针301(参见图3)的末端生长,并且在整个培养和测试时段期间保持附接在那里。平头针301是中间层102的一部分,并且因此OC 300被认为是中间层102的一部分。
在位置上,OC 300确实占据了底层103的内部空腔。然而,当三个层分离时,OC 300保持锚定至中间层102,如图3A所示。类似地,电极306(图3A)延伸至顶层101和底层103两者中,但是当各层分开时所述电极保持附接至中间层102。
参照图2,OC生物反应器100的顶层101具有使溶液流入和流出OC 300的内部体积所需的流体部件(参见图3A)。在一些实施方式中,OC 300包含类器官和/或组织,并且在一些实施方式中,OC 300还包括非生物衬里材料(例如,支撑材料),例如弹性体材料,例如弹性气囊。公鲁尔滑动末端200定位在顶层101的底表面处,终止顶层101中的流体通道。公鲁尔滑动末端200连接至中间层102的顶表面,以提供用于顶层101与中间层102之间的流体连通的通道。当公鲁尔滑动末端200连接至中间层102时,建立了在顶层101与中间层102之间的流体连通通道。顶层101的底部开口是流体连通通道的一部分,该部分分支到顶层101的顶表面上的两个开口,并且这两个开口用作内部流体的入口201和出口202。瓣膜203或多个瓣膜调节流体从入口201至出口202的流动。瓣膜203允许流动优先发生在一个方向上(即,从入口201朝向出口202),并且还使得在入口和出口处的独立压力负荷。顶层101包含测量通道,所述测量通道用于放置或插入测量设备,例如用于测量OC生物反应器100内的压力的压力传感器。测量通道终止于测量端口204中的顶层101的表面,例如侧表面处。
在该实施方式中,顶层101包括两层带有瓣膜层的聚碳酸酯片。瓣膜层定位在两个聚碳酸酯片之间。瓣膜本身在瓣膜层的内部(并且因此在顶层的内部),但是瓣膜层是作为顶层的一部分堆叠的。瓣膜层由本领域已知的弹性体材料薄片制成,所述弹性体材料为例如聚二甲基硅氧烷(PDMS)或类似弹性体,具有允许流体在一个方向上穿过但阻止相反方向上的流体流动的孔径或其他特征。使用CNC镂铣机(router)、铣床或类似的制造方法将聚碳酸酯片铣削成所需的设计。这三个层使用紧固件紧固在一起,所述紧固件为例如螺钉205和螺纹嵌件或螺母圈套206。可以在所述层中的各层之间放置垫圈,以创建密封的不透液系统。在其他实施方式中,使用粘合剂或密封剂。入口201和出口202使用无凸缘接头207连接至外部流体管线。竖直通孔208存在于顶层101上,以用于至少一个起搏电极306(优选地一对起搏电极)和用于进入OC 300的外部体积的进料/取出端口209。
参照图3,OC生物反应器100的中间层102在培养和测试期间将OC 300保持在适当的位置。类器官或组织(例如心脏类器官)在气囊周围形成以产生OC 300。气囊附接至定位在底层103中的平头针301的末端。因此,平头针301突出穿过底层103的顶表面和中间层102的底表面。平头针301的另一末端是用于连接至OC生物反应器100的顶层101的鲁尔接头,例如母鲁尔锁定末端302。在一些实施方式中,中间层102直接定位在底层103的顶部上。在中间层102的底表面上,凹槽303优选经铣削以配合底层103的顶表面。
在该实施方式中,中间层102是使用CNC镂铣机由单片聚碳酸酯制成的。中间层102可具有灌注入口端口304和/或灌注出口端口305,以用于交换来自底层103的培养基,即,流体与OC 300的外部流体连通。另外,中间层102可以具有与顶层101中的类似进料/取出端口209对齐的进料/取出端口308,以允许流体400(例如,培养基)从顶层101进入底层103中。顶层101的入口端口201和出口端口202提供了与OC 300的内部接触的流体连通通道。在该实施方式中,如图3B所示,单独的入口灌注端口304和出口灌注端口305朝向中间层102的相对边缘定位。在一些实施方式中,灌注端口附接至适用于细胞培养的管道。中间层102可以具有用于对类器官或组织进行电刺激的系统。在这些实施方式中,每个电极306(例如,碳电极)定位为朝向并穿透中间层102的相对边缘,以在中间层102内包含的OC 300的相对侧上提供电刺激源。每个电极306使用至少一个O形环307保持在适当位置。在另一个实施方式中,使用用于对类器官或组织进行点刺激的系统。这种系统可以将双极电极直接定位到类器官或组织或OC 300的表面上,或者集成在OC 300与中间层102的附接点处。中间层102还可具有使用感测电极306以类似于心电图的方式来感测OC 300的类器官或组织的电生理学变化的系统。
参照图4,OC生物反应器100的底层103用于保持OC 300的外表面周围的流体400的体积。底层103可以由聚苯乙烯、玻璃、聚碳酸酯或任何生物相容且光学透明的材料制成。在一些实施方式中,底层103的顶表面具有延伸部401,所述延伸部按压配合到中间层102的底表面上的凹槽303中。在一些实施方式中,底层103具有至少一个平坦窗402,以用于从所述OC的侧面观察OC 300(即,正视图)。底层103内的流体400的体积可以通过降低底层103的高度来减小。或者,嵌件可以放置在底层103内部以取代流体体积。底层103可以具有其自身的端口或瓣膜系统,以用于交换流体或添加感兴趣化合物。底层103可以具有用于使用电极对类器官或组织进行电刺激的系统。在典型实施方式中,这些电极替代电极306。底层可以具有用于通过将感测电极定位在OC 300紧邻处来感测类器官或组织的电生理学变化的系统。
在各种实施方式中,在生物反应器100的各层中的流体通道之间进行本领域已知的任何无泄漏连接。优选地,这些连接是可逆的。在示例性实施方式中,顶层101的鲁尔接头(例如,公鲁尔滑动末端200)和中间层102的鲁尔接头(例如,母鲁尔锁定末端302)用作两层之间的安全但容易可逆的流体连接器。更一般地,本公开包括任何一组配合接头以建立无泄漏的流体通道,包括将公鲁尔滑动末端200放置在中间层102的顶表面上以与顶层101的底表面上的母鲁尔滑动末端302配合。可以使用其他附接方法,例如螺纹螺钉、磁性连接器,或者使用允许将各层扣合在一起的几何设计。经连接的流体系统在OC 300内创建了内部体积403,所述内部体积通过OC 300本身与外部体积400分开,所述OC可包括任何内部或外部非生物衬里材料与类器官或组织的组合,包括OC 300的壁。在一些实施方式中,衬里材料是类器官或组织的支撑材料。示例性衬里材料是弹性气囊,所述弹性气囊也可以用作类器官或组织的支撑材料。衬里材料(例如,支撑材料)存在于类器官或组织的制造或形成期间,并且可在OC 300的使用期间保留,例如在疾病建模中用于观察疾病进展、用于测试化合物的功效和/或用于测试化合物的毒性。在一些实施方式中,一旦完成了类器官或组织的制造,就去除非生物衬里材料(例如,支撑材料),并且在没有衬里材料的情况下执行对类器官或组织的监测或测试。
参照图5,OC生物反应器100可适于在仅使用中间层102和底层103的标准培养箱中培养OC 300内的类器官或组织。在一个示例性优选实施方式中,通过从中间层102的母鲁尔锁定末端302添加流体,可以在这种配置中向OC 300施加流体静压。或者,内部压力可以通过(例如,使用瓣膜)膨胀和密封OC 300来施加,例如在OC 300包括类器官和/或组织以及弹性材料(诸如气囊)的实施方式中。定制机架可用于运输和培养一系列OC生物反应器100,以实现多个OC 300的高通量制造和维护。
用于测量OC 300内的类器官或组织的电生理学的系统可以集成到OC生物反应器100中。这种系统将使用感测电极来测量OC 300中的类器官或组织的细胞外电位。在一个实施方式中,感测电极通过将所述电极接触或嵌入在OC 300的内表面上的气囊上或者通过将所述电极定位在OC 300的外表面上而与OC 300直接接触。在另一个实施方式中,感测电极定位在OC生物反应器100中而不与OC 300直接接触,并且电极以类似于心电图的方式感测来自OC 300的聚集电信号。
使用与OC生物反应器100相容的系统来测量OC 300的体积。在一个实施方式中,使用相机从OC的侧面对OC 300成像(即,正视图),以确定横截面投影面积。基于OC 300的几何形状,通过考虑OC的横截面积来计算OC的体积。在另一个实施方式中,压力-体积导管换能器被放置在OC 300的内部体积403内,以测量OC 300的体积。在另一个实施方式中,使用在线流量计测量内部流体的流量,以计算OC 300体积的变化。在另一个实施方式中,将基准标记物嵌入或附接至OC 300的表面(直接在组织上或者在气囊表面上),并且光学地、磁性地或者通过本领域中已知的任何方法跟踪以确定OC 300的体积。在另一个实施方式中,使用超声波换能器来对OC 300成像。在另一个实施方式中,使用基于激光的检测系统来监测OC300的大小和形状的变化。更一般地,使用本领域已知的任何方法或技术来检测或测量OC300的形状和/或体积的变化。
用于控制OC 300内的压力的系统可以集成到OC生物反应器100中。由于顶层101的设计提供了由一个或多个瓣膜分开的入口201和出口202,所以流体前负荷和后负荷可以被独立控制并施加至OC生物反应器100。在一个实施方式中,使用商用压力控制器来控制施加的压力。这种系统可以使所施加的压力的控制自动化,并施加模拟心脏生理学的动态压力。在另一个实施方式中,使用流体静压来控制所施加的压力。在另一个实施方式中,使用各种泵系统来控制所施加的压力。
参考文献
Shah,R.R.,Can pharmacogenetics help rescue drugs withdrawn from themarket?,Pharmacogenomics.7(2006)889-908.doi:10.2217/14622416.7.6.889
DiMasi,J.A.,Grabowski,H.G.&Hansen,R.W.Innovation in thepharmaceutical industry:New estimates of R&D costs.J.Health Econ.47,20-33(2016).
Mercola,M.,Colas,A.,Willems,E.,Induced pluripotent stem cells incardiovascular drug discovery,Circ.Res.112(2013)534-548.doi:10.1161/CIRCRESAHA.111.250266
Passier,R.,Orlova,V.,Mummery,C.,Complex Tissue and Disease Modelingusing hiPSCs.Cell Stem Cell 18,(2016)309-321.doi:10.1016/j.stem.2016.02.011
Li,R.A.,Keung,W.,Cashman,T.J.,Backeris,P.C.,Johnson,B.V.,Bardot,E.S.,Wong,A.O.T.,Chan,P.K.W.,Chan,C.W.Y.,Costa,K.D.,Bioengineering anelectromechanically functional miniature ventricular heart chamber from humanpluripotent stem cells.Biomaterials 163,(2018)116-127.doi:10.1016/j.biomaterials.2018.02.024
实施方式
实施方式1.一种用于源自中空器官的类器官或组织的生物反应器,所述生物反应器包括:
(a)顶层,所述顶层用于引导流体流进入和/或离开包括类器官或组织的类器官腔室;
(b)中间层,其中所述中间层包括用于所述类器官腔室的附接点;以及
(c)底层,所述底层包括用于培养流体的贮存器;
其中所述顶层和所述中间层流体连通成能够交换内部流体,
其中所述顶层、所述中间层和所述底层流体连通成能够交换外部流体;并且
其中所述类器官或组织包括在所述内部流体与所述外部流体之间的阻挡层。
实施方式2.根据实施方式1所述的生物反应器,其中所述类器官腔室还包括弹性体衬里材料,所述弹性体衬里材料在所述内部流体与所述外部流体之间提供不可渗透的阻挡层。
实施方式3.根据实施方式2所述的生物反应器,其中所述弹性体材料是气囊。
实施方式4.根据实施方式1所述的生物反应器,其中所述类器官或组织来源于心脏、肺、胆囊、膀胱、血管、淋巴管、输尿管、尿道、小肠或结肠的细胞。
实施方式5.根据实施方式4所述的生物反应器,其中所述细胞来源于多能干细胞。
实施方式6.根据实施方式1所述的生物反应器,其中所述顶层包括底表面,所述底表面包括终止所述顶层中的流体通道的鲁尔接头,其中所述鲁尔接头连接至所述中间层的顶表面,从而提供用于所述顶层与所述中间层之间的流体连通的通道。
实施方式7.根据实施方式6所述的生物反应器,其中所述顶层中的所述流体通道终止于所述顶层的顶表面中的入口端口和出口端口中。
实施方式8.根据实施方式7所述的生物反应器,所述生物反应器还包括用于将所述入口端口连接至外部流体管线的第一无凸缘接头和用于将所述出口端口连接至第二外部流体管线的第二无凸缘接头。
实施方式9.根据实施方式7所述的生物反应器,所述生物反应器还包括至少一个瓣膜,所述至少一个瓣膜用于控制所述顶层中的所述通道中的流体的流动。
实施方式10.根据实施方式9所述的生物反应器,其中所述至少一个瓣膜允许从所述入口端口至所述出口端口的单向流体流动。
实施方式11.根据实施方式9所述的生物反应器,所述生物反应器还包括两层塑料或金属片,所述两层塑料或金属片之间包含瓣膜层,其中所述瓣膜层包括至少一个瓣膜以控制流体的流动。
实施方式12.根据实施方式11所述的生物反应器,其中所述塑料片是聚碳酸酯片。
实施方式13.根据实施方式11所述的生物反应器,其中垫圈插置在所述瓣膜层与每层塑料或金属片之间。
实施方式14.根据实施方式11所述的生物反应器,其中所述两层塑料或金属片和所述瓣膜层使用紧固件、溶剂、密封剂或胶水附接。
实施方式15.根据实施方式14所述的生物反应器,其中所述紧固件是螺钉、螺纹嵌件、螺母圈套、夹具、闩锁、卡扣配件或按压配件。
实施方式16.根据实施方式1所述的生物反应器,其中所述顶层还包括用于测量设备的测量通道,其中所述测量通道与所述顶层的所述内部流体通道流体连通,并且其中所述测量通道终止于测量端口中所述顶层的侧表面处。
实施方式17.根据实施方式16所述的生物反应器,其中所述测量通道包括测量设备。
实施方式18.根据实施方式17所述的生物反应器,其中所述测量设备是压力传感器。
实施方式19.根据实施方式1所述的生物反应器,其中所述活细胞在所述弹性气囊周围形成类器官或至少一个组织。
实施方式20.根据实施方式1所述的生物反应器,所述生物反应器还包括平头针,所述平头针终止于所述类器官腔室的内部体积中并且穿过所述生物反应器的所述中间层。
实施方式21.根据实施方式1所述的生物反应器,其中所述中间层的所述底表面和所述底层的所述顶表面提供相对于彼此配准表面的配合表面。
实施方式22.根据实施方式21所述的生物反应器,其中所述中间层的所述底表面包括凹槽并且所述底层的所述顶表面包括与包括所述凹槽的所述中间层的所述底表面互补的配合表面,或者其中所述底层的所述顶表面包括凹槽并且所述中间层的所述底表面包括与包括所述凹槽的所述底层的所述顶表面互补的配合表面。
实施方式23.根据实施方式1所述的生物反应器,其中所述中间层由单片塑料或金属制成。
实施方式24.根据实施方式23所述的生物反应器,其中所述塑料是聚碳酸酯。
实施方式25.根据实施方式1所述的生物反应器,其中所述中间层还包括灌注入口端口和灌注出口端口。
实施方式26.根据实施方式1所述的生物反应器,其中所述中间层还包括电气系统,所述电气系统包括至少一个电极,其中每个电极被定位成向所述类器官腔室提供电刺激,电记录来自所述类器官腔室的信号,或两者。
实施方式27.根据实施方式26所述的生物反应器,其中至少一个电极与所述类器官腔室接触。
实施方式28.根据实施方式26所述的生物反应器,其中每个电极由碳、铂或金制成。
实施方式29.根据实施方式26所述的生物反应器,其中两个电极设置为彼此呈180度。
实施方式30.实施方式26所述的生物反应器,其中每个电极由至少一个O形环定位。
实施方式31.根据实施方式26所述的生物反应器,其中所述至少一个电极是双极电极,所述双极电极(a)与包括所述类器官或至少一个组织的所述类器官腔室的所述外表面接触,或者(b)集成到所述平头针附接到所述中间层的点中。
实施方式32.根据实施方式1所述的生物反应器,其中所述中间层还包括用于感测所述类器官腔室的所述类器官或组织中的电生理变化的系统。
实施方式33.根据实施方式1所述的生物反应器,其中所述底层包括与所述类器官腔室的外部接触的培养流体。
实施方式34.根据实施方式1所述的生物反应器,其中所述底层由生物相容且光学透明的材料组成。
实施方式35.根据实施方式34所述的生物反应器,其中所述材料是丙烯酸类、聚苯乙烯、玻璃或聚碳酸酯。
实施方式36.根据实施方式1所述的生物反应器,其中所述底层还包括至少一个用于观察所述类器官腔室的平坦窗,优选地,所述平坦窗是光学透明的。
实施方式37.根据实施方式1所述的生物反应器,其中所述底层包括至少一个端口、至少一个瓣膜、或至少一个端口和至少一个瓣膜,其中所述至少一个端口和/或至少一个瓣膜允许交换流体或添加至少一种化合物。
实施方式38.根据实施方式1所述的生物反应器,其中所述底层包括用于刺激所述类器官或组织的电极。
实施方式39.根据实施方式1所述的生物反应器,其中不同层中的流体通道使用鲁尔接头、螺纹连接器、磁性连接器或卡扣配合几何设计连接。
实施方式40.根据实施方式39所述的生物反应器,其中所述顶层的所述底表面处的公鲁尔滑动末端连接至所述中间层的所述顶表面处的母鲁尔锁定末端。
实施方式41.根据实施方式1所述的生物反应器,其中所述中间层和所述底层足以在培养箱中培养所述类器官或组织。
实施方式42.根据实施方式1所述的生物反应器,所述生物反应器还包括用于测量所述类器官或组织的电生理特性的系统。
实施方式43.根据实施方式42所述的生物反应器,其中所述系统包括至少一个感测电极,所述至少一个感测电极用于测量所述类器官腔室中的所述类器官或组织的细胞外电位。
实施方式44.根据实施方式43所述的生物反应器,其中所述感测电极与所述类器官腔室的内部或外部直接接触。
实施方式45.根据实施方式37所述的生物反应器,其中存在多个不直接接触所述类器官腔室的感测电极,其中所述多个感测电极检测来自所述类器官腔室的电信号。
实施方式46.根据实施方式1所述的生物反应器,其中用于所述类器官腔室的所述附接点包括平头针,所述平头针的一个末端附接至所述中间层并且另一个末端附接至所述类器官腔室。
实施方式47.根据实施方式1-45所述的生物反应器用于培养、维持、刺激、监测或测定类器官腔室中的类器官或组织的用途。
实施方式48.根据实施方式47所述的用途,所述用途包括向所述培养基中添加化合物并观察对所述类器官或组织的效应,从而测定所述化合物的生物效应。
实施方式49.根据实施方式48所述的用途,其中所述效应是改变的类器官或组织刚性、压力、体积或生长率。
实施方式50.根据实施方式48所述的用途,其中所述效应是电生理学的改变。
实施方式51.根据实施方式48所述的用途,其中所述类器官或组织是心脏类器官或组织。
实施方式51.一种用于测量类器官腔室的体积或所经受的压力的系统,所述系统包括根据实施方式1-46所述的生物反应器和测量设备。
实施方式53.根据实施方式52所述的系统,其中所述用于测量体积的设备是相机、放置到所述类器官腔室的所述内部体积中的压力-体积导管、用于测量内部流体流量的流量计、或用于对所述类器官腔室成像的超声波换能器。
实施方式54.根据实施方式53所述的系统,其中所述用于测量体积的设备是相机,所述系统还包括至少一个附接到所述类器官腔室的所述表面的基准标记物。
实施方式55.根据实施方式54所述的系统,其中光学地或磁性地跟踪所述至少一个基准标记物。
实施方式56.根据实施方式52所述的系统,其中所述压力由压力传感器测量。
实施方式57.一种用于控制类器官腔室内的压力的系统,所述系统包括根据实施方式1-46所述的生物反应器和压力控制器,所述压力控制器附接至所述顶层的所述入口端口、所述顶层的所述出口端口、或所述顶层的所述入口端口和所述出口端口两者,以调节施加至所述类器官腔室的所述流体压力。
实施方式58.根据实施方式57所述的系统,其中所述类器官是心脏类器官,并且其中施加到所述类器官腔室的所述压力是自动控制的。
实施方式59.根据实施方式58所述的系统,其中所述压力经动态控制以模拟心脏生理学。
实施方式60.根据实施方式57所述的系统,其中使用流体静压或使用至少一个流体泵来控制压力。
除非另有说明,否则在说明书和权利要求中使用的表示成分的量、性质(例如分子量)、反应条件等的所有数字应理解为在所有情况下均由术语“约”修饰。如本文所用,术语“约”和“大致”是指在10%至15%之内,优选在5%至10%之内。因此,除非有相反的指示,否则在说明书和所附权利要求书中列出的数值参数是近似值,所述近似值可以根据本发明寻求获得的所需性质而变化。无论如何并非试图限制权利要求书范围的等同物的原则的应用,每个数值参数应至少根据报告的有效位的数量并通过应用普通的舍入技术来解释。尽管阐述本发明广泛范围的数值范围和参数是近似值,但是具体实施例中列出的数值是尽可能精确报告的。然而,任何数值固有地含有必然由其各自相应的测试测量中存在的标准偏差引起的某些误差。
除非在此另外指明或者明显与上下文相矛盾,否则在描述本发明的上下文中(尤其是在以下权利要求的上下文中)使用的术语“一”、“一个”、“该”以及类似的指示词应被解释为涵盖单数和复数两者。本文中对值范围的描述仅旨在用作为引用落入该范围的每个单独值的速记方法。除非本文另有说明,否则每个单独的值被并入说明书中,如同其在本文中被单独引用一样。除非本文另有说明或明显与上下文相矛盾,否则本文所述的所有方法均可以任何合适的顺序进行。本文提供的任何和所有示例、或例示性语言(例如“例如”)的使用仅旨在更好地说明本发明,而不是对要求保护的本发明的范围构成限制。说明书中的任何语言都不应被解释为表示任何不要求保护的要素对于本发明的实践为必不可少的。
本文公开的本发明的替代要素或实施方式的分组不应解释为限制。每个组成员可以单独地或与该组中的其他成员或本文中找到的其他要素任意组合地被提及和要求保护。预期组中的一个或多个成员可以出于方便和/或可专利性的原因而被包括在组中或从组中删除。当发生任何此类包括或删除时,本说明书被视为包含经修改的组,从而满足对所附权利要求书中使用的所有马库什组的书面描述。
本文描述了本发明的某些实施方式,包括本发明人已知的用于实现本发明的最佳方式。当然,对于本领域普通技术人员来说,在阅读前面的描述后,这些描述的实施方式的变型将变得显而易见。本发明人希望技术人员适当地采用此类变型,并且本发明人希望以不同于本文具体描述的方式实践本发明。因此,本发明包括适用法律所允许的本文所附权利要求中所述主题的所有修改和等同物。此外,除非本文另有说明或明显与上下文相矛盾,否则本发明涵盖上述要素的所有可能变型的任何组合。
本文公开的具体实施方式可以在权利要求中使用由......组成或基本上由……组成的语言来进一步限制。当在权利要求中使用时,无论是原始提交还是按照修正添加,过渡术语“由...组成”不包括权利要求中未指定的任何要素、步骤或成分。过渡术语“基本上由......组成”将权利要求的范围限制于指定的材料或步骤,以及不会对基本和新颖特征产生实质性影响的那些材料或步骤。如此要求保护的本发明的实施方式在本文中被固有地或明确地描述和实现。
此外,在整个说明书中,已经对专利和印刷出版物进行了大量引用。上面引用的参考文献和印刷出版物中的每一者的全部内容均以引用方式单独地并入本文。
最后,应理解,本文公开的本发明的实施方式是对本发明原理的说明。可以采用的其他修改在本发明的范围内。因此,举例来说而非限制,可以根据本文的教导使用本发明的替代配置。因此,本发明不被限制为如精确地所示和所描述的。
- 包括类器官腔室的设备及其用于培养、维持、监测或测试类器官的用途
- 一种用于类器官培养的培养基及类器官培养方法
