射血分数保留的心衰动物模型的构建方法及应用
文献发布时间:2023-06-19 13:48:08
技术领域
本发明属于生物医药和基因工程领域,具体涉及一种敲除心肌细胞STAT3基因构建射血分数保留的心衰动物模型的方法及应用。
背景技术
心力衰竭(HF)是一种多种病因的临床综合征,可按照射血分数分类为射血分数降低的心力衰竭(HFrEF),射血分数中间值的心力衰竭(HFmrEF),射血分数保留的心力衰竭(HFpEF)。在所有心力衰竭患者中,HFpEF占比50%以上,且呈日益增长的趋势。毫无疑问,HFpEF将成为未来全世界最常见的心力衰竭类型。尽管HFpEF呈现高发病率和高死亡率,然而到目前为止,依然没有有效的循证医学证据可提供有益的治疗方法。在这其中,缺乏合适的HFpEF动物模型是阻碍HFpEF治疗发展的最重要原因。因此急需创新的HFpEF动物模型来进一步探究HFpEF,并以此寻找新的治疗靶点。
在过去的几十年中,科研工作者设计了些许HFpEF动物模型来模拟揣测可能引发HFpEF的各种病理机制。其中最常见的HFpEF传统模型侧重于研究经典危险因素,包括高血压,肥胖,糖尿病和衰老。然而,这些经典的HFpEF动物模型不仅有其自身的局限性,而且仅仅匹配有限且特定的HFpEF群体,不能为HFpEF整个群体提供有益的治疗方案研究。因此,我们迫切需要一种全新的HFpEF动物模型来模拟整个HFpEF群体所具有的共性。
大量的临床实验表明,心脏纤维化和内皮功能障碍,最终会增加心肌的被动刚度。Titin蛋白是目前已知的心脏中分子量最大的蛋白质,且Ttitin蛋白是改变心肌被动高度的主要影响因素。心脏被动刚度可以通过Titin蛋白弹簧区域的磷酸化来调节。既往研究表明,蛋白激酶A(PKA)可通过磷酸化Titin蛋白的弹簧元件来增加心肌的顺应性,降低心脏被动刚度,从而改善心脏的舒张功能。
信号转导和转录激活因子3(STAT3)于1994年左右首次被确认为急性期反应因子,该因子被炎症激活并与增强的基因表达耦合。在7种哺乳动物STAT转录因子中,只有STAT3基因的胚胎期丧失是致命的。
本发明通过特异性敲除动物心肌细胞STAT3基因,构建了射血分数保留的心衰(HFpEF)动物模型。
发明内容
本发明旨在提供一种构建射血分数保留的心衰动物模型的方法及应用。
本发明还提供了STAT3基因的应用。
一种射血分数保留的心衰动物模型的构建方法,步骤包括敲除动物的心肌细胞STAT3基因。可采用Cre/loxP重组酶系统敲除动物的心肌细胞STAT3基因。
敲除心肌细胞STAT3基因的方法包括以下步骤:
(1)将STAT3(flox/flox)动物与α-MyHC-Cre转基因动物交配,选定表达Cre-STAT3(flox/flox)的动物;
具体的,将loxP等位基因靶向定位于STAT3外显子3~4,产生STAT3(flox/flox)动物;
将Cre重组酶靶向在α-肌球蛋白重链基因启动子位点,产生表达Cre-重组酶的α-MyHC-Cre转基因动物;
(2)诱导动物中Cre重组酶的表达,使STAT3基因沉默,从而产生心肌细胞STAT3特异性敲除动物模型。
步骤(1)中,将Cre重组酶靶向在心肌细胞特异性动物α-肌球蛋白重链基因启动子位点,产生表达Cre-重组酶的α-MyHC-Cre转基因动物。
步骤(2)中用他莫昔芬诱导Cre重组酶的表达,具体地,用他莫昔芬诱导心肌细胞中Cre重组酶的表达,从而介导LoxP位点重组,敲除LoxP位点之间的STAT3基因。
所述的α-MyHC-Cre转基因动物为具有心肌细胞特异性、他莫昔芬可诱导的心肌细胞Cre-重组酶表达的转基因动物,Cre-重组酶位于α-肌球蛋白重链(α-MyHC)基因启动子位点上。
Cre重组酶能识别特异的DNA序列,即LoxP位点,能介导两个LoxP位点(序列)之间的特异性重组,使LoxP位点间的基因序列被删除或重组。
优选的,所述的动物模型为小鼠模型。
敲除心肌细胞STAT3基因的动物用作射血分数保留的心力衰竭动物模型。
敲除心肌细胞STAT3基因的动物模型在筛选和制备治疗射血分数保留的心力衰竭药物中的应用。所述的动物模型为小鼠模型。
敲除心肌细胞STAT3基因的动物模型在筛选和制备治疗心脏纤维化、心脏肥大或内皮功能障碍药物中的应用。
STAT3基因在筛选和制备治疗射血分数保留的心力衰竭药物、治疗心脏纤维化、心脏肥大或内皮功能障碍药物、治疗心脏舒张功能障碍药物或者调节蛋白激酶A活性的药物中的应用。
心肌细胞STAT3特异性敲除会损害小鼠模型心脏舒张功能。当小鼠等动物的心肌细胞中STAT3被特异性敲除后,心肌被动刚度增加,并由此产生HFpEF表型。STAT3特异性敲除可导致心脏舒张功能受损而收缩功能保持正常,并可导致心脏纤维化加重和内皮功能障碍,心肌肥厚,心脏肥大,并最终通过降低PKA的活性(从而影响titin的磷酸化),而损害心脏的舒张功能。所有这些变化伴随着PKA活性程度的降低。由此可见STAT3可调节心肌PKA活性。
本发明的有益效果在于,通过心肌细胞STAT3特异性敲除,构建了一种射血分数保留的心力衰竭动物模型,发现了STAT3可调节心肌PKA活性。该方法可获得合适舒张功能降低的小鼠HFpEF模型,有助于对HFpEF深入的研究和理解,并为临床治疗和药物筛选提供新的靶点。
附图说明
图1的A-D分别为WT小鼠和敲除心肌细胞STAT3基因的(STAT3cKO)小鼠心肌、肌肉、肝脏、肾脏中STAT3蛋白表达电泳结果和表达水平比较;
图2为WT小鼠和敲除心肌细胞STAT3基因的(STAT3cKO)小鼠心脏大小(图2A)、心脏重量(图2B)、心脏重量/胫骨长度即HW/LT(图2C)、肺部重量(图2D)和血压(图2E)的比较,以及血清生物标志物BNP即脑钠肽(图2F)、ST2(图2G)、和IL-6(图2H)表达量的比较;
图3为WT小鼠和STAT3cKO小鼠的常规超声心动图和多普勒成像结果(图3A)、射血分数即EF(图3B)、缩短率分数即FS(图3C)、舒张末期的室间隔厚度(图3D)、收缩末期的室间隔厚度(图3E)、舒张末期的左室后壁厚度LVPW;d(图3F)、收缩末期的左室后壁厚度(图3G)、MV A值即A peak(图3H)、MV E值即E peak(图3I)、E/A(图3J)、E/E'值(图3K);
图4为蛋白印迹法检测STAT3cKO小鼠和WT小鼠心脏胶原蛋白1、胶原蛋白3、纤连蛋白的电泳图和表达量(图4A)、心脏切片HE染色组织形态(图4B)、心脏切片MASSON染色组织形态(图4C),胶原蛋白1、胶原蛋白3、纤连蛋白和CD31的MASSON染色结果(图4D~F);
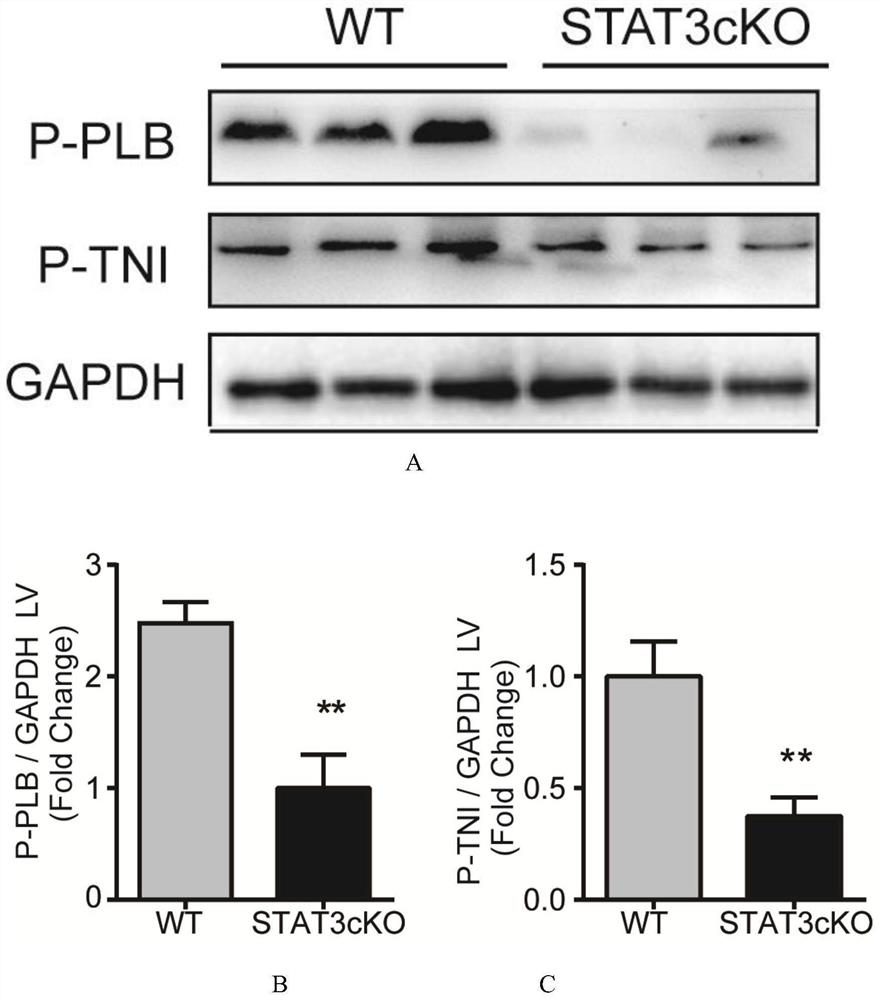
图5为蛋白印迹法检测STAT3cKO小鼠和WT小鼠心脏p-TN I和p-PLB的电泳图(图5A)表达量(图5B、C)。
具体实施方式
以下结合具体的实施例来对本发明的技术方案加以说明。
实施例1
所有动物实验均按照上海交通大学医学院动物伦理指南进行。该方案已获得上海交通大学医学院动物实验伦理委员会的批准。从杰克逊实验室购买了4周大小的雄性stat3(flox+/+)小鼠,即,loxP等位基因靶向定位于STAT3外显子3~4产生的STAT3(flox/flox)小鼠,并将其饲养在上海交通大学医学院附属瑞金医院动物实验中心。将所有小鼠饲养在标准笼子中,保持12小时光照/12小时黑暗周期,可自由获取食物和水。
将STAT3(flox/flox)小鼠与他莫昔芬可诱导的心肌Cre-α-肌球蛋白重链小鼠交配(心肌细胞特异性,Jackson Laboratorie株005657,B6.FVB(129)–Tg(Myh6-cre/Esr1*)1Jml/J,15*回交至C57BL/6,此小鼠的α-肌球蛋白重链(α-MyHC)基因启动子位点上靶向Cre重组酶,是表达Cre-重组酶的α-MyHC-Cre转基因小鼠,可用他莫昔芬诱导心肌细胞Cre-重组酶表达),获得表达Cre-STAT3(flox/flox)的flox/flox Cre+小鼠。
将溶于玉米油中的他莫昔芬(T5648,Sigma),以50mg/kg/天的剂量向8周至10周龄的flox/flox Cre+小鼠连续腹腔注射5天。
通过鼠尾鉴定的方式(从小鼠鼠尾采集组织进行鉴定)选定表达Cre-STAT3(flox/flox)的flox/flox Cre+小鼠,从而获得心肌细胞STAT3特异性敲除小鼠(STAT3cKO)。
实施例2
当心肌细胞STAT3特异性敲除小鼠(STAT3cKO)和对照组WT小鼠长到4个月大时,我们测试了下述所有指标:
(一)常规超声心动图和多普勒成像
使用配备有MS400换能器(Visual Sonics)的VisualSonics Vero2100系统进行小鼠经胸腔超声心动图检查。LVEF和其他收缩功能指标是从心室中水平的短轴M型扫描获得的。使用二尖瓣水平的脉冲波和组织多普勒成像在麻醉小鼠中获得心尖四腔视图,以进行舒张功能测量。麻醉是由5%异氟醚诱导的,并通过对一只后爪对固定压力的反应不足而得到证实。在超声心动图采集过程中,在体温可控的条件下,将异氟烷降低至1.0-1.5%,并进行调整以将心率维持在每分钟415-460次心跳范围内。收集的参数包括:心率,左心室舒张末期直径,左心室收缩末期直径,舒张末期后壁,左心室分数缩短,LVEF,舒张早期早期通过二尖瓣的多普勒血流峰值速度,多普勒血流峰值舒张末期跨过二尖瓣的流入速度,等容舒张时间,舒张早期和早期充盈减速时间的二尖瓣环的心肌舒张速度的峰值多普勒。程序结束时,所有小鼠均顺利从麻醉中恢复。
WT小鼠和STAT3cKO小鼠的常规超声心动图和多普勒成像结果如图3A所示。
(二)鼠尾血压记录
使用尾袖套法和CODA仪器(Kent Scientific)在有意识的小鼠中无创测量收缩压。将小鼠放在温度控制平台(37℃)上的单独的支架中,并在稳态条件下进行记录。在测试之前,对所有小鼠进行训练以使其习惯于短期约束。连续四天记录血压,每节至少测量八次,取平均值。结果如图2F。
(三)蛋白质印迹分析
小鼠心脏组织裂解液在含有1%PMSF的RIPA裂解缓冲液中匀浆。将匀浆液在4℃下以14,000×g离心30分钟后,我们收集上清液,并使用BCA蛋白测定试剂盒测定蛋白浓度。将上清液与上样缓冲液混合,并在沸水浴中加热10分钟。将等量制备的蛋白质进行SDS-PAGE并印迹到聚偏二氟乙烯膜上。用无蛋白的快速封闭缓冲液(Epizyme)封闭膜,并在4℃下与抗STAT3(稀释浓度为1:1000)(CST),抗胶原蛋白1(稀释浓度为1:1000)(Abcam)抗胶原蛋白3(稀释浓度为1:1000)(Abcam),抗纤连蛋白(稀释浓度为1:1000)(Abcam),抗磷酸化-磷脂酰肌醇(稀释浓度为1:1000)(CST),抗磷酸化-肌钙蛋白I(稀释浓度为1:1000)(CST)和GAPDH(稀释浓度为1:10000)(CST)的抗体一起孵育过夜。然后将膜与结合HRP的二抗(1:5000)在室温下孵育1小时。使用增强的化学发光(ECL)系统(Millipore,MA,USA)检测了免疫反应性条带,并使用Image-Pro Plus 6进行了定量。如图4A所示。
(四)组织化学分析
用4%多聚甲醛固定小鼠心脏,包埋在石蜡中,切成5微米厚的切片。通过苏木精-尹红(HE)染色以及Masson三色染色对切片进行分析,以观察心脏组织的形态。使用抗胶原1抗体(1:100),抗胶原3抗体(1:100),抗纤连蛋白抗体(1:100)和抗CD31抗体(1:100)在4℃条件下孵育24小时。然后免疫组织化学染色和辣根过氧化物酶连接的抗兔抗体(1:500)在室温下孵育上述处理切60分钟。然后,将载玻片与3,3'-二氨基联苯胺一起孵育,并用苏木精复染。在显微镜下(日本东京奥林巴斯公司)捕获图像,并使用ImageJ软件(美国马里兰州国立卫生研究院)对图像进行定量。结果如图4所示。
(五)血清生物标志物
选择能够反映心力衰竭以及促炎和纤维化状态的生物标志物,特别是脑钠肽(BNP),ST2和白介素6(IL-6),通过ELISA试剂盒(BNP(Sxm117),ST2n(Sam106),IL-(Sxm032))分别测定小鼠血清中BNP、ST2、IL-6的浓度。如图2F-H所示。
统计学方法分析:所有动物实验数据均以平均值±标准差(SEM)的方式表示。为了比较两组之间的差异,我们进行了统计学的t检验。使用Bonferroni检验,并用单向方差分析(ANOVA)进行了两组以上的比较。P值<0.05被认为具有统计学意义。所有分析均使用GraphPad Prism软件V5.04(GraphPad软件,Inc,LaJolla,CA,USA)进行。对于动物实验,我们根据之前发表的实验的可行性和统计能力的先验知识为所有组选择了样本量。对于小样本量,我们没有对方差的正态性或均等性进行统计检验。
检测结果如下:
I.Stat3cKO小鼠心脏中的STAT3蛋白水平显著降低
通过蛋白质印迹分析方法证实了Stat3cKO小鼠心脏中的STAT3蛋白水平显著降低(图1A)。此外,我们还证明了STAT3cKO和WT小鼠的肌肉(图1B),肝脏(图1C)和肾脏(图1D)中STAT3的表达水平没有差异。
II.心肌细胞STAT3条件性敲除小鼠在不改变血压的条件下从心肌肥厚发展为心力衰竭
取STAT3cKO和WT小鼠的心脏,测量其尺寸,结果如图2A,与WT小鼠相比,STAT3cKO小鼠的心脏长度厚度有明显增加,更为肥大。
我们测试了一些心力衰竭指标,包括心脏重量,心脏重量/胫骨长度(HW/LT),肺部重量,BNP,ST2和IL-6。结果如如图2B和图2C所示,STAT3cKO小鼠的心脏重量较大,且心脏重量/胫骨长度的比例较大。这些数据与图2A中显示的照片一致。他们都反映出STAT3cKO小鼠存在心脏肥大。为了了解周围组织水肿的状况,我们测量了所有小鼠的肺重量。结果,STAT3cKO小鼠的肺重量比WT小鼠重(图2D)。这些数据表明STAT3cKO小鼠在一定程度上存在肺水肿。此外,STAT3cKO小鼠的血清BNP和ST2均升高(图2F,图2G),而IL-6水平在两组小鼠中无显著统计学差异(图2H)。此外,所有小鼠的血压均相似(图4E)。综上所述,心肌细胞STAT3条件性敲除小鼠在不改变血压的条件下从心肌肥厚发展为心力衰竭。
III.从超声心动图观察心肌细胞STAT3条件性敲除可引起小鼠心肌肥厚及舒张功能障碍
WT小鼠和STAT3cKO小鼠的多普勒成像结果和常规超声心动图如图3A所示。结果显示,与WT小鼠相比,TAT3cKO小鼠的心肌肥厚;多普勒结果峰值增高;
为进一步评估心脏功能,对4个月大的STAT3cKO和WT小鼠进行了超声心动图分析。结果显示,STAT3cKO小鼠的舒张末期(IVS;d)(图3D)和收缩末期(IVS;s)(图3E)(1.284±0.088mm VS 0.990±0.069mm)的室间隔厚度增加,p<0.01)。此外,与WT小鼠相比,STAT3cKO小鼠的收缩末期左室后壁厚度(LVPW;s)显著增加(图3G),舒张末期左室后壁厚度(LVPW;d)也有增加(图3F)。这些数据表明心肌细胞STAT3特异性敲除可引起心肌肥厚。此外,STAT3cKO小鼠的心脏舒张功能受损,MV A值(444.896±66.991mm/s VS 298.840±11.921mm/s,p<0.05)(图3H)和MV E值(654.974±81.813mm/s VS 451.740±62.933mm/s,p<0.05)(图3I)均显著升高,E/E'值降低(-34.298±6.689 VS-22.000±3.364,p<0.05)(图3K),上述均为评估心脏舒张功能的重要指标。
此外,评估心脏收缩功能的射血分数(EF)和缩短率分数(FS)在STAT3cKO小鼠和WT小鼠之间没有显着差异(如图3B、图3C)。E/A也没有明显变化(图3J),这些数据表明心肌STAT3缺失会导致心脏舒张功能障碍。
IV.心肌细胞STAT3特异性敲除促进了小鼠心脏纤维化和内皮功能障碍的发生
另外,我们需确认Stat3cKO心脏在心脏纤维化和内皮功能障碍方面是否具有改变。蛋白质印迹分析和组织学分析表明,通过胶原蛋白1、胶原蛋白3、纤连蛋白和MASSON染色的表达,心肌细胞STAT3特异性敲除显著促进了心肌纤维化(图4A,图4C-F)。通过组织学分析,我们还发现STAT3cKO小鼠中CD31(血管内皮化的标志物)的水平也显着降低(图4G)。另外,苏木精-伊红(HE)染色清楚地表明STAT3cKO小鼠出现心脏肥厚(图4B)。
V.心肌细胞STAT3特异性敲除可降低心脏PKA活性,并最终导致心脏舒张功能障碍
基于以上这些数据,我们试图确认STAT3cKO小鼠中PKA的活性是否发生了变化。
众所周知,PKA活性的增加了TNI[p(S23/24)-肌钙蛋白I]和PLB[p(S16)-PLB]的磷酸化表达。因此,我们尝试以蛋白印迹的方法测试p-TN I和p-PLB的表达量,并以此评估PKA的活性。我们发现Stat3cKO心脏中的p-TNI和p-PLB明显下调(图5)。这些结果表明,STAT3在心肌细胞中的条件下敲除显著降低了PKA的活性,从而抑制了titin的磷酸化途径并降低了心肌的顺应性,最终导致了心脏舒张功能障碍。
综上所述,心肌细胞STAT3特异性敲除,可致小鼠心脏舒张功能受损,而收缩功能保持正常,并可使小鼠纤维化加重和内皮功能障碍。此外,我们发现STAT3可调节心肌PKA活性,从而影响了titin的磷酸化状态,当特异性敲除心肌细胞中的STAT3时,心肌PKA活性降低,titin蛋白的磷酸化状态减少,心肌被动刚度增加,心脏舒张功能障碍。总之,以上数据清楚地表明,心肌细胞STAT3特异性敲除模型是成功的HFpEF动物模型,这将有助于将来HFpEF治疗研究的发展。
- 射血分数保留的心衰动物模型的构建方法及应用
- 一种射血分数保留的心衰小鼠模型的建立方法
