一种含有类软骨陷窝结构的硬度可调水凝胶支架
文献发布时间:2023-06-19 13:48:08
技术领域
本发明涉及组织工程关节软骨修复技术领域,具体是一种用于关节软骨修复的含有类软 骨陷窝结构的硬度可调水凝胶支架及制备方法。
背景技术
关节软骨损伤是一种常见的临床疾病。关节软骨因缺少血管、神经及淋巴组织,且所含 细胞量极少,其自身修复能力有限,因此,无论是物理或化学因素导致的关节软骨损伤都很 难恢复到健康状态。目前临床常用治疗软骨损伤的方法,如微创钻孔术、微骨折术、马赛克 移植术、骨膜或软骨膜移植等,虽然能在一定程度上减轻患者痛苦,但长期效果不好,多形 成纤维软骨,最后仍然发展成骨组织而丧失软骨功能。伴随组织工程技术的发展,软骨组织 修复的新型生物支架材料的设计与开发已经成为软骨损伤修复的研究热点。而软骨的天然组 织结构特征是含有软骨陷窝结构,软骨细胞都是分布在软骨陷窝中。
而目前常见的致孔技术多在水凝胶密闭环境内引入致孔剂(含有碳酸根的无机盐),在 酸性环境下通过反应产气形成孔径。该技术的最大问题是,无法将细胞准确的放在致孔剂形 成的孔洞中,且致孔过程引入的酸性环境等会对细胞造成损伤。因此,构建类似天然组织中 含有软骨细胞的软骨陷窝结构的水凝胶,成为当前软骨修复支架设计的研究难点。
发明内容
为解决上述问题,本发明提出将海藻酸盐的凝胶-溶胶转化过程引入软骨水凝胶支架,即 海藻酸盐先以载细胞凝胶微球的固态引入到水凝胶支架中,再通过凝胶-溶胶转化过程,将海 藻酸盐固态微球在生理条件下转变成液态溶液,形成水凝胶支架内部的球形空腔,并在空腔 内原位载有软骨细胞。本发明解决了在全生理条件致孔(模拟软骨陷窝结构)的问题,同时 也确保细胞分布在模拟软骨陷窝的空腔中。
为实现上述发明目的,本发明采用以下技术方案:
一种含有类软骨陷窝结构的硬度可调水凝胶支架,类软骨陷窝结构包埋在水凝胶支架中;
所述类软骨陷窝结构为球形结构,粒径为50μm-500μm;所述类软骨陷窝结构中装载软 骨相关细胞和/或促软骨生成的细胞因子,细胞载量为2-5000个细胞/软骨陷窝。
上述技术方案中,进一步地,所述水凝胶支架含有海藻酸盐,所述类软骨陷窝结构由海 藻酸盐的凝胶-溶胶转化过程形成;优选地,所述凝胶-溶胶转化过程为海藻酸盐以载细胞凝 胶微球的固态引入到水凝胶支架中,海藻酸盐固态微球转变成液态溶液,形成水凝胶支架内 部的球形空腔,即类软骨陷窝结构,空腔内原位载有软骨相关细胞和/或促软骨生成的细胞因 子;
所述水凝胶支架含有胶原、透明质酸、PRP中的一种或两种,水凝胶中的海藻酸盐通过 离子交联和共价交联形成双交联水凝胶。
上述技术方案中,进一步地,所述共价交联为点击化学反应,点击化学反应基团对中的 一种预先修饰在海藻酸盐的羟基上,点击化学反应基团对中的另一种基团预先修饰在聚乙二 醇分子上;预先修饰的海藻酸盐分子分布在水凝胶支架中,与预先修饰的聚乙二醇分子发生 点击化学反应共价交联。
上述技术方案中,进一步地,所述软骨相关细胞为软骨细胞、骨髓间充质干细胞、滑膜 干细胞中的任意一种或两种以上;所述细胞因子为TGF-β、bFGF、IGF-1、FGF、PDGF、PRP的任意一种或两种以上;所述TGF-β为TGF-β1、TGF-β2;所述FGF为FGF 2。
前述含有类软骨陷窝结构的硬度可调水凝胶支架的制备方法为:
(1)制备载细胞和细胞因子的海藻酸钙微球:
a.将海藻酸盐分子羟基上进行点击化学反应基团对中任意一种基团共价修饰;所述海藻 酸盐优选为海藻酸钠、海藻酸钾;
b.将修饰后的海藻酸盐与未修饰的海藻酸盐按照1:0-1:10比例配制成终浓度10-30g/L海 藻酸盐溶液;
c.将步骤b制备的海藻酸盐溶液与软骨相关细胞和细胞因子混合,混合液中细胞密度在1 ×10
d.配制凝胶浴水溶液,凝胶浴水溶液中含有总浓度5-30g/L钙离子和0-20g/L氯化钠、 0-20g/L氯化钾、0-20g/L柠檬酸钠、0-20g/L磷酸钠、0-20g/L磷酸氢二钠、0-20g/L磷酸二氢 钠0-30g/L、0-30g/L吐温、0-30g/L F68中的一种或二种以上;
e.通过液体颗粒化技术制备载有软骨相关细胞和细胞因子的海藻酸钙微球,微球粒径在 50-500微米;
(2)制备载有海藻酸钙微球的水凝胶支架:
a.配制胶原、透明质酸钠的混合溶液,溶液中胶原浓度在2-10mg/mL,透明质酸钠溶液 在0-10mg/mL;
b.将步骤a配制的混合溶液调节pH到6.8-7.4后,与步骤(1)制备海藻酸钙微球均匀混 合,微球与混合液的体积比为1:1-1:20;
c.将步骤b配制的混有微球的混合溶液铺展成0.2mm-5mm厚度薄膜,于20-40℃环境下, 制备成载有海藻酸钙微球的水凝胶支架。
(3)制备含有类软骨陷窝结构的硬度可调的水凝胶支架:
a.点击化学反应基团对中另一基团共价修饰聚乙二醇,形成1臂、2臂、4臂或8臂聚乙 二醇;
b.在步骤(2)制备的载有海藻酸钙微球的水凝胶支架上,滴加钙离子螯合剂溶液,在生 理条件下,液化反应1-20分钟,溶解水凝胶支架中的海藻酸钙,在水凝胶支架内部形成球形 空腔,空腔内保留软骨相关细胞和细胞因子,即形成类软骨陷窝结构,且液化后的海藻酸盐 分子和羟基上进行点击化学反应基团修饰的海藻酸盐分子从空腔向水凝胶支架中扩散;
c.弃去步骤b凝胶外的钙离子螯合剂溶液,生理盐水清洗1-5次,在水凝胶支架上先后滴 加浓度为5-30g/L离子交联剂溶液和步骤a中制备的修饰后的浓度为1-20g/L聚乙二醇溶液, 水凝胶中的海藻酸盐先与离子交联剂交联,再与修饰后的聚乙二醇共价交联1-30分钟形成双 交联水凝胶支架。
所述液体颗粒化技术为通过液体颗粒化技术制备载有软骨相关细胞和细胞因子的海藻酸 钙微球,液体颗粒化技术包括同向/轴流动制备技术(A.M.Ganan-Calvo.Generation of steady liquid microthreads and micron-sized monodispersesprays in gas streams.Physical review letters, 1998,80(2):285-288);静电液滴法(In Vivo Culture of Encapsulated Endostatin-Secreting Chinese Hamster OvaryCells for Systemic Tumor Inhibition,Human Gene Therapy.2007,18: 474-481);静电雾化制备技术(B.Bugarski,Q.L.Li,M.F.A.Goosen,et al.Electrostatic dropletgeneration-mechanism of polymer droplet formation.Aiche Journal,1994,40(6):1026-1031);振 动效应制备技术(H.H.Lee,O.J.Park,J.M.Park,et al.Continuousproduction of uniform calcium alginate beads by sound wave inducedvibration.Journal of Chemical Technology and Biotechnology,1996,67(3):255-259);离心力场制备技术(C.P.Champagne,N.Blahuta,F.Brion, C.Gagnon.A Vortex-BowlDisk Atomizer System for the Production of Alginate Beads in a 1500-LiterFermentor.Biotechnology and Bioengineering,2000,68(6):681-688);微通道阵列制备技术(S.Sugiura,T.Oda,Y.Izumida,et al.Size control of calcium alginate beadscontaining living cells using micro-nozzle array.Biomaterials,2005,26(16):3327-3331);乳化-外部凝胶化技 术(T.Takei,M.Yoshida,Y.Hatate,et al.Preparationof lactic acid bacteria-enclosing alginate beads in emulsion system:effect ofpreparation parameters on bead characteristics.Polymer Bulletin, 2009,63(4):599-607);乳化-内部凝胶化技术(一种乳化/内部凝胶化制备海藻酸钙凝胶珠的方 法,刘群,马小军,刘袖洞,中国发明专利,ZL01109449.4)及膜乳化技术(一种制备海藻酸钙 凝胶珠的膜乳化/内部凝胶化耦合技术,刘袖洞,马小军,刘群,中国发明专利ZL01104365.2,A.M.Chuah,T.Kuroiwa,I.Kobayashi,et al.Preparation of uniformly sized alginatemicrospheres using the novel combined methods of microchannel emulsificationand external gelation.Colloids and Surfaces a-Physicochemical and EngineeringAspects,2009,351(1-3):9-17)等。
上述技术方案中,进一步地,所述离子交联剂和共价交联剂通过调控交联剂浓度、交联 剂种类、交联反应时间,调节水凝胶支架硬度。
上述技术方案中,进一步地,所述步骤(1)中,在步骤c制备的混合液中加入细胞和细 胞因子,其中含有骨髓间充质干细胞0-10
所述步骤(3)中的离子交联剂为二价阳离子,或者三价阳离子,二价阳离子包括Ca
上述技术方案中,进一步地,所述点击化学基团对包括叠氮-炔烃基,硫醇-烯烃,巯基- 丙烯酸酯,共轭二烯体-亲轭二烯体中的任意一对;所述硫醇-烯烃优选为巯基-马来酰亚胺, 所述共轭二烯体-亲轭二烯体优选为呋喃基-马来酰亚胺。
上述技术方案中,进一步地,所述水凝胶的孔隙率为60%-90%。
前述含有类软骨陷窝结构的硬度可调水凝胶支架的应用,所述水凝胶支架可作为软骨组 织工程支架,用于关节软骨修复。
与现有技术相比,本发明的有益效果:
本发明将海藻酸盐的凝胶-溶胶转化过程引入软骨水凝胶支架,实现在生理条件下在水凝 胶支架内部的致孔(模拟软骨陷窝结构)问题,同时也确保细胞分布在模拟软骨陷窝的空腔 中,且整个制备过程均在生理条件下完成,不影响细胞的生物学活性。
本发明中转化成溶液态的海藻酸钠分子,通过分子扩散,扩散到微球周围的胶原-透明质 酸等水凝胶网络中,形成复合材料水凝胶支架,以提高水凝胶支架的力学强度。
本发明将转化成溶液态的海藻酸钠分子,进一步通过共价、离子双交联技术,制备出力 学强度显著优于单纯离子交联的水凝胶支架,且可通过调控离子、共价双交联工艺中的交联 剂浓度、交联时机等调控水凝胶支架的硬度,以适应不同力学环境需求。
本发明引入共价键的方式,是通过点击化学反应,该反应通过将共价修饰的基团预先修 饰到材料上,再将修饰好的材料先通过离子交联制备出一定形状的凝胶后,最后通过温和的 点击化学反应形成共价交联凝胶。这个离子交联和点击化学反应过程是在常温常压下瞬间发 生的反应,因此凝胶的制备过程可以带细胞操作,在提高复合支架的整体结构稳定性的同时, 又不影响细胞活性。
附图说明
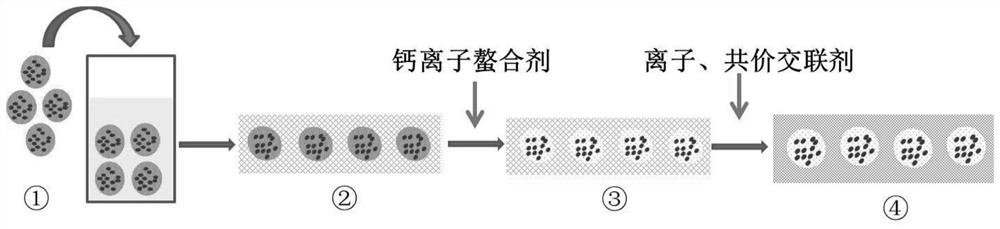
图1本发明实施例1中含有类软骨陷窝结构的复合水凝胶支架制备过程示意图,其中①代表制 备的载有软骨相关细胞和细胞因子的海藻酸钙水凝胶微球;②代表包埋有海藻酸钙微球的胶 原-透明质酸水凝胶支架;③代表海藻酸钙凝胶通过钙离子螯合剂液化后形成空腔(凝胶微球 区域由蓝色变成白色来表示这个变化)的胶原-透明质酸水凝胶支架;④代表在交联剂作用下, 通过离子-共价双交联后形成的带有空腔的胶原-透明质酸-海藻酸钠-PEG复合水凝胶支架(通 过水凝胶支架部分的颜色变深,网络更致密来表示这个变化)。
图2本发明实施例1中软骨细胞在类软骨陷窝结构中增殖7天后,通过live-dead染色观察细胞 死活的形态学图像,显示细胞活性保持良好,且显著增殖。
图3本发明实施例2中荧光标记的海藻酸钠分子在胶原凝胶网络中的扩散行为。图3中的A图 显示,胶原水凝胶网络中,海藻酸盐分子从海藻酸钙凝胶态转变成溶液态的过程中,伴随液 化时间延长,海藻酸钠分子向胶原水凝胶网络的扩散行为,9min时,海藻酸盐分子已基本扩 散。图3中的B图显示,液化9分钟后,大部分的海藻酸钠分子已经扩散到胶原网络中,但可 见光下可以看到空腔仍然存在。
具体实施方式
以下结合具体实施例对本发明作进一步说明,但不以任何方式限制本发明。
实施例1
制备含有类软骨陷窝结构的复合水凝胶支架,包括以下步骤:
(1)将海藻酸钠分子与含有叠氮基团的3-(p-苄氨基)-1,2,4,5-四嗪(BAT)反应,从而将 海藻酸钠的羟基接枝叠氮基团(-N=N-),通过核磁质谱表征其接枝率为120%。
(2)将步骤(1)制备的羟基修饰后的海藻酸钠与未修饰的海藻酸钠按照1:5比例配制 成终浓度15mg/mL海藻酸钠混合溶液。
(3)将软骨细胞和TGF-β1均匀混悬在步骤(2)制备的海藻酸钠溶液中,细胞密度为5×10^6/mL,TGF-β1浓度为10微克/mL。
(4)配制凝胶浴溶液,凝胶浴中含有氯化钙(浓度30g/L),氯化钠(浓度5g/L),磷酸二氢钠(浓度1g/L),吐温5g/L。
(5)采用静电液滴法,将步骤(3)制备的含细胞的海藻酸钠溶液,形成均匀的射流液 滴,液滴进入步骤(4)配制的凝胶浴溶液中,发生凝胶化反应,反应30分钟后即得包埋有软 骨细胞和细胞因子TGF-β1的海藻酸钙水凝胶微球,微球粒径300±50微米(如附图1中①所示)。
(6)配制复合水凝胶溶液:将二型胶原与透明质酸钠混合,形成复合水凝胶溶液,溶液 中含有胶原4mg/mL,透明质酸钠3mg/mL。
(7)将步骤(5)制备的载有软骨细胞和细胞因子的海藻酸钙凝胶微球,与步骤(6)制 备的二型胶原-透明质酸复合溶液混合均匀,将混合液铺展成3mm厚度薄膜,升温至37℃形成 包埋有海藻酸钙微球的胶原-透明质酸钠复合水凝胶(如附图1中②所示),同等条件制备5个 平行样品。
(8)在步骤(7)制备的水凝胶表面滴加柠檬酸钠溶液,生理条件(常温常压,中性pH) 下液化反应10分钟,弃去柠檬酸钠溶液,PBS清洗3次(如附图1中③所示),此时水凝胶中 形成空腔,即类软骨陷窝结构。
(9)在步骤(8)的水凝胶表面滴加氯化钙溶液交联10min,再滴加含有烯烃基团(-C=C-) 的炔基化的甲氧基2臂聚乙二醇(MPEG-NB)溶液,通过点击化学反应,形成共价键 (-CH=N-NH-),即获得含有类软骨陷窝结构的复合水凝胶支架(如附图1中④所示)。制备 过程示意图见附图1。
将步骤(9)制备的水凝胶支架,用力学测试机检测其基质刚度,5个平行样取均值,其 基质刚度为430kPa。
将步骤(9)制备的水凝胶支架,在培养箱中培养7天后,live-dead染色观察肋软骨陷窝 结构中的细胞活性,结果见附图2,细胞在类软骨陷窝空腔内显著增殖,且活性保持良好。
实施例2
制备含有类软骨陷窝结构的复合水凝胶支架,包括以下步骤:
(1)配制FITC海藻酸钠溶液,浓度为20mg/mL,在高压静电场下,形成均匀的射流液滴, 滴入到浓度为0.1mol/L的氯化钙溶液中,发生凝胶化反应30分钟,即得FITC-海藻酸钙水凝胶 微球。
(2)将步骤(1)制备的微球与胶原溶液混合后,形成胶原水凝胶,5个平行样。在激光 共聚焦扫描显微镜下观察到凝胶中的绿色荧光标记的海藻酸钙微球结构(附图3中0min时间点 图像)。
(3)在步骤(2)的凝胶表面滴加柠檬酸钠,并继续激光共聚焦扫描,xyt模式下,观察 到海藻酸钙微球液化后形成的海藻酸钠分子从微球向周围胶原凝胶网络的扩散过程(附图3 中其他时间点图像),最终在胶原凝胶中原海藻酸钙微球结构的位置形成空腔,即类软骨陷 窝结构(附图3的B中可见光部分可见,海藻酸钙液化9分钟都变成海藻酸钠溶液时,空腔仍 然存在)。
实施例3
制备含有类软骨陷窝结构的硬度可调控的复合水凝胶支架,包括以下步骤:
(1)将海藻酸钠分子与呋喃基糠胺反应,利用海藻酸钠糖元上的-COOH与糠胺上的氨 基的酰胺化反应对海藻酸钠接枝改性,得到含有呋喃根的海藻酸钠(Alg-furan),通过核磁 质谱表征其接枝率为60%。
(2)将步骤(1)制备的羟基修饰后的海藻酸钠与未修饰的海藻酸钠按照1:9比例配制 成终浓度15mg/mL海藻酸钠混合溶液。
(3)将步骤(2)制备的海藻酸钠混合溶液通过液体颗粒化技术制备成粒径在50微米的 海藻酸钙微球。
(4)配制4mg/mL胶原溶液。
(5)将步骤(3)制备的海藻酸钙凝胶微球,与步骤(4)制备的胶原溶液均匀混合,将混合液铺展成3mm厚度薄膜,升温至40℃形成包埋有海藻酸钙微球的胶原复合水凝胶,同等条件制备18个平行样品。
(6)在步骤(5)制备的水凝胶表面滴加柠檬酸钠溶液,生理条件下液化反应10分钟, 弃去柠檬酸钠溶液,PBS清洗3次,此时水凝胶中形成空腔,即类软骨陷窝结构。
(7)在步骤(6)的水凝胶样品分成6组,G1-4表面滴加离子交联剂氯化钙溶液反应10 分钟,G5-6表面滴加离子交联剂氯化钡溶液反应10分钟,弃去离子交联剂,PBS清洗3次。G1 和G5样品组备用。
(8)在步骤(7)制备的样品中,G2和G6表面滴加两端端基为马来酰亚胺基团的2臂-聚 乙二醇(mal-PEG-mal);G3表面滴加马来酰亚胺基团修饰的4臂-聚乙二醇;G4表面滴加马 来酰亚胺基团修饰的8臂-聚乙二醇。通过Diels-Alder(DA)点击化学反应形成共价键,制备 DA点击化学交联的水凝胶支架。
将步骤(7)、(8)制备的6组水凝胶支架样品,用力学测试机检测其基质刚度,每组3个平行样取均值,其基质刚度分别为G1-83kPa;G2-220kPa;G3-480kPa;G4-890kPa; G5-130kPa;G6-370kPa。通过对交联剂浓度、种类等的调控,调节最终水凝胶支架硬度。
对于任何熟悉本领域的技术人员而言,在不脱离本发明技术方案范围情况下,都可利用 上述揭示的技术内容对本发明技术方案作出许多可能的变动和修饰,或修改为等同变化的等 效实施例。因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例 所做的任何简单修改、等同变化及修饰,均应仍属于本发明技术方案保护的范围内。
