用于高效递送核酸类药物的脂肽载体及其制备方法和应用
文献发布时间:2023-06-19 18:34:06
技术领域
本发明属于医药技术领域,具体涉及一种用于高效递送核酸类药物的脂肽载体及其制备方法和应用,其应用还涉及基于此脂肽载体制备的高效核酸类药物递送系统。
背景技术
近年来,随着对基因相关发病机制的不断深入研究,以及分子生物学和生命科学技术的不断发展,包括质粒DNA(pDNA)、反义寡核苷酸(ASO)、小干扰RNA(siRNA)、信使RNA(mRNA)和微小RNA(miRNA)等在内的核酸类药物受到了广泛关注。其中,一些核酸类药物已获得批准上市,用于临床治疗,例如,Vitravene,Gendicine,Onpattro等。然而,裸核酸类药物在体液和细胞内运输过程中面临一系列障碍,如在血液中易被快速降解、容易激活天然免疫系统、肝肾清除速度快、细胞摄取效率低以及难以从溶酶体中逃逸等问题,极大阻碍了核酸类药物的临床应用。因此,开发合适的核酸类药物递送载体成为此类药物临床应用的主要技术瓶颈。
核酸类药物的递送载体主要包括病毒类载体和非病毒类载体两大类。病毒类载体有着感染细胞的天然机制,具有将自身基因导入靶细胞的完整体系,细胞转染效率非常高。但是,病毒类载体存在制备工艺复杂、载药量小、免疫原性强等问题,其在安全性上存在的隐患极大地限制了临床应用。非病毒类载体是一些生理条件下荷正电的聚合物、脂质或其衍生物等,例如,阳离子聚合物,阳离子脂质体等。非病毒类载体制备工艺相对简单、载药量高、无免疫原性,逐渐成为核酸类药物递送的首选载体。然而,非病毒类载体也存在的主要制约因素是核酸类药物的递送效率较低。其主要原因在于:1.多数非病毒类载体是借助载体和核酸类药物之间的静电相互作用实现载药,在靶细胞中缺乏高效的药物解离机制;2.非病毒类载体多以内吞形式被摄取进入细胞,形成内涵体并逐渐熟化形成溶酶体。在这个过程中,伴随着酸性的增强和酶的增加,导致核酸类药物被降解失活。有文献报道,通过脂质纳米粒介导的siRNA递送,只有1~2%可以从溶酶体中逃逸出来进入胞浆发挥蛋白沉默作用(Image-based analysis of lipid nanoparticle–mediated siRNA delivery,intracellular trafficking and endosomal escape[J].Nature Biotechnology.2013,31(7):638-646.)。因此,构建安全有效的核酸类药物递送载体成为该领域亟待解决的关键问题。
随着大量具有特殊生物活性的多肽被发现、分离以及多肽合成技术的发展,多肽越来越多地用于核酸类药物的递送载体,多肽类载体的发展也从早期的天然多肽或其衍生物逐步发展到功能性的合成多肽。人们逐渐发现天然或功能性合成多肽载体可以帮助克服核酸类药物递送面临的一系列细胞内、外的屏障,从而提高核酸药物递送效率。例如,Chou(Enhanced silencing and stabilization of siRNA polyplexes by histidine-mediated hydrogen bonds.Biomaterials.2014;35(2):846-855.)等发现组氨酸可以通过与siRNA形成氢键方式来稳定siRNA复合物。Futaki(Stearylated Arginine-RichPeptides:A New Class of Transfection Systems[J].Bioconjugate Chemistry,2001,12(6):1005.)等发现寡聚精氨酸可以促进siRNA的溶酶体逃逸过程,并且对其N端进行烷基化修饰,可以进一步增强其介导溶酶体逃逸的能力。但是多肽类载体也面临着一定的局限性,多肽类载体比如寡聚精氨酸与核酸药物形成的复合物稳定性和溶酶体逃逸效率均有待加强。
发明内容
本发明的目的在于提供一种用于高效递送核酸类药物的脂肽载体及其制备方法和应用,用于高效递送核酸类药物的脂肽载体可用于包载质粒DNA、反义寡核苷酸、小干扰RNA、信使RNA等核酸类药物,制备的核酸类药物递送系统,具有pH响应性,包载能力好,具有抵御阴离子置换的能力,能够提高核酸类药物在血清中稳定性,有效延长其体内的半衰期,有效降低核酸类药物的解离和释放,有效地介导核酸类药物的内涵体逃逸。
为了实现上述目的,本发明采用以下技术方案:
本发明的一种用于高效递送核酸类药物的脂肽载体,包括疏水性脂肪酸片段和多肽片段。
进一步的,疏水性脂肪酸片段选自脂肪酸,脂肪酸的碳链长度大于3,且在顺式或反式构型碳链中含1至6个双键。脂肪酸包括但不限于饱和脂肪酸和/或不饱和脂肪酸,饱和脂肪酸优选为月桂酸,豆蔻酸,棕榈酸,硬脂酸中的一种或几种,不饱和脂肪酸优选为油酸,亚油酸,亚麻酸,花生四烯酸,二十碳五烯酸,二十二碳六烯酸中的一种或几种。
所述的多肽片段包括可阳离子化片段和辅助性多肽片段。
进一步的,可阳离子化片段为碱性氨基酸组成的可阳离子化片段,进一步的,碱性氨基酸选用寡聚精氨酸和/或寡聚赖氨酸,其中,碱性氨基酸的聚合度为1~30,优选聚合度为1~20,更优选聚合度为1~10。
进一步的,辅助性多肽片段由任意氨基酸组成,更优选为由寡聚组氨酸、寡聚色氨酸,寡聚丝氨酸或任意氨基酸寡肽中的一种或几种混合组成,其中,辅助性多肽片段的聚合度为1~30,优选聚合度为1~20,更优选聚合度为1~15。
本发明的一种用于高效递送核酸类药物的脂肽载体的制备方法,包括以下步骤:
S1:根据所述的用于高效递送核酸类药物的脂肽载体的结构要求,选择符合要求的疏水性脂肪酸片段和多肽片段,其中,多肽片段包括可阳离子化片段和辅助性多肽片段;
S2:将疏水性脂肪酸片段中的游离羧基与可阳离子化片段N端的游离氨基缩合形成酰胺键,可阳离子化片段多肽片段的C端与辅助性多肽嵌段的N端或者C端通过二硫键或酰胺键相互连接,形成两亲性脂肽分子,作为用于高效递送核酸类药物的脂肽载体。
本发明的用于高效递送核酸类药物的脂肽载体的应用,用于包载核酸类药物。
本发明的用于高效递送核酸类药物的脂肽载体的应用,用于包载核酸类药物后,制备得到核酸类药物递送系统。
所述的核酸类药物选自质粒DNA、反义寡核苷酸、小干扰RNA、微小RNA、信使RNA中的一种或几种。
所述的用于高效递送核酸类药物的脂肽载体,PD-L1 siRNA的浓度为50nM时,蛋白沉默率为85-90%,比Lipo2000脂质体转染试剂高1.4倍以上。
本发明的用于高效递送核酸类药物的脂肽载体,其包载核酸类药物后作为核酸类药物递送系统,其作用原理是:用于高效递送核酸类药物的脂肽载体是两亲性脂肽分子,其中的可阳离子化片段可通过静电相互作用包载荷负电的核酸类药物;辅助性多肽片段可以提供静电或非静电作用力,辅助压缩核酸类药物,疏水性脂肪酸片段可以平衡用于高效递送核酸类药物的脂肽载体的亲疏水性,提供疏水作用力、氢键作用力或范德华作用力。用于高效递送核酸类药物的脂肽载体与荷负电的核酸类药物可以通过自组装形成纳米颗粒,和/或与PEG化磷脂或聚合物表面自组装形成PEG化纳米颗粒。
用于高效递送核酸类药物的脂肽载体中的辅助性多肽片段可以是具有pH敏感性质的氨基酸寡肽,在溶酶体酸性条件下,辅助性多肽片段发生质子化,嵌段由疏水性转变为亲水性,同时暴露二硫键/酰胺键,二硫键在还原酶/酰胺酶的作用下断裂,使得递送系统结构和压缩核酸分子的作用力受到破坏,从而实现核酸分子的快速促发释放。此外,pH敏感性质的多肽片段还可以诱发“质子海绵”效应,脂肪酸修饰的可阳离子化片段会与溶酶体膜可产生相互作用增加其通透性,增强核酸分子的溶酶体逃逸速率,从而实现高效细胞浆递送。
附图说明
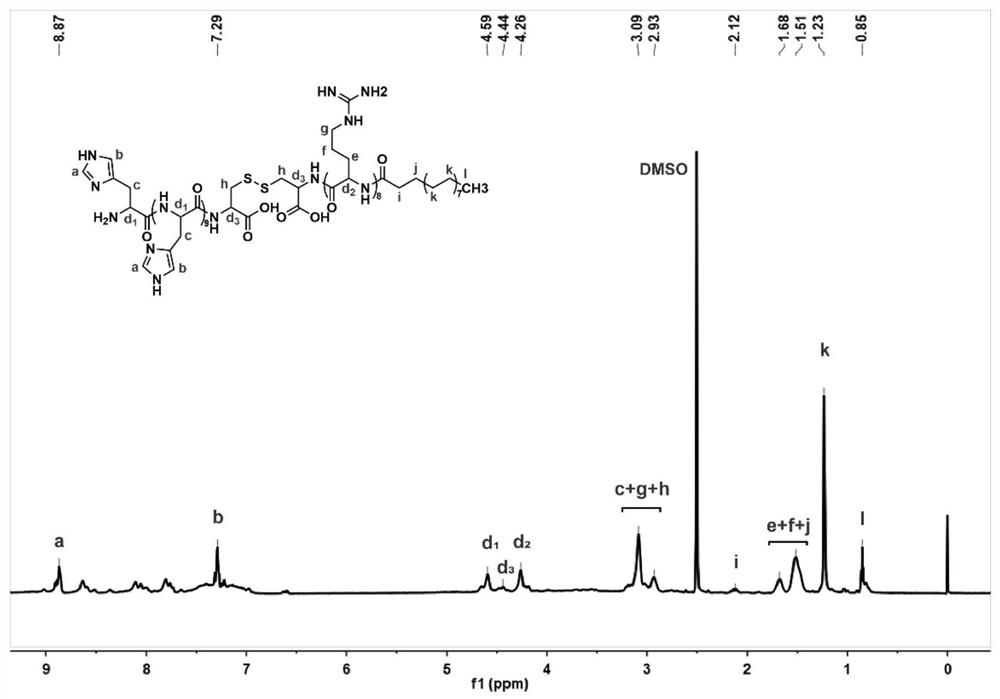
图1为本发明所述实例1stearyl-Arg
图2为本发明所述实例1stearyl-Arg
图3为本发明所述实例1stearyl-Arg
图4为本发明所述实例1stearyl-Arg
图5为本发明所述实例2的不同pH条件下临界胶束浓度曲线。
图6为本发明所述实施例5的脂肽复合物抵御阴离子置换能力。
图7为本发明所述实施例5的脂肽复合物血清稳定性。
图8为本发明所述实施例6的siRNA脂肽复合物(N/P 25)体外释放曲线。
图9为本发明所述实施例6的不同N/P脂肽复合物的siRNA累积释放量。
图10为本发明所述实施例7的共聚焦法考察溶酶体逃逸结果图。
图11为本发明所述实施例8的体外蛋白沉默效率结果图。
图12为本发明所述实施例9的体内抗肿瘤药效结果图。
具体实施方式
下面结合具体实施例对本发明做进一步描述。应当理解,以下实施例仅作为范例用于更为清楚的描述本发明的优点和特点,并不对本发明的权利要求构成任何限制。
实施例1:pH/氧化还原双敏感脂肽的合成
利用Fmoc固相多肽合成法合成精氨酸
利用Fmoc固相多肽合成法分别合成His
由于不同种类的脂肪酸和氨基酸寡肽在化学结构上具有相同的活性基团,通过改变起始物料脂肪酸的种类、寡肽的氨基酸种类,可以灵活地得到不同化学结构的脂肽分子,如棕榈酸-精氨酸
实施例2:pH/氧化还原双敏感脂肽stearyl-Arg
采用芘荧光探针技术测定stearyl-Arg
实施例3:脂肽复合物的制备
称取适量DSPE-PEG
实施例4:PD-L1 siRNA脂肽复合物的制剂学性质考察
(1)包封率
采用超滤离心法测定siRNA的包封率。精密吸取1.0mL荧光标记的siRNA(FAM-siRNA)、mRNA(FAM-mRNA)、DNA(FAM-DNA脂肽复合物,加入
表1不同脂肽复合物的包封率、粒径和电位结果
通过以上表内结果表明,不同核酸药物复合物的包封率在N/P 15至30范围内,包封率均大于90%,粒径均小于120nm,表明脂肽对不同的核酸药物均具有较好的包载能力。
实施例5:脂肽复合物的稳定性考察
(1)阴离子置换实验
取不同N/P(25,35和45)的Bcl-2siRNA脂肽复合物,按照肝素钠与siRNA的比例为2,4,6,8,10,12,16,20和25(IU/μg)加入肝素钠溶液,涡旋10min,取10μL与3μL50%蔗糖溶液混合均匀,上样,进行电泳(电压100mV,电泳时间10min)。结果图6所示,三种不同N/P的递送系统均具有一定抵御阴离子置换的能力,且随着N/P的增加,这种抵御能力也变得越强。
(2)血清稳定性实验
取不同N/P(25,35和45)的Bcl-2siRNA脂肽复合物,与新生牛血清等体积混合后,置于37℃摇床中孵育,分别在0、1、2、4、6、8、12和24小时各取样10μL,置于-20℃条件下保存。待所有样品采集完毕后,加入肝素钠置换样品中的siRNA(肝素钠/siRNA(IU/μg)=20),涡旋10min后,与3μL 50%蔗糖溶液混匀,上样,进行电泳(电压100mV,电泳时间10min)。以等量裸siRNA作为对照组。结果图7所示,裸siRNA易被核酸酶降解,在血清中孵育6h基本被完全降解;而不同N/P的Bcl--2siRNA脂肽复合物在与血清共孵育24h后仍能观察到明显的siRNA条带,说明Bcl--2siRNA脂肽复合物对siRNA具有较好的保护作用,可以显著增加siRNA在血清中的稳定性,有效延长其体内的半衰期。
实施例6:PD-L1 siRNA脂肽复合物的体外触发释放行为的考察
采用透析法测定siRNA的触发释放行为。将PD-L1 siRNA脂肽复合物(N/P 25,35和45)装于透析膜(截留分子量为50kD)中,浸泡在不同的透析介质中(pH 7.4(PBS,0.01M),pH7.4(PBS,0.01M)+5mM GSH,(pH 6.5(PBS,0.01M),pH 6.5(PBS,0.01M)+5mM GSH,pH 5.5(PBS,0.01M),pH 5.5(PBS,0.01M)+5mM GSH),置于恒温摇床中振摇(37℃,100rpm/min),在0.5、1、2、3、4、5、6、8、10、12、24、36和48小时采样。采用荧光分光光度法测定FAM-siRNA的累积释放量。
siRNA的累计释放曲线如图8所示,pH7.4生理条件下,无明显的突释现象,释放曲线较平缓且累计释放量较低。随pH从7.4降低到5.5,siRNA的累积释放量从13.23±0.89%增加到70.42±1.46%。在此基础上,还原性条件进一步促进siRNA的释放,在pH 5.5+5mMGSH环境下,siRNA最大累积释放量曾至79.09±0.75%。综上可以看出,siRNA的释放呈现pH和还原双重依赖性。此外,通过对比不同N/P的PD-L1 siRNA脂肽复合物的累计释放量(图9),可以看出siRNA的触发释放行为还具有N/P比依赖性。在低N/P时,表现出较明显的pH/氧化还原敏感释放行为。N/P升高后,siRNA触发释放特性变得不明显,且累计释放量显著降低。推测是由于高N/P的条件下,阳离子浓度较高,与siRNA之间形成较强的静电作用力,此时PD-L1 siRNA脂肽复合物结构的转变并不足以破坏二者之间的静电相互作用,因此,极大地降低了siRNA从脂肽复合物中的有效解离和释放。
实施例7:PD-L1 siRNA脂肽复合物的溶酶体逃逸行为考察
取对数生长期的B16F10细胞,以2×10
实施例8:siRNA脂肽复合物的体外蛋白沉默效率
通过蛋白免疫印迹(Western Blotting)方法考察不同siRNA脂肽复合物的体外蛋白沉默效率。取对数生长期的B16F10细胞,以1×10
结果如图11所示,不同脂肽复合物的蛋白沉默效率均较高,说明在此N/P条件下,siRNA可以有效的从载体中释放并逃逸到胞浆中发挥蛋白沉默作用。随着N/P的升高,沉默效率逐渐降低,推测可能是由于高N/P产生较强的静电相互作用,导致siRNA无法有效的解离释放,从而无法到达胞浆发挥蛋白沉默作用。
实施例9:PD-L1 siRNA脂肽复合物的体内抗肿瘤作用
取健康C57BL/6小鼠(6周龄,体重约20g),于右侧腋下注射小鼠黑色素瘤B16F10细胞(1×10
结果如图12所示,生理盐水组和空白脂肽复合物组的肿瘤体积增长较快,且两组无显著性差异,表明PD-L1 siRNA脂肽复合物材料本身无肿瘤生长抑制作用(P>0.05)。与生理盐水组相比,PD-L1 siRNA脂肽复合物组的肿瘤体积增长均显著减慢。其中,N/P 25组的肿瘤生长抑制作用最为明显,随着N/P的增加,抑制作用逐渐减弱。这与体外释放和溶酶体逃逸实验结果相似,表明siRNA的有效解离以及溶酶体逃逸过程对其蛋白沉默作用的发挥起至关重要的作用。
- 核酸-药物结合物、药物递送系统及其制备方法和应用
- 基于核酸材料负载铂类药物结合物、铂类药物递送系统及其制备方法和应用
- 用于核酸递送的包含脂化的阳离子肽化合物的脂质纳米颗粒制剂
