一种抗菌抗蛋白涂层及其制备方法
文献发布时间:2023-06-19 19:00:17
技术领域
本发明属于天然高分子领域,涉及一种抗菌抗蛋白涂层及其制备方法。
背景技术
蛋白质的非特异性吸附,是指蛋白质出于其结构特性,例如同时具备亲水性与疏水性、带有大量的氢键、带电基团,能够与许多不同类型的表面产生或强或弱的相互作用,引起在表面的吸附行为。蛋白质的非特异性吸附(Non-specific adsorption)给不断发展的新材料的实际应用带来了诸多问题:在工业生产中,膜分离过程已成为原材料处理、产品质量提升以及降低生产污染等许多环节的重要工艺,然而分离膜微孔中常常发生的蛋白吸附与生物体滞留会导致膜通量严重降低,减少分离膜的工作寿命。
邢卫红等研究了膜表面的性质对膜污染的影响。一般认为粗糙膜由于大的粗糙度会增加颗粒与膜间的接触面积,使更多的颗粒或蛋白等污染物被膜表面吸附,导致通量迅速衰减。膜表面的亲水性也是影响膜污染的重要因素,通常亲水性强的膜能够有效抑制蛋白质等污染物的吸附,因而能够减少膜污染的形成,PEG链的亲水性能好,可结合大量的水分子,高度流动,有很大的空间排斥力,通过围绕分子链的氢键,形成了“空间排斥”和水和层,从而阻止非特异性蛋白质在材料表面的吸附。因此,将PEG固定到表面是赋予材料抗蛋白吸附性能的最普遍方法之一。但PEG类聚合物制成的表面虽然能有效阻抗蛋白质的吸附,并不能完全保证可以阻止细菌的黏附。在抗蛋白吸附、低污染功能表面的研究中,两性离子聚合物展现的优越性能受到许多研究者的关注。诸多不同结构的两性离子基团与聚合物被合成出来,许多表面功能的手段与应用方法也不断被提出。然而,但由于两性离子聚合物自身的水溶性极好,在水溶液中常常难以稳定地附着在材料表面,也因此难以在固体界面发生抗污染作用。
胶原多肽作为优良的天然高分子材料,具有良好的生物相容性、生物可降解性、低生物毒性和优良的延展性等特征,是一种极具研究价值的环境友好型天然高分子膜材料。但是,天然的胶原多肽易霉变,易滋生细菌等,从而限制了胶原多肽在膜分离过程中的应用。金露等,2014年10月10日于全国口腔材料学术交流会公开,钛种植表面接枝大分子季铵盐增强材料表面抗菌性的研究。通过ATRP技术在钛片表面成功接枝聚甲基丙烯酸二甲氨基乙酯(DMAEMA)高分子,并利用十六烷基溴进一步使DMAEMA分子末端的叔胺基团发生N-烷基化反应,获得季铵化聚合物。表明改性后的钛片表面对大肠杆菌和金黄色葡萄球菌均有显著的杀灭作用。
但是,高分子化的季铵盐化合物在对材料进行改性处理时,具有以下缺陷,高分子聚合物其链段的空间位阻较大,溶液中的聚合物链段很难继续与材料表面接触反应,因此接枝密度往往不高,随着大分子季铵盐分子量的增大,空间位阻变大,接枝效率也会降低。因此会影响改性性能,且其抗蛋白性能没有明显提升。
发明内容
本发明为了解决现有技术中小分子季铵盐易溶解渗出、化学稳定性不佳、而大分子季铵盐空间位阻大、接枝率低的缺点,以及现有膜材料由于蛋白质的非特异性吸附易造成污染的问题。提供一种抗菌抗蛋白涂层及其制备方法。本发明通过在钛基胶原多肽单层膜上接枝双环氧季铵盐、马来海松酸季铵盐以及聚硅氧烷来改变膜表面的抗蛋白及抗菌性能。
本发明的目标是合成一种基于季铵盐-聚硅氧烷接枝物(其疏水性来自于聚硅氧烷嵌段,亲水性来自于接枝两种季铵盐)的抗菌涂层,多肽分子通过自组装技术附着在材料表面,而接枝分子通过与多肽单层膜接枝反应,使得接枝物能够在材料表面的稳定附着,同时利用亲水段实现材料表面亲水化、抗菌化,具备抗蛋白吸附能力。
蛋白质的黏附会在表面形成一层蛋白质膜,为细菌、真菌等微生物在表面的繁殖提供生存条件,抗蛋白性即抗蛋白质的非特异性吸附(Non-specific adsorption)。
本发明中的马来海松酸季铵盐分子量为585.09g/mol,非高分子季铵盐,双环氧季铵盐烷基链分子量为301g/mol,为小分子季铵盐。
为了实现以上目的,本发明采用以下技术方案:
一种抗菌抗蛋白涂层,其特征在于,所述涂层为多肽单层膜接枝环氧聚硅氧烷、双环氧季铵盐与马来海松酸季铵盐,双环氧季铵盐的接枝率为2~3%,马来海松酸季铵盐的接枝率为1.2~2.1%,环氧聚硅氧烷的接枝率为1.0~1.8%,所述涂层的接触角为73°~77°,所述涂层在0.1g/L的牛血清白蛋白溶液中,对牛血清白蛋白的抗吸附率为81%~87%;在1g/L的牛血清白蛋白溶液中,对牛血清白蛋白的抗吸附率为97%~99%。
优选的,所述涂层对大肠杆菌的的抗菌率为89~92%,对金黄色葡萄球菌的抗菌率为90~94%。优选的,所述涂层的表面粗糙度为4~7nm。优选的,双环氧季铵盐的接枝率为2.1~2.6%,马来海松酸季铵盐的接枝率为1.6~2.1%,环氧聚硅氧烷的接枝率为1.1~1.8%。
优选的,所述涂层为多肽单层膜接枝环氧聚硅氧烷、双环氧季铵盐与马来海松酸季铵盐,双环氧季铵盐的接枝率为2.5±0.05%,马来海松酸季铵盐的接枝率为2.0±0.05%,环氧聚硅氧烷的接枝率为1.2±0.05%,所述涂层的接触角为73±0.5°,所述涂层在0.1g/L的牛血清白蛋白溶液中,对牛血清白蛋白的抗吸附率为87±0.5%;在1g/L的牛血清白蛋白溶液中,对牛血清白蛋白的抗吸附率为98±0.2%。
本发明抗蛋白吸附性的测试方法为:
将Ti片作为对照,将Ti片和待测涂层(实验组)用无水乙醇和去离子水分别冲洗,再用PBS=7.4的缓冲溶液冲洗,以除去涂层表面的活性基团和污染物;取对照组和实验组涂层的盖玻片(2×2cm)放入六格板中,先用PBS缓冲溶液浸泡3h后;将PBS溶液倒出并将板内和样品擦干,分别加入10mL 0.1g/L或1g/L的牛血清白蛋白(BSA)溶液,在30℃下恒温静态吸附5h,待吸附平衡后,取出样品,测定BSA溶液在280nm处的吸光值,根据吸光值-BSA浓度标准曲线,计算得到单位面积上吸附的BSA量;
抗蛋白吸附率=(对照组单位面积上吸附的BSA量-实验组单位面积上吸附的BSA量)/对照组单位面积上吸附的BSA量。
所述吸光值-BSA浓度标准曲线绘制:以不同浓度的牛血清白蛋白在298nm处的吸光度值A绘制A-ρ标准工作曲线(A为吸光度,ρ为BSA浓度),在0-10g/L内线性回归方程得到为A=0.04987ρ+0.02972,其相关系数R
所述抑菌率的计算公式为:抑菌率AR(%)=(CFU
抑菌率测试方法为:金黄色葡萄球菌(S.aureus)和大肠杆菌(E.coli)生长到中对数阶段,将细菌悬浮液稀释至10
所述接枝率的定义为:
接枝反应前、后膜上伯氨基摩尔量的变化量占接枝反应前膜上伯氨基摩尔量的百分比。
接枝马来海松酸季铵盐,或环氧聚硅氧烷前、后膜上伯氨基摩尔量的变化量分别可通过(W
优选的,所述双环氧季铵盐(DEQAS)的分子式如下所示:
所述马来海松酸季铵盐(MPA-N+)的分子式如下所示:
所述环氧聚硅氧烷(PDMS-E)的分子式如下所述:
优选的,所述多肽单层膜是由分子量为(1.48±0.2)×10
进一步优选的,所述多肽单层膜是由分子量为(1.48±0.2)×10
进一步优选的,所述多肽单层膜是由分子量为(1.48±0.2)×10
进一步优选的,所述双环氧季铵盐的合成方法,包括以下步骤:
(1)将硫酸钾、溶剂以及环氧氯丙烷混合后于45~55℃加热搅拌0.5h~1h;
(2)向步骤(1)的混合溶液中滴加四甲基乙二胺,滴加四甲基乙二胺的时间为25~35min;恒温的温度为45~55℃,恒温搅拌1~2h;
(3)将反应物减压蒸馏除去溶剂,得到淡黄色的液体即双环氧季铵盐。
优选的,四甲基乙二胺、环氧氯丙烷的摩尔比为1.0:0.5~1.5。
优选的,步骤(1)中硫酸钾与环氧氯丙烷的摩尔比为0.9~1.1:100。
优选的,步骤(1)中环氧氯丙烷与溶剂的质量体积比为0.2~0.3g/mL。进一步优选的,步骤(1)中蒸馏水和甲醇作为溶剂,两者体积比为V(甲醇):V(蒸馏水)=1:0.8~1.8。
进一步优选的,马来海松酸季铵盐的合成方法,包括以下步骤:
(1)氮气气氛下,将松香酸加热至一定温度并保持一定时间,然后冷却至120~125℃,加入马来酸酐和乙酸;在120~130℃下回流12~15h;冷却至室温,重结晶得到马来海松酸;松香酸和马来酸酐的物质的量之比为1.0:0.8~1.2;
(2)将马来海松酸溶解在乙醇中,然后加入N,N-二甲基乙二胺加热,然后冷却至室温,过滤干燥得到化合物(MPA-N,马来海松酸基胺);马来海松酸和N,N-二甲基乙二胺的物质的量之比为1.0:0.9~1.1;
(3)将化合物(MPA-N)与溴乙烷溶解在干燥的四氢呋喃中,加热反应,过滤得到产物马来海松酸季铵盐(MPA-N
优选的,步骤(1)中所述加热温度维180~185℃并维持3~3.5h。
优选的,步骤(2)中所述加热温度为85~90℃,并维持搅拌5~5.5h。
优选的,步骤(3)中所述加热温度为40~45℃,并维持搅拌48~50h;化合物(MPA-N)与溴乙烷的物质的量之比为1.0:18~21。
本发明还提供上述抗菌抗蛋白涂层的制备方法,其特征在于,包括以下步骤:
(1)将双环氧季铵盐加入到碳酸钠/碳酸氢钠缓冲液种,超声处理,使双环氧季铵盐充分分散在缓冲溶液中得到混合溶液;
(2)将胶原多肽单层膜置于步骤(1)的混合溶液中,于48~52℃,反应10~11h后,在蒸馏水中提拉10次以上,去除掉弱结合或者未结合的季铵盐,即得到胶原多肽-DEQAS涂层,用高纯氮气吹干后置于氮气中保存;
(3)将EDC(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)、NHSS(N-羟基硫代琥珀酰亚胺)和马来海松酸季铵盐加入到碳酸钠/碳酸氢钠缓冲液种,超声处理,使马来海松酸季铵盐充分分散在缓冲溶液中得到混合溶液;
(4)将胶原多肽单层膜置于步骤(3)的混合溶液中,于48~52℃水浴中,反应10~11h后,在蒸馏水中提拉10次以上,去除掉弱结合或者未结合的季铵盐,即得到胶原多肽-DEQAS-(MPA-N
(5)将环氧聚硅氧烷加入到碳酸钠/碳酸氢钠缓冲液种,超声处理,使环氧聚硅氧烷充分分散在缓冲溶液中得到混合溶液;
(6)将胶原多肽单层膜置于步骤(5)的混合溶液中,于48~52℃水浴中,反应10~11h后,在丙酮中提拉10次以上,去除掉弱结合或者未结合的环氧聚硅氧烷,即得到抗菌抗蛋白涂层,用高纯氮气吹干后置于氮气中保存。
优选的,所述缓冲液的pH=9.6。优选的,步骤1)中,双环氧季铵盐的浓度为0.008~0.01mol/L;步骤3)中,混合溶液中马来海松酸季铵盐的浓度为0.01~0.02mol/L;步骤5)中环氧聚硅氧烷的浓度为0.01~0.02mol/L。
优选的,步骤(1)中马来海松酸季铵盐和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)的摩尔比为:n(MPA-N
马来海松酸季铵盐和N-羟基硫代琥珀酰亚胺(NHSS)的摩尔比为:n(MPA-N+):n(NHSS)=1:850~860。
本发明还提供上述抗菌抗蛋白涂层在膜分离工程中的应用。
本发明的有益效果:
本发明利用碱性条件下胶原多肽单层膜上面的伯氨基与季铵盐上的羧基或氨基进行接枝,胶原多肽单层膜与马来海松酸季铵盐和双环氧季铵盐之间以共价键的方式结合;伯氨基与双环氧季铵盐上的环氧基开环反应进行接枝,环氧基团具有较高的化学反应活性,更易于和胶原多肽中的伯氨基发生交联反应,从而将季铵盐本身含有的功能基团引入到胶原多肽单层膜中,使得胶原多肽的抗菌、抗蛋白性能能得到改善。同时接枝马来海松酸季铵盐和双环氧季铵盐,以及环氧聚硅氧烷,使涂层具有抗菌、抗蛋白、耐腐蚀的特性,更好的用于膜分离工程。
附图说明
图1涂层的水接触角(WCA)图像;
图2涂层的光学显微镜(OM)图像;
图3涂层的原子力显微镜(AFM)图像;
图4涂层的原子力显微镜(AFM)3D图像;
图5大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)在不同涂层样品表面经过24h培养后的菌落图片;
图6大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)在不同涂层样品表面经过24h培养后的菌落计数;
图7大肠杆菌(E.coli)和金黄色葡萄球菌(S.aureus)在不同涂层样品表面经过24h培养后的杀菌率;
图8牛血清白蛋白浓度与吸光度工作曲线;
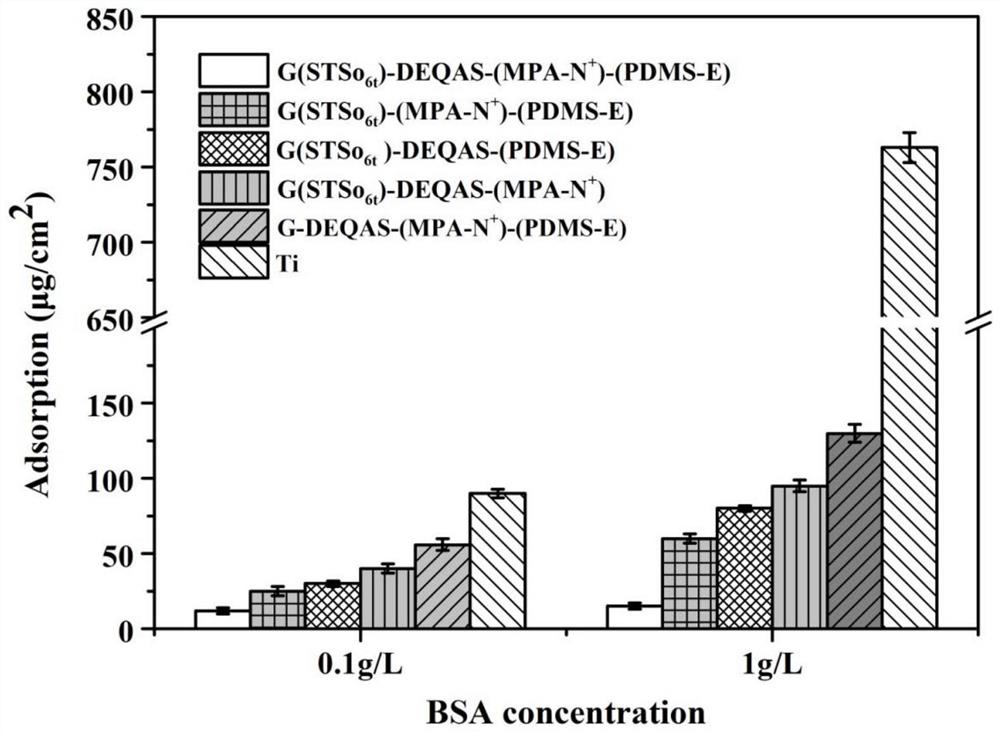
图9涂层在浓度为0.1g/L和1.0g/L的BSA溶液中的蛋白吸附量。
具体实施方式
本发明实施例所用试剂除非特别说明,均为普通市售产品,本发明1g胶原多肽中含有伯氨基5.6×10
本发明中马来海松酸季铵盐的制备方法,包括以下步骤:
(1)在氮气气氛下,在恒温回流冷凝器中,将松香酸(100.0g,0.28mol)加热至180℃并保持3h。之后,将反应混合物的温度冷却至120℃,并加入马来酸酐(27.5g,0.28mol)和乙酸(400.0mL)。将反应在120℃下回流12h,然后将反应冷却至室温,并使其静置另外2h。沉淀出粗制马来酸,并从乙酸中重结晶两次,得到纯马来酸(87.0g,纯度:96%,产率:74wt%)。
(2)将马来酸(MPA,10.0g,0.025mol)溶解在乙醇(250.0mL)中,然后加入N,N-二甲基乙二胺(2.8mL,0.025mol)后加热至85℃搅拌5h。然后将溶液冷却至室温。当化合物(MPA-N)从溶液中沉淀出来时,将其过滤并干燥(9.0g,纯度:96%,产率:73wt%)。
(3)将上述化合物(MPA-N,1.0g,0.0021mol)与溴乙烷(3.1mL,0.043mol)溶解在干燥的四氢呋喃(THF,30.0mL)中加热至40℃搅拌48h。在40℃下保持反应48h。反应期间,粗产物(MPA-N
马来海松酸季铵盐的合成路线如下所示:
本发明中马来海松酸季铵盐的制备方法可参考文献:
Li Z,X Yang,Liu H,etal.Dual-functional antimicrobial coating based ona quaternary ammonium salt from rosin acid with invitro and in vivoantimicrobial and antifouling properties[J].Chemical Engineering Journal,2019,374:564-575。
本发明中双环氧季铵盐的制备方法:包括以下步骤:
(1)取250mL三口烧瓶,向其中依次加入蒸馏水(22.0mL)、硫酸钾(0.2g)、甲醇(17.0mL)以及环氧氯丙烷(9.5g),然后于50℃,加热搅拌0.5h;
(2)在上述搅拌过程中,以12d min
(3)将反应后的混合物倒入250mL圆底烧瓶中,进行减压蒸馏除去溶剂,得到淡黄色的液体。
双环氧季铵盐的合成路线如下所示:
双环氧季铵盐的制备方法也可参考Shilin Xu等,A multifunctional gelatine–quaternary ammonium copolymer:An efficient material for reducing dye emissionin leather tanning process by superior anionic dye adsorption[J].Journal ofHazardous Materials,383(2020)121142.
本发明中所用环氧聚硅氧烷的制备方法,可参考:Zhu C,Xu J,Hou Z,etal.Scale Effect on Interface Reaction between PDMS-E Emulsion Droplets andGelatin[J].Langmuir,2017。本发明所用环氧聚硅氧烷的分子量为1000。
实施例1
一种抗菌抗蛋白涂层G(STSo
首先,制备多肽单层膜:
(1)配制浓度为4%wt的胶原多肽溶液50mL:精确称取胶原多肽100mL于三口烧瓶中,准确量取去离子水,把去离子水倒入三口烧瓶中,室温溶胀0.5h后,将三口烧瓶放入50±1℃的水浴中,加热搅拌2h,使其完全溶解,然后用2mol/L的氢氧化钠调节溶液的pH值至10.00±0.02,在水浴中稳定0.5h。
(2)向上述胶原多肽溶液中加入表面活性剂STSo,得到胶原多肽-STSo混合溶液,混合溶液中STSo的浓度为7.96mmol/L;在水浴中稳定6h备用。
(3)切割大小为1cm×1cm的方形钛片,使用金相砂纸按照,800,1500,3000,5000,7000目的顺序依次打磨抛光,依次用去离子水、无水乙醇、丙酮超声清洗钛片各15min,然后用高纯氮气吹干后在60℃烘箱干燥12h备用。
(4)配制30%H
(5)配制1mg/mL的PEI(聚乙烯亚胺)溶液,将(4)中的钛片用PEI溶液室温处理0.5h,后用去离子水清洗5次,去除掉弱结合或者未结合的电荷,最后用高纯氮气吹干后在60℃烘箱中干燥12h备用。
(6)将正离子化的钛片放入沉积盒中,分别向沉积盒中加入配置好的STSo-多肽溶液,50℃下沉积10min,然后将其在去离子水中提拉20次,用高纯氮气吹干后置于氮气中保存。所得胶原多肽层标记为G-STSo
其次,制备抗菌涂层:
(7)碳酸钠/碳酸氢钠缓冲液(pH=9.6)的配制:精确称取3.432g碳酸氢钠和0.969g碳酸钠于烧杯中,量取适量蒸馏水,用玻璃棒充分搅拌至完全溶解,然后将混合溶液用玻璃棒引流至清洗干净的容量瓶中,然后用蒸馏水润洗烧杯3次,引流至容量瓶中,最后用蒸馏水定容至1L;
(8)向反应瓶内加入上述缓冲液5mL和双环氧季铵盐(13.2mg),将反应瓶放置于超声清洗器中10min,使双环氧季铵盐尽量分散在缓冲溶液中(双环氧季铵盐的浓度为0.00877mol/L);然后将制备好的胶原多肽单层膜放置于上述反应瓶中,于50℃水浴中,反应12h后,在蒸馏水中提拉10次,去除掉弱结合或者未结合的季铵盐,用高纯氮气吹干后置于氮气中保存。所得涂层标记为G(STSo
(9)向另一反应瓶内加入上述缓冲液5mL、EDC(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)、NHSS(N-羟基硫代琥珀酰亚胺)和马来海松酸季铵盐(15.60mg)(n(MPA-N
(10)另取一反应瓶,加入上述缓冲液5mL和环氧聚硅氧烷(19.7mg),将反应瓶放置于超声清洗器中10min,使环氧聚硅氧烷尽量分散在缓冲溶液中(环氧聚硅氧烷的浓度为0.0197mol/L);然后将制备好的胶原多肽单层膜放置于上述反应瓶中,于50℃水浴中,反应12h后,在丙酮中提拉10次,去除掉弱结合或者未结合的环氧聚硅氧烷,用高纯氮气吹干后置于氮气中保存。所得涂层标记为G(STSo
环氧聚硅氧烷接枝率2.536%;马来海松酸季铵盐接枝率2.035%;双环氧季铵盐接枝率1.191%;对大肠杆菌和金黄色葡萄球菌的抑菌率分别为91.8%和93.3%。在0.1g/L的BSA溶液中吸附量为12μg/cm
G(STSo
实施例2
一种抗菌抗蛋白涂层G(STSocac)-DEQAS-(MPA-N
环氧聚硅氧烷接枝率2.108%;马来海松酸季铵盐接枝率1.069%;双环氧季铵盐接枝率1.531%。对大肠杆菌和金黄色葡萄球菌的抑菌率分别为89.3%和90.3%;在0.1g/L的BSA溶液中吸附量为17μg/cm
实施例3
一种抗菌抗蛋白涂层G(STSocmc)-DEQAS-(MPA-N
环氧聚硅氧烷接枝率2.357%;马来海松酸季铵盐接枝率1.735%;和双环氧季铵盐接枝率1.732%;对大肠杆菌和金黄色葡萄球菌的抑菌率分别为90.2%和92.1%,水接触角为76.7°。在0.1g/L的BSA溶液中吸附量为14μg/cm
实施例4
一种抗菌涂层G(SDS
所得抗菌涂层的粗糙度为6.72nm。环氧聚硅氧烷接枝率2.065%;马来海松酸季铵盐接枝率1.353%;双环氧季铵盐接枝率1.421%。;接触角74.5°,对大肠杆菌和金黄色葡萄球菌的抑菌率分别为87.6%和89.3%。在0.1g/L的BSA吸附率为80.5%,在1g/L的BSA溶液中抗吸附率为85.9%,
本发明使用自组装单分子层膜(SAMs)技术实现金属表面多官能团化,在分子尺度上创建具有受控表面或界面性质有序的有机表面。在Ti表面组装胶原多肽单层膜,通过加入表面活性剂调控胶原多肽构象调整表面组成,不同的表面活性剂得到的膜的表面性能、二级结构均不相同,从而接枝不同改性分子后,得到的膜的性能也差别较大。
对比例1
一种抗菌涂层G(STSo
马来海松酸季铵盐接枝率2.923%;双环氧季铵盐接枝率3.957%;接触角为72.1°。对大肠杆菌和金黄色葡萄球菌的抑菌率分别为98.1%和99.2%。在0.1g/L的BSA溶液中吸附量为40μg/cm
对比例2
一种抗菌涂层G(STSo
双环氧季铵盐的接枝率为3.735%;环氧聚硅氧烷的接枝率为1.756%,G(STSo6%
对比例3
一种抗菌涂层G(STSo
马来海松酸季铵盐的接枝率为3.235%;环氧聚硅氧烷的接枝率为1.632%;Ra=6.06nm。对大肠杆菌和金黄色葡萄球菌的抑菌率分别为84.1%和93.8%。在0.1g/L的BSA溶液中吸附量为25μg/cm
对比例4
一种抗菌涂层的制备方法,与实施例1相比,不同之处在于,在单层膜制备过程中没有加表面活性剂,仅将胶原多肽沉积到正离子化的钛片上,其他条件与实施例1相同,所得胶原多肽单层膜标记为G。所得涂层标记为G-DEQAS-(MPA-N
环氧聚硅氧烷接枝率1.218%;马来海松酸季铵盐接枝率1.156%;双环氧季铵盐接枝率1.837%;对大肠杆菌和金黄色葡萄球菌的抑菌率分别为39.6%和48.1%。在0.1g/L的BSA溶液中吸附量为56μg/cm
对比例5
一种抗菌涂层的制备方法,将10g明胶,加水搅拌加热至50℃,待明胶完全溶解后,加入氢氧化钠调节反应pH为10.0,得到质量浓度为5%的明胶溶液,然后加入双环氧季铵盐17.4mg、马来海松酸季铵盐44.3mg,EDC(1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐)、NHSS(N-羟基硫代琥珀酰亚胺)(其中,n(MPA-N
将正离子化处理的钛片放置于溶液2中,于50℃下沉积10min,然后将其在去离子水、丙酮中各提拉20次,用高纯氮气吹干后置于氮气中保存,得到涂层。
所得涂层对大肠杆菌的抗菌率为79.2%,对金黄色葡萄球菌的抗菌效果为82.3%,接触角为85.3°,粗糙度为72.7nm。所得抗菌涂层的厚度为微米级,而本发明实施例所得涂层均为纳米级厚度平均厚度为30~120nm。
所得膜在0.1g/L的BSA溶液中抗吸附率为43.21%,在1g/L的BSA溶液中抗吸附率为49.28%。
由以上结果可以看出,本发明通过将明胶制备成多肽单层膜后,再与双环氧季铵盐、马来海松酸季铵盐、环氧聚硅氧烷行接枝反应,不仅可以将膜的厚度控制在纳米级别范围内,还能进一步提高抗菌率和抗蛋白吸附率。说明多肽单层膜与明胶聚合物相比,结构、性能均发生了一定程度改变,其与季铵盐接枝后,膜的性能产生了预料不到的变化。另外,先对明胶进行改性后接枝的方法接枝率不易控制,所得涂层中有未接枝成功的小分子季铵盐,在后续使用过程中,易溶解渗出,加之未接枝的环氧聚硅氧烷存在分布不均匀问题,易导致膜的化学稳定性降低。
现有专利中报道,先对明胶聚合物进行改性后再涂抹到皮革表面形成改性涂层,其在涂饰过程中,溶液中的水分缓慢挥发,明胶组分与皮胶原之间的同源性促使二者之间产生较强的分子间相互作用而紧密结合,形成涂层。但是该方法无法控制伯氨基暴露,且仅适用于皮革等与明胶具有同源性的材料;该改性明胶与金属等材料没有较强的相互作用,涂层牢固度不好。
测试方法及步骤:
1、抗菌涂层表面润湿性测定
对膜样品采用DSA-100型光学接触角测量仪(Kruss公司,德国)在室温下测量水接触角(CA)。使用自动分配控制器将2mL去离子水滴到样品上,并使用Laplace-Young拟合算法自动确定CA。通过在五个不同位置测量样本获得平均CA值,并用数码相机(日本索尼有限公司)拍摄图像,结果如图1所示。
2、膜表面形貌测定
本发明抗菌涂层的形貌由DMI3000B倒置光学显微镜(徕卡,德国)上进行,该显微镜配备Lecia DFC 450C型CCD。观察前,需先将机器预热15min后使用,后将载玻片清洗干净,取待测样品于清洗干净的载玻片上,放在载物台上固定,先粗略调节载物台高度,随后微调聚焦,用明场找到最清晰的样品细节,先用50X观察分布情况,然后依次把倍数放大,观察其形貌。
图2为涂层的光学显微镜图像;(a)涂层G(STSo
3、膜表面平整度测定
本发明抗菌涂层的表面平整度由Multimode8型AFM(Bruker,德国)测定,将制备好的样品置于工作台上,以Peak Force模式对样品的形貌和平整度进行了表征,测试时,先用原子力显微镜自带的光学辅助系统找到边界,然后把测试范围设置为20μm以横跨样品区域,用AFM针尖进行扫描,扫描速度为0.977Hz,扫描范围为1μm,数据处理软件为AFM自带的NanoScope Analysis,结果如图3、4所示。图3为涂层的原子力显微镜(AFM)图像;(a)涂层G(STSo
由于大的粗糙度会增加颗粒与膜间的接触面积,使更多的颗粒或蛋白等污染物被膜表面吸附,导致通量迅速衰减。实施例1的粗糙度为4.26nm。本发明所得涂层的粗糙度均为纳米级别,粗糙度很小,有利于作为膜分离材料。
4、抗菌性测试
金黄色葡萄球菌(S.aureus)和大肠杆菌(E.coli)生长到中对数阶段。将细菌悬浮液稀释至10
5、抗牛血清白蛋白吸附测试
使用牛血清白蛋白(BSA)来研究无规共聚物表面对蛋白质的吸附性能,以此来表征共聚物的抗污性能。
(1)磷酸盐缓冲液的配制分别称取纯Na
(2)涂层对BSA吸附的测定
使用紫外分光光度计来考察涂层表面对牛血清白蛋白的吸附情况,并以此来表征共聚物的防污性能。首先,以不同浓度的牛血清白蛋白在298nm处的吸光度值A绘制A-ρ标准工作曲线(A为吸光度,ρ为BSA浓度),如图8所示,在0-10g/L内具有良好的线性关系,其线性回归方程为A=0.04987ρ+0.02972,其相关系数R
将样品(其中Ti为对照组,实施例或对比例样品为实验组)用无水乙醇和去离子水分别冲洗,再用PBS=7.4的缓冲溶液冲洗,以除去涂层表面的活性基团和污染物。取对照组和实验组涂层的盖玻片(2×2cm)放入六格板中,先用PBS缓冲溶液浸泡3h后;将PBS溶液倒出并将板内和样品擦干,分别加入10mL 0.1g或1g/L的BSA溶液,在30℃下恒温静态吸附5h,待吸附平衡后,取出样品,测定BSA溶液在280nm处的吸光值,得到单位面积上吸附的BSA量(四舍五入取整数)。
抗蛋白吸附率=(对照组单位面积上吸附的BSA量-实验组单位面积上吸附的BSA量)/对照组单位面积上吸附的BSA量。
表1 不同涂层在0.1g/L或1g/L BSA溶液中的蛋白质吸附量
由图9可以看出,空白样表面(Ti)的蛋白污染严重,在1.0g/L的BSA溶液中吸附量为763.0/cm
- 一种绷带用丝素蛋白整理的抗污抗菌聚丙烯无纺布的制备方法
- 一种用于制备涂层的抗菌型丙烯酸树脂的制备方法
- 一种用于海工液压活塞杆的镍基抗磨耐蚀涂层配方、涂层及其制备方法
- 一种抗菌性复合涂层的制备方法
- 一种抗菌和抗蛋白黏附涂层及其制备方法
- 一种抗菌和抗蛋白黏附涂层及其制备方法
