硼酸衍生物及其合成、多晶型和治疗用途
文献发布时间:2023-06-19 19:30:30
关于联邦资助R&D的声明
本发明是在美国政府支持下根据卫生和人类服务部合同号HHSO100201600026C进行的。美国政府享有本发明的某些权利。
背景
领域
本申请涉及化学和药物领域。更具体地,本申请涉及硼酸抗微生物化合物、组合物、其制备及其作为治疗剂的用途。
相关技术描述
在过去的半世纪中,抗生素是治疗传染性疾病的有效工具。从开发抗生素治疗至二十世纪八十年代末,在发达国家中几乎完全控制了细菌感染。然而,由于抗生素使用的压力,多重抗性机制已变得普遍并且威胁到抗菌治疗的临床效用。抗生素抗性菌株的增加在主要医院和护理中心已尤为普遍。抗性菌株增加的后果包括更高的发病率和死亡率、更长期的患者住院治疗和治疗费用的增加。
多种细菌已进化出β-内酰胺去活性酶,即对抗多种β-内酰胺抗生素的功效的β-内酰胺酶。基于β-内酰胺酶的氨基酸序列可以将其分成4类,即,Ambler类A、B、C和D。在A、C和D类中的酶包括活性位点丝氨酸β-内酰胺酶,并且较低频率遇到的B类酶是Zn-依赖性的。这些酶催化β-内酰胺抗生素的化学降解,使其失去活性。一些β-内酰胺酶可以在多种细菌菌株和物种之内和之间转移。细菌抗性的快速扩散和多重抗性菌株的进化严重限制了β-内酰胺治疗选择的可用性。
D类β-内酰胺酶表达细菌菌株,例如鲍氏不动杆菌(Acinetobacter baumannii)的增加成为了新出现的多重耐药性威胁。鲍氏不动杆菌菌株表达A、C和D类β-内酰胺酶。D类β-内酰胺酶,例如OXA家族对破坏碳青霉烯型的β-内酰胺抗生素(例如,亚胺培南,Merck's
近来进化出新型的β-内酰胺酶,其使碳青霉烯类抗微生物剂(包括亚胺培南、比阿培南、多利培南、美罗培南和厄他培南以及其它β-内酰胺抗生素)水解。这些碳青霉烯酶属于分子A、B和D类。KPC型的A类碳青霉烯酶主要在肺炎克雷伯氏菌(Klebsiellapneumoniae)中,但现在也在其它肠杆菌(Enterobacteriaceae)、铜绿假单胞菌(Pseudomonas aeruginosa)和鲍氏不动杆菌中有报导。1996年在北卡罗来纳州首次记载了KPC碳青霉烯酶,但从此以后在美国广泛传播。尤其是在纽约市地区域已成为问题,在该区域已报导了若干在主要医院内的扩散和患者发病率的报告。近来还在法国、希腊、瑞典、英国报导了这些酶,并且近来报导了在德国爆发。用碳青霉烯类治疗抗性菌株可能与不良结果有关。
锌依赖的B类metallo-β-内酰胺酶主要是由VIM、IMP和NDM型表示。产生IMP和产生VIM的肺炎克雷伯氏菌分别在二十世纪九十年代的日本和2001年的南欧首次观察到。IMP阳性菌株在日本保持频发,并且其还引起中国和澳大利亚的医院爆发。然而,产生IMP的肠杆菌在世界其余地方的传播似乎稍微有所限制。产生VIM的肠杆菌在地中海国家可频繁地被分离,达到希腊的传染比例。产生VIM的菌株的分离率在北欧和美国仍然是低的。完全相反地,产生NDM的肺炎克雷伯氏菌分离菌的特性是从它们的中心(印度次大陆),快速传播至西欧、北美、澳大利亚和远东。而且,NDM基因已扩散至除了肺炎克雷伯氏菌之外的多种物种。
质粒表达的D类碳青霉烯酶属于OXA-48型。2001年在土耳其首次检测到产生OXA-48的肺炎克雷伯氏菌。中东和北非仍然是感染的主要中心。然而,最近在印度、塞内加尔和阿根廷分离了产生OXA-48型的有机体,表明了全球扩张的可能性。OXA-48在除了肺炎克雷伯氏菌之外的细菌中的分离强调了OXA-48的扩散潜力。
用碳青霉烯类治疗产生任何一种这些碳青霉烯酶的菌株可能与不良结果有关。
β-内酰胺酶介导的对碳青霉烯类的抗性的另一机制涉及与β-内酰胺酶的超生产结合的渗透性或流出机制的组合。一个实例是,与ampCβ-内酰胺酶的超生产结合的孔蛋白的损失导致铜绿假单胞菌中对亚胺培南的抗性。与ampCβ-内酰胺酶的超生产结合的流出泵的过表达还可导致对诸如美罗培南的碳青霉烯类的抗性。
最近已经描述了新的β-内酰胺酶抑制剂(BLI)。然而,需要合成这些BLI的有效方法。
发明内容
在一些实施方案中,本文提供了化合物I'的结晶形式:
或其溶剂化物。在一些实施方案中,化合物I'的结晶形式可以显示出包含至少一个特征峰的X射线粉末衍射图,其中所述特征峰选自约6.2、11.7、12.4、12.8、16.7、17.6、19.1、20.2、20.6、21.7、22.0、22.7和24.7度2θ。在一些实施方案中,化合物I'的结晶形式可以显示出包含至少三个特征峰的X射线粉末衍射图,其中所述特征峰选自6.2、11.7、12.4、12.8、16.7、17.6、19.1、20.2、20.6、21.7、22.0、22.7和24.7度2θ。
在一些实施方案中,化合物I'的结晶形式可以在约142℃和约167℃处具有吸热。在一些实施方案中,结晶形式在约152℃处具有吸热。
在一些实施方案中,化合物I'的结晶形式可以是水合物。在一些实施方案中,化合物I'的结晶形式可以是一水合物。
在其它实施方案中,本文提供了制备式(A-II)的化合物或其药物可接受的盐的方法,
所述方法包括以下步骤:
在镍催化剂和碱体系的存在下,使式(A-I)
其中
R
R
所述溶剂体系和所述碱体系可以选自:分别为THF和CsOH·H
在一些实施方案中,碳酸盐碱可以是Cs
在一些实施方案中,碱体系与式(A-I)的化合物的摩尔比可以是约1:1至约5:1。在一些实施方案中,碱体系与式(A-I)的化合物的摩尔比可以是约3:1、2:1、1.5:1或1:1。
在一些实施方案中,碱体系中的碱可以被研磨。在其它实施方案中,碱体系中的碱可以是颗粒状。
在一些实施方案中,溶剂体系可以是THF/H
在一些实施方案中,溶剂体系可以是MeTHF/H
在一些实施方案中,硼化剂与式(A-I)的化合物的比例是约1:1至约2:1。在一些实施方案中,硼化剂与式(A-I)的化合物的比例是约1.5:1。在一些实施方案中,硼化剂与式(A-I)的化合物的比例是约1.25:1。
在一些实施方案中,硼化剂可以选自(HO)
在一些实施方案中,在使式(A-I)的化合物与硼化剂在溶剂体系和碱体系中反应之前,将镍催化剂前体和配体结合以形成镍催化剂。在其它实施方案中,在式(A-I)的化合物与硼化剂在溶剂体系和碱体系中存在时,将镍催化剂前体和配体结合以形成镍催化剂。
在一些实施方案中,Ni催化剂前体可以选自NiCl
在一些实施方案中,Ni催化剂前体可以是NiCl
在一些实施方案中,镍催化剂可以是NiCl
在一些实施方案中,式(A-II)的有机硼中间体可以与作为手性助剂的(+)-伪麻黄碱反应以形成式(A-III)
在一些实施方案中,式(A-III)的有机硼中间体可以在环丙烷化剂和任选的催化剂的存在下转化为式(A-IV)
在一些实施方案中,环丙烷化剂包括CH
在一些实施方案中,环丙烷化剂是CH
在一些实施方案中,式(A-IV)的化合物可以被水解以形成化合物I:
在一些实施方案中,式(A-II)的有机硼中间体可以与式(Aux-I)
在一些实施方案中,式(B-III)的有机硼中间体可以在环丙烷化剂和任选的催化剂的存在下转化为式(B-IV)
在一些实施方案中,环丙烷化剂包括CH
在一些实施方案中,环丙烷化剂包括CH
在一些实施方案中,环丙烷化剂是CH
在一些实施方案中,手性助剂可以是具有式
在一些实施方案中,式(B-IV)的化合物可以被水解以形成化合物I。
在一些实施方案中,本文公开的方法可以包括将式(B-IV)的有机硼中间体转化为式(B-V)
在一些实施方案中,本文所述的方法可以包括在水解以形成化合物I'之前用酸水溶液洗涤式(B-IV)或式(B-V)的化合物的步骤。
在一些实施方案中,本文所述的方法可以包括在碱的存在下水解式(A-IV)、式(B-IV)或式(B-V)的化合物以形成粗化合物I'
在一些实施方案中,本文公开的方法中水解式(A-IV)的化合物的步骤可以在约50℃至约70℃的温度下进行。在一些实施方案中,水解式(A-IV)的化合物的步骤可以在约60℃的温度下进行。在一些实施方案中,水解式(A-IV)的化合物的步骤可以进行约30分钟至约6小时。
在一些实施方案中,本文公开的方法可以还包括用离子交换树脂处理粗化合物I'以实现约9至约10.5的pH的步骤。在一些实施方案中,可以用离子交换树脂处理粗化合物I'以实现约9.8的pH。
在一些实施方案中,所述方法可以包括进一步过滤掉离子交换树脂以形成水性滤液。在一些实施方案中,水性滤液可以真空浓缩以形成浓缩的水性滤液。在一些实施方案中,水性滤液可以在约20℃至约60℃的温度下真空浓缩。
在一些实施方案中,可以将浓缩的水性滤液添加至甲基乙基酮以形成结晶溶液。在一些实施方案中,结晶溶液可以包含相对于甲基乙基酮的量为1.0重量%至5.0重量%的水。在一些实施方案中,结晶溶液可以包含相对于甲基乙基酮的量为2.5重量%至4.5重量%的水。
在一些实施方案中,所述方法可以包括在结晶溶液中使化合物I'结晶以形成结晶的化合物I'。在一些实施方案中,可以将结晶的化合物I'过滤并且真空干燥。在一些实施方案中,可以将结晶的化合物I'过滤并且在约100mbar至约500mbar的压力下真空干燥以形成化合物I'一水合物。在一些具体实施方案中,可以将结晶的化合物I'过滤并且在100mbar的压力下真空干燥以形成化合物I'一水合物。
在一些实施方案中,本文提供了化合物A-3的结晶形式:
(A-3),或其溶剂化物。
在一些实施方案中,化合物A-3的结晶形式可以显示出包含至少一个特征峰的X射线粉末衍射图,其中所述特征峰选自约7.6、8.0、10.4、13.7、14.0、16.0、16.3、19.0、20.9、23.2、23.4和24.4度2θ。在一些实施方案中,化合物A-3的结晶形式可以显示出包含至少三个特征峰的X射线粉末衍射图,其中所述特征峰选自7.6、8.0、10.4、13.7、14.0、16.0、16.3、19.0、20.9、23.2、23.4和24.4度2θ。
在一些实施方案中,化合物A-3的结晶形式可以具有约194℃的熔点。
在一些实施方案中,化合物A-3的结晶形式可以是无水的。
在一些实施方案中,本文提供了式(A-4)化合物的结晶形式:
(A-4),或其溶剂化物。
在一些实施方案中,结晶形式可以显示出包含至少一个特征峰的X射线粉末衍射图,其中所述特征峰选自约7.4、8.9、10.7、11.2、11.5、12.8、13.7、15.3、17.0、17.7、18.7、20.1、21.4和22.6度2θ。在一些实施方案中,结晶形式显示出包含至少三个特征峰的X射线粉末衍射图,其中所述特征峰选自7.4、8.9、10.7、11.2、11.5、12.8、13.7、15.3、17.0、17.7、18.7、20.1、21.4和22.6度2θ。
在一些实施方案中,化合物(A-3)的结晶形式可以在约176℃处具有吸热。
在一些实施方案中,化合物(A-3)的结晶形式可以是非溶剂化的。在一些实施方案中,化合物(A-3)的结晶形式可以显示出包含至少一个特征峰的X射线粉末衍射图,其中所述特征峰选自约7.4、7.9、9.1、11.1、12.0、13.7、14.4、15.8、16.4、17.6、19.8、20.9和22.8度2θ。在一些实施方案中,化合物(A-3)的结晶形式可以显示出包含至少三个特征峰的X射线粉末衍射图,其中所述特征峰选自7.4、7.9、9.1、11.1、12.0、13.7、14.4、15.8、16.4、17.6、19.8、20.9和22.8度2θ。
在一些实施方案中,本文提供的化合物I'是
在一些实施方案中,本文提供了式(A-IV)的化合物:
或其药物可接受的盐或溶剂化物。在一些实施方案中,R
在一些实施方案中,本文提供了式(B-III)的化合物:
或其药物可接受的盐或溶剂化物,其中R
在一些实施方案中,本文提供了式(B-IV)的化合物:
或其药物可接受的盐或溶剂化物,其中R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,式(B-IV)的化合物可以是
在一些实施方案中,本文提供了式(B-V)的化合物:
附图说明
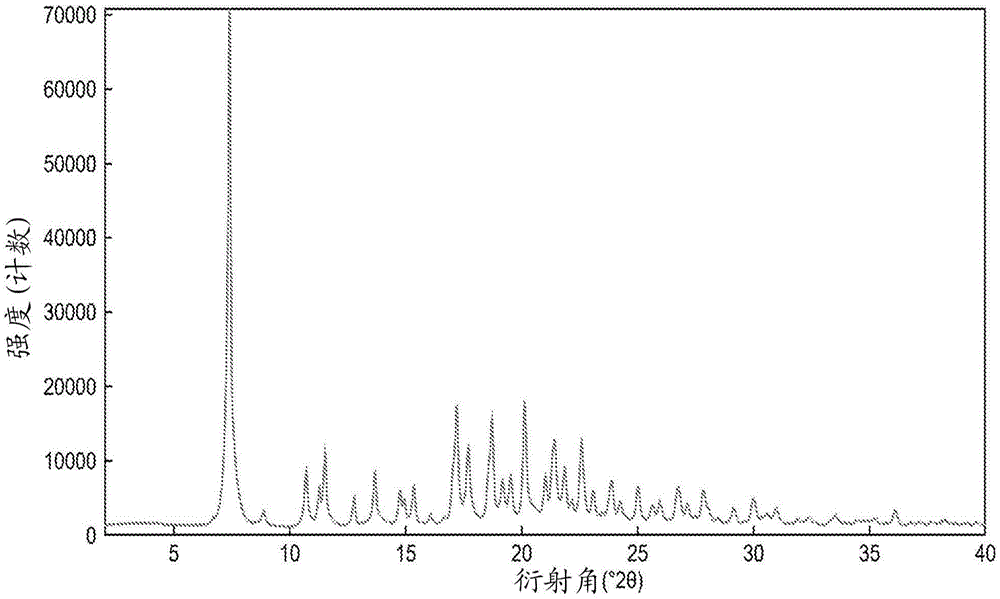
图1是化合物I'的结晶形式A的X射线粉末衍射(XRPD)图。
图2示出了化合物I'的结晶形式A的差示扫描量热法(DSC)分析。
图3示出了化合物I'的结晶形式A的热重分析(TGA)结果。
图4示出了化合物I'的结晶形式A的动态蒸汽吸附(TGA)结果。
图5示出了通过化合物I'的结晶形式A的傅里叶变换红外(FTIR)光谱法获得的结果。
图6示出了通过化合物I'的结晶形式A的傅里叶变换拉曼(FT拉曼)光谱法获得的结果。
图7示出了通过化合物I'的结晶形式A的固态碳-13核磁共振(
图8示出了化合物I'的结晶形式A的晶体的光学显微镜图像。
图9是化合物A-3的结晶形式的X射线粉末衍射图。
图10示出了化合物A-3的结晶形式的差示扫描量热法分析。
图11示出了化合物A-3的结晶形式的热重分析结果。
图12示出了化合物A-3的结晶形式的动态蒸汽吸附结果。
图13示出了通过化合物A-3的结晶形式的FTIR光谱法获得的结果。
图14示出了通过化合物A-3的结晶形式的FT拉曼光谱法获得的结果。
图15示出了通过化合物A-3的结晶形式的低频拉曼(LF拉曼)光谱法获得的结果。
图16是化合物A-3的结晶形式的光学显微镜图像。
图17示出了化合物A-3的晶体结构的不对称单元。
图18是化合物A-4的结晶形式的X射线粉末衍射图。
图19示出了化合物A-4的结晶形式的差示扫描量热法分析。
图20示出了化合物A-4的结晶形式的热重分析结果。
图21示出了化合物A-4的结晶形式的动态蒸汽吸附结果。
图22示出了通过化合物A-4的结晶形式的FTIR光谱法获得的结果。
图23示出了通过化合物A-4的结晶形式的FT拉曼光谱法获得的结果。
图24示出了化合物A-4的结晶形式的光学显微镜图像。
图25示出了各种钯催化剂的A-3向A-4的转化。
图26示出了来自催化剂筛查的质量平衡。
图27是在动态蒸汽吸附分析后获得的化合物A-4的结晶形式的X射线粉末衍射图。
图28示出了化合物I'的形式A的高度结晶样品的差示扫描量热法(DSC)分析。
图29示出了化合物I'的形式A的高度结晶样品的热重分析(TGA)结果。
图30示出了化合物I'的形式A的高度结晶样品的动态蒸汽吸附(TGA)结果。
具体实施方式
化合物I及其药物可接受的盐描述于国际申请PCT/US2017/039787中,所述国际申请通过援引整体并入本文。化合物I是当与β-内酰胺抗生素组合使用时有效治疗细菌感染的β-内酰胺酶抑制剂。
本文公开了化合物I的二钠盐的结晶形式以及使化合物I的二钠盐结晶的方法。化合物I的二钠盐如下所示并且在本文中将被称为化合物I':
本申请涉及化合物I'的固体形式。在一些实施方案中,化合物I'可以是结晶的。在其它实施方案中,化合物I'可以是无定形的。在一些实施方案中,化合物I'的结晶形式可以是结晶形式A。本申请还涉及使用化合物I'的各种结晶形式,特别是结晶形式A通过向患者施用治疗有效量的包含化合物I'的一种或多种结晶形式和一种或多种药物可接受的赋形剂的组合物来治疗疾病和病症的方法。
化合物I'的结晶形式
本文公开了化合物I'的结晶形式,特别是结晶形式A(如下所述)。
化合物I'的结晶形式A
一些实施方案包括化合物I'的结晶形式,在本文中称为化合物I'的结晶形式A。用于形成化合物I'的结晶形式A的精确条件可以实践确定,并且仅可能给出已经发现适于实践的几种方法。
使用实验方法章节中进一步详细描述的各种技术来表征化合物I'的结晶形式A。图1示出了通过X射线粉末衍射(XRPD)测定的形式A的晶体结构。可以通过本文公开的方法获得的化合物I'的结晶形式A显示出约6.2、11.7、12.4、12.8、16.7、17.6、19.1、20.2、20.6、21.7、22.0、22.7和24.7度2θ处的突出峰。因此,在一些实施方案中,化合物I'的结晶形式具有至少一个特征峰(例如,1、2、3、4、5、6、7、8、9、10、11、12或13个特征峰),所述特征峰选自约6.2、11.7、12.4、12.8、16.7、17.6、19.1、20.2、20.6、21.7、22.0、22.7和24.7度2θ。在一些实施方案中,化合物I'的结晶形式具有至少三个特征峰,所述特征峰选自约6.2、11.7、12.4、12.8、16.7、17.6、19.1、20.2、20.6、21.7、22.0、22.7和24.7度2θ。
如本领域所熟知,由于在不同仪器上测量X射线衍射图时的实验可变性,如果2θ(2θ)值符合在一定程度的可变性内,则假定峰位置相等。例如,美国药典规定,如果10个最强衍射峰的角度设置符合在参比材料的角度设置的±0.2度内,并且峰的相对强度变化不超过20%,则确认同一性。因此,在一些实施方案中,本文所述的峰位置包括±0.5度2θ内的可变性。在其它实施方案中,本文所述的峰位置包括±0.2度2θ内的可变性。如本文公开,术语“约”在提及2θ的值时被定义为±0.5度2θ。
图2示出了通过化合物I'的结晶形式A的差示扫描量热法(DSC)获得的结果。DSC结果表明化合物I'的结晶形式A的约142℃和167℃的吸热。因此,在一些实施方案中,化合物I'的结晶形式A显示在约139℃至145℃、约140℃至约144℃或在约142℃处的吸热。在一些实施方案中,化合物I'的结晶形式A显示在约164℃至170℃、约165℃至约169℃或在约167℃处的吸热。熔点分析表明化合物I'的结晶形式A在熔化之前在约270℃下分解。
图3示出了通过化合物I'的结晶形式A的热重分析(TGA)获得的结果。TGA结果显示,化合物I'的结晶形式A在25℃至135℃进行时显示出5.5%的重量损失,并且在135℃至200℃进行时显示出1.43%的重量损失。同时,图4示出了化合物I'的结晶形式A的动态蒸汽吸附(DVS)结果,并且示出了显著的水吸收,表明化合物I'的结晶形式A是吸湿性的。KarlFisher分析表明,化合物I'的结晶形式A平均含有6.86%的水,对应于一个水分子。
图5示出了通过化合物I'的结晶形式A的傅里叶变换红外(FTIR)光谱法获得的结果。化合物I'的结晶形式A显示出在约1608、1592、1553、1473、1416、1364、1334和1277cm
图6示出了通过化合物I'的结晶形式A的傅里叶变换拉曼光谱法获得的结果。化合物I'的结晶形式A显示出在约1611、1591、1574、1472、1426和1366cm
图7示出了通过化合物I'的结晶形式A的固态碳-13核磁共振(
因此,化合物I'的结晶形式A可以表征为吸湿性固体。化合物I'的结晶形式A也显示出良好的结晶度,具有不同尺寸的不规则形状的晶体(图8)。化合物I'的结晶形式A显示出水合物形成的证据,其中化合物I'与水的摩尔比是约1:1(即一水合物)。
图28示出了通过化合物I'的形式A的高度结晶样品的差示扫描量热法(DSC)获得的结果。DSC结果表明化合物I'的结晶形式A的约152℃的吸热,表现出在约151℃至153℃、约150℃至约154℃或约152℃处的吸热。
图29示出了通过化合物I'的形式A的高度结晶样品的热重分析(TGA)获得的结果。TGA结果显示,化合物I'的形式A的高度结晶样品在34℃至140℃进行时显示出5.3%的重量损失,并且在140℃至238℃进行时显示出0.71%的重量损失。高度结晶样品不开始显示可感知的水损失直至加热至高于100℃。同时,图30示出了化合物I'的形式A的高度结晶样品的动态蒸汽吸附(DVS)结果,并且显示样品在5%至75%的相对湿度范围内抵抗水的获得/损失。
使化合物I'结晶的方法
公开了使化合物I'结晶的方法。化合物I'的结晶形式通常可以通过在受控条件下使化合物I'结晶来获得或产生。在一些实施方案中,该方法可以产生溶剂化结晶形式。在一些实施方案中,该方法可以产生化合物I'的结晶形式A。
控制氧的存在在形成所需结晶形式中可能是重要的。在一些实施方案中,结晶可以在用氮气覆盖的反应器中进行。在一些实施方案中,使用的结晶溶剂可以通过使氮气鼓泡通过溶剂适合的时间段来脱气。
在一些实施方案中,化合物I'的结晶可以通过将化合物I'的水溶液添加至反溶剂中以形成结晶溶液来进行。在一些实施方案中,化合物I'的水溶液可以在30分钟、40分钟、50分钟、60分钟、70分钟、80分钟、90分钟、100分钟、110分钟或120分钟或者任何两个上述值之间的范围的时间段内添加至反溶剂中。在某些实施方案中,化合物I'的水溶液可以在搅拌的同时添加至反溶剂中。
在一些实施方案中,反溶剂可以选自丙酮、乙腈、苯、1-丁醇、2-丁醇、甲基乙基酮(MEK)、叔丁醇、氯仿、环己烷、1,2-二氯乙烷、二甘醇、二乙醚、二甘醇二甲醚(二甘醇二甲醚)、1,2-二甲氧基乙烷(甘醇二甲醚,DME)、二甲基甲酰胺(DMF)、二甲基亚砜(DMSO)、1,4-二噁烷、乙醇、乙酸乙酯、乙二醇、庚烷、六甲基磷酰胺(HMPA)、六甲基磷酰三胺(HMPT)、己烷、甲醇、甲基叔丁基醚(MTBE)、二氯甲烷、N-甲基-2-吡咯烷酮(NMP)、戊烷、1-丙醇、2-丙醇、吡啶、四氢呋喃(THF)、甲苯、三乙胺、邻二甲苯、间二甲苯、对二甲苯或其组合。在一些实施方案中,反溶剂可以是甲基乙基酮。
温度控制对于结晶也可以是有利的。例如,在一些实施方案中,在将化合物I'的水溶液添加至反溶剂中后,希望将结晶溶液保持在约50℃的最大温度下。在一些实施方案中,结晶溶液的温度是约5℃至约50℃、约10℃至约50℃、约15℃至约50℃、约20℃至约50℃、约25℃至约50℃、约30℃至约50℃、约35℃至约50℃、约40℃至约50℃、或约45℃至约50℃。例如,在一些实施方案中,在25℃、30℃、35℃、40℃、45℃或50℃,或者这些值中的任何两个之间的范围下结晶。在一些实施方案中,结晶溶液可以在所需温度下保持0.5小时、1小时、2小时、3小时、4小时、5小时、6小时、7小时、8小时、9小时、10小时或更多,或者这些值中的任何两个之间的范围。
控制结晶溶液中存在的水的量对于制备化合物I'的一水合物可能是有利的。在一些实施方案中,将化合物I'的水溶液添加至反溶剂中以形成结晶溶液,使得结晶溶液的水含量是反溶剂的至多5重量%。在一些实施方案中,水含量可以是相对于反溶剂的量的0.5重量%、1.0重量%、1.5重量%、2.0重量%、2.5重量%、3.0重量%、3.5重量%、4.0重量%、4.5重量%、5.0重量%,或者在由任何上述值限定的范围内。例如,结晶溶液可以包含相对于反溶剂的量的0.5重量%至5.0重量%、1.0重量%至5.0重量%、1.5重量%至5.0重量%、2.0重量%至5.0重量%、2.5重量%至5.0重量%、2.5重量%至4.5重量%、3.0重量%至4.5重量%或2.0重量%至4.0重量%的水。
固体结晶化合物I'可以通过过滤从结晶溶液中回收,随后用含有3%(w/w)水的甲基乙基酮溶液洗涤,然后减压干燥。在一些实施方案中,干燥在不高于50℃的温度下进行。例如,干燥可以在25℃、30℃、35℃、40℃、45℃或50℃下进行。在一些实施方案中,干燥在不低于100mbar的压力下进行。例如,干燥可以在100mbar、150mbar、200mbar、250mbar、300mbar、350mbar、400mbar、450mbar或500mbar下,或者在任何上述值之间的范围内的压力下进行。
制备化合物I的方法
本文还提供了制备化合物I或其药物可接受的盐的对映选择性方法,
所述方法包括以下步骤:
在镍催化剂和碱体系的存在下用硼化剂硼化式(A-I)
水解式(B-IV)的化合物以形成化合物I的二钠盐(即,化合物I')。在一些实施方案中,式(B-IV)的化合物可以在水解以形成化合物I'之前分离。式(A-I)的化合物的制备描述于第WO2019/075084号国际专利公开,其通过援引整体并入本文。
在一些实施方案中,手性助剂是(1S,2S)-(+)-伪麻黄碱。在一些实施方案中,手性助剂不是(1S,2S)-(+)-伪麻黄碱。
在一些实施方案中,R
在一些实施方案中,R
硼化剂可以是适用于将硼原子引入呋喃环中的任何硼化剂。在一些实施方案中,硼化剂是(R
硼化剂与式(A-I)的化合物的摩尔比可以取决于使用的反应条件。在一些实施方案中,硼化剂与式(A-I)的化合物的摩尔比可以是约1.0:1至约3:1。在一些实施方案中,硼化剂与式(A-I)的化合物的摩尔比可以是约1.0:1、1.05:1、1.10:1、1.15:1、1.20:1、1.25:1、1.3:1、1.35:1、1.4:1、1.45:1、1.5:1、1.6:1、1.7:1、1.8:1、1.9:1、2.0:1、2.1:1、2.2:1、2.3:1、2.4:1、2.5:1、2.6:1、2.7:1、2.8:1、2.9:1或3:1。在一些实施方案中,硼化剂与式(A-I)的化合物的摩尔比可以小于1.1:1、1.2:1、1.3:1、1.4:1或1.5:1。
在一些实施方案中,在使式(A-I)的化合物与硼化剂在溶剂体系和碱体系中反应之前,将镍催化剂前体和配体结合以形成镍催化剂。在其它实施方案中,在式(A-I)的化合物与硼化剂在溶剂体系和碱体系中存在时,将镍催化剂前体和配体结合以形成镍催化剂。
在一些实施方案中,Ni催化剂前体选自NiCl
在一些实施方案中,Ni催化剂前体的量是式(A-I)的化合物的约5mol%至约25mol%。在一些实施方案中,Ni催化剂前体的量是式(A-I)的化合物的约2.5mol%、5mol%、10mol%、15mol%、20mol%、25mol%、30mol%、40mol%、50mol%。在一些实施方案中,Ni催化剂前体的量大于式(A-I)的化合物的约1mol%、5mol%、10mol%、15mol%、20mol%、25mol%、30mol%、40mol%、50mol%。在一些实施方案中,Ni催化剂前体的量小于式(A-I)的化合物的约5mol%、10mol%、15mol%、20mol%、25mol%、30mol%、40mol%、50mol%。在一些实施方案中,Ni催化剂前体的量是式(A-I)的化合物的约1mol%至约20mol%、约1mol%至约30mol%、约5mol%至约20mol%、约5mol%至30mol%、约5mol%至约40mol%、约5mol%至约50mol%。
在一些实施方案中,配体是单齿或双齿的。在一些实施方案中,配体选自脂族、芳香族、NHC配体、亚磷酸酯、亚磷酰胺和胺。在一些实施方案中,配体选自NHC配体、膦、亚磷酸酯、亚磷酰胺、胺、醇、氨基醇以及它们的组合。在一些实施方案中,配体是任选地被芳基、烷基和/或杂芳基基团取代的胺。在一些实施方案中,配体是NHC配体。在一些实施方案中,配体是膦。在一些实施方案中,配体是亚磷酸酯。在一些实施方案中,配体是亚磷酰胺。在一些实施方案中,配体是胺。在一些实施方案中,配体是醇。在一些实施方案中,配体是氨基醇。在一些实施方案中,配体或催化剂选自双(二-环戊基鏻)乙基四氟硼酸盐、4,5-双(二-叔丁基膦基)-9,9-二甲基呫吨、2,2'-双(二环己基膦烷基)-1,1'-联苯、1,2-双((二-叔丁基膦烷基)甲基)苯、1,3-双(1-金刚烷基)咪唑鎓、1,3-二-叔丁基咪唑鎓、1,3-双(2,6-二异丙基-苯基)-4,5-二氢咪唑-2-亚基、1,3-双(2,6-二异丙基苯基)-1H-咪唑-3-鎓-2-亚基、P(辛基)
配体与Ni催化剂前体的摩尔比可以取决于使用的前体和配体的类型。在一些实施方案中,配体与Ni催化剂前体的摩尔比可以是约0.5:1至约5:1。在一些实施方案中,配体与Ni催化剂前体的摩尔比可以是约0.5:1、1:1、1.5:1、2:1、2.5:1或5:1。在一些实施方案中,配体与Ni催化剂前体的摩尔比可以是约0.1:1-10:1、0.5:1-5:1、0.5:1-3:1、0.5:1-2.5:1、1:1-2:1、1:1-3:1、1:1-4:1、1:1-5:1或1:1-2.5:1。在一些实施方案中,配体与Ni催化剂前体的摩尔比可以大于约0.1:1、0.5:1、1:1、1.25:1、1.5:1、1.75:1、2:1、3:1、4:1、5:1、6:1或10:1。在一些实施方案中,配体与Ni催化剂前体的摩尔比可以小于0.5:1、1:1、1.25:1、1.5:1、1.75:1、2:1、3:1、4:1、5:1、6:1、10:1或20:1。
在一些实施方案中,镍催化剂可以选自:NiCl
在一些实施方案中,在碱体系的存在下进行式(A-I)的化合物和硼化剂的反应。在一些实施方案中,碱体系包括一种或多种无机碱。在一些实施方案中,碱体系包括K
在一些实施方案中,碳酸盐碱可以是Cs
在一些实施方案中,式(A-I)的化合物和硼化剂的硼化反应在Cs
在一些实施方案中,式(A-I)的化合物和硼化剂的反应在溶剂体系中进行。在一些实施方案中,溶剂体系包括四氢呋喃(THF)。在一些实施方案中,溶剂体系包括2-甲基-四氢呋喃(MeTHF)。在一些实施方案中,溶剂体系包括1,4-二噁烷。在一些实施方案中,溶剂体系包括甲基叔丁基醚。
在一些实施方案中,溶剂体系可以还包括水。在一些实施方案中,水可以以1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45或50%v/v存在。在一些实施方案中,溶剂体系可以包含约1%至10%v/v、2%至8%v/v、4%至7%v/v、3%至8%v/v、5%至10%v/v或5%至15%v/v的水。在一些具体实施方案中,水可以以5%v/v存在。在其它实施方案中,溶剂体系可以还包括醇。在一些实施方案中,醇可以以1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40、45或50%v/v存在。在一些实施方案中,溶剂体系可以包含约1%至10%v/v、2%至8%v/v、4%至7%v/v、3%至8%v/v、5%至10%v/v或5%至15%v/v的醇。在一些具体实施方案中,醇可以以5%v/v存在。在一些实施方案中,醇可以是甲醇。在一些实施方案中,醇可以是乙醇。
在一些实施方案中,溶剂体系可以是甲苯。在一些实施方案中,溶剂体系可以还包括约1%至10%v/v、2%至8%v/v、4%至7%v/v、3%至8%v/v、5%至10%v/v或5%至15%v/v的H
在一些实施方案中,溶剂体系可以是THF。在一些实施方案中,溶剂体系可以还包括约1%至10%v/v、2%至8%v/v、4%至7%v/v、3%至8%v/v、5%至10%v/v或5%至15%v/v的H
在一些实施方案中,溶剂体系可以是2-甲基四氢呋喃(MeTHF)。在一些实施方案中,溶剂体系可以还包括约1%至10%v/v、2%至8%v/v、4%至7%v/v、3%至8%v/v、5%至10%v/v或5%至15%v/v的H
在一些实施方案中,式(A-I)的化合物的硼化反应可以包括预混合硼化剂和碱的步骤。
在一些实施方案中,式(A-I)的化合物的硼化反应可以在约60℃至100℃的温度下进行。在一些实施方案中,式(A-I)的化合物的硼化反应可以在约60、65、70、75、80、85、90、95或100℃的温度下进行。在一些实施方案中,式(A-I)的化合物的硼化反应在约60至100℃、70至100℃、80至100℃、90至100℃、60至70℃、60至80℃、60至90℃、65至85℃、65至90℃或75至95℃的温度下进行。
在一些实施方案中,式(A-II)的有机硼烷中间体与一种或多种手性助剂结合以形成手性络合物。在一些实施方案中,手性络合物具有式(B-III)的结构。在一些实施方案中,手性助剂是(1S,2S)-(+)-伪麻黄碱,从而形成具有式(A-III)的结构的手性络合物。
在一些实施方案中,手性助剂是式(Aux-I)的化合物
或其立体异构体,
其中
R
R
在一些实施方案中,手性助剂是式Aux-I-a的化合物:
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,R
在一些实施方案中,手性助剂是(1S,2S)-(+)-伪麻黄碱。在一些实施方案中,手性助剂不是(1S,2S)-(+)-伪麻黄碱。在其它实施方案中,手性助剂是(1S,2S)-2-(甲基氨基)-1-(对甲苯基)丙-1-醇。在其它实施方案中,手性助剂可以是(1S,2S)-2-(乙基氨基)-1-(对甲苯基)丙-1-醇。在一些实施方案中,手性助剂可以是(1S,2S)-2-(异丙基氨基)-1-(对甲苯基)丙-1-醇。在一些实施方案中,手性助剂可以是(1S,2R)-2-(甲基氨基)-1-苯基丙-1-醇。在其它实施方案中,手性助剂可以是(1R,2S)-2-(甲基氨基)-1-(对甲苯基)丙-1-醇。在又一些实施方案中,手性助剂可以是(1R,2S)-2-(乙基氨基)-1-(对甲苯基)丙-1-醇。在一些实施方案中,手性助剂可以是(1R,2S)-2-(异丙基氨基)-1-(对甲苯基)丙-1-醇。
一些实施方案涉及具有式(B-III)的结构的化合物。在一些实施方案中,式(B-III)的化合物具有式(A-III)的结构。在一些实施方案中,式(A-III)的化合物具有化合物A-3的结构。在一些实施方案中,式(B-III)的化合物是
在一些实施方案中,式(A-III)的手性络合物可以与环丙烷化剂反应以引入环丙基基团,形成式(A-IV)的化合物。在一些实施方案中,通过在第二催化剂的存在下使式(A-III)的化合物与类卡宾或与重氮甲烷反应来引入环丙基基团。在一些实施方案中,通过使式(A-III)的化合物与重氮甲烷反应来引入环丙基基团。在一些实施方案中,在第二催化剂的存在下将环丙基基团引入式(A-III)的化合物中。在一些实施方案中,通过使式(A-III)的化合物与包含CH
在一些实施方案中,式(B-III)的化合物进行环丙烷化反应以形成式(B-IV)的化合物。在一些实施方案中,通过使式(B-III)的化合物与类卡宾或与重氮甲烷在第二催化剂的存在下反应来引入环丙基基团。在一些实施方案中,通过使式(B-III)的化合物与重氮甲烷反应来引入环丙基基团。在一些实施方案中,在第二催化剂的存在下将环丙基基团引入式(B-III)的化合物中。在一些实施方案中,通过使式(B-III)的化合物与包含CH
在一些实施方案中,式(A-IV)的化合物可以用大于约50%、约60%、约70%、约80%、约90%、约95%、约98%、约99%的对映体过量制备。在一些实施方案中,式(A-IV)的化合物可以用小于约50%、约60%、约70%、约80%、约90%、约95%、约98%、约99%的对映体过量制备。在一些实施方案中,式(A-IV)的化合物可以用约30%至60%、约30%至80%、约30%至90%、40%至60%、约40%至80%、约40%至90%、约50%至90%、约30%至99%、约40%至99%或约50%至99%的对映体过量制备。在一些实施方案中,式(A-IV)的化合物的合成可以用大于约50%、约60%、约70%、约80%、约90%或约95%的对映体过量实现。
在一些实施方案中,式(B-IV)的化合物可以用大于约50%、约60%、约70%、约80%、约90%、约95%、约98%、约99%的对映体过量制备。在一些实施方案中,式(B-IV)的化合物可以用小于约50%、约60%、约70%、约80%、约90%、约95%、约98%、约99%的对映体过量制备。在一些实施方案中,式(B-IV)的化合物可以用约30%至60%、约30%至80%、约30%至90%、40%至60%、约40%至80%、约40%至90%、约50%至90%、约30%至99%、约40%至99%或约50%至99%的对映体过量制备。在一些实施方案中,式(B-IV)的化合物的合成可以用大于约50%、约60%、约70%、约80%、约90%或约95%的对映体过量实现。
以下方案A概述了本文描述的化合物I'的合成路线,其从化合物(A-1)开始,化合物(A-1)是其中R
方案A
或者,化合物A-3可以首先转化成化合物A-5,然后水解以形成化合物I'。化合物A-3向化合物A-5的转化以及随后水解化合物A-5可以导致更有效的合成和纯化,从而改善化合物I'的产率和纯度。在以下方案A'中示出该合成。
方案A'
化合物A-3可以使用本文所述的环丙烷化条件转化成化合物A-5。在一些实施方案中,化合物A-3可以用锌/铜对和CH
以下方案B概述了本文描述的化合物I'的合成路线,其从化合物(A-1)开始,化合物(A-1)是其中R
方案B
在本文所述的一些实施方案中,式(B-IV)或式(B-V)的化合物可以在水解之前用酸水溶液洗涤。这种用酸水溶液的处理可以导致去除不希望的杂质并导致在水解步骤中形成的化合物I'的纯度得到改善。
一些实施方案涉及制备化合物I'的方法,所述方法包括以下步骤:使式(A-I)的化合物与硼化剂在镍催化剂前体和碱体系的存在下反应以形成式(A-II)的化合物。在一些实施方案中,式(A-I)的化合物是化合物A-1。在一些实施方案中,式(A-II)的化合物是化合物A-2。
图9示出了通过XRPD测定的化合物A-3的晶体结构。化合物A-3显示出在约7.6、8.0、10.4、13.7、14.0、16.0、16.3、19.0、20.9、23.2、23.4和24.4度2θ处的突出峰。因此,在一些实施方案中,化合物A-3的结晶形式具有至少一个特征峰(例如,1、2、3、4、5、6、7、8、9、10、11或12个特征峰),所述特征峰选自约7.6、8.0、10.4、13.7、14.0、16.0、16.3、19.0、20.9、23.2、23.4和24.4度2θ。在一些实施方案中,化合物A03的结晶形式具有至少三个特征峰,所述特征峰选自约7.6、8.0、10.4、13.7、14.0、16.0、16.3、19.0、20.9、23.2、23.4和24.4度2θ。
图10示出了通过结晶化合物A-3的DSC获得的结果。DSC结果显示在约194℃的温度处的峰,这表明晶体的熔点。因此,在一些实施方案中,结晶化合物A-3表现出约191℃至约197℃、约192℃至约196℃或约194℃的熔点。
图11示出了通过结晶化合物A-3的TGA获得的结果。TGA结果显示结晶化合物A-3在从25℃至350℃进行时表现出0.21%的重量损失。同时,图12示出了结晶化合物A-3的DVS结果,并且显示没有显著的水吸收,并且表明结晶化合物A-3不是吸湿性的。
图13示出了通过结晶化合物A-3的傅里叶变换红外(FTIR)光谱法获得的结果。结晶化合物A-3表现出在约3143、2984、2873、1731、1622、1598、1578、1306、1202、1053、and1019cm
图14示出了通过结晶化合物A-3的傅里叶变换拉曼光谱法获得的结果。结晶化合物A-3表现出在约3066、3007、2943、2873、1733、1623、1603、1579和1437cm
图15示出了通过结晶化合物A-3的低频拉曼(LF拉曼)光谱法获得的结果。结晶化合物A-3表现出在约122、102、91、64、53、37、31、23和11cm
化合物A-3因此可以表征为非溶剂化的非吸湿性固体。化合物A-3还显示出良好的结晶度,具有大的叶片状晶体(图16)和相对高的熔点(约194℃)。单晶X射线结构测定显示化合物A-3具有P2
一些实施方案涉及制备化合物I'的方法,所述方法包括以下步骤:使式(A-III)的化合物与环丙烷化剂在任选的催化剂的存在下反应,以得到式(A-IV)的化合物。在一些实施方案中,环丙烷化剂是CH
图18示出了通过XRPD测定的化合物A-4的晶体结构。结晶化合物A-4表现出在约7.4、8.9、10.7、11.2、11.5、12.8、13.7、15.3、17.0、17.7、18.7、20.1、21.4和22.6度2θ处的突出峰。因此,在一些实施方案中,化合物A-4的结晶形式具有至少一个特征峰(例如,1、2、3、4、5、6、7、8、9、10、11、12、13或14个特征峰),所述特征峰选自约7.4、8.9、10.7、11.2、11.5、12.8、13.7、15.3、17.0、17.7、18.7、20.1、21.4和22.6度2θ。在一些实施方案中,化合物A-4的结晶形式具有至少三个特征峰,所述特征峰选自约7.4、8.9、10.7、11.2、11.5、12.8、13.7、15.3、17.0、17.7、18.7、20.1、21.4和22.6度2θ。
图19示出了通过结晶化合物A-4的DSC获得的结果。DSC结果显示在约176℃的温度处的峰,这表明晶体的熔点。因此,在一些实施方案中,结晶化合物A-4表现出约173℃至约179℃、约174℃至约178℃或约176℃的熔点。
图20示出了通过结晶化合物A-4的TGA获得的结果。TGA结果显示结晶化合物A-4在低于100℃表现出0.92%的重量损失。图21示出了结晶化合物A-4的DVS结果,显示没有显著的水吸收,并且表明结晶化合物A-4不是吸湿性的。
图22示出了通过结晶化合物A-4的傅里叶变换红外(FTIR)光谱法获得的结果。结晶化合物A-4表现出在约1727、1608、1481、1437和1298cm
图23示出了通过结晶化合物A-4的傅里叶变换拉曼光谱法获得的结果。结晶化合物A-4表现出在约1730、1602、1455和1437cm
化合物A-4因此可以表征为非溶剂化的非吸湿性固体。化合物A-4还显示出良好的结晶度,具有各种尺寸的叶片状晶体(图24)和相对高的熔点(约176℃)。
图27示出了通过XRPD测定的化合物A-4的晶体结构。在对如图18所表征的结晶形式进行动态蒸汽吸附(DVS)分析后,获得该结晶形式,其中将样品暴露于95%相对湿度(RH)并降低至5%RH。DVS后的结晶化合物A-4表现出在约7.4、7.9、9.1、11.1、12.0、13.7、14.4、15.8、16.4、17.6、19.8、20.9和22.8度2θ处的突出峰。因此,在一些实施方案中,DVS后的化合物A-4的结晶形式具有至少一个特征峰(例如,1、2、3、4、5、6、7、8、9、10、11、12或13个特征峰),所述特征峰选自约7.4、7.9、9.1、11.1、12.0、13.7、14.4、15.8、16.4、17.6、19.8、20.9和22.8度2θ。在一些实施方案中,DVS后的化合物A-4的结晶形式具有至少三个特征峰,所述特征峰选自7.4、7.9、9.1、11.1、12.0、13.7、14.4、15.8、16.4、17.6、19.8、20.9和22.8度2θ。
当本文公开的化合物具有至少一个手性中心时,其可作为单独的对映体和非对映体存在或作为此类异构体的混合物(包括外消旋体)存在。通过应用多种本领域从业者所熟知的方法来实现分离单独的异构体或选择性合成单独的异构体。除非另外指出,否则所有此类异构体及其混合物均包括在本文公开的化合物的范围内。此外,本文公开的化合物可以以一种或多种结晶形式或无定型形式存在。除非另外指出,否则所有此类形式(包括任何多晶形式)均包括在本文公开的化合物的范围内。此外,本文公开的一些化合物可以与水形成溶剂化物(即,水合物)或者与常见有机溶剂形成溶剂化物。除非另外指出,否则此类溶剂化物包括在本文公开的化合物的范围内。
技术人员应认识到,本文描述的一些结构可以是化合物的共振形式或互变异构体,其可以由其它化学结构清楚地表示,即使在动力学上亦如此;技术人员认识到,此类结构仅可以表示此类化合物很小一部分的样品。尽管本文并未表示出此类共振形式或互变异构体,但认为此类化合物在所述结构的范围内。
定义
除非另外定义,否则本文使用的所有技术术语和科学术语具有与本公开内容所属领域的普通技术人员通常理解的相同含义。所有专利、申请、公开的申请以及其它出版物均通过援引整体并入本文。在本文中对术语存在多个定义的情况下,除非另外说明,否则以本章节中的定义为准。
术语“药物可接受的盐”是指保留化合物的生物效应和性质并且不是生物学或其它方面不期望用于药物的盐。在许多情况下,借助于氨基和/或羧基基团或与其类似的基团的存在,本文公开的化合物能够形成酸式盐和/或碱式盐。可以用无机酸和有机酸形成药物可接受的酸加成盐。可以由其得到盐的无机酸包括,例如,盐酸、氢溴酸、硫酸、硝酸、磷酸等。可以由其得到盐的有机酸包括,例如,乙酸、丙酸、乙醇酸、丙酮酸、草酸、马来酸、丙二酸、琥珀酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等。也可以使用无机碱和有机碱形成药物可接受的盐。可以由其得到盐的无机碱包括,例如,包含钠、钾、锂、铵、钙、镁、铁、锌、铜、锰、铝等的碱;特别优选的是铵、钾、钠、钙和镁盐。在一些实施方案中,用无机碱处理本文公开的化合物导致化合物中不稳定的氢的损失,以得到包含诸如Li
如本文使用,“烷基”是指完全饱和(即,不含有双键或叁键)的直烃链或支化烃链。烷基基团可以具有1个至20个碳原子(每当在本文中出现时,诸如“1至20”的数值范围是指给定范围内的每一个整数;例如,“1个至20个碳原子”意指烷基基团可以由1个碳原子、2个碳原子、3个碳原子等,直至并且包括20个碳原子组成,然而本定义还涵盖存在未指定数值范围的术语“烷基”)。烷基基团也可以是具有1个至9个碳原子的中等大小的烷基。烷基基团也可以是具有1个至4个碳原子的低级烷基。可以将烷基基团指定为“C
保护基团
在一些情况下,可能需要在多官能化合物中的一个反应位点处选择性地进行化学反应。用于实现此类选择性的一种此类方法是用保护基团暂时地封闭多官能化合物中的一个或多个反应位点。此类方法通常被称为“保护”官能团。许多保护基团是本领域已知的。参见,例如,Greene等人,Protective Groups in Organic Synthesis,第三版(John Wiley&Sons,Inc.1999),其通过援引整体并入本文;Wutz等人,Greene's Protective Groups inOrganic Synthesis,第四版(John Wiley&Sons,Inc.2007),其通过援引整体并入本文。当多官能化合物中的多于一个的反应位点需要保护时,或者当制备将具有多于一个的受保护官能团的化合物时,重要的是使用正交保护基团。如果保护基团易于选择性去除,则保护基团是正交的。
在一些实施方案中,可能需要保护一个或多个官能团以防止它们在所需反应中的干扰。例如,可能需要保护一个或多个官能团,例如胺、羧酸和/或羟基基团。
羧酸的合适的保护基团包括:酯,例如可酶裂解的酯,包括庚基、2-N-(吗啉基)乙基、胆碱、(甲氧基乙氧基)乙基、甲氧基乙基;烷基酯,例如甲基、乙基、丙基、异丙基、丁基、叔丁基、仲丁基、戊基、新戊基、己基、庚基、壬基、癸基及其构型异构体;取代的甲基酯,例如9-芴基甲基、甲氧基甲基、甲硫基甲基、四氢吡喃基、四氢呋喃基、甲氧基乙氧基甲基、2-(三甲基甲硅烷基)乙氧基甲基、苄氧基甲基、新戊酰氧基甲基、苯基乙酰氧基甲基、三异丙基甲硅烷基甲基、氰基甲基、丙酮醇、苯甲酰基、对溴苯甲酰基、α–甲基苯甲酰基、对甲氧基苯甲酰基、二苯乙酮基(desyl)、甲酰氨基甲基、对偶氮苯甲酰胺基甲基、N-邻苯二甲酰亚胺基甲基;2-取代的乙基酯,例如2,2,2-三氯乙基、2-卤代乙基、ω–氯烷基、2-(三甲基甲硅烷基)乙基、2-甲硫基乙基、1,3-二噻烷基-2-甲基、2-(对硝基苯基亚磺酰基)乙基、2-(对甲苯磺酰基)乙基、2-(2'-吡啶基)乙基、2-(对甲氧基苯基)乙基、2-(二苯基膦基)乙基、1-甲基-1-苯基乙基、2-(4-乙酰基-2-硝基苯基)乙基、2-氰基乙基、3-甲基-3-戊基、二环丙基甲基、2,4-二甲基-3-戊基、环戊基、环己基、烯丙基、甲代烯丙基、2-甲基丁-e-烯-2-基、3-甲基丁-2-(异戊二烯基)、3-丁烯-1-基、4-(三甲基甲硅烷基)-2-丁烯-1-基、肉桂基、α–甲基肉桂基、丙-2-炔基、苯基;2,6-二烷基苯酯,例如2,6-二甲基苯基、2,6-二异丙基苯基、2,6-二-叔丁基-4-甲基苯基、2,6-二-叔丁基-4-甲氧基苯基、对-(甲硫基)苯基、五氟苯基、苄基;取代的苄基酯,例如三苯基甲基、二苯基甲基、双(邻硝基苯基)甲基、9-蒽基甲基、2-(9,10-二氧代)蒽基甲基、5-二苯并环庚基、1-芘基甲基、2-(三氟甲基)-6-色酮基甲基、2,4,6-三甲基苄基、对溴苄基、邻硝基苄基、对硝基苄基、对甲氧基苄基、2,6-二甲氧基苄基,4-(甲基亚磺酰基)苄基、4-磺基苄基、4-叠氮基甲氧基苄基、4-{N-[1-(4,4-二甲基-2,6-二氧代亚环己基)-3-甲基丁基]氨基}苄基、胡椒基、4-皮考基、聚合物负载的p-苄基;甲硅烷基酯,例如三甲基甲硅烷基、三乙基甲硅烷基、叔丁基二甲基甲硅烷基、异丙基二甲基甲硅烷基、苯基二甲基甲硅烷基、二-叔丁基甲基甲硅烷基、三异丙基甲硅烷基;活化酯,例如硫醇酯;噁唑;2-烷基-1,3-噁唑啉;4-烷基-5-氧代-1,3-噁唑烷;2,2-双三氟甲基-4-烷基-5-氧代-1,3-噁唑烷;5-烷基-4-氧代-1,3-二氧杂环戊烷;二氧杂环己酮;原酸酯;五氨基钴(III)络合物;以及甲锡烷基酯,例如三乙基甲锡烷基和三正丁基甲锡烷基;酰胺,例如N,N-二甲基、吡咯烷基、哌啶基、5,6-二氢菲啶基、邻硝基苯胺、N-7-硝基吲哚基、N-8-硝基-1,2,3,4-四氢喹啉基、2-(2-氨基苯基)乙醛二甲基缩醛酰胺和聚合物负载的对苯磺酰胺;酰肼,例如N-苯基、N,N'-二异丙基;以及四烷基铵盐,例如甲基、乙基、丙基、异丙基、丁基、叔丁基、仲丁基、戊基、新戊基、己基、庚基、壬基、癸基及其构型异构体。
施用及药物组合物
本文公开的化合物(例如,化合物I'的结晶形式A)以治疗有效剂量施用。尽管对于本文描述的化合物仍待优化人剂量水平,但通常日剂量可以是约0.25mg/kg体重至约120mg/kg体重或更多、约0.5mg/kg体重或更少至约70mg/kg体重、约1.0mg/kg体重至约50mg/kg体重、或者约1.5mg/kg体重至约10mg/kg体重。因此,对于向70kg的人施用,剂量范围可以是每天约17mg至每天约8000mg、每天约35mg或更少至每天约7000mg或更多、每天约70mg至每天约6000mg、每天约100mg至每天约5000mg、或者每天约200mg至每天约3000mg。当然,施用的活性化合物的量将取决于被治疗的个体和疾病状态、疾病的严重程度、施用的方式和时间表以及处方医师的判断。
可以经由任一种可接受的具有类似效用的试剂的施用方式来施用本文公开的化合物,所述施用方式包括但不限于,口服、皮下、静脉内、鼻内、局部、经皮、腹膜内、肌内、肺内、阴道、直肠或眼内施用。在治疗作为优选实施方案的个体的适应症时,口服和肠胃外施用是常用的。
可以将上述有用的化合物配制成用于治疗这些病况的药物组合物。使用标准的药物制剂技术,例如以下公开的技术:Remington的The Science and Practice ofPharmacy,第21版,Lippincott Williams&Wilkins(2005),通过援引整体并入本文。因此,一些实施方案包括药物组合物,其包含:(a)安全且治疗有效量的本文描述的化合物(包括其对映异构体、非对映异构体、互变异构体、多晶型物及溶剂化物),或其药物可接受的盐;以及(b)药物可接受的载体、稀释剂、赋形剂或其组合。
除了如以上描述有用的所选化合物之外,一些实施方案包括含药物可接受的载体的组合物。术语“药物可接受的载体”或“药物可接受的赋形剂”包括任何和所有的溶剂、分散介质、包衣、抗菌剂和抗真菌剂、等渗剂和吸收延迟剂等。对药物活性物质使用此类介质和试剂是本领域熟知的。除非任何常规介质或试剂与活性成分不相容,可以预期其用于治疗性组合物。此外,可以包括例如本领域常用的各种佐剂。描述了在药物组合物中包含各种组分的考虑,例如,描述于Gilman等人(编著)(1990);Goodman和Gilman的:ThePharmacological Basis of Therapeutics,第8版,Pergamon Press,其通过援引整体并入本文。
可以用作药物可接受的载体或其组分的物质的一些实例是糖,例如乳糖、葡萄糖和蔗糖;淀粉,例如玉米淀粉和马铃薯淀粉;纤维素及其衍生物,例如羧甲基纤维素钠、乙基纤维素和甲基纤维素;黄芪粉;麦芽;明胶;滑石;固体润滑剂,例如硬脂酸和硬脂酸镁;硫酸钙;植物油,例如花生油、棉籽油、芝麻油、橄榄油、玉米油和可可油;多元醇,例如丙二醇、甘油、山梨糖醇、甘露糖醇和聚乙二醇;海藻酸;乳化剂,例如TWEENS;润湿剂,例如月桂酸硫酸钠;着色剂;调味剂;制锭剂、稳定剂;抗氧化剂;防腐剂;无热原水;等渗盐水和磷酸盐缓冲溶液。
与题述化合物联用的药物可接受的载体的选择基本上由该化合物的施用方式决定。
本文描述的组合物优选以单位剂型提供。如本文使用,“单位剂型”是根据良好医疗实践,包含适用于以单次剂量向动物(优选哺乳动物个体)施用的化合物的量的组合物。然而,单次或单位剂型的制备并不意味着所述剂型每天施用一次或每疗程施用一次。预期此类剂型每天施用一次、两次、三次或更多次,并且可以以输注一段时间(例如,约30分钟至约2-6小时)施用,或者以连续输注施用,并且可以在疗程期间施用一次以上,然而并没有特别排除单次施用。技术人员应认识到,制剂并未特别考虑整个疗程,并且将此类决定留给治疗领域的技术人员而不是制剂领域的技术人员。
上述有用的组合物可以处于用于各种施用途经的各种适合的形式,例如用于口服、鼻、直肠、局部(包括经皮)、眼、脑内、颅内、鞘内、动脉内、静脉内、肌内或其它胃肠外施用途经。技术人员应认识到,口服组合物和鼻用组合物包括通过吸入施用并且利用可用方法学制备的组合物。取决于期望的具体施用途经,可以使用本领域熟知的各种药物可接受的载体。药物可接受的载体包括,例如,固体或液体填充剂、稀释剂、助溶剂、表面活性剂和封装物质。可以包含任选的药物活性材料,其基本上不干扰化合物的抑制活性。与化合物结合使用的载体的量足以提供施用每单位剂量化合物的材料的实际用量。在以下参考文献(全部通过援引并入本文)中描述了可用于本文描述的方法的用于制备剂型的技术和组合物:Modern Pharmaceutics,第4版,Chapters 9and 10(Banker&Rhodes编著,2002);Lieberman等人,Pharmaceutical Dosage Forms:Tablets(1989);和Ansel,Introductionto Pharmaceutical Dosage Forms第8版(2004)。
可以使用各种口服剂型,包括固体形式,例如片剂、胶囊剂、颗粒剂和散装粉剂。片剂可以是压制的、模印片、肠衣的、糖衣的、膜包衣的或多重压制的,含有适合的粘合剂、润滑剂、稀释剂、崩解剂、着色剂、调味剂、流动诱导剂和熔化剂。液体口服剂型包括水溶液、乳液、悬浮液、由非泡腾颗粒重构的溶液和/或悬浮液,以及由泡腾颗粒重构的泡腾制剂,其含有适合的溶剂、防腐剂、乳化剂、混悬剂、稀释剂、甜味剂、熔化剂、着色剂和调味剂。
适用于制备经口施用的单位剂型的药物可接受的载体是本领域熟知的。片剂通常包含常规的药物相容的佐剂作为惰性稀释剂,例如碳酸钙、碳酸钠、甘露糖醇、乳糖和纤维素;粘合剂,例如淀粉、明胶和蔗糖;崩解剂,例如淀粉、海藻酸和交联羧甲基纤维素;润滑剂,例如硬脂酸镁、硬脂酸和滑石。可以使用诸如二氧化硅的助流剂来改善粉末混合物的流动特性。为了外观,可以添加着色剂,例如FD&C染料。甜味剂和调味剂,例如阿斯巴甜、糖精、薄荷醇、薄荷和水果味,是可咀嚼片剂的有用佐剂。胶囊剂通常包含一种或多种以上公开的固体稀释剂。载体组分的选择取决于诸如味道、成本和储存稳定性的次要因素,其可以由本领域技术人员容易地决定。
经口组合物还包括液体溶液剂、乳剂、混悬剂等。适用于制备此类组合物的药物可接受的载体是本领域熟知的。用于糖浆剂、酏剂、乳剂和混悬剂的典型的载体组分包括乙醇、甘油、丙二醇、聚乙二醇、液体蔗糖、山梨糖醇和水。对于混悬剂,典型的悬浮剂包括甲基纤维素、羧甲基纤维素钠、AVICEL RC-591、黄芪胶和海藻酸钠;典型的润湿剂包括卵磷脂和聚山梨醇酯80;而典型的防腐剂包括对羟基苯甲酸甲酯和苯甲酸钠。经口液体组合物也可以包含例如以上公开的甜味剂、调味剂和着色剂中的一种或多种组分。
此类组合物还可以通过常规方法进行包衣,通常用pH依赖性包衣或时间依赖性包衣,使得题述化合物在所需的局部应用附近的肠胃道中释放,或在不同时间释放以延长所需作用。此类剂型通常包括但不限于,邻苯二甲酸乙酸纤维素、聚乙酸乙烯邻苯二甲酸酯、邻苯二甲酸羟丙基甲基纤维素、乙基纤维素、尤特奇(Eudragit)包衣、蜡和虫胶中的一种或多种。
本文描述的组合物可以任选地包含其它药物活性成分。
用于实现全身递送题述化合物的其它组合物包括舌下、颊部和鼻用剂型。此类组合物通常包含一种或多种可溶填充剂物质,例如蔗糖、山梨醇和甘露醇;以及粘合剂,例如阿拉伯树胶、微晶纤维素、羧甲基纤维素和羟丙基甲基纤维素。还可以包含以上公开的助流剂、润滑剂、甜味剂、着色剂、抗氧化剂和调味剂。
配制了为局部眼用配制的液体组合物,使得其可以向眼睛局部施用。应尽可能使舒适感最大化,但有时配制考虑(例如药物稳定性)可能致使无法达到最佳舒适感。在不能将舒适感最大化的情况下,应配制液体,使得液体对局部眼应用的患者而言是可容忍的。另外,眼可接受的液体应被包装成单次使用,或包含防腐剂以预防经多次使用的污染。
对于眼应用,通常用生理盐水溶液作为主要溶媒制备溶液或药物。应优选用适当的缓冲系统使眼溶液保持在舒适的pH。制剂还可以含有常规的药物可接受的防腐剂、稳定剂和表面活性剂。
可用于本文公开的药物组合物的防腐剂包括但不限于,苯扎氯铵、PHMB、氯丁醇、硫柳汞、乙酸苯汞和硝酸苯汞。有用的表面活性剂为,例如Tween80。同样地,各种有用的溶媒也可用于本文公开的眼制剂中。这些溶媒包括但不限于,聚乙烯醇、聚维酮、羟丙基甲基纤维素、泊洛沙姆、羧甲基纤维素、羟乙基纤维素和纯水。
需要或方便时可以添加张力调节剂。它们包括但不限于,盐(特别是氯化钠、氯化钾)、甘露醇和甘油,或任何其它适合的眼可接受的张力调节剂。
可以使用各种用于调节pH的缓冲液和方法,只要得到的制剂是眼可接受的即可。对于许多组合物,pH为4至9。因此,缓冲液包括乙酸盐缓冲液、柠檬酸盐缓冲液、磷酸盐缓冲液和硼酸盐缓冲液。可以按需要用酸或碱调节这些制剂的pH。
类似地,眼可接受的抗氧化剂包括但不限于,焦亚硫酸钠、硫代硫酸钠、乙酰半胱氨酸、丁基羟基茴香醚和丁基羟基甲苯。
可以包含在眼制剂中的其它赋形剂组分为螯合剂。有用的螯合剂为依地酸二钠,但也可以使用其它螯合试剂代替或与其联用。
对于局部应用,使用包含本文公开的化合物的乳膏剂、软膏剂、凝胶剂、溶液剂或混悬剂等。局部制剂通常可以包含药物载体、共溶剂、乳化剂、渗透促进剂、防腐剂系统和软化剂。
对于静脉内施用,可以将本文描述的化合物和组合物溶解或分散在药物可接受的稀释剂(例如盐水或葡萄糖溶液)中。还可以包含适合的赋形剂以达到期望的pH,包括但不限于NaOH、碳酸钠、乙酸钠、HCl和柠檬酸。在各种实施方案中,最终组合物的pH为2至8,或优选4至7。抗氧化剂赋形剂可以包括亚硫酸氢钠、丙酮合亚硫酸氢钠、甲醛次硫酸氢钠、硫脲和EDTA。最终静脉内组合物中存在的适合的赋形剂的其它非限制性实例可以包括磷酸钠或磷酸钾、柠檬酸、酒石酸、明胶和诸如葡萄糖、甘露醇和葡聚糖的碳水化合物。其它可接受的赋形剂描述于:Powell等人,Compendium of Excipients for Parenteral Formulations,PDA J Pharm Sci and Tech 1998,52 238-311和Nema等人,Excipients and Their Rolein Approved Injectable Products:Current Usage and Future Directions,PDA JPharm Sci and Tech 2011,65 287-332,两者通过援引整体并入本文。还可以包含抗微生物剂以获得抑制细菌或抑制真菌的溶液,包括但不限于硝酸苯汞、硫柳汞、苄索氯铵、苯扎氯铵、苯酚、甲酚和氯丁醇。
可以以一种或多种固体形式向护理人员提供用于静脉内施用的组合物,所述固体在施用之前可以立即用适合的稀释剂(例如无菌水、盐水或葡萄糖水溶液)进行重构。在其它实施方案中,以准备好进行胃肠外施用的溶液形式提供组合物。在其它实施方案中,以在施用之前需另外稀释的溶液形式提供组合物。在包括施用本文描述的化合物与其它试剂的组合的实施方案中,该组合可以作为混合物向护理人员提供,或者护理人员可以在施用之前混合两种试剂,或可以单独施用两种试剂。
本文描述的活性化合物的实际剂量取决于具体化合物和待治疗的病况;适当剂量的选择完全在技术人员的知识范围内。
治疗方法
本发明的一些实施方案包括用本文描述的化合物和包含本文描述的化合物的组合物治疗细菌感染的方法。一些方法包括向有需要的个体施用本文描述的化合物、组合物、药物组合物。在一些实施方案中,个体可以为动物,例如哺乳动物(包括人)。在一些实施方案中,细菌感染包括本文描述的细菌。从上述中应认识到,治疗细菌感染的方法包括预防有细菌感染风险的个体中的细菌感染的方法。
在一些实施方案中,个体是人。
其它实施方案包括向有需要的个体施用化合物的组合。组合可以包含本文描述的化合物、组合物、药物组合物与额外的药物。
一些实施方案包括共施用本文描述的化合物、组合物和/或药物组合物与额外的药物。“共施用”意指可以在患者的血流中同时存在两种或更多种药剂,无论其实际上是何时或如何被施用。在一个实施方案中,同时施用药剂。在一个此类实施方案中,通过将药剂合并在单次剂型中来实现组合施用。在另一个实施方案中,依次施用药剂。在一个实施方案中,通过相同途径施用药剂,例如口服。在其它实施方案中,通过不同途径施用药剂,例如一种是口服施用,而另一种是静脉内施用(i.v.)。
额外的药物的实例包括抗细菌剂、抗真菌剂、抗病毒剂、抗炎剂和抗过敏剂。
优选实施方案包括本文描述的化合物、组合物或药物组合物与诸如β-内酰胺的抗细菌剂的组合。此类β-内酰胺的实例包括阿莫西林、氨苄西林(例如,匹氨西林、海他西林、巴氨西林、美坦西林、酞氨西林)、依匹西林、羧苄西林(卡茚西林)、替卡西林、替莫西林、阿洛西林、哌拉西林、美洛西林、美西林(匹美西林)、磺苄西林、苄基青霉素(G)、氯甲西林、苄星青霉素、普鲁卡因苄基青霉素、阿度西林、培那西林、苯氧甲基青霉素(V)、丙匹西林、苄星苯氧甲基青霉素、非奈西林、氯唑西林(例如,双氯西林、氟氯西林)、苯唑西林、甲氧西林、萘夫西林、法罗培南、比阿培南、多利培南、厄他培南、亚胺培南、美罗培南、帕尼培南、头孢唑林、头孢乙腈、头孢羟氨苄、头孢氨苄、头孢来星、头孢洛宁、头孢噻啶、头孢噻吩、头孢匹林、头孢曲秦、头孢西酮、头孢氮氟、头孢拉定、头孢沙定、头孢替唑、头孢克洛、头孢孟多、头孢米诺、头孢尼西、头孢雷特、头孢替安、头孢丙烯、头孢拉宗、头孢呋辛、头孢唑南、头孢西丁、头孢替坦、头孢美唑、氯碳头孢、头孢克肟、头孢他啶、头孢曲松、头孢卡品、头孢达肟、头孢地尼、头孢托仑、头孢他美、头孢甲肟、头孢地秦、头孢哌酮、头孢噻肟、头孢咪唑、头孢匹胺、头孢泊肟、头孢磺啶、头孢特仑、头孢布烯、头孢噻林、头孢唑肟、氟氧头孢、拉氧头孢、头孢吡肟、头孢唑兰、头孢匹罗、头孢喹肟、头孢吡普、头孢洛林、头孢噻呋、头孢喹肟、头孢维星、氨曲南、替吉莫南和卡芦莫南。
优选实施方案包括诸如头孢他啶、比阿培南、多利培南、厄他培南、亚胺培南、美罗培南、替比培南、替比培南匹酯、艾帕培南和帕尼培南的β-内酰胺。
额外的优选实施方案包括诸如氨曲南、替吉莫南和卡芦莫南的β-内酰胺。
一些实施方案包括本文描述的化合物、组合物和/或药物组合物与额外的药剂的组合,其中该额外的药剂包括单酰胺菌素。单酰胺菌素的实例包括氨曲南、替吉莫南、诺卡菌素A、卡芦莫南和烟草野火菌毒素。在一些此类实施方案中,该化合物、组合物和/或药物组合物包含A、C或D类β-内酰胺酶抑制剂。一些实施方案包括共施用本文描述的化合物、组合物或药物组合物与一种或多种额外的药剂。
一些实施方案包括本文描述的化合物、组合物和/或药物组合物与额外的药剂的组合,其中该额外的药剂包括B类β-内酰胺酶抑制剂。B类β-内酰胺酶抑制剂的实例包括ME1071(Yoshikazu Ishii等人,“In Vitro Potentiation of Carbapenems with ME1071,a Novel Metallo-β-Lactamase Inhibitor,against Metallo-β-lactamase ProducingPseudomonas aeruginosa Clinical Isolates.”Antimicrob.Agents Chemother.doi:10.1128/AAC.01397-09(2010年7月))。一些实施方案包括共施用本文描述的化合物、组合物或药物组合物与一种或多种额外的药剂。
一些实施方案包括本文描述的化合物、组合物和/或药物组合物与额外的药剂的组合,其中该额外的药剂包括一种或多种包括A、B、C或D类β-内酰胺酶抑制剂的药剂。一些实施方案包括共施用本文描述的化合物、组合物或药物组合物与所述一种或多种额外的药剂。
适应症
本文描述的化合物和包含所述化合物的组合物可以用于治疗细菌感染。可以用本文描述的化合物、组合物和方法治疗的细菌感染可以包括广谱细菌。示例性生物体包括革兰氏阳性菌、革兰氏阴性菌、需氧细菌和厌氧细菌,例如葡萄球菌(Staphylococcus)、乳酸杆菌(Lactobacillus)、链球菌(Streptococcus)、八叠球菌(Sarcina)、埃希氏菌(Escherichia)、肠杆菌(Enterobacter)、克雷伯氏菌(Klebsiella)、假单胞菌(Pseudomonas)、不动杆菌(Acinetobacter)、分枝杆菌(Mycobacterium)、变形杆菌(Proteus)、弯曲杆菌(Campylobacter)、柠檬酸杆菌(Citrobacter)、奈瑟氏菌(Nisseria)、芽孢杆菌(Baccillus)、拟杆菌(Bacteroides)、消化球菌(Peptococcus)、梭状芽孢杆菌(Clostridium)、沙门菌(Salmonella)、志贺菌(Shigella)、沙雷菌(Serratia)、嗜血杆菌(Haemophilus)、布鲁氏菌(Brucella)和其它生物体。
细菌感染的更多实例包括铜绿假单胞菌(Pseudomonas aeruginosa)、荧光假单胞菌(Pseudomonas fluorescens)、食酸假单胞菌(Pseudomonas acidovorans)、产碱假单胞菌(Pseudomonas alcaligenes)、恶臭假单胞菌(Pseudomonas putida)、嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia)、洋葱伯克霍尔德菌(Burkholderia cepacia)、嗜水气单胞菌(Aeromonas hydrophilia)、大肠杆菌(Escherichia coli)、弗氏柠檬酸杆菌(Citrobacter freundii)、鼠伤寒沙门菌(Salmonella typhimurium)、伤寒沙门菌(Salmonella typhi)、副伤寒沙门菌(Salmonella paratyphi)、肠炎沙门菌(Salmonellaenteritidis)、痢疾志贺菌(Shigella dysenteriae)、弗氏志贺菌(Shigella flexneri)、宋内氏志贺菌(Shigella sonnei)、阴沟肠杆菌(Enterobacter cloacae)、产气肠杆菌(Enterobacter aerogenes)、肺炎克雷伯氏菌(Klebsiella pneumoniae)、产酸克雷伯氏菌(Klebsiella oxytoca)、粘质沙雷菌(Serratia marcescens)、土拉热弗朗西丝菌(Francisella tularensis)、摩氏摩根菌(Morganella morganii)、奇异变形杆菌(Proteusmirabilis)、普通变形杆菌(Proteus vulgaris)、产碱普罗威登斯菌(Providenciaalcalifaciens)、雷氏普罗威登斯菌(Providencia rettgeri)、斯氏普罗威登斯菌(Providencia stuartii)、鲍氏不动杆菌(Acinetobacter baumannii)、乙酸钙不动杆菌(Acinetobacter calcoaceticus)、溶血不动杆菌(Acinetobacter haemolyticus)、小肠结肠炎耶尔森菌(Yersinia enterocolitica)、鼠疫耶尔森菌(Yersinia pestis)、假结核耶尔森菌(Yersinia pseudotuberculosis)、中间耶尔森菌(Yersinia intermedia)、百日咳博德特菌(Bordetella pertussis)、副百日咳博德特菌(Bordetella parapertussis)、支气管炎博德特菌(Bordetella bronchiseptica)、流感嗜血杆菌(Haemophilusinfluenzae)、副流感嗜血杆菌(Haemophilus parainfluenzae)、溶血性嗜血杆菌(Haemophilus haemolyticus)、副溶血性嗜血杆菌(Haemophilus parahaemolyticus)、杜克雷嗜血杆菌(Haemophilus ducreyi)、多杀巴斯德菌(Pasteurella multocida)、溶血巴斯德菌(Pasteurella haemolytica)、粘膜炎布兰汉球菌(Branhamella catarrhalis)、幽门螺杆菌(Helicobacter pylori)、胎儿弯曲杆菌(Campylobacter fetus)、空肠弯曲杆菌(Campylobacter jejuni)、结肠弯曲杆菌(Campylobacter coli)、博氏疏螺旋体菌(Borrelia burgdorferi)、霍乱弧菌(Vibrio cholerae)、副溶血性弧菌(Vibrioparahaemolyticus)、嗜肺军团菌(Legionella pneumophila)、单核细胞增生李斯特菌(Listeria monocytogenes)、淋病奈瑟氏菌(Neisseria gonorrhoeae)、脑膜炎奈瑟氏菌(Neisseria meningitidis)、金氏杆菌(Kingella)、摩拉克氏菌(Moraxella)、阴道加德那菌(Gardnerella vaginalis)、脆弱拟杆菌(Bacteroides fragilis)、吉氏拟杆菌(Bacteroides distasonis)、拟杆菌3452A同源组(Bacteroides 3452A homology group)、普通拟杆菌(Bacteroides vulgatus)、卵形拟杆菌(Bacteroides ovalus)、多形拟杆菌(Bacteroides thetaiotaomicron)、单形拟杆菌(Bacteroides uniformis)、埃氏拟杆菌(Bacteroides eggerthii)、内脏拟杆菌(Bacteroides splanchnicus)、艰难梭状芽孢杆菌(Clostridium difficile)、结核分枝杆菌(Mycobacterium tuberculosis)、鸟分枝杆菌(Mycobacterium avium)、细胞内分枝杆菌(Mycobacterium intracellulare)、麻风分枝杆菌(Mycobacterium leprae)、白喉棒状杆菌(Corynebacterium diphtheriae)、溃疡棒状杆菌(Corynebacterium ulcerans)、肺炎链球菌(Streptococcus pneumoniae)、无乳链球菌(Streptococcus agalactiae)、酿脓链球菌(Streptococcus pyogenes)、粪肠球菌(Enterococcus faecalis)、屎肠球菌(Enterococcus faecium)、金黄色葡萄球菌(Staphylococcus aureus)、表皮葡萄球菌(Staphylococcus epidermidis)、腐生葡萄球菌(Staphylococcus saprophyticus)、中间葡萄球菌(Staphylococcus intermedius)、猪葡萄球菌猪亚种(Staphylococcus hyicus subsp.hyicus)、溶血性葡萄球菌(Staphylococcus haemolyticus)、人葡萄球菌(Staphylococcus hominis)或解糖葡萄球菌(Staphylococcus saccharolyticus)。
为了进一步说明本发明,包括以下实施例。当然,这些实施例不应被解释为具体限制本发明。这些实施例在权利要求范围内的变体在本领域技术人员的技术范围内,并且被认为落入如本文描述且要求保护的本发明的范围内。读者应认识到,借助本公开内容的技术人员和本领域技术人员无需详尽的实例就能够制备并且使用本发明。以下实施例将进一步描述本发明,并且仅用于说明的目的,而不应认为是限制。
实施例
X-射线粉末衍射(XRPD)
Rigaku Smart-Lab X射线衍射系统被配置用于使用线源X射线光束的反映Bragg-Brentano几何形状。X射线源是在40kV和44ma下操作的Cu长细聚焦管。该源在样品处提供入射光束分布,该入射光束分布从大角度处的窄线变化到小角度处的宽矩形。在线X射线源上使用光束调节狭缝以确保最大光束尺寸沿着线和垂直于线两者均小于10mm。Bragg-Brentano几何形状是由无源发散狭缝和接收狭缝控制的对焦几何形状,其中样品本身用作光学器件的聚焦组件。Bragg-Brentano几何形状的固有分辨率部分地由所使用的衍射仪半径和接收狭缝的宽度决定。通常,操作Rigaku Smart-Lab以得到0.1°2θ或更小的峰宽。X射线光束的轴向发散由入射和衍射光束路径上的5.0度Soller狭缝控制。在分析的同一天使用ASTM硅标准使仪器达标。
在低背景Si保持器中使用轻微的手动压力制备粉末样品,以保持样品表面平坦并且与样品保持器的参考表面齐平。使用每分钟6°2θ的连续扫描以0.02°2θ的有效步长从2°至40°2θ分析每个样品。
差示扫描量热法(DSC)
使用TA Instruments Q2500 Discovery Series仪器进行DSC分析。使用铟进行仪器温度校准。在每次分析期间,将DSC池保持在约50mL/分钟的氮气吹扫下。将样品置于标准的、卷曲的铝盘中,并且以10℃/分钟的速率从约25℃加热至350℃。
熔点(MP)分析
使用Stuart SMP3熔点设备进行熔点分析。将样品置于玻璃毛细管中,并且以10℃/分钟加热。
热重(TG)分析
使用TA Instruments Q5500 Discovery Series仪器进行TG分析。使用M类砝码校准仪器天平,并且使用铝镍合金进行温度校准。在天平处进行约40mL/分钟的氮气吹扫,在炉子处为约60mL/分钟。将每个样品置于预配衡的铂盘中,并且以10℃/分钟的速率从约25℃加热至350℃。
动态蒸汽吸附(DVS)分析
使用TA仪器Q5000 Dynamic Vapor Sorption分析仪进行DVS分析。用标准砝码和溴化钠标准物校准仪器的湿度。将约20mg样品装载到金属涂覆的石英盘中进行分析。在25℃下分析样品,在10%相对湿度(RH)步骤中从5%至95%RH(吸附循环)和从95%至5%RH(解吸循环)的最大平衡时间为1小时。在满足0.01%重量变化的平衡标准之后,或者如果不满足平衡标准则在1小时之后,从一步移动到下一步。使用Microsoft
卡尔费休(KF)分析
使用具有在175℃加热的炉附件的Mettler-Toledo C20库仑KF滴定仪进行卡尔费休分析。使用含有1%水的Hydranal水标准品校准仪器。滴定剂是Hydranal甲醇溶液。样品一式三份进行分析。
光学显微术
在Leica DM 2500P复合显微镜上进行光学显微术实验,使用10×放大倍数的目镜和10×放大倍数的物镜,总放大倍数为100×。使用Qimaging MicroPublisher 3.3RTV照相机捕获图像。
红外(IR)光谱
使用配备有氘代硫酸三甘氨酸(DTGS)检测器、溴化钾(KBr)分束器和电子温控(ETC)
拉曼光谱法
傅里叶变换(FT)拉曼光谱在与Nexus拉曼附件模块连接的Nicolet 6700型光谱仪上获得。该仪器配置有在1024nm下操作的Nd:YAG激光器、CaF
低频拉曼光谱法
拉曼光谱法是红外(IR)光谱法的补充技术,并且两种技术都提供了被研究实体的完全振动分析。商购拉曼仪器通常使用阻断瑞利散射并且仅允许获得低至约100cm
由于新的滤波器设计,低频(LF)拉曼光谱变得可用,并且已经证明该区允许识别/区分不同的结晶形式(参见Roy,S.,Chamberlin,B.和Matzger,A.J.,“PolymorphDiscrimination Using Low Wavenumber Raman Spectroscopy,”Org.ProcessRes.Dev.2013,17,976-980)。LF拉曼光谱法允许在拉曼光谱区(包括从2200cm
使用配备有ONDAX Thz拉曼系统(激发激光器853nm,陷波滤波器)的Renishaw拉曼获得LF拉曼光谱。分析固体样品的暴露时间为10秒和32次累积。将固体样品铺展在金载玻片上,并且使用接触固体样品的ONDAX TR-探针(Marqme TriX)进行分析。在样品分析之前使用硫参考标准品校准LF-拉曼。
13
在Bruker Avance II400光谱仪上进行固态
实施例1
催化剂制备:在充满N
反应:在充满N
反应条件:A-1(0.3mmol)、碱(1.5至3当量/A-1);B
分析:将加盖的小瓶从手套箱中取出,使其冷却至室温并去盖。将DI水(1mL)和甲苯或THF(500μL)添加至每个小瓶中。将6N HCl溶液(100-200μL)逐滴添加至每个小瓶中以中和过量的碱并达到1-2的pH。将小瓶搅拌1小时。分离两相,并将有机相的等分试样(50μL)添加至GC小瓶中。添加乙腈(950μL),将小瓶加盖并进行HPLC分析。结果总结于表1中。基于%面积产物(P)和%面积起始材料(SM)给出定性结果。使用校准曲线确定HPLC产率(稀释:反应体积:1.50mL,等分试样HPLC:50μL)。
表1:溶剂对A-2产率的影响
当Cs
实施例2
为了进一步理解水对A-1的硼化形成A-2的积极影响,使用Cs
催化剂制备:在充满N
反应:在充满N
反应条件:A-1(0.3mmol)、碱(1.1至3当量/A-1);B
分析:将加盖的小瓶从手套箱中取出,使其冷却至室温并去盖。将DI水(1mL)和乙醚(Et
表2:水对A-2产率的影响
当使用Cs
实施例3
将NiCl
催化剂制备:在充满N
反应:在充满N
反应条件:A-1(0.3mmol)、碱(1.1至3当量/A-1);B
分析:将加盖的小瓶从手套箱中取出,使其冷却至室温并去盖。将DI水(1mL)和Et
通过稍微不同的方案分析在THF和MTBE中进行的反应:将加盖的小瓶从手套箱中取出,使其冷却至室温并去盖。将DI水(1mL)和Et
将进行的结果总结在以下表3中。基于%面积产物(P)和%面积起始材料(SM)给出定性结果。
表3:催化剂制备和溶剂对A-1硼化的影响
观察到水的积极影响,最佳为5体积%。当在THF/H
实施例4
膦、碱的混合物、水和二硼对A-1硼化的影响
研究了4种不同的膦(P(Oct)
催化剂制备:在充满N
反应:在充满N
反应条件:A-1(0.3mmol)、碱(1.0至3当量/A-1);B
将加盖的小瓶从手套箱中取出,使其冷却至室温并去盖。将DI水(1mL)和Et
将结果总结在以下表4中。基于%面积P(产物)和%面积SM(起始材料)给出定性结果。
表4:膦、碱、水和二硼对A-1的硼化的影响
/>
三种脂肪族膦(P(Oct)
使用CsOH·H
实施例5
催化剂负载量对A-1硼化的影响
催化剂负载量对A-1硼化的影响以2.5和1.25mol%使用NiCl
催化剂制备:在充满N
反应:在充满N
反应条件:A-1(0.3mmol)、碱(2.0至3当量/A-1);B
分析:将加盖的小瓶从手套箱中取出,使其冷却至室温并去盖。将DI水(1mL)和Et
表5:催化剂负载量对A-1硼化的影响
在催化剂负载量低于5mol%时,没有一个反应显示起始材料完全消耗。
实施例6
用于A-1硼化的碱和B
测试三个不同量的碱(2.0;1.5和1.2当量/A-1)与三个不同量的B
催化剂制备:在充满N
反应:在充满N
反应条件:A-1(0.3mmol)、碱(1.2至2.0当量/A-1);B
分析:将加盖的小瓶从手套箱中取出,使其冷却至室温并去盖。将DI水(1mL)和Et
表6:用于A-1硼化的碱和B
在2当量的碱的存在下,以良好的产率检测到反应产物,但也观察到明显量的未水解的杂质A-1。将碱的量减少至1.5当量/A-1得到更干净的色谱图。使用1.2当量的B
实施例7
乙醇作为溶剂对A-1硼化的影响
催化剂制备:在充满N
反应:在充满N
反应条件:A-1(0.3mmol)、碱(1.0至3当量/A-1);B
分析:将加盖的小瓶从手套箱中取出,使其冷却至室温并去盖。将DI水(1mL)和Et
当使用THF/EtOH(95/5%v/v)作为溶剂时,硼化反应进行得非常好,表现出比THF/H
实施例8
使用CsOH·H
反应条件显示在以下表7中。所有反应使用作为碱的CsOH·H
表7:放大的A-1的硼化的反应条件
将进行的结果总结如下。基于%面积P;%面积SM;%面积PCOOH(水解产物);%面积smCOOH(水解的起始材料)给出定性结果。
观察:实验#1当遵循与1mL规模反应相同的方案时,观察到优异的再现性:添加作为固体的碱和B
实验#2在室温下(约30-32℃)搅拌CsOH·H
实验#3在1小时内以固体形式加入CsOH·H
实验#4还在作为溶剂的EtOH中进行与CsOH·H
实验#5发现在添加溶剂和底物之前预混合固体碱和固体催化剂对反应非常不利。似乎催化剂与碱的接触引起催化剂分解:在2.5小时后几乎没有反应发生。此时,添加新批次的催化剂(5mol%)导致形成中等量的产物,但未实现完全转化。
实验#6将B
实施例9
使用Cs
所有反应使用作为碱的Cs
反应条件:底物(1.6mmol;333mg)、B
将反应结果总结如下。基于%面积P和%面积SM给出定性结果。
以小规模使用Cs
实施例10
用在THF中的CsOH·H
描述的所有步骤均在充满N
在配备有磁力搅拌器的25mL反应小瓶中,添加固体(403mg,2.4mmol,1.5当量;Aldrich,99.95%痕量金属基)。接着将固体B
实施例11
用CsOH·H
描述的所有步骤均在充满N
通过将固体CsOH·H
在配备有磁力搅拌器的25mL小瓶中,添加固体CsOH·H
实施例12
用在THF/EtOH(95/5%v/v)中的Cs
描述的所有步骤均在充满N
在配备有磁力搅拌器的25mL小瓶中,添加固体Cs
实施例13
在预混合B
描述的所有步骤均在充满N
在配备有磁力搅拌器的25mL小瓶中,添加固体Cs
一旦反应完成,将反应小瓶冷却至室温。将DI水(3mL)添加至混合物中,并将小瓶在室温下搅拌,然后将Et
实施例14
化合物A-3的制备
制备用于反应的(+)-伪麻黄碱:在氮气下,将10L的2-甲基四氢呋喃(MeTHF)加入100L反应器中。将伪麻黄碱盐酸盐(3070mg)加入反应器中并在搅拌下悬浮在MeTHF中。将另外的10L的2-MeTHF加入以洗涤附着在反应器的玻璃壁上的所有伪麻黄碱盐酸盐的固体。夹套温度设定在20℃。在氮气下,将6.2L的4N NaOH(3.4kg的30%NaOH)添加至伪麻黄碱盐酸盐在2-MeTHF中的悬浮液中。保持添加速率以保持内部温度低于50℃。将反应混合物在氮气下搅拌约1小时,然后停止搅拌以使溶液静置超过30分钟。在室温下分离各相,并将有机层保持在100L反应器内,并用盐水(5L)洗涤两次,最后水层的pH为pH9-10。将有机层转移出反应器并保持在玻璃瓶内。
在氮气下,将碳酸铯(14.1kg)加入100L反应器中。在氮气下,将固体频哪醇二硼(5.13kg)添加至反应器中。添加2-MeTHF(25.6kg、30L)以洗涤附着在内壁上的所有固体。将混合物在室温下搅拌约30分钟以溶解频哪醇二硼。将苯并呋喃酯A-1(3.0kg)添加至反应器中。通过真空/充入氮气将反应混合物脱气三次。在氮气下,将反应混合物加热至50℃,同时搅拌。分批添加P(n-Bu)
化合物A-3的单晶X射线结构测定
将具有式C
空间群由嵌入SHELXTL(6.14版,Bruker AXS Inc.,Madison,Wisconsin:USA)的程序XPREP确定。系统缺失和强度统计表明空间群P2
使用由Parsons等人,Acta Cryst.2013,B69,249-259描述的方法使用1,748个商[(I+)-(I-)]/[(I+)+(I-)]测定绝对结构参数(Flack x),并细化至-0.03(6)。67.679°θ弗里德尔对的完全性为97.2%。对于所有数据,它是93.6%。
细化的最后一个循环包括256个变量参数和1个约束(对于原点)和收敛(最大的参数偏移是其标准不确定度的0.001倍),其中未加权和加权一致因子为:R1=Σ|F
实施例15
化合物A-4的制备
在氮气下在搅拌下将乙醚(30L)装入100L反应器中。将对甲苯磺酸(PTSA)(15kg)装入反应器中并悬浮在乙醚中。再添加40L的乙醚以洗掉所有附着在玻璃壁上的PTSA固体。将反应混合物冷却至0℃,并将37%HCl(16kg)装入反应器中,同时保持温度低于0℃。然后用1kg的DI水洗涤附加线。缓慢添加NaNO
将N-甲基-N-亚硝基对甲苯磺酰胺溶液缓慢温热至20℃以溶解所有固体。用
在发生器内部,在氮气下加入二甲氧基乙烷(6.9kg)和45%KOH的水溶液(3.8kg),然后加热至高于53℃,并在反应期间保持在53-58℃。
反应器内部:将化合物A-3(1.2kg)装入反应器中,然后加入THF(21.7kg)。将反应器内容物在氮气下搅拌以溶解所有A-3,然后冷却至-25℃至-15℃的温度。在室温搅拌下将乙酸钯(12g)溶解在THF(3.1kg)中。将常压蒸馏设备用正氮吹扫惰性化并检查泄漏(将出口浸入60%乙酸水溶液中。观察到连续的氮气泡)。
一旦发生器的温度达到53℃或更高。将约500mL的乙醚送入发生器中。当醚被反应器连续接收时(醚滴从冷凝器的尾部连续落入反应器中),将所需量的N-甲基-N-亚硝基对甲苯磺酰胺的醚溶液连续均匀地送入发生器中。送入N-甲基-N-亚硝基对甲苯磺酰胺的时间总计为约100-110分钟。用泵将钯催化剂溶液分批添加到反应器中:每3分钟打开泵约30秒。添加催化剂的时间为约100-110分钟。在反应过程中,黄色重氮甲烷溶液连续流入反应器,并且在乙酸溶液中总是观察到气泡。
反应在90分钟时取样并通过HPLC分析完成。在氮气吹扫的存在下,在催化剂添加之后,将反应温度保持在低于-15℃,持续30分钟。用60%HOAc(3.7kg)的水溶液(内部温度在乙酸添加期间保持高于60℃)将发生器内容物镇静。用60%HOAc的THF(3.22kg)淬灭反应混合物。将淬灭的反应混合物转移到碳中并保持在室温下。合并使用A-3的三批反应用于后处理。将反应混合物在50℃减压浓缩至几乎干燥。将残余物溶于18L(对于三个合并的批次)的THF中。在减压蒸馏期间,将正庚烷(25kg)连续送入旋转蒸发瓶。使用旋转蒸发蒸馏将产物混合物浓缩至几乎干燥,再次再溶解在18L THF中,并且在减压蒸馏期间将正庚烷(25kg)连续送入旋转蒸发瓶中,使其浓缩至几乎干燥。将残余物溶解在18L(对于一个批次的步骤2反应,6L)的THF中,然后用异丙醇(35.4kg)稀释。然后通过过滤袋(填充有约300g的Celite)、1-5μm抛光过滤器和0.25μm抛光过滤器过滤溶液。使用旋转蒸发仪将过滤的产物溶液减压浓缩至干。使用异丙醇(14.1kg)溶解所有残余物,然后添加6L的正庚烷。检查溶液的乙酸含量,并且其低于1wt%。在搅拌下将IPA中的产物溶液冷却至0-10℃。使用过滤分离结晶化合物A-4并用冷异丙醇(3L)洗涤一次。首先使用减压蒸馏将滤液的体积减少至一半,然后冷却至0℃,并且使用过滤分离另外的A-4并用冷异丙醇(3L)洗涤一次。将结晶化合物A-4在45℃下真空干燥两天。
实施例16
化合物A-4的替代制备
将Zn/Cu对(1.71g,26.1mmol,2当量)和化合物A-3(5g,13mmol)的2-甲基四氢呋喃(25mL)的不均匀混合物在油浴中加热至65℃(浴68℃)。在达到65℃后,添加二碘甲烷(0.5mL,6.2mmol,0.5当量)。然后添加碘以引发反应,随后分批添加二碘甲烷(1.4mL,17.4mmol,1.3当量)以控制放热。在添加二碘甲烷完成后,将黑色不均匀混合物在65℃下搅拌30分钟,然后冷却至室温,通过HPLC测得转化率>99%且化学纯度为96.9%。将冷却的反应混合物用饱和NH
实施例17
化合物A-4的替代制备
在室温下,将乙酰氯(50μL)添加到Zn(3.41g,52.2mmol)、CuCl(517mg,5.2mmol)和CH
实施例18
化合物A-4的替代制备
向圆底烧瓶中加入1M ZnEt
实施例19
化合物A-5的制备
开发了7-氟-2-羟基-2H-苯并[e][1,2]氧杂硼杂环己二烯-8-甲酸乙酯(A-3)的伪麻黄碱络合物的环丙烷化方法,其通过原位制备试剂来减轻与锌/铜对的反应性相关的问题。此外,这些新条件允许用更便宜的CH
在室温下,将乙酰氯(93μL,1.3mmol)添加到Zn(6.83g,104mmol)、CuCl(1.03g,10.4mmol)和二硼甲烷(0.5mL、13mmol)在2-甲基四氢呋喃(MeTHF)(50mL)中的不均匀混合物中。将灰色混合物在设定为50℃的油浴中加热。当内部温度达到50℃时,立即添加起始材料A-3(10g,26.1mmol),并用MeTHF(5mL)冲洗烧瓶。将灰色的非均匀混合物加热至60℃(浴在60℃)。在内部温度达到59℃时,分小份添加剩余的CH
实施例20
化合物I'的制备
在氮气下,将化合物A-4(7kg)加入100L反应器中。将2-MeTHF(64kg)加入100L反应容器中以冲洗掉附着在玻璃壁上的所有固体。将温度升高至40℃。在搅拌下在约35℃下将化合物A-4溶解在2-MeTHF中。将氢氧化钠溶液(1.8kg固体溶解在13kg DI H
实施例21
手性助剂对化合物(B-IV)的制备的影响
用于该反应的手性助剂的制备可以通过描述于例如Tetrahedron Asymm.2016,27,338和Tetrahedron Asymm 2010,21,837(其各自的公开内容通过援引整体并入本文)中的程序来实现。
制备底物A-2在无水THF(30mg/mL)中的储备溶液和Pd(OAc)
表8:各种手性助剂的对映体过量化合物B-IV(乙酯)
/>
数据表明Aux-3在环丙烷化反应中显示出作为助剂的最佳性能。用该助剂获得的对映体过量与用(1S,2S)-(+)伪麻黄碱获得的对映体过量几乎相同。随着N-取代基尺寸的增加,环丙烷化反应的立体选择性降低。用N-异丙基Aux-5得到接近外消旋的产物。
应用麻黄碱类似物Aux-11导致显著较低的不对称诱导。用接近的类似物获得的对映体过量的绝对值与用(1S,2R)-(+)麻黄碱获得的对映体过量的绝对值相当。对于三种麻黄碱类似物(Aux-11、Aux-13和Aux-14),出现与伪麻黄碱类似物(Aux-3、Aux-4和Aux-5)相同的趋势:随着N-取代基尺寸的增加,环丙烷化反应的立体选择性降低。使用Aux-14,获得接近外消旋的产物,如使用Aux-5的情况。
实施例22
钯催化剂负载量对使用重氮甲烷的A-3的环丙烷化的影响
钯催化剂对于A-3环丙烷化的影响,例如以下催化剂:Pd(OAc)
结果提供在图25中。关于A-3转化率,Pd(OPiv)
图26示出了CH
实施例23
化合物I'的结晶形式A的制备和分离
化合物I'的结晶形式A是化合物I的二钠盐的一水合物。
将2-甲基四氢呋喃(2-Me-THF,8.0kg/kg化合物A-5)加入反应器中,抽真空并在20℃(15-25℃)下用N
在搅拌的同时向反应器中剩余的有机相中加入稀氢氧化钠溶液(NaOH
分离底部水相并弃去顶部有机相。将水相加回反应器中,然后向其中添加足够制备的酸性离子交换树脂以实现9.8的pH(9.0-10.5;在pH下降到该范围之下的情况下,可以使用稀氢氧化钠溶液校正pH)。然后在过滤器干燥器中过滤出树脂,用水冲洗反应器和树脂,并使滤液通过活性炭筒和抛光过滤器。然后将产物水溶液在最高65℃下真空浓缩至2.11kg/kg化合物A-5,随后在50℃(45-55℃)下在90分钟内加入到搅拌的甲基乙基酮(MEK,33.4kg/kg化合物A-5)中,并搅拌最少10小时,其结晶化合物I'(在MEK上清液中的水含量太高的情况下,浆料可以共沸浓缩)。然后,将产物在过滤器干燥器中滤出,用MEK(2.5kg/kg化合物A-5)和水(0.073kg/kg化合物A-5)的混合物洗涤,最后真空干燥(约100毫巴)在最高50℃的夹套温度下得到作为一水合物的化合物I'。
实施例24
化合物I
将合适尺寸的反应器抽真空并用N
使含有MEK反溶剂的反应器的夹套达到95℃并将溶剂回流脱气45分钟。在将反溶剂冷却回到51℃之后,在85分钟内并在300rpm的搅拌器速度下将以上制备的化合物I'溶液计量加入,使得化合物I'沉淀并结晶为一水合二钠盐。用脱气水(0.21kg/kg化合物I')将用于计量加入的设备中的残余化合物I'冲洗到反应器中。继续搅拌10小时,然后在50℃下通过nutsch过滤器过滤浆料。用MEK(2.7kg/kg化合物I')和水(0.081kg/kg化合物I')的混合物冲洗反应器,用冲洗混合物洗涤湿产物,并在最高50℃下真空(约100毫巴)干燥产物以获得高度结晶形式的化合物I'一水合物。
与上述结晶方法类似地制备的化合物I'的高度结晶形式A的差示扫描量热法(5℃/min)、热重分析(5℃/min)和动态蒸气吸附(在50℃下从45%至0%逐步RH降低)数据分别显示在图28至图30中。数据显示形式A的高度结晶的样品在152℃处具有吸热,当从34℃进行至140℃时表现出5.3%的重量损失,以及从140℃进行至238℃时具有0.71%的重量损失。高度结晶的样品不开始显示可感知的水损失直至加热至高于100℃,并且在5%至75%的相对湿度范围内抵抗水的获得/损失。
- 硼酸酯衍生物的合成及其用途
- 含铽的硼酸盐化合物、含铽的硼酸盐的多晶化合物、光学晶体及其制备方法和用途
