热稳定性提高的D-阿洛酮糖3-差向异构酶突变体及其应用
文献发布时间:2023-06-19 19:30:30
(一)技术领域
本发明涉及一种热稳定性提高的D-阿洛酮糖3-差向异构酶突变体及其编码基因,以及其在微生物催化D-阿洛酮糖异构化制备D-果糖和D-阿洛酮糖混合物的应用。
(二)背景技术
D-阿洛酮糖是D-果糖的C-3差向异构体。在立体化学中,含有多个手性碳原子的立体异构体,除了一个手性碳原子的构型不相同,其余的构型都相同的非对映体,叫做差向异构体,也称作差向立体异构体。D-阿洛酮糖作为一种新型功能性稀少糖,近来研究表明D-阿洛酮糖还具有很多生理功能,并且在膳食、医药、保健等领域具有重要应用潜力,吸引着越来越多国内外科学家的广泛关注。因此开发天然健康稀有糖代替已有的甜味剂成为研究热点。而日本厚生省批准可应用于食品生产中,并于2011年注册了阿洛酮糖的商标并正式申请了特定保健食品。美国食品药物管理局(FDA)也认定D-阿洛酮糖为食品安全级GRAS。
目前在生产D-阿洛酮糖的方法中认为生物法制备D-阿洛酮糖是最为有效的方法是寻找能使D-果糖转变为D-阿洛酮糖的酶。然而,目前的DAE酶对果糖催化活性低,且温度稳定性差等问题不适合工业化生产D-阿洛酮糖。随着D-阿洛酮糖的市场需求量的日益增加,高效的生物催化剂的开发对其工业应用至关重要。
为满足工业化应用的需求,不同属性的D-阿洛酮糖3-差向异构酶基于蛋白质工程技术开展酶分子热稳定性改造已进行开展研究。而基于计算机辅助的酶热稳定性分子改造对于满足人民群众日益增长的摄糖需求也具有重要意义。因此开发具有高催化活性和温度稳定性好的DAE酶对D-阿洛酮糖的生产有重要的意义。
(三)发明内容
本发明涉及一种D-阿洛酮糖3-差向异构酶突变体及编码基因,以及其在微生物催化D-阿洛酮糖异构化制备D-果糖和D-阿洛酮糖混合物的应用。
本发明采用的技术方案是:
一种D-阿洛酮糖3差向异构酶突变体,由序列如SEQ ID NO.2所示的氨基酸经单突变获得,所述单突变位点为:第13位氨基酸。
优选的,所述D-阿洛酮糖3差向异构酶突变体为SEQ ID NO.2所示氨基酸序列的第13位的丙氨酸突变为丝氨酸(核苷酸序列为SEQ ID NO.3,氨基酸序列为SEQ ID NO.4)
由于氨基酸序列的特殊性,任何SEQ ID NO.4所示氨基酸序列的多肽的变体,如其保守性变体、生物活性片段或衍生物,只要该多肽的片段或多肽变体与前述氨基酸序列同源性在95%以上,均属于本发明保护范围之列。所述改变可包括氨基酸序列中氨基酸的缺失、插入或替换;对于变体的保守性改变,所替换的氨基酸具有与原氨基酸相似的结构或化学性质,如用亮氨酸替换异亮氨酸,变体也可具有非保守性改变,如用色氨酸替换甘氨酸。
本发明还涉及编码所述D-阿洛酮糖3差向异构酶突变体的基因。
由于核苷酸序列的特殊性,任何SEQ ID NO.3所示多核苷酸的变体,只要其与该多核苷酸具有95%以上同源性,均属于本发明保护范围之列。所述多核苷酸的变体是指一种具有一个或多个核苷酸改变的多核苷酸序列。此多核苷酸的变体可以使生的等位变异体或非生的变异体,包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变编码氨基酸的功能。
本发明还涉及含有所述编码所述D-阿洛酮糖3差向异构酶突变体的基因的重组菌。
本发明还涉及所述D-阿洛酮糖3差向异构酶突变体在微生物催化D-果糖异构化制备D-阿洛酮糖中的应用。构建含有所述D-阿洛酮糖3差向异构酶基因的重组载体,将所述重组载体转化至大肠杆菌中,获得的重组基因工程菌进行诱导培养,将培养液分离得到含D-阿洛酮糖3差向异构酶的菌体细胞,即可作为酶源用于微生物催化D-果糖异构化制备D-阿洛酮糖。
具体的,所述应用为:以含D-阿洛酮糖3差向异构酶突变体基因的重组基因工程菌经发酵诱导培养获得的湿菌体为酶源,以D-果糖为底物,以钴离子为助催剂,以pH8.0的缓冲液为反应介质,在50~80℃、100~200r/min条件下反应,反应完全后,获得D-果糖和D-阿洛酮糖混合物。
所述反应体系中,湿菌体用量为10~70g/L,优选25g/L,钴离子终浓度为0.1~10mM,优选1mM,底物初始浓度为50~500g/L,优选100g/L。
所述湿菌体按如下方法制备获得:将含D-阿洛酮糖3差向异构酶突变体基因的重组基因工程菌接种至含终浓度50μg/mL卡那霉素的LB液体培养基中,37℃、200r/min培养至OD
本发明所述D-阿洛酮糖3差向异构酶突变体的筛选、表达及酶活测定方法为:
(1)重组菌的筛选:所述重组表达质粒pET-28a-CbDAE上带有卡那霉素抗性基因,如果重组质粒已经转化到大肠杆菌中,重组菌株具有卡那霉素抗性,能够在含有50μg/mL卡那霉素的平板上生长;挑取阳性转化子,即为D-阿洛酮糖3差向异构酶重组菌BL21(DE3)/pET-28a-CbDAE。
(2)D-阿洛酮糖3差向异构酶突变体表达菌株的构建
根据来源于Christensenellaceae bacterium的原始酶CbDAE的基因序列(CbDAE的核苷酸序列如SEQ ID NO.1所示,氨基酸序列如SEQ ID NO.2所示)设计定点突变的突变引物,利用快速PCR技术,以重组菌BL21(DE3)/pET-28a-CbDAE的质粒为模板,进行突变PCR,将第13位的丙氨酸突变为丝氨酸,突变质粒经Dpn I消化后转入大肠杆菌中,重组菌株具有卡那霉素抗性,能够在含有50μg/mL卡那霉素的平板上生长,挑取阳性转化子测序,序列显示成功突变13位点,即为D-阿洛酮糖3差向异构酶突变体菌BL21(DE3)/pET-28a-CbDAE/A13S。
(3)重组突变体菌经培养表达D-阿洛酮糖3差向异构酶
LB液体培养基(g/L)组成:胰蛋白胨10,酵母粉5,NaCl 10,溶剂为超纯水;LB固体培养基添加20g/L琼脂;高压灭菌;使用前添加终浓度50μg/mL卡那霉素。
将D-阿洛酮糖3差向异构酶突变体菌接种至终浓度50μg/mL卡那霉素的LB液体培养基,试管,装液量为10mL,培养温度37℃、摇床转速200r/min,培养至OD
(4)D-阿洛酮糖3差向异构酶酶活与得率测定
将0.25g菌体溶于10mL 50mMTris-Hcl缓冲溶液(pH 9.0)中,充分混匀悬浮菌体,加入终浓度1mM Co
HPLC检测条件:Agilent 1260HPLC色谱仪,Agilent自动进样器,sugar-park色谱柱,Agilent示差检测器,流动相采用超纯水,柱温设定为75℃,流速为0.4mL/min,采用外标法,根据峰的保留时间和峰面积来确定D-阿洛酮糖的产量。酶活定义:80℃和pH9.0下,每分钟将D-果糖异构化生成1μmolD-阿洛酮糖所需酶量定义为一个酶活单位(U)。得率(%)定义为反应3h取样时D-阿洛酮糖浓度与D-果糖初始浓度的比例。
本发明所述的D-阿洛酮糖3差向异构酶和突变体都能够耐受高温40~70℃,且在底物浓度为100g/L、反应温度80℃时,野生型D-阿洛酮糖3差向异构酶的酶活达到223.5U/(g·wet cell weight),转化率达到29.2%;D-阿洛酮糖3差向异构酶突变体的酶活达到275.6U/(g·wet cell weight),转化率达到31.2%。
本发明的有益效果主要体现在:本发明筛选得到一种耐高温D-阿洛酮糖3-差向异构酶突变体,增强了突变酶的半衰期,提高了酶对合成D-阿洛酮糖所用底物D-果糖的底物亲和力和转化效率,叠加突变体酶A13S在50℃时的t
(四)附图说明
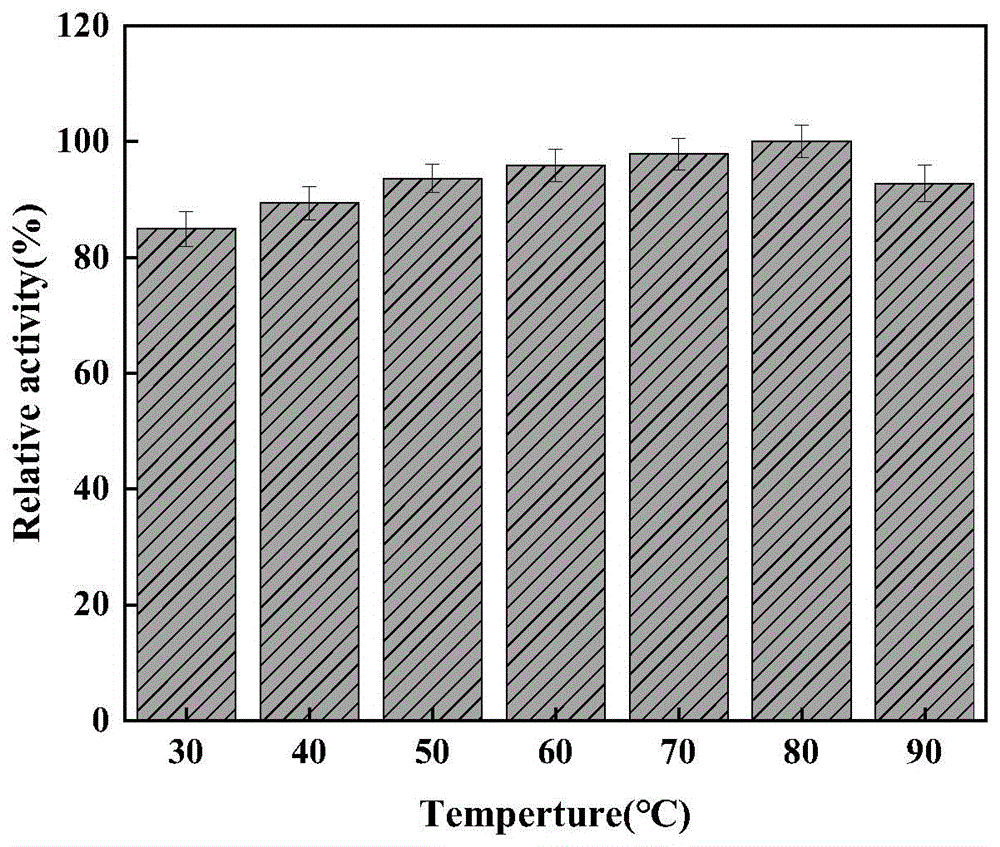
图1突变酶CbDAE/A13S的最适反应温度。
图2突变酶CbDAE/A13S的最适金属离子。
图3突变酶CbDAE/A13S纯酶的T
(五)具体实施方式
为了加深对本发明的理解,下面将结合具体实施例对本发明做进一步详细描述,该实施例仅用于解释本发明,并不对本发明的保护范围构成限定。
实施例1:D-阿洛酮糖3-差向异构酶单位点突变体文库的构建
根据原始酶CbDAE的基因序列(氨基酸序列为SEQ ID NO.2,核苷酸序列为SEQ IDNO.1)设计定点突变的突变引物,利用快速PCR技术,以重组载体pET28a/CbDAE为模板,分别对第13位和第148位引入单突变,设计引物为:
正向引物A13S:CCTACTGGGAACAG
反向引物A13S:ACAGGTAGTCGGCGGCCCA
正向引物G148M:TGATCTG
反向引物G148M:TCTCCAT
PCR反应体系(50μL)为:2×Phanta Max Buffer 25μL,dNTPs 1μL,正向引物2μL(5pmol/μL),反向引物2μL(5pmol/μL),模板DNA 1μL(20ng/μL),Phanta Max Super-Fidelity DNA Polymerase 1μL,加入ddH2O至50μL。
PCR反应程序为95℃预变性5min;30个循环(95℃变性10s,55-60℃退火15s,72℃延伸5.5min);72℃延伸10min,最后16℃保温,PCR产物以0.9%琼脂糖凝胶电泳验证,结果扩增到与目的载体大小相符的基因片段,即可进行下一步的实验。
PCR产物经过Dpn I 37℃酶切模板3h后,取3μL的PCR产物,加入100μL冰浴的E.coli BL21(DE3)感受态细胞悬液中,冰上静置30min,将转化产物于42℃热击90s,迅速置于冰上冷却5min,向管中加入600μL的LB液体培养基,37℃,150r/min培养50min,12000r/min离心1min,弃去400μL上清液并重悬菌液。取100μL上述重悬液涂布于含终浓度50μg/mL卡那霉素抗性LB固体培养基板,待菌液完全被培养基吸收后,37℃倒置培养12h,挑取菌落接种于含终浓度50μg/mL的卡那霉素抗性的10mL LB液体培养基中,37℃培养12h,获得各自的菌液。
菌液送至北京擎科生物有限公司进行测序且测序结果比对正确,即为单位点突变体重组菌E.coli BL21(DE3)/pET28a/CbDAE/A13S和E.coli BL21(DE3)/pET28a/CbDAE/G148M。
实施例2:重组大肠杆菌的表达
将实施例1中的D-阿洛酮糖3-差向异构酶CbDAE/A13S和CbDAE/G148M菌株分别接种至10mL LB液体培养基中(含终浓度50μg/mL卡那霉素),37℃、200r/min培养至OD
诱导培养13h后,将1g菌体沉淀悬浮于10mL 50mMTris-Hcl(pH 9.0)缓冲液中,超声破碎(超声2s,暂停2s,30min),离心后采用nickel-NTA亲和层析柱(Bio-Scale MiniProfinity IMAC预装柱,40mm长×12.6mm内径)进行纯化,纯化后在超纯水溶液(pH7.0)中过夜透析,取15μL透析后的纯酶液,加5μL 4X SDS缓冲液混合,沸水浴加热15min,取8μL进行SDS-PAGE电泳分析,得到一条分子量约33kDa的蛋白条带即为目的蛋白表达成功。
实施例3:D-阿洛酮糖3-差向异构酶突变体的酶活测定
将野生型D-阿洛酮糖3-差向异构酶CbDAE,实施例1单位点突变体D-阿洛酮糖3-差向异构酶CbDAE/A13S和CbDAE/G148M,分别按照实施例2中的方法进行诱导表达,同时测定该重组突变体菌对D-果糖的酶活。
酶活测定方法为:将0.25g实施案例3中收集的菌体溶于10mL 50mMTris-Hcl(pH9.0)缓冲液中,充分混匀悬浮菌体,加入终浓度1mM Co
HPLC检测条件:Agilent 1260HPLC色谱仪,Agilent自动进样器,sugar-park色谱柱,Agilent示差检测器,流动相采用超纯水,柱温设定为75℃,流速为0.4mL/min,采用外标法,根据峰的保留时间和峰面积来确定D-阿洛酮糖的产量。
酶活单位定义:80℃和pH 9.0下,每分钟将D-果糖异构化生成1μmolD-阿洛酮糖所需酶量定义为一个酶活单位(U)。D-阿洛酮糖3-差向异构酶的比酶活以每g湿菌体所含有的酶活力单位表示(U/g·wet cell weight),结果见表1。D-阿洛酮3-差向异构酶单位点突变体重组菌CbDAE/A13S活力是野生型D-阿洛酮糖3-差向异构酶的1.23倍,达到275.6U/(g·wet cell weight),而突变体重组菌CbDAE/G148M活力仅为野生型D-阿洛酮糖3-差向异构酶的0.87倍。
表1:D-阿洛酮糖3-差向异构酶及其突变体酶活力
实施例4:D-阿洛酮糖3-差向异构酶及其突变体的动力学常数测定
纯化重组突变体酶:将野生型D-阿洛酮糖3-差向异构酶CbDAE,实施例1中的突变体D-阿洛酮糖3-差向异构酶CbDAE/A13S按照实施例2中的方法进行诱导表达。诱导培养12h后,8000r/min,10min离心收集菌体,弃上清,用50mMTris-Hcl(pH 9.0)缓冲液润洗一遍菌体后,同样条件收集菌体。取一定量菌体,按100g菌体/LTris-Hcl(pH 9.0)缓冲液中比例悬浮菌体,超声破碎,8000r/min,10min离心,取上清,上清液为粗酶液,将上清通过nickel-NTA亲和层析柱(Bio-Scale Mini Profinity IMAC预装柱,40mm长×12.6mm内径)进行纯化,收集纯酶液。收集得到的纯酶液采用BCA试剂盒分别测试纯酶液的蛋白浓度为2.72mg/mL。将此纯化酶用于催化底物D-果糖和D-阿洛酮糖测定动力学常数。
反应体系如下:D-果糖和D-阿洛酮糖初始底物浓度为20-600mM,以钴离子(1mM)为助催剂,以50mMTris-Hcl(pH 9.0)缓冲液为反应介质,在80℃、600r/min条件下反应10min后,将反应液分离纯化,通过D-果糖和D-阿洛酮糖的生成量拟合计算出动力学常数。结果见表2。结果显示单点突变CbDAE/A13S对底物亲和力有所提高。
表2:酶动力学参数测定
实施例5:D-阿洛酮糖3-差向异构酶突变体的热稳定性测定
对D-阿洛酮糖3-差向异构酶原始菌及突变体CbDAE/A13S进行纯化。将收集得到的纯酶液用于催化底物D-果糖异构化反应制备D-阿洛酮糖。反应体系:50mM Tris-Hcl(pH9.0)缓冲液、100g/LD-果糖及0.03mg/mL纯酶液,共1mL体系。反应条件:50℃水浴锅中分保温420min,在此过程中每隔10min取终浓度为0.03mg/ml的酶量反应10min,冰浴10min终止反应,12000r/min离心,稀释10倍后,0.22μm水膜过滤后。采用实施例3中检测方法检测D-果糖(D-Fructose)、D-阿洛酮糖(D-Allulose)的浓度并计算残余酶活。
表3:酶50℃下半衰期测定
实施例6:D-阿洛酮糖3-差向异构酶突变体CbDAE/A13S的最适反应温度测定
将实施例4制备的纯酶液作为转化用酶,测定酶的最适反应温度。反应体系:100g/L的D-果糖和0.04mg/mL纯酶液,再加入50mM Tris-Hcl(pH9.0)缓冲液至总体系1mL。于不同温度(40、45、50、55、60、65、70、75、80、90℃)条件下反应10min,其他条件同实施例3的酶活检测方法,结果见图1所示。由图可知,D-阿洛酮糖3-差向异构酶突变酶CbDAE/A13S的最适反应温度为80℃。
实施例7:D-阿洛酮糖3-差向异构酶突变体的T
照实施例5中的D-阿洛酮糖3-差向异构酶纯化方法对野生型D-阿洛酮糖3-差向异构酶CbDAE,实施例1中的突变体CbDAE/A13S分别进行纯化。将收集的纯酶液分别进行脱盐处理后利用圆二色普仪进行值测定,结果如图3所示,T
实施例8:D-阿洛酮糖3-差向异构酶突变体CbDAE/A13S的最适金属离子测定
将实施例4制备的纯酶液作为转化用酶,测定酶的最适反应金属离子。反应体系:100g/L的D-果糖和0.03mg/mL纯酶液,再加入50mM Tris-Hcl(pH 9.0)缓冲液至总体系1mL。添加不同金属离子(EDTA、Mg
实施例9:D-阿洛酮糖3-差向异构酶突变体催化D-果糖制备D-阿洛酮糖
将实施例1中的突变体CbDAE/A13S,按照实施例2中的方法进行诱导表达。诱导培养13h后,8000r/min,10min离心收集菌体,弃上清,用50mMTris-Hcl(pH 9.0)缓冲液润洗一遍菌体后,同样条件收集菌体。收集湿菌体作为转化用酶,以D-果糖为底物,进行异构化反应制备D-阿洛酮糖。
具体操作如下:在50mL反应瓶中依次加入10mL50 mMTris-Hcl(pH 9.0)缓冲液,0.25g湿菌体、终浓度为50g/L的D-果糖、硼酸与果糖比为0.7的硼酸浓度(终浓度35g/L)、终浓度1mM Co
- 一种热稳定性提高的D-阿洛酮糖 3-差向异构酶的突变体酶及其应用
- 热稳定性得到改善的D-阿洛酮糖3-差向异构酶突变体和使用其的D-阿洛酮糖的连续制备
