基于DTN和CRISPR Cas12a的电感耦合等离子体质谱核酸检测方法
文献发布时间:2024-01-17 01:15:20
技术领域
本发明涉及生物检测技术领域,特别涉及一种基于DTN和CRISPR Cas12a的电感耦合等离子体质谱核酸检测方法。
背景技术
宫颈癌是最常见的妇科恶性肿瘤,被报道为导致女性死亡的主要原因之一。大多数宫颈癌是由持续的高危人乳头瘤病毒(High Risk-Human PapillomaVirus,HR-HPV)感染引起。据报道,大约有10种HR-HPV(例如HPV-16、HPV-18、HPV-31、HPV-33、HPV-35、HPV-39、HPV-45、HPV-52、HPV-58和HPV-59)与癌前病变及患癌密切相关。在中国,HPV-16、HPV-52、HPV-18和HPV-58基因型最为常见。HR-HPV的早期检测和基因分型对宫颈癌的筛查、诊断和治疗极为重要。近年来,世界卫生组织将HPV-DNA检测作为宫颈癌筛查的首选方法。
传统核酸检测方法如聚合酶链反应(polymerase chain reaction,PCR)等技术虽然被广泛用于HPV-DNA的检测和分型,但该方法需扩增产物,而大量扩增产物容易增加环境污染风险,且容易产生假阳性信号以及实验程序繁琐,极大阻碍了其更为广泛的临床应用。因此,迫切需要操作简单、灵敏度高、选择性强、多重检测能力强、无需核酸扩增的HR-HPV-DNA基因分型检测新方法。
CRISPR-Cas(Clustered regularly interspaced short palindromic repeats-associated system)是一种高效地基因编辑工具,可实现特定靶标核酸序列的识别、锚定和切割。其中,CRISPR-Cas12a系统已应用于体外诊断领域,其包含基因靶向性的crRNA和Cas蛋白,当两者形成核糖核酸复合物时可靶向特定的核酸序列并激活Cas蛋白的核酸酶切活性。该系统的高效酶裂解特性和高特异性序列识别特性,使其与多种光谱分析技术如荧光法、比色法、表面增强拉曼散射法等结合,实现核酸分析物良好的检测性能,有望取代PCR等传统技术。但是,由于CRISPR-Cas12a本身固有的非特异性单链DNA(single-stranded,ssDNA)切割活性的特点,基于CRISPR-Cas12a进行多重核酸分析物检测的应用依旧非常受限,尤其是对于HPV-DNA的多重检测。
发明内容
针对上述问题,本发明旨在提供一种基于DTN和CRISPR Cas12a的电感耦合等离子体质谱核酸检测方法,将ICP-MS的多重贵金属元素标记技术及DNA四面体纳米结构(DTN)与CRISPR-Cas12a相结合,利用ICP-MS(电感耦合等离子体质谱)不受光谱重叠、散射背景和生物基质物质干扰限制的优势及信号增强特点,以及DNA四面体核酸框架结构的生物表界面探针构象优化的特点,实现基于CRISPR-Cas12a技术的多重HPV-DNA的高特异性和高灵敏度的免扩增检测。
本发明的技术方案如下:
一种基于DTN和CRISPR Cas12a的电感耦合等离子体质谱核酸检测方法,以至少一种HPV分型的核酸为靶标,所述核酸检测方法包括以下步骤:
S1:获取金属纳米粒子和磁珠,采用巯基功能化的ssDNA对所述金属纳米粒子进行修饰,获得修饰金属纳米粒子;采用DTN对所述磁珠进行修饰,获得DTN修饰磁珠;
S2:将所述靶标对应CRISPR-Cas12a蛋白与crRNA进行混合,获得具有复合结构的复合物;
S3:分别将相同体积不同浓度的HPV分型加入所述复合物中,并向各个混合物中加入Linker底物,在37℃条件下反应30~60min后,加热终止反应,获得反应产物;
S4:将所述反应产物与DTN修饰磁珠进行混合孵育,然后进行磁性分离洗涤;
S5:向步骤S4获得的产物中加入所述修饰金属纳米粒子进行混合孵育,形成三明治结构;
S6:对所述三明治结构进行磁性分离洗涤去除上清液,用王水消解,并用纯水进行稀释,获得质谱采集溶液;
S7:对所述质谱采集溶液进行电感耦合等离子体质谱检测,获取其中金属纳米粒子的同位素信号;
S8:研究所述同位素信号的强度与HPV分型浓度的关系,获得HPV分型的检测结果。
作为优选,当以一种HPV分型的核酸为靶标时,步骤S1中,所述金属纳米粒子采用金纳米粒子;
当以两种HPV分型的核酸为靶标时,步骤S1中,所述金属纳米粒子采用金纳米粒子和银纳米粒子;
当以三种HPV分型的核酸为靶标时,步骤S1中,所述金属纳米粒子采用金纳米粒子、银纳米粒子和铂纳米粒子;
当以四种HPV分型的核酸为靶标时,步骤S1中,所述金属纳米粒子采用金纳米粒子、银纳米粒子、铂纳米粒子和钯纳米粒子。
作为优选,步骤S1中,采用巯基功能化的ssDNA对所述金属纳米粒子进行修饰时,采用如Seq_1所示的DNA序列进行巯基功能化,然后对金纳米粒子进行修饰;采用如Seq_2所示的DNA序列进行巯基功能化,然后对银纳米粒子进行修饰;采用如Seq_3所示的DNA序列进行巯基功能化,然后对铂纳米粒子进行修饰。
作为优选,步骤S1中,采用DTN对所述磁珠进行修饰时,具体包括以下子步骤:
S11:合成DNA四面体纳米结构;
S12:对所述磁珠进行链霉亲和素功能化,获得链霉亲和素功能化磁珠;
S13:将所述DNA四面体纳米结构与所述链霉亲和素功能化磁珠等体积混合,在室温条件下震荡孵育1~2h;
S14:进行多次磁分离,去除未反应的DNA四面体纳米结构,然后加入PBST缓冲液进行分散,获得所述DTN修饰磁珠。
作为优选,步骤S11中,合成DNA四面体纳米结构具体包括以下子步骤:
将等量的四条单链DNA在TM缓冲液中混匀,然后在90~95℃条件下退火5~15min,最后在4℃环境下孵育2~4h即可获得所述DNA四面体纳米结构。
作为优选,四条单链DNA分别为生物素修饰的ssDNA-A、生物素修饰的ssDNA-B、生物素修饰的ssDNA-C、ssDNA-D,所述ssDNA-D根据所述金属纳米粒子进行确定,选自ssDNA-D
作为优选,步骤S13中,所述DNA四面体纳米结构的用量为1~2uM,所述链霉亲和素功能化磁珠的用量为1~10mg/mL。
作为优选,步骤S2中,所述crRNA根据所采用的金属纳米粒子进行确定,当所述金属纳米粒子为金纳米粒子时,所述crRNA采用如Seq_10所示的crRNA
作为优选,步骤S3中,所述Linker底物根据所述金属纳米粒子选自Linker
作为优选,步骤S3中,加热终止反应时,加热至65℃维持10min。
本发明的有益效果是:
本发明首次实现了基于空间分离的CRISPR-Cas12a系统与ICP-MS技术结合,在DTN界面强化作用下对HPV-DNA多重精准诊断,对于其他多重核酸检测项目具有普适性;本发明将DNA四面体修饰在磁珠表界面,优化其表面探针取向和分布,进一步提高CRISPR-Cas12a系统检测性能,实现了50~100pM的HPV-DNA检测灵敏度;通过对宫颈试子处理后的样本检测,其结果与毛细管电泳片段分析、基因测序的结果一致,具有很好的临床应用前景。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
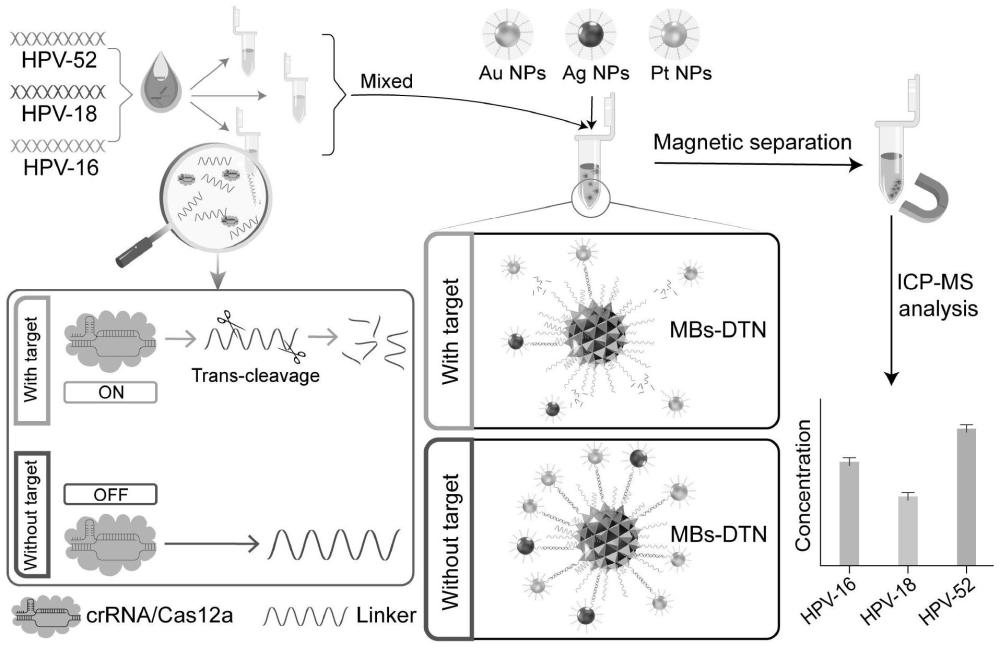
图1为一个具体实施例本发明基于DTN和CRISPR Cas12a的电感耦合等离子体质谱核酸检测方法的流程示意图;
图2为一个具体实施例不同DTN和ssDNA量的信号强度结果示意图;其中,图2(a)为DTN对应的信号强度结果示意图,图2(b)为ssDNA对应的信号强度结果示意图;
图3为一个具体实施例金纳米粒子的透射电镜结果示意图;
图4为一个具体实施例金纳米粒子表面修饰ssDNA前后紫外可见光谱结果示意图;
图5为一个具体实施例金纳米粒子表面修饰ssDNA前后的粒径和电位结果示意图;
图6为一个具体实施例银纳米粒子的透射电镜结果示意图;
图7为一个具体实施例银纳米粒子表面修饰ssDNA前后紫外可见光谱结果示意图;
图8为一个具体实施例银纳米粒子表面修饰ssDNA前后的粒径和电位结果示意图;
图9为一个具体实施例铂纳米粒子的透射电镜结果示意图;
图10为一个具体实施例铂纳米粒子表面修饰ssDNA前后紫外可见光谱结果示意图;
图11为一个具体实施例铂纳米粒子表面修饰ssDNA前后的粒径和电位结果示意图;
图12为一个具体实施例HPV16浓度与Au元素信号的关系结果示意图,载体为DTN修饰磁珠;
图13为一个具体实施例HPV18浓度与Ag元素信号的关系结果示意图,载体为DTN修饰磁珠;
图14为一个具体实施例HPV52浓度与Pt元素信号的关系结果示意图,载体为DTN修饰磁珠;
图15为一个具体实施例HPV16浓度与Au元素信号的关系结果示意图,载体为ssDNA修饰磁珠。
具体实施方式
下面结合附图和实施例对本发明进一步说明。需要说明的是,在不冲突的情况下,本申请中的实施例及实施例中的技术特征可以相互结合。需要指出的是,除非另有指明,本申请使用的所有技术和科学术语具有与本申请所属技术领域的普通技术人员通常理解的相同含义。本发明公开使用的“包括”或者“包含”等类似的词语意指出现该词前面的元件或者物件涵盖出现在该词后面列举的元件或者物件及其等同,而不排除其他元件或者物件。
本发明提供一种基于DTN和CRISPR Cas12a的电感耦合等离子体质谱核酸检测方法,以至少一种HPV分型的核酸为靶标,所述核酸检测方法包括以下步骤:
S1:获取金属纳米粒子和磁珠,采用巯基功能化的ssDNA对所述金属纳米粒子进行修饰,获得修饰金属纳米粒子;采用DTN对所述磁珠进行修饰,获得DTN修饰磁珠。
在一个具体的实施例中,若以一种HPV分型的核酸为靶标,则所述金属纳米粒子采用金纳米粒子;若以两种HPV分型的核酸为靶标,则所述金属纳米粒子采用金纳米粒子和银纳米粒子;若以三种HPV分型的核酸为靶标,则所述金属纳米粒子采用金纳米粒子、银纳米粒子和铂纳米粒子;若以四种HPV分型的核酸为靶标,则所述金属纳米粒子采用金纳米粒子、银纳米粒子、铂纳米粒子和钯纳米粒子。
在一个具体的实施例中,所述金纳米粒子、银纳米粒子、铂纳米粒子和钯纳米粒子采用还原法合成。其中金纳米粒子、银纳米粒子、铂纳米粒子的还原方法具体包括以下子步骤:分别取1~2ml的HAuCl
需要说明的是,除了上述实施例的合成方法外,也可采用现有技术中的其他合成方法或者直接购买获得所述金纳米粒子、银纳米粒子、铂纳米粒子和钯纳米粒子。
在一个具体的实施例中,采用巯基功能化的ssDNA对所述金属纳米粒子进行修饰时,采用如Seq_1所示的DNA序列进行巯基功能化,然后对金纳米粒子进行修饰;采用如Seq_2所示的DNA序列进行巯基功能化,然后对银纳米粒子进行修饰;采用如Seq_3所示的DNA序列进行巯基功能化,然后对铂纳米粒子进行修饰。
可选地,对金纳米粒子和铂纳米粒子进行修饰时,采用盐老化法进行修饰,对银纳米粒子进行修饰时,采用酸法进行修饰。
所述盐老化法具体包括以下子步骤:首先将Au-ssDNA和Pt-ssDNA于2~4nM的TCEP溶液中处理1h,然后将60uL的5~10uM的Au-ssDNA或Pt-ssDNA加入到1ml的金或铂纳米粒子溶液中(含有0.1%吐温20和10mM的Tris溶液),室温搅拌12h,加入20uL的3M NaCl溶液5次,每次间隔1h。最后室温反应24h,加入0~4uM的PEG 2000溶液反应2h,最后以12000转离心15min,去除上清液中多余的DNA探针和PEG,使用TBST缓冲液洗涤3次,最后分散在1mL的TBS缓冲液中。
所述酸法具体包括以下子步骤:首先将Ag-ssDNA于2~4nM的TCEP溶液中处理1h,其中加入600uL的银纳米粒子溶液,然后分两次加入12uL柠檬酸钠缓冲液(500mM,pH 3),孵育30min后,加入90μLHEPES缓冲液(500mM,pH 7.6),使pH恢复到中性。然后以12000rpm离心15min,去除上清液中多余的DNA探针,然后用TBST缓冲液洗涤3次,再分散到1ml TBS缓冲液中,加入4μM PEG反应2h,形成封闭。最后以12000rpm离心15min,去除上清液中多余的PEG,然后用TBST缓冲液洗涤3次,再分散到1ml TBS缓冲液中进行下一步。
在一个具体的实施例中,采用DTN对所述磁珠进行修饰时,具体包括以下子步骤:S11:合成DNA四面体纳米结构;S12:对所述磁珠进行链霉亲和素功能化,获得链霉亲和素功能化磁珠;S13:将所述DNA四面体纳米结构与所述链霉亲和素功能化磁珠等体积混合,可选地,所述DNA四面体纳米结构的用量为1~2uM,所述链霉亲和素功能化磁珠的用量为1~10mg/mL,在室温条件下震荡孵育1~2h;S14:进行多次磁分离,去除未反应的DNA四面体纳米结构,然后加入PBST缓冲液进行分散,获得所述DTN修饰磁珠。
在一个具体的实施例中,合成DNA四面体纳米结构具体包括以下子步骤:将等量的四条单链DNA在TM缓冲液中混匀,然后在90~95℃条件下退火5~15min,最后在4℃环境下孵育2~4h即可获得所述DNA四面体纳米结构。
可选地,四条单链DNA分别为生物素修饰的ssDNA-A、生物素修饰的ssDNA-B、生物素修饰的ssDNA-C、ssDNA-D,所述ssDNA-D根据所述金属纳米粒子进行确定,选自ssDNA-D
需要说明的是,本发明主要是利用DNA四面体纳米结构的空间特性,优化表面探针取向和分布,增强信号,除了上述实施例的合成方法外,现有技术中的其他合成方法获得的DNA四面体纳米结构也可适用于本发明。
S2:将所述靶标对应CRISPR-Cas12a蛋白与crRNA进行混合,获得具有复合结构的复合物。
在一个具体的实施例中,所述crRNA根据所采用的金属纳米粒子进行确定,当所述金属纳米粒子为金纳米粒子时,所述crRNA采用如Seq_10所示的crRNA
在一个具体的实施例中,当以三种不同分型的HPV为靶标时,将20~50nM的Cas12a蛋白和三种50~150nM的crRNA分别在不同的PCR管中在37℃条件下孵育15~30min,获得所述复合物。
S3:分别将相同体积不同浓度的HPV分型加入所述复合物中,并向各个混合物中加入Linker底物,在37℃条件下反应30~60min后,加热终止反应,获得反应产物。
在一个具体的实施例中,所述Linker底物根据所述金属纳米粒子选自Linker
可选地,在复合物中除了加入Linker底物和HPV外,还加有buffer用于调节溶液pH值;加热终止反应时,加热至65℃维持10min。需要说明的是,加热终止反应时,主要是利用升温使酶蛋白失活,除了本实施例采用的温度和时间外,也可采用其他温度和时间,只要能使酶蛋白失活即可。
S4:将所述反应产物与DTN修饰磁珠进行混合孵育,可选地,,进行混合孵育的时间为30~60min,然后进行磁性分离洗涤。
S5:向步骤S4获得的产物中加入所述修饰金属纳米粒子进行混合孵育,形成三明治结构。
在一个具体的实施例中,加入所述修饰金属纳米粒子时,在原有ssDNA修饰好的纳米粒子浓度基础上稀释5~10倍。
S6:对所述三明治结构进行磁性分离洗涤去除上清液,用王水消解,并用纯水进行稀释,获得质谱采集溶液。
在一个具体的实施例中,使用100~200uL的王水进行消解,使用4~8mL的纯水进行稀释。
S7:对所述质谱采集溶液进行电感耦合等离子体质谱检测,获取其中金属纳米粒子的同位素信号。
在一个具体的实施例中,金纳米粒子的同位素选自
S8:研究所述同位素信号的强度与HPV分型浓度的关系,获得HPV分型的检测结果。
在一个具体的实施例中,如图1所示,采用本发明所述基于DTN和CRISPR Cas12a的电感耦合等离子体质谱核酸检测方法对HPV-DNA进行检测,在本实施中,以HPV-16、HPV-18、HPV-52三种核酸为靶标。
主要试剂包括:Dynabeads商用磁珠(赛默飞);EnGenLba Cas12a(Cpf1)酶(纽英伦);引物序列(生工生物工程股份有限公司);RNase抑制剂(生工生物工程股份有限公司);四氯金酸(III)四水(HAuCl
实验仪器包括:恒温振荡仪,电感耦合等离子体质谱仪。
所述检测方法具体包括以下步骤:
(1)制备DTN功能化的磁珠(MBs-DTN)和ssDNA功能化的磁珠(MBs-ssDNA);
使用TBS buffer将100uL的10mg/mL的链霉亲和素功能化商用磁珠反复清洗三次,加入30、50、100、150、200、300uL的1uM DTN结构,孵育1h后,磁分离去除多余的DTN,重新溶解在TBST中。
ssDNA的功能化同上,不同的是,在加入ssDNA时,用量为200、300、400、500、600、700uL。
如图2所示,随着不同量DTN和ssDNA的加入,最终得到的信号强度不同,最终分别选择150uL和500uL作为最佳参数,进行后续步骤。
(2)金、银、铂纳米粒子表面ssDNA探针的修饰;
其中,金纳米粒子表面ssDNA的修饰通过盐老化法实现,具体包括以下子步骤:ssDNA在4nM TCEP溶液中处理1h后,将60uL的8uM的Au-ssDNA加入到1ml的金纳米粒子溶液中(含有0.1%吐温20和10mM的Tris溶液),室温搅拌12h,加入20uL的3M NaCl溶液5次,每次间隔1h。最后室温反应24h,加入0uM的PEG 2000溶液反应2h,最后以12000转离心15min,去除上清液中多余的DNA探针,使用TBST缓冲液洗涤3次,最后分散在1mL的TBS缓冲液中,表征结果如图3-5所示。
银纳米粒子表面ssDNA的修饰通过酸法实现,具体包括以下子步骤:首先将Ag-ssDNA与4nM的TCEP溶液中处理1h,其中加入600uL的银纳米粒子溶液,然后分两次加入12uL柠檬酸钠缓冲液(500mM,pH 3),孵育30min后,加入90μL HEPES缓冲液(500mM,pH7.6),使pH恢复到中性。然后以12000rpm离心15min,去除上清液中多余的DNA探针,然后用TBST缓冲液洗涤3次,再分散到1ml TBS缓冲液中,加入4μM PEG反应2h,形成封闭。最后以12000rpm离心15min,去除上清液中多余的PEG,然后用TBST缓冲液洗涤3次,再分散到1ml TBS缓冲液中进行下一步,表征结果如图6-8所示。
铂纳米粒子表面ssDNA的修饰通过盐老化法实现,具体包括以下子步骤:ssDNA在4nM TCEP溶液中处理1h后,将60uL的8uM的Pt-ssDNA加入到1ml的铂纳米粒子溶液中(含有0.1%吐温20和10mM的Tris溶液),室温搅拌12h,加入20uL的3MNaCl溶液5次,每次间隔1h。最后室温反应24h,加入4uM的PEG2000溶液反应2h,最后以12000转离心15min,去除上清液中多余的DNA探针和PEG,使用TBST缓冲液洗涤3次,最后分散在1mL的TBS缓冲液中,表征结果如图9-11所示。
(3)进行孵育、检测;
将50nM的Cas12a蛋白和三种150nM的crRNA分别在不同的PCR管中37℃孵育30min。分别在上述三种EP管中加入1uM的linker底物,包括Linker
将三个空间独立的CRISPR反应产物混合在一起,和40ug的DTN功能化商用磁珠在37℃孵育30min,三次磁分离去除上清液,待用。然后在获得的产物中加入三种DNA探针功能化的金、银、铂纳米粒子,在37℃孵育30min。将孵育后获得的产物三次磁分离去除上清液,使用200uL王水消解,并添加8mL纯水稀释,使用ICP-MS对产物进行测试,得到
从图12-图15可以看出,标准曲线分别为:
y=0.1342lgC+0.2319 (R
y=0.1557lgC+0.2113 (R
y=0.1692lgC+0.1898(R
对于ssDNA修饰的磁珠:
y=0.1205lgC+0.1383(R
根据式(1)-式(4),采用3倍SD值除以斜率的方法进行计算,所述SD是10个空白样品的标准偏差值,计算得到的最低检测限分别为53fM、79fM、85fM和837fM。由此可以看出,本发明可实现50~100fM的HPV-DNA检测灵敏度,并且基于DTN结构磁珠的检测方案较常规ssDNAc磁珠获得的检测线更低,信号效果更强。
需要说明的是,除了上述实施例对HPV-16、HPV-18、HPV-52这三种HPV分型进行检测外,本发明还成功的对其他多种HPV分型进行了多重检测,例如对HPV-58、HPV-56、HPV-39进行三重检测,对HPV-16和HPV-18进行二重检测,对HPV-6、HPV-11、HPV-16、HPV-18进行四重检测等等。
综上所述,本发明能够实现基于CRISPR-Cas12a技术的多重HPV-DNA的高特异性和高灵敏度的免扩增检测。与现有技术相比,本发明具有显著的进步。
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,当可利用上述揭示的技术内容作出些许更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
- 一种基于元素标记-电感耦合等离子体质谱检测策略的cfDNA分析方法及其应用
- 基于稀硝酸浸提的电感耦合等离子体质谱检测家畜中痕量元素的方法
