利用多孔纳米材料进行核酸提取和纯化的方法和试剂
文献发布时间:2024-04-18 19:58:21
技术领域
本发明涉及一种利用多孔材料中的纳米孔从生物样本中提取核酸的方法。
相关申请的交叉引用
本申请要求2022年5月27日提交的中国专利申请号202210593931.1的优先权,其专利申请的内容以全文引用的方式并入本文中。
技术背景
液体活检在医疗诊断和疾病筛查中常被认为是无创的检测方法。在常规体检中心,血液检查是一种常规的检查方式。在很多体液中(包括血液中),细胞外的微小RNA(microRNA或miRNA)被发现是高度稳定,可定量的分子。miRNA由细胞内源产生的含发卡结构的转录本切割而来的非编码RNA,其长度一般在18至25个核苷酸。研究表明,miRNA主要通过与靶标mRNA的3’UTR通过完全使其在转录后降解,或不完全互补结合后使其在翻译水平降低来抑制蛋白合成,但是也有部分miRNA能结合到5’UTR或者编码区行使功能。
miRNA的功能不仅是发生在细胞内部,由内源性产生的miRNA进行调控。多个研究团队的研究中发现在血清和血浆中存在稳定的miRNA,是构成循环系统中的核酸的一部分。在血清、血浆、唾液、尿液等体液中均已发现循环miRNA的存在,其主要来源有三种:一是破损的细胞或受损的组织被动释放;二是经外泌体主动分泌;三是不被外泌体包裹,二是与RNA结合蛋白结合后分泌。
目前的miRNA分离纯化技术目前主要是基于Trizol的酚氯仿抽提技术和柱分离技术。由于miRNA主要是以miRNA-蛋白复合体的形式稳定存在,所以提高miRNA提取效率的关键因素之一在于miRNA和蛋白分离。提高miRNA提取效率的第二点是,由于核酸的磷酸骨架带负电,使用外部或内部带有正电荷的材料可以有效的吸附并分离miRNA,或者使用高浓度离液盐屏蔽溶液中的静电磁力破坏含负电荷的材料和miRNA表面的水化层,促使材料和miRNA通过氢键和范德华力吸附。
自2000年以来,介孔二氧化硅纳米颗粒被广泛应用在药物载体的研究。由于介孔二氧化硅颗粒特殊的孔道结构具有较大的比表面积和较大的孔容积等特点。多孔材料的分支状态呈三维链状结构,大量不饱和残键和不同键合状态的羟基在其表面存在。目前使用的有纳米孔的无机非金属多孔材料(例如介孔二氧化硅和多孔二氧化钛等)和金属有机框架材料(例如沸石咪唑酯骨架材料ZIF-8)常见使用于药物装载后给药的使用,尚未在核酸提取中发挥作用。
发明内容
具体地,本发明通过如下各项技术方案解决现有技术中存在的技术问题。
项1.一个用于核酸提取的试剂盒,包含磁性多孔材料,所述磁性多孔材料包含含有四氧化三铁核心的介孔二氧化硅,且所述磁性多孔材料不含氨基化修饰,所述介孔二氧化硅的纳米孔的平均孔径为2~7纳米或1~3纳米。
项2.如项1所述的试剂盒,其特征在于,所述磁性多孔材料的平均颗粒粒径为100~600纳米。
项3.一种从样本中提取核酸的方法,其特征在于,使用如项1或2所述的试剂盒从样本中提取核酸,所述核酸包含微小RNA。
项4.一种从样本中提取核酸的方法,其特征在于,使用含纳米孔的多孔材料进行核酸的提取,包含:
(a)可选地,将所述多孔材料分散活化;优选地,所述分散活化包含加入弱极性溶剂A后通过超声振荡进行分散;
(b)可选地,将所述多孔材料制备保存液;
(c)将所述多孔材料和所述样本混合形成混合液后孵育;可选地,在所述混合液中还包含裂解结合液;
(d)可选地,向所述混合液中加入弱极性溶剂B,混合后除去溶液部分;
(e)可选地,向所述多孔材料加入所述裂解结合液和弱极性溶剂C,混合后除去溶液部分;
(f)可选地,向所述多孔材料一次或多次加入清洗液混合后除去溶液部分;
(g)向所述多孔材料加入洗脱液,孵育后分离,从而将所述核酸提取到洗脱液中。
项5.如项4所述的方法,其特征在于,所述多孔材料为实心有纳米孔的材料或有多级纳米孔的材料。
项6.如项4或5所述的方法,其特征在于,所述多孔材料包含多孔非金属单体材料,多孔非金属氧化物材料、多孔金属氧化物材料、金属有机框架材料(Metal-OrganicFrameworks,MOFs)、或内核为有磁性或无磁性的无机氧化物成分,外壳为有纳米孔的有核壳结构的复合材料。
项7.如项4-6任一项所述的方法,其特征在于,所述多孔材料包含非硅基介孔材料,非金属氧化物材料,金属氧化物材料,金属有机框架材料,或复合材料。
项8.如项4-7任一项所述的方法,其特征在于,所述多孔材料包含氮掺杂介孔碳(Mesoporous nitrogen doped carbon),介孔二氧化硅,介孔二氧化钛,ZIF-8,MOF-74。
项9.如项4-8任一项所述的方法,其特征在于,所述多孔材料包含介孔二氧化硅。
项10.如项9所述的方法,其特征在于,所述多孔材料包含四氧化三铁核心介孔二氧化硅。
项11.如项4-10任一项所述的方法,其特征在于,所述多孔材料无额外的氨基化修饰。
项12.如项4-11任一项所述的方法,其特征在于,所述多孔材料不含氨基化修饰。
项13.如项4-12任一项所述的方法,其特征在于,所述多孔材料含羟基修饰或无修饰。
项14.如项4-13任一项所述的方法,其特征在于,所述多孔材料无修饰。
项15.如项4-14任一项所述的方法,其特征在于,所述多孔材料的平均颗粒粒径为10~1,000纳米,10~800纳米,10~600纳米,10~400纳米,10~200纳米,200~400纳米,400~600纳米,300~700纳米,200~800纳米,或200~1000纳米。
项16.如项4-15任一项所述的方法,其特征在于,所述多孔材料的平均颗粒粒径为约500纳米,400~600纳米,或300~700纳米。
项16.1.如项4-16任一项所述的方法,其特征在于,所述多孔材料的平均颗粒粒径为100~600纳米。
项16.2.如项4-15任一项所述的方法,其特征在于,所述多孔材料的平均颗粒粒径为约200纳米,150~250纳米,或100~300纳米。
项16.3.如项4-16任一项所述的方法,其特征在于,所述多孔材料的平均颗粒粒径为200~400纳米。
项17.如项4-16.3任一项所述的方法,其特征在于,所述多孔材料材料的纳米孔的平均孔径为0.1~50纳米;优选地,平均孔径为0.1~20纳米;更优选地,平均孔径为1~10纳米;更优选地,平均孔径为2~7纳米或1~3纳米。
项18.如项4-17任一项所述的方法,其特征在于,所述多孔材料材料的纳米孔的平均孔径为2~7纳米。
项19.如项4-18任一项所述的方法,其特征在于,所述多孔材料材料的纳米孔的平均孔径为1~3纳米。
项20.如项4-19任一项所述的方法,其特征在于,所述多孔材料包裹于有磁性的微球上。
项21.如项20所述的方法,其特征在于,所述的有磁性的微球的材料包含四氧化三铁、三氧化二铁、氧化锰、和四氧化三锰中的一种或多种;优选地,包含四氧化三铁。
项22.如项4-21任一项所述的方法,其特征在于,所述核酸包含DNA和/或RNA。
项23.如项4-22任一项所述的方法,其特征在于,所述核酸包含微小RNA。
项24.如项4-23任一项所述的方法,其特征在于,所述核酸的长度小于200个核苷酸;优选地,小于100个核苷酸;更优选地,小于50个核苷酸;更优选地,小于30个核苷酸。
项25.如项4-24任一项所述的方法,其特征在于,所述核酸的长度为10-200个核苷酸;优选地,10-100个核苷酸;更优选地,10-50个核苷酸;更优选地,10-30个核苷酸;更优选地,15-30个核苷酸。
项26.如项4-25任一项所述的方法,其特征在于,所述样本为血清、血浆、唾液、尿液、生物组织、组织匀浆、或其混合物;优选地,所述样本为血清或血浆。
项27.如项4-26任一项所述的方法,其特征在于,包含(a)分散活化步骤;优选地,所述分散活化步骤包含向所述多孔材料加入所述弱极性溶剂A后通过超声振荡进行分散;优选地,所述弱极性溶剂A为甲醇、乙醇、异丙醇、丙酮、或其任一种混合溶液;更优选地,所述弱极性溶剂A为乙醇。
项28.如项4-27任一项所述的方法,其特征在于,在步骤(a)后去除溶液部分,向所述多孔材料加入盐溶液后通过超声振荡或涡旋振荡,获得所述多孔材料的所述保存液;优选地,所述的盐溶液的成分含量为:终浓度1~5摩尔每升的异硫氰酸胍、盐酸胍、或两者混合物,终浓度0%~20%(w/v)的分子量为200~8,000的聚乙二醇,所述的盐溶液的pH范围为3~8;更优选地,所述盐溶液的pH范围为5~7。
项29.如项4-28任一项所述的方法,其特征在于,在所述多孔材料和所述样本的所述混合液中还包含裂解结合液,所述的裂解结合液包含终浓度1~5摩尔每升的异硫氰酸胍、盐酸胍、或两者混合物;优选地,包含终浓度为2-4,2.5-3.5,或约3摩尔每升的异硫氰酸胍。
项30.如项29所述的方法,其特征在于,所述裂解结合液包含终浓度为约3摩尔每升的异硫氰酸胍。
项31.如项29或30所述的方法,其特征在于,所述的裂解结合液包含终浓度0.01~1.60摩尔每升,0.1~1.0摩尔每升,0.5~1.0摩尔每升,或0.01~0.60摩尔每升的氯化钠;优选地,0.2~0.5摩尔每升,0.3~0.7摩尔每升,或0.5~1.0摩尔每升的氯化钠。
项32.如项29-31任一项所述的方法,其特征在于,所述的裂解结合液包含终浓度0.1%~5.0%(w/v)的十二烷基硫酸钠;终浓度1%~10%(v/v)的吐温-20;终浓度0.01~0.10摩尔每升的柠檬酸钠或三羟甲基氨基甲烷;以及终浓度0.02~0.50摩尔每升的选自乙二胺四乙酸、乙二胺四乙酸二钠的一种或两种。
项33.如项4-32任一项所述的方法,其特征在于,所述裂解结合液与所述样本的比例为0.5:1.0(v/v)~3.0:1.0(v/v);更优选地,1.0:1.0(v/v)~2.2:1.0(v/v);更优选地,1.0:1.0(v/v)~1.8:1.0(v/v)。
项34.如项4-33任一项所述的方法,其特征在于,在所述多孔材料和所述样本的混合液中还包含蛋白酶K,优选地,所述蛋白酶K的终浓度为0.1-2.0mg/mL。
项35.如项4-34任一项所述的方法,其特征在于,所述多孔材料保存液与所述样本的比例为0.1:1.0(v/v)~2.0:1.0(v/v);优选地,0.20:1.00(v/v)~0.75:1.00(v/v)。
项36.如项4-35任一项所述的方法,其特征在于,所述多孔材料包含介孔二氧化硅,所述样本为血浆,且介孔二氧化硅与血浆的比例范围为2mg:1mL-60mg:1mL。
项37.如项4-36任一项所述的方法,其特征在于,步骤(c)的孵育温度为22~80℃,优选地50~65℃。
项38.如项4-37任一项所述的方法,其特征在于,步骤(c)的孵育时间为0~120分钟,0~90分钟,0~60分钟,0~50分钟,0~40分钟,0~30分钟,或0~20分钟;优选地,5~120分钟;更优选地,10~20分钟。
项39.如项4-38任一项所述的方法,其特征在于,包含步骤(d);优选地,所述弱极性溶剂B的终浓度为20%~80%(v/v),优选地,所述弱极性溶剂B为乙醇、异丙醇、或其混合溶液。
项40.如项4-39任一项所述的方法,其特征在于,包含步骤(e);优选地,所述弱极性溶剂C为乙醇、异丙醇、或其混合溶液;优选地,所述的裂解结合液和弱极性溶剂C的比例为0.3:1.0(v/v)~4:1(v/v),更优选地1:1(v/v)~2:1(v/v);优选地,去除溶液部分的方法为使用离心柱截留和/或使用磁性介质吸附多孔材料后去除溶液部分。
项41.如项4-40任一项所述的方法,其特征在于,包含步骤(f);优选地,所述清洗液为乙醇和无核酸酶水混合液,其中乙醇浓度为50%~80%;更优选地,60%~80%;优选地,使用所述清洗液清洗至少两次。
项42.如项4-41任一项所述的方法,其特征在于,所述步骤(g)的所述洗脱液包含10~100mM的三羟甲基氨基甲烷溶液(pH7.0~8.0)、10~100mM的三羟甲基氨基甲烷和10~100mM乙二胺四乙酸溶液(pH7.0~8.0)、无核酸酶水、0.05%~2.00%(v/v)焦碳酸二乙酯的水溶液、或其任意组合;优选地,孵育的时间为1~5分钟;优选地,所述分离方法为离心和/或使用磁性介质吸附多孔材料。
项43.一个用于核酸提取的试剂盒,包含含纳米孔的多孔材料。
项44.如项43所述的试剂盒,其特征在于,所述多孔材料为实心有纳米孔的材料或有多级纳米孔的材料。
项45.如项43或44所述的试剂盒,其特征在于,所述多孔材料包含多孔非金属单体材料,多孔非金属氧化物材料、多孔金属氧化物材料、金属有机框架材料(Metal-OrganicFrameworks,MOFs)、或内核为有磁性或无磁性的无机氧化物成分,外壳为有纳米孔的有核壳结构的复合材料。
项46.如项43-45任一项所述的试剂盒,其特征在于,所述多孔材料包含非硅基介孔材料,非金属氧化物材料,金属氧化物材料,金属有机框架材料,或复合材料。
项47.如项43-46任一项所述的试剂盒,其特征在于,所述多孔材料包含氮掺杂介孔碳(Mesoporous nitrogen doped carbon),介孔二氧化硅,介孔二氧化钛,ZIF-8,MOF-74。
项48.如项43-47任一项所述的试剂盒,其特征在于,所述多孔材料包含介孔二氧化硅。
项49.如项48所述的试剂盒,其特征在于,所述多孔材料包含四氧化三铁核心介孔二氧化硅。
项50.如项43-49任一项所述的试剂盒,其特征在于,所述多孔材料无额外的氨基化修饰。
项51.如项43-50任一项所述的试剂盒,其特征在于,所述多孔材料不含氨基化修饰。
项52.如项43-51任一项所述的试剂盒,其特征在于,所述多孔材料含羟基修饰或无修饰。
项53.如项43-52任一项所述的试剂盒,其特征在于,所述多孔材料无修饰。
项54.如项43-53任一项所述的试剂盒,其特征在于,所述多孔材料的平均颗粒粒径为10~1,000纳米,10~800纳米,10~600纳米,10~400纳米,10~200纳米,200~400纳米,400~600纳米,300~700纳米,200~800纳米,或200~1000纳米。
项55.如项43-54任一项所述的试剂盒,其特征在于,所述多孔材料的平均颗粒粒径为约500纳米,400~600纳米,或300~700纳米。
项55.1.如项43-55任一项所述的试剂盒,其特征在于,所述多孔材料的平均颗粒粒径为100~600纳米。
项55.2.如项43-54任一项所述的试剂盒,其特征在于,所述多孔材料的平均颗粒粒径为约200纳米,150~250纳米,或100~300纳米。
项55.3.如项43-55任一项所述的试剂盒,其特征在于,所述多孔材料的平均颗粒粒径为200~400纳米。
项56.如项43-55.3任一项所述的试剂盒,其特征在于,所述多孔材料材料的纳米孔的平均孔径为0.1~50纳米;优选地,平均孔径为0.1~20纳米;更优选地,平均孔径为1~10纳米;更优选地,平均孔径为2~7纳米或1~3纳米。
项57.如项43-56任一项所述的试剂盒,其特征在于,所述多孔材料材料的纳米孔的平均孔径为2~7纳米。
项58.如项43-57任一项所述的试剂盒,其特征在于,所述多孔材料材料的纳米孔的平均孔径为1~3纳米。
项59.如项43-58任一项所述的试剂盒,其特征在于,所述多孔材料包裹于有磁性的微球上。
项60.如项59所述的试剂盒,其特征在于,所述的有磁性的微球的材料包含四氧化三铁、三氧化二铁、氧化锰、和四氧化三锰中的一种或多种;优选地,包含四氧化三铁。
项61.如项43-60任一项所述的试剂盒,其特征在于,所述核酸包含DNA和/或RNA。
项62.如项43-61任一项所述的试剂盒,其特征在于,所述核酸包含微小RNA。
项63.如项43-62任一项所述的试剂盒,其特征在于,所述核酸的长度小于200个核苷酸;优选地,小于100个核苷酸;更优选地,小于50个核苷酸;更优选地,小于30个核苷酸。
项64.如项43-63任一项所述的试剂盒,其特征在于,所述核酸的长度为10-200个核苷酸;优选地,10-100个核苷酸;更优选地,10-50个核苷酸;更优选地,10-30个核苷酸;更优选地,15-30个核苷酸。
项65.如项43-64任一项所述的试剂盒,其特征在于,所述试剂盒针对的样本为血清、血浆、唾液、尿液、生物组织、组织匀浆、或其混合物;优选地,所述样本为血清或血浆。
项66.如项43-65任一项所述的试剂盒,其特征在于,包含弱极性溶剂A;优选地,所述弱极性溶剂A为甲醇、乙醇、异丙醇、丙酮、或其任一种混合溶液;更优选地,所述弱极性溶剂A为乙醇。
项67.如项43-66任一项所述的试剂盒,其特征在于,包含盐溶液;优选地,所述的盐溶液的成分含量为:终浓度1~5摩尔每升的异硫氰酸胍、盐酸胍、或两者混合物,终浓度0%~20%(w/v)的分子量为200~8,000的聚乙二醇,所述的盐溶液的pH范围为3~8;更优选地,所述盐溶液的pH范围为5~7。
项68.如项43-67任一项所述的试剂盒,其特征在于,包含裂解结合液,所述的裂解结合液包含终浓度1~5摩尔每升的异硫氰酸胍、盐酸胍、或两者混合物;优选地,包含终浓度为2-4,2.5-3.5,或约3摩尔每升的异硫氰酸胍。
项69.如项68所述的试剂盒,其特征在于,所述裂解结合液包含终浓度为约3摩尔每升的异硫氰酸胍。
项70.如项68或69所述的试剂盒,其特征在于,所述的裂解结合液包含终浓度0.01~1.60摩尔每升,0.1~1.0摩尔每升,0.5~1.0摩尔每升,或0.01~0.60摩尔每升的氯化钠;优选地,0.2~0.5摩尔每升,0.3~0.7摩尔每升,或0.5~1.0摩尔每升的氯化钠。
项71.如项68-70任一项所述的试剂盒,其特征在于,所述的裂解结合液包含终浓度0.1%~5.0%(w/v)的十二烷基硫酸钠;终浓度1%~10%(v/v)的吐温-20;终浓度0.01~0.10摩尔每升的柠檬酸钠或三羟甲基氨基甲烷;以及终浓度0.02~0.50摩尔每升的选自乙二胺四乙酸、乙二胺四乙酸二钠的一种或两种。
项72.如项43-71任一项所述的试剂盒,其特征在于,包含蛋白酶K。
项73.如项43-72任一项所述的试剂盒,其特征在于,包含弱极性溶剂B;优选地,所述弱极性溶剂B为乙醇、异丙醇、或其混合溶液。
项74.如项43-73任一项所述的试剂盒,其特征在于,包含弱极性溶剂C;优选地,所述弱极性溶剂C为乙醇、异丙醇、或其混合溶液。
项75.如项43-74任一项所述的试剂盒,其特征在于,包含清洗液;优选地,所述清洗液为乙醇和无核酸酶水混合液,其中乙醇浓度为50%~80%;更优选地,60%~80%。
项76.如项43-75任一项所述的试剂盒,其特征在于,包含洗脱液;优选地,所述洗脱液包含10~100mM的三羟甲基氨基甲烷溶液(pH7.0~8.0)、10~100mM的三羟甲基氨基甲烷和10~100mM乙二胺四乙酸溶液(pH7.0~8.0)、无核酸酶水、0.05%~2.00%(v/v)焦碳酸二乙酯的水溶液、或其任意组合。
附图说明
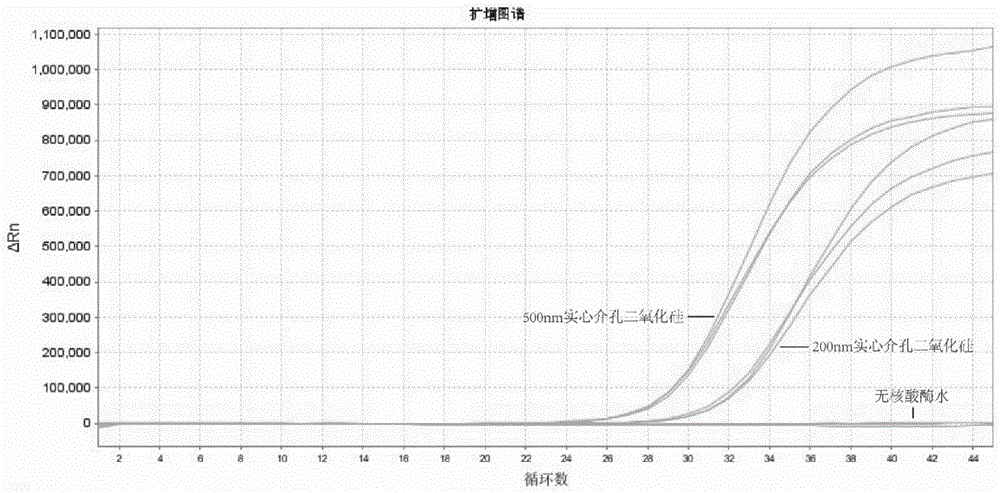
图1显示了使用10mg 200nm实心介孔二氧化硅和500nm实心介孔二氧化硅提取的血浆中的核酸作为hsa-miR-122的RT-qPCR时DNA扩增曲线。无核酸酶水作为空白对照。
图2显示了使用10mg四氧化三铁磁核心介孔二氧化硅提取的血浆中的核酸作为hsa-miR-122的RT-qPCR时DNA扩增曲线。商品化试剂盒使用Qiagen公司生产的miRNeasySerum/Plasma Advanced Kit(Cat.218204),提取流程按生产商的操作手册进行提取,洗脱体积为0.1mL。无核酸酶水作为空白对照。
图3显示了使用10mg四氧化三铁磁核心介孔二氧化硅提取0.5mL含有1.3×10
图4显示了使用10mg四氧化三铁磁核心介孔二氧化硅提取不同体积的血浆中的核酸作为hsa-miR-122的RT-qPCR时DNA扩增曲线。图中显示了0.1mL,0.2mL,0.5mL血浆5次重复提取的核酸的扩增曲线,其中0.1mL和0.2mL的血浆在提取前使用无菌的PBS缓冲液添加至0.5mL。
图5显示了在裂解结合液中异硫氰酸胍浓度对提取效率的影响。显示的是使用10mg四氧化三铁磁核心介孔二氧化硅提取血浆中的核酸作为hsa-miR-122的RT-qPCR时DNA扩增曲线。其中,裂解结合液中的异硫氰酸胍浓度为3M的时候提取效率最高。
图6显示了在裂解结合液中氯化钠浓度对提取效率的影响。显示的是使用10mg四氧化三铁磁核心介孔二氧化硅提取血浆中的核酸作为hsa-miR-122的RT-qPCR时DNA扩增曲线。其中,裂解结合液中的氯化钠浓度为0.5M或1M的时候提取效率高。
图7显示了四氧化三铁磁核心介孔二氧化硅不同的修饰对提取效率的影响。显示的是使用10mg经氨基化修饰(M-MSN-NH2)或羟基修饰(M-MSN-OH)或无修饰(M-MSN)的四氧化三铁磁核心介孔二氧化硅提取血浆中的核酸作为hsa-miR-122的RT-qPCR时DNA扩增曲线。结果显示氨基化修饰的四氧化三铁磁核心介孔二氧化硅的提取效率远远低于无修饰或羟基修饰的四氧化三铁磁核心介孔二氧化硅。同时,有无羟基修饰对提取效率没有显著的差异,说明吸附核酸的核心是材料的纳米孔。
图8显示了含有纳米孔和和不含有纳米孔的二氧化硅材料对miRNA提取效率的差异。结果显示,含有纳米孔的二氧化硅(介孔二氧化硅微球)对于miRNA的提取效率明显优于无纳米孔的二氧化硅材料(二氧化硅微球)。结果说明材料在提取小核糖核酸时的有效结构是材料中的纳米孔。
图9显示了使用非介孔二氧化硅的有纳米孔的多孔材料提取核酸的效率。其中MOF-74由Mg
图10显示了使用介孔二氧化硅微球和氮掺杂介孔碳(Mesoporous nitrogendoped carbon)材料提取生物样本中的小核糖核酸的效率。其中氮掺杂介孔碳的平均粒径为1μM,平均孔径为4.83nm。
发明详述
本发明提供了一种可以利用多孔材料中的纳米孔从生物样本中分离纯化核酸分子的方法及相应的试剂。在一些实施例中,此方法可以使用有纳米孔的材料包裹的磁性微球应用于全自动核酸提取工作站提高核酸提取效率,具有很高的商业应用价值。
在本发明的一个方面,提供了一种从样本中提取核酸的方法,其特征在于,使用含纳米孔的多孔材料进行核酸的提取,包含:
(a)可选地,将所述多孔材料分散活化;优选地,所述分散活化包含加入弱极性溶剂A后通过超声振荡进行分散;
(b)可选地,将所述多孔材料制备保存液;
(c)将所述多孔材料和所述样本混合形成混合液后孵育;可选地,在所述混合液中还包含裂解结合液;
(d)可选地,向所述混合液中加入弱极性溶剂B,混合后除去溶液部分;
(e)可选地,向所述多孔材料加入所述裂解结合液和弱极性溶剂C,混合后除去溶液部分;
(f)可选地,向所述多孔材料一次或多次加入清洗液混合后除去溶液部分;
(g)向所述多孔材料加入洗脱液,孵育后分离,从而将所述核酸提取到洗脱液中。
在本发明的另一个方面,提供了用于核酸提取的试剂盒,包含含纳米孔的多孔材料。
在本发明的另一个方面,提供了含纳米孔的多孔材料在核酸提取中的应用。
在一些实施例中,多孔材料为实心有纳米孔的材料或有多级纳米孔的材料。
在一些实施例中,多孔材料包含多孔非金属单体材料,多孔非金属氧化物材料、多孔金属氧化物材料、金属有机框架材料(Metal-Organic Frameworks,MOFs)。在一些实施例中,多孔材料包含内核为无机氧化物成分,外壳为有纳米孔的有核壳结构的复合材料。在一些实施例中,内核为有磁性的无机氧化物成分。在一些实施例中,内核为无磁性的无机氧化物成分。
在一些实施例中,多孔材料为非硅基介孔材料。在一些实施例中,非硅基介孔材料为氮掺杂介孔碳(Mesoporous nitrogen doped carbon)。
在一些实施例中,多孔材料为非金属氧化物材料。在一些实施例中,非金属氧化物材料为介孔二氧化硅。
在一些实施例中,多孔材料为金属氧化物材料。在一些实施例中,金属氧化物材料为介孔二氧化钛。在一些实施例中,介孔二氧化钛的粒径为1-100nm,2-80nm,3-70nm,4-60nm,5-60nm,6-50nm,7-50nm,8-40nm,9-35nm,或10-30nm。在一些实施例中,介孔二氧化钛的粒径为10-30nm。
在一些实施例中,多孔材料为金属有机框架材料。在一些实施例中,金属有机框架材料为沸石咪唑酯骨架材料(ZIF-8)和/或MOF-74。
在一些实施例中,金属有机框架材料为沸石咪唑酯骨架材料(ZIF-8)。在一些实施例中,ZIF-8包含Zn
在一些实施例中,金属有机框架材料为MOF-74。在一些实施例中,MOF-74由Mg
在一些实施例中,金属有机框架材料为MIL-101(Cr)。在一些实施例中,MIL-101(Cr)包含Cr
在一些实施例中,多孔材料的内核为有磁性的微球。在一些实施例中,有磁性的微球的材料包含四氧化三铁、三氧化二铁、氧化锰、和四氧化三锰中的一种或多种.。在一些实施例中,有磁性的微球的材料包含四氧化三铁。
在一些实施例中,该复合多孔材料包含介孔二氧化硅外壳。
在一些实施例中,多孔材料无额外的氨基化修饰。在一些实施例中,多孔材料不含氨基化修饰。
在一些实施例中,多孔材料含羟基修饰。在一些实施例中,多孔材料不含羟基化修饰。
在一些实施例中,多孔材料不含羟基化修饰或氨基化修饰。在一些实施例中,多孔材料无修饰。
在一些实施例中,多孔材料的平均颗粒粒径为10~1,000纳米,10~800纳米,10~600纳米,10~400纳米,10~200纳米,200~400纳米,400~600纳米,200~800纳米,或200~1000纳米。在一些实施例中,多孔材料的平均颗粒粒径为10~20纳米,20~30纳米,30~40纳米,40~50纳米,50~70纳米,70~100纳米,100~200纳米,200~300纳米,300~400纳米,400~500纳米,500~700纳米,700~1000纳米,10~30纳米,20~40纳米,30~50纳米,40~70纳米,50~100纳米,70~200纳米,100~300纳米,200~400纳米,300~500纳米,400~700纳米,500~1000纳米,10~40纳米,20~50纳米,30~70纳米,40~100纳米,50~200纳米,70~300纳米,100~400纳米,200~500纳米,300~700纳米,400~1000纳米,10~50纳米,20~70纳米,30~100纳米,40~200纳米,50~300纳米,70~400纳米,100~500纳米,200~700纳米,300~1000纳米,10~70纳米,20~100纳米,30~200纳米,40~300纳米,50~400纳米,70~500纳米,100~700纳米,200~1000纳米,10~100纳米,20~200纳米,30~300纳米,40~400纳米,50~500纳米,70~700纳米,100~1000纳米,10~200纳米,20~300纳米,30~400纳米,40~500纳米,50~700纳米,70~1000纳米,10~300纳米,20~400纳米,30~500纳米,40~700纳米,50~1000纳米,10~400纳米,20~500纳米,30~700纳米,40~1000纳米,10~500纳米,20~700纳米,30~1000纳米,10~700纳米,20~1000纳米,或10~1000纳米。在一些实施例中,多孔材料的平均颗粒粒径为大约10纳米,20纳米,30纳米,40纳米,50纳米,70纳米,100纳米,200纳米,300纳米,400纳米,500纳米,700纳米,或1000纳米。
在一些实施例中,多孔材料的平均颗粒粒径为100~600纳米。在一些实施例中,多孔材料的平均颗粒粒径为100~300纳米。在一些实施例中,多孔材料的平均颗粒粒径为200~400纳米。在一些实施例中,多孔材料的平均颗粒粒径为300~500纳米。在一些实施例中,多孔材料的平均颗粒粒径为400~600纳米。
在一些实施例中,多孔材料的平均颗粒粒径为100~300纳米,150~250纳米,或约200纳米。
在一些实施例中,多孔材料的平均颗粒粒径为200~400纳米,250~350纳米,或约300纳米。
在一些实施例中,多孔材料的平均颗粒粒径为300~700纳米,400~600纳米,450~550纳米,或约500纳米。
多孔材料的平均颗粒粒径可通过粒径分析仪测量。
在一些实施例中,多孔材料材料的纳米孔的平均孔径为0.1~50纳米。在一些实施例中,多孔材料材料的纳米孔的平均孔径为0.1~0.2纳米,0.1~0.5纳米,0.1~1纳米,0.1~2纳米,0.1~3纳米,0.1~4纳米,0.1~5纳米,0.1~7纳米,0.1~10纳米,0.1~20纳米,0.1~30纳米,0.1~40纳米,0.1~50纳米,0.2~0.5纳米,0.2~1纳米,0.2~2纳米,0.2~3纳米,0.2~4纳米,0.2~5纳米,0.2~7纳米,0.2~10纳米,0.2~20纳米,0.2~30纳米,0.2~40纳米,0.2~50纳米,0.5~1纳米,0.5~2纳米,0.5~3纳米,0.5~4纳米,0.5~5纳米,0.5~7纳米,0.5~10纳米,0.5~20纳米,0.5~30纳米,0.5~40纳米,0.5~50纳米,1~2纳米,1~3纳米,1~4纳米,1~5纳米,1~7纳米,1~10纳米,1~20纳米,1~30纳米,1~40纳米,1~50纳米,2~3纳米,2~4纳米,2~5纳米,2~7纳米,2~10纳米,2~20纳米,2~30纳米,2~40纳米,2~50纳米,3~4纳米,3~5纳米,3~7纳米,3~10纳米,3~20纳米,3~30纳米,3~40纳米,3~50纳米,4~5纳米,4~7纳米,4~10纳米,4~20纳米,4~30纳米,4~40纳米,4~50纳米,5~7纳米,5~10纳米,5~20纳米,5~30纳米,5~40纳米,5~50纳米,7~10纳米,7~20纳米,7~30纳米,7~40纳米,7~50纳米,10~20纳米,10~30纳米,10~40纳米,10~50纳米,20~30纳米,20~40纳米,20~50纳米,30~40纳米,30~50纳米,或40~50纳米。在一些实施例中,纳米孔的平均孔径为0.1~20纳米。在一些实施例中,纳米孔的平均孔径为1~10纳米。在一些实施例中,纳米孔的平均孔径为2~7纳米。在一些实施例中,纳米孔的平均孔径为1~3纳米。
多孔材料的孔径可通过BET比表面积检测法测量。
在一些实施例中,所提取的核酸包含DNA。在一些实施例中,所提取的核酸包含RNA。在一些实施例中,所提取的核酸包含单链核酸。在一些实施例中,所提取的核酸包含双链核酸。在一些实施例中,所提取的核酸是细胞外核酸。在一些实施例中,所提取的核酸的长度小于200个核苷酸。在一些实施例中,所提取的核酸的长度小于100个核苷酸。在一些实施例中,所提取的核酸的长度小于50个核苷酸。在一些实施例中,所提取的核酸的长度小于30个核苷酸。
在一些实施例中,所提取的核酸包含微小RNA。微小RNA(microRNA)是一类小的内源性非编码RNA分子,大小为17-25个核苷酸。这些miRNA通常可以靶向一个或者多个mRNA,通过翻译水平的抑制或者断裂靶标mRNA来调节基因的表达。miRNA比mRNA在作为肿瘤标志物方面具有更大的优势,因为他们通常更为稳定。
miRNA是从pri-miRNA产生的,pri-miRNA被RNase III Drosha加工为含有茎环结构的前体miRNA,然后在Dicer的作用下,前体miRNA在细胞质中被进一步切割产生成熟的miRNA。microRNA在成熟过程中会产生iso-miRNAs(miRNA亚型),根据位置不同可以分为3’、5’和中间的突变类型三类。iso-miRNAs产生的机制大概有两种,一种是Drosha或者Dicer酶在microRNA成熟过程中切割位置偏移导致的;另一种是转录后修饰产生的。有研究表明iso-miRNAs在稳定性和表达丰度等与成熟microRNA都有不同,也会调控不同的下游信号途径。
在一些实施例中,所提取的核酸的长度为10~15个核苷酸,15~20个核苷酸,20~25个核苷酸,25~30个核苷酸,30~40个核苷酸,40~50个核苷酸,50~70个核苷酸,70~100个核苷酸,10~20个核苷酸,15~25个核苷酸,20~30个核苷酸,25~40个核苷酸,30~50个核苷酸,40~70个核苷酸,50~100个核苷酸,10~25个核苷酸,15~30个核苷酸,20~40个核苷酸,25~50个核苷酸,30~70个核苷酸,40~100个核苷酸,10~30个核苷酸,15~40个核苷酸,20~50个核苷酸,25~70个核苷酸,30~100个核苷酸,10~40个核苷酸,15~50个核苷酸,20~70个核苷酸,25~100个核苷酸,10~50个核苷酸,15~70个核苷酸,20~100个核苷酸,10~70个核苷酸,15~100个核苷酸,或10~100个核苷酸。在一些实施例中,所提取的核酸的长度为约10个核苷酸,15个核苷酸,20个核苷酸,25个核苷酸,30个核苷酸,40个核苷酸,50个核苷酸,70个核苷酸,或100个核苷酸。在一些实施例中,所提取的核酸的长度为10~200个核苷酸。在一些实施例中,所提取的核酸的长度为10~100个核苷酸。在一些实施例中,所提取的核酸的长度为10~50个核苷酸。在一些实施例中,所提取的核酸的长度为10~25个核苷酸。在一些实施例中,所提取的核酸的长度为10~30个核苷酸。在一些实施例中,所提取的核酸的长度为15~30个核苷酸。
在一些实施例中,样本为血清、血浆、唾液、尿液、生物组织、组织匀浆、或其混合物。在一些实施例中,样本为血清或血浆。
在一些实施例中,所述的方法包含(a)分散活化步骤。在一些实施例中,分散活化步骤包含向所述多孔材料加入所述弱极性溶剂A后通过超声振荡进行分散。在一些实施例中,所述的试剂盒包含弱极性溶剂A。在一些实施例中,弱极性溶剂A为甲醇、乙醇、异丙醇、丙酮、或其任一种混合溶液。在一些实施例中,弱极性溶剂A为乙醇。
在一些实施例中,所述的方法包含在步骤(a)后去除溶液部分,向所述多孔材料加入盐溶液后通过超声振荡或涡旋振荡,获得所述多孔材料的所述保存液。在一些实施例中,所述的试剂盒包含盐溶液。在一些实施例中,盐溶液的成分含量为:终浓度1~5摩尔每升的异硫氰酸胍、盐酸胍、或两者混合物,终浓度0%~20%(w/v)的分子量为200~8,000的聚乙二醇。在一些实施例中,所述的盐溶液的pH范围为3~8。在一些实施例中,所述盐溶液的pH范围为5~7。
在一些实施例中,在多孔材料和样本的混合液中还包含裂解结合液。在一些实施例中,所述的试剂盒包含裂解液。在一些实施例中,裂解结合液包含终浓度1~5摩尔每升的异硫氰酸胍、盐酸胍、或两者混合物。在一些实施例中,裂解结合液包含终浓度为2-4,2.5-3.5,或约3摩尔每升的异硫氰酸胍。在一些实施例中,裂解结合液包含终浓度为约3摩尔每升的异硫氰酸胍。在一些实施例中,裂解结合液包含终浓度0.01~1.60摩尔每升,0.1~1.0摩尔每升,0.5~1.0摩尔每升,或0.01~0.60摩尔每升的氯化钠。在一些实施例中,裂解结合液包含0.2~0.5摩尔每升的氯化钠。在一些实施例中,裂解结合液包含0.3~0.7摩尔每升的氯化钠。在一些实施例中,裂解结合液包含0.5~1.0摩尔每升的氯化钠。在一些实施例中,裂解结合液包含终浓度0.1%~5.0%(w/v)的十二烷基硫酸钠;终浓度1%~10%(v/v)的吐温-20;终浓度0.01~0.10摩尔每升的柠檬酸钠或三羟甲基氨基甲烷;以及终浓度0.02~0.50摩尔每升的选自乙二胺四乙酸、乙二胺四乙酸二钠的一种或两种。
在一些实施例中,裂解结合液与所述样本的比例为0.5:1.0(v/v)~3.0:1.0(v/v)。在一些实施例中,裂解结合液与所述样本的比例为1.0:1.0(v/v)~2.2:1.0(v/v)。在一些实施例中,裂解结合液与所述样本的比例为1.0:1.0(v/v)~1.8:1.0(v/v)。
在一些实施例中,所述的方法还包含使样本中的miRNA与其相应的蛋白分离。在一些实施例中,所述的试剂盒还包含使样本中的miRNA从miRNA-蛋白复合体中分离的试剂。在一些实施例中,分离的方法/试剂包含蛋白酶的使用。在一些实施例中,所述的蛋白酶包含蛋白酶K。
在一些实施例中,在多孔材料和样本的混合液中还包含蛋白酶K。在一些实施例中,所述的试剂盒包含蛋白酶K。在一些实施例中,蛋白酶K的终浓度为0.1-2.0mg/mL。在一些实施例中,蛋白酶K的终浓度为0.1-1.0mg/mL。
在一些实施例中,多孔材料保存液与样本的比例为0.1:1.0(v/v)~2.0:1.0(v/v)。在一些实施例中,多孔材料保存液与样本的比例为0.20:1.00(v/v)~0.75:1.00(v/v)。
在一些实施例中,多孔材料包含介孔二氧化硅,样本为血浆,且介孔二氧化硅与血浆的比例范围为2mg:1mL-60mg:1mL。
在一些实施例中,所述的方法步骤(c)的孵育温度为22~80℃。在一些实施例中,所述的方法步骤(c)的孵育温度为50~65℃。
在一些实施例中,步骤(c)的孵育时间为0~120分钟,0~90分钟,0~60分钟,0~50分钟,0~40分钟,0~30分钟,或0~20分钟。在一些实施例中,步骤(c)的孵育时间为5~120分钟。在一些实施例中,步骤(c)的孵育时间为10~20分钟。
在一些实施例中,所述的方法包含步骤(d)。在一些实施例中,所述的试剂盒包含弱极性溶剂B。在一些实施例中,弱极性溶剂B的终浓度为20%~80%(v/v)。在一些实施例中,弱极性溶剂B为乙醇、异丙醇、或其混合溶液。
在一些实施例中,所述的方法包含步骤(e)。在一些实施例中,所述的试剂盒包含弱极性溶剂C。在一些实施例中,弱极性溶剂C为乙醇、异丙醇、或其混合溶液。在一些实施例中,裂解结合液和弱极性溶剂C的比例为0.3:1.0(v/v)~4:1(v/v)。在一些实施例中,裂解结合液和弱极性溶剂C的比例为1:1(v/v)~2:1(v/v)。在一些实施例中,去除溶液部分的方法包含使用离心柱截留和/或使用磁性介质吸附多孔材料后去除溶液部分。在一些实施例中,去除溶液部分的方法包含使用离心柱截留去除溶液部分。在一些实施例中,去除溶液部分的方法包含使用磁性介质吸附多孔材料后去除溶液部分。
在一些实施例中,所述的方法包含步骤(f)。在一些实施例中,所述的试剂盒包含清洗液。在一些实施例中,清洗液为乙醇和无核酸酶水混合液,其中乙醇浓度为50%~80%。在一些实施例中,乙醇浓度为60%~80%。在一些实施例中,所述方法使用所述清洗液清洗至少两次。
在一些实施例中,所述的方法包含步骤(g)。在一些实施例中,所述的试剂盒包含洗脱液。在一些实施例中,洗脱液包含10~100mM的三羟甲基氨基甲烷溶液(pH7.0~8.0)、10~100mM的三羟甲基氨基甲烷和10~100mM乙二胺四乙酸溶液(pH7.0~8.0)、无核酸酶水、0.05%~2.00%(v/v)焦碳酸二乙酯的水溶液、或其任意组合。在一些实施例中,洗脱液的孵育时间为1~5分钟。在一些实施例中,洗脱液的分离方法为离心和/或使用磁性介质吸附多孔材料。在一些实施例中,洗脱液的分离方法为离心。在一些实施例中,洗脱液的分离方法为使用磁性介质吸附多孔材料。
在一些实施例中,本发明采用以下技术方案:
一种利用多孔材料中的纳米孔从生物样本中提取核酸的方法,具体包括以下步骤:
(a)称取100~500mg有纳米孔的多孔材料颗粒于离心管中,加入0.1~15.0mL的弱极性溶剂,通过50~150W的超声振荡处理使材料在弱极性溶剂中均匀分散;所采用的的有纳米孔的纳米颗粒的颗粒粒径大小不限,优选的粒径为10~1000纳米;多孔材料的纳米孔径为0.1~50纳米,优选孔径为0.1~20纳米;所述的有纳米孔的多孔材料优选实心有纳米孔的材料、有多级纳米孔的材料,包含但不限于多孔非金属氧化物材料、多孔金属氧化物材料、金属有机框架材料、或内核为有磁性或无磁性的无机氧化物成分,外壳为有纳米孔的有核壳结构的复合材料;所述的多孔材料类型包括但不限于非金属单体,金属和非金属氧化物,金属有机框架材料以及相关的复合材料。如:氮掺杂介孔碳(Mesoporous nitrogendoped carben)等非硅基介孔材料,介孔二氧化硅等非金属氧化物,微孔二氧化钛等金属氧化物,ZIF-8和MOF-74等金属有机框架材料,四氧化三铁核心介孔二氧化硅等复合材料;所述的弱极性溶剂包括但不限于甲醇、乙醇、异丙醇和丙酮的一种或多种,优选溶剂为乙醇;所述的有磁性的无机氧化物成分包括但不限于四氧化三铁、三氧化二铁、氧化锰、和四氧化三锰中的一种或多种,优选四氧化三铁;
(b)将步骤(a)所得的混合液离心(2,000~20,000RCF)后弃去上清,加入0.1~10mL的盐溶液后通过超声振荡(50-150W)或涡旋振荡使得混合溶液分散后备用,获得保存液;所述的盐溶液的成分含量为:终浓度1~5摩尔每升的异硫氰酸胍、盐酸胍的一种或两种;终浓度0%~20%(w/v)的分子量为200~8,000的聚乙二醇;所述的盐溶液的pH范围为3~7,优选5~7;
(c)向生物样本中加入裂解结合液、蛋白酶K溶液、和步骤(b)制备的保存液,涡旋振荡混匀后在一定温度下静置一段时间;所述的生物样本可以是生物体液、生物组织、组织匀浆的一种或混合;所加入的蛋白酶K终浓度为0.1-1.0mg/mL;所加入的裂解结合液与生物样本的比例为0.5:1.0(v/v)~3.0:1.0(v/v),优选1.0:1.0(v/v)~1.8:1.0(v/v);所述的裂解结合液的成分含量为:终浓度1~5摩尔每升的异硫氰酸胍、盐酸胍的一种或两种;终浓度0.1~0.6摩尔每升的氯化钠;终浓度0.1%~5.0%(w/v)的十二烷基硫酸钠;终浓度1%~10%(v/v)的吐温-20;终浓度0.01~0.10摩尔每升的柠檬酸钠或三羟甲基氨基甲烷;终浓度0.01~0.50摩尔每升的乙二胺四乙酸、乙二胺四乙酸二钠的一种或两种;所加入的保存液与生物样本的比例为0.1:1.0(v/v)~2.0:1.0(v/v),优选0.20:1.00(v/v)~0.75:1.00(v/v);所述的温度为22~80℃,优选50~65℃;所述的静置时间为5~120分钟,优选10~20分钟;
(d)向步骤(c)的混合液加入终浓度20%~80%的弱极性溶剂,涡旋振荡混匀后分离多孔材料;所述的弱极性溶剂包括但不限于乙醇、异丙醇的一种或二种;所述的分离方法可以是2,000~20,000RCF离心1~5分钟后去除上清、和/或使用磁性介质吸附多孔材料后去除上清;
(e)向步骤(d)中的多孔材料加入适量步骤(c)中使用的裂解结合液和弱极性溶剂,通过涡旋振荡混匀、或超声振荡(50-150W)分散后加入无核酸酶的离心柱,离心1-3分钟,直至将所有多孔材料截留在离心柱的滤膜上、和/或使用磁性介质吸附多孔材料后去除上清;所述的弱极性溶剂包括但不限于乙醇、异丙醇的一种或二种;所述的裂解结合液和弱极性溶剂的比例为0.3:1.0(v/v)~4:1(v/v),优选1:1(v/v)~2:1(v/v);
(f)使用清洗液清洗多孔材料两次,每次清洗使用离心或磁力分离多孔材料后去除清洗液;所述的清洗液为乙醇和无核酸酶水混合液,其中乙醇浓度为50%~80%,优选60%~80%;
(g)向步骤(f)中的多孔材料中加入适量洗脱液,孵育一段时间后将含有miRNA的提取物与多孔材料分离;所述的洗脱液为10~100mM的三羟甲基氨基甲烷溶液(pH7.0-8.0)、10~100mM的三羟甲基氨基甲烷和10-100mM乙二胺四乙酸溶液(pH7.0-8.0)、无核酸酶水、或0.05%~2.00%(v/v)焦碳酸二乙酯的水溶液的一种或组合;所述的孵育时间为1~10分钟;所述的分离方法可以是离心、和/或使用磁性介质吸附多孔材料后获得提取产物;
应理解,在本发明范围内中,本发明的上述技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案,在此不再一一累述。
本发明的优势包括但不限于:
-本发明的方法和试剂通过将核酸诱导进入多孔材料的纳米孔道,使得在分离和清洗条件下结合的核酸不易从纳米孔道中脱离;
-所述多孔材料可以通过增加具有顺磁性的核心应用于全自动核酸提取工作站提高核酸提取效率;
-对核酸(例如微小RNA等短链核酸)具有很高的提取效率;
-操作周期短;
-材料稳定性高;
-试剂对环境和人体相对安全。
定义
除另有定义外,本文使用的所有技术和科学术语具有与本公开所属领域的普通技术人员通常所理解的含义相同的含义。虽然在实施或测试本文的制剂或单位剂量时可以使用与本文所述的方法和材料类似或等同的任何方法和材料,但现在要对一些方法和材料进行描述。除另有说明外,本文所采用或考虑的技术是标准方法。所述材料、方法和实例仅是说明性而非限制性的。
除非另外定义,在此使用的所有技术和科学术语具有与所属领域普通技术人员通常理解的相同的含义。在此描述的实施方式可以包括一个或多个数值范围(例如,大小、浓度、时间、温度)。除非上下文另外明确指明,数值的范围将被理解为包含该范围内的所有数值,包括所述范围内的数值的子集(一个或多个),直至下限单位的十分之一。
如本文所用,冠词“一个”、“一种”和“所述”同等地涉及单数或复数的含义,除非上下文另有规定。
当术语“包含”被用于本发明说明书或权利要求书中时,除非上下文要求,其应理解为意在指包括陈述的步骤或元件或实体或者陈述的步骤组合或元件组合或实体组合,但不排除任何其它的步骤或元件或实体或步骤组或元件组或实体组。为了实现本发明的目的,术语“由……组成”被认为是术语“包含”的优选实施方案。术语“包含”(及相关术语如“包含”或“具有”或“包括”;“comprising”)并不旨在排除在其它某些实施方案(例如本文所述的任何物质组成、组合物、方法或过程等的实施方案)中可“由所描述的特征组成”(“consisting of”)或“基本上由所描述的特征组成”(“consisting essentially of”)。
如本文所用,除另指出外,术语“或”可以是连接词或反意连接词。如本文所用,除另指出外,任何实施方案可与任何其它实施方案组合。
如本申请中使用的,术语“约”和“大约”用作等同物。本申请中使用的有或无约/大约的任何数值意指涵盖相关领域普通技术人员所了解的任何正常波动。在一些实施例中,术语“大约”或“约”是指在陈述的参考值的任一方向(大于或小于)的10%的范围,除非另外陈述或另外从上下文明显可见(除了这种数字将会超过可能值的100%的情况)。
如本文所用,除另指出外,术语“核酸”和“多核苷酸”可互换使用。
具体实施方式
以下结合附图和具体实施例对本发明作具体的介绍。给出的实施例仅为了阐明本发明,不代表对本发明保护范围的限制,其他人根据本发明理念所作出的一些非本质的修改和调整仍属于本发明的保护范围。除非另有说明,本申请中使用的技术术语具有本发明所属领域技术人员通常理解的含义。
本发明实施例中的实验方法,如无特殊说明,均按照本领域内文献中描述的方法或仪器、试剂对应的产品说明书进行。本发明实施例中所用的试剂、耗材及仪器,如无特殊说明,均通过常规商业途径购得。
术语解释:
如本文所用,“v/v”表示体积比例;“w/v”表示质量体积比例;RCF表示离心力g。miRNA指微小核苷酸。△Rn表示相对荧光值。
以下实施例中的血浆来源于样本1与样本2,样本1(年龄30岁)与样本2(年龄33岁)均为健康成年志愿者,无病史。细胞系为HepG2,经PBS稀释后进行提取。
血浆制备方法:各抽取样本1与样本2的静脉血50mL,1900RCF,4℃离心10分钟,取得混合上清约40mL。将上清进一步3000RCF,4℃离心10分钟,取得上清约36mL。
实施例1:
一种使用实心介孔二氧化硅从血浆中提取核酸的方法,包括如下步骤:
1.称取150mg实心介孔二氧化硅纳米颗粒(200nm粒径/500nm粒径,2~7nm孔径),加入5mL无水乙醇,使用100W超声3分钟至完全分散后涡旋振荡混匀。
2.将混合液体2810RCF离心5分钟,弃去上清。
3.加入5mL 4M的异硫氰酸胍溶液后超声(100W)3分钟至完全分散。
4.将混合液体2810RCF离心5分钟,弃去上清。
5.加入4.5mL 4M的异硫氰酸胍溶液后超声(100W)3分钟至完全分散。
6.加入0.5mL经高压灭菌的50% PEG8000(w/v),涡旋振荡混匀,此时保存液制备完成。
7.使用前,保存液在60℃加热10分钟。
8.在5mL无核酸酶的离心管中,向0.5mL血浆中加入1.0mL裂解结合液(3M异硫氰酸胍,0.5M氯化钠,1%十二烷基硫酸钠,5%吐温-20,25mM柠檬酸钠,10mM乙二胺四乙酸)振荡混匀,加入0.1mL蛋白酶K(20mg/mL)后再次振荡混匀,60℃孵育10分钟。
9.向管内加入0.1mL保存液,振荡混匀后60℃孵育10分钟。
10.加入2.3mL无水乙醇,振荡混匀。
11.在3000RCF离心3分钟后弃去上清,加入0.4mL裂解结合液振荡混匀并60℃孵育10分钟。
12.加入0.6mL无水乙醇后振荡混匀。
13.将混合物转至有盖的无核酸酶离心柱内并10,000RCF离心2分钟后弃去滤液。
14.重复步骤13至全部液体滤过。
15.向离心柱中加入80%的乙醇0.5mL,10,000RCF离心2分钟后弃去滤液。
16.重复步骤15。
17.将离心柱转至新的收集管中,10,000RCF离心3分钟。
18.将离心柱转移至新的无核酸酶的1.5mL离心管中,开盖干燥2分钟。
19.向离心柱内加入30μL无核酸酶水后静置5分钟。
20.常温10,000RCF离心2分钟后将滤液重新加入离心柱中。
21.常温离心13,000RCF离心3分钟后得到提取产物。
实施例2:
一种使用四氧化三铁核心介孔二氧化硅外壳的纳米颗粒从血浆中提取核酸的方法,包括如下步骤:
1.称取200mg四氧化三铁核心介孔二氧化硅纳米颗粒(150-200nm粒径,2~7nm孔径),加入5mL无水乙醇,使用100W超声3分钟至完全分散后涡旋振荡混匀。
2.将混合液体2810RCF离心5分钟,弃去上清。
3.加入5mL 4M的异硫氰酸胍溶液后振荡至完全分散。
4.将混合液体2810RCF离心5分钟,弃去上清。
5.加入1.8mL 4M的异硫氰酸胍溶液后振荡至完全分散。
6.加入0.2mL经高压灭菌的50%PEG8000(w/v),涡旋振荡混匀,此时保存液制备完成。
7.使用前,保存液在60℃加热10分钟。
8.在5mL无核酸酶的离心管中,向0.5mL血浆中加入1.0mL裂解结合液(3M异硫氰酸胍,0.5M氯化钠,1%十二烷基硫酸钠,5%吐温-20,25mM柠檬酸钠,10mM乙二胺四乙酸)振荡混匀,加入0.1mL蛋白酶K(20mg/mL)后再次振荡混匀,60℃孵育10分钟。
9.向管内加入0.1mL保存液,振荡混匀后60℃孵育10分钟。
10.加入2.3mL无水乙醇,振荡混匀。
11.在磁力架上静置2~5分钟至澄清后弃去上清。
12.加入0.4mL裂解结合液后从磁力架上取下,振荡混匀并60℃孵育10分钟。
13.加入0.6mL无水乙醇后振荡混匀,将液体转至新的2mL离心管。
14.将2mL离心管置于磁力架上静置2~5分钟至澄清后弃去上清。
15.向离心管中加入80%的乙醇0.8mL,振荡混匀后瞬时离心,然后置于磁力架上静置2~5分钟至澄清后弃去上清。
16.重复步骤15。
17.在磁力架上开盖干燥2分钟。
18.向离心管内加入30μL无核酸酶水,振荡混匀后静置5分钟。
19.将离心管瞬时离心后置于磁力架上至澄清。
20.将上清转移至无核酸酶的离心管中即得到提取产物。
将实施例1(如图1所示)和实施例2(如图2和图3所示)所得的提取产物对hsa-miR-122进行逆转录后进行实时荧光定量PCR(qPCR)。如图4所示,不同体积的血浆使用PBS缓冲液补充到0.5mL后使用磁核心介孔二氧化硅进行血浆提取的检测结果。图5显示裂解结合液中使用3M的异硫氰酸胍的核酸提取效率最佳。图6显示使用含氯化钠的裂解结合液的提取效率更高。图7显示氨基修饰对降低核酸提取效率,羟基修饰对比没有修饰的磁核心介孔二氧化硅在提取效率上没有明显差异。图8显示含纳米孔和不含纳米孔的二氧化硅材料的提取效率,结果指出多孔材料中的纳米孔为提取小核糖核酸的关键结构。图9和图10显示,不同种有纳米孔的多孔材料使用实施例1中的提取方法,也能有效的提取血浆中的游离核酸。
所述的实施例和图例中,使用的逆转录试剂盒为miRNA 1st Strand cDNASynthesis Kit(by stem-loop),生产商为南京诺唯赞生物科技股份有限公司,货号:MR101-02;使用的qPCR试剂盒为Taq Pro HS Universal Probe Master Mix,生产商为南京诺唯赞生物科技股份有限公司,货号:QN113-01。
逆转录反应体系如下:
1.提取产物预处理
提取产物消化DNA反应体系如下
42℃反应2分钟后置于冰上。
2.逆转录反应体系如下
25℃反应5分钟后50℃反应15分钟,然后85℃变性5分钟。反应完成后置于冰上。
逆转录引物序列为
5’-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAAACCCCA-3’(SEQ ID NO:1)
3.qPCR反应体系如下
反应条件:95℃变性30秒;95℃10秒,60℃30秒,循环45次。
探针序列为5’FAM-TTCAGTTGAGAAACCCCA-3’MGB(SEQ ID NO:2)
上游引物序列:GCCGAGTGGAGTGTGACAA(SEQ ID NO:3)
下游引物序列:CTCAACTGGTGTCGTGGAGT(SEQ ID NO:4)
以上内容是结合具体的实施方式对本发明所做的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。在不脱离本发明构思的前提下,简单的替换有纳米孔的多孔材料、增加表面修饰、更换复合材料的内部核心、替换和加减提取试剂和成分应当也属于本发明的保护范围之内。
在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
尽管在本申请中已经将权利要求阐述为特征的特定组合,但应该理解的是,本公开的范围还包括本文明确或隐含地公开的任何新颖特征或任何新颖特征组合或其任何概括,无论它是否涉及与任何权利要求中目前要求保护的相同的发明,并且无论它是否减轻了与本发明相同的技术问题中的任何一个或全部问题。申请人在此提供通知,在本申请或由此衍生的任何进一步申请的审查期间,新的权利要求可以被制定为这样的特征和/或特征的组合。
本领域技术人员会理解,在不脱离本发明的全部范围和精神的情况下,可对本申请描述的部件、方法、步骤、结构、运动、配合进行修改(添加和/或去除),本发明的范围和精神涵盖这样的修改以及其任何和全部等同物。
- 基于磁珠法进行核酸提取的试剂盒及应用
- 一种利用纳米多孔材料治理土壤金属污染的方法
- 核酸提取纯化设备、试剂联、核酸提取纯化系统和方法
- 纯化核酸的方法、提取核酸的方法和用于纯化核酸的试剂盒
