缀合物及其制备方法和用途
文献发布时间:2024-04-18 19:58:26
相关申请的交叉引用
本申请要求2021年04月23日提交的中国专利申请202110442394.6的权益,该申请的内容通过引用被合并于本文。
本发明涉及生物技术领域,具体涉及一种缀合物及其制备方法和用途。
前列腺特异性膜抗原(PSMA)又称为叶酸水解酶1(FOLH1)、谷氨酸羧肽酶II(GCP II)、N-乙酰化-α-连接酸性二肽酶I(NAALAD1),它属于肽酶M28家族中的M28B亚家族。PSMA是一种结构为同型二聚体的II型跨膜蛋白,每个亚基能够结合2个锌离子。PSMA既具有叶酸水解酶又具有N-乙酰化-α-连接的酸性二肽酶(NAALADase)活性,其作用是调节N-酰基聚γ-谷氨酸及其衍生物的水解。相对于其他组织,PSMA在神经系统、前列腺、胰腺、肾脏和小肠中表达较高,并且在大多数前列腺癌的上皮层以及其他实体瘤的新生血管中表达量远高出正常组织的表达量。这种组织特异性使得PSMA成为前列腺癌递送最有吸引力的靶标之一。
由于PSMA在前列腺癌细胞中的高度富集,特异性识别PSMA的抗体、适体和小分子配体被竞相研究开发。其中,由于合成的简单性以及较高的蛋白结合亲和力,PSMA的小分子配体的研究一直备受关注。作为一种PSMA的小分子配体,赖氨酸和谷氨酸通过脲基连接而形成的二肽(KUE)已被成功地用于前列腺癌的成像及靶向治疗中。另外,RNA干扰(RNAi)是一种使用siRNA等治疗性寡核苷酸治疗包括癌症在内的各种疾病的新型技术。受到美国食品药品监督管理局(FDA)对Patisiran和Givosiran的批准的鼓舞,RNAi在治疗前列腺癌上也备受瞩目。而且,Givosiran的获批使得配体与siRNA的直接连接形成的缀合物成为靶向治疗肿瘤的一种简单、有效的新途径。但是,如何将治疗性siRNA有效地递送到前列腺癌组织/细胞中继而实现癌症的治疗仍然是一个巨大的挑战。此外,如何突破Givosiran所采用的固相合成法的局限(比如灵活性较差、操作繁琐、合成效率不理想、适用范围窄等)也是RNAi疗法急需解决的关键问题。
发明内容
本发明的目的是为了克服现有技术存在的制备核酸缀合物灵活性差、操作繁琐、生产规模小等技术问题,提供一种缀合物及其制备方法,该缀合物兼具靶向性高与活性高的双重特点。并且,本发明提供的方法具有快速、高效、简便、适用范围广的优势。此外,本发明还提供本发明制备的核酸缀合物在制备用于治疗前列腺癌、结肠癌、胰腺癌、乳腺癌、肾脏疾病和神经系统相关疾病中任意一种疾病的药物中的应用,特别是用于治疗前列腺癌的药物中的应用。
为了实现上述目的,本发明第一方面提供一种缀合物,该缀合物由叠氮修饰的靶向配体与炔丙基修饰的小核酸序列共价连接而成。
本发明第二方面提供一种制备前述缀合物的方法,该方法包括:在一价铜催化剂的存在下,使叠氮修饰的靶向配体与炔丙基修饰的小核酸序列进行接触。
本发明第三方面提供一种前述缀合物或前述方法制备的缀合物在制备用于治疗表达PSMA的组织出现异常导致的相关疾病的药物中的应用,所述疾病优选发生在腺体组织、结肠、肾脏和神经系统中;其中,所述腺体组织选自前列腺、胰腺、乳腺和胸腺中的一种。
本发明通过炔丙基修饰的寡核酸(特别是在3'-末端修饰)以及叠氮修饰的靶向配体的巧妙设计,并且利用本发明的方法(即合成后修饰策略(铜催化的点击化学))高效、快速地构建本发明的核酸缀合物。通过细胞成像、基因沉默评价以及细胞凋亡实验,发现本发明提供的缀合物(核酸缀合物)具有较高的特异性识别性能、基因沉默性能、抑制肿瘤细胞生成性能。本发明提供的制备缀合物(核酸缀合物)的方法在RNAi治疗试剂的靶向递送及治疗中具有广阔的应用前景。另外,本发明提供的制备方法仅涉及简单的化学反应,能够实现灵活、高效合成核酸缀合物,并且也适用于构建其他多种配体靶向核酸缀合物,具有较好的实用性。
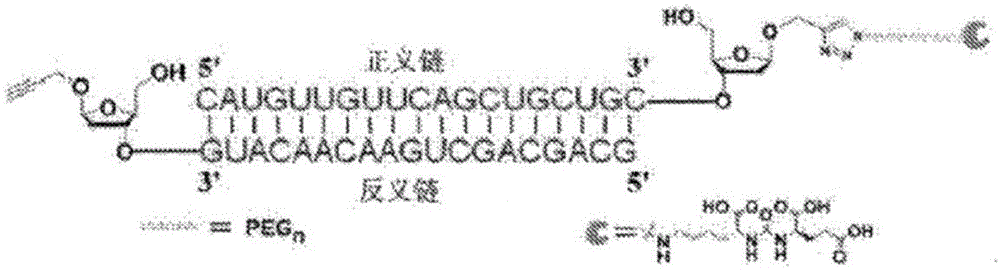
图1是本发明中KUE缀合的小核酸示意图;
图2是本发明中3'-末端炔丙基修饰的寡核酸1(ON1)的高效液相色谱谱图及质谱图;
图3是本发明中3'-末端炔丙基修饰的寡核酸2(ON2)的高效液相色谱谱图及质谱图;
图4是本发明中3'-末端炔丙基修饰的寡核酸3(ON3)的高效液相色谱谱图及质谱图;
图5是本发明中不同的KUE-PEG-siRNA缀合物的聚丙烯酰胺凝胶电泳表征图;
图6是本发明中不同的DUPA-PEG
图7是本发明实施例1中核酸缀合物KUE-PEG
图8是本发明实施例21中核酸缀合物KUE-PEG
图9是本发明实施例22中核酸缀合物KUE-PEG
图10是本发明实施例23中核酸缀合物DUPA-PEG
图11是本发明实施例24中核酸缀合物DUPA-PEG
图12是本发明一种具体实施方式中不同核酸缀合物的细胞成像效果图;
图13是本发明一种具体实施方式中不同核酸缀合物的细胞内平均荧光强度统计图;
图14是本发明一种具体实施方式中不同核酸缀合物的细胞内化方式评价效果图;
图15是本发明一种具体实施方式中不同核酸缀合物在前列腺癌细胞的摄入效率评价图;
图16是本发明一种具体实施方式中不同核酸缀合物的mRNA沉默效果图;
图17是本发明一种具体实施方式中不同核酸缀合物的蛋白表达抑制效果图;
图18是本发明中不同核酸缀合物促进细胞凋亡的效果图。
在本文中所披露的范围的端点和任何值都不限于该精确的范围或值,这些范围或值应当理解为包含接近这些范围或值的值。对于数值范围来说,各个范围的端点值之间、各个范围的端点值和单独的点值之间,以及单独的点值之间可以彼此组合而得到一个或多个新的数值范围,这些数值范围应被视为在本文中具体公开。
发明人经大量的研究发现,通过叠氮修饰的靶向配体(例如叠氮修饰的KUE配体、叠氮修饰的DUPA配体等)与3'-末端的炔丙基修饰的小核酸(寡核酸)可灵活、高效地构建抗原(如PSMA)靶向的siRNA缀合物。并且,为了验证3'-末端炔丙基修饰小核酸是否能够保持热稳定性、整体构象以及RNAi活性,发明人对3'-末端炔丙基修饰小核酸的相关性质进行了研究,例如融链温度、构象以及RNAi活性评价等方面的研究,发现在siRNA的3'-末端进行炔丙基修饰的不但不会影响RNA固有性质,而且凸显了该siRNA在合成后修饰属性。
基于以上内容,本发明第一方面提供一种缀合物,该缀合物由叠氮修饰的靶向配体与炔丙基修饰的小核酸序列共价连接而成。
根据本发明的一些实施方式,所述叠氮修饰的靶向配体中叠氮基团与靶向配体通过至少一个聚乙二醇的片段共价连接。其中,聚乙二醇的片段中聚乙二醇单体数量没有特别的限定,例如可以为1-100。其中,所述聚乙二醇的片段主要起连接作用。
根据本发明的一些实施方式,所述靶向配体为至少一种氨基酸为谷氨酸的两个氨基酸形成的二肽;优选地,所述氨基酸选自赖氨酸和谷氨酸、谷氨酸和谷氨酸以及谷氨酸和谷氨酸类似物;其中,所述靶向配体能够通过谷氨酸识别并结合靶细胞表面表达的抗原;所述抗原为PSMA。
根据本发明的一些实施方式,所述靶向配体的末端含有羧基;所述靶向配体通过羧基与靶细胞表面的抗原相连。
根据本发明的一些实施方式,所述靶细胞可以选自前列腺癌细胞、神经元细胞、肾癌细胞和结肠癌细胞中的至少一种。
根据本发明的一些实施方式,所述叠氮修饰的靶向配体具有如下所示的结构:
其中n为1-100的整数。优选n为1-50的整数,更优选为1-20的整数,进一步优选为1-15的整数。例如可以为1、2、3、4、5、6、7、8、9、10、11、12、13、14、15。
本发明中,所述叠氮修饰的靶向配体可以通过如下方法制备:
首先,先将叔丁酯、苄酯保护的赖氨酸与叔丁酯保护的谷氨酸通过三光气连接合成KUE;之后乙二醇经过丙烯酸化、叠氮化得到叠氮基PEG丙酸;最后,两者(KUE和叠氮基PEG丙酸)可以通过缩合反应得到所述靶向配体。
本发明中,优选地,所述叠氮修饰的靶向配体(6a(n=2)、6b(n=5)、6c(n=12))可以按照如下步骤制备:
(1)使聚乙二醇1a-c与金属钠接触,再与丙烯酸叔丁酯进行第一反应,得到2a-c所示的化合物;
(2)在三乙胺的存在下,使式2a-c所示的化合物与甲苯磺酰氯进行第二反应得到式3a-c所示的化合物;
(3)在第三溶剂的存在下,使式3a-c所示的化合物与叠氮化钠进行第三反应,得到式4a-c所示的化合物;
(4)在HATU(2-(7-氮杂苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯)与DIPEA(N,N-二异丙基乙胺)的存在下,使4a-c所示的化合物与KUE进行第四反应,得到式5a-c所示的化合物;
(5)使式5a-c所示的化合物与三氟乙酸进行第五反应,得到式6a-c所示的化合物;
在步骤(1)中,所述第一反应的反应温度可以20-40℃,反应时间可以为5-20小时。其中,相对于每毫摩尔的聚乙二醇(1a-c),金属钠的用量可以为0.05-2mmol,丙烯酸叔丁酯的用量可以为0.3-0.8mmol。所述第一反应在第一溶剂的存在下进行;其中,相对于每毫摩尔的聚乙二醇,所述第一溶剂的用量可以为1-2mL;所述第一溶剂可以为四氢呋喃。
步骤(2)中,所述第二反应的反应温度可以为-20℃至10℃,反应时间可以为5-20小时。其中,相对于每毫摩尔的式2a-c所示的化合物,三乙胺的用量为0.5-1mL,对甲苯磺酰氯的用量可以为1.2-1.8mmol。所述第二反应在第二溶剂的存在下进行;其中,相对于每毫摩尔的式2a-c所示的化合物,所述第二溶剂的用量可以为1-3mL。其中,所述第二溶剂可以为二氯甲烷。所述第二反应优选在惰性气氛下进行,所述惰性气氛可以由氩气提供。
步骤(3)中,所述第三反应的反应温度可以为60-90℃,反应时间可以5-24小时。其中,相对于每毫摩尔的式3a-c所示的化合物,叠氮化钠的用量可以为1.2-1.8mmol。其中,相对于每毫摩尔的式3a-c所示的化合物,所述第三溶剂的用量可以为2-3mL。所述第三溶剂可以为DMF(N,N二甲基甲酰胺)。
步骤(4)中,所述第四反应的反应温度可以为20-40℃,反应时间可以为5-24小时。其中,相对于每毫摩尔的式4a-c所示的化合物,KUE的用量可以为0.9-1.5mmol。其中,在 4a-c所示的化合物与KUE进行第四反应之前,可以先在三氟乙酸(相对于1mol的4a-c所示的化合物,三氟乙酸的用量为2-3mL)的存在下,使4a-c所示的化合物脱保护,其中,所述脱保护的温度可以为20-30℃,时间为10-24h;之后可以用HATU与DIPEA对4a-c所示的化合物的脱保护产物进行活化处理;其中,相对于每毫摩尔的式4a-c所示的化合物,HATU和DIPEA的用量可以分别为1.2-1.8mmol和2-4mmol。所述第四反应在第四溶剂的存在下进行;其中,相对于每毫摩尔的式4a-c所示的化合物,所述第四溶剂的用量可以为0.8-1.5mL。所述第四溶剂可以为DMF(N,N二甲基甲酰胺)。
步骤(5)中,所述第五反应的反应温度可以为20-40℃,反应时间可以为5-24小时。其中,相对于每毫摩尔的式5a-c所示的化合物,三氟乙酸的用量可以为20-30mL。
其中,对步骤(1)-(5)中的反应的后处理没有特别的限定,均可以通过柱层析分离得到纯化产物。
本发明中,KUE的结构式如下所示:
根据本发明的一些实施方式,所述小核酸序列可以选自靶向STAT3、PHB1、Notch1、PLK1和BRD4的小核酸中的至少一种。
根据本发明优选的实施方式,所述炔丙基修饰优选为3'-末端炔丙基修饰。
根据本发明的一些实施方式,所述炔丙基修饰的小核酸序列采用亚磷酰胺法通过固相合成技术将炔丙基化合物修饰到小核酸序列的3'-末端;其中,所述炔丙基化合物至少含有一个活性羟基。其中,所述炔丙基修饰可以为多个炔丙基修饰(1个、2个、3个……)。本发明中,对于将炔丙基化合物修饰到小核酸序列的3'-末端的方式不做特别的限定,可以通过如下方式进行:首先,基于现有技术(Bioorg.Med.Chem.,2013,5583–5588),以商业化的霍夫氯糖为原料历经4步反应合成1-O-炔丙基-2-脱氧-D-呋喃糖亚磷酰胺单体;然后,得到的亚磷酰胺单体与固相载体(CPG)连接后通过自动核酸合成仪将炔丙基单体X寡核苷酸的3'-末端;最后,脱除CPG以及保护基得到3'-末端炔丙基修饰的小核酸。
本发明中,优选地,所述炔丙基化合物具有如下所示的结构:
其中,
本发明第二方面提供一种制备前述缀合物的方法,该方法包括:在一价铜催化剂的存在下,使叠氮修饰的靶向配体与炔丙基修饰的小核酸序列进行接触。
根据本发明的一些实施方式,所述叠氮修饰的靶向配体与炔丙基修饰的小核酸序列的摩尔比可以为(1.05-10):1,优选为(2-4):1。
根据本发明的一些实施方式,所述一价铜催化剂可以选自Cu(I)-TBTA、CuBr和CuCl中的至少一种,优选为Cu(I)-TBTA。
根据本发明的一些实施方式,相对于1mol的小核酸序列,所述一价铜催化剂的用量可以为2-10mol,优选为3-6mol。
根据本发明的一些实施方式,所述接触的条件包括:温度为35.5-38.5℃,优选为36.5-37.5℃;时间为1-5h,优选为2-4h。
本发明中,所述接触中,对转速没有特别的限定,只要能够满足本发明的需求即可,例如转速可以为600-1000r/min,优选为700-900r/min。
本发明中,所述接触优选在震荡的条件下进行,所述震荡的条件可以为:每隔0.4-0.6h震荡一次。
根据本发明的一些实施方式,所述接触在有机溶剂的存在下进行,所述有机溶剂选自N,N-二甲基甲酰胺(DMF)、甲醇、乙醇和丙酮中的至少一种。
根据本发明的一些实施方式,所述有机溶剂的用量使得所述小核酸序列的浓度维持在20-200μM,优选为80-120μM。
本发明中,所述缀合物可以指单链核酸缀合物或双链核酸缀合物;当所述缀合物为双链核酸缀合物时,可以参照本领域常规的方式由正义链核酸和反义链核酸经退火形成双链核酸缀合物,例如将正义链核酸和反义链核酸以等摩尔的比例在退火缓冲液(含镁离子)中,90-100℃下形成。
根据本发明的一些实施方式,所述小核酸序列为包括正义链和反义链的siRNA序列,所述方法包括:
(1)分别获得炔丙基修饰的正义链和炔丙基修饰的反义链;
(2)将叠氮修饰的靶向配体与炔丙基修饰的正义链或炔丙基修饰的反义链接触,得到单链缀合物;
(3)将单链缀合物与另一条链在退火缓冲液中90-100℃条件下孵育1-5分钟得到所述缀合物;
根据本发明优选的实施方式,所述退火缓冲液选自所述退火缓冲液选自1.5-2.5mM的醋酸镁溶液。
本发明第三方面提供一种前述缀合物或前述方法制备的缀合物在制备用于治疗表达PSMA的组织出现异常导致的相关疾病的药物中的应用,所述疾病优选发生在腺体组织、结肠、肾脏和神经系统中;其中,所述腺体组织选自前列腺、胰腺、乳腺和胸腺中的一种。其中,所述疾病优选为癌症。
本发明中,“缀合物”指的是“KUE-PEG-siRNA缀合物”或“DUPA-PEG-siRNA缀合物”。
以下将通过实施例对本发明进行详细描述。
以下实施例中,所有的原料为市售品。
制备例1
本制备例用于说明叠氮修饰的KUE配体6a-c的制备
n=2、5、12。
合成路线一:
具体操作步骤:
(i)将聚乙二醇1a-c(100mmol,1eq)溶解于干燥THF(150mL)中,向其中加入金属钠(230mg,10mmol,0.1eq),室温下搅拌直至钠完全溶解。随后,向混合液中缓慢滴加丙烯酸叔丁酯(6.4g,50mmol,0.5eq),并在室温下反应12小时。反应结束后,加入8mL的1M盐酸水溶液淬灭反应。搅拌10分钟后,将反应液倒进200mL饱和食盐水,用乙酸乙酯萃取3 次,收集有机相,用饱和食盐水洗涤,无水硫酸钠干燥,快速柱色谱分离纯化(PE/EA=10:1-1:1)得到微黄色单叔丁酯产物。
1
1
1
(ii)合物2a-c(12.3mmol,1eq)溶于30mL二氯甲烷和10mL三乙胺的混合物中,并在氩气氛围下,冰浴中搅拌。然后,分批加入(3.53g,18.5mmol,1.5eq)对甲苯磺酰氯。混合物在室温搅拌过夜,然后,加入10g少量硅胶(100-200目)浓缩至干,并在硅胶(300-400目)上进行色谱分离(PE/EA=10:1-1:3),产物为无色油状物。
1
1
1
(iii)将化合物3a-c(2mmol,1eq)溶于5mL二甲基甲酰胺中,并加入叠氮化钠(195mg,3mmol,1.5eq)。混合物在80℃条件下反应过夜,然后,加入2g少量硅胶(100-200目)浓缩至干,并在硅胶(300-400目)上进行色谱分离(PE/EA=20:1-1:2),产物为无色油状物。
1
1
1
(iv)将化合物4a-c(2mmol,1eq)溶于5mL三氟乙酸中,在室温下反应过夜,然后,浓缩除去剩余的三氟乙酸,加入二氯甲烷和2g硅胶(100-200目)浓缩至干,并在硅胶(300-400目)上进行色谱分离(PE/EA=5:1-1:5),产物为无色油状物,并溶于2mL二甲基甲酰胺中。加入HATU(1.15g,3mmol,1.5eq)以及DIPEA(775.5mg,6mmol,3eq)进行活化。15min后,加入KUE(1.17g,2.4mmol,1.2eq)。混合物在室温下反应过夜,然后,加入3g少量硅胶(100-200目)浓缩至干,并在硅胶(300-400目)上进行色谱分离(PE/EA=10:1-1:5),产物为无色油状物。
1
1
1
(v)将化合物5a-c(0.2mmol,1eq)溶于5mL三氟乙酸中,在室温下反应过夜,然后,浓缩除去剩余的三氟乙酸,加入二氯甲烷和1g少量硅胶(100-200目)浓缩至干,并在硅胶(300-400目)上进行色谱分离(DCM/MeOH=10:1-1:2),产物为无色油状物。对6a-c所示的化合物进行高分辨质谱确认。
6a:145mg,Yield 96%,HRMS:calcd.for C
6b:179mg,Yield 94%,HRMS:calcd.for C
6c:260mg,Yield 92%,HRMS:calcd.for C
制备例2
本制备例用于说明叠氮修饰的DUPA配体的制备
n=5。
合成路线二:
具体操作步骤:
(i)将化合物S1(244mg,0.5mmol)和2-(7-氮杂苯并三唑-1-基)-N,N,N',N'-四甲基脲鎓六氟磷酸盐(HATU,228mg,0.6mmol)一起加入到5mL的二甲基甲酰胺中。搅拌条件下加入N,N-二异丙基乙胺(DIPEA,129mg,1mmol)后,将混合物在室温下搅拌15分钟。立即将17-叠氮基-3,6,9,12,15-五氧杂十七烷-1-胺(182mg,0.6mmol)以喷雾的形式加入混合物中,室温条件下继续反应6小时。反应结束后,将反应混合物倒入20mL水中,乙酸乙酯萃取(50mL×3),收集有机相,饱和食盐水洗涤,无水硫酸钠干燥,减压除去溶剂得到橘黄色油状粗产物。残余物经柱色谱分离纯化(乙酸乙酯/石油醚=1/5),得到黄色油状化合物S2(338mg,产率:87%)。
1
(ii)在冰浴条件下,将化合物S2(472mg,0.5mmol)溶解在二氯甲烷和三氟乙酸的等体积混合溶液(5mL)中,反应液在室温下反应6小时。蒸发除去溶剂,所得残余物通过快速柱层析纯化(MeOH/CH2Cl2=1/3)纯化得到油状化合物S3(238mg,98%)。
1
制备例3
本制备例用于说明3'-末端炔丙基修饰小核酸的合成
1-O-炔丙基-2-脱氧-D-呋喃糖(X,即炔丙基单体),作为一种通用的悬突修饰,通过使用ABI 394 DNA/RNA合成仪(ABI,USA)连接到小核酸(寡核酸)的3'-末端(如图1所示)。
3'-末端炔丙基修饰小核酸的合成的具体步骤如下:首先,以商业化的霍夫氯糖为原料合成1-O-炔丙基-2-脱氧-D-呋喃糖亚磷酰胺单体(Bioorg.Med.Chem.,2013,5583–5588);然后,得到的亚磷酰胺单体与固相载体(CPG)连接后通过前述自动核酸合成仪将炔丙基单体X寡核苷酸的3'-末端;最后,脱除CPG以及保护基得到不同的3'-末端炔丙基修饰单链小核酸,本发明制备的所有炔丙基修饰的单链核酸的纯度经过高效液相色谱仪确认而且结构经过质谱仪确认(图2-4)。
表1 不同的3'-末端炔丙基修饰单链小核酸
实施例1
本实施例用于说明KUE-PEG-siRNA缀合物的高效合成
KUE-PEG
实施例2-12
按照实施例1的方式进行,不同的是,改变加入有机溶剂的种类和/或用量。结果见表2。
表2
实施例13-20
按照实施例1的方式进行,不同的是,改变催化剂的种类和/或用量。实验结果见表3。
表3
实施例21
按照实施例1的方式进行,不同的是,用等摩尔量的叠氮修饰的靶向配体6b代替6a。最终收率为96%。
实施例22
按照实施例1的方式进行,不同的是,用等摩尔量的叠氮修饰的靶向配体6c代替6a。最终收率为95%。
实施例23
本实施例用于说明靶向不同基因的KUE-PEG-siRNA缀合物的高效合成
按照实施例1的方式进行,不同的是,使用靶向PHB-1基因的RNA(ON5)代替靶向STAT3基因的RNA(ON3)。最终收率为97%。
实施例24
本实施例用于说明DUPA-PEG-siRNA缀合物的高效合成
按照实施例1的方式进行,不同的是,用等摩尔量的叠氮修饰的DUPA配体代替6a。最终收率为98%。
实施例25
将实施例1-22得到的单链缀合物和Cy5标记的互补链小核酸以摩尔比1:1的比例在退火缓冲液(2mM醋酸镁含镁离子)中,95℃下孵育3分钟形成不同的KUE-PEG-siRNA缀合物以及DUPA-PEG-siRNA缀合物。
实施例1、实施例21、实施例22、实施例23和实施例24制备得到的核酸缀合物KUE-PEG
测试实施例1
KUE-PEG-siRNA缀合物在前列腺癌细胞摄入的选择性评价
细胞成像:选择LNCaP细胞(PSMA阳性,购自中国科学院)和PC3细胞(PSMA阴性,购自中国科学院)评价KUE-PEG-siRNA缀合物的细胞摄取。使用Cy5标记的KUE-PEG-siRNA缀合物以及siRNA(50nM)与两种前列腺癌细胞共孵育,转染6小时后细胞在649nm激发光条件下进行荧光成像(图12A(LNCaP细胞的荧光成像)和图12B(PC3细胞的荧光成像))。从图12A可以发现只有在lipofectamine 2000(牌号:Invitrogen,厂家:赛默飞)存在下才能在两种细胞中观察到来自siRNA组的红色荧光信号,而在LNCaP细胞中可以观察到来自KUE-PEG-siRNA缀合物组的红色荧光信号。此外,图12B中,在PC-3细胞中几乎无法观察到来自KUE-PEG-siRNA缀合物组的红色荧光信号。以上这些结果表明,KUE-PEG-siRNA缀合物,与未缀合的siRNA不同,KUE-PEG-siRNA缀合物能够选择性地进入前列腺癌细胞,并且这种内化不借助lipofectamine 2000也能高效率地完成。将图12A的细胞荧光成像进行平均荧光强度统计(见图13),从图13的统计结果中发现在LNCaP细胞中KUE-PEG-siRNA缀合物组的平均荧光强度为95%,而lipofectamine 2000转染的siRNA组的平均荧光强度为82%;在PC-3细胞中KUE-PEG-siRNA缀合物的平均荧光强度小于为5%。以上这些结果表明,siRNA在不借助转染试剂时几乎无法进入任何细胞,而KUE-PEG-siRNA缀合物不借助转染试剂能够选择性地进入LNCaP细胞。
细胞内化方式:通过加入PSMA特异性抑制剂(ZJ43,参照Eur.J.Neurosci.,2004,483-494制备得到)进一步确认KUE-PEG-siRNA缀合物进入LNCaP细胞的途径。其中,LNCaP细胞提前与ZJ43一起孵育,然后再加入Cy5标记的KUE-PEG-siRNA缀合物。6小时,LNCaP细胞在640nm激发光条件下进行荧光成像(见图14)。图14的结果表明相对于未加入PSMA特异性抑制剂的对照组而言,ZJ43的加入使得LNCaP细胞几乎观察不到来自KUE-PEG-siRNA缀合物的红色荧光信号。这表明相对于未加入ZJ43组,ZJ43的加入能明显地抑制LNCaP细胞对KUE-PEG-siRNA缀合物的摄入。
测试实施例2
KUE-PEG-siRNA缀合物在前列腺癌细胞的摄入效率评价
选择PSMA阳性表达的LNCaP细胞(购自中国科学院)评价KUE-PEG-siRNA缀合物的细胞摄取效率。Cy5标记的KUE-PEG-siRNA缀合物(50nM)和siRNA(50nM)与LNCaP细胞共孵育,其中siRNA与lipofectamine 2000(牌号:Invitrogen,厂家:赛默飞)共同转染 作为对照组。4小时后,按照AnnexinV-FITC/PI细胞凋亡双染试剂盒(牌号:556547,厂家:美国BD公司)的操作对细胞进行处理。制备好的细胞样品通过FACS Calibur流式细胞仪在Cy5相对应的检测通道下进行分析。实验过程中依次对空白独照组、siRNA单独转染组、siRNA与lipofectamine 2000共同转染组以及不同KUE-PEG-siRNA缀合物转染组进行分析,并且每一组收集检测10
测试实施例3
为了验证KUE-PEG-siRNA缀合物的RNAi活性,本测试实施例用到靶向STAT3基因的治疗性小核酸,其序列见表4。
表4
向200μL灭菌离心管中依次加入炔丙基修饰的小核酸序列(ON2)(10nmol)、叠氮修饰的靶向配体(30nmol)、Cu(I)-TBTA(50nmol),使得RNA终浓度维持在100μM左右。向体系中加入DMF(体积为反应液体积的25%)。反应体系经轻轻涡旋混匀后放置在金属反应器中,在37℃、900r/min的条件下震荡反应3h。最后,用15%变性聚丙烯酰胺凝胶电泳对反应结果进行监测,经寡核酸提取试剂盒分离纯化得到单链缀合物。当使用的靶向配体为6a时,收率为97.7%;当使用靶向配体为6b时,收率为96.2%;当使用靶向配体6c时,收率为95.6%。
之后将得到的单链缀合物和互补链小核酸以摩尔比1:1的比例在退火缓冲液(2mM醋酸镁)中,95℃下孵育3分钟形成KUE-PEG-siSTAT3缀合物。
1)KUE-PEG-siSTAT3缀合物的基因沉默效果评价:
靶标基因沉默:将靶向信号转导与转录激活因子3(STAT3)的KUE-PEG-siSTAT3(KUE-PEG-siRNA)缀合物(100nM)与LNCaP细胞共孵育。48小时后,mRNA的表达通过逆转录聚合酶链反应法(RT-PCR)进行检测。如图16A所示,所有KUE-PEG-siRNA缀合物能够有效地降低STAT3的mRNA表达,其中KUE-PEG
蛋白质表达抑制:除了mRNA下调实验外,还通过蛋白质印迹法(Western Blot)探究了缀合物对于STAT3蛋白的表达的影响(见图17A和图17B)。图17A中的结果表明所有的KUE-PEG-siSTAT3缀合物实验组对应的条带灰度,相对于未缀合的siSTAT3组,均呈现能不同程度地降低,这说明KUE-PEG-siSTAT3缀合物可以抑制STAT3蛋白的表达。图17B中定量实验结果表明KUE-PEG
2)KUE-PEG-siRNA缀合物的前列腺癌细胞生长抑制效果评价
基于上述的生化测试评价,可以确定KUE-PEG-siSTAT3(KUE-PEG-siRNA)缀合物能够被前列腺癌细胞LNCaP特异性摄取并促发RNAi机制从而导致STAT3的mRNA以及蛋白表达量显著降低。用流式细胞仪(厂家:美国BD公司,型号:FACS Calibur)检测KUE-PEG-siSTAT3缀合物对于LNCaP细胞生长状况影响(见图18)。图18中,流式细胞结果表明靶向STAT3基因的KUE-PEG-siSTAT3缀合物均能不同程度地促进LNCaP细胞凋亡(25.01%-34.94%),并且缀合物KUE-PEG
通过以上内容可知,本发明构建的KUE-PEG-siSTAT3缀合物能够被前列腺癌细胞(LNCaP细胞)选择性地摄取,并且能够触发LNCaP细胞中的RNAi机制最终成功地抑制前列腺癌细胞的生长。
而且,进一步的研究表明,本发明的缀合物与常规方式(如脂质体)递送小核酸在降低靶基因的表达(或抑制癌细胞生长)方面的效果相当。
以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。
- 用于制备治疗肝癌药物的芳基钌配合物及其制备方法和用途
- 一种含蜂胶提取物的组合物及其制备方法和用途
- 一种含蜂胶提取物的治疗老年痴呆的药物组合物及其制备方法和用途
- 甘草水提取物、包含其的组合物及其制备方法和用途
- 氢可酮的苯甲酸缀合物、苯甲酸衍生物缀合物和杂芳基羧酸缀合物及其前药、制备方法和用途
- 氢可酮的苯甲酸缀合物、苯甲酸衍生物缀合物和杂芳基羧酸缀合物及其前药、制备方法和用途
