包含蕨素化合物及其衍生物作为活性成分的用于预防或治疗PKA相关疾病的药物组合物
文献发布时间:2024-04-18 19:58:53
技术领域
本申请要求于2020年12月14日提交的韩国专利申请号2020-0174821的优先权,并且其整个说明书通过引用并入本文。
本发明涉及用于预防或治疗与蛋白激酶A(PKA,一种cAMP依赖性蛋白激酶)相关的疾病的组合物,所述组合物包含蕨素(pterosin)化合物及其衍生物作为活性成分,更具体而言,本发明涉及用于预防或治疗神经精神疾病的组合物,所述组合物包含式1定义的蕨素化合物或其衍生物作为活性成分。
背景技术
抑郁症是一种情绪障碍,其导致持续的悲伤感和兴趣丧失。据估计,超过50%的抑郁症患者对已知的施用药物没有产生足够的治疗反应。正如抑郁症药物治疗的开放标签研究中所指出的,在大多数情况下,需要2周或更长时间的药物治疗才能观察到显著改善(Rush等人,Am.J.Psychiatry 2006,163:1905)。由于对抑郁症和其它相关疾病仍然没有单一有效的治疗方法,因此相关研究仍在进行中。
与此同时,精神治疗性麻醉镇痛药及精神治疗类药物如安眠药、麻醉药等以及其中的成瘾性药物如酒精、海洛因等的使用日益增多,药物成瘾被认为是一个严重的社会问题。为了治疗这种病症,人们正在积极开发药物成瘾的解毒剂。但是,存在例如高成本和副作用等各种问题,效果并不显著。
另一方面,蛋白激酶A(PKA,cAMP依赖性蛋白激酶)是一种将磷酸酯与蛋白质共价结合的磷酸化酶,且PKA的特点是根据细胞内cAMP水平的波动来调节其活性。因此,这种酶充当通过cAMP信号传导途径发挥作用的各种激素的最终效应器。换句话说,PKA主要参与所有由最终的cAMP次级传导系统导致的细胞反应。PKA作为异四聚体,由两个具有酶活性的催化亚基和两个具有调节所述活性的功能的调节亚基组成。所述催化亚基包含所述酶的活性功能区并且还包含ATP结合结构域和与所述调节亚基结合的结构域。调节亚基以相反方向彼此结合形成同型二聚体,其具有两个cAMP结合结构域、一个催化亚基结合结构域和一个可以抑制催化结构域的“自身抑制”结构域。因此,所述催化亚基的活性可被调节。除了调节催化亚基的作用外,这些调节亚基还可具有其它生物活性。PKA在脂肪细胞、肌细胞(包括心肌细胞)、肝细胞、肾细胞和神经细胞中发挥作用。根据细胞类型的不同,所述酶的活性具有不同功能。
cAMP应答元件结合蛋白(CREB)作为主要的细胞内转录因子,与称为cAMP应答元件(CRE)的特定DNA序列结合,以增加或减少亚基因的表达。CREB在1987年首次被报道为调节生长抑素基因的cAMP应答性转录因子。ATP是细胞的化学能,可通过存在于膜中的腺苷酸环化酶转变为环式AMP(cAMP),以调节细胞中主要蛋白质的活性。CREB主要是由外界刺激引起的细胞内cAMP浓度升高而激活的蛋白激酶A(PKA)所激活,并且增加或抑制与细胞内营养供应和生长、生理节律、空间知觉和记忆相关的基因的表达。
已知PKA-CREB信号传导在神经发育、突触和神经可塑性以及神经保护中发挥重要作用,许多研究已经报道PKA-CREB信号传导与多种神经精神疾病例如抑郁症的治疗密切相关。
现有技术文献
专利文献
(专利文献0001)韩国专利号号10-2085358
发明概述
技术问题
因此,本发明的发明人研究了欧洲蕨(bracken)提取物中的蕨素(pterosin)化合物及其衍生物对生物体的作用,证实蕨素化合物及其衍生物可以通过激活PKA-CREB信号传导途径而对多种神经精神疾病表现出预防或治疗作用,并完成了本发明。
因此,本发明的一个目的是提供用于预防或治疗神经精神疾病的药物组合物,所述组合物包含作为活性成分的下式1定义的化合物、其异构体、其衍生物、或其药学上可接受的盐。
另外,本发明的一个目的是提供用于预防或治疗神经精神疾病的药物组合物,所述组合物由下式1定义的化合物、其异构体、其衍生物或其药学上可接受的盐组成。
此外,本发明的一个目的是提供用于预防或治疗神经精神疾病的药物组合物,所述组合物基本上由下式1定义的化合物、其异构体、其衍生物或其药学上可接受的盐组成。
[式1]
其中:
R
本发明的另一个目的是提供用于预防或改善神经精神疾病的食品组合物,所述组合物包含作为活性成分的下式1定义的化合物、其异构体、其衍生物、或其药学上可接受的盐。
本发明的另一个目的是提供用于预防或改善神经精神疾病的食品组合物,所述组合物由下式1定义的化合物、其异构体、其衍生物或其药学上可接受的盐组成。
此外,本发明的另一个目的是提供用于预防或改善神经精神疾病的食品组合物,所述组合物基本上由下式1定义的化合物、其异构体、其衍生物或其药学上可接受的盐组成。
[式1]
其中:
R
本发明的另一个目的是提供上式1定义的化合物、其异构体、其衍生物、或其药学上可接受的盐在制备用于治疗神经精神疾病的药物中的用途。
本发明的另一个目的是提供一种治疗神经精神疾病的方法,包括向有需要的个体施用有效量的包含上式1定义的化合物、其异构体、或其药学上可接受的盐的组合物。
问题的解决方案
为了实现本发明的上述目的,本发明提供了用于预防或治疗神经精神疾病的药物组合物,所述组合物包含下式1定义的化合物、其异构体、其衍生物、或药学上可接受的盐作为活性成分。
此外,本发明提供了用于预防或治疗神经精神疾病的药物组合物,所述组合物由下式1定义的化合物、其异构体、其衍生物或其药学上可接受的盐组成。
此外,本发明提供了用于预防或治疗神经精神疾病的药物组合物,所述组合物基本上由下式1定义的化合物、其异构体、其衍生物或其药学上可接受的盐组成。
[式1]
其中:
R
为了实现本发明的另一个目的,本发明提供了用于预防或改善神经精神疾病的食品组合物,所述组合物包含下式1定义的化合物、其异构体、其衍生物、或其药学上可接受的盐作为活性成分。
此外,本发明提供了用于预防或改善神经精神疾病的食品组合物,其由下式1定义的化合物、其异构体、其衍生物或其药学上可接受的盐组成。
此外,本发明提供了用于预防或改善神经精神疾病的食品组合物,所述组合物基本上由下式1定义的化合物、其异构体、其衍生物或其药学上可接受的盐组成。
[式1]
其中:
R
为了实现本发明的另一个目的,本发明提供了上式1定义的化合物、其异构体、其衍生物、或其药学上可接受的盐在制备用于治疗神经精神疾病的药物中的用途。
为了实现本发明的另一个目的,本发明提供了一种治疗神经精神疾病的方法,包括向有需要的个体施用有效量的包含上式1定义的化合物、其异构体或其药学上可接受的盐的组合物。
以下,对本发明进行详细描述。
本发明提供了用于预防或治疗神经精神疾病的药物组合物,所述组合物包含下式1定义的化合物、其异构体、其衍生物、或其药学上可接受的盐作为活性成分:
[式1]
其中:
R
如本文所用,术语“烷基”用于描述包含含有1至4个碳原子的直链或支链烷基的基团或基团的一部分。该基团的代表性实例包括甲基、乙基、丙基、异丙基、正丁基、异丁基和叔丁基。
如本文所用,术语“烯基”是具有2至10个碳原子(例如,C2-C10)并具有一个或多个双键的直链或支链的一价或二价烃。烯基的实例包括乙烯基、丙烯基、亚丙烯基、烯丙基和1,4-丁二烯基,但本发明不限于这些。
如本文所用,术语“炔基”是具有2至10个碳原子(例如,C2-C10)并具有一个或多个三键的直链或支链的一价或二价烃。炔基的实例包括乙炔基、亚乙炔基、1-丙炔基、1-和2-丁炔基以及1-甲基-2-丁炔基,但本发明不限于这些。
如本文所用,术语“醇”用于描述具有1至4个碳原子的直链或支链的醇或烷氧基。这种基团包括甲醇、乙醇、丙醇、丁醇及其烷氧基。烷氧基的实例包括甲氧基、乙氧基、异丙氧基、叔丁氧基。本发明中使用的术语“具有1至4个碳原子的醇”可以与“具有1至4个碳原子的羟基烷基”相同地解释。
在本发明的一个方面,上式1中的R
在本发明的另一方面,上式1中的R
在本发明的一个优选方面,上式1中的R
在本发明的另一个优选方面,R
本发明的“式1定义的化合物”是存在于欧洲蕨中的倍半萜类化合物并且可以是从欧洲蕨提取物中纯化的蕨素化合物。另外,本发明的蕨素化合物可以为蕨素(pterosin)A、蕨素B、蕨素C、蕨素D、蕨素J、蕨素M、蕨素N、蕨素P、蕨素S、蕨素Z、蕨苷(pteroside)A、蕨苷A2、蕨苷B、蕨苷C、蕨苷D、蕨苷N、蕨苷P、蕨苷Z或硫酸化蕨素C,并且可以优选为蕨素A、蕨素C、蕨素D、蕨素N或其异构体,但本发明不限于这些。
优选地,本发明的上式1定义的化合物可以是R
最优选地,本发明的上式1定义的化合物可以是蕨素C、D或其异构体,其中R
此外,本发明的蕨素化合物可以具有非芳香族双键和一个或多个不对称中心,其可以作为外消旋体和外消旋体的混合物、单一对映异构体、单个的非对映体、非对映体的混合物以及顺式或反式异构体而存在,并且可以包括所有这样的异构形式。
本发明的上式1定义的化合物及其衍生物可以从自然界分离或通过本领域已知的新化合物的化学合成法来制备。优选地,本发明的上式1定义的化合物及其衍生物可以从天然植物中分离和纯化。即,它们可以通过使用提取和分离物质的常规方法从植物或植物部分中获得。可以将茎、根或叶适当地干燥和浸软或仅干燥并使用适当的有机溶剂提取以获得所需的提取物,并且可以使用本发明所属领域技术人员已知的纯化方法来纯化所需的提取物。优选地,本发明的上式1定义的化合物及其衍生物可以从欧洲蕨中分离和纯化。
所述欧洲蕨植物可以是例如碗蕨科(Dennstaedtiaceae)和凤尾蕨科(Pteridaceae)。此类植物的具体实例包括刺柄碗蕨(Dennstaedtia scandens)、栗蕨(Histiopteris incisa)、热带鳞盖蕨(Microlepia speluncae)、蕨(Pteridium aquilinumvar.latiusculum)、毛轴蕨(Pteridium revolutum)、姬蕨(Hypolepis punctata)、水蕨(Ceratopteris thalictroides)、傅氏凤尾蕨(Pteris pauriea fauriei)、半边羽裂凤尾蕨(Pteris dimidiata)和剑叶凤尾蕨(Pteris ensiformi)。这些植物分布于世界各地,尤其可在中国台湾省台北县乌来区和中国台湾省台北市大屯山发现,但本发明不限于此。
上式I定义的化合物及其衍生物可以通过包括以下步骤的方法进行分离和纯化:
(a)用水或具有1至4个碳原子的有机溶剂提取欧洲蕨;
(b)用乙酸乙酯对在步骤(a)获得的提取物进行提取分离;和
(c)通过浓度梯度色谱对在步骤(b)获得的乙酸乙酯部分进行分离和纯化。
在步骤(a)中,可以使用整个欧洲蕨植物或其干燥体,并且可以将欧洲蕨干燥体用粉碎机粉碎以提高提取效率。作为干燥方法,可以使用阳光干燥、阴干、热风干燥、冷冻干燥和自然干燥中的任何干燥方法。优选地,可以使用热风干燥和冷冻干燥。
用于欧洲蕨提取的具有1至4个碳原子的有机溶剂可以是甲醇、乙醇、丙醇、异丙醇、丁醇、丙酮、乙醚、氯仿、乙酸乙酯、二氯甲烷、己烷、环己烷、二氯甲烷或石油醚。在本发明的一个实施方案中,用水提取欧洲蕨。
在步骤(b)中,将在步骤(a)获得的提取物进行提取分离,用乙酸乙酯进行分配提取。在步骤(b)中获得的乙酸乙酯部分通过梯度色谱法分离。作为色谱法,可以单独或组合使用柱色谱、装有各种合成树脂例如硅胶、活性氧化铝的高效液相色谱(HPLC)。优选地,在步骤(b)获得的各部分中,将乙酸乙酯部分施加于硅胶柱,并调节洗脱溶剂的组成以逐渐提高极性,从而得到各种流分。可以进行浓度梯度硅胶色谱法来调节洗脱溶剂的组成,以逐渐增加在上述过程中获得的流分中具有活性的流分的极性。然而,提取、分离和纯化所述化合物的方法不一定限于上述方法。
在步骤(c)中,将在步骤(b)获得的乙酸乙酯部分通过浓度梯度色谱法进行分离和纯化。
作为色谱法,可以单独或组合使用柱色谱、装有各种合成树脂例如硅胶、活性氧化铝的高效液相色谱(HPLC)。优选地,可以通过使用高效液相色谱法来分离和纯化新化合物。
用于分离此类化合物的方法是本领域熟知的(参见例如[Takahashi等人,Phytother.Res,2004,18,573,Sheridan等人,Planta Med.,1999,65,271,Nagao等人,Mutation Research,1989,215,173,Murakami等人,Chem.Pharm.Bull,1976,24,2241,和Kuraishi等人,Chem.Pharm.Bull,1985,33,2305])。这些化合物也可以通过化学合成制备。非天然存在的蕨素化合物可以由天然存在的化合物转化而获得(参见例如[Banerji等人,Tetrahedron Letters,1974,15,1369,Hayashi等人,Tetrahedron Letters,1991,33,2509,和McMorris等人,J.Org.Chem.,1992,57,6876])或通过本领域熟知的方法新合成。
可用于合成上式1定义的化合物的合成化学转化和保护基团的方法(保护和脱保护)是本领域已知的(参见例如[R.Larock,Comprehensive Organic Transformations,VCHPublishers(1989);T.W.Greene和P.G.M.Wuts,Protective Groups in OrganicSynthesis,第3版,John Wiley and Sons(1999);L.Fieser和M.Fieser,Fieser andFieser's Reagents for Organic Synthesis,John Wiley and Sons(1994);以及L.Paquette编辑,Encyclopedia of Reagents for Organic Synthesis,John Wiley andSons(1995),以及其后续版本])。
在本发明的一个实施方案中,将200至500g欧洲蕨用热水提取后,加入乙酸乙酯(EA),充分混合并干燥。然后将乙酸乙酯提取物溶解在DMSO中,用水稀释,并通过柱色谱法分成7个流分。所分开的流分通过HPLC分析以提取本发明的化合物(参见实施例1)。
在本发明中,所述的神经精神疾病是与PKA和CREB信号转导相关的疾病,本发明的疾病的具体实例可以是选自亨廷顿病、脑瘫、孤独症、注意力缺陷多动症(ADHD)、截瘫、抑郁症、药物成瘾、Rubinstein-Taybi综合征、失眠、睡眠时相延迟综合征和睡眠时相前移综合征中的任何一种或多种疾病,但本发明不限于这些。
如下所述,通过多种文献已知PKA和CREB活化对上述神经精神疾病具有预防或治疗作用。
抑郁症、药物成瘾、Rubinstein-Taybi综合征、脑瘫、孤独症、注意力缺陷多动症
与CREB的KID结构域相互作用的蛋白质(一种CREB结合蛋白(CBP))的异常与Rubinstein-Taybi综合征相关,并且多项证据表明CREB功能障碍与严重抑郁相关(参见[Belmaker,R.H.;Agam,Galila(2008).“Major depressive disorder.”New EnglandJournal of Medicine.358(1):55–68.doi:10.1056/nejmra073096.PMID 18172175])。具有齿状回中的CREB过表达的抑郁小鼠的行为与接受抗抑郁药物治疗的小鼠相似(参见[Blendy,J.A.(2006).“The role of CREB in depression and antidepressanttreatment.”Biol Psychiatry.59(12):1144–50.doi:10.1016/j.biopsych.2005.11.003.PMID 16457782])。尸检显示,与健康对照组和接受抗抑郁药物治疗的患者相比,未经治疗的严重抑郁患者的皮质中含有降低水平的CREB。CREB的功能可能通过血清素和去甲肾上腺素与突触后G蛋白偶联受体结合产生的信号传导途径而被调节。所述神经递质的功能障碍也与严重抑郁有关。此外,已知脑瘫、注意力缺陷多动症和截瘫可以通过PKA和CREB活化而改善。
失眠、睡眠时相延迟综合征和睡眠时相前移综合征
哺乳动物生物钟的调谐是通过PER的光诱导建立的。光激发含有黑视蛋白的光敏性视网膜神经节细胞,这些细胞通过视网膜下丘脑(RHT)纤维向视交叉上核(SCN)发送信号。RHT发出由SCN中NMDA受体接收的谷氨酸释放信号,导致钙流入SCN。钙诱导Ca
此外,在夜间诱导体内时相变化的光脉冲与SCN中的CREB磷酸化相关(参见[Ginty,D.D.;Kornhauser,J.M.;Thompson,M.A.;Bading,H.;Mayo,K.E.;Takahashi,J.S.;Greenberg,M.E.(9April 1993).“Regulation of CREB phosphorylation in thesuprachiasmatic nucleus by light and a circadian clock.”Science.260(5105):238–241.Bibcode:1993Sci...260..238G.doi:10.1126/science.8097062.ISSN 0036-8075.PMID 8097062])。2002年Gunther Schutz进行的实验表明,缺乏Ser142磷酸化位点的突变小鼠无法响应于光脉冲而诱导生物钟调节基因mPer1。此外,这种突变小鼠难以适应光暗循环(参见[Gau,Daniel;Lemberger,Thomas;von Gall,Charlotte;Kretz,Oliver;LeMinh,Nguyet;Gass,Peter;Schmid,Wolfgang;Schibler,Ueli;Korf,Horst W.(2002年4月11日).“Phosphorylation of CREB Ser142 Regulates Light-Induced Phase Shifts ofthe Circadian Clock.”Neuron.34(2):245–253.doi:10.1016/S0896-6273(02)00656-6.PMID 11970866])。
本发明的上式1定义的化合物包含其衍生物,所述衍生物包括所有源自欧洲蕨的蕨素衍生物。所述化合物包括通过化学基团的去除、插入、非保守或保守取代或其组合而衍生的所有蕨素衍生物,只要所述化合物通过包含野生型蕨素衍生物而具有PKA激活功能即可。
蕨素衍生物是指在一个或多个化学基团上与野生型不同的化学衍生物。插入通常是通过插入约1至20个原子的连续序列来进行,但更大的插入也是可能的。去除通常是去除约1至30个原子,但也可以进行更大的去除,例如在某些情况下可以去除侧链之一。此类衍生物可以通过本领域已知的化学合成方法来制备。不完全改变分子活性的化学衍生物中的化学基团替换是本领域已知的。最常见的替换是化学基团之间的替换。
另外,在某些情况下,上式1定义的化合物可以通过磷酸化、硫酸化、丙烯酰化、糖基化、甲基化、法尼基化等进行修饰。
在本发明中,上式1定义的化合物的衍生物是表现出与天然化合物相同生物活性的功能等价物,但如果需要的话,可以是其性质被修饰以使功效最大化和副作用最小化的衍生物。优选地,其是其中通过侧链的突变和修饰而对热、pH等的结构稳定性提高、体内的吸收率增加或者生理活性提高的化合物。
上式1定义的化合物的衍生物可以通过本领域熟知的方法从包含欧洲蕨的天然来源中提取和纯化来获得。或者,由于蕨素的结构式是已知的,可以通过化学合成获得所述衍生物。当通过化学合成制备时,所述衍生物可以通过使用本领域熟知的化合物合成方法获得。
在本发明的另一个实施方案中,通过使用核磁共振(NMR)鉴定从欧洲蕨提取物中纯化的化合物的类型和化学结构(参见实施例2)。
在本说明书中,术语“药学上可接受的盐”是指对暴露于所述组合物的细胞或人而言无毒性的盐,其具有适合施用于人的安全性和功效特征。
所述盐可以以药学上可接受的碱盐或酸盐的形式使用。所述碱盐可以以有机碱盐或无机碱盐的形式使用,并且选自钠盐、钾盐、钙盐、锂盐、镁盐、铯盐、胺盐、铵盐、三乙胺盐和吡啶鎓盐。
作为酸盐,可以使用由游离酸形成的酸加成盐。无机酸和有机酸可以用作游离酸。无机酸可包括盐酸、氢溴酸、硫酸、亚硫酸、磷酸、二磷酸和硝酸。有机酸可包括柠檬酸、乙酸、马来酸、苹果酸、富马酸、葡糖酸、甲磺酸、苯磺酸、樟脑磺酸、草酸、丙二酸、戊二酸、乙酸、乙醇酸、琥珀酸、酒石酸、4-甲苯磺酸、半乳糖醛酸、扑酸、谷氨酸、柠檬酸、天冬氨酸、硬脂酸等。然而,本发明不限于这些,并且通过使用本领域常用的各种无机酸和有机酸形成的所有盐均包含在本发明内。
此外,上式1定义的化合物除了上述盐之外,还可以包含可通过常规方法制备的所有盐、水合物、溶剂化物、衍生物等。加成盐可以通过常规方法制备,通过溶解在与水混溶的有机溶剂如丙酮、甲醇、乙醇和乙腈中,并加入过量的有机碱或加入无机碱的水溶液,然后沉淀或结晶而制备。或者,可以从所述混合物中蒸发溶剂或过量的碱、然后干燥,或者可以将沉淀的盐抽滤,以制备加成盐。
本发明的药物组合物可以包含单独的上式1定义的化合物、其异构体、其衍生物、或其药学上可接受的盐,或与药学上可接受的载体一起配制为合适形式,或进一步包含赋形剂或稀释剂。在上文中,术语“药学上可接受的”是指生理学上可接受的无毒组合物,并且当施用于人体时不会引起过敏反应,例如胃肠道病症、头晕和类似反应。
药学上可接受的载体还可以包括例如用于口服施用的载体或用于肠胃外施用的载体。用于口服施用的载体可以包括乳糖、淀粉、纤维素衍生物、硬脂酸镁、硬脂酸等。此外,所述载体可以包括用于口服施用肽制剂的各种药物递送材料。另外,用于肠胃外施用的载体可以包含水、合适的油、盐水、葡萄糖水溶液和乙二醇等,并且还可以包含稳定剂和防腐剂。合适的稳定剂是抗氧化剂,例如亚硫酸氢钠、亚硫酸钠和抗坏血酸。合适的防腐剂是苯扎氯铵、对羟基苯甲酸甲酯或对羟基苯甲酸丙酯以及氯丁醇。本发明的药物组合物除了上述组分以外,还可以包含润滑剂、湿润剂、甜味剂、调味剂、乳化剂、助悬剂等。还可以提及的是本领域已知的其它药学上可接受的载体和物质。
本发明的组合物可以通过任何方法施用于包括人在内的哺乳动物。例如,它可以口服或肠胃外施用。肠胃外施用方法可包括静脉内、肌内、动脉内、髓内、鞘内、心内、经皮、皮下、腹膜内、鼻内、肠内、局部、舌下或直肠施用,但本发明不限于这些。
本发明的药物组合物可以根据上述施用途径配制成用于口服施用或肠胃外施用的制剂。
在口服施用制剂的情况下,本发明的组合物可以通过本领域已知的方法配制成粉末、颗粒剂、片剂、丸剂、糖衣片剂、胶囊剂、溶液剂、凝胶剂、糖浆剂、浆剂、混悬剂等。例如,口服制剂可以通过以下方式获得:将活性成分与固体赋形剂混合,将其研磨,向其中添加合适的助剂,并将其加工成颗粒混合物以获得片剂或糖衣片剂。合适的赋形剂的实例可包括糖(例如,乳糖、右旋糖、蔗糖、山梨醇、甘露醇、木糖醇、赤藓糖醇和麦芽糖醇)、淀粉(例如,玉米淀粉、小麦淀粉、大米淀粉和马铃薯淀粉)、纤维素(例如,纤维素、甲基纤维素、羧甲基纤维素钠和羟丙甲基纤维素)和填充剂(例如明胶和聚乙烯吡咯烷酮)。另外,如果需要,可以添加交联聚乙烯吡咯烷酮、琼脂、海藻酸或海藻酸钠作为崩解剂。此外,本发明的药物组合物还可包含抗凝剂、润滑剂、湿润剂、调味剂、乳化剂和防腐剂。
用于肠胃外施用的制剂可以通过本领域已知的方法配制成注射剂、乳膏剂、洗剂、外用软膏剂、油剂、润肤霜、凝胶剂、气雾剂和鼻吸入剂的形式。此类制剂描述于所有药剂师普遍已知的处方中。
本发明的组合物的总有效量可以以单次剂量或通过其中在长时间内施用多个剂量的分次治疗方案施用给患者。本发明的药物组合物中所含的活性成分的含量可以根据疾病的严重程度而变化。优选地,本发明的药物组合物的优选总剂量可以为每天每kg患者体重约0.01μg至10,000mg,最优选0.1μg至500mg。然而,所述药物组合物对患者的有效剂量是根据多种因素确定的,包括配制方法、施用途径和治疗次数、患者的年龄、体重、健康状况、性别、疾病的严重程度、饮食和排泄率等因素。因此,考虑到这些因素,本领域技术人员将能够确定本发明组合物的合适的有效剂量。本发明的药物组合物在其配制、施用途径和施用方法方面没有特别限制,只要它表现出本发明的效果即可。
本发明提供了用于预防或改善神经精神疾病的食品组合物,所述组合物包含由下式1定义的化合物、其异构体、其衍生物、或其药学上可接受的盐作为活性成分。
[式1]
其中:
R
由上式1定义的化合物和疾病如上所述。
本发明的包含上式1定义的化合物的食品组合物包括所有形式,例如功能性食品、营养补充剂、保健食品和食品添加剂。上述类型可以根据本领域已知的常规方法制备成各种形式。
例如,作为保健食品,本发明的食品组合物本身可以制备成茶、果汁或饮料的形式来食用,或者通过造粒、胶囊化或粉末化形式来食用。另外,本发明的食品组合物可以通过将其与已知具有减少体脂、改善胆固醇和降低血压作用的已知物质或活性成分混合而制备成组合物的形式。
此外,功能性食品可以通过将本发明的食品组合物添加到饮料(例如,酒精饮料)、水果及其加工食品(例如,罐装水果、瓶装水果、果酱和橘子酱)、鱼、肉及其加工食品(例如火腿、香肠和腌牛肉)、面包和面条(例如乌冬面、荞麦面、拉面、意大利面和通心粉)、果汁、各种饮料、饼干、太妃糖、乳制品(例如黄油和奶酪)、食用植物油、人造黄油、植物蛋白、蒸煮食品、冷冻食品及各种调味料(如大豆酱、酱油、酱汁)中而制备。
按最终制备的食品的总重量计,本发明的用于食品的组合物的优选含量优选为0.01%-50%,但本发明不限于此。为了以食品添加剂的形式使用本发明的食品组合物,所述食品组合物可以以粉末或浓缩物的形式制备和使用。
此外,本发明的食品组合物可以包含多种调味剂或天然碳水化合物作为附加组分,与常规饮料类似。所述碳水化合物包括单糖例如葡萄糖和果糖,二糖例如麦芽糖和蔗糖,多糖例如糊精和环糊精,以及糖醇例如木糖醇、山梨醇和赤藓糖醇。甜味剂的实例包括天然甜味剂如奇异果甜蛋白和甜叶菊提取物,以及合成甜味剂如糖精和阿斯巴甜。所述天然碳水化合物的比例通常可为每100mL本发明组合物约0.01至0.04g,优选约0.02至0.03g,但本发明不限于此。
本发明的赋形剂、粘合剂、崩解剂、润滑剂、矫味剂、调味剂等术语的定义描述于本领域已知的文献中,并且包括具有相同或相似功能的那些试剂。
在本发明的另一个实施方案中,将NIH3T3细胞作为正常细胞,将B16F10细胞作为癌细胞,将它们在96孔板中培养,然后将化合物2至11添加到细胞培养基中,培养并用MTT处理,使用酶标仪在550nm处测量光密度。根据测量结果计算LD50值。结果发现,每种化合物在癌细胞和正常细胞中的LD50值均较高。因此,确认了每种化合物均具有低细胞毒性(参见实施例3)。
此外,本发明提供了如下式1定义的化合物、其异构体、或其药学上可接受的盐在制备用于治疗神经精神疾病的药物中的用途:
[式1]
其中:
R
此外,本发明提供了一种治疗神经精神疾病的方法,包括向有需要的个体施用有效量的包含下式1定义的化合物、其异构体或其药学上可接受的盐的组合物:
[式1]
其中:
R
本发明的“有效量”是指当施用于个体时表现出改善、治疗、预防、检测、诊断、或抑制或减轻神经精神疾病的作用的量,并且“个体”是指动物,优选地可以是哺乳动物,尤其是包括人在内的动物,并且可以是源自动物的细胞、组织、器官等。个体可以是需要所述作用的患者。
本发明的“治疗”广泛地指改善神经精神疾病或神经精神疾病的症状,其可以包括治愈、基本上预防、或改善神经精神疾病的状况,以及减轻、治愈或预防所述疾病引起的某个症状或大部分症状,但本发明不限于此。
如本文所用,术语“包含”以与“包括”或“特征在于”相同的含义使用。本发明的组合物或方法不排除未具体提及的其它组分或方法步骤。此外,术语“由...组成”是指排除未另外描述的其它元件、步骤或组分。术语“基本上由...组成”是指除了所描述的材料或步骤之外,组合物或方法的范围内也可以包含基本上不影响其基本特征的材料或步骤。
发明的有利效果
如上所述,包含本发明提供的化合物、其异构体或其药学上可接受的盐作为活性成分的组合物表现出激活PKA和CREB的作用,因此可用于开发选自以下疾病的治疗剂:亨廷顿病、脑瘫、孤独症、注意力缺陷多动症(ADHD)、截瘫、抑郁症、药物成瘾、Rubinstein-Taybi综合征、失眠、睡眠时相延迟综合征和睡眠时相前移综合征,或用于开发改善所述疾病治疗的食品。
附图简述
图1是举例说明分离和纯化蕨素化合物及其衍生物的方法图示。
图2显示了确认蕨素化合物及其衍生物对神经元和作为脑结缔组织细胞的星形胶质细胞中的CREB磷酸化的作用结果。
图3显示了PKA的调节亚基和催化亚基。
图4显示了PKA的调节亚基的3D结构。
图5显示了蕨素A和CBD1之间的结合模型。
图6显示了蕨素A和CBD2之间的结合模型。
图7显示了蕨素A、CBD1和CBD2的表面模型。
图8显示了通过蛋白质印迹确认蕨素A、C、D和B对神经元中的CREB、脑源性神经营养因子(BDNF)和trk磷酸化的作用结果。
图9和图10是用蕨素化合物处理小鼠脑组织后观察电生理变化的结果。
图11是显示在显微镜下定量和观察用蕨素D处理后促进神经细胞(Neuron)的增殖、分化和再生的作用的图。
具体实施方式
下面通过以下实施方案对本发明进行详细描述。
但是,以下实施方案仅用于举例说明本发明,本发明并不限于此。
实验方法
实验设备
在JEOL JUM ECP-400光谱仪(Jeol,Tokyo,日本)上通过使用氘代氯仿(CDCl
使用硅胶(70-230目;Merk,Darmstadt,德国)、RP-18(40-63mm;Merk)和SephadexLH-20(20-100mm;Sigma,St.Louis,MO,美国)进行柱色谱法。通过用预包被Kiesel凝胶60F254板(0.25mm;Merck)和25RP-18F 254s板(5-10cm,Merk)进行薄层色谱(TLC)。喷雾试剂为50% H
MTT测定法
NIH3T3细胞作为小鼠成纤维细胞系,B16F10细胞作为小鼠黑色素瘤细胞系,将这些细胞以2×10
细胞增殖率(%)=OD550(样品)/OD550(对照)×100
蛋白质印迹分析
使用以下方法进行蛋白质印迹分析。将细胞在RIPA缓冲液(20mM Tris-Cl pH7.4,1mM EDTA,150mM NaCl,1% Triton X-100,1mM EGTA,1μM Na
电生理学实验
1.将4月龄小鼠的大脑置于冰冷的解剖缓冲液中,使用振动切片机制备300μm厚的矢状面海马切片(解剖缓冲液:含量以mM为单位:蔗糖、25NaHCO
2.将切片在正常ACSF中在32℃恢复1小时(ACSF:以mM为单位:125NaCl、2.5KCl、1.25NaH
3.在记录期间,将切片移至在28℃浸没于ACSF中的室中,并连续灌注用95% O
4.对于输入/输出、双脉冲比例和长时程增强(LTP)实验,使用ACSF填充的移液器(电阻:1MΩ)来测试海马。在CA1区域测量场兴奋性突触后电位(fEPSP)。使用Multiclamp700B(Molecular Devices)放大fEPSP信号,并使用Digidata 1440A(Molecular Devices)进行数字化。每20秒(LTP)或15秒(输入/输出,双脉冲比例)用填充有ACSF(0.3-0.5MΩ)的移液器刺激Schaffer侧支通路。
5.在获得稳定的基线信号以诱导LTP后,对其进行θ爆发刺激(40个脉冲列,每列包含4个100Hz的刺激;40个脉冲列分为4个爆发刺激,每个脉冲列包含具有1秒爆发间隔的电刺激的10个脉冲列;在这10个脉冲列内,有170ms时间的列间间隔)。以25、50、75、100、200和300ms的间隔给予双刺激后测量双脉冲比例。
6.为了分析药物A(蕨素A)/C(蕨素C)/X(药物X,amx,一种磷酸二酯酶(PDE)抑制剂)对突触性质的药理作用,将每种药物以1000倍的原液浓度溶解于DMSO中,施用以使在ACSF中的浓度分别为10μM(X)和1μM(A/C)。使用与实验药物相同体积的DMSO作为对照药物。
实施例1:蕨素化合物及其衍生物的纯化
使用乙酸乙酯提取欧洲蕨的热水提取物并分离成7个流分,使用HPLC从每个流分中分离出蕨素化合物。
具体而言,将在京畿道加平郡(Gapyeong-gun,Gyeonggi-do)采集的200-250g欧洲蕨洗净,放入蒸煮容器(OSK-2002,Dr.Red Ginseng,Well sosanaTM,DaewoongPharmaceutical)中,加入1.5L水,蒸煮24小时,再加入3.5L水并熟化72小时,将冷藏的混合物用作热水提取物。
向所述热水提取物中加入等体积的乙酸乙酯(EA)并充分混合后,将EA层用旋转蒸发器干燥并用作EA提取物。
将EA提取物溶解在最少量的DMSO中,然后用水稀释。此时,稀释倍数为稀释至所述热水提取物原始体积的70%,假设产率为约70%。
使用硅胶柱色谱在氯仿(CHCl
实施例2:化合物2-11的蕨素化合物及其衍生物的鉴定
为了鉴定实施例1中纯化的每种化合物,从EA流分中分离出单一化合物,然后通过在实验方法中描述的核磁共振(NMR)方法鉴定化合物的类型和化学结构。在欧洲蕨提取物中鉴定的各化合物的结构和名称如下表1所示,具体的NMR分析结果如下表2所示。
[表1]
化合物的名称
/>
[表2]
化合物2至11的
a
实施例3:蕨素化合物的细胞毒性评估(MTT测定法)
为了确认实施例2的化合物2至11对细胞表现毒性作用,进行了以下实验。
如实验方法中所述,将作为正常细胞的小鼠胚胎成纤维细胞系(NIH3T3)和作为癌细胞的小鼠黑色素瘤细胞系(B16F10)在96孔板中培养,并将每种化合物以各种浓度加入细胞培养基中并培养48小时,然后施用MTT,使用酶标仪在550nm处测量光密度。光密度是表示存活细胞数的指标,通过下式计算,并通过3次实验确认了重现性。
细胞增殖率(%)=OD550(样品)/OD550(对照)×100
然后,根据细胞增殖率的变化计算LD50(半数致死剂量)值。
结果,如表3所示,化合物6在癌细胞中的LD50值为最低的522±25μM,化合物2在正常细胞中的LD50值为3,110±130μM,化合物3在正常细胞中的LD50值为553±37μM,发现化合物3在癌细胞中的LD50值为618±71μM。除此之外,发现其它化合物在正常细胞和癌细胞中的LD50值均大于5000μM。
因此,证实化合物3具有弱细胞毒性,化合物6仅在癌细胞中具有弱细胞毒性,并且化合物2、4、5、7至11在正常细胞和癌细胞中几乎没有细胞毒性。
[表3]
蕨素化合物的细胞毒性作用
实施例4:PKA的cAMP结合位点的刚性对接实验
进行实验以预测蕨素化合物或其衍生物的PKA结合模型。
对于这个实验,使用Schrodingr's MAESTRO软件,通过使用配体对接和诱导拟合对接方法测量蛋白质与药物(蕨素A)之间的结合。PKA调节亚基的cAMP结合结构域(CBD)是两个位点(即CBD1和CBD2),测定了与每个位点的结合(参见图3),结果表明,在CBD1和CDB2处测定的对接评分分别为-8.307和-9.808,从而证实蛋白质-药物结合非常稳定(参见表4)。
[表4]
实施例5:用于测量CREB磷酸化水平的蛋白质印迹
如图2所示,在蕨素的五边形环底部具有-OH基团作为侧链的蕨素衍生物,例如蕨素A、C和D,在神经元中在10μM时使磷酸二酯酶(PDE)显著增加至高于作为阳性对照的磷酸二酯酶(PDE)抑制剂amx的水平。
另一方面,蕨素衍生物例如蕨素B、P和Z,其五边形环底部侧链中不具有-OH基团,在10μM时完全不增加CREB磷酸化。
在大脑的结缔组织细胞星形胶质细胞中,在蕨素五边形环底部的侧链上具有-OH基团的蕨素衍生物如蕨素A、C和D和在蕨素五边形环底部的侧链上不具有-OH的蕨素衍生物如蕨素B、P和Z对CREB磷酸化均没有影响。
随后,通过蛋白质印迹证实了蕨素A、C、D和B对神经元中CREB、BDNF和trk磷酸化的影响。
结果表明,如图8所示,当比较在五边形环底部侧链带有-OH基团的蕨素衍生物与所述侧链不含-OH基团的蕨素B时,蕨素A、C和D通过PKA活化在统计学上显著增加了CREB的磷酸化。因此,证实了具有-OH基团的衍生物增加BDNF,BDNF是脑源性神经营养因子,用作认知障碍中最重要的靶点之一,使得蕨素激活PKA-CREB-BDNF信号传导途径,从而显示出减轻学习和记忆障碍的功效。
实施例6:电生理学实验
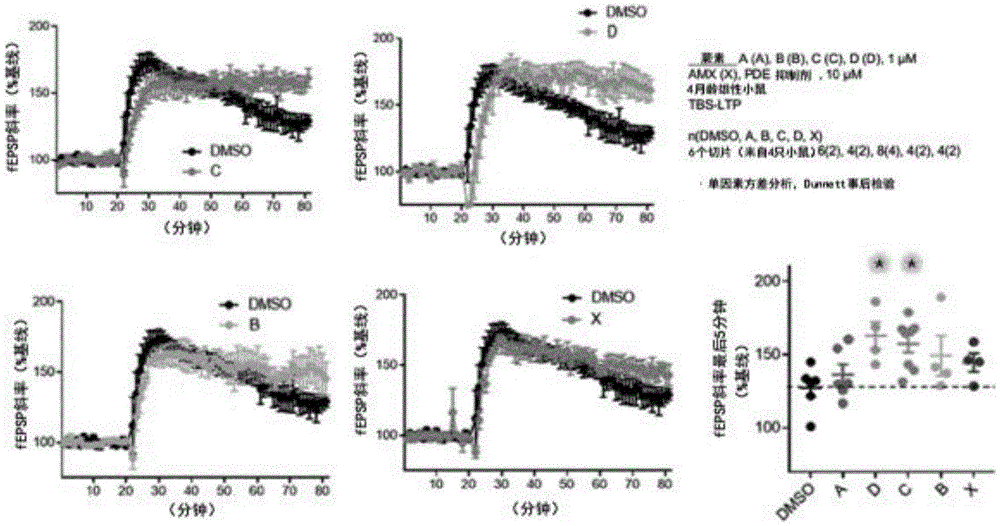
参照海马体切片的电生理学实验结果,通过测试物质的处理,正常的突触传递没有发生特别的变化(图9)。然而,已证实,海马苔藓纤维-CA1 LTP(一种负责长期记忆的脑组织)通过蕨素化合物处理得到增强,并且使用蕨素C和D的这种效果特别强(图10)。
实施例7:促进神经元增殖、分化和再生能力
评估了蕨素化合物促进神经细胞增殖、分化和再生的能力。
如图11所示,用蕨素D处理的神经细胞长度显著长于对照组,证实出现了促进神经细胞增殖和分化的效果。
实施例8:血脑屏障透过性评估
根据以下方法评估在上述实施例中表现出最佳活性的化合物之一的蕨素D的血脑屏障通透性。黄体酮用作阳性对照,雷尼替丁作为阴性对照:
(1)将pH 7.4的供体缓冲液分配至深孔板并与测试物质混合。
(2)将供体缓冲液以150μl/孔分配至紫外板中,测定光密度:空白值。
(3)将在深孔板中的混合物以150μl/孔分配至紫外板中,然后测量光密度:空白值。
(4)将200μl步骤1)中的混合物分配至Stirwell PAMPA夹心试验供体板中。
(5)将Stirwell PAMPA夹心试验受体板的膜用5μl的BBB-1-脂质包被。
(6)将脑浸没缓冲液(brain sink buffer)以200μl/孔分配至受体板上每个孔中。
(7)将受体板和供体板合并,在25℃下温育4小时。
(8)温育4小时后,分离受体板和供体板,将每孔150μl转移至紫外板,并测量光密度。
通透性评估标准如下表5所示:
[表5]
蕨素D和对照组的BBB通透性评估结果如下表6所示:
[表6]
-P
工业实用性
如上所述,本发明提供的包含蕨素化合物及其衍生物作为活性成分的用于预防或治疗疾病的组合物具有激活PKA和CREB的作用,因此可用于开发用于抑郁症、药物成瘾、Rubinstein-Taybi综合征、失眠、睡眠时相延迟综合征和睡眠时相前移综合征、脑瘫、孤独症、注意力缺陷多动症(ADHD)和截瘫的治疗剂,或用于改善所述疾病的食品。因此,本发明的组合物的工业实用性非常优异。
- 用于预防和/或治疗哺乳动物的焦虑症及相关病症的包含益生菌的营养组合物
- 用于预防和/或治疗哺乳动物的焦虑症及相关病症的包含益生菌的营养组合物
- 一种取代的含硼的化合物及包含该化合物的药物组合物
- 环氧化合物、包含该环氧化合物的固化性组合物以及使固化性组合物固化得到的固化物
- 包含作为活性成分的蕨素化合物及其衍生物的组合物,用于预防或治疗退行性脑疾病
- 苯甲酰胺衍生物化合物、其制备方法、和包含其作为活性成分的用于预防或治疗炎性疾病的药物组合物
