一种降低游离多糖含量的多糖蛋白结合疫苗制备方法
文献发布时间:2024-04-18 19:58:53
技术领域
本发明涉及疫苗制备技术领域,尤其涉及一种降低游离多糖含量的多糖蛋白结合疫苗制备方法。
背景技术
由致病性细菌引起的疾病,如b型流感嗜血杆菌(Hib)、肺炎链球菌和脑膜炎奈瑟菌仍然是非常严重,给许多国家带来了不小的疾病负担。多糖结合疫苗已被证明在预防此类疾病方面具有非常好的效果。多糖结合疫苗提高了多糖抗原的免疫原性,解决了多糖疫苗不能在2岁以下婴儿中有效应用的问题,极大地促进了该类疫苗的发展。
目前,全球常见结合疫苗的结合路线主要有2种方式。第1种方式即采用CNBr或则CDAP活化多糖,使用ADH为连接剂,在EDAC的催化下与载体蛋白(TT、DT或CRM197)连接;第二种方式即采用NaIO4等氧化剂氧化多糖形成醛基,然后直接与蛋白形成席夫碱,或则与活化的蛋白形成席夫碱,再用NaBH3CN还原。
结合疫苗在结合过程中也会存在一些问题,如采用ADH作连接剂时,多糖在衍生过程中,会自身偶联,形成多糖-ADH-多糖衍生物。随着疫苗中游离多糖含量的增加,其免疫原性会明显下降,这是因为游离多糖会与B细胞上的抗原识别受体竞争性的结合而抑制结合物中多糖与B细胞结合,形成免疫无应答状态。由于游离多糖在结合疫苗中很难除去,所以结合疫苗中游离多糖的含量,成为了疫苗质量中的重要考察指标,
为此,我们设计一种降低游离多糖含量的多糖蛋白结合疫苗制备方法,用于对上述技术问题提供另一种技术方案。
发明内容
基于此,有必要针对上述技术问题,提供一种降低游离多糖含量的多糖蛋白结合疫苗制备方法,用于解决上述背景技术中提出的技术问题。
为了解决上述的技术问题,本发明采用了如下技术方案:
一种降低游离多糖含量的多糖蛋白结合疫苗制备方法,步骤如下:
S1:对多糖原液经进行超声解聚,得到合适分子量大小的多糖溶液;
S2:在S1得到的多糖溶液中加入0.2M NaOH溶液,再加入等质量的CDAP,进行活化;
S3:对S2步骤得到的活化液中加入带Boc保护基的linker-Boc-NH-PEG4-CH
S4:对S3步骤得到的多糖-linker-Boc化合物用正相分析柱进行制备;
S5:收集制备液,进行浓缩;
S6:对S5步骤得到的样品,加入PBS缓冲液,调节pH为6.0后,加入蛋白溶液,当蛋白溶液终浓度为4~6mg/ml,加入催化剂DMTMM,让DMTMM的终浓度为0.5mol/L,在25℃下反应4h,生成多糖-蛋白结合物;
S7:S6步骤得到的多糖-蛋白结合物用分子筛进行纯化。
作为本发明提供的所述的一种降低游离多糖含量的多糖蛋白结合疫苗制备方法的一种优选实施方式,所述S2步骤中,在S1得到的多糖溶液中加入0.2M NaOH溶液,再加入等质量的CDAP,进行活化,步骤如下:
在S1得到的多糖溶液中加入0.2M NaOH溶液,并调节pH值范围为9.0~10.0;
加入等质量的CDAP,让CDAP浓度为0.1mol/L,在25℃下活化3min。
作为本发明提供的所述的一种降低游离多糖含量的多糖蛋白结合疫苗制备方法的一种优选实施方式,所述S3步骤中,对S2步骤得到的活化液中加入带Boc保护基的linker-Boc-NH-PEG4-CH
对S2步骤得到的活化液中加入带Boc保护基的linker-Boc-NH-PEG4-CH
对样品超滤,除去未反应的小分子杂质。
作为本发明提供的所述的一种降低游离多糖含量的多糖蛋白结合疫苗制备方法的一种优选实施方式,所述S4步骤中,对S3步骤得到的多糖-linker-Boc化合物用正相分析柱进行制备,步骤如下:
利用多糖-linker-Boc和多糖分子的极性不同,将不带Boc保护基的多糖分离出来。
作为本发明提供的所述的一种降低游离多糖含量的多糖蛋白结合疫苗制备方法的一种优选实施方式,所述S5步骤中,收集制备液,进行浓缩,步骤如下:
加入0.2M NaOH溶液,并调节pH值范围为9.0~10.0,反应12h,将Boc保护基脱掉。
可以毫无疑义的看出,通过本申请的上述的技术方案,必然可以解决本申请要解决的技术问题。
同时,通过以上技术方案,本发明至少具备以下有益效果:
本发明提供的一种降低游离多糖含量的多糖蛋白结合疫苗制备方法,通过方法的改进,能够多次过滤去除未反应的小分子等杂质,并通过分子筛对生成的多糖-蛋白结合物用纯化,来根据结合物分子量大小不同,收集符合药典要求的结合物。
附图说明
为了更清楚地说明本发明实施例技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
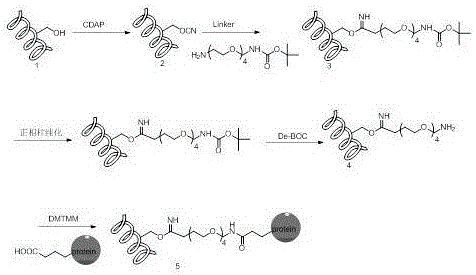
图1为本发明的分子示意图;
图2为本发明的正相柱制备多糖示意图;
图3为本发明的分子筛纯化多糖蛋白结合物示意图。
实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
为了使本技术领域的人员更好地理解本发明方案,下面将结合附图,对本发明实施例中的技术方案进行清楚、完整地描述。
需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征和技术方案可以相互组合。
应注意到:相似的标号和字母在下面的附图中表示类似项,因此,一旦某一项在一个附图中被定义,则在随后的附图中不需要对其进行进一步定义和解释。
参照图1-图3,一种降低游离多糖含量的多糖蛋白结合疫苗制备方法。
采用ACYW135群脑膜炎球菌多糖为例(包括但不限于ACYW135群和24型肺炎多糖),采用一种特殊的化学linker,Boc-NH-PEG4-CH
然后将多糖-linker连接物的BOC保护基脱掉,与CRM197(包含但不限于DT、TT、CRM197)进行结合形成多糖蛋白结合疫苗。
先将代表性多糖采用超声解聚后,得到理论分子量。
向解聚后一定浓度的多糖溶液中加入CDAP(N-氰-4-二甲氨基-吡啶四氟硼酸盐),活化多糖,具体为:
在解聚的多糖溶液中加入0.2M NaOH溶液,并调节pH值范围为9.0~10.0,加入等质量的CDAP(N-氰-4-二甲氨基-吡啶四氟硼酸盐),使CDAP浓度为0.1mol/L,在25℃下活化3min。
向活化后的多糖中加入linker-Boc-NH-PEG4-CH
将形成的多糖-linker-Boc中间品用正相极性柱进行制备,由于Boc保护基是大极性分子,连接在多糖上面后,会将多糖极性增大。此时样品中的多糖-linker-Boc和游离多糖极性会有明显差别,在流动相的冲洗下,极性不同的物质会先后流出,这样就会将游离多糖分离。如图2所示
然后加入0.2M NaOH溶液,并调节pH值范围为9.0~10.0,反应12h,将制备后的多糖-linker-Boc样品脱去Boc保护基,将结合位点的氨基裸露出来。然后将样品超滤,除去未反应的小分子等杂质,
加入PBS缓冲液,调节pH为6.0。然后加入准备好的蛋白溶液,使蛋白溶液终浓度为4~6mg/ml,向脱去保护的多糖-linker连接物中加入蛋白,然后加入催化剂DMTMM(4-(4,6-二甲氧基三嗪-2-基)-4-甲基吗啉盐酸盐),形成多糖-蛋白结合物,使DMTMM的终浓度为0.5mol/L,在25℃下反应4h,然后将样品超滤,除去未反应的小分子等杂质。将多糖蛋白结合物用分子筛进行纯化,将符合质量要求的大分子结合物分离出来。这样经过两次纯化,就会得到游离多糖含量很低,根据结合物分子量大小不同,收集符合药典要求的结合物,而且原液中只要多糖-蛋白结合物的疫苗。如图3所示。
以上公开的本发明优选实施例只是用于帮助阐述本发明。优选实施例并没有详尽叙述所有的细节,也不限制该本发明仅为所述的具体实施方式。显然,根据本说明书的内容,可作很多的修改和变化。本说明书选取并具体描述这些实施例,是为了更好地解释本发明的原理和实际应用,从而使所属技术领域技术人员能很好地理解和利用本发明。本发明仅受权利要求书及其全部范围和等效物的限制。
- 一种猪巴氏杆菌多糖蛋白偶联疫苗及其制备方法
- 一种脑膜炎球菌多糖结合疫苗成品各群游离多糖含量的测定方法
- 一种脑膜炎球菌多糖结合疫苗成品各群游离多糖含量的测定方法
