双取代苯环的多羟基锍鎓盐类衍生物及其制备方法和医药用途
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及化学合成领域,具体涉及一类双取代苯环的多羟基锍鎓盐类衍生物及其制备方法和医药用途。
背景技术
五层龙属植物Salacia来源于锍鎓盐结构的化合物,结构式如下,具有与市售α-葡萄糖苷酶抑制剂类降糖药相当的降糖活性,研究人员对其构效关系进行研究,以期望发现一类结构全新的候选降糖药。
以neoponkoranol为先导化合物,在多羟基侧链的C-3’,C-5’引入苯叉基醛缩醇结构,得到双位点修饰的衍生物是一种有效的修饰方法。
在C-3',C-5'羟基引入疏水的苯亚甲基利于该类型化合物蔗糖酶抑制活性的增加,并且在苯环邻位连接有强吸电子基的修饰会提高化合物的α-葡萄糖苷酶抑制活性。其中化合物Ⅱe酶抑制活性最高(IC
在C-3',C-5'羟基引入疏水的苯亚甲基利于该类型化合物蔗糖酶抑制活性的增加,并且在苯环连接不同取代基会影响化合物的α-葡萄糖苷酶抑制活性,表明取代基的类型和位置对化合物的活性和降糖效果有重要影响。目前,单取代苯环的锍鎓盐类衍生物的酶抑制活性仍在μM级别,体内稳定性也有大幅提升的必要性。
发明内容
发明目的:针对现有技术存在的问题,本发明提供了一类新型的锍鎓盐类衍生物,合成了双取代苯环的锍鎓盐类衍生物,根据酶实验,本发明的化合物具有优异的α-葡萄糖苷酶抑制活性,比单取代苯环的硫鎓盐衍生物具有更强的降糖的潜力,选取部分小分子抑制剂进行小鼠体内降糖活性测试,结果表明候选化合物也具有强于临床同类药物和天然产物本身的降低餐后血糖的活性。本发明所保护的是一系列在苯亚甲基上进行双位点取代的多羟基锍鎓盐类似物,旨在进一步优化衍生物对α-葡萄糖苷酶的抑制活性,同时丰富了小分子抑制剂的结构类型。
本发明还提供了所述锍鎓盐类衍生物的制备方法以及其医药用途。
技术方案:为了实现上述目的,本发明所述如通式(I)所示的锍鎓盐类衍生物,
其中R
R
R
X选自氯离子,溴离子,三氟乙酸根离子,乙酸根离子,硫酸氢根离子或者磷酸二氢根等常见有机或无机阴离子。
作为优选,所述锍鎓盐类衍生物或者药学上可接受的盐选自如下任意一种化合物:
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,3-二氯苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰa);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,4-二氯苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰb);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,5-二氯苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰc);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,6-二氯苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰd);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(3,4-二氯苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰe);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(3,5-二氯苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰf);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,3-二氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰg);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,4-二氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰh);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,5-二氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰi);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,6-二氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰj);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(3,4-二氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰk);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(3,5-二氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰl);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2-氯-3-氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰm);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2-氯-4-氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰn);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2-氯-5-氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰo);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2-氯-6-氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰp);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(3-氯-4-氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰq);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(3-氯-5-氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰr);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2-氯-4-溴苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰs);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2-三氟甲基-6-氯苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰt);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,6-二甲氧基苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰu);
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2-氯-6-甲氧基苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰv);
本发明所述的锍鎓盐类衍生物或者药学上可接受的盐的制备方法,包括以下步骤:
a)阿拉伯糖醇与苯甲醛和HCl气体反应形成1,3-二亚苄基保护的阿拉伯糖醇;
b)在二丁基氧化锡的催化下与对甲苯磺酰氯缩合形成5-对甲苯磺酰基保护的5-对甲苯磺酰基-1,3-O-苯亚甲基-D-阿拉伯糖醇;
c)经三氟乙酸水溶液催化后脱去亚苄基形成5-对甲苯磺酰基-D-阿拉伯糖醇;
d)在酸催化下,用不同取代苯甲醛保护5-对甲苯磺酰基-D-阿拉伯糖醇得到苯亚甲基的苯环上有不同取代的5-对甲苯磺酰基-1,3-O-苯亚甲基-D-阿拉伯糖醇衍生物;
e)权利要求d)中的阿拉伯糖醇衍生物在碱的作用下生成作为关键偶合片段的系列环氧化合物4,5-脱水-1,3-O-苯亚甲基-D-阿拉伯糖醇衍生物;
f)随后以乙腈为反应溶液,在三氟乙酸的催化下与硫糖片段在-20℃至室温下进行偶合反应,随后经过氯离子交换树脂的处理得到目标化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-邻甲基苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物;
其中,步骤a)中的反应溶剂为DMF,反应时间为12-24h,投料温度为0℃,反应温度为室温。步骤b)中的反应溶剂为THF,反应时间为8-12h,投料温度为0℃,反应温度为室温。步骤c)中的反应溶剂为THF或DCM,反应时间为6-12h,反应温度为室温。步骤d)中的反应溶剂为MeCN,酸为对甲基苯磺酸、反应时间为12-24h,反应温度为室温。步骤d)中的取代苯甲醛为2,3-二氯苯甲醛,2,4-二氯苯甲醛,2,5-二氯苯甲醛,2,6-二氯苯甲醛,3,4-二氯苯甲醛,3,5-二氯苯甲醛,2,3-二氟苯甲醛,2,4-二氟苯甲醛,2,5-二氟苯甲醛,2,6-二氟苯甲醛,3,4-二氟苯甲醛,3,5-二氟苯甲醛,2-氯-3-氟苯甲醛,2-氯-4-氟苯甲醛,2-氯-5-氟苯甲醛,2-氯-6-氟苯甲醛,3-氯-4-氟苯甲醛,3-氯-5-氟苯甲醛,2-氯-4-溴苯甲醛,2-三氟甲基-6-氯苯甲醛,2,6-二甲氧基苯甲醛,2-氯-6-甲氧基苯甲醛。步骤e)中的溶剂为DCM,碱为1,8-二氮杂二环十一碳-7-烯(DBU)、无水碳酸钾,反应温度为室温,反应时间为的4-15h。步骤g)中的反应溶剂为二氯甲烷或乙腈,反应试剂为三氟乙酸,反应温度为20-40℃,反应时间为12-48小时。
本发明所述的锍鎓盐类衍生物或者药学上可接受的盐在制备鋶鎓盐型α-葡萄糖苷酶抑制剂中的应用。
本发明所述的锍鎓盐类衍生物或者药学上可接受的盐在制备降低血糖药物中的应用。
有益效果:与现有技术相比,本发明具有如下优点:
1、本发明通过生物电子等排体原理,设计了一类新型的锍鎓盐类衍生物,制备的产率比单取代苯环的硫鎓盐类化合物高,耐酸性强。
2、本发明所涉及锍鎓盐类化合物相比于单取代苯环的硫鎓盐类化合物具有更强的α-葡萄糖苷酶抑制活性,可以作为鋶鎓盐型α-葡萄糖苷酶抑制剂,该类分子具有降血糖活性。
本发明的化合物主要由D-阿拉伯糖醇为原料,经过多步反应得到具有α-葡萄糖苷酶抑制活性的鋶鎓盐类衍生物分子。本发明的化合物结构简单,设计巧妙,原料便宜易得,合成工艺安全、环保,易于规模化生产,易于制备且成本低廉。
附图说明
图1为一类鋶鎓盐型α-葡萄糖苷酶抑制剂的制备方法。
图2为糖负荷后曲线下面积-时间图。
具体实施方式
下面结合具体实施例对本发明作出详细说明。
实施例1
5-对甲苯磺酰基-1,3-O-苯亚甲基-D-阿拉伯糖醇的制备
将化合物10(购买于江苏试剂网,品牌为Adamas)(612mg,2.0mmol)溶解于DMF(10mL)溶液中,加入适量的HCl气体和对甲苯磺酸(50mg);将反应混合物在室温下搅拌24h,反应混合物用三乙胺中和。将反应混合物减压浓缩,所得残渣在硅胶上用柱层析纯化,得到淡黄色油状液体11,收率为61%。
将化合物11(2.0mmol)置于二氯甲烷中呈混悬状,在冰浴条件下依次加入对甲基苯磺酰氯(0.22mmol)、TEA(0.22mmol)、二丁基氧化锡(0.22mmol)。在室温条件下搅拌12-18h,反应完成后,加入冰水淬灭反应,二氯甲烷萃取,水洗,饱和食盐水洗,无水硫酸钠干燥有机层,浓缩,经柱层析(分离得到化合物淡黄色油状液体12(0.18mmol,70%)。[α]
实施例2
5-对甲苯磺酰基-D-阿拉伯糖醇的制备
取化合物12(788mg,2.0mmol)溶于DCM(100mL))溶液,加入30% TFA水溶液(500mL),室温搅拌4h-8h,将反应混合物减压浓缩,在硅胶上用柱层析纯化得到白色固体化合物13(0.37mmol,74%)。m.p.110-111℃。[α]
实施例3
5-对甲苯磺酰基-1,3-O-(2,3-二氯苯亚甲基)-D-阿拉伯糖醇的制备
将化合物13(612mg,2.0mmol)溶解于MeCN(10mL)溶液中,加入2,3-二氯苯甲醛(3.0mmol)和对甲苯磺酸(50mg);将反应混合物在室温下搅拌24h,反应混合物用三乙胺中和。将反应混合物减压浓缩,所得残渣在硅胶上用柱层析纯化,得到淡黄色油状液体14,收率为61%。
[α]
实施例4
4,5-脱水-1,3-O-(2,3-二氯苯亚甲基)-D-阿拉伯糖醇的制备
在氩气保护下,将1,8-二氮杂二环[5.4.0]十一碳-7-烯(2.5mL)加入到14(2.0mmol)的DCM(10mL)溶液中,温度为0℃。在室温下搅拌2h,减压浓缩反应混合物,所得残渣在硅胶上用柱层析纯化,得到淡黄色油状化合物15,收率为85%。[α]
实施例5
1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,3-二氯苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物的制备
在氩气保护下,4.0mL无水乙腈中分别加入三氟乙酸(0.36mmol),化合物15(0.4mmol)和硫糖9(0.36mmol),-20℃搅拌10min后,放至室温再搅拌8h,减压浓缩反应混合物。得到的残渣在甲醇中溶解,加入强碱性阴离子交换树脂(Cl
实施例6
将实施例3中的2,3-二氯苯甲醛换成2,4-二氯苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,4-二氯苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰb)。
将实施例3中的2,3-二氯苯甲醛换成2,5-二氯苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,5-二氯苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰc)。
将实施例3中的2,3-二氯苯甲醛换成2,6-二氯苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,6-二氯苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰd)。
将实施例3中的2,3-二氯苯甲醛换成3,4-二氯苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(3,4-二氯苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰe)。
将实施例3中的2,3-二氯苯甲醛换成3,5-二氯苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(3,5-二氯苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰf)。
将实施例3中的2,3-二氯苯甲醛换成2,3-二氟苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,3-二氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰg)。
将实施例3中的2,3-二氯苯甲醛换成2,4-二氟苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,4-二氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰh)。
将实施例3中的2,3-二氯苯甲醛换成2,5-二氟苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,5-二氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰi)。
将实施例3中的2,3-二氯苯甲醛换成2,6-二氟苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,6-二氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰj)。
将实施例3中的2,3-二氯苯甲醛换成3,4-二氟苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(3,4-二氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰk)。
将实施例3中的2,3-二氯苯甲醛换成3,5-二氟苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(3,5-二氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰl)。
将实施例3中的2,3-二氯苯甲醛换成2-氯-3-氟苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2-氯-3-氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰm)。
将实施例3中的2,3-二氯苯甲醛换成2-氯-4-氟苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2-氯-4-氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰn)。
将实施例3中的2,3-二氯苯甲醛换成2-氯-5-氟苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2-氯-5-氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰo)。
将实施例3中的2,3-二氯苯甲醛换成2-氯-6-氟苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2-氯-6-氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰp)。
将实施例3中的2,3-二氯苯甲醛换成3-氯-4-氟苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(3-氯-4-氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰq)。
将实施例3中的2,3-二氯苯甲醛换成3-氯-5-氟苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(3-氯-5-氟苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰr)。
将实施例3中的2,3-二氯苯甲醛换成2-氯-4-溴苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2-氯-4-溴苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰs)。
将实施例3中的2,3-二氯苯甲醛换成2-三氟甲基-6-氯苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2-三氟甲基-6-氯苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰt)。
将实施例3中的2,3-二氯苯甲醛换成2,6-二甲氧基苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2,6-二甲氧基苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰu);
将实施例3中的2,3-二氯苯甲醛换成2-氯-6-甲氧基苯甲醛,其余反应步骤与其他实施例1、2、4、5保持一致即可得到化合物1,4-二脱氧-1,4-[(R)-(5-脱氧-1,3-O-(2-氯-6-甲氧基苯亚甲基-D-阿拉伯糖醇-5-基)硫代亚基]-D-阿拉伯糖醇氯化物(Ⅰv)。
实施例7
一类鋶鎓盐型α-葡萄糖苷酶抑制剂的酶活性测试实验
α-葡萄糖苷酶是糖苷水解酶大家族中的一大类酶,主要功能为水解葡萄糖苷键,释放出葡萄糖作为产物。包含麦芽糖酶,蔗糖酶等。本发明选取蔗糖和麦芽糖为底物,测定化合物对麦芽糖酶和蔗糖酶的IC
称取表1中的化合物作为待试衍生物1mg,用0.1mol/L,pH值为6.8的磷酸缓冲溶液配置成1mM的溶液,梯度稀释成1*10
取25μLα-葡萄糖苷酶液,经考马斯蓝法测定蛋白液后,将50μL底物(蔗糖和麦芽糖),25μLα-葡萄糖苷酶液和25μL上述不同梯度的样品混合,37℃孵育30min,用沸水淬灭酶催化反应,通过葡萄糖氧化酶-过氧化物酶法测定生成葡萄糖的量,采用SPSS probit回归模型计算出化合物的IC
表1部分目标产物的IC
其中,1-5是现有文献公开的该类锍鎓盐,6为临床伏格列波糖,7是临床阿卡波糖,8为临位三氟甲基单取代苯环的硫鎓盐衍生物,与本发明衍生物在相同条件下测定活性。
由表1可知,本发明制备的其中绝大多数化合物对蔗糖酶和麦芽糖酶的抑制活性远强于临床使用的α-葡萄糖苷酶抑制剂类药物阿卡波糖和伏格列波糖,显示该类小分子化合物具有的降血糖活性,化合物Ⅰg,Ⅰt的酶抑制活性远远强于临位三氟甲基单取代苯环的硫鎓盐化合物,可用于预防和治疗糖尿病,是一类潜在的降糖候选药物分子。
实施例8
口服蔗糖耐量实验
正常雄性ICR小鼠(30-35g),禁食过夜,测定体重及空腹血糖,根据体重和血糖分成8组,每组8只,分别为:
空白对照组:0.17g/ml蔗糖6ml+双蒸水2ml;
阳性对照组:0.17g/ml蔗糖6ml+4mg/ml acarbose 2ml;
Ⅰg 10mg/kg组:0.17g/ml蔗糖6ml+2mg/mlⅠg 2ml;
Ⅰt10mg/kg组:0.17g/ml蔗糖6ml+2mg/mlⅠt 2ml;
Ⅰg 1mg/kg组:0.17g/ml蔗糖6ml+0.2mg/mlⅠg 2ml;
Ⅰt 1mg/kg组:0.17g/ml蔗糖6ml+0.2mg/mlⅠt 2ml。
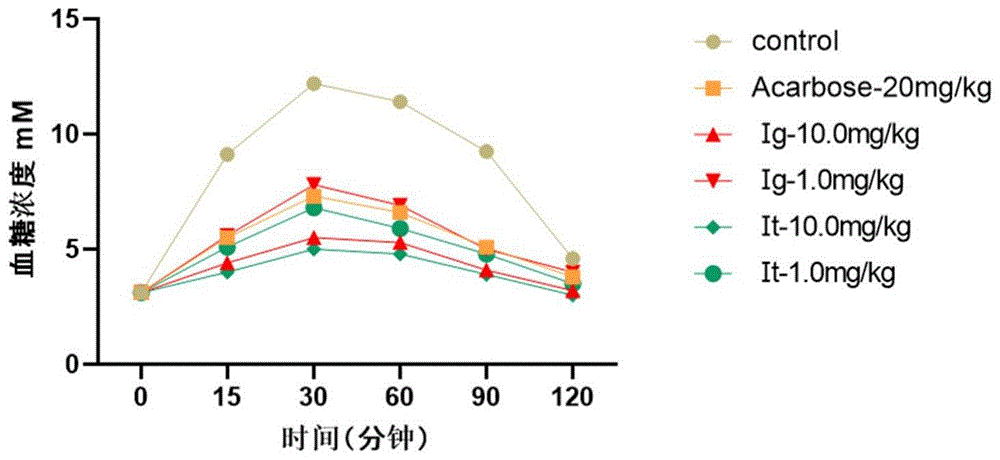
各组动物口服上述蔗糖与不同浓度药物的混合物后,给药15,30,60,90,120min测定血糖值,如图2所示,并计算了15,30,60,120min血糖下降水平和糖负荷后曲线下面积如表2所示。
表2
在蔗糖耐量实验中,发现化合物Ⅰg、Ⅰt在1mg/kg的剂量下均可有效降低正常小鼠的餐后血糖水平。通过对比Ⅰg、Ⅰt的降糖效果和阳性药acarbose的降糖效果,可以发现10.0mg/kgⅠg、Ⅰt比20.0mg/kg acarbose有着更强的降糖效果,1.0mg/kgⅠg、Ⅰt的降糖效果与20.0mg/kg剂量的acarbose降糖类似,Ⅰt比Ⅰg有着更强的体内降糖活性。这提示化合物Ⅰt具有良好的餐后降血糖作用,可以作为治疗糖尿病,预防糖尿病并发症的潜在候选药物。
- MFG-E8在制备用于选择性调控淀粉样蛋白诱导的小胶质细胞极化的药物中的应用
- 刺五加苷B在制备预防或治疗急性肾损伤的药物中的应用
- Dpdtp A在制备预防或治疗Tau蛋白聚集所致小胶质细胞损伤性疾病药物中的应用
- CXCL16蛋白及其单克隆抗体在制备预防和/或治疗肠道损伤性疾病的药物中的应用
