一种驼源重链抗体或抗原结合片段及应用
文献发布时间:2024-04-18 20:00:50
技术领域
本发明属于生物医药领域,具体涉及一种驼源重链抗体或抗原结合片段及应用。
背景技术
1.羊驼纳米抗体的特点
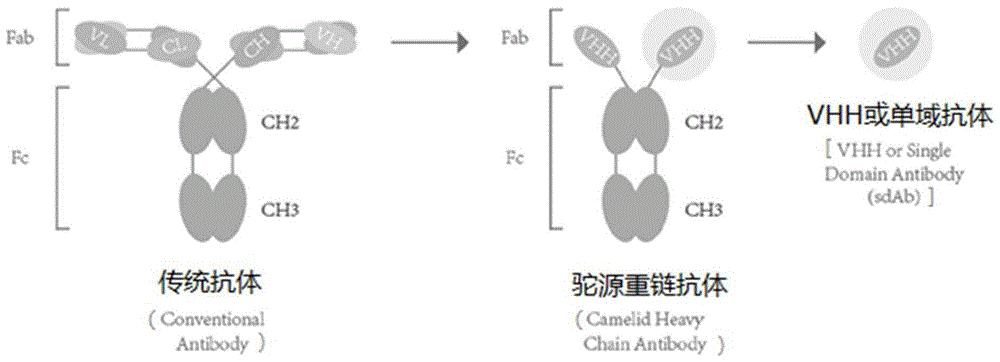
纳米抗体是天然缺失重链,只含有重链可变区的单域抗体,经典抗体分子(IgG)是由两条重链和两条轻链组成,轻链包含1个VL区和1个CL区,重链包含1个 VH区和3个CH区(CH1、CH2和CH3),轻链和重链的VH区和VL区构成抗体识别抗原的可变区(Fv),CL区和CH区称为抗体的恒定区,对抗体招募免疫细胞发挥ADCC和CDC至关重要。如图1,仅由重链的重链可变区(variable domain of heavy chain of heavy-chain,VHH)构成,可识别结合抗原,也可单独稳定地在体外存在的小抗体,被称为单域抗体(single domain antibody,sdAb)或者纳米抗体 (nanobody,Nb)或VHH抗体。纳米抗体具有完整的抗原识别能力。
羊驼纳米抗体于1993年首次被比利时布鲁塞尔自由大学的免疫学家Hamers-Casterman报到,这种新型抗体不仅存在于单峰驼,也在于其他骆驼科动物——双峰驼、美洲驼、羊驼、骆马和小羊驼。这种抗体天然缺失轻链,又被称为单域重链抗体,与普通抗体相比,驼源重链抗体除了缺少轻链之外,其重链可变区与铰链区之间没有CH1(conventionalregion of heavy chain,CH)区。人和鼠VH的CDR3 平均长度分别为12和9个氨基酸,而纳米抗体CDR3为13~18个氨基酸,在一定程度上弥补了轻链缺失造成的抗原结合力下降;传统抗体的FR2中,V37、G44, L45和W47这4个氨基酸残基参与VL的相互作用,而在Nb中,这4个氨基酸突变为F/Y37,E/Q44,R/C45,G/F/S/L47,由疏水氨基酸突变为亲水氨基酸,使纳米抗体更易于溶解。
相对于传统抗体而言,羊驼纳米抗体稳定性好,分子量小,仅为传统完整抗体的1/10(约15kD),其晶体直径仅为2.5nm,长4nm,因此组织穿透力强,甚至可以穿过血脑屏障;纳米抗体靠仅有的3个互补决定区(complementarity-determining region,CDR)就具备抗原的特异性和高亲和力,而普通抗体则需要6个CDRs;纳米抗体和抗原靶点结合特异性更强,能到达传统抗体无法达到的表位,由于其长的 CDR3区,能够伸入到酶的活性中性,细菌或病毒表面受体的裂缝中;也具有更高的稳定性,能耐受更加恶劣的条件如耐高温,更易储藏和运输;纳米抗体利用噬菌体筛选等技术适合工业化大规模生产,传统的通过细胞融合制备单克隆抗体周期长约6个月,而通过噬菌体展示技术能够绕开细胞的融合,更加快速的制备单克隆单体;更容易改造和人源化,纳米抗体与人抗体的重链可变区具有超过80%的序列同源性,并且二者的3D结构可以重合,因此人源化简单;另外,纳米抗体更易于构建多价和多功能抗体。
2.CD38抗原的应用
CD38抗原是一种大小为46kDa的II型跨膜糖蛋白。它的配体为CD31,也称为PECAM-1。除了在内皮细胞上表达外,还在淋巴样细胞(卵泡膜B细胞和浆细胞)、肺(肺泡管、肺泡和淋巴管)和肾脏(肾小球细胞)中表达。通常,CD38 在正常淋巴样细胞和髓样细胞上低水平表达,但在浆细胞(也称效应B细胞)中的 CD38表达水平特别高。
CD38与配体CD31相互作用,在调节细胞迁移、受体介导的粘附以及信号传导中扮演着重要角色。此外,CD38蛋白质还是一种双功能胞外酶,兼具环化酶和水解酶的活性,参与核苷酸代谢。
CD38的表达与多种疾病有关,包括艾滋病、自身免疫性疾病(例如系统性红斑狼疮)、2型糖尿病、骨质疏松症和癌症。研究发现,CD38在大量恶性血液癌症中高度表达,特别是在多发性骨髓瘤(MM)、急性髓性白血病(ALL)、急性b淋巴细胞白血病(B-ALL)等癌症中,这使CD38成为多发性骨髓瘤治疗性抗体药物的开发靶点,目前国内外有多家药企正在开发。
强生的达雷妥尤单抗(Daratumumab)是全球首个获批上市的人源化抗CD38 单抗赛诺菲(Sanofi)的Sarclisa是第2款获FDA批准的CD38抗体药物。目前,中国仅有强生的达雷妥尤单抗一款CD38单抗于2021年获批上市,用于治疗MM 效果显著。目前以CD38为靶点的在研药物多为单克隆抗体,尚未有抗CD38 CAR- T上市产品。
3.抗CD38 CAR-T技术的开发
CAR-T疗法,即嵌合抗原受体T细胞免疫疗法,通过基因工程技术在T细胞表面表达包括scFv单链抗体、共刺激域等元件的嵌合抗原受体(CAR),使其能够识别特定肿瘤抗原,用于治疗恶性血液癌症已取得良好疗效,包括急性B淋巴细胞白血病、大B细胞非霍奇金淋巴瘤和复发难治的CD19阳性恶性淋巴瘤等。CAR 结构是将抗体中可以直接识别肿瘤抗原的单链可变区域scFv(抗原受体)、共刺激信号都嵌合到T细胞的激活信号通路CD3ζ链上。CD38抗原在大多数AML和骨髓瘤细胞上表达,且在造血干细胞(HSC)上几乎不表达,使其成为CAR-T疗法治疗血液肿瘤疾病患者的潜在靶点。传统的CAR-T细胞的构建,把抗体重链可变区(VH) 和轻链可变区(VL)基因通过柔性Linker(比如(G4S)3)连接成为scFV(单链可变片段),再根据序列构建相应的CAR目标质粒,并联合病毒包装系统生产病毒然后用其转染T细胞制备相应靶点的CAR-T细胞,从而把scFv段表达T细胞表面,行使抗体靶向肿瘤抗原的功能。但由于传统的scFv形式分子量较大,空间位阻大,不稳定,不易通过慢病毒转导成功,因此作为scFv(传统VH与VL串联)的替代方案,纳米抗体VHH因体积小、分子量小、免疫原性低、稳定性好、抗原识别能力强和穿透力强等优点,而被广泛用作CAR-T的抗原结合结构域。然而,联合纳米抗体制备CAR-T细胞在噬菌体文库构建方面有所不同。
4.与本发明创造相关的现有技术及缺点
抗体基因工程技术在不断发展,如噬菌体展示技术为抗体的大量、快速生产提供了技术手段。噬菌体展示是一种新兴的表达技术,是在1990年建立和发展起来的,将外源抗体片段与噬菌体的衣壳蛋白融合,从而将其展示在噬菌体表面,筛选特异性抗原的抗体,通过原核或者真核细胞表达可以大规模生产抗体,此法操作简单且生产成本低。用抗原免疫骆驼后,使用噬菌体展示技术筛选相应的纳米抗体是非常高效和快速的方法,免疫骆驼后,采集骆驼血液,分离淋巴细胞,提取总RNA,进行逆转录即可获得cDNA,将其亚克隆至噬菌粒载体中与辅助噬菌体M13K07联用,用于制备单价纳米抗体展示库。构建的纳米抗体文库的大小及多样性是获得高亲和力纳米抗体的前提,还有,新鲜血液的采集和mRNA及cDNA的制备是构建高质量文库的关键。
噬菌体展示技术是抗体筛选的首选方法,因为该技术成熟且稳定,适合抗体的大规模生产。除了噬菌体展示技术外,其他的相关技术也成功应用到抗体生产中,这些技术包括核糖体或mRNA展示技术、酵母或细菌表面展示技术和酵母双杂交筛选技术等。在酵母和细菌系统中,纳米抗体的多价展示文库通过应用流式细胞分选(FACS)可以快速从文库中筛到高质量的纳米抗体。核糖体和mRNA展示技术是在体外进行的,省去了转化这个步骤。此外,每一轮反转录聚合酶链式反应(RT-PCR) 后,可能会引入序列的微小突变,这样有利于筛选结合力更强的抗体。与其他筛选方法相比,此法建库简单、库容量较大、筛选简便,也是较为理想的筛选技术。
目前针对CD38阳性表达的恶性血液癌症,主要采用抗CD38单克隆抗体进行治疗,抗CD38抗体主要是通过抗体依赖细胞毒性和抗体依赖吞噬作用靶向CD38 癌细胞。目前已有2款CD38单克隆治疗抗体(daratumumab,isatuximab)获批上市,在临床上显示出一定的治疗效果。但对于CD38阳性的恶性血液肿瘤依然需要开发更有效的治疗方式。
CAR-T疗法已在包括急性B淋巴细胞白血病、大B细胞非霍奇金淋巴瘤等血液癌症中表现出良好的治疗效果,但目前以CD38为靶点的在研药物多为单克隆抗体,尚未有抗CD38 CAR-T上市产品。而且传统的CD38单克隆抗体药物主要还存在两个主要问题:
a.结构复杂,分子量大,不易穿透血脑屏障;而纳米抗体仅有重链抗体的可变区(VHH),分子量小,可溶性好、穿透力强,且免疫原性低。
b.传统单克隆抗体药物的核心技术从腹水法/杂交瘤细胞体外培养技术(鼠源性单抗)到嵌合抗体技术(鼠嵌合单抗),从抗体人源化技术(人源化抗体)向噬菌体展示抗体库技术/人源抗体转基因小鼠技术(全人源抗体)迭代,免疫原性问题是难点。相对而言,纳米抗体通过免疫羊驼来获得抗体基因,然后通过噬菌体展示筛选技术从羊驼抗体库中筛选到最适合的抗体序列,包括羊驼免疫、噬菌体文库构建和抗体筛选三个阶段,在制备上更具优势。
发明内容
为了获得新的特异性结合CD38的驼源重链抗体或抗原结合片段,尤其是特异性结合CD38抗原的VHH抗体,利用VHH抗体的分子量小,可溶性好、穿透力强,且免疫原性低的优点来进行抗肿瘤药物开发,本发明公开了5条氨基酸序列。虽然这5条氨基酸序列是作为纳米抗体被筛选获得的,但是利用其特异性结合 CD38抗原的性质,本领域技术人员可以显而易见的知悉这5条氨基酸序列可以作为结合CD38的驼源重链抗体的部分氨基酸序列,或抗原结合片段的氨基酸序列,或抗原结合片段的部分氨基酸序列。因此,本发明的具体方案如下:
一种驼源重链抗体或抗原结合片段包含:
a1)如SEQ ID NO:6所示的氨基酸序列;或
a2)如SEQ ID NO:7所示的氨基酸序列;或
a3)如SEQ ID NO:8所示的氨基酸序列;或
a4)如SEQ ID NO:9所示的氨基酸序列;或
a5)如SEQ ID NO:10所示的氨基酸序列;
所述驼源重链抗体是多克隆抗体或抗CD38单克隆抗体;
所述驼源重链抗体或抗原结合片段能够特异性结合CD38抗原。
在一些实施方案中,所述抗原结合片段是VHH抗体;所述VHH抗体的氨基酸序列选自:
a1)如SEQ ID NO:6所示的氨基酸序列;
a2)如SEQ ID NO:7所示的氨基酸序列;
a3)如SEQ ID NO:8所示的氨基酸序列;
a4)如SEQ ID NO:9所示的氨基酸序列;
a5)如SEQ ID NO:10所示的氨基酸序列。
另一方面,本发明公开了一种核酸,其编码如上所述的驼源重链抗体或抗原结合片段。
在一些实施方案中,该核酸包含:
c1)如SEQ ID NO:1所示的核苷酸序列;或
c2)如SEQ ID NO:2所示的核苷酸序列;或
c3)如SEQ ID NO:3所示的核苷酸序列;或
c4)如SEQ ID NO:4所示的核苷酸序列;或
c5)如SEQ ID NO:5所示的核苷酸序列。
在一些实施方案中,该核酸选自:
c1)如SEQ ID NO:1所示的核苷酸序列;
c2)如SEQ ID NO:2所示的核苷酸序列;
c3)如SEQ ID NO:3所示的核苷酸序列;
c4)如SEQ ID NO:4所示的核苷酸序列;
c5)如SEQ ID NO:5所示的核苷酸序列。
第三方面,本发明还公开了一种载体,其包含如上所述的核酸。在一些实施方案中,所述载体为重组慢病毒载体;所述重组慢病毒载体含有如上所述的核酸。
第四方面,本发明还公开了一种宿主细胞,其包含如上所述的核酸或者如上所述的载体。
第五方面,本发明还公开了用于产生驼源重链抗体或抗原结合片段的方法,其培养如上所述的宿主细胞并从培养物回收所述驼源重链抗体或抗原结合片段。
第六方面,本发明还公开了一种抗CD38 CAR,其包含抗CD38纳米抗体;所述抗CD38纳米抗体为如上所述的抗原结合片段。
在一些实施方案中,所述抗CD38 CAR的结构为CD8 leader-抗CD38纳米抗体-CD8Hinge-CD8 TM-共刺激结构域-胞内信号肽,包括依次串联的CD8 leader膜受体信号肽(CD8Leader)、抗CD38纳米抗体、CD8 Hinge嵌合受体铰链区(CD8 Hinge)、CD8 TM嵌合受体跨膜区(CD8 TM)、共刺激结构域和胞内信号肽。在该实施方案中的抗CD38 CAR由抗CD38纳米抗体替换传统抗CD38 CAR中的抗CD38 scFv。
在一些实施方案中,所述共刺激结构域包括但不限于选自CD28、OX40和 4-1BB中的一种或多种。进一步地,所述胞内信号肽为CD3ζ。
在一些实施方案中,所述CAR结构包括但不局限于CD8 leader-抗CD38纳米抗体-CD8 Hinge-CD8 TM-共刺激结构域-胞内信号肽结构。
第七方面,本发明还公开了一种抗CD38 CAR-T或抗CD38 CAR-NK或抗 CD38 CAR-M,其上修饰有嵌合抗原受体(CAR),所述嵌合抗原受体为如上所述的抗CD38 CAR。在一些实施方案中,所述抗CD38 CAR-T中的T细胞包括但不限于αβT细胞、γδT细胞、NKT细胞、MAIT细胞、CIK细胞中的一种或多种。
第八方面,本发明还公开了如上所述的驼源重链抗体或抗原结合片段,或如上所述的核酸,或如上所述的载体,或如上所述的宿主细胞,或如上所述的抗CD38 CAR,或如上所述的抗CD38 CAR-T或抗CD38 CAR-NK或抗CD38 CAR-M在制备抗肿瘤药物中的应用。
在一些实施方案中,所述肿瘤为CD38阳性表达的肿瘤或BMCA阳性表达的肿瘤。
在一些实施方案中,所述肿瘤为多发性骨髓瘤、慢性淋巴细胞白血病(CLL)、套细胞淋巴瘤MCL、急性髓系白血病AML、急性淋系白血病ALL。
如本文所用,术语“CAR-T”中的T细胞除非在具体实施时特别指明为某一类的T细胞外,应理解为是广义上的T细胞,即包括但不限于αβT细胞和/或γδT细胞,还包括一些非典型T细胞,例如自然杀伤T(NKT)细胞、粘膜相关不变T(Mucosal AssociatedInvariant T,MAIT)细胞、细胞因子诱导的杀伤细胞(Cytokine-Induced Killer,CIK)等。这些非典型T细胞也作为T淋巴细胞的效应类型。T细胞的来源也不限于外周血,包括脐带血、干细胞、IPSC、细胞系等分化诱导转化而来的细胞,及其T细胞分化而成的其他的细胞类型。αβT 和γδT细胞是根据TCR类型不同对典型T细胞的分类。
如本文所用,术语“宿主细胞”应从广义上来理解,可以是原核细胞或真核细胞;可以是本领域已知的任何适宜宿主细胞,例如,哺乳动物宿主细胞、细菌宿主细胞、酵母宿主细胞、昆虫宿主细胞等。
如本文所用,术语“单链可变片段”(single-chain fragment variable,scFv) 由轻链的可变区(VL)、重链的可变区(VH)以及linker组成,重链和轻链可变区均包括3个互补决定区(CDR1、CDR2、CDR3)和4个框架区(FR1、FR2、 FR3、FR4)。可与抗原结合。
癌症是威胁人类健康的重要疾病,因各种癌症死亡的人数比例逐年呈上升趋势。随着科学技术的不断发展,癌症的诊断和治疗条件虽得到了很大改善,但仍存在很大的不足,癌症的治疗仍以化疗或手术等手段为主,借助此种手段往往副作用很大,在治疗的同时也给患者的健康造成了不可逆转的损害。CD38是表达于多种血液系统肿瘤细胞表面的跨膜糖蛋白分子,其能够促进肿瘤细胞的增殖、浸润和转移,肿瘤恶性程度越高,CD38的表达量也就越高,被认为是恶性血液肿瘤的生物标志物。以CD38为靶标蛋白相继开发出了其多克隆和单克隆抗体,虽然有生产周期短等优势,但由于传统的IgG形式分子量较大,不易被机体清除,组织渗透性差,比如单克隆抗体(mAb)无法透过血脑屏障。作为scFv(传统VH与VL)的优选方案,纳米抗体因体积小、分子量小、免疫原性低、稳定性好、抗原识别能力强和穿透力强等优点,被广泛用于作为CAR-T的抗原结合结构域。目前CD38的纳米抗体应用很少,本发明研究结果清楚地证明了使用VHH定向的CD38 CAR-T细胞对 CD38+肿瘤细胞的杀伤能力,支持进一步开发这种CD38 CAR-T用于临床试验和应用。
本发明公开了一种驼源重链抗体或抗原结合片段及其应用。该抗体或抗原结合片段包含5条氨基酸序列中的一条或多条;这5条氨基酸序列为特异性结合CD38 的驼源纳米抗体VHH。本发明利用筛选获得的这5条氨基酸序列构建得到抗 CD38 CAR,再利用慢病毒转导技术将该抗CD38 CAR构建到免疫细胞上,并以抗CD38 CAR-T为例进行了体外功能验证和临床功能验证。体外实验结果显示本发明的抗CD38 CAR-T具有良好的靶细胞杀伤能力并可刺激分泌大量与抗肿瘤活性相关的细胞因子(比如IFN-γ和TNFα);临床结果显示使用纳米抗体行使靶向功能的抗CD38 CAR-T细胞在体内受到CD38阳性肿瘤细胞刺激后,可以在患者体内特异性扩增。本发明首次公开了一组抗CD38的VHH抗体,并将其用于CAR中来识别抗原,且取得了良好的技术效果,有利于改进CAR- T、CAR-NK和CAR-M治疗。
以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
图1是传统抗体和纳米抗体示意图。
图2是基于5种VHH的抗CD38 CAR的结构。
图3是检测与抗原CD38-HIS结合的抗CD38 CAR-T细胞的百分比。
图4是551~555共5组抗CD38纳米抗体制备的抗CD38 CAR-T细胞对靶细胞的杀伤功能比较。
图5是551~555共5组抗CD38纳米抗体制备的抗CD38 CAR-T细胞在IFN- γ和TNFα细胞因子释放水平上的比较。
图6是8名患者输注后抗CD38 CAR-T(pUT553)细胞的扩增。
具体实施方式
为了使发明实现的技术手段、创造特征、达成目的和功效易于明白了解,下结合具体图示,进一步阐述本发明。但本发明不仅限于以下实施的案例。
附表:
表1、5个抗CD38 VHH核苷酸序列和氨基酸序列编号
表2、抗CD38 CAR部分相关元件核苷酸序列和氨基酸序列编号
表3、抗CD38 CAR核苷酸序列
表4、PCR扩增VHH基因引物序列编号
实施例1、抗CD38纳米抗体的筛选
实验动物双峰骆驼,饲养于内蒙古。辅助噬菌体M13KO7购自NEB,货号 N0315S。质粒小抽试剂盒、DNA胶回收试剂盒购自天根生化科技有限公司。抗原Human CD38 Protein、His Tag(MALS verified)购自百普赛斯,货号CD8-H5224。HRP抗His Tag antibody购自Biolegend,所需引物购自生物生物工程有限公司。SfiI购自NEB。T4 DNA连接酶购自NEB。Tg1大肠杆菌来自优卡迪。
选择两周岁以上的羊驼作为免疫动物,羊驼免疫步骤为:选取羊驼颈背部,靠近弓淋巴结区域,剃去背毛;使用碘伏消毒和消毒剂清洗。取1mg CD38-HIS 抗原蛋白,用1×PBS将其稀释为1mg/ml,与1ml的完全弗氏佐剂充分混匀,之后的免疫采用不完全佐剂。采取皮下注射方式进行多点免疫,免疫前用真空采血管从羊驼颈静脉处取血,作为阴性血清对照。每次免疫一周后进行加强免疫,共免疫4次,免疫后采集羊驼外周血。用外周血淋巴细胞分离液分离淋巴细胞,抽RNA逆转录为cDNA。使用如表4所示引物序列,进行PCR反应。第一轮PCR的引物对为CS-F和CS-R,程序设为:95℃预变性3分钟;95℃变性30s,58℃退火30s,72℃延伸30s,共35个循环;最后72℃延伸5分钟。将第一轮PCR产物用琼脂糖凝胶电泳鉴定,并胶回收PCR产物。将胶回收产物作为模板进行第二轮PCR反应。第二轮PCR引物对是VHH-F和VHH-R,程序设为:95℃预变性3分钟;95℃变性30s,55℃退火30s,72℃延伸30s,共35个循环;最后72℃延伸5分钟。纯化PCR产物后用SfiI酶切,酶切产物纯化后与线性化载体通过T4DNA连接酶连接。将纯化后的连接产物电转Tg1 大肠杆菌感受态。电转后的Tg1大肠杆菌摇瓶培养至对数生长期后,用辅助噬菌体M13KO7侵染,第二天收集噬菌体,获得纳米抗体噬菌体文库。噬菌粒载体PA008来自优卡迪,经SfiI酶切后形成上述线性化载体。
以CD38-HIS抗原作为靶标,用胰酶溶液洗脱噬菌体,对纳米抗体噬菌体文库进行4轮亲和淘选。采用噬菌体酶联免疫(phageELISA)进行阳性筛选,最终拿到了5个阳性克隆(即5个纳米抗体,或者说5个VHH),分别为FA- 2E、FA-7G、FB-1E、FB-5G、FB-8A,其核苷酸序列和氨基酸序列编号见表1。
实施例2、抗CD38-CAR的构建及慢病毒的包装
慢病毒骨架质粒载体pUT-Bacbone,来自优卡迪;pPac-R、pPac-GP和pEnv- G均来自优卡迪;DMEM培养基来自Gibco,293T细胞来自ATCC。
将实施例1获得的5组抗CD38纳米抗体(FA-2E、FA-7G、FB-1E、FB-5G、FB- 8A)分别构建5组重组慢病毒载体,分别命名为PUT551、PUT552、PUT553、 PUT554、PUT555。
具体步骤包括:将慢病毒骨架质粒载体pUT-Bacbone与EcoR I、BamH I两种限制性核酸内切酶混合进行酶切;进行凝胶电泳(120V,20min)后使用琼脂糖凝胶DNA回收试剂盒回收7000bp大小的线性质粒;设计相应引物通过聚合酶链式反应(PCR)合成目的基因,即为抗CD38-CAR质粒基因,包含依次串联的CD8 leader膜受体信号肽、抗CD38 VHH、CD8α嵌合受体铰链区Hinge和CD8α嵌合受体跨膜区TM、CD28共刺激结构域、OX40共刺激结构域,以及CD3ζ胞内信号肽; PCR反应产物进行琼脂糖凝胶电泳(120V,20min)回收并通过纯化试剂盒进行纯化,获得的载体线性质粒和目的基因片段按照无缝克隆试剂盒同源重组,获得嵌入目的基因(抗CD38 CAR)的目的质粒。5个抗CD38 CAR的结构如图2。
取适量目的质粒对293T细胞进行转染,步骤如下:在15mL离心管中加入2500ulCaCl
实施例3、抗CD38 CAR-T的制备
将实施例2所得的重组慢病毒载体pUT551~pUT555分别转导原代T细胞,制备CAR-T细胞,流式细胞仪检测CAR阳性率;CAR阳性率定义为能够与CD38抗原结合的细胞百分比。流式检测一抗为Human CD38 Protein,His Tag,二抗为抗 His荧光。具体步骤包括:用单个核细胞分离液分离外周血单个核细胞(PBMC);CD4分离磁珠和CD8分离磁珠分选淋巴T细胞;CD3和CD28抗体激活T细胞;加入慢病毒分别转导T细胞,放入37℃,5%CO
实施例4、抗CD38 CAR-T的体外功能验证
CD4/CD8磁珠,CD3抗体,CD28抗体均来自美天旎;IL-2来自Peprotech; A-IMV培养基来自Gibco;FITC-Protein L蛋白来自Biolegend。LDH杀伤试剂盒来源:CytoTox 96Non-Radioactive Cytotoxicity Assay,Promega,货号REF: G1782;A-IMV培养基来自Gibco;K562(CD38阴性)来自上海中国科学院细胞库;过表达CD38的髓系白血病细胞株K562-CD38(简称K562-CD38)来自上海优卡迪。
分别培养效应细胞NC(没有转病毒的T细胞,作为阴性对照,即图4和图 5中的对照组),2354(传统scFv对照CAR-T细胞),551,552,553,554, 555(用VHH纳米抗体构建的CAR-T细胞)共7组细胞;分别培养靶细胞K562、 CD38(PSE2348)-K562(即前述的K562-CD38);将效应细胞和靶细胞分组共孵育进行细胞毒性实验,实验效靶比设置分别为5:1和2.5:1;孵育过夜后采用乳酸脱氢酶(LDH)法测杀伤效率,同时效应细胞与靶细胞共孵育后取上清检测细胞因子水平。
具体实验步骤如下:1)收集靶细胞的悬液:贴壁细胞弃去培养上清每皿使用10ml生理盐水浸润皿底后弃去生理盐水,每皿细胞加入1ml胰酶消化细胞,视细胞系特性决定消化时间,显微镜下观察细胞不贴壁,悬浮且形态变圆,加入3mL完全培养基终止消化。1500rpm离心5min,弃去上清,分别加入5 mL PBS重悬,1500rpm离心5min,弃上清。2)靶细胞铺板:用1mL AIM- V杀伤培养基(AIM-V+4%FBS)分别重悬靶细胞。使用血球计数板法计数。96 孔板每孔加入靶细胞1x104孔,根据所需细胞量,使用杀伤培养基配制靶细胞悬液,配好后将靶细胞铺于96孔细胞培养板中,250g,离心5分钟,放入37℃二氧化碳培养箱培养2h,促进靶细胞贴壁。3)收集效应细胞悬液,将T细胞混合均匀,使用血球计数板法计数。根据杀伤所需效应细胞用量,取效应细胞, 1500rpm离心5min,用1mL AIM-V杀伤培养基(AIM-V+4%FBS)分别重悬效应细胞,台盼蓝染色计数。4)96孔板每孔已经加入靶细胞1×10
检测细胞因子步骤:效应T细胞与靶细胞共孵育后,收集上清于1.5mL EP 管中进行细胞因子检测。a样本处理:细胞悬液1500rpm离心3min后收集上清于新的1.5mL EP管中。b标准品准备:加入2mL标准品稀释液稀释标准品冻干粉,室温静置15min。接着2倍梯度稀释标准品(最高浓度至空白稀释液共10个梯度)。c在新的EP管中加入50μL标准品或者样本,接着加入50μL 磁珠以及50μL检测抗体,涡旋仪混合均匀,室温孵育3h。d加入洗涤缓冲液(Wash Buffer)洗涤两遍后弃去上清加入200μL Wash Buffer重悬上机检测细胞因子IL-2/IL-4/IL-6/IL-10/IFNγ/TNFα。
LDH杀伤结果如图4显示,pUT551、pUT552组对CD38+K562靶细胞杀伤效率低,pUT553、pUT554组对CD38+K562靶细胞杀伤效率数值正常范围内,pUT555组对K562(CD38阴性细胞)和K562-CD38(CD38阳性细胞)均有杀伤,提示可能有脱靶效应。
细胞因子释放水平检测结果如图5所示,结果与LDH结果基本一致,551、 552组与CD38+K562靶细胞共孵育后IFNγ/TNFα几乎阴性,553、554组 IFNγ/TNFα阳性正常范围内,555组除了CD38+K562对无靶点靶细胞K562也有IFNγ/TNFα表达。
综上所述,pUT553(FB-1E)组的杀伤能力最强,且没有脱靶效应,因此选定为最终的基于纳米抗体FB-1E设计的抗CD38 CAR-T细胞(pUT553)开展后续实验。
实施例5、抗CD38 CAR-T的体内扩增和治疗效果
筛选了合适的多发性骨髓瘤(MM)、急性髓系白血病(AML)、急性淋巴细胞白血病(ALL)患者入组后(必备入组条件:肿瘤细胞CD38阳性表达),评估抗CD38 CAR-T(CAR编号为pUT553,FB-1E-VHH行使靶向功能)细胞治疗MM、AML、ALL患者的临床治疗效果和安全性。输注抗CD38 CAR-T细胞前,先用氟达拉滨和环磷酰胺(FC)(氟达拉滨30mg/m
临床结果如图6所示,给8例MM、AML、ALL患者输注抗CD38 CAR-T 后,CAR-T细胞都能在体内进行扩增,这表明使用纳米抗体VHH(FB-1E)行使靶向功能的抗CD38 CAR-T细胞在体内受到CD38阳性肿瘤细胞刺激后,可以在患者体内特异性扩增。
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
- 消防火灾模拟评估展示仪及操作方法
- 一种基于森林火灾蔓延模拟的动态森林火灾损失评估方法
