一种脂肪酶突变体及其应用
文献发布时间:2024-04-18 20:00:50
技术领域
本发明涉及一种脂肪酶突变体及其应用,属于生物技术领域。
背景技术
脂肪酶属羧基酯水解酶,全称三酰甘油酰基水解酶,是催化天然底物油脂水解,生成脂肪酸、甘油单酯或二酯一类酶的总称。脂肪酶在油水界面上其催化活力最大,其具有水溶性酶,可作用于非水溶性底物,使反应在两个彼此分离的完全不同的相界面上进行的催化特性。作为重要的工业酶制剂,脂肪酶广泛存在于动、植物和微生物中。由于微生物易培养、生长周期短、表达量高及作用范围广等优势,因此,微生物来源的脂肪酶得到大量研究。广泛应用于医药、食品、皮革、饲料添加及油脂加工等领域。
此外,以脂肪酶作为催化剂,酶法合成聚合物及生物材料得到大量研究。如XinranL等人(Copper Phthalocyanine Improving Nonaqueous Catalysis of Pseudomonascepacia Lipase for Ester Synthesis.Applied Biochemistry and Biotechnology(2023))以固定化脂肪酶Novozym435为催化剂,在甲苯中催化2,5-呋喃二甲酸二甲酯与正丁醇转酯化反应制备2,5-呋喃二甲酸正丁酯(DBF)。Tomasz S等人(Highenantioselective Novozym 435-catalyzed esterification of(R,S)-flurbiprofenmonitored with a chiral stationary phase.Applied Biochemistry andBiotechnology(2015))以叔丁醇作为反应溶剂,非水相酶法合成氟比洛芬维C脂。例如中国专利文献CN113046397A以脂肪酶为催化剂,通过非水相酶法合成低分子量6-O-PGA-L-抗坏血酸等。
然而,大部分脂肪酶属于中温脂肪酶,其最适温度低于等于45℃,耐热性能较差。来源于微生物的酶大多与其宿主具有相似的适应性,因此,研究人员从嗜热菌入手以纯化出高热稳定性的脂肪酶。Bakir Z B等(Purification and Characterization of anAlkali-Thermostable Lipase from Thermophilic Anoxybacillus flavithermus HBB134.Journal of Microbiology and Biotechnology(2016))从嗜热菌Anoxybacillusflavithermus HBB 134的发酵产物中分离纯化得到最适反应温度为50℃的脂肪酶。Sun QQ等(Heterologous production of an acidic thermostable lipase with broad-rangepH activity from thermophilic fungus Neosartorya fischeri P1.Journal ofBioscience and Bioengineering(2016))分离自嗜热真菌Neosartorya fischeri P1的脂肪酶LIP09也表现出较高的热稳定性,其在60℃保温30min仍保留96%的活性。Haki G D等(Developments in industrially important thermostable enzymes:areview.Bioresource Technology(2003))发现,来源于微生物Bacillus thermoleovorans和Rhizopus oryzae的脂肪酶在70~75℃时仍然能正常发挥功能。此外,部分热稳定性好的脂肪酶对有机溶剂(如正己烷、二甲基亚砜)也有较强的耐受性。
然而,少部分来自嗜热菌的脂肪酶耐热性并不能满足生产和应用的需求。由于在油脂加工等反应中需在高温条件下进行,而耐热性不高的脂肪酶在高温反应条件下会出现失活现象,并且尽管部分来源于嗜热菌或超嗜热菌的脂肪酶具有较好的热稳定性,但嗜热微生物往往需要极端且昂贵的培养条件。因此若以其作为生产菌来分离纯化脂肪酶,成本较高且操作复杂。因此,研究出一种脂肪酶突变体,提高脂肪酶的热稳定性对脂肪酶在油脂加工等需要高温反应条件的应用具有重要价值。
发明内容
针对现有技术的不足,本发明提供一种脂肪酶突变体及其应用。
本发明的技术方案如下:
一种脂肪酶突变体LipA1,其氨基酸序列如SEQ ID NO.3所示,编码基因的核苷酸序列如SEQ ID NO.4所示。
本发明提供的脂肪酶突变体LipA1是在来源于铜绿假单胞菌(Pseudomonasaeruginosa)的脂肪酶LipA的基础上,将其第63位的精氨酸(Arg)突变为半胱氨酸(Cys)。所述脂肪酶LipA的氨基酸序列如SEQ ID NO.1所示,编码基因的核苷酸序列如SEQ ID NO.2所示。
一种脂肪酶突变体LipA2,其氨基酸序列如SEQ ID NO.5所示,编码基因的核苷酸序列如SEQ ID NO.6所示。
本发明提供的脂肪酶突变体LipA2是在脂肪酶突变体LipA1的基础上,将其第115位的精氨酸(Arg)突变为谷氨酰胺(Gln)。
一种脂肪酶突变体LipA5,其氨基酸序列如SEQ ID NO.7所示,编码基因的核苷酸序列如SEQ ID NO.8所示。
本发明提供的脂肪酶突变体LipA5是在脂肪酶突变体LipA2的基础上,将其第149位的脯氨酸(Pro)突变为丝氨酸(Ser)、第202位的谷氨酰胺(Gln)突变为谷氨酸(Glu)、第269位的异亮氨酸(Ile)突变为丝氨酸(Leu)。
一种重组载体,是在质粒载体中插入上述脂肪酶突变体的编码基因。
根据本发明优选的,所述质粒载体为pPIC9K。
一种重组菌株,是将上述重组载体转化入宿主菌株中获得。
根据本发明优选的,所述宿主菌株为毕赤酵母GS115。
上述脂肪酶突变体在食品加工中的应用。
上述脂肪酶突变体在非水相酶法合成聚合物中的应用。
进一步优选的,所述聚合物为6-O-PGA-L-抗坏血酸。
本发明的有益效果在于:
本发明以脂肪酶LipA为基础,提供了包含R63C单点突变的脂肪酶突变体LipA1、包含R63C和R115Q两点突变的脂肪酶突变体LipA2、以及包含R63C、R115Q、P149S、Q202E、I269L五点突变的脂肪酶突变体LipA5。与脂肪酶LipA相比,本发明提供的脂肪酶突变体LipA1、LipA2和LipA5的最适作用温度和pH没有发生改变,其最适温度均为50℃,最适pH均为8.0,但其热稳定性得到显著提升,在70℃保温30min后,脂肪酶LipA的残留酶活仅剩余19%,而脂肪酶突变体LipA1、LipA2和LipA5的残留酶活相比于脂肪酶LipA分别提高了13.37%、22.51%和33.74%,从而有利于其在食品、油脂加工等领域的应用。此外,脂肪酶突变体LipA1、LipA2和LipA5在非水相酶法合成聚合物领域也具有良好的效果,以LipA5为例,其催化合成6-O-PGA-L-抗坏血酸的效率比野生型酶LipA提高7.8倍。
附图说明
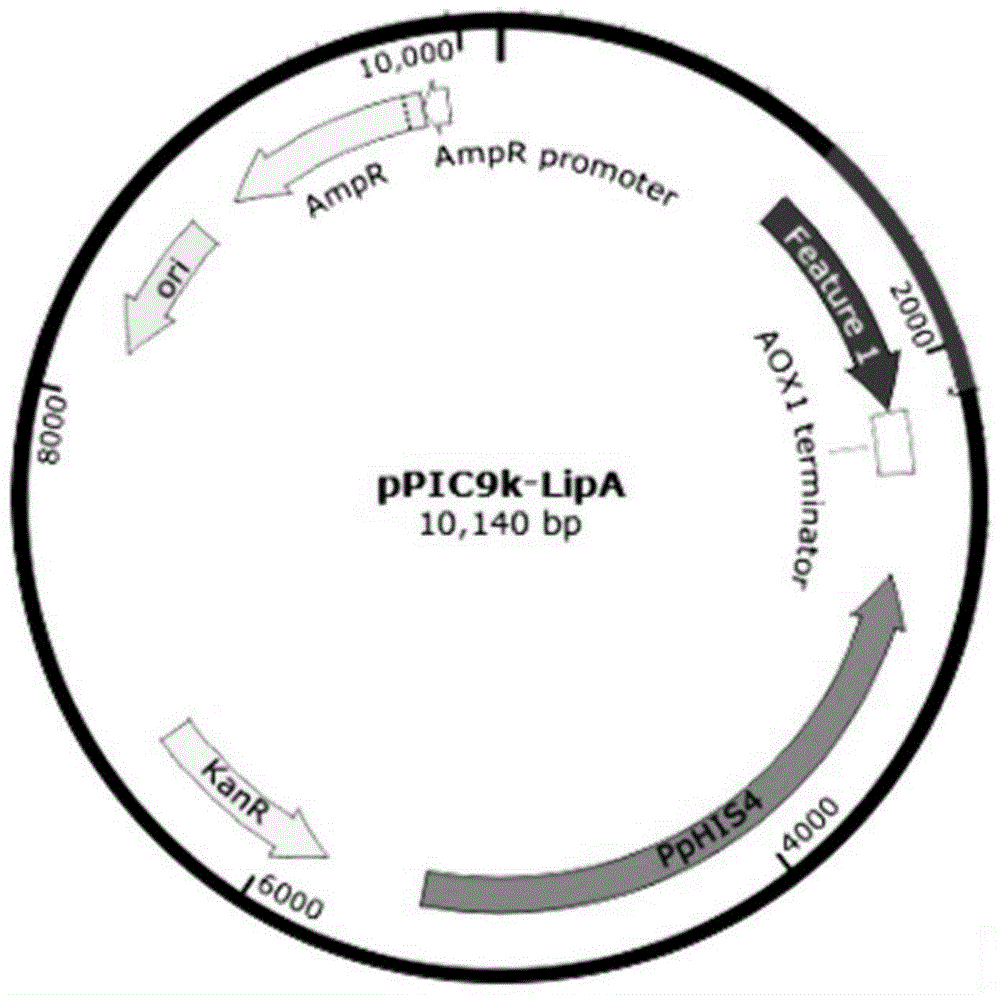
图1为重组质粒pPIC9K-LipA结构示意图;
图2为重组质粒pPIC9K-LipA1、重组质粒pPIC9K-LipA2和重组质粒pPIC9K-LipA5的双酶切验证电泳图;
图中:泳道1为pPIC9K-LipA1;泳道2为pPIC9K-LipA2;泳道3为pPIC9K-LipA5;
图3为毕赤酵母工程菌GS115-pPIC9K-LipA1、GS115-pPIC9K-LipA2和GS115-pPIC9K-LipA5的菌落PCR验证电泳图;
图中:泳道1为毕赤酵母工程菌GS115-pPIC9K-LipA1;泳道1为毕赤酵母工程菌GS115-pPIC9K-LipA2;泳道1为毕赤酵母工程菌GS115-pPIC9K-LipA5;
图4为温度对脂肪酶突变体LipA1、LipA2和LipA5酶活性的影响;
图5为pH对脂肪酶突变体LipA1、LipA2和LipA5酶活性的影响;
图6为脂肪酶LipA和脂肪酶突变体LipA1、LipA2、LipA5的耐热性比较图。
具体实施方式
本发明的以下实施例和附图仅说明实现本发明的具体实施方案,这些方案和附图不可以理解为对本发明的限制,任何在不脱离本发明的原理和实质的情况下所做的任何改变,均落在本发明的保护范围之内。
本实施例中所用到的实验技术与实验方法,如无特殊说明均为常规技术方法。本实施例中所使用的材料、试剂等,如无特殊说明,均可通过正规商业渠道获得。
为了更好的解释本发明,下面结合实施例对本发明进行进一步的阐述。本发明中的实验方法如无特殊说明均为常规方法,未作具体说明的分子生物学实验方法具体可参见J.萨姆布鲁克等编著的《分子克隆实验指南》,或按照试剂盒方法进行。具体实施例中使用的试剂及生物材料,无特殊说明均可从商业途径获得。
以下实施例中涉及的实验材料及试剂如下:
菌种与质粒:大肠杆菌DHα、毕赤酵母GS115、质粒载体pPIC9K。
酶和试剂盒:PCR酶、T4连接酶、限制性内切酶,质粒提取试剂盒及琼脂糖胶回收试剂盒。
以下实施例中涉及的培养基配方如下:
大肠杆菌培养基(LB培养基):1%胰蛋白胨、1% NaCl、0.5%酵母浸粉,pH7.0,121℃灭菌20分钟,固体培养基中加入2%琼脂粉。
LB-Kan培养基:LB培养基加50μg/mL的卡那霉素。
YPD培养基:1%酵母提取物、2%蛋白胨、2%葡萄糖,固体培养基中加入2%琼脂粉。
YPD-G418培养基:YPD培养基加4mg/mL的遗传霉素G418。
MD培养基:10×YNB、500×生物素、10×葡萄糖,0.22μm滤膜过滤除菌,-20℃保存。
BMGY培养基:2%蛋白胨、1%酵母提取物、0.1mol磷酸钾缓冲液(pH6.0)、10×YNB、500×生物素、1%甘油。
BMMY培养基:2%蛋白胨、1%酵母提取物、0.1mol磷酸钾缓冲液(pH6.0)、10×YNB、生物素、0.5%甲醇。
50mg/mL遗传霉素G418:0.22μm滤膜过滤除菌,避光-20℃保存。
50mg/mL卡那霉素:0.22μm滤膜过滤除菌,-20℃保存。
实施例1:突变位点的选择
以蛋白质分子晶体结构的B值(B-factor)高低作为筛选准则,快速确定影响脂肪酶热稳定性的潜在氨基酸残基。选取PDB数据库中的铜绿假单胞菌脂肪酶1EX9作为模板,构建了来源于铜绿假单胞菌(Pseudomonas aeruginosa)的脂肪酶LipA的3D分子结构模型。所述脂肪酶LipA的氨基酸序列如SEQ ID NO.1所示,编码基因的核苷酸序列如SEQ ID NO.2所示。
3D分子结构模型具体构建方法如下:比对脂肪酶1EX9和LipA多肽链的氨基酸序列,确定存在的氨基酸差异性位点。在YASARA软件中,实现1EX9蛋白结构的可视化;然后利用该软件的SWAP功能,将1EX9与LipA多肽链差异性位点的氨基酸残基,逐一替换为LipA对应的氨基酸残基,获得LipA3D结构的初始模型。利用B-FITTER软件分析1EX9晶体中,具有较高B-factor值的氨基酸残基及其在多肽链中的位置。比对LipA与1EX9多肽链氨基酸残基序列,在LipA多肽链中,选择与1EX9多肽链中具有较高B-factor值的氨基酸残基所在位置及类型相同的氨基酸残基作为潜在突变位点。
为获得热稳定性的LipA变体,使用基于结构和序列的算法PROSS进行组合突变体预测,PROSS使用Rosetta局部构象采样和具有来自多序列比对的序列保守偏差的能量评分来预测每个位置的所有其他19个突变的稳定性。PROSS使用Rosetta能量函数talaris2014来进行突变扫描,使用默认的能量阈值参数筛选潜在的稳定突变,给出了四个突变位点数量累加的组合突变体,四个组合突变体分别包含2、3、4、5个突变位点。基于PROSS组合突变体中的单点进行性质测定,筛选热稳定性较高且与酶活性没有较大损失的单点突变,通过全路径迭代组合突变规避上位性效应,获得热稳定性最优的多点组合突变体。
经过分析后,将脂肪酶LipA氨基酸序列的第63位、115位、149位、202位、269位作为突变位点,对其进行定点突变极有可能提高脂肪酶LipA的催化活性。设计了包含R63C单点突变的脂肪酶突变体LipA1,其氨基酸序列如SEQ ID NO.3所示,编码基因的核苷酸序列如SEQ ID NO.4所示;设计了包含R63C和R115Q两点突变的脂肪酶突变体LipA2,其氨基酸序列如SEQ ID NO.5所示,编码基因的核苷酸序列如SEQ ID NO.6所示;以及设计了包含R63C、R115Q、P149S、Q202E、I269L五点突变的脂肪酶突变体LipA5,其氨基酸序列如SEQ ID NO.7所示,编码基因的核苷酸序列如SEQ ID NO.8所示。
实施例2:表达载体的构建
以SEQ ID NO.4、SEQ ID NO.6、SEQ ID NO.8所示脂肪酶突变体基因序列为参考,分别人工合成脂肪酶LipA1、LipA2、LipA5三段基因,其编码氨基酸序列依次为SEQ IDNO.3、SEQ ID NO.5、SEQ ID NO.7。三段基因分别利用EcoRⅠ和PinAⅠ两个限制性内切酶位点连接入表达载体pPIC9K,重组质粒pPIC9K-LipA结构如图1所示。然后将3个重组质粒转化至E.coli DH5α,得到工程菌E.coli DH5α-pPIC9K-LipA1,E.coli DH5α-pPIC9K-LipA2,E.coli DH5α-pPIC9K-LipA5,以上基因合成、表达载体构建和亚克隆工作委托上海生工生物工程有限公司完成。
使用质粒提取试剂盒对工程菌进行质粒提取,然后将得到的重组质粒pPIC9K-LipA1、重组质粒pPIC9K-LipA2和重组质粒pPIC9K-LipA5进行凝胶电泳验证,结果如图2所示。由图2可知,三个重组表达载体构建、表达成功。
实施例3:毕赤酵母工程菌株的构建
1、携带脂肪酶突变体基因的pPIC9K重组质粒的提取
分别将E.coli DH5α-pPIC9K-LipA1,E.coli DH5α-pPIC9K-LipA2,E.coli DH5α-pPIC9K-LipA5三株工程菌接种至LB-Kan培养基中,37℃过夜培养,收集菌体沉淀,利用质粒小量提取试剂盒提取重组质粒,得到重组质粒pPIC9K-LipA1、pPIC9K-LipA2、pPIC9K-LipA5。
2、酵母感受态的制备
将毕赤酵母GS115菌株进行YPD固体培养基活化,30℃培养48h,挑酵母单菌落接种至含有10mL的YPD液体培养基的100mL三角瓶中,在30℃、220r/min条件下培养24h,转接菌液至含有30mL的YPD液体培养基的三角摇瓶中,在30℃、220r/min条件下摇瓶培养至OD
3、电转化法构建工程菌株及验证
分别将重组质粒pPIC9K-LipA1、pPIC9K-LipA2、pPIC9K-LipA5经SacⅠ线性化,线性化片段胶回收后分别电击转化毕赤酵母GS115感受态细胞。分别将转化液涂布MD固体培养基进行培养,筛选得到毕赤酵母重组菌株GS115/pPIC9K-LipA1、GS115/pPIC9K-LipA2和GS115/pPIC9K-LipA5,然后分别在4.0mg/mL遗传霉素G418的YPD固体培养基上,于30℃下继续培养2~3d,筛选出高拷贝转化子,经摇瓶复筛后,最终获得毕赤酵母工程菌GS115/pPIC9K-LipA1、GS115/pPIC9K-LipA2和GS115/pPIC9K-LipA5。
然后对毕赤酵母工程菌GS115/pPIC9K-LipA1、GS115/pPIC9K-LipA2和GS115/pPIC9K-LipA5进行菌落PCR验证阳性转化子,PCR验证的结果如图3所示。
所述PCR验证的引物序列如下:
5’端引物LipA-F:5’-GAATTCATGAAGAAGAAGTCTCTGCTCCCC-3’,
3’端引物LipA-R:5’-ACCGGTCTACAGGCTGGCGTTCTTCAG-3’。
PCR验证反应体系:10×MutazymeⅡreaction buffer 5μL,dNTP mix 1μL,MutazymeⅡDNA polymerase 1μL,正向引物(10mM)2μL,反向引物(10mM)2μL,模板DNA 1μL,用无核酸酶的纯水补足至50μL。
PCR验证反应条件:(1)95℃预变性10min;(2)95℃变性1min;(3)54℃退火50s;(4)72℃延伸1min;(5)重复(2)-(4)30cycles;(6)72℃最终延伸3min。
由图3可知,重组质粒pPIC9K-LipA1、pPIC9K-LipA2和pPIC9K-LipA5在毕赤酵母GS115中表达成功,毕赤酵母工程菌GS115-pPIC9K-LipA1、GS115-pPIC9K-LipA2和GS115-pPIC9K-LipA5构建成功。
同时按照相同的方法获得对照菌株毕赤酵母工程菌GS115-pPIC9K-LipA。
4、脂肪酶LipA和脂肪酶突变体LipA1、LipA2、LipA5的表达和纯化
将毕赤酵母工程菌GS115-pPIC9K-LipA、GS115-pPIC9K-LipA1、GS115-pPIC9K-LipA2和GS115-pPIC9K-LipA5分别接种于YPD液体培养基中,30℃,220r/min震荡培养24h,将种子液按照10%接种量接种于BMGY培养基中,30℃、220r/min振荡培养24h,分别取四株菌的BMGY培养液,无菌条件下离心,弃去上清,用BMMY培养基充分悬浮菌体,继续在25℃、250r/min下振荡诱导培养,每24h补充1%(V/V)的甲醇,诱导表达120h,8000r/min离心10min去除菌体,即得到分别含有脂肪酶LipA和脂肪酶突变体LipA1、LipA2、LipA5的发酵液上清,用0.22μm滤膜过滤上清液,在上清液中添加硫酸铵至饱和度为30%,4℃过夜盐析,8000r/min离心10min收集沉淀,复溶于适量纯化水中,经透析除盐后冷冻干燥得粗酶粉。
实施例4:脂肪酶突变体酶活及酶学特性分析
1、脂肪酶LipA和脂肪酶突变体LipA1、LipA2、LipA5酶活的测定
脂肪酶活性的一个单位定义为在标准测定条件下1分钟内释放1μmol对硝基苯酚的酶的量。酶活力单位,U/mL。
以p-NPP作为底物测定脂肪酶活性。将底物溶解在2-丙醇(20mM)中,然后将底物(75μL)与3mL Tris-HCl缓冲液(50mM,pH8.0)混合,然后在50℃下预孵育5min后,通过向混合物中分别添加50μL稀释10倍的脂肪酶LipA和脂肪酶突变体LipA1、LipA2、LipA5,在50℃下进行反应10min,通过添加1mL SDS(0.05%w/v)终止反应。在410nm处记录释放的对硝基苯酚的吸光度。每种样品设立3组平行,计算均值,通过标准曲线用回归直线方程计算脂肪酶活性。
其中用于计算脂肪酶活性的标准曲线方程为:y=0.0326x+0.102(R2=0.9997),其中y为吸光度值,x为对硝基苯酚的质量(μg)。酶活=1000nV(y-0.102)/0.0326t,其中n为稀释倍数,t为反应时间(min),V为反应体系的总体积(L),1000为换算系数。
按照上述方法测定脂肪酶LipA和脂肪酶突变体LipA1、LipA2、LipA5的酶活分别为158U/mL、186U/mL、225U/mL和275U/mL。
2、脂肪酶突变体LipA1、LipA2和LipA5酶学特性的分析
(1)最适作用温度
将1mg脂肪酶突变体LipA1、LipA2和LipA5分别加入至10mL的50mM Tris-HCl缓冲液(pH 8.0)中,于梯度温度20、30、40、50、60、70℃下预孵育30min,然后按照本实施例方法1在标准条件下测试样品的残余脂肪酶活性,得出脂肪酶突变体LipA1、LipA2和LipA5的最适作用温度,结果如图4所示。
由图4可知,脂肪酶突变体LipA1、LipA2和LipA5的最适作用温度均为50℃。
(2)最适作用pH
将1mg脂肪酶突变体LipA1、LipA2和LipA5分别加入至体积为10mL、梯度pH为4、5、6、7、8、9、10的50mM Tris-HCl缓冲液中,于50℃下预孵育30min,然后按照本实施例方法1在标准条件下测试样品的残余脂肪酶活性,得出脂肪酶突变体LipA1、LipA2和LipA5的最适作用pH,结果如图5所示。
由图5可知,脂肪酶突变体LipA1、LipA2和LipA5的最适作用pH均为8。
(3)热稳定性分析
用10mL预热10min、pH 8.0的50mM Tris-HCl缓冲液分别将脂肪酶LipA和脂肪酶突变体LipA1、LipA2、LipA5稀释10倍,混合均匀,于70℃孵育30min后冷却至室温,测定酶活,以未孵育粗酶液的酶活计100%,计算残留酶活,结果如图6所示。
由图6可知,70℃孵育30min后,脂肪酶LipA的残留酶活仅剩19%,脂肪酶突变体LipA1、LipA2、LipA5的残留酶活相比于脂肪酶GS115-pPIC9k-LipA分别提高了13.37%、22.51%和33.74%,由此说明相较于脂肪酶LipA,脂肪酶突变体LipA1、LipA2、LipA5的耐热性得到显著提升。
实施例5:脂肪酶突变体在非水相酶法合成6-O-PGA-L-抗坏血酸中的应用
在500mL具塞锥形瓶中加入叔丁醇100mL、吡啶100mL、分子筛10g,震荡混匀,然后分别加入脂肪酶LipA和脂肪酶突变体LipA1、LipA2和LipA5,混合均匀,再在加入L-抗坏血酸5g、聚谷氨酸5g,在60℃、150r/min的条件下恒温震荡反应48h,静置后过滤,将滤液旋转蒸发得粗品,粗品复溶于纯化水后静置分层得水相,过滤,以2倍体积的乙醇进行醇沉得沉淀,60℃下干燥去除乙醇,得到6-O-PGA-L-抗坏血酸。
上述非水相酶法合成6-O-PGA-L-抗坏血酸的反应方程式如下所示:
其中,a≥0的自然数,c≥0的自然数,b≥1的自然数。
利用HPLC法测定所得6-O-PGA-L-抗坏血酸的含量,具体检测方法如下。
流动相:以0.3mol/L NaSO
色谱条件:采用Waters Ultrahydrogel Liner(7.8mm×300mm)凝胶色谱柱,通过Waters配置的2489紫外检测器进行测定。检测柱温为30℃,检测波长为210nm,流速0.5mL/min,进样体积20μL。
标准品处理:称取γ-聚谷氨酸标准品(含量≥99.0%),用流动相分别溶解成0、0.2、0.4、0.6、0.8和1.0mg/mL的γ-聚谷氨酸标准溶液,通过0.22μm滤膜过滤,并超声脱气15min后进样,记录峰面积,绘制标准曲线。
样品处理:称取上述所得的6-O-PGA-L-抗坏血酸样品,用流动相溶解1.0mg/mL的6-O-PGA-L-抗坏血酸样品溶液,通过0.22μm滤膜过滤,并超声脱气15min。
含量测定:将待检测的6-O-PGA-L-抗坏血酸样品注入色谱柱中,记录峰面积,计算得到6-O-PGA-L-抗坏血酸的含量,结果如表1所示。
表1、不同脂肪酶催化L-抗坏血酸和PGA合成6-O-PGA-L-抗坏血酸的结果
由表1可知,本发明提供的脂肪酶突变体LipA1、LipA2和LipA5能够有效提高6-O-PGA-L-抗坏血酸的含量,是脂肪酶LipA合成6-O-PGA-L-抗坏血酸产量的6倍以上。
综上所述,本发明以脂肪酶LipA为基础,提供了包含R63C单点突变的脂肪酶突变体LipA1,包含R63C和R115Q两点突变的脂肪酶突变体LipA2和包含R63C、R115Q、P149S、Q202E、I269L五点突变的脂肪酶突变体LipA5,与脂肪酶LipA相比,突变体LipA1、LipA2和LipA5的最适作用温度和pH没有发生改变,但其热稳定性得到显著提升。相比于野生型酶LipA突变体LipA5催化合成6-O-PGA-L-抗坏血酸的催化效率提高7.8倍。
- 基于区块链的商品信息生成方法、区块链节点及其系统
- 一种验证交易的方法、一种节点及一种区块链系统
- 一种基于区块链技术的区块链项目EPI评价方法
- 一种基于区块链技术的结算方法、装置及区块链网络
- 区块链轻量化处理方法、区块链节点及存储介质
- 一种基于区块链的品牌推广方法及区块链节点
- 一种基于区块链的资源授权方法及区块链节点
