一种梵净山石斛快速繁殖方法
文献发布时间:2024-04-18 20:01:23
技术领域
本发明涉及梵净山石繁殖技术领域,具体为一种梵净山石斛快速繁殖方法。
背景技术
梵净山石斛(Dendrobium fanjingshanense)为兰科(Orchidaceae)石斛属(Dendrobium)附生植物,是2001年发现的一个新种,为保护植物。其可入药,用于治疗口干、烦渴、热病伤津、肺热干咳、腰膝软弱、阴伤目暗等病症,具有药用价值,是药用植物;其花黄褐色或橙黄色,也具有较高的观赏价值,可作为观赏植物。此外,梵净山石斛营养价值高,文献报道,其水分含量高,富含蛋白质和粗纤维,且脂肪含量较低,并且含有粗多糖及黄酮类成分,具有抗氧化潜力。梵净山石斛含有16种氨基酸,必需氨基酸(EAA)占氨基酸(TAA)总量的42.92%,必需氨基酸与非必需氨基酸(NEAA)的比值为86.96%,符合FAO/WHO提出的理想蛋白模式,说明其是一种优质的蛋白来源,脂肪酸中不饱和脂肪酸含量较多,最丰富的是亚油酸,其次是油酸和亚麻酸,矿物质中具有钾、钙、铁等这些丰富的高营养价值的矿质元素,此外,贵州梵净山产的梵净山石斛中还含有硒元素,硒元素具有很多保健功能,可开发利用为富硒产品。和铁皮石斛相比,梵净山石斛中铜、钙、镁、钾和硒5种元素的含量均高出铁皮石斛,在有效成分方面,除了粗多糖含量较低外,梵净山石斛的醇溶性浸出物含量和石斛碱含量均高于铁皮石斛,因此,梵净山石斛同样具有较高的开发利用价值。
梵净山石斛分布范围狭窄,自然分布区少,仅在贵州省梵净山黑湾河和浙江省九龙山国家级自然保护区发现分布,种群数量少,亟待恢复,其种子微小,胚胎发育不完全,在自然条件下种子萌发极为困难。因此,加强繁殖、扩大数量,扭转或延缓濒危态势,是当前刻不容缓的任务,而采用生物技术手段扩繁是一条有效途径。
但是,目前人工繁育种植仍存在一定的限制,研究开发出有质量有产量的梵净山石斛是缓解资源稀缺的可行性措施,为此,我们提出一种梵净山石斛快速繁殖方法。
发明内容
本发明要解决的技术问题是克服现有的缺陷,提供一种梵净山石斛快速繁殖方法,采用梵净山石斛种子和茎段作为外植体进行组织培养研究,建立快繁技术体系,为其保育和开发利用提供研究资料,可以有效解决背景技术中的问题。
为实现上述目的,本发明提供如下技术方案:一种梵净山石斛快速繁殖方法,包括两套梵净山石斛快速繁殖体系;
体系一:以种子为外植体快速繁殖体系:1.1蒴果消毒、1.2种子萌发及原球茎诱导、1.3.1原球茎增殖、1.3.2无菌小苗增殖、1.4生根壮苗培养;
体系二:以带节茎段为外植体快速繁殖体系:2.1茎段消毒和接种、2.2腋芽诱导、2.3不定芽诱导和增殖、2.4生根壮苗培养。
优选的,所述体系一包含以下步骤:
1.1蒴果消毒:将未开裂的蒴果用洗洁精搓洗15~30s后自来水冲洗30min,然后转移至超净工作台,75%酒精消毒30s,无菌水冲洗3次,0.1%升汞消毒15min,无菌水冲洗6;
1.2.种子萌发和原球茎诱导:在超净工作台内,将消毒后的梵净山石斛蒴果置于无菌滤纸上,吸干表面的水分,用无菌解剖刀将蒴果纵向剖开,取出种子,均匀撒在萌发培养基上进行原球茎诱导;
1.3.1原球茎增殖:选取生长良好的原球茎作为外植体,转接到原球茎增殖培养基中,进行原球茎增殖培养;
1.4生根壮苗培养:选取生长健壮、长势一致的增殖无菌小苗,将无菌小苗切成单株,接种到培养基中,进行生根壮苗培养。
优选的,所述体系一包含以下步骤:
1.1蒴果消毒:将未开裂的蒴果用洗洁精搓洗15~30s后自来水冲洗30min,然后转移至超净工作台,75%酒精消毒30s,无菌水冲洗3次,0.1%升汞消毒15min,无菌水冲洗6;
1.2种子萌发:在超净工作台内,将消毒后的梵净山石斛蒴果置于无菌滤纸上,吸干表面的水分,用无菌解剖刀将蒴果纵向剖开,取出种子,均匀撒在萌发培养基上进行种子萌发。
1.3.2无菌小苗增殖:将萌发的无菌小苗(0.5~1cm)作为外植体,将小苗接种到无菌小苗增殖培养基中,进行增殖培养;
1.4生根壮苗培养:选取生长健壮、长势一致的增殖无菌小苗,将无菌小苗切成单株,接种到培养基中,进行生根壮苗培养。
优选的,所述体系二包含以下步骤:
2.1茎段消毒和接种:用剪刀从梵净山石斛植株上剪掉茎段,去掉叶片和叶鞘,剪成8~10cm长,用洗洁精搓洗15~30s后自来水冲洗30min,然后转移至超净工作台,按照以下消毒方法处理进行消毒:75%酒精消毒30s,无菌水冲洗3次,0.1%HgCl2消毒13min,无菌水冲洗6次;
2.2腋芽诱导:在超级工作台内取出消毒后的梵净山石斛茎段,置于无菌滤纸上,吸干表面水分,用无菌剪刀将茎段剪成2~3cm长的带节茎段,正插放于腋芽诱导培养中。
2.3不定芽诱导和增殖:将诱导出的腋芽作为外植体,将芽从茎段基部切下,接种到培养基中,进行不定芽诱导和增殖培养;
2.4生根壮苗培养:选取生长健壮、长势一致的增殖无菌小苗,将无菌小苗切成单株,接种到培养基中,进行生根壮苗培养
优选的,所述种子萌发和原球茎诱导培养基配方为MS+1.0mg/LNAA+1.0mg/L6-BA+7g/L琼脂+25g/L蔗糖+1g/L活性炭,培养基灭菌调节为pH5.7±0.1,于121℃高温下灭菌20min后冷却凝固,培养基接种后培养条件为:培养温度25±2℃,光照/黑暗时间14/12h,光照强度1500~2000lx。
优选的,所述原球茎增殖培养基的配方为MS+0.5mg/LNAA+2mg/L6-BA+7g/L琼脂+25g/L蔗糖,培养基灭菌调节为pH5.7±0.1,于121℃高温下灭菌20min后冷却凝固,培养基接种后培养条件为:培养温度25±2℃,光照/黑暗时间14/12h,光照强度1500~2000lx。
优选的,所述无菌小苗增殖所用的培养基配方为MS+1.0mg/LNAA+1.0mg/L6-BA+7g/L琼脂+25g/L蔗糖,或者:MS+1.0mg/LNAA+2.0mg/L6-BA+7g/L琼脂+25g/L蔗糖,或者:MS+1.0mg/LNAA+3.0mg/L6-BA+7g/L琼脂+25g/L蔗糖,培养基灭菌调节为pH5.7±0.1,于121℃高温下灭菌20min后冷却凝固,培养基接种后培养条件为:培养温度25±2℃,光照/黑暗时间14/12h,光照强度1500~2000lx。
优选的,所述生根壮苗培养所用的培养基配方为MS+0.5mg/L NAA+1mg/L IBA+7g/L+25g/L蔗糖,或者:MS+0.5mg/L NAA+0.1mg/L IBA+7g/L+25g/L蔗糖,或者:MS+0.5mg/LNAA+0.5mg/L IBA+7g/L+25g/L蔗糖,培养基灭菌调节为pH5.7±0.1,于121℃高温下灭菌20min后冷却凝固,培养基接种后培养条件为:培养温度25±2℃,光照/黑暗时间14/12h,光照强度1500~2000lx。
优选的,所述腋芽诱导培养基配方为1/2MS+0.5mg/L6-BA+0.2mg/LNAA+7g/L+25g/L蔗糖,或者:B5+0.5mg/L6-BA+0.2mg/LNAA+7g/L+25g/L蔗糖,培养基灭菌调节为pH5.7±0.1,于121℃高温下灭菌20min后冷却凝固,培养基接种后培养条件为:培养温度25±2℃,光照/黑暗时间14/12h,光照强度1500~2000lx。
优选的,所述不定芽诱导和增殖所用的培养基配方为培养基配方:1/2MS+0.5mg/LNAA+1mg/L 6-BA+7g/L+25g/L蔗糖,培养基接种后培养条件为:培养温度25±2℃,光照/黑暗时间14/12h,光照强度1500~2000lx。
与现有技术相比,本发明的有益效果是:本梵净山石斛快速繁殖方法,具有以下优势:
1、本发明建立了梵净山石斛的两套快速繁殖体系,有效的解决了其种群数量少、繁殖难、繁殖周期长、繁殖系数低等问题,有利于其保护和开发利用。
2、本发明采用种子和带节茎段为外植体进行组培快繁,繁殖材料易获得,茎段采集不受季节约束,四季皆宜,环境条件容易控制,解决了梵净山石斛繁殖难、种苗参差不齐等问题,具有广阔的市场前景和研究价值。
3、本发明保护的繁殖方法体系稳定,建立了有效的灭菌程序,繁殖系数高,繁殖周期短,苗壮,出苗率高。
附图说明
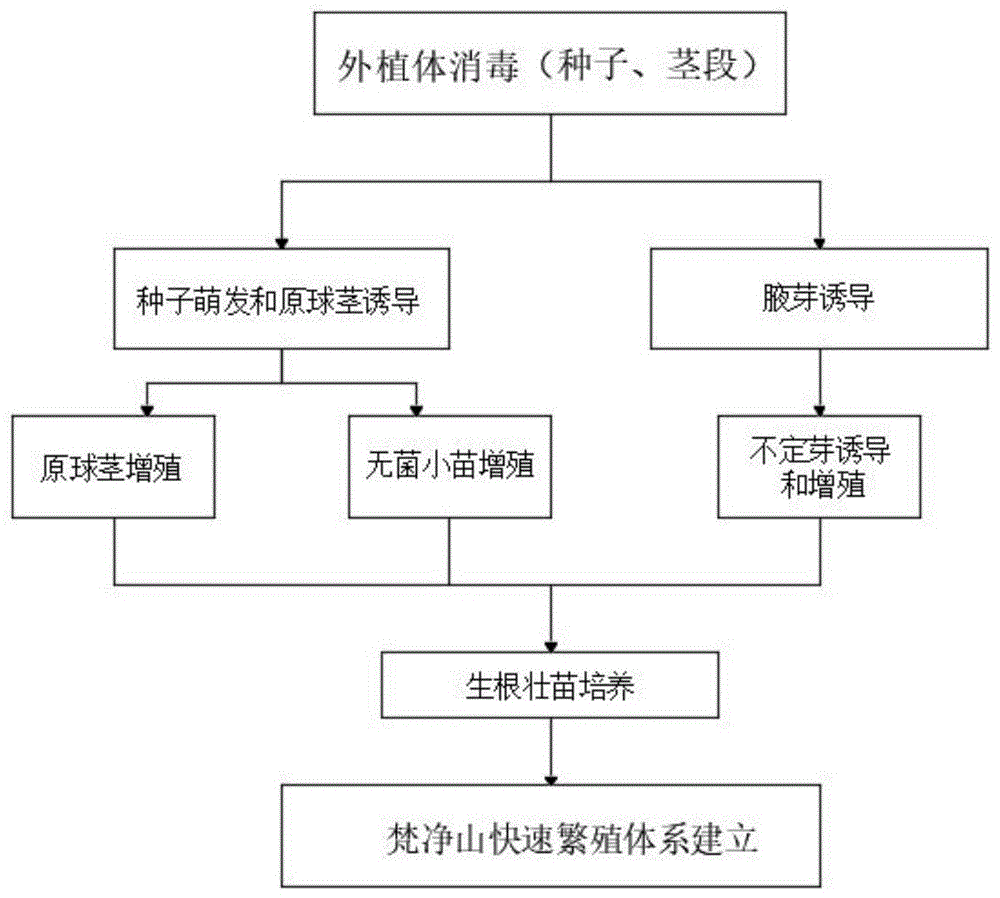
图1为本发明技术路线图;
图2为本发明茎段组培过程结构示意图;
图3为本发明原球茎增殖过程结构示意图;
图4为本发明无菌小苗增殖过程结构示意图;
图5为本发明生根壮苗培养过程结构示意图;
图6为本发明种子萌发和原球茎诱导培养基结构示意图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
请参阅图1-6,本实施例提供一种技术方案:一种梵净山石斛快速繁殖方法,包括两套梵净山石斛快速繁殖体系;
体系一:以种子为外植体快速繁殖体系:1.1蒴果消毒、1.2种子萌发及原球茎诱导、1.3.1原球茎增殖、1.3.2无菌小苗增殖、1.4生根壮苗培养;
体系二:以带节茎段为外植体快速繁殖体系:2.1茎段消毒和接种、2.2腋芽诱导、2.3不定芽诱导和增殖、2.4生根壮苗培养。
其中:体系一包含以下步骤:
1.1蒴果消毒:将未开裂的蒴果用洗洁精搓洗15~30s后自来水冲洗30min,然后转移至超净工作台,75%酒精消毒30s,无菌水冲洗3次,0.1%升汞消毒15min,无菌水冲洗6;
1.2.种子萌发和原球茎诱导:在超净工作台内,将消毒后的梵净山石斛蒴果置于无菌滤纸上,吸干表面的水分,用无菌解剖刀将蒴果纵向剖开,取出种子,均匀撒在萌发培养基上进行原球茎诱导。
1.3.1原球茎增殖:选取生长良好的原球茎作为外植体,转接到原球茎增殖培养基中,进行原球茎增殖培养;
1.4生根壮苗培养:选取生长健壮、长势一致的增殖无菌小苗,将无菌小苗切成单株,接种到培养基中,进行生根壮苗培养
其中:体系一包含以下步骤:
1.1蒴果消毒:将未开裂的蒴果用洗洁精搓洗15~30s后自来水冲洗30min,然后转移至超净工作台,75%酒精消毒30s,无菌水冲洗3次,0.1%升汞消毒15min,无菌水冲洗6;
1.2种子萌发:在超净工作台内,将消毒后的梵净山石斛蒴果置于无菌滤纸上,吸干表面的水分,用无菌解剖刀将蒴果纵向剖开,取出种子,均匀撒在萌发培养基上进行种子萌发。
1.3.2无菌小苗增殖:将萌发的无菌小苗(0.5~1cm)作为外植体,将小苗接种到无菌小苗增殖培养基中,进行增殖培养;
1.4生根壮苗培养:选取生长健壮、长势一致的增殖无菌小苗,将无菌小苗切成单株,接种到培养基中,进行生根壮苗培养。
体系二包含以下步骤:
2.1茎段消毒和接种:用剪刀从梵净山石斛植株上剪掉茎段,去掉叶片和叶鞘,剪成8~10cm长,用洗洁精搓洗15~30s后自来水冲洗30min,然后转移至超净工作台,按照以下消毒方法处理进行消毒:75%酒精消毒30s,无菌水冲洗3次,0.1%HgCl2消毒13min,无菌水冲洗6次;
2.2腋芽诱导:在超级工作台内取出消毒后的梵净山石斛茎段,置于无菌滤纸上,吸干表面水分,用无菌剪刀将茎段剪成2~3cm长的带节茎段,正插放于腋芽诱导培养中。
2.3不定芽诱导和增殖:将诱导出的腋芽作为外植体,将芽从茎段基部切下,接种到培养基中,进行不定芽诱导和增殖培养;
2.4生根壮苗培养:选取生长健壮、长势一致的增殖无菌小苗,将无菌小苗切成单株,接种到培养基中,进行生根壮苗培养
其中:种子萌发和原球茎诱导培养基配方为MS+1.0mg/LNAA+1.0mg/L6-BA+7g/L琼脂+25g/L蔗糖+1g/L活性炭,培养基灭菌调节为pH5.7±0.1,于121℃高温下灭菌20min后冷却凝固,培养基接种后培养条件为:培养温度25±2℃,光照/黑暗时间14/12h,光照强度1500~2000lx。
其中:原球茎增殖培养基的配方为MS+0.5mg/LNAA+2mg/L6-BA+7g/L琼脂+25g/L蔗糖,培养基灭菌调节为pH5.7±0.1,于121℃高温下灭菌20min后冷却凝固,培养基接种后培养条件为:培养温度25±2℃,光照/黑暗时间14/12h,光照强度1500~2000lx。
其中:无菌小苗增殖所用的培养基配方为MS+1.0mg/LNAA+1.0mg/L6-BA+7g/L琼脂+25g/L蔗糖,或者:MS+1.0mg/LNAA+2.0mg/L6-BA+7g/L琼脂+25g/L蔗糖,或者:MS+1.0mg/LNAA+3.0mg/L6-BA+7g/L琼脂+25g/L蔗糖,培养基灭菌调节为pH5.7±0.1,于121℃高温下灭菌20min后冷却凝固,培养基接种后培养条件为:培养温度25±2℃,光照/黑暗时间14/12h,光照强度1500~2000lx。
其中:生根壮苗培养所用的培养基配方为MS+0.5mg/L NAA+1mg/L IBA+7g/L+25g/L蔗糖,或者:MS+0.5mg/L NAA+0.1mg/L IBA+7g/L+25g/L蔗糖,或者:MS+0.5mg/L NAA+0.5mg/L IBA+7g/L+25g/L蔗糖,培养基灭菌调节为pH5.7±0.1,于121℃高温下灭菌20min后冷却凝固,培养基接种后培养条件为:培养温度25±2℃,光照/黑暗时间14/12h,光照强度1500~2000lx。
其中:腋芽诱导培养基配方为1/2MS+0.5mg/L6-BA+0.2mg/LNAA+7g/L+25g/L蔗糖,或者:B5+0.5mg/L6-BA+0.2mg/LNAA+7g/L+25g/L蔗糖,培养基灭菌调节为pH5.7±0.1,于121℃高温下灭菌20min后冷却凝固,培养基接种后培养条件为:培养温度25±2℃,光照/黑暗时间14/12h,光照强度1500~2000lx。
其中:不定芽诱导和增殖所用的培养基配方为培养基配方:1/2MS+0.5mg/L NAA+1mg/L 6-BA+7g/L+25g/L蔗糖,培养基接种后培养条件为:培养温度25±2℃,光照/黑暗时间14/12h,光照强度1500~2000lx。
1茎段消毒方法筛选
方法:用剪刀从梵净山石斛植株上剪掉茎段,去掉叶片和叶鞘,剪成8~10cm长,用洗洁精搓洗15~30s后自来水冲洗30min,然后转移至超净工作台,按照以下3种消毒方法处理进行消毒,接种30d后统计污染数并计算污染率。
a 75%酒精消毒30s,无菌水冲洗3次,10%NaClO消毒13min,无菌水冲洗6次。
b 75%酒精消毒30s,无菌水冲洗3次,0.1%HgCl2消毒10min,无菌水冲洗6次。
c 75%酒精消毒30s,无菌水冲洗3次,0.1%HgCl2消毒13min,无菌水冲洗6次。
表1梵净山石斛茎段消毒方法筛选
结果:采用不同消毒试剂和消毒时间对梵净山石斛茎段进行消毒,结果如表1所示,消毒时间对茎段的消毒有影响,采用0.1%HgCl2消毒,消毒10min污染率为26.67%,而延长消毒时间至13min后,污染率可降至4.44%,表明梵净山石斛茎段消毒时间13min为佳;消毒时间均为13min时,采用10%NaClO消毒污染率为15.56%,而0.1%HgCl2消毒污染率仅4.44%,表明梵净山石斛茎段消毒采用0.1%HgCl2消毒效果比10%NaClO好。综上,梵净山石斛茎段最佳消毒方法为:75%酒精消毒30s,无菌水冲洗3次,0.1%HgCl2消毒13min,无菌水冲洗6次。
2腋芽诱导培养基筛选
方法:将固体B5、MS、1/2MS作为基本培养基,添加植物生长激素组合均为0.5mg/L6-BA+0.2mg/LNAA,考察不同培养基对腋芽诱导的影响;将1/2MS作为基本培养基,添加不同浓度的6-BA和NAA,考察不同植物生长激素对腋芽诱导的影响。每处理接种15瓶,每瓶1个外植体,3次重复。接种50d后分别统计存活外植体、出芽外植体及出芽外植体存活数量,计算成活率、诱导出芽率和存活外植体出芽率。
表2不同激素、基本培养基下腋芽诱导情况
注:同列中各字母表示差异显著性,不同字母表示差异显著(P<0.05),下同。
结果:从表2可知,6-BA浓度为0.5mg/L时,不同NAA浓度下腋芽诱导率不同,NAA浓度在0.2mg/L时,腋芽诱导率为82.22%,大于NAA浓度在0.1mg/L时的腋芽诱导率,但NAA浓度在0.5mg/L时,腋芽诱导率降为34.70%,表明梵净山石斛茎段最佳腋芽诱导效果为6-BA0.5mg/L+NAA 0.2mg/L;在相同添加剂的条件下,不同基本培养基对腋芽诱导也有不同的影响,从腋芽诱导率和存活外植体出芽率来看,1/2MS和B5培养基均显著大于MS培养基,但1/2MS培养基和B5培养基之间无显著性差异,表明1/2MS和B5培养基作为基本培养基比MS更适合用于梵净山石斛腋芽诱导。
3腋芽诱导不定芽增殖培养基筛选
方法:以固体1/2MS为基本培养基,添加固定浓度NAA为0.5mg/L,分别设置6-BA浓度为1mg/L、2mg/L和3mg/L,将诱导出的腋芽作为外植体,将芽从茎段基部切下,随机接种到各处理的培养基中,考察不同激素对不定芽增殖的影响。每处理接种5瓶,每瓶2个芽,重复3次。接种50d后统计芽的数量并记录其生长情况,计算芽增殖倍数。
表3腋芽诱导丛生芽增殖情况
结果:以固体1/2MS为基本培养基,将诱导出的腋芽切下作为外植体继代培养,可成功诱导不定芽,不定芽增殖系数随着6-BA浓度的改变而变化,从表3可知,NAA浓度不变为0.5mg/L,6-BA在1mg/L时芽增殖系数显著高于2mg/L和3mg/L,而2mg/L和3mg/L之间无显著性差异,表明通过梵净山石斛腋芽作为外植体进行丛生芽诱导增殖,最佳激素组合为0.5mg/L NAA+1mg/L 6-BA。
4种子萌发和原球茎诱导培养基筛选
方法:将固体MS作为基本培养基,添加不同浓度的6-BA和NAA以及活性炭,考察不同激素、不同添加物对梵净山石斛种子萌发和原球茎诱导的影响,具体见表4。培养基pH5.7±0.1,均于121℃高温下灭菌20min后冷却凝固。接种后定期观察并记录种子萌发情况。
表4种子萌发和原球茎诱导培养基配方
结果:从表4可知,不同激素浓度对梵净山石斛种子萌发无明显影响,在其它条件一致情况下,NAA浓度为1.0mg/L时,6-BA在0.5mg/L,1mg/L,2mg/L时,均只有少部分种子萌发变绿,形成原球茎,大部分种子黄化后死亡,不能继续生长;基本培养基对种子萌发有一定影响,1/2MS培养基中大部分种子萌发,形成绿色原球茎,少部分种子黄化死亡,不能继续生长,表明其它条件一致的情况下,1/2MS培养基比MS培养基对梵净山石斛种子萌发和原球茎诱导效果更好;培养基性质也对种子萌发具有一定的影响,半固体MS培养基中大部分种子萌发,形成黄绿色原球茎,少部分种子黄化,表明半固体培养基比固体培养基更能促进种子萌发;添加物对种子萌发影响很大,MS固体培养基添加活性炭后,种子几大部分萌发,形成深绿色原球茎,原球茎饱满,长势良好,表明添加活性碳能够极大的促进种子萌发和原球茎形成,且原球茎长势最好。综上,梵净山石斛种子萌发和原球茎诱导最佳培养基为:MS+1.0mg/L NAA+1.0mg/L 6-BA+7g/L琼脂+25g/L蔗糖+1g/L活性炭。
5原球茎增殖培养基筛选
方法:以固体MS为基本培养基,添加固定浓度NAA为0.5mg/L,分别设置6-BA浓度为1mg/L、2mg/L和3mg/L,选取生长良好的原球茎作为外植体,称重后转接到原球茎增殖培养基中,具体见表,考察不同激素对原球茎增殖的影响。每处理接种5瓶,重复3次。接种50d后观察原球茎生长情况并统计增殖原球茎的数量,计算增殖系数。
表5原球茎增殖情况
结果:从表5可知,NAA不变为0.5mg/L,6-BA在1mg/L时,原球茎长势较差,增殖系数较低,显著小于2mg/L和3mg/L;6-BA在2mg/L和3mg/L时增殖系数无显著性差异,当6-BA为3mg/L时,原球茎分化为小苗较多,但少部分原球茎褐化。因此,结合增殖系数和生长情况来看,原球茎增殖最佳激素组合为0.5mg/L NAA+2mg/L 6-BA。
6无菌小苗增殖培养基筛选
方法:以固体MS和1/2MS为基本培养基,添加固定浓度NAA为0.5mg/L,分别设置6-BA浓度为1mg/L、2mg/L和3mg/L,将萌发的无菌小苗(0.5~1cm)作为外植体,将小苗随机接种到各处理的培养基中,考察不同激素对不定芽增殖的影响。每处理接种5瓶,每瓶6~12个小苗,重复3次。接种50d后统计芽的数量,计算芽增殖系数。
表6无菌小苗增殖情况
结果:从表6可知,以种子萌发的无菌小苗作为外植体继代培养,基本培养基为MS,NAA浓度固定为0.5mg/L时,不同6-BA浓度对无菌小苗增殖无显著影响;基本培养基为1/2MS,NAA浓度固定为0.5mg/L时,无菌小苗不定芽增殖系数随着6-BA浓度的增加而增加,6-BA浓度为2mg/L和3mg/L时增殖系数显著大于1mg/L,而2mg/L和3mg/L之间无显著性差异。不同基本培养基对无菌小苗增殖具有影响,MS作为基本培养基增殖系数大于1/2MS。综上,结果表明MS更加适合用作无菌小苗增殖培养基,而NAA和6-BA浓度没有显著影响。
7生根壮苗培养基筛选
方法:以固体MS为基本培养基,添加不同浓度的6-BA、NAA和IBA,具体见表7,选取生长健壮、长势一致的增殖无菌小苗,将无菌小苗切成单株,随机接种到各培养基处理中,每处理接种3瓶,每瓶接种5株,重复3次。接种50d后观察小苗生长情况,统计生根株数、生根数(以长度大于0.3cm计数),计算生根率,并测量记录株高。
表7生根壮苗培养基激素配比
表8小苗生根壮苗情况
结果:从表8可知,不同激素对无菌小苗生根壮苗有影响,采用NAA和IBA组合,小苗生根率可达100%,但采用较高浓度NAA和较低浓度6-BA组合,小苗生根率为0,不能生根;NAA浓度固定不变为0.5mg/L时,不同IBA浓度对小苗生根数、株高和生长状况均无显著影响,表明IBA低浓度或者高浓度均可使梵净山石斛小苗生根壮苗,最佳激素组合为NAA和IBA组合。
以上所述仅为本发明的实施例,并非因此限制本发明的专利范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其它相关的技术领域,均同理包括在本发明的专利保护范围内。
- 静水与动水条件下可视化变开度裂隙注浆试验装置及方法
- 手术麻醉可视化监测躯体颜色温度及感应呼吸动度的装置
- 三位一体高灵敏度感应式可视化手术床
