一种蝉花多肽提取物及制备方法、质量检测方法和用途
文献发布时间:2024-04-18 20:01:30
技术领域
本发明涉及一种蝉花多肽提取物及制备方法、质量检测方法和用途。
背景技术
生物活性肽具有多种生理调节活性,如降血压、降血脂、抑菌、抗氧化、抑制肿瘤和免疫调节等。抗氧化活性可通过清除人体内自由基,降低自由基过量堆积带来的机体加速衰老、心血管疾病等风险,而抗氧化剂来源主要包括化学抗氧化剂和天然抗氧化剂等。化学抗氧化剂工艺成熟、产量大,但存在一定毒副作用,人体摄入存在很多条件限制。抗氧化肽作为一种天然抗氧化剂,安全性远高于化学抗氧化剂。
目前制备多肽方法有酶法、化学法和固态发酵法。化学合成法则对技术要求高,工艺繁琐,多不被采用。酶解法在食品和生物医药业中应用性很高,因为酶解的过程中不会加入有机溶剂,也不会产生对人体有毒害的物质,整个反应体系便于调控,具有多种优点如反应效率高、条件温和、反应过程可控且能够保留多肽的营养价值。目前常见的酶有胰蛋白酶、胃蛋白酶、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶。
蝉花为麦角菌科真菌大蝉草Cordyceps cicadae Shing的无性型蝉拟青霉Paecilomyces cicadae(Miq.)Samon寄生在山蝉Cicada ftammatas Dist.幼虫上的真菌孢梗束或子座及幼虫尸体的干燥复合体。始载于《雷公炮炙论》,其性寒,味咸、甘,具有疏散风热,透疹,熄风止痉,明目退翳。用于外感风寒,发热头昏,咽痛;麻疹初期,疹出不畅;小儿惊风,夜啼;目赤肿痛,翳膜遮睛。现代研究表明,蝉花中含有核苷类、麦角甾醇、虫草酸、氨基酸、多糖、有机酸等多种化学成分,具有抗氧化、免疫调节、抗衰老、保护肾脏及抗肿瘤等作用。
目前对蝉花的研究主要集中在其中的多糖、虫草酸、虫草素领域,如申请号201410799979.3,发明名称:一种提高免疫力、抗肿瘤、改善肾功能、促进睡眠的金蝉花提取物,涉及提高免疫力、抗肿瘤、改善肾功能、促进睡眠的金蝉花提取物,有效解决金蝉花提取物有效成分含量低、活性成分提取得率低、产品收率低及产品活性低的问题,该提取物是金蝉花药材粉碎,加纯水,循环超声提取,离心过滤除渣,得提取液,提取液经超滤膜微滤,得清液,膜浓缩至比重为1.15-1.20的浓缩液,冷冻,干燥,即得,本发明实现了虫草素、虫草酸(甘露醇)、腺苷、多糖等有效成分在较低的温度下的提取,提取得率高,产品收率高。对于蝉花中的多肽,尚无相关的研究报道。
发明内容
本发明的技术方案是提供了一种蝉花多肽提取物。本发明还提供了该蝉花多肽提取物的制备方法、以及质量检测方法和用途。
本发明提供了一种蝉花多肽提取物,它包含下述三个肽段:IVINHPGQIGNGY、SIEPPTRPTDKPL、FTDYPPLGRF。
本发明蝉花多肽提取物是以蝉花为原料,采用水酶法提取制备而成。
本发明还提供了一种制备所述的蝉花多肽提取物的方法,它包括如下步骤:
a、取蝉花粉末,打粉,加入有机溶剂脱脂;
b、取a步骤蝉花脱脂粉,加水于常温下溶胀,用碱或盐调pH,加入蛋白酶水解,水解完成后将溶液煮沸,灭活蛋白酶,冷却、离心,微孔滤膜过滤,浓缩,冷冻干燥,即得。
进一步地,a步骤所述的有机溶剂是石油醚;b步骤所述的蛋白酶是瓜蛋白酶、胰蛋白酶、胃蛋白酶、中性蛋白酶、碱性蛋白酶。
更进一步优选地,a步骤所述的脱脂方法为:取蝉花粉末,以1:3(w:v)加入石油醚(30℃~60℃),于常温静置24h,过滤,滤渣于45℃烘干,得到蝉花脱脂粉末;b步骤所述的提取方法为:取蝉花脱脂粉,加入蒸馏水(料液比1:16),于常温下0.5h使其充分溶胀,用1mol/LNaOH或1mol/LHCl,调节pH至1.5,加入胃蛋白酶,加酶量为4570u/g,酶解温度为37℃,开始酶解,酶解时间为4h,酶解完成后将样品溶液煮沸10min,使酶灭活,冷却后,4000r/min离心15min,取上清液,待测。
本发明还提供了一种所述的蝉花多肽提取物的质量检测方法,它是通过Nano LC-Q-Exactive
进一步地,它包括如下步骤:
a、检测样本前处理:
取待检测多肽溶液加入DTT溶液使其终浓度为10mmol/L,于56℃水浴中还原1h;加入IAM溶液使其终浓度为55mmol/L,避光反应40min;使用自填脱盐柱脱盐,于45℃真空离心浓缩仪中挥干溶剂,0.1%甲酸-水复溶;
b、Nano LC-MS/MS分析
流动相A:0.1%甲酸水;流动相B:20%0.1%甲酸乙腈;流速为600nL/min;上样量2~20μL;洗脱梯度为:0~3min,4%~8% B;3~89min,8%~28% B;89~109min,28%~40% B;
质谱检测条件:Q-Exactive
本发明还提供了所述的蝉花多肽提取物在制备具有抗氧化作用的保健食品或药品中的用途。
本发明还提供了一种具有抗氧化作用的保健食品组合物或药物组合物,它含有所述的蝉花多肽提取物为活性成分,加上保健食品或药品中可接受的辅料或辅助性成分制备成常用的制剂。
其中,所述的制剂是口服制剂。
本发明蝉花多肽提取物,质量可控,基于质谱检测技术的多肽组学的发展为鉴定蝉花的多肽提供便利。全扫描的数据采集模式。可以获得未知多肽质谱信息,通过对多肽一、二级质谱图进行采集,得到丰富的离子信息,结合数据库匹配完成多肽的分析鉴定。本发明采用多肽组学手段通过纳升液相与高分辨质谱串联(Nano LC-Q-Exactive)技术对蝉花中的多肽类成分进行检测,从而灵敏快速地鉴定多肽短时间内获得大量数据。制备的多肽提取物具有较好的抗氧化性,可以作为优质抗氧化肽的良好来源。
附图说明
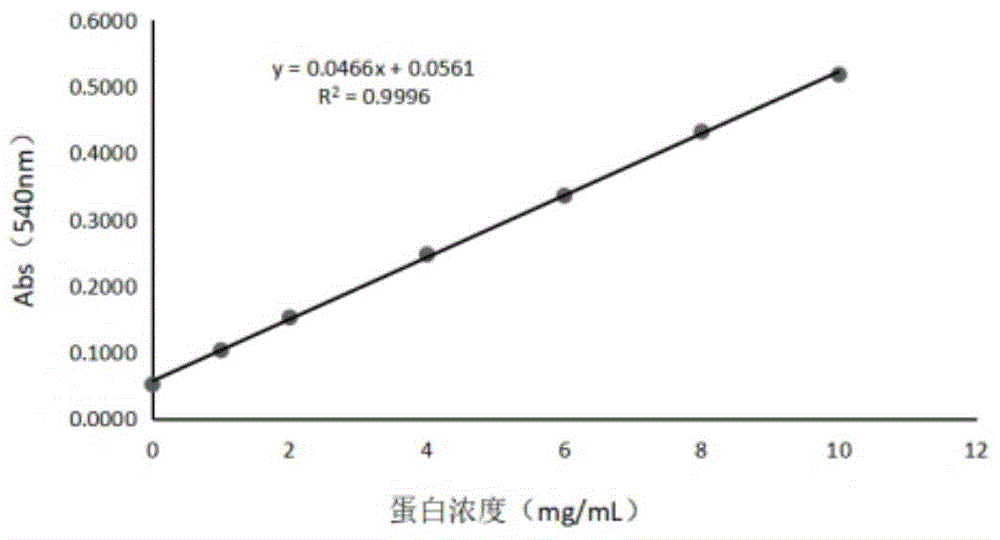
图1多肽标准曲线图;
图2不同蛋白酶酶解多肽的得率图;
图3不同提取条件对多肽得率的影响图(A:pH;B:酶解温度;C:加酶量;D:料液比;E:酶解时间);
图4 pH、料液比、加酶量交互作用对蝉花多肽提取率的影响图;
图5蝉花多肽的总离子流图(Y1);
图6蝉花多肽的总离子流图(Y2);
图7蝉花多肽的总离子流图(Y3);
图8 Q-Exactive
图9蝉花多肽提取液(A)、L-还原型谷胱甘肽(B)对DPPH自基清除能力图;
图10蝉花多肽提取液(A)、L-还原型谷胱甘肽(B)对ABTS自基清除能力图。
具体实施方式
实施例1本发明蝉花多肽提取工艺
1材料与方法
1.1供试材料
1.1.1仪器
PHS-3E型PH计(雷磁有限公司);TCL-16G型离心机(上海安亭科学仪器厂);HH-S8型电热恒温水浴锅(科技有限公司);TGL-16高速冷冻离心机(四川蜀科仪器有限公司);BS110S十万分之一分析天平(德国sartorius公司);UV-6100型紫外可见分光光度计(上海美谱达仪器有限公司)。
1.1.2试药和试剂
蝉花干品购于新荷花中药材饮片市场;HCL(批号:2207251)四川百隆科学有限公司;NaOH(批号:2022112101)、三氯乙酸(批号:2022060601)、硫酸铜(批号:2022081202)、酒石酸钾(批号:2022042201)成都市科隆化学品有限公司;牛血清白蛋白(批号:130208)(总蛋白含量≥98%)如吉生物科技;木瓜蛋白酶(批号:810R023,蛋白酶活力:100000U/g)、胰蛋白酶(批号:906W021,蛋白酶活力:250000U/g)、胃蛋白酶(批号:623J031,蛋白酶活力:3000U/g)、中性蛋白酶(批号:823J011,蛋白酶活力:50000U/g)、碱性蛋白酶(批号:701Z023,蛋白酶活力:200000U/g)均来源于北京索莱安公司。纯水均购自华润怡宝饮料有限公司。
1.2方法
1.2.1蝉花多肽的制备
取一定量的蝉花粉末,以1:3(w:v)加入石油醚(30℃~60℃),于常温静置24h,过滤,滤渣于45℃烘干,得到蝉花脱脂粉末。
取0.5g蝉花脱脂粉,加入8mL蒸馏水(料液比1:16),于常温下0.5h使其充分溶胀,用1mol/LNaOH或1mol/LHCl,按所需条件调节到各酶的最适pH,加入蛋白酶,水浴锅调节到各酶最适温度,开始水解,水解完成后将样品溶液煮沸10min,使酶灭活,冷却后,4000r/min离心15min,取上清液,待测。
三氯乙酸可溶性氮(TCA-NSI)法:取2mL水解液与2mL10%TCA溶液混合后反应30min,在4500r/min下离心20min,上清液用双缩脲法测多肽得率。
1.2.2制作标准曲线
标准蛋白质溶液(浓度为10mg/mL):称取100mg牛血清白蛋白(BSA),用水定容至10mL。
双缩脲试剂:称取1.5g硫酸铜(CuSO
取6只干燥洁净的试管编号,按表加入试剂。充分混匀后,室温下(20℃~25℃)放置30min,紫外可见分光光度计540nm下测定吸光度值。以A540为纵坐标,蛋白质浓度为横坐标,绘制标准曲线表1。
表1标准曲线的制作
1.2.3蝉花多肽得率的测定
取试管,加入待测样品液各1mL,加双缩脲试剂4mL,室温下放置30min,测定A540,由测得的吸光度在标准曲线上查得样品浓度,以mg/mL计。
式中:n为稀释倍数
1.2.4单因素实验
蛋白酶的筛选:按1.2.1的流程,以多肽得率为指标,根据表2中各种酶的最适条件,加酶量4000u/g对蝉花粉末进行水解,水解时间为1、2、4、6、8h,绘制多肽浓度曲线,计算多肽得率。
表2各酶最适条件
1.2.5响应面优化蝉花多肽的提取工艺
以多肽得率为响应值,在单因素试验的基础上,确定提取工艺的主要影响工艺和水平,采用Design-Expert V8.0.6软件,进行3因素3水平的Box-Behnken试验设计,并对结果进行统计分析。
1.2.7数据统计和分析
采用SPSS Statistics 25.0进行数据处理,单因素方差分析,采用多重比较的方法进行显著性分析,显著性水平为P<0.05。使用GraphPad Prism进行绘图。
2结果与分析
2.1双缩脲试剂法测定多肽浓度的标准曲线
不同的蛋白质浓度的吸光度(表4)值绘制标准曲线(见图1)。
表3不同蛋白质浓度下的吸光度
2.2单因素试验
2.2.1不同酶酶解蛋白的多肽得率
几种蛋白酶水解蝉花药材的多肽得率-时间曲线,从图2中可见,木瓜蛋白酶、胰蛋白酶、中性蛋白酶效率较低,胃蛋白酶效率最好。后续采用胃蛋白酶酶解蝉花多肽进行工艺考察。
2.2.2不同提取条件对多肽得率的影响
胃蛋白酶的酶解性能、水解效率的提升需要适宜的酸性环境,由图3A可知随着酶解液pH值的增大,蝉花多肽得率先增大后减小,在pH值为1.5时,多肽得率达最大值此后pH增加,多肽得率表现为下降趋势。这是因在酶解反应中,每种酶促反应都会有对应的最适pH,过高或过低的pH值都会对酶的催化活性产生抑制作用,从而影响蛋白酶与底物的结合,降低多肽得率,因此,在本试验条件下,酶的最适pH值为1.5。
酶解温度对多肽得率的影响,多肽得率最先表现为随着温度得升高而升高,到达临界点后转变为随温度升高而下降,实验结果表明(图3B),酶解温度达到37℃时,多肽得率最大。在大于37℃时多肽得率减少且趋于平缓,这是因为酶具有温度依赖性,每种酶都有其最适的酶解温度,温度过高或者过低都无法达到酶的最大催化活性,并可能导致酶的变性失活,多肽作为主要酶解产物,产量会相应减少,最终导致多肽得率降低。因此选择酶解温度为37℃较佳。
加酶量对多肽得率的影响(图3C),多肽得率的趋势表现为随着加酶量的增加先增后减,在加酶量达到4000u/g时,多肽得率最大。这是由于在反应体系中,酶添加量越大,就有越多的蛋白质被酶解成多肽,多肽得率也随之上升。酶量增加到一定值时,反应体系中的蛋白质被酶解得较彻底,底物的水解程度趋于饱和,此时继续添加酶会使酶的催化能力被抑制,导致多肽得率下降。因此选取4000u/g的加酶量作为蝉花蛋白酶解时的最佳酶量。
料液比为1:12~1:16时,料液比越高多肽得率越高。当料液比为1:16时多肽得率最高,之后随着料液比的增加多肽得率显著性降低然后趋于平缓。因此,取料液比为1:16较佳(图3D)。
酶解时间对多肽得率的影响(图3E),酶解时间2~4h时,多肽得率随着时间升高而增加。当酶解时间为4h时,多肽得率达到最大,当酶解时间超过4h,多肽得率逐渐减少且趋于平缓。这是因为当酶的作用已达到饱和状态时,继续延长酶解时间并不能提升多肽得率。因此将选择4h为最佳酶解时间。
2.3响应面优化蝉花多肽得提取试验
2.3.1响应面模型试验
基于响应面中心组合Box-Behnken设计试验,影响多肽得率(Y)的三个因素为:pH(A),料液比(B),添酶量(C),以多肽得率为考察指标,采用三因素三水平的响应面分析法进行实验设计,以确定蝉花多肽的最优酶解条件,其因素水平编码表4。Box-Behnken试验设计方案及结果如表5。
表4响应面试验因素及水平
表5Box-Behnken试验设计方案及结果
2.3.2响应面试验回归模型的建立
采用Design Expert 13对试验数据进行回归分析,得到pH(A)、料液比(B)、添酶量(C)与蝉花多肽得率的回归方程:Y=10.68-0.5500A-0.1200B-0.1675C+0.2175AB-0.3725AC+0.2525BC-3.37A
模型P≤0.01,表明模型具有极显著性差异,失拟项P值为0.2183>0.1(不显著),表明二次模型是高度可靠的,说明不同提取条件下蝉花多肽的提取率有显著性差异,其决定系数R
通过显著性分析可以看出A的P值大于C的P值,B的P值最小,可以说明对响应值的影响程度为:A>C>B,酶解pH的影响力更大,其次是添酶量,料液比的影响最小。
表6回归模型显著性检验及方差分析
*:P≤0.05**:P≤0.01
利用Design Expert软件绘制等高线和响应面,如图4,反应了pH、料液比、添酶量各因素两两之间的交互作用及对蝉花多肽得率得的影响。各因素间的交互作用是否显著可以通过响应面直观的反应,可以从响应曲面坡度陡峭程度说明因素的改变对其响应值的影响程度。等高线的密集程度以及形状可以反映各因素间的交互作用是否显著,等高线越密集、形状呈椭圆形,说明两因素的交互作用显著。根据响应面试验结果,pH(A)、料液比(B)、添酶量(C)两两交互作用时,任意两个因素对多肽得率均有影响,随着两个影响因素的比例增加,其多肽得率表现出先增加后下降的趋势,均存在多肽得率的最大值点,但各响应曲面陡峭程度存在一定差异。
2.3.3验证试验
通过响应面试验优化,得到蝉花多肽得率最优工艺参数为:pH=1.450,料液比1:15.93,加酶量4567.544u/g。在此条件下蝉花多肽得率的理论值为10.428%。
综合考量上述最优提取工艺条件和实际可操作性,将最佳提取条件调整为pH=1.5,料液比1:16,加酶量4570u/g。重复实验3次,测得蝉花多肽得率为10.360%,RSD<3%,相对误差小于1%,结果可靠。
最终确定其最佳工艺为:取蝉花粉末,以1:3(w:v)加入石油醚(30℃~60℃),于常温静置24h,过滤,滤渣于45℃烘干,得到蝉花脱脂粉末。取0.5g蝉花脱脂粉,加入8mL蒸馏水(料液比1:16),于常温下0.5h使其充分溶胀,用1mol/LNaOH或1mol/LHCl调pH=1.5,加入胃蛋白酶4570u/g,水浴锅调节37℃,开始水解,水解完成后将样品溶液煮沸10min,使酶灭活,冷却后,4000r/min离心15min,取上清液。
实施例2本发明基于Nano LC-Q Exactive的蝉花多肽鉴定方法
1实验材料
1.1试药与试剂
3批蝉花干品产地分别四川(Y1)、江西(Y2)、安徽(Y3),二硫苏糖醇(DTT)、碘乙酰胺(IAM)、碳酸氢铵(NH
1.2仪器
Easy-nLC 1200液相色谱仪(美国Thermo Fisher Scientific公司);Q Exactive
2 实验方法
2.1 多肽提取
取一定量的蝉花粉末,以1:3(w:v)加入石油醚(30℃~60℃),于常温静置24h,过滤,滤渣于45℃烘干,得到蝉花脱脂粉末。
取0.5g蝉花脱脂粉,加入8mL蒸馏水(料液比1:16),于常温下0.5h使其充分溶胀,用1mol/LNaOH或1mol/LHCl调pH=1.5,加入胃蛋白酶4570u/g,水浴锅调节37℃,开始水解,水解完成后将样品溶液煮沸10min,使酶灭活,冷却后,4000r/min离心15min,取上清液。三批蝉花干品制备多肽溶液。
2.2样本处理
取适量多肽溶液加入DTT溶液使其终浓度为10mmol/L,于56℃水浴中还原1h。加入IAM溶液使其终浓度为55mmol/L,避光反应40min。使用自填脱盐柱脱盐,于45℃真空离心浓缩仪中挥干溶剂,0.1%甲酸-水复溶,以便进行LC-LC/MS分析。
2.3 Nano LC-MS/MS分析
流动相A:0.1%甲酸水;流动相B:20%0.1%甲酸乙腈;流速为600nL/min;上样量2~20μL。洗脱梯度为:0~3min,4%~8% B;3~89min,8%~28% B;89~109min,28%~40% B
质谱检测条件:Q-Exactive
2.4数据处理
使用PEAKS Studio(10.6)软件进行Uniport数据库检索和蛋白鉴定,参数设置如下:酶解方式:Non specific:遗漏酶切位点:3,一级质谱误差<20ppm,二级质谱误差<0.02Da。数据库为实验室自建数据库。固定修饰为半胱氨酸烷基化;可变修饰为甲硫氨酸的氧化和蛋白N端乙酰化。
3.实验结果
3.1蝉花多肽质谱总离子流图
蝉花多肽提取液通过Nano LC-Q-Exactive进行分析鉴定,得到多肽的总离子流图。根据多肽的溶解性依次被C
3.2蝉花多肽分析
采用PEAKS软件结合实验室数据库对多肽总离子流图进行匹配,Y1、Y2、Y3共鉴定到多肽分别72、38、96条,Y1相对分子质量分布范围为200~1200、Y2相对分子质量分布范围为600~3600、Y3相对分子质量分布范围为600~2300。由(图8A)Y1~Y3多数多肽的相对分子质量分布在1000~2000。对鉴定到的多肽所带电荷数进行分析发现(图8B),这些多肽的电荷数为1~6,主要为2个电荷的多肽。将鉴定后的肽段长度进行分析(图8C),Y1肽段长度分布在7~21个氨基酸范围内,Y2肽段长度分布在7~33个氨基酸范围内,Y3肽段长度分布在7-20个氨基酸范围内。其中大多为10~20个氨基酸序列,Y1序列最长的肽段为MVVTFAPSNVTTEVKSVEMHH,他有21个氨基酸,相对分子质量为2342.1399,带5个电荷。Y2序列最长的肽段为VGRVETGVIKPGMVVTFAPSNVTTEVKSVEM(+15.99)HH,相对分子质量为3550.8276Y3,带6个电荷。Y3序列最长的肽段为VPISGFHGDNML AASTNC(+57.02)PW,相对分子质量为2172.9722,带3个电荷。
对多肽的氨基酸残基出现频次进行统计(图8D),发现出现频次最多的是甘氨酸(G),其次是丙氨酸(P)。其中,丝氨酸(S)、苏氨酸(T)、赖氨酸(K)及谷氨酸(E)等都是出现频次较高的亲水性氨基酸;疏水性氨基酸丙氨酸(A)、异亮氨酸(I)及缬氨酸(V)等的出现频次较多。Y1~Y3亲水性氨基酸一共出现频次总共为1310次,占总数的53.7%。采用GRAVY软件对肽段进行亲水性评分,评分越低则胀段的亲水性越好。由图8E的可知Y1~Y3亲水性肽段总共80条,主要评分在-1~0之间,疏水性肽段64条,主要评分在0~1之间,亲水性肽段的数量要多于疏水性肽段的数量,说明蝉花中肽段大多为亲水性肽段。
通过质谱鉴定结合PEAKS软件对自建库进行搜索匹配可以得到多肽的序列,对其二级质谱图进行分析可以得到蝉花肽段信息。表7~表9中展示了Y1~Y3得分较高的20个肽段信息,通过Uniprot数据库鉴别多肽序列以及蛋白,蛋白质以酶和骨架蛋白居多,主要来源于以下蛋白Translation elongation factor 1-alpha,chitinase,Elongationfactor-1alpha,GIY-YIG endonuclease。从Uniprot数据库中检索到这些蛋白质均来源于蝉花(Cordyceps cicadae)单味药材。
通过分析已鉴定蛋白以及肽段信息后,得到能够代表样品中某一个蛋白质的多肽,即为鉴定蛋白数据集中的特征肽。在此基础上,选择无修饰、无漏切位点、响应高、稳定性好且长度适宜的特征肽作为蝉花质量标志物。最终,筛选得到3个特征肽。在样品Y3中IVINHPGQIGNGY、SIEPPTRPTDKPL、FTDYPPLGRF肽段评分前三,且均来源于平移伸长率因子1-α蛋白Translation elongation factor 1-alpha,该蛋白来源于生物体蝉花Cordycepscicadae。
取另外两批样品Y1、Y2进行检测,IVINHPGQIGNGY、SIEPPTRPTDKPL、FTDYPPLGRF肽段评分均较高,推测这三个肽段可以作为蝉花质量标志物。
Translation elongation factor 1-alpha具有GTP酶激活功能,GTP酶是一族调节蛋白,可以与被激活的G蛋白结合并刺激其GTP酶的活性,降低G蛋白的活性,最终终止信号传递活动。这类蛋白质在许多重要的细胞活动中都能发挥作用,例如大型G蛋白把信号从G蛋白偶联受体转导至不同的不同的信号传导过程中,而小型G蛋白与胞内运输和细胞循环有关。该前体蛋白具有GTP结合蛋白功能,可结合鸟苷5'-三磷酸(GTP),GTP是一种核糖核苷酸鸟苷(一种与糖D-呋喃核糖相连的嘌呤碱基鸟嘌呤),携带三个酯化到糖部分的磷酸基团。该前体蛋白且具有平移伸长因子活性,在蛋白质合成的延伸阶段周期性地与核糖体结合,并催化进入的氨基酸残基和肽链之间酰基键的形成的蛋白质。该前体蛋白可结合核苷酸的蛋白质,核苷酸的磷酸酯,由与核糖或脱氧核糖磷酸盐相连的嘌呤或嘧啶碱基组成。该前体蛋白同时参与mRNA分子蛋白质生物合成的蛋白质,这个过程称为翻译,由核糖体执行,其中活化的氨基酸被添加到新生的多肽链中。
/>
/>
以下通过功效学试验证明本发明的有益效果。
试验例1本发明蝉花多肽提取物体外抗氧化活性
1实验材料
1.1试药与试剂
蝉花干品购于新荷花中药材饮片市场。2,2联苯基-1-苦基肼基(批号DPPHCHB210105)、2,2-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS,批号:AA0400)、L-还原型谷胱甘肽(批号:CHB201214)成都克洛玛生物科技有限公司。过硫酸钾(批号:2021110101)成都市科隆化学品有限公司。无水乙醇分析级,纯水均购自华润怡宝饮料有限公司。
1.2仪器
UV-6100型紫外可见分光光度计(上海美谱达仪器有限公司)。
2 实验方法
2.1 供试品制备
取一定量的蝉花粉末,以1:3(w:v)加入石油醚(30℃~60℃),于常温静置24h,过滤,滤渣于45℃烘干,得到蝉花脱脂粉末。
取0.5g蝉花脱脂粉,加入8mL蒸馏水(料液比1:16),于常温下0.5h使其充分溶胀,用1mol/LNaOH或1mol/LHCl调pH=1.5,加入胃蛋白酶4570u/g,水浴锅调节37℃,开始水解,水解完成后将样品溶液煮沸10min,使酶灭活,冷却后,4000r/min离心15min,取上清液,为供试品。
2.2DPPH自由基清除率
DPPH溶液的制备:精密称取DPPH 5.15mg,适量无水乙醇溶解,避光超声溶液使其溶解充分,再加无水乙醇定容至100mL,配制成50.0μg/mL DPPH溶液。避光4℃冷藏,备用。
DPPH自由基清除率的测定:将1mL供试品溶液与3mL的DPPH溶液混匀,作为试验组A
将1mL样品溶剂纯水与3mL的DPPH溶液混匀,作为空白组A
DPPH清除率(%)=[1-(A
2.3ABTS自由基清除率
ABTS溶液的制备:精密称取ABTS200.55mg,过硫酸钾34.87mg,溶于50mL蒸馏水,摇匀,室温避光放置24h作为ABTS母液。取适量ABTS母液,用无水乙醇稀释至734nm波长处吸光度值在0.70±0.02内。
ABTS自由基清除率的测定:将0.1mL供试品溶液与3.9mLABTS溶液混合,作为试验组A
ABTS清除率(%)=(1-A
3实验结果
3.1蝉花多肽体外抗氧化活性的测定
3.1.1DPPH自由基清除率的测定
由图9可知,蝉花多肽提液对DPPH自由基有一定的清除作用,且随着浓度的不断增大,清除率逐渐上升,变现为浓度依赖型。但多肽提取液对DPPH的清除作用均低于阳性对照L-还原型谷胱甘肽。当蝉花多肽提取液浓度达到10mg/mL(以原生药量计)时,DPPH自由基清除率达到97.58%,IC50值为0.6519mg/mL;L-还原型谷胱甘肽浓度为0.5mg/mL时,DPPH自由基清除率为56.23%,IC50值为0.4061mg/mL。
3.1.2ABTS自由基清除率的测定
如图10所示,蝉花多肽提液对ABTS自由基有较强的清除作用,且随着浓度的不断增大,清除率逐渐上升。当蝉花多肽提取液浓度达到10mg/mL,ABTS自由基清除率达61.55%,IC50值为6.385mg/mL;L-还原型谷胱甘肽浓度为0.5mg/mL时,清除率达到99.56%,其IC50值为0.07312mg/mL。
本发明以多肽得率为指标,以蝉花为实验原料,对其进行提取酶解,制备蝉花抗氧化活性肽。首先通过对不同蛋白酶进行考察,筛选出效果最佳的蛋白酶,其次考察料液比、酶解温度、添酶量、酶解时间和酶解pH对多肽得率的影响,选取对多肽得率影响较显著的三个因素酶解pH,料液比,添酶量,并使用Box-Behnken设计了试验组合,优化了蝉花多肽的提取工艺。研究表面:从蝉花中得到蝉花多肽得率最优工艺参数为:pH=1.450,料液比1:15.93,加酶量4567.544u/g。在此条件下蝉花多肽得率的理论值为10.428%。综合考量上述最优提取工艺条件和实际可操作性,将最佳提取条件调整为pH=1.5,料液比1:16,加酶量4570u/g。重复实验3次,测得蝉花多肽得率为10.360%,RSD<3%。
蝉花中含多肽类物质,但其中的多肽类成分尚未被完全开发多肽组技术的发展及多肽检测技术的进步,为多肽鉴定提供了技术支持。多肽组学技术源自于“鸟枪法”蛋白质组学,它是基于蛋白质组学发展而来的一种多肽检测鉴定技术。近些年来,质谱的分辨率和灵敏度不断提升,特别是高分辨质谱的产生和发展,为多肽的研究提供了更多的便利,这极大地拓宽了天然多肽的研究范围。
本发明通过采用Nano LC-Q-Exactive对蝉花多肽进行鉴定,分别鉴定到72、38、96条序列不同的肽段,且均为多价态的肽段。此外,通过对氨基酸出现频次进行统计并对肽段进行亲水性评分发现,蝉花中的肽段主要为亲水性肽段。通过对其前体蛋白进行分析发现,蝉花多肽主要来源于酶及结构蛋白等。取三批样品进行检测,IVINHPGQIGNGY、SIEPPTRPTDKPL、FTDYPPLGRF肽段评分均较高,且均来源于蛋白Translation elongationfactor1-alpha,该蛋白来源于生物体蝉花Cordyceps cicadae,推测这三个肽段可以作为蝉花质量标志物。
体外抗氧化活性实验结果表明胃蛋白酶酶解蝉花多肽具有较好的抗氧化性,可以作为优质抗氧化肽的良好来源。
- 一种酸敏感两亲性化合物及其制备方法与用途
- 一种两亲性线性嵌段共聚物及制备方法和其纳米胶束的制备方法
- 一种可降解酸敏感两亲性接枝共聚物及其制备方法
- 一种可降解的酸敏感高分子两亲性阳离子嵌段共聚物与胶束粒子及其制备方法
