分离和培养组织驻留uPAR+/巢蛋白+干细胞的方法及其用途
文献发布时间:2024-04-18 20:01:30
技术领域
本公开涉及对在固体组织中的组织稳态和组织再生中起重要作用的组织驻留uPAR+/巢蛋白+干细胞进行分离和培养的方法,及其用途。
背景技术
用于分离和培养存在于固体组织中的干细胞的常规方法需要以下工序:进行组织解离以通过蛋白酶处理降解组织并将构成组织的每个细胞分开,然后制备单细胞悬液。在组织解离工序中,基于所用蛋白酶的类型、浓度、反应时间、反应温度和所用组织的类型,所获得的单细胞产量显示出很大的变化,使得在组织解离工序中细胞损伤是一个不可避免的问题。因此,组织解离过程显示出依赖于组织类型的细胞损伤程度和细胞产量的显著差异,具有难以标准化的缺点。特别地,在固体组织中干细胞的频率低于0.1%的情况下,众所周知,蛋白酶处理后的组织解离步骤导致极低的细胞产量。
需要从自组织解离出的单细胞悬液中分离和纯化组织驻留干细胞的后续工序。分离和纯化干细胞的工序涉及使用标志物(例如,c-Kit和Sca-1)来分离标志物为阳性或阴性的细胞。然而,由于这些标志物不仅在组织驻留干细胞中表达,而且也在造血细胞中表达,可能将不需要的细胞一起分出来,并且存在标志物为阴性的干细胞,从而限制了使用特定标志物分离和纯化组织驻留干细胞的方法。
发明内容
技术目标
本公开的一个目的是提供诱导位于固体组织(例如,脂肪组织、骨髓组织、心肌组织、周围神经组织、骨骼肌组织或滑膜组织)中的组织驻留uPAR+/巢蛋白+干细胞的细胞进入细胞周期,诱导迁移和生长,以及分离细胞的方法。
此外,本公开的另一目的是提供根据所述方法分离和培养的组织驻留uPAR+和巢蛋白+干细胞或其培养物。
此外,本公开的另一目的是提供用于预防或治疗炎症性疾病或自身免疫性疾病的药物组合物,所述药物组合物包含组织驻留uPAR+和巢蛋白+干细胞或其培养物作为活性成分。
此外,本公开的另一目的是提供用于愈合伤口或促进血管再生的药物组合物,所述药物组合物包含组织驻留uPAR+和巢蛋白+干细胞或其培养物作为活性成分。
技术方案
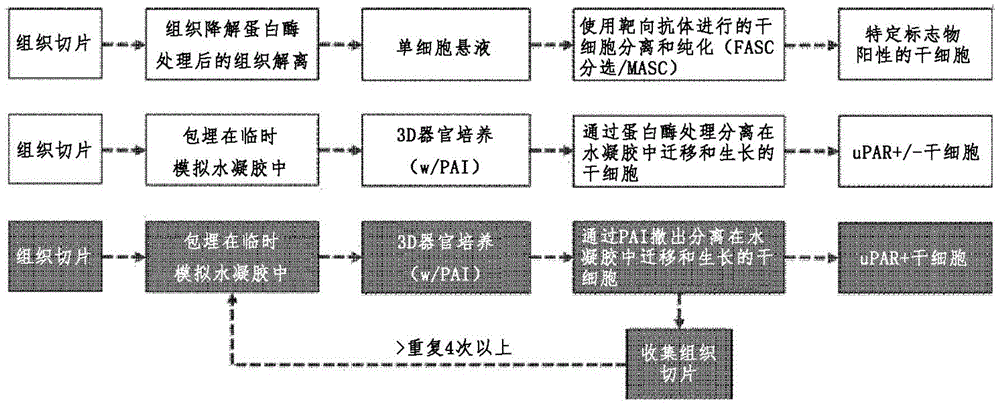
为了实现上述目的,本公开提供了诱导组织驻留uPAR+和巢蛋白+干细胞进入细胞周期的方法,所述方法包括:(1)制备临时基质模拟水凝胶;(2)将分离的组织碎片包封到所述临时基质模拟水凝胶中;以及(3)在添加有纤溶酶原激活物抑制剂(PAI)的培养基中对其中包封组织碎片的临时基质模拟水凝胶进行三维(3D)培养。
此外,本公开提供了对组织驻留uPAR+和巢蛋白+干细胞进行分离和培养的方法,所述方法包括:(1)制备临时基质模拟水凝胶;(2)将分离的组织碎片包封到所述临时基质模拟水凝胶中;(3)在添加有PAI的培养基中对其中包封所述组织碎片的临时基质模拟水凝胶进行3D培养;(4)去除3D培养基并通过洗涤去除PAI;(5)用不含PAI的培养基对所述去除PAI的培养物进行再培养以降解所述临时基质模拟水凝胶;以及(6)对在再培养培养基中释放的干细胞进行分离。
此外,本公开提供了根据所述方法分离和培养的组织驻留uPAR+和巢蛋白+干细胞或其培养物。
此外,本公开提供了用于预防或治疗炎症性疾病的药物组合物,所述药物组合物包含组织驻留uPAR+和巢蛋白+干细胞或其培养物作为活性成分。
此外,本公开提供了用于预防或治疗自身免疫性疾病的药物组合物,所述药物组合物包含组织驻留uPAR+和巢蛋白+干细胞或其培养物作为活性成分。
此外,本公开提供了用于愈合伤口的药物组合物,所述药物组合物包含组织驻留uPAR+和巢蛋白+干细胞或其培养物作为活性成分。
此外,本公开提供了用于促进血管再生的药物组合物,所述药物组合物包含组织驻留uPAR+和巢蛋白+干细胞或其培养物作为活性成分。
有益效果
本公开涉及对组织驻留uPAR+/巢蛋白+干细胞进行分离和培养的方法及其用途,提供了基于uPAR-纤溶酶活性对存在于固体组织中的组织驻留干细胞进行分离的方法。干细胞的uPAR-纤溶酶活性与干细胞的生长、迁移能力、生化活性和分化能力密切相关,因此适于作为对具有高水平功能活性的干细胞进行分离的方法。本公开的从固体组织分离的uPAR+干细胞由于适用于生产细胞治疗剂、组织工程治疗剂以及使用包括外泌体的分泌物的新型生物药物而具有巨大的工业潜力。此外,在本公开中,它可以应用于与组织驻留干细胞的细胞分裂、迁移、生长和分化相关的细胞生物学和分子生物学的基础研究以及新药开发研究。
附图说明
图1示出了体外器官培养的组织碎片中组成细胞的pFAK、uPAR、巢蛋白和Ki-67的表达率。2D,单层器官培养;3D,3D器官培养;AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。**,与2D相比p<0.01。
图2示出了心肌中表达pFAK+、uPAR+和巢蛋白+的细胞根据3D心肌器官培养而增加的特性。
图3示出了心肌中具有细胞分裂的ki-67阳性细胞根据3D器官培养而增加的特性。
图4示出了心肌中pFAK、uPAR、巢蛋白和ki-67阳性细胞的频率与3D心肌器官培养的时间成比例地增加。**,与0d(培养前)相比,p<0.01。
图5示出了在3D心肌器官培养后迁移到水凝胶中并在水凝胶中生长的细胞的uPAR、巢蛋白和BrdU的表达。
图6示出了在3D器官培养2周后迁移到水凝胶中并在水凝胶中生长的细胞的uPAR和巢蛋白的表达率。AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。
图7示出了器官培养之前和器官培养后3天组织碎片中uPAR mRNA表达(A)和纤溶酶活性(B)。AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。*,与培养前(培养之前)相比,p<0.05;**,与培养前(培养之前)相比,p<0.01。
图8示出,器官培养后在培养基中通过PAI去除和培养物洗涤而使水凝胶降解,并使迁移到水凝胶中并在水凝胶中生长的细胞被释放到培养基中。
图9示出了迁移到水凝胶中并在水凝胶中生长的细胞通过在培养基中的PAI去除和培养物洗涤而从水凝胶脱离,并且释放的细胞收缩和聚集(相差显微照相)。
图10示出了其中水凝胶中的uPAR+细胞在PAI去除和培养物洗涤后被释放的分离(石蜡切片的HE染色和uPAR免疫组织化学染色)。
图11示出了在PAI去除、培养物洗涤(PAI撤去)和外源性尿激酶添加(Urokinase)后从水凝胶中分离后收集的细胞的产量以及收集的细胞中uPAR的表达率。AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。**,与Urokinase相比p<0.01。
图12示出了通过对PAI去除和培养物洗涤后收集的组织碎片进行重复器官培养,从水凝胶中重复分离后收集的细胞的产量。AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。
图13示出了在培养容器中接种PAI去除和培养物洗涤后收集的细胞后,细胞在单层培养环境中的粘附和生长。A,PAI去除和洗涤后从水凝胶中释放的细胞的聚集体。B,从水凝胶中收集的细胞的聚集体。C-E,在培养容器中接种收集的细胞后30分钟(C)、1小时(D)和2小时(D)时的细胞的粘附和生长(相差显微照相)。
图14示出了在培养脂肪组织、骨髓、心肌、神经、骨骼肌和滑膜器官然后进行PAI去除并洗涤培养物(顶部)后从水凝胶中释放的细胞,以及收集的细胞被接种、粘附至培养容器并生长的结果(底部)(相差显微照相)。
图15示出了神经和心肌器官培养后PAI去除和培养物洗涤后从水凝胶释放的细胞在单层培养环境中的粘附和生长。
图16示出了从水凝胶中收集的细胞的免疫表型特征。A,PAI去除和培养物洗涤后从水凝胶中撤出后释放的细胞的免疫表型特征。B,外源性尿激酶处理后从水凝胶释放的细胞的免疫表型特征。AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。**,与尿激酶(B)相比p<0.01。
图17示出了从水凝胶收集的细胞的造血细胞和血管内皮细胞标志物的表达率。A,PAI去除和培养物洗涤后分离和收集的细胞的表达率。B,外源性尿激酶处理后分离和收集的细胞的表达率。AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。**,与尿激酶(B)相比p<0.01。
图18示出了从水凝胶中分离和收集的细胞的自我复制能力。A;集落形成单位(CFU)的代表性图片。B;根据组织来源从水凝胶中分离和收集的细胞的CFU频率。尿激酶,外源性尿激酶处理后分离和收集的细胞;PAI撤出,在PAI去除和培养物洗涤后分离和收集的细胞;AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。**,与尿激酶相比p<0.01。
图19示出了从水凝胶中分离和收集的细胞的体外生长能力。A;群体倍增时间(PDT)。B;群体倍增水平(PDL)。尿激酶,外源性尿激酶处理后分离和收集的细胞;PAI撤出,在PAI去除和培养物洗涤后分离和收集的细胞;AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。*,与尿激酶相比p<0.05;**,与尿激酶相比p<0.01。
图20示出了从水凝胶中分离和收集的细胞的Ki-67表达率。尿激酶,外源性尿激酶处理后分离和收集的细胞;PAI撤出,在PAI去除和培养物洗涤后分离和收集的细胞;AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。**,与尿激酶相比p<0.01。
图21示出了从水凝胶中分离和收集的细胞分化为成骨细胞(茜素红)和脂肪细胞(油红O)的能力。尿激酶,外源性尿激酶处理后分离和收集的细胞;PAI撤出,在PAI去除和培养物洗涤后分离和收集的细胞。
图22示出了从水凝胶中分离和收集的细胞分化为成骨细胞(茜素红)和脂肪细胞(油红O)的能力的比较。尿激酶,外源性尿激酶处理后分离和收集的细胞;PAI撤出,在PAI去除和培养物洗涤后分离和收集的细胞;AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。**,与尿激酶相比p<0.01。
图23示出了与从水凝胶中分离和收集的细胞的组织再生、干细胞动员和血管生成相关的mRNA的表达水平。尿激酶,外源性尿激酶处理后分离和收集的细胞;PAI撤出,在PAI去除和培养物洗涤后分离和收集的细胞;CB-MSC,脐带血来源的间充质干细胞;AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。*,与尿激酶相比p<0.05;**,与尿激酶相比p<0.01。
图24示出了从水凝胶中分离和收集的细胞的纤溶酶活性和巢蛋白表达率。uPAR-,外源性尿激酶处理后分离和纯化的uPAR阴性细胞;uPAR+,外源性尿激酶处理后分离和纯化的uPAR+细胞;PAI撤出,在PAI去除和培养物洗涤后分离和收集的细胞;AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。*,与uPAR-相比p<0.05;**,p,相对于uPAR-为0.01;*,与uPAR-相比p<0.05;**,与uPAR-相比p<0.01。
图25示出了从水凝胶中分离和收集的细胞的自我复制(集落形成单位;CFU)和体外生长(Ki-67)能力。uPAR-,外源性尿激酶处理后分离和纯化的uPAR阴性细胞;uPAR+,外源性尿激酶处理后分离和纯化的uPAR+细胞;PAI撤出,在PAI去除和培养物洗涤后分离和收集的细胞;AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。*,与uPAR-相比p<0.05;**,p,相对于uPAR-为0.01;*,与uPAR-相比p<0.05;**,与uPAR-相比p<0.01。
图26示出了从水凝胶中分离和收集的细胞的抗炎能力。LPS致敏的RAW 264.7细胞在条件培养基中的TNFα和IL-1β分泌抑制效果。uPAR-,外源性尿激酶处理后分离和纯化的uPAR阴性细胞;uPAR+,外源性尿激酶处理后分离和纯化的uPAR+细胞;PAI撤出,PAI去除和培养物洗涤后分离和收集的细胞;AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。*,与uPAR-相比p<0.05;**,p,相对于uPAR-为0.01;*,与uPAR-相比p<0.05;**,与uPAR-相比p<0.01。
图27示出了从水凝胶中分离和收集的细胞的血管内皮细胞(HUVEC)和成纤维细胞(DF)生长刺激活性。uPAR-,外源性尿激酶处理后分离和纯化的uPAR阴性细胞;uPAR+,外源性尿激酶处理后分离和纯化的uPAR+细胞;PAI撤出,PAI去除和培养物洗涤后分离和收集的细胞;AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。*,与uPAR-相比p<0.05;**,p,相对于uPAR-为0.01;*,与uPAR-相比p<0.05;**,与uPAR-相比p<0.01。
图28示出了从水凝胶中分离和收集的细胞的血管内皮细胞(HUVEC)和成纤维细胞(DF)细胞保护活性。uPAR-,外源性尿激酶处理后分离和纯化的uPAR阴性细胞;uPAR+,外源性尿激酶处理后分离和纯化的uPAR+细胞;PAI撤出,PAI去除和培养物洗涤后分离和收集的细胞;AT,脂肪组织;BM,骨髓;Myocar,心肌;PN,周围神经;SM,骨骼肌;Syn,滑膜。*,与uPAR-相比p<0.05;**,p,相对于uPAR-为0.01;*,与uPAR-相比p<0.05;**,与uPAR-相比p<0.01。
图29示出了与现有技术相比的本公开的示意图。
具体实施方式
本公开提供了诱导组织驻留uPAR+和巢蛋白+干细胞进入细胞周期的方法,所述方法包括:(1)制备临时基质模拟水凝胶;(2)将分离的组织碎片包封到所述临时基质模拟水凝胶中;以及(3)在添加有纤溶酶原激活物抑制剂(PAI)的培养基中对其中包封组织碎片的临时基质模拟水凝胶进行3D培养。
优选地,所述临时基质模拟水凝胶可以是纤维蛋白水凝胶,其中,浓度为0.25%至2.5%的纤维蛋白原溶液与浓度为0.5I.U./mL至5I.U./mL的凝血酶溶液混合;纤维蛋白/胶原混合水凝胶,其中,浓度为0.1%至0.5%的胶原溶液混合在纤维蛋白水凝胶中;或纤维蛋白/明胶混合水凝胶,其中,浓度为0.1%至0.5%的明胶溶液混合在纤维蛋白水凝胶中,但不限于此。
优选地,所述组织可以是脂肪组织、骨髓组织、心肌组织、周围神经组织、骨骼肌组织和滑膜组织,但不限于此。
优选地,PAI可以是氨甲环酸或氨基甲基苯甲酸,但不限于此。
优选地,所述方法可以激活组织中细胞的整合素-FAK细胞信号传导,以诱导组织驻留uPAR+和巢蛋白+干细胞的细胞分裂和细胞生长,但不限于此。
优选地,所述方法可以诱导组织驻留uPAR+和巢蛋白+干细胞进入临时基质模拟水凝胶中的细胞迁移以及在所述水凝胶中的细胞生长,但不限于此。
需要组织特异性临时基质来诱导本公开的uPAR+和巢蛋白+组织驻留干细胞迁移到临时基质中。通过模拟在组织损伤凝结后从血管释放的血浆中形成的临时基质组分,可以使用生物聚合物进行制备。本公开的临时基质可以单独使用纤维蛋白、胶原和明胶或其组合来制备。工程化的临时基质的uPA-纤溶酶活性因器官而异,可以制备对uPA-纤溶酶活性具有抗性的临时基质以供使用。临时基质可以通过调节生物聚合物的含量或组成来制备。换言之,可以使用通过混合两种以上组分(例如,纤维蛋白-胶原、纤维蛋白-明胶和胶原-明胶)获得的临时基质。本公开的临时基质可以含有1.0mg/mL至20.0mg/mL的量的组成聚合物,例如,纤维蛋白原、胶原和明胶。为了增强临时基质的结构性质,可以调节交联度,并且可以通过使用交联剂(例如,Ca++或因子XIIIa)控制临时基质的交联度来调节结构性质。
细胞信号传导通路的激活是通过体外培养来诱导组织中干细胞的细胞分裂和生长所必需的。与细胞的整合素配体结合,能够诱导细胞生长和迁移的信号可以通过临时基质被传递和激活。通过用能够经由直接结合细胞的整合素将信号传递到细胞中的临时基质来支持组织,能够诱导组织中的干细胞的细胞分裂、生长和迁移。整合素-β1-FAK信号传导通路通过整合素将信号传递给组织驻留干细胞并在临时基质的支持下诱导激活,并且组织驻留干细胞可以根据传递的信号增加uPAR和巢蛋白的表达并诱导组织中的再生干细胞的分裂、生长和迁移。本公开的能够激活整合素-FAK细胞信号传导通路的临时基质可以通过制备由具有RGD基序的聚合物(例如,纤维蛋白、胶原和明胶)组成的临时基质模拟水凝胶来实现上述目的。
本公开提供了通过激活整合素-β1-FAK-uPAR信号传导通路来诱导组织驻留干细胞的迁移、细胞分裂和生长的方法。向组织中的干细胞传导信号的效率与能够结合整合素配体的受体的密度成比例。能够结合整合素配体的受体的密度可以通过增加与组织的接触面来实现。因此,通过提供三维(3D)环境而不是二维(2D)环境来增加粘附到细胞的面积,可以增加整合素配体和受体的结合。因此,可以提高对组织中干细胞的信号传导效率。本公开提供了通过向组织提供人造临时基质的3D支持物来激活整合素-β1-FAK-uPAR信号传导通路的方法。为此,提供了通过用能够溶胶-凝胶相变的水凝胶作为临时基质向组织碎片提供3D结合来增强信号传导通路的方法。
uPA-纤溶酶活性可能因组织、损伤程度和原因而异。与脂肪、胎盘和脐带相比,神经组织具有高uPA-纤溶酶活性,因此,神经组织对临时基质具有高度的降解。可以通过调节构成临时基质的组分的含量、聚合物的分子量和交联密度的程度来控制临时基质的降解。本公开提供了通过增加构成临时基质的聚合物的浓度、分子量和交联度来控制对uPA-纤溶酶活性的抗性程度提高的方法。此外,本公开提供了通过PAI添加来调节uPA-纤溶酶活性以连续诱导临时基质中组织中的干细胞的活性、生长和迁移的方法。适用于本公开的PAI可以选自于由氨基己酸、氨甲环酸、抑肽酶和氨基甲基苯甲酸所组成的组。应用于本公开的PAI可以通过以10μg~10mg每mL水凝胶剂量的浓度添加来使用。因此,本公开提供了通过维持PAI的添加和临时基质的结构稳定在器官培养期间诱导和支持组织驻留干细胞的生长和迁移的方法。
对于干细胞的uPAR-uPA-纤溶酶的过度活性,由于在体外培养工序中临时基质模拟水凝胶的快速降解,组织碎片和细胞周围的临时基质被降解并丢失,造成干细胞可能粘附和迁移的临时基质的丢失,导致丢失、减少、或从组织迁移到水凝胶中的细胞的丢失。为了控制临时基质模拟水凝胶的过度降解和丢失,本公开提供了通过经由添加PAI控制干细胞和组织碎片的过度纤溶酶活性,使得在器官培养期间维持临时基质模拟水凝胶作为组织碎片的物理支持基质起作用同时使激活的组织驻留干细胞能够迁移和生长,从而保持和维持作为基质的结构功能的方法。
此外,本公开提供了对组织驻留uPAR+和巢蛋白+干细胞进行分离和培养的方法,所述方法包括:(1)制备临时基质模拟水凝胶;(2)将分离的组织碎片包封到所述临时基质模拟水凝胶中;(3)在添加有PAI的培养基中对其中包封组织碎片的临时基质模拟水凝胶进行3D培养;(4)去除3D培养基并通过洗涤去除PAI;(5)用不含PAI的培养基对所述去除PAI的培养物进行再培养以降解所述临时基质模拟水凝胶;以及(6)对在再培养培养基中释放的干细胞进行分离。
优选地,所述临时基质模拟水凝胶为纤维蛋白水凝胶,其中,浓度为0.25%至2.5%的纤维蛋白原溶液与浓度为0.5I.U./mL至5I.U./mL的凝血酶溶液混合;纤维蛋白/胶原混合水凝胶,其中,浓度为0.1%至0.5%的胶原溶液混合在纤维蛋白水凝胶中;或纤维蛋白/明胶混合水凝胶,其中,浓度为0.1%至0.5%的明胶溶液混合在纤维蛋白水凝胶中,但不限于此。
优选地,所述组织可以是脂肪组织、骨髓组织、心肌组织、周围神经组织、骨骼肌组织和滑膜组织,但不限于此。
优选地,PAI可以是氨甲环酸或氨基甲基苯甲酸,但不限于此。
优选地,步骤(5)可以诱导组织中uPAR表达的增加,并通过纤溶酶活性的增加来降解临时基质模拟水凝胶,但不限于此。
优选地,组织驻留uPAR+和巢蛋白+干细胞在自我复制、体外生长、分化或组织再生诱导方面可具有增加的能力,但不限于此。
优选地,在步骤(5)中从再培养培养基收集的组织碎片可以进一步包括重复步骤(2)至步骤(5)1次-10次的工序,但本公开不限于此。
本公开提供了选择性分离迁移到临时基质中并在临时基质中生长的uPAR+干细胞的方法。尽管可以通过PAI的添加来控制临时基质被过度的uPAR-纤溶酶活性的降解,但是提供了在实现目标干细胞的迁移和生长之后从临时基质收集细胞的方法。利用干细胞固有uPAR-纤溶酶活性的特性,通过在洗涤后去除PAI,提供了在临时基质降解时收集迁移到基质中并在基质中生长的释放的干细胞的方法。本公开提供了从固体组织中分离uPAR+干细胞的方法,无需使用任何外源性蛋白酶,也无需随后的纯化工序,根据在干细胞中的uPAR表达率和纤溶酶活性通过uPAR-纤溶酶降解临时基质。
本公开提供了在不使用任何外源性蛋白酶而保持器官培养中使用的组织碎片的结构和功能完整的状态下进行收集的方法。提供了通过重复器官培养诱导其迁移到临时基质中以收集组织驻留uPAR+干细胞并保留器官培养后收集的组织碎片的结构的方法,因为。
本公开提供了临时基质的组合物,在所述组合物中,组织驻留干细胞的uPAR-uPA-纤溶酶活性根据组织而变化,所述组合物不会由于根据组织的uPAR-uPA-纤溶酶的活性而被降解和丢失,并且还提供了根据组织的PAI的类型和浓度,其中过度降解是可控的。
提供了分离高纯度干细胞的方法,无需随后的纯化工艺,所述方法通过迁移到临时基质模拟水凝胶中并在临时基质模拟水凝胶中生长的组织驻留uPAR+/巢蛋白+干细胞的PAI冲洗和去除(PAI撤出)来进行。组织驻留uPAR+/巢蛋白+干细胞可用于生产具有高自我复制、体外生长、分化能力、组织再生诱导基因表达、血管再生和伤口愈合效果的干细胞来源的生物药物和干细胞治疗剂。
此外,本公开提供了根据所述方法分离和培养的组织驻留uPAR+和巢蛋白+干细胞,或其培养物。
在本公开中,本文使用的术语“培养基”是指能够在体外支持干细胞生长和存活的介质,并且包括介质中包含的所培养的干细胞的分泌物。用于培养的介质包括本领域中使用的适合干细胞培养的所有常规培养基。根据细胞的类型,可以选择介质和培养条件。用于培养的介质优选为细胞培养基础培养基(CCMM),通常包括碳源、氮源和微量元素组分。这样的细胞培养基础培养基包括但不限于,例如,Dulbecco改良Eagle培养基(DMEM)、最低必需培养基(MEM)、Eagle基础培养基(BME)、RPMI1640、F-10、F-12、α最低必需培养基(αMEM),Glasgow最低必需培养基(GMEM)和Iscove改良Dulbecco培养基。
另一方面,在本公开中,可用的形式包括:所有形式,包括干细胞、其分泌物和培养基组分;仅包括分泌物和培养基组分的形式;单独使用分离的分泌物的形式或与干细胞组合使用的形式;或通过仅施用于干细胞在体内产生分泌物的形式。
干细胞可以使用本领域公知的任何方法获得。
此外,本公开提供了用于预防或治疗炎症性疾病的药物组合物,所述药物组合物包含组织驻留uPAR+和巢蛋白+干细胞或其培养物作为活性成分。
此外,本公开提供了用于预防或治疗自身免疫性疾病的药物组合物,所述药物组合物包含组织驻留uPAR+和巢蛋白+干细胞或其培养物作为活性成分。
此外,本公开提供了用于愈合伤口的药物组合物,所述药物组合物包含组织驻留uPAR+和巢蛋白+干细胞或其培养物作为活性成分。
此外,本公开提供了用于促进血管再生的药物组合物,所述药物组合物包含组织驻留uPAR+和巢蛋白+干细胞或其培养物作为活性成分。
本公开的组织驻留uPAR+和巢蛋白+干细胞可用作治疗某些疾病的细胞治疗剂,其治疗可以是分子的前处理或直接治疗。
本文所用的术语“细胞治疗剂”是指用活的自体细胞、同种异体细胞和异种细胞在体外通过一系列动作(如通过其他方法进行增殖、选择或改变细胞的生物学特性)以恢复细胞和组织的功能从而用于治疗、诊断和预防的药物。
细胞治疗剂可以通过任何一般途径施用于人体,只要它可以到达目标组织。
除了活性成分之外,本公开的药物组合物还可以使用药学上合适的且生理上可接受的辅料来制备,其中,增溶剂(如赋形剂)、崩解剂、甜味剂、粘合剂、包衣剂、减摩剂、润滑剂、助流剂或调味剂可以用作辅料。本公开的药物组合物可以优选地制备为药用组合物,所述药用组合物包含活性成分以及一种或多种类型的药学上可接受的载体用于施用。在以液体溶液制备的组合物中,可混合并使用可接受的药物载体,包括盐水、无菌水、林格氏液、缓冲盐水、白蛋白注射溶液、葡萄糖溶液、麦芽糊精溶液、甘油、乙醇及其中一种或多种无菌且适用于体内的组分,以及可以根据需要添加其它常规的添加剂(例如,抗氧化剂、缓冲剂和抑菌剂)。此外,可以额外添加稀释剂、分散剂、表面活性剂、粘合剂和润滑剂来制备可注射制剂,例如,水性溶液、悬浮液和乳液、丸剂、胶囊剂、颗粒剂或片剂。
本公开的药物组合物的药物制剂形式可以是活性化合物的缓释制剂、颗粒剂、酸、包衣片剂、片剂、胶囊剂、栓剂、糖浆剂、果汁、悬浮液、乳剂、滴剂或注射液。本公开的药用组合物可以以常规方式通过静脉内、动脉内、腹膜内、肌内、动脉内、腹膜内、胸骨内、经皮、鼻内、吸入、局部、直肠、口服、眼内或皮内途径施用。本公开的药用组合物中活性成分的有效剂量是指预防或治疗疾病所需的量。因此,它可以根据各种因素来调节,包括疾病的类型、疾病的严重程度、组合物中包含的活性成分和其它组分的类型和含量、制剂的类型,和患者的年龄、体重、一般健康状况、性别和饮食,施用时间、施用途径和组合物的分泌速率,治疗的持续时间以及一起使用的药物。
本公开提供了分离干细胞的方法,所述方法不使用任何外源性蛋白酶并且在分离固体组织驻留干细胞的工艺中没有组织解离。由于不使用外源性蛋白酶,在分离干细胞后,组织可以保留其功能和结构,从而提供了能够用作组织源的方法,用于从组织中重复分离干细胞。
众所周知,组织驻留干细胞在构成组织的细胞中所占比例很小,通常低于0.01%。组织损伤后,体细胞数减少,替代或再生这些细胞的干细胞被激活,使得与损伤前相比,干细胞的频率增加。损伤后,组织中的干细胞通过细胞分裂自我复制,产生子代祖细胞,并且子代干细胞迁移到损伤部位。本专利提供了通过体外培养激活体内组织稳态机制并在体外将自我复制和分裂的干细胞募集到损伤部位来诱导组织碎片中干细胞的自我复制和细胞分裂的方法。
组织损伤后,在损伤组织周围形成临时基质,通过所述临时基质使得基质-细胞整合素途径被激活,当作用于组织损伤的干细胞在细胞分裂后迁移到损伤部位,引起组织再生机制的启动。本公开提供了激活组织中的干细胞,诱导细胞分裂、生长和迁移到临时基质模拟水凝胶,以及分离迁移到水凝胶中的干细胞的方法,所述方法通过组织碎片周围的临时基质模拟水凝胶的3D支持物最大化基质-细胞整合素相互作用来进行。
据报道,作为对组织损伤的反应,组织驻留干细胞被激活,并且被激活的干细胞具有增加的uPAR或巢蛋白表达。已经揭示了uPAR和巢蛋白表达在干细胞生长和迁移中发挥重要作用,并且已知uPAR+和巢蛋白+细胞在组织再生中发挥关键作用。由于uPAR和巢蛋白在修复性干细胞中的表达增加,uPAR和巢蛋白可以作为干细胞分离中的关键目标标志物。本公开提供了通过诱导组织驻留uPAR+和巢蛋白+干细胞的细胞分裂、生长和迁移(这是通过体外培养激活基质-细胞整合素途径的结果),选择性分离和收集uPAR+干细胞的方法。
此外,本公开提供了如下方法,所述方法是根据作为对干细胞的激活和刺激的生理反应的结果的uPAR-纤溶酶-MMP活性,在诱导迁移到3D培养时提供的临时基质模拟水凝胶中并在其中生长之后,根据迁移到水凝胶中并在水凝胶中生长的干细胞的纤溶酶活性和uPAR表达从水凝胶中分离和收集细胞,而无需外源性蛋白酶。
本公开提供了从代表性固体组织(例如,脂肪、骨髓、心肌、神经、骨骼肌和滑膜)中分离组织驻留uPAR+和巢蛋白+干细胞的一般方法。组织驻留uPAR+和巢蛋白+干细胞具有自我复制、高体外生长、多能性和高组织再生的能力,使得干细胞可以用作再生治疗剂。
实施例
在下文中,将通过示例实施方式更详细地描述本公开。这些示例实施方式仅用于更详细地描述本公开的目的,并且对于本领域的技术人员来说将显而易见的是,根据本公开的要点,本公开的范围不受这些示例实施方式的限制。
<实施例1>临时基质模拟水凝胶的制备
通过混合纤维蛋白原、胶原、明胶或这些聚合物制备临时基质模拟水凝胶。将血浆来源的纤维蛋白原以2.5mg/mL至10mg/mL的浓度溶解在包含10mM至50mM CaCl
将真皮来源的胶原(Matrix BioScience,德国)或明胶(befMatrix Collagen,Nitta Gelatin,日本)溶于0.1%(wt./vol.)乙酸中,以使用浓度为1.0mg/mL~20.0mg/mL的胶原溶液。用50mM NaHCO
临时基质模拟水凝胶通过如下方式制备:使用浓度为0.25%至2.5%的纤维蛋白原溶液和浓度为0.5I.U./mL至5I.U./mL的凝血酶溶液生产纤维蛋白原水凝胶,并在纤维蛋白水凝胶的制备过程中混合浓度为0.1%至0.5%的胶原或明胶溶液,从而制备纤维蛋白/胶原或纤维蛋白/明胶混合水凝胶。
<实施例2>二维(2D)和三维(3D)器官培养
用于培养的器官包括脂肪组织(AT)、骨髓(BM)、心肌(Myocar)、周围神经(PN)、骨骼肌(SM)和滑膜(Syn)。这项使用来源于脑死亡捐赠者的组织的研究获得了机构伦理审查委员会的批准,并且组织是脑死亡患者捐赠的。在用剪刀去除附着在周围组织上的纤维组织和血肿后,使用外科手术刀将捐赠的组织精细地切割成0.2mm
洗涤后,将组织碎片悬浮在培养基中,然后通过两种器官培养方法进行培养。在第一种方法中,定义为单层(2D)器官培养方法,是将悬浮在培养基中的组织碎片接种到培养容器中并在培养容器的表面上培养的情况。
在第二种方法中,定义为3D器官培养方法,是将组织碎片包埋在纤维蛋白、纤维蛋白/胶原或纤维蛋白/明胶临时基质模拟水凝胶中,并在三维(3D)环境中培养的方法。在3D器官培养方法中,将组织碎片与0.25%~2.5%纤维蛋白原溶液混合,然后以1:1的剂量与等量的0.5单位/mL~5单位/mL凝血酶溶液混合,并将混合物在37℃下聚合1小时以将组织碎片包埋在纤维蛋白水凝胶中。对于脂肪、骨髓、心脏和肌肉,将组织碎片包埋在临时基质模拟纤维蛋白水凝胶中,所述临时基质模拟纤维蛋白水凝具有最终为0.25%~1.25%的纤维蛋白原溶液和0.25单位/mL~2.5单位/mL的凝血酶溶液。对于神经和滑膜组织碎片,将组织碎片包埋在由0.25%~2.5%纤维蛋白原、0.1%~0.5%中性胶原或明胶溶液和0.25单位/mL~2.5单位/mL凝血酶溶液组成的临时基质模拟纤维蛋白/胶原或明胶水凝胶中。
将与临时基质模拟水凝胶溶液混合的组织碎片转移到100-mm至150-mm的培养容器中,然后将其置于37℃的培养箱中1小时,并在聚合工序后转化为凝胶。器官培养基的组合物包含45%v/v DMEM、45%v/v Ham’s F12、10%胎牛血清(FBS,Invitrogen)、20ng/mLEGF、2ng/mL bFGF、10ng/mL IGF和10μg/mL庆大霉素(Invitrogn)。以等于凝胶量的两倍的量加入培养基,并且在加入培养基之后,将培养容器放置在轨道振荡器上在以30rpm的速率搅拌的同时培养14天。培养基每周更换两次。
为了抑制水凝胶降解,在培养期间,将氨甲环酸或氨基甲基苯甲酸等PAI以每天10μg/mL~500μg/mL的浓度加入到培养基中。对于脂肪、骨髓、心肌和骨骼肌器官的培养,在培养基中加入浓度为100μg/mL~250μg/mL的氨甲环酸或氨基甲基苯甲酸,以抑制临时基质模拟水凝胶的降解。在周围神经和滑膜的情况下,将氨甲环酸或氨基甲基苯甲酸以250μg/mL~500μg/mL的浓度加入培养基中,然后进行培养。
<实施例3>根据器官培养的组织碎片中pFAK、uPAR、巢蛋白和Ki-67的表达
在2D和3D器官培养7天后,从培养容器或水凝胶中收集培养的脂肪组织、骨髓、心肌、神经、骨骼肌和滑膜组织碎片。使用4%中性福尔马林溶液固定2小时后制备石蜡块。从石蜡块上剥离厚度为4μm的切片,并进行免疫组织化学染色。
为了评估培养的组织中整合素-FAK细胞信号传导通路的活性程度,使用一抗(例如,抗-磷酸化FAK(3283,Cell Signaling Technology,USA;pFAK)、抗-uPAR(MAB807,R&DSystems,USA)和抗-Ki-67(M7240,DAKO,USA))来评估表达。在与一抗反应后,在经受三次洗涤、与HRP-缀合的二抗(ImmPRESS One-Step Polymer Systems,Vector Laboratories,USA)反应、使用DAB作为底物的显色、然后用苏木精(H-3401-500,Vector Laboratories)复染色后,评估阳性细胞的定位和表达率。
根据体外器官培养,组织碎片中的组成细胞被激活,激活的细胞在细胞分裂后增殖,以运行组织稳态机制来替换或再生受损或丢失的细胞。整合素细胞信号传导通路是诱导组织再生的主要机制之一,并且整合素细胞信号传导通过细胞配体、细胞外基质和受体的结合而激活。在本示例实施方式中分析的是pFAK、uPAR和巢蛋白蛋白的表达,所述pFAK、uPAR和巢蛋白蛋白是在单层培养(二维、2D)下培养的组织碎片内的组成细胞中由于整合素细胞信号传导而激活的目标因子,其中,组织碎片在直接接种到培养容器中后在培养容器的表面上进行培养,以及在包埋在水凝胶中后在三维(3D)环境中培养。
在3D器官培养后,发现在组织碎片中pFAK表达率显著高于2D器官培养。鉴定了器官培养后pFAK表达率根据组织类型的差异,并且在心肌、神经和骨骼肌中,3D器官培养后的pFAK表达显著更高(图1A)。
在3D器官培养环境下,整合素信号传导通路的下游因子uPAR的表达也显著地高,具有类似于pFAK的趋势,并且在心肌、神经和骨骼肌中观察到高表达(图1B)。
通过整合素信号传导,可以诱导器官中组成细胞的细胞分裂和生长。通过在经受再生或细胞分裂的细胞中特异性表达的巢蛋白和Ki-67的表达来评估细胞再生和细胞生长能力。与在2D器官培养后的组织中的巢蛋白表达相比,3D器官培养后组织碎片中的组成细胞中巢蛋白的表达率显著地高(图1C)。Ki-67(细胞分裂的标志物)的表达率在3D器官培养后的组织碎片中也显著地高(图1D)。
可以通过体外器官培养诱导构成组织碎片的细胞的细胞分裂和生长,通过3D培养环境利用能够结合整合素的配体最大化整合素信号传导,并增强作为下游目标因子的pFAK和uPAR的表达,因此发现与2D器官培养相比,3D器官培养诱导了组织碎片中组成细胞的显著高的细胞分裂和细胞生长。
临时基质模拟水凝胶的3D物理刺激可以提供通过激活器官中组成细胞的信号传导通路来显著增加细胞分裂和生长的方法。
<实施例4>3D器官培养后组织碎片中pFAK+、uPAR+和巢蛋白+细胞的定位和特征
从水凝胶中收集3D器官培养前(0d)或培养后3天、5天、7天和14天培养的心肌组织碎片。使用4%中性福尔马林溶液固定2小时后制备石蜡块。从石蜡块中获得厚度为4μm的切片,并进行免疫组织化学染色。为了评估培养后组织中整合素-FAK细胞信号传导通路的活性程度,使用一抗(例如,抗-磷酸化FAK(3283,Cell Signaling Technology,USA;pFAK),抗-uPAR(MAB807,R&D Systems,USA)、抗-巢蛋白(MAB5326,Millipore,USA)和抗-Ki-67(M7240,DAKO,USA))来评估表达。在与一抗反应后,在经受三次洗涤、与HRP-缀合的二抗(ImmPRESS One-Step Polymer Systems,Vector Laboratories,USA)反应、使用DAB作为底物的显色和用苏木精(H-3401-500,Vector Laboratories)复染色后,评估阳性细胞的定位和表达率。
在将心肌包封在临时基质模拟水凝胶中后,进行3D器官培养,并确定心肌中pFAK+、uPAR+和巢蛋白+细胞的频率。培养前,pFAK、uPAR和巢蛋白的表达率低于6%。然而,pFAK、uPAR和巢蛋白-阳性细胞计数与3D器官培养后的培养期成比例显著增加。培养2周后,在组织碎片中pFAK、uPAR和巢蛋白的表达率大于或等于30%(图2和图3)。pFAK、uPAR和巢蛋白在成熟体细胞之间的基质中的细胞中表达,pFAK、uPAR和巢蛋白在毛细血管周细胞而不是毛细血管内皮细胞中表达。
Ki-67是细胞分裂的标志物,在成熟体细胞中不表达,但在培养前表达不到1%。然而,体外3D器官培养后Ki-67的表达率与培养期成比例地增加,并且在器官培养2周后驻留在心肌中的细胞中Ki-67表达率为45.7%,结果通过3D器官培养诱导心肌内细胞的分裂和生长,同时Ki-67也主要在血管周围细胞中表达(图4)。
在本示例实施方案中,发现通过3D临时基质模拟水凝胶可诱导心肌中的细胞分裂和生长,并且通过器官培养可诱导pFAK+、uPAR+和巢蛋白+血管周细胞的分裂和生长。
<实施例5>通过3D器官培养诱导组织中的uPAR+和巢蛋白+细胞向临时基质模拟水凝胶的迁移并在其中生长
将脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片包封在纤维蛋白或纤维蛋白/胶原水凝胶中,并进行3D器官培养。以水凝胶的两倍的量加入培养基,并将培养容器放置在轨道振荡器上在以30rpm的速率搅拌的同时培养14天。将PAI加入到培养基中以抑制水凝胶降解。每天向培养基中加入5μM溴脱氧尿苷(B5002,Sigma-Aldrich,USA),持续7天,以标记在体外培养过程中经受细胞分裂的细胞。培养进行2周,每周更换两次培养基。
在3D器官培养3天、7天和14天后,同时收集培养的组织和水凝胶。使用4%中性福尔马林溶液固定2小时后制备石蜡块。从石蜡块上剥离厚度为4μm的切片,并进行免疫组织化学染色。
为了评估uPAR、巢蛋白和BrdU在迁移到水凝胶中并在水凝胶中生长的细胞中的表达,使用抗-uPAR(MAB807,R&D Systems,USA)、抗-巢蛋白(MAB5326,Millipore,USA)和抗-BrdU(347580,BD Biosciences,USA)一抗。在与一抗反应后,通过经受三次洗涤、与HRP-缀合的二抗(ImmPRESS One-Step Polymer Systems,Vector Laboratories,USA)反应、使用DAB作为底物的显色和用苏木精(H-3401-500,Vector Laboratories)的复染色来评估表达率。
临时基质模拟水凝胶作为能够支持细胞迁移和生长的细胞外基质发挥作用,这可以通过提供纤连蛋白、胶原和纤维蛋白来实现,这些是细胞迁移所必需的细胞粘附因子。经由3D临时基质水凝胶通过受体-配体结合激活整合素-pFAK细胞信号传导通路,可以诱导器官中uPAR+和巢蛋白+细胞的细胞分裂和生长,并诱导uPAR+或巢蛋白+细胞募集、迁移和生长到临时基质模拟水凝胶中。
观察到迁移到水凝胶中并在水凝胶中生长的细胞数量与3D心肌器官的培养期成比例增加(图5)。可以观察到迁移到水凝胶中并在水凝胶中生长的细胞呈现纺锤形,与水凝胶结合导致细胞质膨胀。
从心肌迁移到水凝胶中并在水凝胶中生长的细胞具有88.5%和95.4%或更高的uPAR和巢蛋白表达率,显示出与在组织中培养器官后经受分裂和生长的细胞相同的uPAR+和巢蛋白+特征。超过89.4%的迁移到水凝胶中的细胞是BrdU阳性的,这是通过吸收器官培养过程中加入的BrdU来合成DNA的细胞,使得水凝胶中的大多数细胞是在器官培养后细胞分裂和生长后迁移的细胞。器官培养前心肌中未检测到BrdU+细胞,并且uPAR+和巢蛋白+细胞少于2%。
在脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片的3D器官培养2周后,临时基质模拟水凝胶中的细胞为约90%uPAR阳性和超过90% BrdU阳性,并且通过器官培养,发现组织驻留细胞是分裂、生长和迁移到水凝胶的细胞,没有观察到根据组织的显著差异(图6)。
<实施例6>3D器官培养后迁移到水凝胶中并在水凝胶中生长的细胞的分离
将脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片包埋在纤维蛋白或纤维蛋白/胶原水凝胶中,并进行3D器官培养。以水凝胶的两倍的量加入培养基,并将培养容器放置在轨道振荡器上,在以30rpm的速率搅拌的同时进行培养14天。为了抑制水凝胶降解,在培养期间每天加入PAI,以根据迁移到水凝胶中并在水凝胶中生长的细胞的PA活性来抑制临时基质模拟水凝胶的降解。
评估3D器官培养后收集的组织碎片的uPAR mRNA和纤溶酶活性。从10mg组织碎片制备组织裂解物后,使用纤溶酶活性测定试剂盒(ab204728,abcam)分析纤溶酶活性。向组织裂解物中加入荧光底物后,通过在37℃下反应20分钟后测量荧光强度来测量纤溶酶活性。纤溶酶活性通过以下公式计算,△RFU360/450nm=(RFU
3D器官培养14天后,去除培养基。加入DMEM后,在轨道振荡器上以30rpm的速率振荡30分钟进行洗涤,并去除洗涤溶液。这个洗涤工序重复三次。洗涤后,通过以下两种方式分离和收集迁移到水凝胶中并在水凝胶中生长的细胞。在第一种方法中,将1,000单位/mL的尿激酶加入到培养基中,然后将其加入到培养容器中,将水凝胶降解2小时,将从降解的水凝胶释放的细胞和组织碎片转移到管中,在3,000rpm下离心10分钟后去除上清液,并将收集的细胞和组织碎片沉淀悬浮在培养基中。
可以通过PAI撤去法从水凝胶中分离和收集细胞。器官培养14天后,去除培养基,然后使用DMEM进行三次洗涤以去除残留在培养基和水凝胶中的PAI。加入新鲜培养基后,在轨道振荡器上以30rpm的速率振荡进行培养1小时,并且培养基中不加入PAI。使用移液管收集从水凝胶分离和释放的细胞,转移到管中,并以3,000rpm离心10分钟,去除上清液,并用培养基悬浮收集的细胞和组织碎片沉淀。
将从水凝胶中分离和收集的细胞悬浮在培养基中,通过血细胞计数器计算总细胞数,并使用流式细胞术分析收集的细胞的uPAR表达率。
在本示例实施方案中提供了选择性分离和收集uPAR+/巢蛋白+细胞的方法,所述方法通过诱导在3D器官培养后的组织中的细胞分裂后生长的uPAR+/巢蛋白+细胞在水凝胶中的迁移和生长,以及关于迁移到水凝胶中并在水凝胶中生长的细胞,根据uPAR+/巢蛋白+细胞本身的纤溶酶活性在没有外源性蛋白酶的情况下降解水凝胶。
评估器官培养前后组织碎片中uPAR mRNA的表达和纤溶酶活性。甚至在体外培养之前,uPAR mRNA表达和纤溶酶活性根据器官而变化,并且与其他组织相比,心肌、神经和骨骼肌中uPAR mRNA的表达和纤溶酶活性高(图7)。在器官培养后评估的所有组织碎片中,与培养前相比,uPAR mRNA表达和纤溶酶活性显著增加。特别是,心肌、神经元和骨骼肌中测量到mRNA表达和纤溶酶活性最高。由于纤溶酶活性与uPAR表达成比例,因此可以通过器官培养诱导组织中uPAR表达的增加,并且提供了在器官培养后通过uPAR增加来增加组织中纤溶酶活性的方法。
在3D器官培养过程中,在培养基中加入了纤溶酶原激活物抑制剂(PAI),并且加入的PAI可以通过控制器官和细胞过度的纤溶酶和蛋白酶活性来抑制水凝胶降解。当通过器官培养在组织内经受细胞分裂和生长的细胞被诱导迁移到水凝胶中并在水凝胶中生长,然后通过冲洗和洗涤过程从培养基和水凝胶中撤去PAI时,可以仅通过器官和细胞驻留的纤溶酶和蛋白酶活性来诱导水凝胶的降解,从而释放迁移到水凝胶中并在水凝胶中生长的细胞,进而能够分离和收集释放的细胞。
对于PAI撤去,去除含有PAI的培养基,通过用DMEM洗涤三次来去除残留在水凝胶和器官中的PAI,并且通过加入水凝胶的两倍量的不包含PAI的培养基进行培养。培养30分钟后,水凝胶由于PAI撤去而开始降解;随着水凝胶的降解,迁移到水凝胶中并在水凝胶中生长的细胞从水凝胶中释放并在细胞之间聚集;以及培养2小时后,迁移和生长的细胞以及组织碎片周围的水凝胶完全降解,使得水凝胶中的细胞释放到培养基中(图8)。通过本示例实施方式,临时基质模拟水凝胶由于细胞驻留的纤溶酶和蛋白酶活性而仅在PAI撤去的情况下降解,水凝胶中的细胞被释放到培养基中,因此,可以分离和收集培养基中释放的细胞,其处于细胞质收缩和聚集的形式。
在器官培养过程中,通过PAI的加入可以防止水凝胶降解,并且水凝胶中的细胞由于细胞质展开而显示出纺锤形。然而,通过在培养基中撤去PAI,细胞周围的水凝胶开始降解以使细胞质收缩,细胞作为细胞-细胞连接的结果诱导细胞形成聚集体,并且聚集的细胞被释放到培养基中(图9)。
在组织学方法中,清楚地表明,尽管在PAI撤去前水凝胶中的细胞显示细胞质完全展开,但当水凝胶在PAI撤去后开始降解时,细胞能够附着的水凝胶丢失,细胞由于细胞-细胞连接而使得细胞聚集、分离,并从水凝胶中释放(图10)。从水凝胶释放的所有聚集细胞都显示出表达uPAR的特征,因此uPAR表达越高,纤溶酶活性越高,从而提供了在仅PAI撤去的情况下分离水凝胶中的uPAR+细胞的基础(图10)。
在PAI撤去或尿激酶处理后,可以分离和收集迁移到水凝胶中并在水凝胶中生长的细胞。在本公开中,即使在PAI撤去而没有尿激酶处理的情况下,对分离迁移到水凝胶中并在水凝胶中生长的细胞的方法的实用性进行了比较和评估。
通过示例实施方案,可以确定通过PAI撤去法分离和收集相当于通过尿激酶处理的细胞数的细胞这一结果(图11A)。器官培养2周后,每100mg组织可分离和收集超过200万个细胞,这低于尿激酶处理后收集的细胞数量,但没有显著差异。
然而,PAI撤去后收集的细胞的uPAR表达率显著高于尿激酶处理后收集的细胞(图11B)。特别地,从具有高uPAR表达率和纤溶酶活性的组织中选择性分离uPAR+细胞的产量高。这表明水凝胶在uPAR+细胞中的降解活性高,因此,可以验证它是通过PAI去除和洗涤选择性分离uPAR+细胞的高效方法。
<实施例7>3D器官培养后收集的组织碎片的细胞分离和重复器官培养
将脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片包封在纤维蛋白或纤维蛋白/胶原水凝胶中,并进行3D器官培养。以水凝胶的两倍的量加入器官培养基,并将培养容器放置在轨道振荡器上,在以30rpm的速率搅拌的同时进行培养14天。为了抑制水凝胶降解,在培养期间每天加入PAI,以抑制由于迁移到水凝胶中并在水凝胶中生长的细胞的纤溶酶活性而引起的临时基质模拟水凝胶的降解。
3D器官培养14天后,去除培养基。加入DMEM后,在轨道振荡器上以30rpm的速率搅拌30分钟进行洗涤,并去除洗涤溶液。洗涤工序重复三次以去除残留在培养基和水凝胶中的PAI。加入新鲜培养基后,以30rpm的速率振荡进行培养2小时,并且培养基中不添加PAI。使用移液管收集从水凝胶中分离和释放的细胞和组织碎片,转移到管中,并以3,000rpm离心10分钟,然后去除上清液。由于高比重,组织碎片比细胞沉淀得更快,因此将细胞和组织碎片沉淀分散在DMEM中,然后放置30秒以诱导组织碎片沉淀,然后仅将上清液转移到新的管中,重复三次以分离收集的细胞和组织碎片。
通过PAI撤去法将从水凝胶中分离的组织碎片再次包封在水凝胶中,通过实施例2中所述的方法进行3D器官培养,两周后,分离并收集通过实施例7中所述方法迁移到水凝胶中并在水凝胶中生长的细胞和组织碎片。通过三次连续的3D器官培养,反复诱导PAI撤去后收集的组织碎片以在组织中进行细胞迁移和生长,从而分离和收集水凝胶中的细胞,并使用血细胞计数器测量分离和收集的细胞的总数。
在本示例实施方式中,提供了如下方法:通过收集PAI撤去后保留结构的组织碎片并使用收集的组织碎片进行重复器官培养,分离和收集在器官培养后迁移到水凝胶中后生长的细胞。外源性蛋白酶处理(例如,尿激酶)可能会降解用水凝胶包埋的组织碎片,导致组织碎片的结构、功能微环境的丧失。
在本示例实施方式中,分离并收集在通过PAI撤去且没有外源性蛋白酶处理的组织中生长后迁移的细胞和组织碎片,同时,还对收集的组织碎片进行重复的器官培养。使用器官培养后收集的组织碎片进行三次连续的器官培养,获得了如下结果:可以以与初始器官培养相似的产量收集到细胞(图12)。可以确定的是,PAI撤去法是能够在3D器官培养后保存与迁移到水凝胶中并在水凝胶中生长的细胞一起包埋的组织碎片的结构、功能微环境的方法,以及通过重复器官培养以高效和稳定的方式分离组织驻留细胞的方法。
<实施例8>PAI撤去和尿激酶处理后从水凝胶中分离的细胞的培养
将脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片包埋在纤维蛋白或纤维蛋白/胶原水凝胶中,并进行3D器官培养。以水凝胶的两倍的量加入器官培养基,并将培养容器放置在轨道振荡器上,在以30rpm的速率搅拌的同时进行培养14天。为了抑制水凝胶降解,每天向培养基中加入氨甲环酸,即PAI。
3D器官培养14天后,去除培养基。加入DMEM后,在以30rpm的速率搅拌的同时洗涤培养基30分钟,并且洗涤工艺重复三次。洗涤后,通过实施例6中呈现的PAI撤去或尿激酶方法分离细胞后,收集迁移到水凝胶中并在水凝胶中生长的细胞。器官培养14天后,去除培养基,并使用DMEM进行洗涤三次,以去除残留在培养基和水凝胶中的PAI。加入新鲜培养基后,接着以30rpm的速率搅拌来培养1小时,并且培养基中不添加PAI。使用移液管收集从水凝胶中分离和释放的细胞,转移到管中,并以3,000rpm离心10分钟,然后去除上清液,然后用培养基悬浮收集的细胞和组织碎片沉淀。
对于尿激酶处理,在洗涤三次后,将1,000单位/mL的尿激酶加入培养基中,将水凝胶降解2小时,然后收集从降解的水凝胶中释放的细胞和组织碎片,转移到管中,并以3,000rpm离心10分钟以去除上清液,随后用培养基悬浮收集的细胞和组织碎片沉淀。
将从水凝胶中分离和收集的细胞以5,000个细胞每cm
在PAI撤去后,观察到随着细胞从水凝胶中释放,形成细胞聚集体(图13A);将收集的细胞悬浮在培养基中以形成小的圆形聚集体(图13B);并在PS培养容器中进行接种以在单层环境中进行培养。以细胞间聚集状态收集的细胞在接种后30分钟粘附至培养容器(图13C);接种的细胞的细胞质在接种后1小时膨胀(图13D);并且在培养2小时后,发现细胞稳定地粘附,同时细胞聚集体周围的细胞生长(图13E)。
在对所有组织碎片(例如,脂肪、骨髓、心肌、神经、骨骼肌和滑膜)进行器官培养后,可以通过PAI撤去安全地分离和收集细胞,并且当收集的细胞与培养基混合并接种在培养容器中时,发现所有收集的细胞在细胞质稳定膨胀的同时在30分钟内粘附到培养容器上,而根据组织没有显著差异(图14)。
在单层环境中接种和培养的细胞显示出高生长速率,在培养2天后在接种的细胞周围生长,并扩展到周边,并且发现通过PAI撤去分离和收集的细胞即使在单层环境中培养时也保持高生长速率(图15)。
<实施例9>PAI撤去后分离的细胞的免疫表型特征
将脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片包埋在纤维蛋白或纤维蛋白/胶原水凝胶中,并进行3D器官培养。以水凝胶的两倍的量加入器官培养基,并将培养容器放置在轨道振荡器上,在以30rpm的速率搅拌的同时进行培养14天。为了抑制水凝胶降解,将氨甲环酸(PAI)以一定浓度加入到培养基中的同时进行培养。
3D器官培养14天后,去除培养基。加入DMEM后,在以30rpm的速率搅拌的同时进行洗涤30分钟,并且洗涤工序重复三次。洗涤后,通过PAI撤去法分离细胞后,收集迁移到水凝胶中并在水凝胶中生长的细胞。器官培养14天后,去除培养基,并使用DMEM进行洗涤三次,以去除残留在培养基和水凝胶中的PAI。加入新鲜培养基后,以30rpm的速率搅拌的同时进行培养1小时,并且培养基中不添加PAI。使用移液管收集从水凝胶中分离和释放的细胞,转移到管中,并以3,000rpm离心10分钟,去除上清液,并将收集的细胞和组织碎片沉淀悬浮在培养基中。
将PAI撤去法或尿激酶处理后分离和收集的细胞悬浮在PBS中,然后使用流式细胞术分析免疫表型特征。评估间充质干细胞(MSC)标志物CD29、CD44、CD105和CD140b以及uPAR和巢蛋白的表达率。使用CD34和CD45(作为造血细胞标志物)以及CD31(作为血管内皮细胞标志物),以评估这些标志物的表达率。
由于尿激酶处理或PAI撤去,可以从水凝胶中收集和分离迁移和生长的细胞。不管收集细胞的方法如何,从所有培养组织而来的在水凝胶中迁移和生长的细胞显示出与间充质干细胞相同的免疫表型特征,CD29、CD73、CD105和CD140b的表达率大于90%(图16A)。根据分离方法从水凝胶中分离和收集的细胞中间充质干细胞标志物的表达率没有差异。
然而,在本实施例中,uPAR和巢蛋白在所有组织碎片的器官培养后通过PAI撤去分离和收集的细胞中的表达率超过90%。另一方面,尿激酶处理后收集的细胞的表达率在30%~67%之间。根据水凝胶中uPAR+和巢蛋白+细胞的高纤溶酶活性,可以得出通过PAI撤去能够进行选择性分离和收集这样的结果。另一方面,在尿激酶处理中确定,混合并收集到水凝胶中具有各种免疫表型特征的细胞(图16B)。
存在于组织中的造血细胞和血管内皮细胞可以在从组织中分离细胞的工序中被混合在内,这些细胞的混合程度可以通过检测CD31+、CD34+和CD45+细胞来确定。在通过PAI撤去法从水凝胶分离和收集的细胞的情况下,CD31、CD34和CD45的表达率小于1%,但在尿激酶处理后分离和收集的细胞为2.8%~7.0%,从而发现造血细胞和血管内皮细胞的混合程度高(图17)。
通过本实施例,发现这是通过PAI撤去选择性分离和收集从组织迁移到水凝胶中的uPAR+和巢蛋白+细胞的方法,同时使分离工艺中造血细胞和血管内皮细胞的混合最小化。
<实施例10>PAI撤去后收集和分离的uPAR+/巢蛋白+细胞的自我复制能力
将脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片包埋在纤维蛋白或纤维蛋白/胶原水凝胶中,进行3D器官培养2周,然后通过实施例6中描述的PAI撤去和尿激酶方法分离和收集迁移到水凝胶中并在水凝胶中生长的细胞。
将从水凝胶中分离和收集的细胞转移到管中,并以3,000rpm离心10分钟以去除上清液。将细胞沉淀物悬浮在培养基中,并将细胞密度调整为1.0×10
根据组织类型,CFU形成的频率不同,但与尿激酶处理后收集的细胞相比,在所有组织碎片中通过PAI撤去从水凝胶分离和收集的细胞中均显著高(图18)。特别地,与来源于其他组织的细胞相比,来源于心肌、神经和骨骼肌的细胞显示出高的集落形成能力。在尿激酶处理后分离的细胞中,CFU频率为3.1%~8.4%,但发现PAI撤去法分离的细胞具有8.8%~37.9%的高CFU频率。
自我复制能力是干细胞的主要特征之一,3D器官培养可以激活组织中的干细胞,以诱导迁移到水凝胶中并在水凝胶中生长,并且可以通过PAI撤去法选择性地分离和收集水凝胶中的具有高自我复制滴度的干细胞,证明具有高纤溶酶活性的uPAR+/巢蛋白+细胞是具有高滴度的干细胞(图18)。
<实施例11>PAI撤去后分离的细胞的体外生长能力
将脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片包埋在纤维蛋白或纤维蛋白/胶原水凝胶中,进行3D器官培养2周,然后通过实施例6中描述的PAI撤去和尿激酶方法分离和收集迁移到水凝胶中并在水凝胶中生长的细胞。
将从水凝胶中分离和收集的细胞转移到管中,并以3,000rpm离心10分钟以去除上清液。将细胞沉淀物悬浮在培养基中,并将细胞密度调整为1.0×10
体外生长能力越高,Ki-67(一种细胞周期标志物)在培养细胞中的表达率就越高。通过流式细胞术分析抗-Ki67的表达率,对体外细胞生长能力进行比较分析。
在尿激酶或PAI撤去处理后,从水凝胶中分离迁移和生长的细胞,并比较和分析收集的细胞的体外生长能力。与尿激酶处理后获得的细胞相比,通过PAI撤去分离和收集的细胞中PDT显著较低,PDL显著较高。与自我复制能力相同的趋势,发现细胞具有优异的体外生长能力,并具有通过PAI撤去分离和收集的细胞的低PDT和高PDL(图19)。
为了验证在PAI撤去处理后从水凝胶中分离和收集的细胞的高生长能力,通过流式细胞术分析Ki-67的表达率。Ki-67标志物是指在细胞周期中的细胞,因此较高的Ki-67表达率是细胞生长能力较高的指示。通过PAI撤去获得的细胞显示出58.5%~75.4%的高Ki-67表达率,显著高于尿激酶处理后获得的细胞中的33.6%~48.7%(图20)。
由于上述结果,可以发现PAI撤去是选择性分离具有高体外生长能力的细胞的方法,这支持了具有高纤溶酶活性的uPAR+/巢蛋白+细胞是具有高生长能力的细胞。
<实施例12>PAI撤去后分离的细胞的分化能力
将脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片包埋在纤维蛋白或纤维蛋白/胶原水凝胶中,进行3D器官培养2周,然后通过实施例6中描述的PAI撤去和尿激酶方法分离和收集迁移到水凝胶中并在水凝胶中生长的细胞。
将从水凝胶中分离和收集的细胞转移到管中,并以3,000rpm离心10分钟以去除上清液。将细胞沉淀物悬浮在培养基中,并将细胞密度调整为1.0×10
在图21中,诱导从骨髓分离和收集的细胞分化为成骨细胞(左)和脂肪细胞(右)后,可以通过茜素红染色观察磷酸钙晶体的积累和沉积,并且可以通过油红O染色观察诱导分化为脂肪细胞的细胞的细胞质中脂质的积累。发现,来源于所有组织碎片的所有细胞都具有分化为成骨细胞和脂肪细胞的能力。
通过溶解沉积或积聚的矿物质晶体和脂泡后测量的OD值来比较和评估向成骨细胞和脂肪细胞的分化能力。发现在所有组织碎片中,与在尿激酶处理后分离并收集的细胞相比,通过PAI撤去从水凝胶分离和收集的细胞中分化成成骨细胞和脂肪细胞的能力显著高(图22)。在骨髓、心肌和骨骼肌来源的细胞中显示出分化为成骨细胞的高能力,在脂肪、骨骼肌和滑膜中显示出分化为脂肪细胞的高能力。然而,通过确定在通过PAI撤去法从水凝胶分离和收集的细胞中以显著高能力分化为成骨细胞和脂肪细胞(无论组织碎片的来源如何),发现具有高纤溶酶活性的uPAR+/巢蛋白+细胞是具有高多能性的干细胞。
<实施例13>PAI撤去后分离的细胞诱导组织再生的能力
将脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片包埋在纤维蛋白或纤维蛋白/胶原水凝胶中,进行3D器官培养2周,然后通过实施例6中描述的PAI撤去和尿激酶方法分离和收集迁移到水凝胶中并在水凝胶中生长的细胞。
将从水凝胶中分离和收集的细胞转移到管中,并以3,000rpm离心10分钟以去除上清液。将细胞沉淀物悬浮在培养基中,并将细胞密度调整为1.0×10
尿激酶或PAI撤去处理后,从水凝胶中分离迁移和生长的细胞,并通过相关mRNA表达来比较和分析收集的细胞诱导组织再生的能力。诱导组织再生的基因的表达根据来源组织而不同,这些基因在心肌、神经和骨骼肌来源的细胞中的表达高,并且心肌来源的细胞在HGF和SDF-1mRNA方面高,而IGF mRNA在神经来源的细胞中表达高[图23]。在通过PAI撤去分离和收集的细胞中,与尿激酶处理后分离和收集到的细胞相比,全组织再生基因的表达显著地高。这些结果表明uPAR的表达与高组织再生调节基因的表达成比例相关。
<实施例14>uPAR+细胞中的纤溶酶活性和巢蛋白表达率
将脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片包埋在纤维蛋白或纤维蛋白/胶原水凝胶中,进行3D器官培养2周,然后通过实施例6中描述的尿激酶方法分离和收集迁移到水凝胶中并在水凝胶中生长的细胞。随后,通过FACSAria(BD Bioscience)分离uPAR+(UK+uPAR+)和uPAR-(UK+uPAR-)细胞,并在单层环境中培养7天,以评估纤溶酶活性和巢蛋白表达率。通过PAI撤去法从水凝胶中分离和收集的细胞具有90%以上的uPAR表达率,使得没有分离出次级uPAR+细胞。根据实施例6中描述的方法进行纤溶酶活性,并使用流式细胞术评估巢蛋白表达率。
在uPAR+细胞中观察到显著高的纤溶酶活性(图24,左)。与UK+uPAR-细胞相比,尿激酶处理后分离和培养的UK+uPAR+细胞以及PAI撤去后分离和培养的细胞显示出显著高的纤溶酶活性。细胞的纤溶酶活性因组织来源而异,在心肌、神经和骨骼肌中较高,而纤溶酶活性根据组织驻留细胞的组织来源进行确定。
以上结果表明,uPAR+细胞中纤溶酶活性与巢蛋白表达率之间存在密切相关性。
<实施例15>uPAR+细胞的自我复制和体外生长能力
将脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片包封在纤维蛋白或纤维蛋白/胶原水凝胶中,然后进行3D器官培养2周,以使用实施例6中描述的尿激酶方法分离和收集迁移到水凝胶中并在水凝胶中生长的细胞。随后,通过FACSAria(BD Bioscience)分离uPAR+(UK+uPAR+)和uPAR-(UK+uPAR-)细胞,并在单层环境中培养7天,然后评估自我复制和生长能力。通过PAI撤去法从水凝胶中分离和收集的细胞具有90%以上的uPAR表达率,使得没有分离出次级uPAR+细胞。根据实施例10中描述的方法评估自我复制能力,并且通过流式细胞术使用Ki-67表达率评估生长能力。
在uPAR+细胞中可以观察到显著高的自我复制能力。发现在UK+uPAR+细胞和PAI撤去细胞中的CFU频率为12.5%~37.5%,在UK+uPAR-细胞中为3.1%~8.8%,在uPAR+细胞中具有显著高的自我复制能力(图25,左)。
发现自我复制能力和体外生长能力密切相关,Ki-67在uPAR+细胞中的表达率为40.8%~82.4%,与Ki-67在uPAR-细胞中的表达率28.1%~45.7%相比,显示出显著高的生长能力(图25,右)。与其他来源的组织相比,心肌、神经和骨骼肌来源的uPAR+细胞具有更高的CFU形成能力和Ki-67表达率。
<实施例16>uPAR+细胞的抗炎能力
将脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片包埋在纤维蛋白或纤维蛋白/胶原水凝胶中,进行3D器官培养2周,然后通过实施例6中描述的尿激酶方法分离和收集迁移到水凝胶中并在水凝胶中生长的细胞。随后,通过FACSAria(BD Bioscience)分离uPAR+(UK+uPAR+)和uPAR-(UK+uPAR-)细胞,并在单层环境中培养7天以评估抗炎能力。通过PAI撤去法从水凝胶中分离和收集的细胞具有90%以上的uPAR表达率,使得没有分离出次级uPAR+细胞。
使用包含细胞分泌的因子的条件培养基来评估抗炎能力。为了制备条件培养基,在向T175烧瓶中加入每cm
RAW 264.7细胞悬浮在90% RPMI 1640/10%小牛血清中,每cm
RAW 264.7细胞在LPS刺激后显示TNFα和IL-1β分泌水平增加5倍。能够确定从水凝胶中分离和收集的组织驻留干细胞分泌的物质具有抑制RAW 264.7细胞的30%~70%炎性细胞因子分离的能力(图26)。由UK+uPAR+细胞和PAI撤去细胞制备的条件培养基显示出与UK+uPAR-细胞相比显著高的TNFα和IL-1β分泌抑制能力。无论来源于何种组织,发现与uPAR-细胞相比,uPAR+细胞都能具有高的抗炎作用。
<实施例17>诱导uPAR+细胞的血管内皮细胞和成纤维细胞生长的作用
将脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片包埋在纤维蛋白或纤维蛋白/胶原水凝胶中,进行3D器官培养2周,然后通过实施例6中描述的尿激酶方法分离和收集迁移到水凝胶中并在水凝胶中生长的细胞。随后,通过FACSAria(BD Bioscience)分离uPAR+(UK+uPAR+)和uPAR-(UK+uPAR-)细胞,并在单层环境中培养7天以评估抗炎能力。通过PAI撤去法从水凝胶中分离和收集的细胞具有90%以上的uPAR表达率,使得没有分离出次级uPAR+细胞。
使用人脐静脉内皮细胞(HUVEC)作为血管内皮细胞,并使用人真皮成纤维细胞(DF)。测试相应细胞在条件培养基中的生长诱导作用。制备通过实施例16中描述的方法制备的条件培养基以测试所述效果。将HUVEC细胞和DF悬浮在99% DMEM/1%小牛血清培养物中,然后将每cm
已经确定,由UK+uPAR+和PAI撤去细胞制备的条件培养基显示出促进HUVEC和DF生长的效果,而与在UK+uPAR-细胞中制备的条件培养基相比,所述效果显著高30%,但是在UK+uPAR+和PAI撤去细胞之间的效果没有差异(图27)。特别地,与其他组织来源的干细胞相比,从心肌、神经和骨骼肌来源的干细胞获得的条件培养基显示出高的生长诱导作用。
<实施例18>uPAR+细胞的血管内皮细胞和成纤维细胞保护作用
将脂肪、骨髓、心肌、神经、骨骼肌和滑膜组织碎片包埋在纤维蛋白或纤维蛋白/胶原水凝胶中,进行3D器官培养2周,以通过实施例6中描述的尿激酶方法分离和收集迁移到水凝胶中并在水凝胶中生长的细胞。随后,通过FACSAria(BD Bioscience)分离uPAR+(UK+uPAR+)和uPAR-(UK+uPAR-)细胞,并在单层环境中培养7天以评估抗炎能力。通过PAI撤去法从水凝胶中分离和收集的细胞具有90%以上的uPAR表达率,使得没有分离出次级uPAR+细胞。
分别使用由UK+uPAR-细胞、UK+uPAR+细胞和PAI去回后分离和收集的细胞制备的条件培养基来测试细胞保护作用。将HUVEC和DF悬浮在99% DMEM/1%小牛血清培养基中,并将每cm
与UK+uPAR-细胞来源的条件培养液相比,由UK+uPAR+细胞和PAI撤去处理后收集的细胞制备的条件培养基显示出对H
本公开通过工程化的临时基质支持的器官培养来实现。将组织碎片包埋在人造临时基质中,并通过临时基质激活整合素-FAK细胞信号传导通路,以诱导组织驻留干细胞的细胞分裂和生长。通过器官培养工艺,组织中干细胞向临时基质的迁移和生长与uPAR-uPA-纤溶酶活性成比例增加。为了控制由于过度的uPAR-uPA-纤溶酶活性造成临时基质降解和丢失而停止对干细胞迁移的抑制的结果,可以通过PAI添加来控制临时基质的过度降解。提供了能够在干细胞迁移到临时基质中和并在其中生长达到目标水平之后通过停止PAI添加来分离uPAR+干细胞的技术。PAI添加中断后,uPAR+干细胞从临时基质中解离,并根据uPAR-uPA-纤溶酶和MMP激活而被释放到培养基中。本公开提供了能够在不使用任何组织降解蛋白的情况下分离和培养uPAR+干细胞的技术,以及通过根据uPAR表达的临时基质的迁移和降解特性使用标志物进行的干细胞纯化工艺。
本公开可应用于分离和培养存在于固体组织(例如,骨髓、脂肪、骨骼肌、心脏、周围神经、脊髓、脑、肺、肝、关节膜、脐带、胎盘和牙周组织)中的uPAR+干细胞。本公开提供了通过重复器官培养分离和培养干细胞的方法,因为用于器官培养的组织碎片的结构可以通过在没有任何蛋白酶处理的情况下分离干细胞而保持完整。
本公开显示了uPAR阳性组织抗性干细胞中除uPAR外的常规干细胞标志物阳性表达的特征。在骨髓、脂肪、肌肉、心脏、关节膜、脐带和胎盘的情况下,间充质干细胞标志物如CD29、CD44、CD73、CD90和CD105表达阳性,但造血干细胞或血管内皮细胞标志物显示阴性特征。本公开表明,诸如巢蛋白、p75、Sox10和Sox2的标志物在来源于周围神经、脊髓和脑组织的uPAR阳性干细胞中共表达。
本公开的uPAR阳性干细胞在分泌作用于迁移的生理活性因子、生长因子、抗炎因子、干细胞募集因子和组织再生的能力方面表现出高的生物学特性。
本公开的uPAR阳性干细胞具有分化为组织组成细胞的高多能性。
- 一种便于分离固体垃圾的垃圾处理箱
- 一种便于收集垃圾的垃圾箱
- 一种便于直立丢垃圾的家用垃圾桶
- 一种便于移动的建筑工地用混凝土搅拌机
- 一种便于运输的工地用围挡装置
- 一种便于环境管控的工地垃圾排放管道
- 一种建筑工地环境噪声排放超标的判定方法及系统
