一种生产L-高丝氨酸的基因工程菌株及构建方法与应用
文献发布时间:2024-04-18 20:01:55
技术领域
本发明属于基因工程技术领域,具体而言,涉及一种生产L-高丝氨酸的基因工程菌株及构建方法与应用。
背景技术
L-高丝氨酸是一种天然存在的非必需氨基酸,是合成必需氨基酸L-苏氨酸、L-甲硫氨酸和L-异亮氨酸的前体物。作为重要的平台化合物,L-高丝氨酸还被用于O-乙酰高丝氨酸、L-氮杂环丁烷、高丝氨酸内酯、异丁醇和γ-丁内酯等。还具有提高植物抗逆性、促进家禽生长的功能。基于L-高丝氨酸具有的L-型-α氨基酸基本骨架且其γ-羟基具有多样性的化学活性,因而作为重要的功能性氨基酸,L-高丝氨酸及其衍生物在农业、药物学、生理学等方面有重要应用前景。
目前,国内外生产L-高丝氨酸的方法主要有以下几种:(1)化学法;(2)化学手性拆分法;(3)生物法。化学法合成L-高丝氨酸主要是采用成本较昂贵的L-蛋氨酸为原料,并使用具有严重生物毒性的碘甲烷或溴甲烷作为甲基化试剂,经亲核进攻以保护氨基,再在弱碱性条件下水解得到产物。该方法不仅成本高,并且需要使用碘化物、生成硫化物,对环境不友好;化学手性拆分法是利用混旋的高丝氨酸与手性试剂反应后,会形成非对应异构体的性质差异,由此分离出L-高丝氨酸。该方法产率低,试剂成本高且需使用大量有机溶剂,对环境有较大污染威胁;生物法目前主要包括生物酶法及发酵法两种方式。其中生物酶法是利用丙酮酸和甲醛在缩醛酶和L-氨基酸脱氢酶的共同作用下生成氨基酸高丝氨酸。该工艺主要问题仍然是成本高,需要使用有毒原料甲醛和甲酸,并需使用价格昂贵的辅酶等。近年来,随着代谢工程和合成生物学的迅猛发展,发酵法合成L-高丝氨酸受到广泛关注。微生物发酵法具有成本低、条件温和、环境污染少等诸多优点。L-高丝氨酸的生物合成以草酰乙酸为前体物,经天冬氨酸激酶、高丝氨酸脱氢酶和天冬氨酸半醛脱氢酶催化合成,其中天冬氨酸激酶和高丝氨酸脱氢酶为限速酶。L-高丝氨酸通常在胞内不积累,而直接代谢为L-苏氨酸。此外,L-赖氨酸与L-高丝氨酸竞争前体物天冬氨酸半醛。故常见L-高丝氨酸生产菌株代谢工程改造策略主要包括增强前体物草酰乙酸合成、阻断L-高丝氨酸竞争和降解途径等。
本发明所设计的L-高丝氨酸合成路线理论上可由2分子葡萄糖产生3分子L-高丝氨酸,其中1分子L-高丝氨酸经乙醛酸途径合成,2分子L-高丝氨酸经草酰乙酸途径合成。草酰乙酸经由苹果酸转化为富马酸,琥珀酸在琥珀酸脱氢酶作用下也转化为富马酸,2种途径所得富马酸在天冬氨酸裂解酶作用下转化为L-天冬氨酸,进而转化为L-高丝氨酸。经由该途径设计,可实现还原力平衡,达到摩尔转化率1.5mol/mol,质量转化率99%。
发明内容
为了解决上述问题,本发明提供了一种生产L-高丝氨酸的基因工程菌株及构建方法与应用。本发明通过将大肠杆菌工程菌11-A中的aspC基因敲除,得到的重组菌11C-A,不仅能使L-高丝氨酸产量及转化率不会降低,而且还可以降低副产物L-谷氨酸的产量,降低后处理难度,节约成本。
本发明的目的及解决其技术问题是采用以下技术方案来实现的。
本发明的一个方面提供了一种生产L-高丝氨酸的基因工程菌株,所述基因工程菌是以大肠杆菌为宿主,将宿主染色体上的天冬氨酸转氨酶基因aspC敲除,得到重组菌ST11C;将重组载体质粒pA导入上述突变型大肠杆菌ST11C中,即得到重组工程菌株,命名为11C-A。
进一步地,所述宿主为大肠杆菌重组工程菌株11-A,于2020年10月23日保藏在中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为:CGMCC No.20947。
本发明的另一个方面还提供了一种生产L-高丝氨酸的基因工程菌株的构建方法,所述基因工程菌是采用CRISPR/Cas9介导的基因编辑技术对宿主大肠埃希氏菌Escherichia coli进行定向改造所得,包括如下步骤:
(1)以pTargetF为模板,使用引物pTarget-aspC-F和pTarget-aspC-R进行PCR扩增,将扩增得到的片段用DpnI甲基化酶消化后转化大肠杆菌Fast-T1感受态,在含链霉素的LB平板上筛选阳性克隆,并用引物pTarget-cexu-F测序验证,测序正确后分别命名为pTarget-aspC;
(2)分别用引物对aspC-up500-F和aspC-down500-R,aspC-KO-F和aspC-KO-R进行PCR扩增,分别得到两个片段,以两个片段的混合物为模板,用引物对aspC-up500-F和aspC-down500-R进行PCR扩增,得到ΔaspC打靶片段;将得到的打靶片段ΔaspC回收;
(3)将大肠杆菌突变体ST11制备化转感受态细胞,并转化pCas质粒,涂布在含卡那霉素的LB平板上,30℃培养,筛选阳性克隆;
(4)从步骤(3)的平板上挑取阳性克隆,制备电转感受态细胞,与pTarget-aspC质粒和打靶片段ΔaspC混合,置于电转杯中电击,加入LB液体培养基30℃复苏后涂布在含卡那霉素和链霉素的LB平板上,30℃培养,筛选阳性克隆,并用引物对aspC-up800-F和aspC-down800-R进行PCR扩增,将扩增片段测序验证筛选出阳性克隆;
(5)将上述得到的阳性克隆接种在含有IPTG和卡那霉素的LB液体培养基中30℃培养过夜以消除pTarget-aspC质粒,过夜培养后的菌株在含有卡那霉素的LB固体平板上划线,30℃培养过夜,得到含有pCas质粒的大肠杆菌突变体ST11ΔaspC;
(6)将上述含有pCas质粒的大肠杆菌突变体ST11ΔaspC接种在LB液体培养基中,37℃培养过夜以消除pCas质粒,将过夜培养后的菌株在LB固体平板上划线,37℃培养过夜培养,得到不含质粒的大肠杆菌突变体ST11ΔaspC,简称ST11C;
(7)将重组载体质粒pA导入上述突变型大肠杆菌ST11C中,即得到重组工程菌株,命名为11C-A。
进一步地,步骤(1)中所述引物pTarget-aspC-F的核苷酸序列如SEQ ID NO.1所示,所述引物pTarget-aspC-R的核苷酸序列如SEQ ID NO.2所示;所述引物pTarget-cexu-F的核苷酸序列如SEQ ID NO.3所示;
所述PCR扩增体系为:5X SF Buffer 10uL、dNTP Mix(10mM each)1uL、模板pTargetF 20ng、引物(10uM)各2uL、Phanta Super-Fidelity DNA Polymerase 1uL、蒸馏水34uL,总体积为50uL;
所述PCR扩增条件为:95℃预变性2分钟,1个循环;95℃变性10秒、55℃退火20秒、72℃延伸1.5分钟,30个循环;72℃延伸10分钟,1个循环。
进一步地,步骤(2)中所述引物aspC-KO-F的核苷酸序列如SEQ ID NO.4所示;所述引物aspC-KO-R的核苷酸序列如SEQ ID NO.5所示;所述引物aspC-up500-F的核苷酸序列如SEQ ID NO.6所示;所述引物aspC-down500-R的核苷酸序列如SEQ ID NO.7所示;
所述PCR扩增体系为:5X SF Buffer 10uL、dNTP Mix(10mM each)1uL、模板pTargetF 20ng、引物(10uM)各2uL、Phanta Super-Fidelity DNA Polymerase 1uL、蒸馏水34uL,总体积为50uL;
所述PCR扩增条件为:95℃预变性2分钟,1个循环;95℃变性10秒、55℃退火20秒、72℃延伸1.5分钟,30个循环;72℃延伸10分钟,1个循环。
进一步地,步骤(4)中所述正向引物aspC-up800-F的核苷酸序列如SEQ ID NO.8所示;所述引物aspC-down800-R的核苷酸序列如SEQ ID NO.9所示;
所述PCR扩增体系为:5X SF Buffer 10uL、dNTP Mix(10mM each)1uL、模板pTargetF 20ng、引物(10uM)各2uL、Phanta Super-Fidelity DNA Polymerase 1uL、蒸馏水34uL,总体积为50uL;
所述PCR扩增条件为:95℃预变性2分钟,1个循环;95℃变性10秒、55℃退火20秒、72℃延伸1.5分钟,30个循环;72℃延伸10分钟,1个循环。
本发明的又一个方面还提供了一种生产L-高丝氨酸的方法,所述方法是在适宜条件下将前述的基因工程菌活化后接种于发酵培养基中并采用生物发酵法制备L-高丝氨酸。
进一步地,所述适宜条件是指在温度为37℃,初始空气通量为2vvm,搅拌转速300rpm,此时的溶解氧浓度设定为100%,菌体生长过程中调节空气通量直至3vvm,同时将搅拌转速与DO值关联来控制溶解氧浓度始终大于30%,当发酵培养基中的初始葡萄糖消耗完时,开启补料培养基,发酵过程采用氨水控制pH在7.0,当菌体密度达到600nm的吸光度OD
进一步地,所述发酵培养基组成为:柠檬酸1-5g/L,磷酸二氢钾1-20g/L,氮源1-5g/L,聚醚类消泡剂150uL/L,葡萄糖5-30g/L,MgSO
所述微量无机盐I组成为:EDTA 840mg/L,CoCl
进一步地,所述补料培养基组成为:葡萄糖100-800g/L,MgSO
所述微量无机盐II组成为:EDTA 1300mg/L,CoCl
本发明预期效果与优点如下:本发明以大肠杆菌为出发菌通过基因工程技术构建了一种能够高效生产L-高丝氨酸的突变型大肠杆菌重组工程菌株11C-A。
本发明通过基因工程改造,获得高产L-高丝氨酸的工程菌株,转化率与出发菌11-A相比没有降低,且副产物L-谷氨酸产量更低,更有利于分离纯化。通过对菌株和制造工艺的不断优化升级,降低了提取成本,进而降低了生产成本。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例详细说明如后。
附图说明
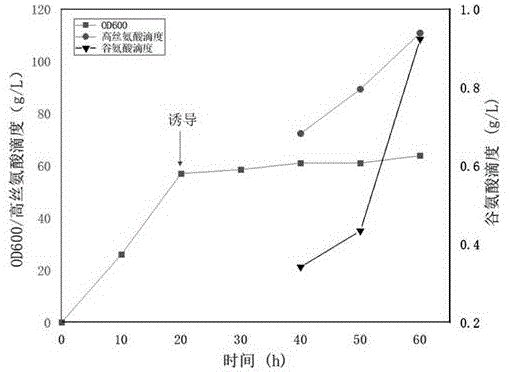
图1为大肠杆菌11C-A的发酵过程中产物L-高丝氨酸及副产物L-谷氨酸含量随时间变化曲线。
具体实施方式
为了使本发明实现的技术手段、创作特征、达成目的与功效易于明白了解,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
本发明的实施例中所使用的实验方法如无特殊说明,均为常规方法。
本发明的实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明实施例中所用的大肠杆菌工程菌11-A于2020年10月23日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称CGMCC,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为CGMCC NO.20947,分类命名为大肠埃希氏菌Escherichia coli。该菌株能够在无机盐培养基中发酵生产L-高丝氨酸。该菌株已于2020年11月13日做过专利申请,申请号为202011270812.X。
在本发明的实施例中,天冬氨酸转氨酶编码基因aspC的编码序列如Gene ID:945553(由1191个核苷酸组成)所示,编码Acession号NP_415448(由396个氨基酸残基组成)所示的天冬氨酸转氨酶。
实施例1:构建大肠杆菌突变体ST11C
大肠杆菌突变体ST11C是利用CRISPR/Cas9技术(Jiang Y,Chen B,Duan C,Sun B,Yang J,Yang S:Multigene editing in the Escherichia coli genome via theCRISPR-Cas9system.Appl Environ Microbiol 2015,81:2506-2514.)敲除大肠杆菌ST11的天冬氨酸转氨酶基因(aspC)从而获得的大肠杆菌ST11C的突变体,在本申请中简称为ST11C,其基因型为E.coli ST11ΔaspC。
该大肠杆菌突变体ST11C的具体构建步骤如下:
(1)制备电转感受态细胞:将pCas质粒(Jiang Y,Chen B,Duan C,Sun B,Yang J,Yang S:Multigene editing in the Escherichia coli genome via the CRISPR-Cas9system.Appl Environ Microbiol 2015,81:2506-2514.)利用化学转化法转化大肠杆菌ST11,在含卡那霉素的LB平板(卡那霉素浓度为50ug/mL)上30℃培养筛选阳性克隆,阳性克隆接种在含2g/L阿拉伯糖的LB液体培养基中30℃培养至OD600约为0.6后,制备电转感受态细胞。
(2)构建pTarget质粒:利用网站https://crispy.secondarymetabolites.org选取敲除位点的N20,设计引物构建pTarget质粒。以pTargetF(Jiang Y,Chen B,Duan C,SunB,Yang J,Yang S:Multigene editing in the Escherichia coli genome via theCRISPR-Cas9system.Appl Environ Microbiol 2015,81:2506-2514.)为模板,分别用引物对pTarget-aspC-F和pTarget-aspC-R进行PCR扩增,分别扩增得到大小约2100bp的片段。
PCR扩增体系为:5X SF Buffer 10uL、dNTP Mix(10mM each)1uL、模板pTargetF20ng、引物(10uM)各2uL、Phanta Super-Fidelity DNA Polymerase(南京诺维赞生物科技股份有限公司,产品目录为P501)1uL、蒸馏水34uL,总体积为50uL。
扩增条件为:95℃预变性2分钟(1个循环);95℃变性10秒、55℃退火20秒、72℃延伸1.5分钟(30个循环);72℃延伸10分钟(1个循环)。
用DpnI甲基化酶反应约3h后,直接利用化学转化法转化大肠杆菌Fast-T1感受态,在含链霉素的LB平板(链霉素浓度为50ug/mL)上筛选阳性克隆,并用引物pTarget-cexu-F测序验证。测序正确后分别命名为pTarget-aspC,pTarget-aspC所用引物序列如下(下划线所示为N20的序列):
pTarget-aspC-F SEQ ID NO.1 5’-
pTarget-aspC-R SEQ ID NO.2 5’-
pTarget-cexu-F SEQ ID NO.3 5’-ctttcctgcgttatcccctg-3’
(3)扩增打靶片段:分别用引物对aspC-up500-F和aspC-KO-R,aspC-KO-F和aspC-down500-R进行PCR扩增,分别得到大小约为500bp和500bp的片段;以两个片段的混合物为模板,用引物对aspC-up500-F和aspC-down500-R进行PCR扩增,得到大小约为1000bp的ΔaspC打靶片段。将打靶片段ΔaspC回收。
PCR扩增体系为:5X SF Buffer 10uL、dNTP Mix(10mM each)1uL、模板5-20ng、引物(10uM)各2uL、Phanta Super-Fidelity DNA Polymerase(南京诺维赞生物科技股份有限公司,产品目录为P501)1uL、蒸馏水34uL,总体积为50uL。
扩增条件为:95℃预变性2分钟(1个循环);95℃变性10秒、55℃退火20秒、72℃延伸0.5-2分钟(30秒/kb)(30个循环);72℃延伸10分钟(1个循环)。
所用引物序列如下:
(4)电转化:将200ng pTarget-aspC质粒,400ng打靶片段ΔaspC与100μL步骤(1)制备的电转化感受态细胞混合,置于2mm的电转杯中,2.5kV电击,加入1mL LB液体培养基30℃复苏后涂布在含卡那霉素和链霉素的LB平板上(卡那霉素浓度为50ug/mL,链霉素浓度为50ug/mL),30℃培养,筛选阳性克隆。用引物对aspC-up800-F和aspC-down800-R进行PCR扩增,将扩增片段测序验证。
所述PCR扩增体系为:Green Taq Mix 10uL(南京诺维赞生物科技股份有限公司,产品目录为P131)、引物(10uM)各0.8uL、蒸馏水8.4uL、模板菌液0.2uL,总体积为20uL;
所述PCR扩增条件为:95℃预变性3分钟(1个循环);95℃变性15秒、55℃退火15秒、72℃延伸1-5分钟(60秒/kb)(30个循环);72℃延伸5分钟(1个循环)。
(5)消除pTarget质粒:将测序验证正确的阳性克隆接种在含有0.1mM IPTG和卡那霉素的LB液体培养基中30℃培养过夜以消除pTarget质粒。过夜培养后的菌株在含有卡那霉素的LB固体平板上划线,30℃培养过夜,得到含有pCas质粒的大肠杆菌突变体ST11ΔaspC。
(6)消除pCas质粒:将测序验证正确的含有pCas质粒的大肠杆菌突变体ST11ΔaspC接种在LB液体培养基中,37℃培养过夜以消除pCas质粒。将过夜培养后的菌株在LB固体平板上划线,37℃培养过夜培养,得到不含质粒的大肠杆菌突变体ST11ΔaspC,简称11C。
用于验证和测序的引物序列如下:
aspC-up800-F SEQ ID NO.8 5’-tgctacctatcgtaactcca-3’
aspC-down800-R SEQ ID NO.9 5’-aatctggtgtgaacaaaccc-3’
实施例2:构建高产L-高丝氨酸的工程菌株11C-A
将表达载体pA用化学转化法转化大肠杆菌突变体ST11C,在含卡那霉素的LB平板(卡那霉素的浓度为50ug/ml)上筛选阳性克隆,得到的克隆菌株命名为11C-A。
实施例3:菌株11C-A的高密度发酵
发酵培养基组成为:柠檬酸1.7g/L,磷酸二氢钾14g/L,磷酸氢二铵4g/L,聚醚类消泡剂150uL/L,葡萄糖20g/L,MgSO
补料培养基组成为:葡萄糖600g/L,MgSO
微量无机盐I组成为:EDTA 840mg/L,CoCl
微量无机盐II组成为:EDTA 1300mg/L,CoCl
本领域技术人员可根据实际情况对上述各成分进行一定幅度的调整,本实施例仅提供一种具体实现方案。作为本实施例可替换的实施方式,所述发酵培养基包括的成分含量可替换为以下范围内的任意值:柠檬酸1-5g/L,磷酸二氢钾1-20g/L,氮源1-5g/L,葡萄糖5-30g/L,MgSO
种子液培养:250mL三角瓶中装液LB为100mL,121℃灭菌20min。冷却后接入-80℃保藏的甘油菌11C-A,培养温度为37℃,摇床转速200rpm,培养7h,用于发酵培养基接种。本领域技术人员可根据实际情况对上述条件进行一定幅度的调整,并不影响本发明目的的实现。本实施例仅提供一种具体实现方案,作为本实施例可替换的实施方式,所述培养条件可替换为以下范围内的任意值:培养温度为25-42℃,摇床转速100-300rpm,培养时间6-8h。
发酵罐接种:作为本实施例优选的实施方式,5L发酵罐发酵培养基体积为2.5L,灭菌后接入上述种子液,接种量为5%(V/V),葡萄糖初始浓度为20g/L。温度为37℃,初始空气通量为2vvm,搅拌转速300rpm,此时的溶解氧浓度设定为100%,菌体生长过程中调节空气通量直至3vvm,同时将搅拌转速与DO值关联来控制溶解氧浓度始终大于30%。当发酵培养基中的初始葡萄糖消耗完时,开启补料培养基。发酵过程采用氨水控制pH在7.0。当菌体密度达到600nm的吸光度(OD600)为30时,向发酵培养基中加入终浓度2g/L的L-阿拉伯糖诱导蛋白表达,当补料培养基耗尽即结束发酵。本领域技术人员可根据实际情况对上述条件进行一定幅度的调整,并不影响本发明目的的实现。
分析方法:使用安捷伦(Agilent-1200)高效液相色谱仪对发酵液中的组分进行测定。L-高丝氨酸的检测方法为:样品适当稀释后用2,4-二硝基氟苯(DNFB)进行衍生,100uL样品加入50uL 10g/L DNFB乙腈溶液和100uL 0.5M NaHCO3溶液,充分混匀,60℃避光反应1h,冷却后加入750uL 0.01M KH2PO4溶液,混匀,用0.22um滤膜过滤后进行高效液相色谱检测。色谱柱为ZORBAX Eclipse XDB-C18 column(4.6×150mm,5um;Agilent),柱温为30℃,流动相为35%乙腈甲酸(千分之一)水溶液,流速为1mL/min,检测波长为360nm。
结果计算:转化液中,L-高丝氨酸的产量达110.8g/L,生成谷氨酸0.92g/L。整个发酵阶段L-高丝氨酸转化率可达0.59g L-高丝氨酸/g葡萄糖,杂质谷氨酸与产物L-高丝氨酸的比例为1:120,计算公式为0.92/110.8(见下表1所示)。
对比实施例1:
专利号CN116286566A通过将大肠杆菌K-12MG1655菌株的thrB基因敲除,ldhA基因敲除、lpxM基因敲除、poxB基因敲除、metA基因敲除、iclR基因敲除、lysA基因敲除、ompT基因敲除、galR基因敲除、ptsG基因敲除、thrA基因突变,并在染色体DNA上多拷贝表达glk、zglf、rhtA、rhtB、asd、ppc和aspA(E.coli BW25113ΔptsG::glk,ΔgalR::zglf,ΔompT::ppc,ΔldhA::rhtA,ΔlpxM::rhtB,ΔpflB::asd,ΔpoxB::aspA,ΔiclR,ΔlysA,ΔmetA,ΔthrB),获得高产L-高丝氨酸的工程菌株11A,其发酵可得97.45g/L的L-高丝氨酸,生成谷氨酸3.25g/L,杂质谷氨酸与产物L-高丝氨酸的比例为1:30,计算公式为3.25/97.45,整个发酵阶段L-高丝氨酸转化率为0.567g L-高丝氨酸/g葡萄糖,明显低于本发明的菌株产L-高丝氨酸的产量110.8g/L,明显高于本发明中谷氨酸的含量(见表1),本发明菌株具有更少的杂质。
表1不同菌株高丝氨酸及谷氨酸产量比较
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,虽然本发明已以较佳实施例揭露如上,然而并非用以限定本发明,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,当可利用上述揭示的方法及技术内容作出些许的更动或修饰为等同变化的等效实施例,但凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
