治疗组合物用于治疗上皮源性肿瘤患者的用途
文献发布时间:2024-04-18 20:01:55
发明领域
本发明涉及生物技术和医学的分支。特别描述了治疗组合物用于通过同时阻断表皮生长因子和PD1/PD1配体的信号传导途径来治疗上皮源性肿瘤患者中的用途。
背景技术
免疫系统产生的抗肿瘤反应由称为“检查点”的分子负调节,其中PD1受体及其PDL1配体最为突出。阻断这些控制点抑制信号传输的单克隆抗体(ACM)(抗-CPI:免疫检查点抑制剂)诱导更有效的抗肿瘤反应。截至2020年12月,七种mAb抑制剂已被批准用于治疗多种“免疫敏感性”恶性肿瘤,诸如黑色素瘤、肺癌、鳞状头颈部肿瘤、肝癌、尿路上皮癌、胃癌、乳腺和结直肠肿瘤(Ravindranathan D等人(2021)Biology,10:325)。其中最成功的ACM包括针对PDL1的PD1特异性(抗-PD1)的纳武单抗(nivolumab)和帕博利珠单抗(pembrolizumab)以及阿替利珠单抗(atezolizumab)和德瓦鲁单抗(durvalumab)。这些疗法已被证明对表达PDL1分子并具有高频率突变的那些肿瘤中更有效,并且如果抑制信号被阻断,免疫细胞的浸润可能能够攻击肿瘤(Gibney GT等人(2016)Lancet Oncol.17(12):e542-e551)。此外,还开发了针对PD1/PDL1的低分子量抑制剂,其在阻断该信号通路方面具有令人鼓舞的结果,而没有显示出与免疫系统相关的副作用(Liu Ch等人(2021)CancerCell Int.21:e1-e17)。
表皮生长因子受体(EGFR)是酪氨酸激酶受体和已知的致癌基因(Yarden Y.(2001)European Journal of Cancer.37:S3-S8),其由七种天然配体激活。几项研究报道了EGFR信号级联的差异激活,这取决于与EGFR结合的配体。配体诸如EGF诱导有利于肿瘤增殖的信号,而低亲和力配体如角调节蛋白(ampfiregulin)促进分化(Freed DM等人(2017)Cell 171:1-13)。与直接受体阻断相比,配体依赖性信号级联的差异激活(例如使用抗-EGFR的ACM,或TKI信号级联抑制剂)对于这些分子的靶向治疗可能是至关重要的。此类差异可以影响治疗的耐受性/安全性,以及在不同治疗环境中更大或更小的临床疗效。在这个意义上,靶向EGFR配体的治疗模式是使用疫苗组合物,诱导针对配体的特异性抗体(Ac)阻断其与EGFR的相互作用。这种治疗策略的一个实例是CIMAvax-EGF疫苗,其产生针对人表皮生长因子(EGF)的特异性Ac,剥夺了肿瘤的这一重要配体。在接受CIMAvax-EGF免疫的非小细胞肺癌(CPCNP)患者中进行的大量临床试验表明,该疫苗是安全的且具有免疫原性。从临床反应的角度来看,接种疫苗显著提高了患者的存活率(Rodriguez PC等人(2016)ClinCancer Res.22(15):3782-90)。
参与EGFR信号传导的最重要的分子之一是GTP酶KRAS。这种分子也激活参与肿瘤发生的多种信号级联。大约30%的人类肿瘤的KRAS编码基因发生突变,这导致EGF-R级联的某些组成型激活,而与常规膜受体激活无关(Fernández-Medarde,A等人(2011)Genes andCancer.2:344-358)。
该基因中的突变在这些瘤形成中的一些(诸如胰腺癌)中占优势,在90%的肿瘤中显示突变。在其它腺癌诸如结肠中,其存在于40%的腺癌中。在肺的情况下,KRAS突变存在于所有非小细胞肺肿瘤的30%中,主要在腺癌组织学中(Moore AR等人(2020)Nat RevDrug Discov.19(8):533-552)。
在诸如胰腺和结肠等肿瘤中,KRAS突变的存在有利于肿瘤生长和对治疗的抗性(Haigis KM等人(2008)Nat Genet.40:600-8.;Bournet B等人(2016)Clin TranslGastroenterol.7:e157)。然而,在其它肿瘤诸如肺腺癌中,关于该基因中的突变的预后价值存在争议性数据(Shepherd FA等人(2013)J Clin.Oncol.31(17):2173-81;Zer A等人(2016)J Thoracic.Oncol.11(13):312-23)。在晚期结肠肿瘤中,天然KRAS的存在是EGFR特异性ACM帕尼单抗(panitumumab)和西妥昔单抗(cetuximab)治疗临床益处的预测指标。此外,尼妥珠单抗nimotuzumab(另一种抗-EGFR药物)与吉西他滨(gencitabine)的联合使用为肿瘤呈天然KRAS的晚期胰腺癌患者提供了临床益处(Schultheis B等人(2017)Ann.Oncol.28:2429-35)。然而,在EGFR信号级联突变的患者的任何亚组中(特别是在KRAS中),使用西妥昔单抗治疗CPCNP都没有显示出临床优势。另一方面,肿瘤中KRAS的突变与否本身并不影响或制约患者对抗-PD1/PDL1的ACM的临床反应。在肺癌中使用抗-PD1/PDL1的ACM的III期临床试验中,对于具有突变的KRAS肿瘤的患者观察到显著的临床益处(Borghaei,H等人(2015)N Engl J Med.373(17):1627-1639;Socinski Ma等人(2018)NEngl J Med.378(24):2288-2301)。与这一发现相一致的是,最近的临床试验表明,在接受抗-PD1/PDL1 mAb治疗的患者中,KRAS突变的其它联合突变(共突变)的存在可能导致更好或更差的反应。特别是,在KRAS与TP53基因共突变的肺腺癌中,它们会导致免疫原性肿瘤对CPI更敏感,而STK11的共突变产生对这种类型的治疗更具抗性的低炎症肿瘤(Dong ZY等人(2017)Clin Cancer Res 23:3012-3024;Skoulidis F等人(2018)Cancer Discov;8:822-835)。
鉴于EGFR信号传导阻断疗法和CPI的成功,几项研究评价了两种方法在不同的治疗生态中联合治疗的益处,结果各不相同。几位作者探讨了将抗-PD1/PDL1的ACM与TKI疗法结合是否可取,所述TKI疗法通过突变的EGFR变体阻断肺癌患者中的异常信号传导。这些研究表明该组合没有优势,并且显著增加了毒性(Yang JC等人(2019)J Thorac Oncol.;14(3):553-9;Schoenfeld AJ等人(2019)Ann Oncol.30(5):839-44)。其他作者评估了耐昔妥珠单抗necitumumab(另一种抗-EGFR的ACM)在肺癌患者中的联合应用。在这项研究中,毒性是可控的,但没有临床相关影响的证据(Besse B等人(2020)Lung Cancer.142:63-69)。在这些试验中,没有一项报道与KRAS分子的状态有关。
本发明首次报道了一种治疗组合物的用途,该组合物将阻断PD1与PDL1之间的相互作用的Ac与在具有天然KRAS的患者中诱导针对自体人EGF的Ac的疫苗组合物联合。所获得的结果表明,该疗法耐受性良好,并特别有利于患有天然KRAS的肿瘤患者。此外,这种疗法有利于PD-L1表达低的肿瘤患者,所述患者对抗-PD1/PDL1的ACM的疗法不太敏感。
发明简述
在一个实施方案中,本发明涉及治疗组合物在治疗上皮源性肿瘤中的用途。这些组合物的特征在于使用诱导产生针对EGF的特异性Ac的疫苗组合物和阻断PD1/PD1配体信号传导途径的化合物。特别地,描述了上述治疗组合物在表达KRAS蛋白的天然形式(优选那些具有SEQ ID NO.:1和SEQ ID NO.:2所述序列)的那些上皮源性肿瘤方面的用途。
特别地,诱导产生针对EGF的Ac的疫苗组合物包含重组人EGF与转运蛋白之间的缀合物作为活性成分。所述转运蛋白选自包括以下各项的组:霍乱毒素B、破伤风类毒素、KLH和脑膜炎奈瑟氏球菌(Neisseria meningitidis)的p64k。
此外,诱导产生针对EGF的Ac的疫苗组合物含有选自包括以下的组的佐剂:弗氏不完全佐剂、基于角鲨烯的佐剂、合成来源的佐剂、矿物来源的佐剂、植物来源的佐剂、动物来源的佐剂、粒状蛋白佐剂和脂质体佐剂。
阻断PD1/PD1配体信号传导途径的化合物选自包括抗-PD1的Ac和抗-PDL1的Ac的组,其中所述抗-PD1的Ac为纳武单抗、帕博利珠单抗、MEDI0608和匹地利珠单抗(pidilizumab),所述抗-PDL1的Ac可以是阿替利珠单抗、德瓦鲁单抗、阿维单抗和MDX-1105。
在本发明的一个实施方案中,通过患者肿瘤细胞样本中是否存在天然KRAS来筛查患者。存在天然KRAS的那些患者被选中接受治疗。接受治疗的肿瘤类型包括:肺、结肠…。
在另一个的实施方案中,本发明涉及将患者分层为本文所述治疗组合物治疗的响应者或无响应者的方法。通过确定肿瘤细胞样本中存在或不存在天然KRAS对患者进行分层,检测到其中存在天然KRAS的患者将被视为治疗的响应者。优选地,其肿瘤样本具有低于1%的PDL1水平的那些患者将被视为响应者。
发明详述
KRAS
本发明的方法和用途被设想用于其上皮源性肿瘤表达天然蛋白KRAS的患者的治疗和/或分层。术语“天然”是指天然来源的人类KRAS同种型(Uniprot登录号P01116,2021年4月7日的第246版)。设想天然KRAS同种型包括序列SEQ ID NO.:1或SEQ ID No.2的那些。特别地,天然KRAS同种型由序列SEQ ID NO.:1或SEQ ID No.2组成。
术语“天然KRAS”通常还包括相对于SEQ ID NO:1(KRAS4A)或SEQ ID No.2(KRAS4B)中所示的参考序列具有突变的KRAS多肽,并且还包括具有与本文所述的SEQ IDNO:1(KRAS4A,Uniprot登录号P01116-1)或SEQ ID No.2(KRAS4B,Uniprot登录号P01116-2)中所示的氨基酸序列共享一定程度的同一性的多肽。更具体地说,“天然KRAS”包括与SEQID NO.:1(KRAS4A)或SEQ ID No.2(KRAS4B)具有至少80%、85%、90%、95%或100%同一性的KRAS多肽。特别地,KRAS同种型4A和4B被术语“天然KRAS”所涵盖。优选地,分别与SEQ IDNo.1或SEQ ID No.2相比,“天然KRAS”在其氨基酸序列中不包含突变。术语天然KRAS和野生型KRAS在本发明中互换使用,并指的是本文描述的自然来源的KRAS同种型。
治疗组合物
本发明涉及用于治疗癌症的治疗组合物,其特别旨在阻断靶向EGF和PD1/PD1配体信号传导途径。本发明描述了针对PD1或其配体PDL1的化合物与降低EGF浓度的药物的联合在患有上皮源性肿瘤(尤其是通常对免疫疗法有响应的那些肿瘤)的患者亚群中的有效用途。在针对PD1或其配体的化合物中包括本发明使用的抗-PD1的ACM。此类化合物都是所有那些与细胞表面受体PD1特异性结合并阻断PD1/PDL1抑制性途径的化合物。这些抗-PD1的ACM包括:专利US 8,008,449中描述的纳武单抗、专利US 8,354,509和US 8,900,587中描述的帕博利珠单抗、MEDI0608(US 8,609,089)、匹地利珠单抗(US 8,686,119)和西米普利单抗(cemiplimab)。
本发明中使用的抗-PDL1的ACM是所有那些特异性结合PDL1并阻断PD1/PDL1抑制性途径的ACM。这些抗-PDL1的ACM包括:专利US 8,217,149中描述的阿替利珠单抗、德瓦鲁单抗(US 8,779,108)、专利US 9,624,298中描述的阿维单抗和MDX-1105(US 7943743)。
此外,根据本发明,抑制PD1/PDL1相互作用的低分子量抑制剂可以与降低EGF浓度的药物联合。这些抑制剂包括:BMS1166、BMS202和CA-170。
本发明提供的降低EGF浓度的药物是所有那些诱导产生针对自体人EGF的特异性Ac的疫苗组合物。此类Ac阻断EGF与EGF受体的相互作用,这有助于降低和/或消除血清EGF的水平。这些疫苗组合物的实例是所有那些包含重组人EGF(EGFhr)与转运蛋白之间的缀合物作为活性成分的疫苗组合物。这种转运蛋白可以是:霍乱毒素B、破伤风类毒素、KLH和来自脑膜炎奈瑟氏球菌的P64k,但不限于这些。此外,这些疫苗组合物包括选自以下的佐剂:弗氏不完全佐剂、基于角鲨烯的佐剂、合成来源的佐剂、矿物来源的佐剂、植物来源的佐剂、动物来源的佐剂、粒状蛋白佐剂和脂质体。
鉴定和/或选择患者的方法
可以使用本领域已知的常规实验技术来评估某个患者是否属于要用本发明方法治疗的患者群体。例如,为了确定上皮源性肿瘤是否表达天然KRAS,通常从要评估的患者中获得肿瘤样本,分别从样本中获得KRAS核酸序列,然后进行扩增和测序。可替代地,可以使用聚合酶链式反应检测KRAS基因中是否存在突变。
另一种方法涉及血浆或血清样本,其中可使用膜微阵列检测具有KRAS癌基因的循环肿瘤细胞。在这方面,血浆或血清中KRAS的阳性突变提示肿瘤中的KRAS突变,而血浆或血清中没有KRAS突变并不一定证明肿瘤上皮组织中没有类似的突变。
此外或者可替代地,野生型KRAS的表达可以通过检测肿瘤样本中的突变型和/或天然KRAS多肽来确定,例如,通过使用分别与对天然或突变的KRAS特异的表位结合的特异性抗体来确定。设想选择患有表达天然KRAS的上皮源性肿瘤的患者进行治疗,而不选择表达突变的KRAS的患者进行治疗。
据认为,患有表达突变的KRAS,特别是具有一种或多种如本文其它地方所述的突变的KRAS的上皮源性肿瘤的患者,对本发明方法中使用的治疗组合物的治疗响应较弱或无响应。因此,本发明还提供了对具有上皮源性肿瘤的患者进行分层的方法。当在本文中使用时,“分层”意指将患有上皮源性肿瘤的患者分选为可能受益于本发明的治疗组合物治疗的患者和不能从中受益的患者。设想其上皮源性肿瘤不表达天然KRAS的患者,特别是其上皮源性肿瘤表达突变的KRAS的患者,不可能受益于(响应于)本文所述治疗组合物的治疗。
否则,其上皮肿瘤表达本文定义的天然KRAS的患者可能受益于(响应于)本文所述的治疗。所述“天然”KRAS优选具有对应于SEQ ID No.1或SEQ ID No.2的序列。
在本文提供的治疗方法的上下文中,术语“响应”意指根据用于测试免疫治疗的临床试验中的反应评估标准(iRECIST),在施用本文定义的治疗组合物后,患者或肿瘤表现出完全反应、部分反应或疾病稳定。根据本发明,术语“无响应”意指在施用本文定义的治疗组合物后,患者或肿瘤表现出进行性疾病。在Seymour L等人RECIST working group(2017)Lancet Oncol.18(3):e143-e152中描述了iRECIST。
因此,本文还提供了一种选择待治疗的患者或患者群体的方法。这是通过确定每个患者的上皮源性肿瘤样本中是否存在突变型和/或天然KRAS来实现的。在其肿瘤样本中检测到突变的KRAS和/或未检测到天然KRAS的患者被认为不符合治疗条件,而在其肿瘤样本中检测到天然KRAS和/或未检测到突变的KRAS的患者被认为符合条件,因此根据本发明选择这些患者进行治疗。
此外如前所述,本发明可以提供一种用于预后患有上皮源性肿瘤的患者是否会对使用本发明所述治疗组合物进行的治疗响应的方法。如前所述,可使用本领域已知的常规方法来评估患者的肿瘤样本中是否存在突变的和/或天然的KRAS。突变的KRAS在上皮源性肿瘤中的表达表明患者或上皮源性肿瘤不会对治疗产生响应,而天然KRAS在上皮源性肿瘤中的表达表明患者将对用本发明所述的治疗组合物进行的治疗有很高的响应可能性。
在本发明的另一个优选实施方案中,对治疗有响应的患者将是表达天然KRAS的那些患者,并且相应地,肿瘤样本中通过免疫组织化学技术测量的PDL1水平低于1%。
治疗方法
可用本发明所述治疗组合物治疗的癌症类型包括但不限于:CPCNP、头颈部鳞状细胞癌、尿路上皮癌、结直肠癌、胃癌、食道癌、宫颈癌、肝细胞癌、Merkel细胞癌、肾细胞癌、子宫内膜癌、乳腺癌、皮肤鳞状细胞癌。
此外,本发明包括可使用本发明的组合抑制其生长的难治性或复发性肿瘤。
包含EGF作为活性成分的疫苗组合物的施用优选通过肌内进行;前四剂每14天一次,其余每28天一次,其中允许的时间范围为3天。使用这些组合物的剂量范围将包括20至70μL/kg体重或20至70μg总蛋白/kg体重或至多5mg总蛋白,更推荐30-60μg/kg。治疗阶段将至少持续6个月,随后是维持阶段,该阶段可根据获得的结果在频率和剂量上进行变化,并可以根据产生的A滴度和临床症状的改善和/或稳定进行优化,前提是保证血清EGF浓度的降低。此类血清EGF浓度可通过任何商购可得的用于此目的的诊断装置来测量。
抗-PD1和抗-PDL1的ACM将按照每种情况下的推荐剂量和方案施用。在抗-PD1的ACM的情况下,将其以100至500mg总蛋白的剂量范围静脉内施用,频率为2至6周。抗-PDL1的ACM将以600至1800mg总蛋白的范围静脉内施用,频率为2至5周。将调整疫苗和MAb的施用,以使阻断PD1/PD1 L信号传导和抑制EGF介导的信号传导的作用相匹配。根据这一原则,施用可以同时进行,也可以依次进行。特别地,疫苗组合物的施用可以与Ac的施用方案重叠。
通过以下实施例和附图进一步阐述本发明。然而,这些实施例不应被解释为对本发明范围的限制。
附图说明
图1.接受CIMAvax-EGF和AcM纳武单抗治疗的患者血清中的抗-EGF的Ac滴度。
图2.接受CIMAvax-EGF和AcM纳武单抗治疗的患者血清中的EGF水平。
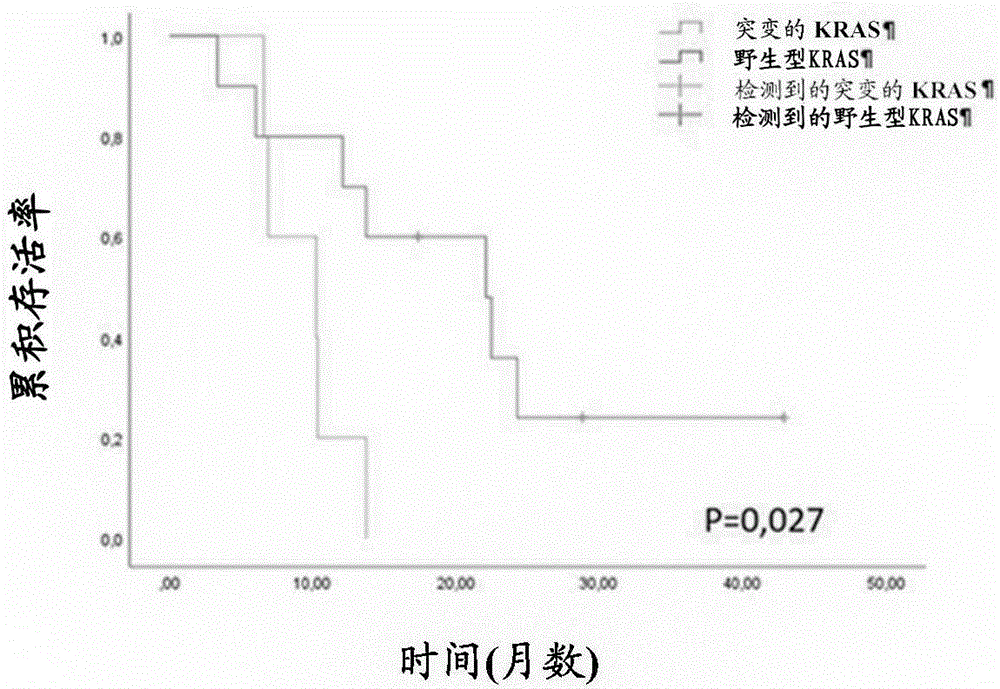
图3.在患有天然KRAS肿瘤和突变的KRAS肿瘤的患者中,接受CIMAvax-EGF和纳武单抗治疗的患者随时间的累积存活率。
图4.对于PD-L1肿瘤<1%的患者,无论是天然KRAS还是突变的KRAS,接受CIMAvax-EGF和纳武单抗治疗的患者随时间的累积存活率。
具体实施方式
实施例1.CIMAvax-EGF和抗-PD1的ACM纳武单抗的联合施用是安全的,并诱导了强效的抗人EGF的Ac反应。
在于纽约州水牛城的Roswell Park综合癌症中心(NCT02955290)进行的I/II期临床试验中,将包含疫苗组合物CIMAvax-EGF和抗-PD1的ACM纳武单抗的治疗组合物用于治疗晚期CPCNP患者。
该项研究分为I期剂量递增和II期疗效评价。共纳入29例转移性CPCNP患者。每2周以240mg的剂量静脉内施用纳武单抗。在诱导期,每2周以2.4mg的剂量肌内使用CIMAvax-EGF疫苗组合物(4剂),然后在维持期每月注射一次。前6名患者接受一半剂量的CIMAvax-EGF(1.2mg)。
安全特性良好,并且没有发现与应用的疗法相关的严重不良反应。CIMAvax-EGF在所有患者中诱导了良好的反应,其被定义为抗-EGF的Ac滴度等于或大于1:4000(血清稀释度)(图1)。
通过ELISA(Human EGF Quantikine ELISA试剂盒,R&D系统)测量,在用CIMAvax-EGF和ACM纳武单抗治疗的患者中也观察到患者血清中EGF浓度的快速下降(图2)。
接受治疗的29名患者的中位总生存期为10.36个月。全年总存活率为44%。
实施例2.CIMAvax-EGF和抗-PD1的ACM纳武单抗的联合施用显著有益于天然KRAS患者。
在实施例1所述的试验中,根据肿瘤中KRAS基因是否存在突变,通过对患者进行分层来进行分析。使用基于多参数PCR的DNA测序的新一代测序测定来验证KRAS基因的突变的存在与否以及KRAS基因的拷贝数。令人惊讶的是,具有天然KRAS的患者的存活率明显高于具有突变的KRAS的患者的存活率(图3)。
天然KRAS患者的中位生存期为22.06个月,突变的KRAS患者的中位生存期为10.26个月。天然KRAS患者的一年存活率为69%,而突变的KRAS患者的一年存活率为37%。
此外在联合治疗后,具有天然KRAS的患者在疾病控制率方面有显著的改善(根据irRECIST标准疾病至少稳定的患者(Seymour L等人,RECIST working group(2017)LancetOncol.18(3):e143-e152)。在具有天然KRAS的患者中,CIMAvax-EGF和纳武单抗联合治疗后的疾病控制率为56.3%,而在含有KRAS突变的肿瘤患者中为12.5%。
在具有天然KRAS的患者中对于联合治疗观察到的存活率具有临床相关性,因为根据文献,根据KRAS突变进行分层不会影响仅用ACM纳武单抗治疗的患者的存活率。在这些患有晚期CPCNP的患者中,在具有突变或天然KRAS的患者中,使用纳武单抗的单一疗法分别导致11.2个月和10个月的中位生存期(Passiglia F等人(2019)Br J Cancer 120(1):57-62)。
实施例3.CIMAvax-EGF和抗-PD1的Ac纳武单抗的联合施用显著有益于具有天然KRAS肿瘤且PDL1<1%的患者。
鉴于文献中已知肿瘤中PDL1表达低的患者中对抗-PD1的ACM单一疗法的反应较低的历史,对肿瘤中不表达PDL1(PDL1<1%)的患者重复实施例2的分析。使用用于PDL1测定的PharmDx测定法28-8测定PDL1的表达。
令人惊讶的是,观察到根据KRAS突变进行患者分层再次改变了患者的存活率。天然KRAS患者的中位生存期为22.06个月,突变的KRAS患者的中位生存期为10.26个月。天然KRAS患者的一年存活率非常高,为80%(图4)。
序列表
<110>分子免疫中心, 创新免疫疗法联盟有限公司
<120>治疗组合物用于治疗上皮源性肿瘤患者的用途
<130>712020CU00
<160>2
<170>PatentIn version 3.5
<210>1
<211>189
<212>PRT
<213>智人
<400>1
Met Thr Glu Tyr Lys Leu Val Val Val Gly Ala Gly Gly Val Gly Lys
1 5 1015
Ser Ala Leu Thr Ile Gln Leu Ile Gln Asn His Phe Val Asp Glu Tyr
202530
Asp Pro Thr Ile Glu Asp Ser Tyr Arg Lys Gln Val Val Ile Asp Gly
354045
Glu Thr Cys Leu Leu Asp Ile Leu Asp Thr Ala Gly Gln Glu Glu Tyr
505560
Ser Ala Met Arg Asp Gln Tyr Met Arg Thr Gly Glu Gly Phe Leu Cys
65707580
Val Phe Ala Ile Asn Asn Thr Lys Ser Phe Glu Asp Ile His His Tyr
859095
Arg Glu Gln Ile Lys Arg Val Lys Asp Ser Glu Asp Val Pro Met Val
100 105 110
Leu Val Gly Asn Lys Cys Asp Leu Pro Ser Arg Thr Val Asp Thr Lys
115 120 125
Gln Ala Gln Asp Leu Ala Arg Ser Tyr Gly Ile Pro Phe Ile Glu Thr
130 135 140
Ser Ala Lys Thr Arg Gln Arg Val Glu Asp Ala Phe Tyr Thr Leu Val
145 150 155 160
Arg Glu Ile Arg Gln Tyr Arg Leu Lys Lys Ile Ser Lys Glu Glu Lys
165 170 175
Thr Pro Gly Cys Val Lys Ile Lys Lys Cys Ile Ile Met
180 185
<210>2
<211>187
<212>PRT
<213>智人
<400>2
Met Thr Glu Tyr Lys Leu Val Val Val Gly Ala Gly Gly Val Gly Lys
1 5 1015
Ser Ala Leu Thr Ile Gln Leu Ile Gln Asn His Phe Val Asp Glu Tyr
202530
Asp Pro Thr Ile Glu Asp Ser Tyr Arg Lys Gln Val Val Ile Asp Gly
354045
Glu Thr Cys Leu Leu Asp Ile Leu Asp Thr Ala Gly Gln Glu Glu Tyr
505560
Ser Ala Met Arg Asp Gln Tyr Met Arg Thr Gly Glu Gly Phe Leu Cys
65707580
Val Phe Ala Ile Asn Asn Thr Lys Ser Phe Glu Asp Ile His His Tyr
859095
Arg Glu Gln Ile Lys Arg Val Lys Asp Ser Glu Asp Val Pro Met Val
100 105 110
Leu Val Gly Asn Lys Cys Asp Leu Pro Ser Arg Thr Val Asp Thr Lys
115 120 125
Gln Ala Gln Asp Leu Ala Arg Ser Tyr Gly Ile Pro Phe Ile Glu Thr
130 135 140
Ser Ala Lys Thr Arg Gln Gly Val Asp Asp Ala Phe Tyr Thr Leu Arg
145 150 155 160
Glu Ile Arg Lys His Lys Glu Lys Met Ser Lys Asp Gly Lys Lys Lys
165 170 175
Lys Lys Lys Ser Lys Thr Lys Cys Val Ile Met
180 185
- 一种变压器油纸绝缘老化微观形貌观测系统及方法
- 一种绕组模型绝缘受潮和老化评估研究的实验方法
- 一种融合多特征量综合评估油纸绝缘老化程度的方法
- 一种油纸绝缘的受潮及老化样品的制备方法、装置及系统
- 一种油纸绝缘电力设备的受潮状态评估方法及系统
