一种胚胎非整倍体的检测方法及应用
文献发布时间:2024-04-18 20:01:55
技术领域
本发明属于测序分析领域,涉及到一种胚胎非整倍体的检测方法及应用。
背景技术
PGT-A:PGT-A(胚胎植入前非整倍体遗传学检测)是对通过IVF产生的胚胎进行的遗传测试。PGT-A提供有关胚胎遗传健康的信息,以帮助护理团队选择最佳胚胎进行转移,并提高成功怀孕的机会。PGT-A技术是通过观察IVF胚胎内的遗传物质的数量来工作,这种遗传物质配置在染色体的结构中。人类染色体对健康的生长和发育非常重要,染色体数量不正确(也称为非整倍体胚胎)的胚胎通常不会导致成功怀孕,还可能导致具有遗传病的儿童的出生。正确数量的染色体(也称为整倍体胚胎)的胚胎更有可能导致成功怀孕。
PGT-A适合绝大多数接受IVF治疗的患者:
所有女性都有生成染色体异常胚胎的风险,随着女性年龄的增长,无论胚胎数量多少,染色体异常胚胎的可能性都会显着增加。PGT-A可以帮助所有年龄段的女性增加成功怀孕的成功率。
染色体数目异常,即非整倍体(aneuploidy)改变在体外受精(in vitrofertilization,IVF)胚胎中十分多见,是导致常规IVF后胚胎移植(embryo transfer,ET)受孕率和胚胎着床率低而流产率高,成功率低下这一难以逾越的技术瓶颈的重要因素。染色体数目异常不仅导致自然流产、死产和胚胎早期丢失,也是新生儿遗传病的主要原因之一。因此从提高IVF—ET成功率,降低染色体病患儿出生率的角度出发,胚胎细胞染色体的非整倍体筛查显得十分重要,业已成为胚胎植入前遗传学诊断(preimplantation geneticdiagnosis,PGD)的主要内容。
NGS检测胚胎的非整体:
随着现代分子生物学的发展,运用于PGS的遗传学分析技术也在不断更新,由最初的PCR仅能检测单位点的突变,发展到FISH技术,可以检测少数染色体,后来又出现芯片技术,可以检测所有染色的数目及结构异常,到目前的二代测序技术,可同时进行染色体异常及单基因疾病的诊断。具体而言,当体外培养5天的受精卵发育至囊胚期时可提取胚胎滋养层细胞(trophoblast)。一般操作为在显微镜下,用毛细玻璃管吸取一个至数个滋养层细胞将细胞裂解,释放其中的微量DNA,将微量DNA进行全基因组扩增后,可采用核酸芯片或二代测序等方法检测细胞的染色体状态(参见发明专利申请CN104711362A,公开日为2015年6月17日)。理论上讲,吸取出来的几个细胞中的染色体状态与胚胎中其它细胞一致,检测这几个细胞即可了解该胚胎的染色体状态是否正常。
三代单分子测序技术:
第三代测序在单分子水平读取核苷酸序列,因此也被称为单分子测序,主要技术路线有HeliScope的tSMS测序技术、Nanopore的纳米孔测序技术和PacBio的SMRT测序技术等等。与传统的第一代和第二代测序技术相比,第三代测序最大的优势是能够产生更长的碱基读长,除此之外,还能直接对RNA进行测序,无需逆转录,测序速度极快,同时其中某些技术所涉及的设备可以小型化,可便携至野外现场测序。纳米孔测序技术具备单分子分辨率,读长长,操作便携等独特优势。在宏基因组测序,病原体测序,新物种基因组测序与表观遗传学测序等多个具体的应用领域中渐渐展示出不可替代的地位。一个主要的例子是牛津纳米孔技术公司的MinION
发明内容
本发明的目的是提供一种基于三代测序进行快速PGTA的方法,所述的方法能够快速、便捷地鉴定胚胎非整倍体。
为实现上述目的,本发明采用了如下技术方案:
本发明第一方面提供了一种检测胚胎非整倍体的方法,该方法包括:
采用第三代测序技术检测胚胎非整倍体。
在本发明的一个实施方式中,所述的方法包括:
(1)对单细胞样本的全基因组进行扩增,获得扩增产物;
(2)构建扩增产物三代文库,进行测序;
(3)对测序数据进行分析处理。
所述的单细胞为胚胎细胞。
作为一种优选的实施方式,所述的胚胎细胞为胚胎滋养层细胞。
在本发明的一个实施方式中,所述的测序为纳米孔测序。
在本发明的一个实施方式中,所述的扩增包括预扩增、指数扩增。
在本发明的一个实施方式中,所述的预扩增的步骤包括:
制备预扩增混合液,向单细胞样本中加入预扩增混合液,进行预扩增反应,获得预扩增反应液。
在本发明的一个实施方式中,所述的预扩增混合液包括亿康chromInst建库试剂盒(货号XK-008-24)中的缓冲液2和预扩增酶。
在本发明的一个实施方式中,所述的预扩增为PCR反应,预扩增的PCR反应条件如本发明中的表3所示。
在本发明的一个实施方式中,所述的指数扩增的步骤包括:
向所述的预扩增反应液中加入指数扩增混合液、标签引物,进行指数扩增反应。
在本发明的一个实施方式中,所述的标签引物为NGS测序建库所用的标签引物。
作为一种优选地实施方式,所述的标签引物为亿康NGS通用Index试剂盒(Illumina)中的标签引物,该试剂盒的货号为YK001-001/YK001-002/YK001-003/YK001-004)
在本发明的一个实施方式中,所述的指数扩增混合液包括亿康chromInst建库试剂盒(货号XK-008-24)中的缓冲液3和扩增酶。
在本发明的一个实施方式,所述的指数扩增为PCR反应,指数扩增的PCR反应条件如本发明中的表5所示。
在本发明的一个实施方式中,所述的方法还包括在步骤(2)之前,进行扩增产物的纯化与定量。
在本发明的一个实施方式中,所述的扩增产物的纯化与定量的步骤包括:
采用磁珠纯化扩增产物,对纯化后的产物进行定量。
在本发明的一个实施方式中,所述的磁珠为亿康chrominst试剂盒中的磁珠。
在本发明的一个实施方式中,所述的定量的方法包括Qubit定量、实时荧光定量PCR。
在本发明的一个实施方式中,所述的构建扩增产物三代文库的步骤包括:
(A)对扩增产物进行DNA末端修复;
(B)进行三代barcode连接;
(C)进行三代接头连接。
在本发明的一个实施方式中,所述的三代barcode连接采用的试剂盒为Nanopore的Native Barcoding Expansion 1-12(EXP-NBD104)。
本发明第二方面提供了一种检测胚胎非整倍体的试剂盒,其包括:扩增用试剂、标签引物、用于三代文库构建的试剂、用于三代测序的试剂,所述的扩增用试剂包括预扩增混合液、指数扩增混合液。
在本发明的一个实施方式中,所述的预扩增混合液包括亿康chromInst建库试剂盒(货号XK-008-24)中的缓冲液2和预扩增酶。
在本发明的一个实施方式中,所述的指数扩增混合液包括亿康chromInst建库试剂盒(货号XK-008-24)中的缓冲液3和扩增酶。
在本发明的一个实施方式中,所述的用于三代文库构建包括:
用于DNA末端修复反应的试剂、用于barcode连接反应的试剂,用于三代接头连接的试剂。
在本发明的一个实施方式中,所述的用于DNA末端修复反应的试剂包括ΜLtra IIEnd-prep reaction buffer、ΜLtra II End-prep enzyme mix。
在本发明的一个实施方式中,所述的用于barcode连接反应的试剂包括NativeBarcode、Blunt/TA Ligase Master Mix。
在本发明的一个实施方式中,所述的用于三代接头连接的试剂包括Adapter MixII(AMII)、NEBNext Quick Ligation Reaction Buffer(5X)、Quick T4 DNA Ligase。
在本发明的一个实施方式中,所述的用于三代测序的试剂包括Flow CellPriming Kit(EXP-FLP002)、Loading Beads(LB)、Sequencing Buffer(SQB)。
本发明第三方面提供了一种检测胚胎非整倍体的装置,其包括:
获取模块,用于对样本按照如本发明第一方面所述的方法进行处理,获得测序数据;
分析模块,用于对测序数据进行分析处理。
本发明第四方面提供了一种计算机设备,其包括存储器和处理器,所述存储器存储有计算机程序,所述计算机程序被所述处理器执行时,使得所述处理器实现:采用本发明第一方面所述的方法检测胚胎非整倍体。
本发明第五方面提供了一种计算机可读存储介质,其存储有计算机程序,所述计算机程序被处理器执行时,使得所述处理器实现:采用本发明第一方面所述的方法检测胚胎非整倍体。
有益效果:
本发明提供了一种利用纳米孔测序进行可靠的,便携的,简单的,快速的鉴定胚胎非整倍体的方法,不仅可以节约成本,还可以减少样本寄送的时间,更加快速便捷,对于产前和生育护理具有临床指导意义。
附图说明
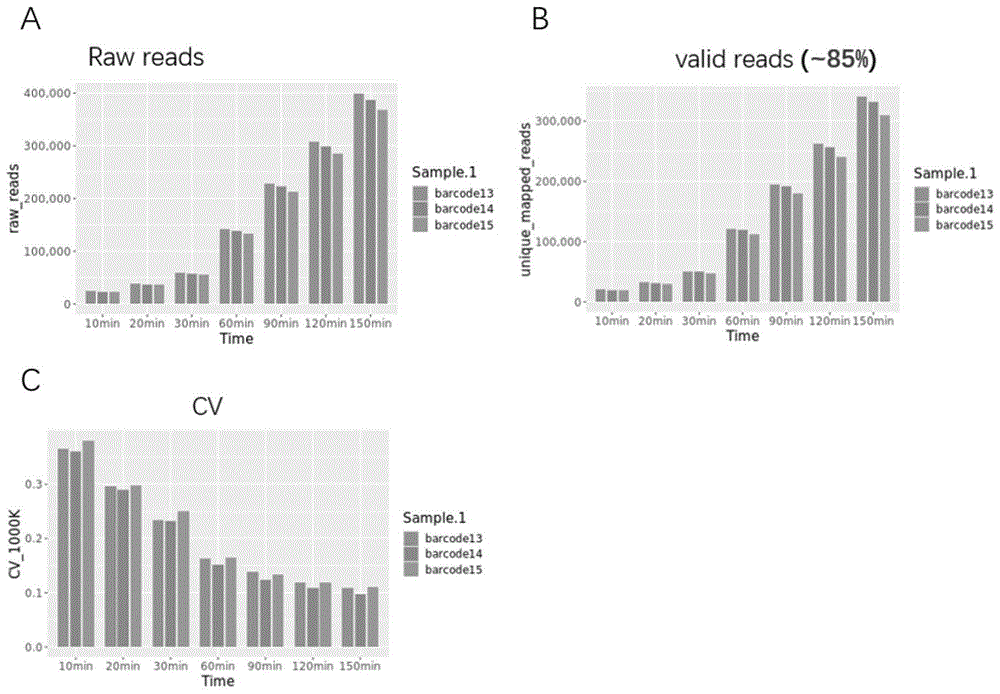
图1为纳米孔测序质控结果图,其中,图1中A为不同测序时间下Raw reads,图1中B为不同测序时间下有Valid reads,图1中C为不同测序时间下不同样本之间的CV值;
图2为纳米孔测序样本测序60min的数据进行CNV图分析的结果图;
图3为纳米孔测序质控结果图,其中,图3中A为不同测序时间下Raw reads,图3中B为不同测序时间下有unique mapped reads,图3中C为不同测序时间下不同样本之间的CV值。
具体实施方式
在进一步描述本发明具体实施方案之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规技术。
实验方法:
实施例1胚胎单细胞全基因组扩增与文库构建
试剂:实施例1中的试剂来自亿康的chromInst建库试剂盒(货号XK-008-24)。
样本处理:
细胞样本来自多中心临床研究医院,为囊胚的滋养外胚层细胞。
在胚胎受精后5-7天,一个微小的孔被刻入所述透明的胚胎,胚胎的外滋养层细胞从这个洞里伸出来,用激光抽吸和分离伸出的细胞样本。
显微镜下挑取1-100个细胞,放入含5μL缓冲液1的200μL PCR管中。
方法:
一、裂解
1.待建库样本,共N管,每个PCR管中分别加入0.5μL细胞裂解酶。
2.PCR管放置于PCR仪上,按照表1设置反应参数:
表1 PCR反应参数
二、预扩增
1.按照表2制备预扩增混合液:
表2预扩增混合液成分
2.向步骤一获得的裂解液加入30μL预扩增混合液(此时反应总体积约为36μL),涡旋振荡,瞬时离心。
3.将PCR管放置于PCR仪上,按照表3设置反应参数:
表3 PCR反应参数
三、指数扩增
1.按照表4制备扩增混合液:
表4扩增混合液成分
2.向步骤二获得的预扩增反应液加入30μL扩增混合液和1μL标签引物(使用亿康NGS通用Index试剂盒(Illumina),货号:YK001-001/YK001-002/YK001-003/YK001-004),涡旋振荡,瞬时离心。记录每个样本对应的标签引物编号。
注意:此处标签引物每个样本加入一种即可,同一批上机样本标签引物不可重复。
3.将PCR管放置于PCR仪上,按照表5设置反应参数:
表5 PCR反应参数
四、文库纯化
1.提前取出磁珠平衡至室温。涡旋振荡磁珠20sec,使其充分混匀。
2.向每个待纯化文库中加入1×的磁珠(例如:文库起始体积为100μL,加入100μL磁珠),涡旋振荡混匀,瞬时离心2000rpm,3~5sec,室温静置5min,离心管固定于磁力架上静置5min,使磁珠与上清液分离。弃上清液体,保留磁珠。
注意:千万不要吹打含有目的片段的磁珠。
3.保持离心管固定于磁力架上,向离心管中加入200μL新鲜配制的80%乙醇,室温放置30sec,小心弃除上清,保留磁珠。
4.重复步骤3一次。
5.保持离心管固定于磁力架上静止放置10min,使乙醇完全挥发干净。
6.将离心管从磁力架上取下,加入17.5μL无核酸酶水,涡旋振荡使磁珠完全重悬,室温放置5min。
7.将离心管短暂离心并置于磁力架上约5min,使磁珠与上清液分离。吸取15μL上清至新的离心管中,即为制备完成的文库,于-20℃保存。
五、文库定量
纯化后的文库可使用
步骤六:文库混合
如果文库使用
实施例2NGS测序
混合后的文库重新进行
实施例3三代测序
一、Chrominst扩增产物三代文库的构建
在实施例1获得的文库基础上,进一步进行三代文库的构建。
(1)DNA末端修复反应
1.按照表6,向200μL PCR管中加入试剂:
表6 DNA末端修复反应体系
2.用枪头轻轻吹吸上述溶液,短暂离心,使所有组分收集到管底。
3.将上述PCR管置于PCR仪中,热盖85℃打开,反应程序如表7所示:
表7 PCR反应参数
4.产物纯化,使用55μL磁珠纯化(Agencourt AMPure XP beads,1X磁珠纯化),回溶于25μL水中,Qubit定量。
(2)Barcode连接反应
1.按照表8加入试剂,进行三代barcode连接,采用的试剂盒为Nanopore的NativeBarcoding Expansion 1-12(EXP-NBD104)
表8 Barcode连接反应体系
2.用枪头将上述试剂吹吸混匀,短暂离心,使溶液收集到管底。
3.室温孵育10分钟后,使用50μL磁珠纯化(Agencourt AMPure XP beads,1X磁珠纯化),回溶于26μL水中,Qubit定量。
4.于新的1.5ml离心管中混合等摩尔量的barcoded样本,确保有足够的样品组合,以产生总100-200fmol的混合样品。
5.取1μL pooling好的样本进行Qubit定量,将100-200fmol的样品稀释到65μL的无核酸酶水中。
(3)三代接头连接反应
1.取出EB,Short Fragment Buffer(SFB)置于室温,涡旋混匀后置于冰上。取出Adapter Mix II离心后置于冰上。
2.按照表9加入试剂,进行三代接头连接。
表9三代接头连接体系
3.用枪头将上述试剂吹吸混匀,短暂离心,使溶液收集到管底。
4.室温孵育15分钟后,加入50μL磁珠纯化(Agencourt AMPure XP beads,0.5X磁珠纯化),室温结合10min后置于磁力架上静置5min;待磁珠全部吸附到管壁上(约5min),弃上清后用SFB buffer清洗磁珠两次,弃上清;室温晾干30seconds。
5.磁珠重悬于15μLEB中,室温孵育10min后置于磁力架上,待溶液澄清后取1μLQubit定量。回收率为50-100fmol。
二、三代文库的上机测序
三代测序相关试剂:Flow Cell Priming Kit(EXP-FLP002);Loading Beads(LB);Sequencing Buffer(SQB);操作步骤参考Nanopore公司的Native Barcoding Expansion1-12(EXP-NBD104)说明书。参照表10进行上机文库溶液的制备。
表10上机文库溶液
75μL的三代待测文库溶液悬滴到R9.4 flow cell(FLO-MIN106;Oxford NanoporeTechnologies)上,开启MinION
实施例4临床样本检测
三例胚胎囊胚滋养层细胞进行全基因组扩增,参考上面的实验步骤进行NGS建库和上机测序以及三代纳米孔建库和上机测序。
二代测序的标签序列为亿康NGS通用Index试剂盒(Illumina)中的K181,K182,K187。
三代测序的标签序列为Nanopore公司的Native Barcoding Expansion 1-12(EXP-NBD104)试剂盒中的NB13,NB14,NB15。
数据分析采用的是CBS算法。CBS算法,全称是circular binary segmentation,是一种基于染色体芯片数据检测拷贝数变异的方法,目前也适用于二代测序数据的拷贝数变异检测的方法。DNAcopy是基于CBS算法实现的R包。
NGS测序结果如表11所示;
表11 NGS测序结果
纳米孔测序质控结果如图1所示。
纳米孔测序样本测序60min的数据进行CNV图分析(如图2所示)。
纳米孔测序结果如表12所示:
表12纳米孔测序结果
实验结果表明:纳米孔测序检出3例临床样本的核型与NGS检测结果一致,证明纳米孔测序鉴定胚胎非整倍体的准确性;另外测序60min的下机数据便可正确的区分出样本的核型信息,表明纳米孔测序进行PGTA的快速便捷。
实施例5多样本混合检测
为了验证多样本混合情况下,纳米孔测序用于PGTA鉴定的准确性和可能性。将样本数量扩大到12个样本进行测试。
12例胚胎囊胚滋养层细胞进行全基因组扩增,参考上面的实验步骤进行NGS建库和上机测序以及三代纳米孔建库和上机测序。
二代测序的标签序列为亿康NGS通用Index试剂盒(Illumina)
三代测序的标签序列为Nanopore公司的Native Barcoding Expansion 1-12(EXP-NBD104)试剂盒中的NB1-12。
数据分析采用的是CBS算法。DNAcopy是基于CBS算法实现的R包。
NGS测序结果如表13所示;
表13NGS测序结果
纳米孔测序质控结果如图3所示。
纳米孔测序结果如表14所示:
表14纳米孔测序结果
实验结果表明:纳米孔测序检测12例临床样本的核型与NGS检测结果一致,再次证明在扩大样本量的情况下,纳米孔测序鉴定胚胎非整倍体的准确性;另外测序150min的下机数据便可正确的区分出12例样本的核型信息,表明纳米孔测序进行多样本同时测序时PGTA的快速便捷。
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
- 热管以及热管的制造方法
- 热管的制造方法和热管
- 采用浆料灌入式的粉末烧结不锈钢热管制造方法及热管
- 采用浆料灌入式的粉末烧结不锈钢热管制造方法及热管
