眼用药物组合物及其用途
文献发布时间:2024-05-31 01:29:11
相关申请
本申请要求2021年12月17日提交的美国专利63/290,781的优先权,其通过引用整体并入本文。
技术领域
本发明总体上涉及(1R,2S,5R)-2-异丙基-N-(4-甲氧基苯基)-5-甲基环己烷-1-甲酰胺(WS-12)的眼用药物组合物及其用途。WS-12的结构如下所示。
背景技术
眼表和其他暴露的黏膜的湿度由外分泌腺产生的持续水性液体分泌维持。这一过程的干扰导致非常普遍的眼、口和阴道干燥综合征,尤其是在老年人中(Moss,S.E.,等人2008.Optom.Vis.Sci.85:668-674;Barker,K.E.&Savage,N.W.2005.Aust.Dent.J.50:220-223;Leiblum,S.R.,等人2009.J.Sex Med 6:2425-2433)。在缺乏情绪或外部刺激物刺激的情况下发生的泪流称为“基础”泪液分泌。在眼睛中,基础泪流根据环境条件和眨眼速率的变化进行调整(Dartt,D.A.2009,Prog.Retin.Eye Res.28:155-177)。眼表刺激后,泪液产生也显著增加(Acosta,M.C.等人2004.Invest Ophthalmol.Vis.Sci.45:2333-2336)。由机械性伤害感受器和多觉性伤害感受器三叉神经末梢检测刺激物刺激,它们对引起疼痛(Belmonte,C.,et al.2004.Exp.Eye Res.78:513-525)和刺激物诱导的泪液产生的伤害性的机械力、有害的热和刺激化学物质敏感。然而,负责感受眼表干燥以调节基础泪液生成率的神经结构仍未确定。
干眼症又称干眼病,是一种以结膜持续干燥和角膜不透明为特征的疾病。如本文所用,干眼症还包括称为睑板腺功能障碍或MGD的病症。
仅在美国就有超过3000万人患有干眼症,但实际接受治疗的不到10%。此外,由于人口老龄化以及更频繁地使用隐形眼镜、电脑、智能手机和平板电脑,干眼症的患病率持续上升。据信,干眼症是最常见的患者为之要求与眼科医生或验光师进行预约的疾病或病症之一,且大多数患者未接受药物干预或泪点塞(Stonecipher等人,Therapeutics andClinical Risk Management 2013,9:409-415)。
多种原因可导致干眼症,这在老年人中更为常见。引起干眼症或与干眼症相关的疾病或病症包括:睑板腺功能减退、炎症或堵塞、维生素A缺乏、干燥综合征、类风湿性关节炎和其他风湿病、化学或热烧伤,或药物例如阿替洛尔、扑尔敏、氢氯噻嗪、异维甲酸、酮咯酸、酮替芬、左卡巴斯汀、左氧氟沙星、奥昔布宁或托特罗定。
干眼症的治疗包括使用皮质类固醇(在疾病早期可能有效)、维生素A补充剂和匹罗卡品(一种增加泪液产生的药物)。将例如人工泪液、羟丙基甲基纤维素(羟丙甲纤维素)溶液和卡波姆凝胶等制剂应用于结膜以减轻干燥。但是,这些治疗方法在其各自的有效性和毒性方面存在明显的局限性。
因此,需要提供在受试者中治疗或减轻涉及泪液产生的疾病或病症的体征或症状的眼用药物组合物。还需要提供这样的眼用药物组合物,其中,维持包含在该眼用药物组合物中的一种或多种药物活性成分的稳定性,以在每次施用的剂量中最大化眼用药物组合物的药物活性。还需要在受试者中治疗或降低干眼症可能性及其体征或症状的眼用药物组合物,其不含可能对受试者产生有害影响的防腐剂。
WO 2012/032209描述了WS-12,一种TRPM8钙通道激动剂,并且可用于治疗干眼病或干眼症。重要的是维持WS-12水性眼用组合物的稳定性,以在每次施用的剂量中最大化WS-12的药物活性。因此,需要一种在容器中包含WS-12的眼用药物组合物,其可以保持WS-12与增加的温度、湿度和光暴露(尤其是紫外线)以及其他类型的外部影响相关的稳定性。
本文对任何参考文献的引用不应被视为承认该参考文献可作为本公开的现有技术获得。
发明内容
本文提供了新的和有用的眼用药物组合物,其用于:(a)在受试者中治疗或降低涉及泪液产生的眼科疾病或病症的可能性,例如干眼症;(b)治疗或减轻该眼科疾病或病症的体征或症状,或(c)(a)和(b)的组合。本发明还提供了一种在受试者中治疗涉及泪液产生的眼科疾病或病症和/或治疗或减轻该眼科疾病或病症的体征或症状的方法。
广义而言,本公开扩展至眼用药物组合物,其包含约0.0005%w/v至约0.01%w/v(1R,2S,5R)-2-异丙基-N-(4-甲氧基苯基)-5-甲基环己烷-1-甲酰胺(WS-12)或其药学上可接受的盐,约0.1%w/v至约5%w/v的增溶剂,约0.1%w/v至约0.5%w/v的粘度调节剂,约0.3%w/v至约1%w/v的缓冲剂,和约0.1%w/v至约1.0%w/v的张度剂。
本公开的眼用药物组合物的pH可在约pH 5.0至约8.5的范围内。更具体地,本公开的眼用药物组合物的pH可在约6.7至约7.3的范围内。在特定实施方案中,本公开的眼用药物组合物的pH为约7。本公开的眼用药物组合物可进一步包含pH调节剂,以获得所需的pH。许多pH调节剂都有应用,包括本公开的眼用药物组合物中的pH调节剂。在本公开的眼用药物组合物中具有应用的pH调节剂的具体示例为氢氧化钠(例如,1N氢氧化钠)。为了将pH调至约7,加入足够量的1N氢氧化钠。
此外,在本公开的眼用药物组合物中具有应用的增溶剂包括聚乙二醇(PEG)400、蓖麻油、聚氧乙烯(20)失水山梨醇单油酸酯(TWEEN 80)、聚氧乙烯35蓖麻油(
根据FAO/WHO食品添加剂联合专家委员会(JECFA),WS-12不溶于水,并且仅微溶于鳄梨油或乙醇。不可预测的是,某些赋形剂未能令人满意地溶解活性药物WS-12,包括聚乙烯吡咯烷酮(PVP)、丙二醇和氧化乙烯-甲醛-对辛基苯酚共聚物(泰洛沙泊),而其他赋形剂令人满意地溶解了活性药物WS-12,包括聚乙二醇(PEG)400、蓖麻油、聚氧乙烯(20)失水山梨醇单油酸酯(TWEEN 80)、聚氧乙烯35蓖麻油(
此外,多种粘度调节剂可容易地用于本公开的眼用药物组合物中,例如纤维素衍生物、粘土、硅酸铝或镁、天然胶、合成聚合物;胶态二氧化硅、硅酸盐(仅举几例)及其任意组合。在本公开的眼用药物组合物中具有应用的纤维素衍生物的具体示例包括但当然不限于甲基纤维素、微晶纤维素、羧甲基纤维素、乙基纤维素、羟乙基纤维素、羟丙基纤维素和羟丙基甲基纤维素。同样,也可以使用几种粘土,例如锂蒙脱石、膨润土、硅酸铝和/或镁以及高岭土。在本公开的眼用药物组合物中具有应用的天然胶包括阿拉伯胶、瓜尔胶、黄蓍胶、黄原胶、藻酸盐、卡拉胶、刺槐豆胶或其任何组合。在本公开的眼用药物组合物的特定实施方案中,粘度调节剂为羟丙基甲基纤维素(羟丙甲纤维素)。
此外,在本公开的眼用药物组合物中,具有应用的特定张度剂为氯化钠。
许多缓冲剂在本公开的眼用药物组合物中具有应用。示例包括但当然不限于磷酸盐缓冲剂、柠檬酸盐缓冲剂、TRIS碱、TRIS HCl、PBS、HEPES、MES、PIPES和TES。其他缓冲剂的示例包括硼酸。在一些实施方案中,缓冲剂包含磷酸盐。
本公开的眼用药物组合物进一步包含纯水。
类似地,本公开的眼用药物组合物的具体示例包含:
(a)约0.003%w/v(1R,2S,5R)-2-异丙基-N-(4-甲氧基苯基)-5-甲基环己烷-1-甲酰胺;
(b)约0.14%w/v羟丙甲纤维素;
(c)约3.0%w/v聚氧乙烯35蓖麻油;
(d)约0.78%w/v磷酸盐缓冲剂(例如磷酸钠缓冲剂,例如磷酸一钠或二水合磷酸二氢钠)
(e)约0.55%w/v NaCl;
(f)足够量的NaOH(例如,1N NaOH),以提供pH约7的眼用药物组合物;和
(g)纯水。
本公开的眼用药物组合物的另一个示例包括:
(a)0.003±15%w/v(1R,2S,5R)-2-异丙基-N-(4-甲氧基苯基)-5-甲基环己烷-1-甲酰胺;
(b)0.14±15%w/v羟丙甲纤维素;
(c)3.0±15%w/v聚氧乙烯35蓖麻油;
(d)0.78±15%w/v磷酸盐缓冲剂(例如磷酸钠缓冲剂,例如磷酸一钠或二水合磷酸二氢钠)
(e)0.55±15%w/v NaCl;
(f)足够量的NaOH(例如,1N NaOH),以提供pH约7的眼用药物组合物;和
(g)纯水。
本公开的眼用药物组合物的另一个示例包括:
(a)0.003±10%w/v(1R,2S,5R)-2-异丙基-N-(4-甲氧基苯基)-5-甲基环己烷-1-甲酰胺;
(b)0.14±10%w/v羟丙甲纤维素;
(c)3.0±10%w/v聚氧乙烯35蓖麻油;
(d)0.78±10%w/v磷酸盐缓冲剂(例如磷酸钠缓冲剂,例如磷酸一钠或二水合磷酸二氢钠)
(e)0.55±10%w/v NaCl;
(f)足够量的NaOH(例如,1N NaOH),以提供pH约7的眼用药物组合物;和
(g)纯水。
本公开的眼用药物组合物的另一个示例包括:
(a)约0.0014%w/v(1R,2S,5R)-2-异丙基-N-(4-甲氧基苯基)-5-甲基环己烷-1-甲酰胺;
(b)约0.14%w/v羟丙甲纤维素;
(c)约3.0%w/v聚氧乙烯35蓖麻油;
(d)约0.78%w/v磷酸盐缓冲剂(例如磷酸钠缓冲剂,例如磷酸一钠或二水合磷酸二氢钠)
(e)约0.55%w/v NaCl;
(f)足够量的NaOH(例如,1N NaOH),以提供pH约7的眼用药物组合物;和
(g)纯水。
本公开的眼用药物组合物的另一个示例包括:
(a)约0.0014±15%w/v(1R,2S,5R)-2-异丙基-N-(4-甲氧基苯基)-5-甲基环己烷-1-甲酰胺;
(b)约0.14±15%w/v羟丙甲纤维素;
(c)约3.0±15%w/v聚氧乙烯35蓖麻油;
(d)约0.78±15%w/v磷酸盐缓冲剂(例如磷酸钠缓冲剂,例如磷酸一钠或二水合磷酸二氢钠)
(e)约0.55±15%w/v NaCl;
(f)足够量的NaOH(例如,1N NaOH),以提供pH约7的眼用药物组合物;和
(g)纯水。
本公开的眼用药物组合物的另一个示例包括:
(a)约0.0014±10%w/v(1R,2S,5R)-2-异丙基-N-(4-甲氧基苯基)-5-甲基环己烷-1-甲酰胺;
(b)约0.14±10%w/v羟丙甲纤维素;
(c)约3.0±10%w/v聚氧乙烯35蓖麻油;
(d)约0.78±10%w/v磷酸盐缓冲剂(例如磷酸钠缓冲剂,例如磷酸一钠或二水合磷酸二氢钠)
(e)约0.55±10%w/v NaCl;
(f)足够量的NaOH(例如,1N NaOH),以提供pH约7的眼用药物组合物;和
(g)纯水。
此外,本公开进一步扩展至使用本文公开的眼用药物组合物治疗各种眼科疾病或病症和/或与该疾病或病症相关的体征或症状的各种方法。
具体而言,本公开扩展至用于治疗涉及泪液产生的眼科疾病或病症和/或减轻其体征或症状的方法,其包括施用治疗有效量的本公开的眼用药物组合物。在特定实施方案中,眼科疾病或病症为干眼症。
本公开进一步扩展至用于在有需要的受试者中治疗或减轻涉及泪液产生的眼部刺激的方法,其包括施用治疗有效量的本公开的眼用药物组合物。
还提供了一种用于在有需要的受试者中治疗或减轻眼科疾病或病症的体征或症状的方法,其包括施用治疗有效量的本公开的眼用药物组合物。因此,本公开的方法容易应用于治疗或减轻眼科疾病或病症(例如干眼症)的体征或症状。可用治疗有效量的本公开的眼用药物组合物容易地治疗或减轻的干眼症的此类症状的示例包括视觉模拟评分(VAS)症状评分(眼部不适评分[ODS],眼干燥评分或眼部疼痛评分)的降低,或在Schaumberg等人的“Global Dry Eye Symptom Index”,The Ocular Surface,5(1):50-57(2007)中公开和验证的“干眼症症状评估”问卷中获得的评分的降低,并且其旨在基于视觉模拟评分(SANDE问卷)、眼干燥和眼睛疼痛或刺激(仅举几例)量化干眼综合征的症状的频率和严重程度。同样地,可用本公开的眼用药物组合物治疗或减轻的干眼症的体征包括但不限于Schirmer评分(未麻醉和经麻醉)、眼表染色、结膜泛红、泪膜破裂时间和泪液生成。Schirmer测试由OttoSchirmer于1903年首次公开,旨在测试受试者的眼睛是否产生足够的泪液以保持眼睛湿润(Schirmer O,Studien zur Physiologie und Pathologie der Tranenabsonderung undTranenbfuhr(Arch.Klin.Opthalmol.56:197-291(1903))。因此,该测试涉及确定受试者是否产生足够量的泪液来润滑眼睛。眼部染色也被用作干眼疾病或病症的体征。在眼表染色中,将一种染料涂在眼表以发现眼表的异常情况。一旦将染料置于在眼睛上,通常通过成像记录使用该染料观察到的染色模式。然后,成像的染色模式可用于诊断干眼症的存在和严重程度。许多染料在眼表染色中有应用,包括但不限于孟加拉玫瑰红、丽丝胺绿和荧光素(仅举几例)。
通过参考以下附图和具体实施方式,将更好地理解本公开的这些和其他方面。
附图说明
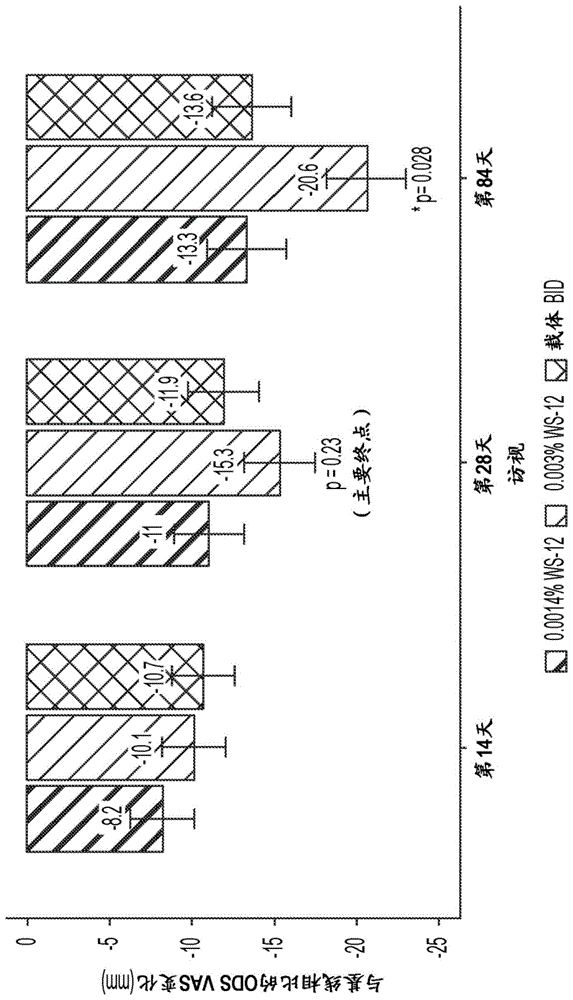
图1是显示施用治疗有效量的本公开的眼用药物组合物的受试者的眼部不适(ODS-VAS)中报告的变化的柱状图(*=p<0.05)。
图2是显示在施用本公开的眼用药物组合物的受试者中观察到的SANDE评分变化的柱状图。
图3是显示在施用本公开的眼用药物组合物的受试者中观察到的干眼症症状VAS评分眼干燥(EDS-VAS)与在这种施用之前观察到的眼干燥相比的变化的柱状图。
图4是比较在基线访视时获得的评分与获自在本文所述研究的第28天和第84天使用本文公开的0.0014%w/v或0.003%w/v WS-12眼用药物组合物治疗的受试者的评分之间所观察到的经麻醉受试者的Schirmer评分变化的柱状图。
图5是比较在基线访视时获得的评分与获自在本文所述研究的第1天和第14天使用本文公开的0.0014%w/v或0.003%w/v WS-12眼用药物组合物治疗的受试者的评分之间所观察到的未麻醉受试者的Schirmer评分变化的柱状图。
图6是追踪施用本公开的0.0014%w/v WS-12和0.003%w/vWS-12眼用药物组合物的研究受试者的结膜泛红的柱状图。
图7是在研究的第14、28和84天对其进行眼表染色的受试者的柱状图。
图8显示了在包括第一储存温度和随后的第二储存温度的两步储存条件后,在包括制剂1的吹灌封容器中WS-12含量随时间的变化。示例对应于在40℃下储存1、2、3、4、7、8、9或10天,然后在25℃下储存最多约150天。对照样品在25℃下储存,未先在40℃下储存。
具体实施方式
本公开部分基于以下发现:令人惊讶且预料不到地,WS-12可充分溶解于本公开的眼用药物组合物中,使得在递送给受试者后,WS-12易于生物利用。此外,本公开的眼用药物组合物不需要防腐剂,例如苯扎氯铵。本公开的眼用药物组合物可以水溶液形式提供。
因此,本公开提供了眼用药物组合物,其包含约0.0005%w/v至约0.01%w/v(1R,2S,5R)-2-异丙基-N-(4-甲氧基苯基)-5-甲基环己烷-1-甲酰胺(WS-12)或其药学上可接受的盐,约0.1%w/v至约5%w/v的增溶剂,约0.1%w/v至约0.5%w/v的粘度调节剂,约0.3%w/v至约1%w/v的缓冲剂以及约0.1%w/v至约1.0%w/v的张度剂。
在一些实施方案中,眼用药物组合物包含:
(a)约0.0005、0.00076、0.0008、0.001、0.0014、0.0015、0.001519、0.002、0.003、0.003039、0.004、0.005、0.006、0.006078、0.007、0.008、0.009或0.009116%w/v(1R,2S,5R)-2-异丙基-N-(4-甲氧基苯基)-5-甲基环己烷-1-甲酰胺(WS-12)或其药学上可接受的盐;
(b)约0.1、0.2、0.3、0.4、0.5、1、1.5、2、2.0、2.00、3、3.0、3.00、4、4.0、4.00、5、5.0或5.00%w/v增溶剂(例如,聚乙二醇(PEG)400、蓖麻油、聚氧乙烯(20)失水山梨醇单油酸酯(TWEEN 80)、聚氧乙烯35蓖麻油(
(c)约0.1、0.14、0.2、0.3、0.4、0.45或0.5%w/v的粘度调节剂(例如,羟丙甲纤维素);
(d)约0.3、0.31、0.4、0.5、0.6、0.7、0.78、0.8、0.9、1或1.0%w/v的缓冲剂(例如,磷酸一钠);和
(e)约0.1、0.2、0.3、0.4、0.49、0.5、0.55、0.6、0.7、0.71、0.8或0.9%w/v的张度剂(例如,氯化钠)。
此外,已经发现WS-12(例如在包含WS-12的组合物中)与包含其的聚烯烃材料发生吸着。这种吸着特性(例如吸附、吸收或两者均有)对储存在这种材料中的WS-12的长期浓度稳定性造成不确定性。已发现一种用于稳定置于聚合物(例如塑料,例如聚烯烃)容器中的含WS-12的组合物的工艺,其包括将在其容器中的WS-12组合物暴露于高于约20-25℃的温度(例如约40℃)至少约1、2、3、4、5、6、7、8、9或10天,至多约两周。已经发现,当WS-12随后在20-25℃储存约7、14、90、140、150、160、180、365天或更多天时,该工艺减少WS-12浓度的变化。例如,在热处理工艺后的储存期间(例如,在或低于约20-25℃的环境温度),这种WS-12浓度变化限于不超过约6%w/v的减少。该工艺的一个优点是,本文提供的组合物可以在环境温度下储存,而无需冷藏。这种存储条件的好处是显而易见的,包括易于存储和运输,特别是在电力或制冷不可靠或不可用的住宅或地理位置。
因此,本文还提供了制备制造物品的工艺,其中该物品包含在聚合物容器中的本文提供的组合物,其中该工艺包括将物品保持在约35-45℃的第一温度(例如,约40℃)。物品随后可在处于或低于环境温度的第二温度下储存,例如在或低于约20-25℃,例如无需冷藏。因此,物品中的WS-12组合物(例如,在液体中与其聚合物容器接触的WS-12水性组合物)在第二温度下储存期间的WS-12浓度变化小于约6%w/v。在一些实施方案中,WS-12的浓度变化小于约5%w/v,小于约4%w/v,小于约3%w/v或小于约2%w/v。应理解,本文中的%w/v可对应于通过液相色谱(LC;例如,高效LC(HPLC))确定的%。在一些实施方案中,制品在第二温度下的储存包括至少约7、14、90、140、150、160、180、365天或更多天,例如至少约1、2、4、12、20、30、52周或更多周,例如至少约1、3、6、9或12个月,例如至少约半年、一年或更多。
本公开还扩展至在有此需要的受试者中治疗或减轻涉及泪液产生的眼部刺激、治疗或减轻涉及眼泪产生的疾病或病症的至少一种体征或症状的方法。
除非另有定义,本文使用的所有技术和科学术语具有本公开所属领域的普通技术人员通常理解的相同含义。尽管在本公开的实践或测试中可以使用与本文所述相似或相当的任何方法和材料。
所有数值指定(例如体积、质量等)为近似值,其根据情况通过1.0或0.1的增量以(+)或(-)变化。应当理解,尽管并非总是明确说明,所有数值指定前均有术语“约”。
本说明书和权利要求书中使用了大量术语和短语,定义如下。
“约”和“大约”可互换使用,指如此限定的数量、参数或特征加或减一个百分数(例如,5%),本领域技术人员应理解其与使用该术语的科学上下文相适应。
如本文所用,除非上下文另有明确规定,否则单数形式的“一(a)”、“一个(an)”和“该(the)”包括复数指代。
如本文所用,术语“包含(comprising)”、“包含(comprises)”和“包含(comprise)”旨在表示本文公开的组合物、制剂和方法,包括所述元素,但不排除其他元素。
如本文所用,短语“pH调节剂”指用于药物组合物中的赋形剂,由于其阳离子或阴离子性质,其有助于将药物组合物控制和维持在所需的pH。
如本文所用,短语“眼科疾病或病症”指眼睛的疾病或病症。
如本文所用,疾病或病症的“体征”是可以观察或测量的疾病的客观证据。
如本文所用,疾病或病症的“症状”是潜在健康问题的主观体验,其不能被临床医生或除了经历该症状的人之外的任何人观察到。
本文所用的术语“治疗有效量”指治疗、改善或预防目标疾病或病症,或对目标疾病或病症或与目标疾病或病症相关的体征或症状表现出可检测的治疗或预防效果所需的药剂的量。通常,治疗有效量可在细胞培养试验或动物模型(例如,非人灵长类动物、小鼠、兔、狗或猪)中初步估算。动物模型也可用于确定施用的适当的浓度范围和途径。这些信息可用于确定人体内施用的有用剂量和途径。对于本公开的眼用药物组合物,治疗有效剂量或量可使用本领域众所周知的各种技术进行初步估算。动物研究中使用的初始剂量可基于细胞培养试验中确定的有效浓度。适用于人类受试者的剂量范围可通过例如动物研究、细胞培养试验和人类临床试验获得的数据来确定。
组合物
本公开的眼用药物组合物可根据所描述的已知方法(例如日本药典第十七版,制备通用规则等)配制成各种剂型。剂型的示例包括注射剂、滴眼剂、眼膏、滴耳剂、局部液体、喷雾剂、软膏、凝胶和糖浆。从有利地利用WS-12的药理作用的观点来看,该剂型优选为用于眼疾的剂型,具体地滴眼剂或眼膏,并且特别优选为滴眼剂。因此,在一些实施方案中,本公开的眼用药物组合物可以局部施用于受试者的眼睛。
任选地,本公开的眼用药物组合物可包含一种或多种额外的活性药物成分,这取决于眼用药物组合物用于在受试者中治疗或减轻涉及泪液产生的疾病或病症的体征或症状的眼科疾病或病症。示例包括但不限于:α1受体阻断剂(包括布那唑嗪或其盐或其溶剂合物,例如盐酸布那唑嗪);α2受体激动剂(包括溴莫尼定或其盐或其溶剂合物,例如酒石酸溴莫尼定,以及安普乐定或其盐或其溶剂合物);β-阻断剂(包括卡替洛尔或其盐或其溶剂合物,例如盐酸卡替洛尔,尼普洛尔或其盐或其溶剂合物,噻吗洛尔或其盐或其溶剂合物,例如马来酸噻吗洛尔,倍他洛尔或其盐或其溶剂合物,例如盐酸倍他洛尔,左布诺尔或其盐或其溶剂合物,例如盐酸左布诺尔,贝福诺尔或其盐或其溶剂合物,阿替洛尔或其盐或其溶剂合物,以及美替普洛尔或其盐或其溶剂合物);碳酸酐酶抑制剂(包括多唑胺或其盐或其溶剂合物,例如盐酸多唑胺,布林唑胺或其盐或其溶剂合物,乙酰唑胺或其盐或其溶剂合物,二氯芬胺或其盐或其溶剂合物,以及甲唑胺或其盐或其溶剂合物);前列腺素(包括其类似物和衍生物(例如,前列腺素F2α衍生物),包括异丙基乌诺前列酮或其溶剂合物,他夫前列素或其溶剂合物,曲伏前列素或其溶剂合物,比马前列素或其溶剂合物,拉坦前列素或其溶剂合物,氯前列醇或其溶剂合物,以及氟前列醇或其溶剂合物);Rho激酶抑制剂(包括奈他地尔、利舒地尔或其盐或其溶剂合物,Y-39983,以及H-1129);拟交感神经药(包括双匹福林或其盐或其溶剂合物,例如盐酸双匹福林,以及肾上腺素或其盐或其溶剂合物,例如肾上腺素、硼酸肾上腺素或盐酸肾上腺素);拟副交感神经药(包括溴化二乙胺或其盐或其溶剂合物,毛果芸香碱或其盐或其溶剂合物,例如毛果芸香碱,盐酸毛果芸香碱或硝酸毛果芸香碱,以及卡巴胆碱或其盐或其溶剂合物);钙拮抗剂(包括洛美利嗪或其盐或其溶剂合物,例如盐酸洛美利嗪);和胆碱酯酶抑制剂(包括杜冷丁或其盐或其溶剂合物,二乙氧磷酰硫胆碱或其盐或其溶剂合物,毒扁豆碱或其盐或其溶剂合物)。这些API可在本公开的眼用药物组合物中单独或以两种或更多种的组合与WS-12混合。
如上所述,许多增溶剂在本公开的眼用药物组合物中具有应用。如本文所用,对于药物组合物,术语“增溶剂”指增加活性药物成分(API)在水中的溶解度的赋形剂。WS-12是本公开的眼用药物组合物中的API,不溶于水。因此,为了增加其在水中的溶解性,从而确保其在递送后的生物利用度在治疗上有效,可向本公开的眼用药物组合物中加入增溶剂。在本公开的眼用药物组合物中具有应用的增溶剂的示例包括聚乙二醇(PEG)400、蓖麻油、聚氧乙烯(20)失水山梨醇单油酸酯(TWEEN 80)、聚氧乙烯35蓖麻油(
胶团(micelle)或胶团(micella)(复数形式分别为micelles或micellae)是分散在液体中的表面活性剂分子的聚集体,形成胶态悬液。水中的典型胶团形成一个聚集体,其亲水性“头部”区域与周围的溶剂接触,从而隔离胶团中心的疏水性单尾区域。不受理论的约束,这一阶段被认为是由单尾脂质在双层中的包封性能引起的。难以充满双层(例如,在脂质体中)内部的所有体积,同时容纳因脂质头基的水化作用而施加在分子上的每个头基的面积,导致了胶团的形成。这种类型的胶团称为正相胶团(水包油胶团)。反胶团的头基位于中心,尾部向外延伸(油包水胶团)。胶团的形状大约为球形。其他相也是可能的,包括椭圆、圆柱和双层等形状。胶团的形状和大小取决于其表面活性剂分子的分子几何形状和溶液条件,例如表面活性剂浓度、温度、pH和离子强度。形成胶团的过程称为胶团化,并且根据许多脂质的多形性形成其相性能的一部分。当表面活性剂高于其临界胶团浓度(CMC)时,它们可以作为乳化剂,使通常(在所用溶剂中)不溶的化合物溶解。发生这种情况是因为不溶的物质可以结合到胶团核中,胶团核本身由于头基与溶剂物质的良好相互作用而溶解在本体溶剂中。
因此,在一些实施方案中,增溶剂在37℃具有约小于0.1%w/w的CMC。在一些实施方案中,增溶剂聚氧乙烯35蓖麻油在37℃具有约0.02%w/w的CMC。在一些实施方案中,在加热纯增溶剂后,聚氧乙烯35蓖麻油的最后固体成分在约26℃下熔化,产生澄清的油状液体。在一些实施方案中,增溶剂以处于或高于其CMC值存在。在一些实施方案中,本文的组合物包括被包裹在增溶剂胶团内的WS-12的至少一部分。在一些实施方案中,存在于组合物中的WS-12的超过50%,例如至少60%,至少70%,至少80%,至少90%,至少95%,至少98%,至少99%,或更多,或基本上全部被包裹在增溶剂胶团内。在一些实施方案中,胶团具有约2至约20nm的平均直径。在一些实施方案中,胶团具有约4至约10nm的平均直径。在一些实施方案中,胶团具有约5nm±2nm的平均直径。在一些实施方案中,胶团具有约5nm±0.5nm的平均直径。因此,在一些实施方案中,WS-12被包埋在平均直径约为2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20±0.5nm的胶团中。在一些实施方案中,胶团是单层的。在一些实施方案中,胶团是球形的,例如当表面活性剂的浓度处于或高于其CMC时。在一些实施方案中,当表面活性剂处于高于表面活性剂的CMC的更高浓度时,表面活性剂形成柱形胶团或其他聚集相(例如六角相、立方相或层状相)。在一些实施方案中,表面活性剂形成多层脂质体。在一些实施方案中,本文提供的组合物中的WS-12具有高达约200μM的浓度。
此外,许多粘度调节剂易于在本公开的眼用药物组合物中应用。如本文所用,对于药物组合物,短语“粘度调节剂”指旨在改变药物组合物的稠度或结构的赋形剂。它们包括用于将液体转化为凝胶、糊剂或粉末的增稠剂、胶凝剂和硬化剂,以帮助配方师为最终用户创造理想的产品。它们还可以改变液体的稠度。在本公开的眼用药物组合物中具有应用的粘度调节剂包括纤维素衍生物(例如甲基纤维素、微晶纤维素、羧甲基纤维素、乙基纤维素、羟乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素或其任何组合);粘土(例如锂蒙脱石、膨润土、铝和/或硅酸镁、高岭土或其任何组合);天然胶(例如阿拉伯胶、瓜尔胶、黄蓍胶、黄原胶、藻酸盐、卡拉胶、刺槐豆胶或其任何组合);合成聚合物;胶态二氧化硅;或其任何组合。在本公开的眼用药物组合物的特定实施方案中,粘度调节剂为羟丙基甲基纤维素。
如本文所述,本公开的眼用药物组合物包含张度剂。术语“张度”指有效渗透压梯度的测量;被半渗透细胞膜分开的两种溶液的水势。它取决于选择性渗透膜的溶质在细胞膜上的相对浓度,其决定了渗透通量的方向和程度。因此,为了防止对本公开的眼用药物组合物的目标细胞的渗透休克,包含了张度剂,例如葡萄糖、甘油、甘露醇、氯化钾、氯化钠或其任何组合。在特定的示例中,张度剂为氯化钠。
本公开的眼用药物组合物的pH范围为约5.0至约8.5,更具体地为约6.7至约7.3。在特定实施方案中,本公开的眼用药物组合物具有约7的pH。pH调节剂易于应用在本公开的眼用药物组合物中,以为组合物提供所需的pH。在本文中应用的pH调节剂的示例包括但当然不限于,包括苏打灰、氢氧化钠、硅酸钠、磷酸钠、石灰、硫酸和氢氟酸,仅举几例。在本公开的特定眼用药物组合物中,所用的pH调节剂为1N氢氧化钠,所需的pH为约7。
本公开的眼用药物组合物进一步包含缓冲剂,例如磷酸盐缓冲剂、柠檬酸盐缓冲剂、TRIS碱、TRIS HCl、PBS、HEPES、MES、PIPES或TES,仅举几例。磷酸盐缓冲剂是在本文公开的眼用药物组合物中具有应用的特定缓冲剂。
本公开的眼用药物组合物的具体示例列于下表1。
表1.WS-12眼用药物组合物的成分
/>
/>
1
方法
如上所述,本公开扩展至用于在需要该方法的受试者中治疗、减轻、改善眼科疾病或病症、该疾病或病症的体征或症状或其组合、降低其可能性或预防其的各种方法。在特定实施方案中,疾病或病症涉及泪液产生,例如干眼症(干眼病)、干燥性角结膜炎或干燥综合征。因此,本公开扩展至用于在受试者中治疗或降低干眼症可能性的方法,其包括施用治疗有效量的本公开的眼用药物组合物。
可使用本公开的眼用药物组合物或方法治疗、改善或预防的适用眼科疾病或病症是不受限的。可用本公开的眼用药物组合物或方法预防或治疗的特定疾病或病症包括但当然不限于干眼症或干燥综合征。术语“干眼症”是根据由TFOSDEWS II提供的干眼症的最近审查的定义理解的。干眼病(DED)又称“干眼综合征”或“干燥性角结膜炎”,是一种多因素的眼表疾病,其特征在于泪膜的动态平衡丧失,并伴有眼部症状,其中泪膜不稳定和高渗、眼表炎症和损伤以及神经感觉异常在其中起着病因学作用(Craig等人,The Ocular Surface2017,15,276-283)。当眼睛没有产生足够的泪液或泪液蒸发得太快时,就会出现干眼症。多种原因可导致干眼症,这在老年人中更为常见。干眼症的原因包括但不限于:MGD和其他眼部炎性过程、维生素A缺乏症、干燥综合征、类风湿性关节炎和其他风湿疾病和病症、化学或热烧伤、药物如阿替洛尔、扑尔敏、利尿剂、氢氯噻嗪、异维甲酸、酮咯酸、酮替芬、左卡巴斯汀、左氧氟沙星、奥昔布宁和托特罗定。干燥综合征是一种以口干和/或干眼症为特征的免疫疾病。
任选地,本公开的眼用药物组合物可储存在阻挡光(尤其是波长范围为约1nm至约340m的光,例如紫外光)透射的包装中。这种包装可包括作为一级包装,例如对于可见光不透光或透光的容器。任选地,本公开的眼用药物组合物的包装,特别是一级或二级包装中的至少一种,可包含至少一种阻挡紫外光透射的物质。在已公布的PCT申请WO/2021/195256中公开了这种包装以及在这种包装中具有应用的UV光阻挡物质的示例,该申请通过引用整体并入本文。在一些实施方案中,本文提供的眼用药物组合物可被制备并置于容器中,以在环境温度或高温下储存。与聚氯乙烯塑料容器相比,当储存在聚烯烃塑料容器中时,可以减少组合物可能发生的任何褪色。不希望受限于理论,在本文中应用的容器可减少容器内容物暴露于电磁辐射,无论是可见光(例如,具有约380-780nm的波长)还是紫外(UV)光(例如,具有约190-320nm(UV B光)或约320-380nm(UV A光))。一些容器还包括减少容器内容物暴露于红外光的能力,或具有该能力的第二成分。可使用的容器包括由聚烯烃制成的容器,例如聚乙烯、聚丙烯、聚对苯二甲酸乙二酯、聚碳酸酯、聚甲基戊烯、聚丁烯或其组合,尤其是聚乙烯、聚丙烯或其组合。在一些实施方案中,容器是玻璃容器。容器可进一步设置在第二容器内,例如纸、硬纸板、纸板、金属膜或箔或其组合,以进一步减少容器内容物暴露于UV、可见或红外光。受益于储存过程中褪色、分解或两者的减少的化合物和组合物包括本文提供的眼用药物组合物。本文提供的眼用药物组合物可能需要储存长达或超过三个月;在某些情况下长达或超过一年。容器可以是任何适合容纳内容物的形式;例如,袋子、瓶子或盒子。
如本文所述,本公开的水性眼用组合物或方法尤其包含WS-12,其调节瞬时受体电位阳离子通道亚家族M成员8或TRPM8受体,尤其是其激动剂。TRPM8受体是一种由人类TRPM8基因编码的蛋白质(Clapham D E,等人2005.Pharmacological Reviews 57(4):427-50)。TRPM8是激活后允许钠离子(Na
人TRPM8基因位于2号染色体2p37.1区;并编码由核苷酸序列NM-024080.4编码的1104个氨基酸的蛋白质(NP-076985.4)。TRPM8基因有六个跨膜片段,C端和N端位于胞质侧。四个亚基四聚化以形成活性通道。
TRPM8受体参与控制泪液产生,并且其使用其激动剂的激活导致泪液产生增加。具体而言,支配哺乳动物角膜的冷温度感受器在正常的角膜温度下保持紧张触发活动,并且对眼表的轻微热变化(例如在眨眼之间和暴露于干燥环境期间发生的角膜前泪膜的蒸发所造成的那些变化)非常敏感。这种明显的冷敏感性是由于TRPM8通道的高表达导致的,其严格决定了对冷作出反应时的自发基础活动和触发频率的提高。此外,通过基因技术去除TRPM8通道使小鼠的泪液分泌减半。角膜加热引起的部分沉默也会减少人的泪液分泌。
有鉴于此,TRPM8是检测支配陆生动物暴露眼表的冷热感受器神经纤维中水分的分子靶标。
在一些实施方案中,本文提供了治疗眼科疾病或病症(该疾病或病症涉及泪液产生)和/或减轻其症状的方法,其包括向有此需要的受试者施用治疗有效量的组合物,其包含与TRPM8(瞬时受体电位阳离子通道亚家族M成员8)受体特异性结合的分子,
其中该分子与TRPM8受体的结合调节了TRPM8通道的活性;
其中该分子与TRPM8受体的结合增加或减少了由眼科疾病或病症引起的泪液分泌;
其中结合和调节组织中的TRPM8受体所需的分子浓度不足以对有此需要的受试者产生细胞毒性;并且
其中该分子为WS-12或其盐。
词语“处理(treating)”或“治疗(treatment)”指治疗性和预防性治疗或预防措施,其目的是预防或停止(减轻)不必要的生理变化或病症,例如眼睛、阴道或口腔干燥。为本公开之目的,有益或预期的临床结果包括但不限于症状减轻、疾病程度减轻、稳定的病理状态(特别是未恶化)、疾病进展延缓或停止、改善或减轻的病理状态和缓解(部分和全部),包括可检测的和不可检测的。需要治疗的受试者包括已患有疾病或病症的受试者、易患疾病或病症的受试者或应预防疾病或病症的受试者。
“治疗方法”定义为对需要该治疗的受试者施用包含TRPM8激动剂(例如WS-12)的药物组合物。
在本公开中,“TRPM8受体激动剂”被定义为与TRPM8受体特异性结合的任何分子,并且在结合后可导致TRPM8通道活性的提高,即增加通过该通道的导致细胞去极化的钠和钙流量。这些激动剂增加冷敏感纤维的泪液分泌刺激。有许多研究可用于检测TRPM8受体激动剂的活性,例如本公开实施例中提及的全细胞、膜片钳电生理测试(参见实施例1)、钙显微学方法(Bodding等人,2007,Cell Calcium,42,618-628)和基于荧光成像读板器分析的方法(Behrendt等人,2004.J.Pharmacol.141,737-745),等等。如上所述,WS-12是TRPM8受体激动剂,并(通过TRPM8受体)产生冷感,这可减轻不适和疼痛。
在一些实施方案中,本公开的眼用药物组合物包括表2中列出的那些。
表2
通过参考以下非限制性实施例,可以更好地理解本公开,这些实施例作为本公开的示例提供。给出以下实施例是为了更充分地说明本公开的优选实施方案。然而,它们不应以任何方式被解释为限制本公开的广泛范围。
实施例
本公开的制剂的制备
在一些实施方案中,本公开的眼用药物组合物包含(在其他成分中的)WS-12和增溶剂,尤其是聚氧乙烯35蓖麻油(KOLLIPHOR EL)。聚氧乙烯35蓖麻油是由蓖麻油和氧化乙烯反应形成的聚乙氧基化形式的蓖麻油。它是一种可与水混溶的非离子表面活性剂。在一些实施方案中,本公开的眼用药物组合物进一步包含羟丙甲纤维素(METHOCEL F4M),其增加了组合物的粘度。此外,本公开的眼用药物组合物被缓冲至具有所需的pH。在一些实施方案中,所需的pH为约7,并且所使用的缓冲剂为磷酸盐缓冲剂。为了使本公开的眼用药物组合物等渗,也可以加入氯化钠。
如上所述,WS-12不溶于水。无论如何,有必要鉴定可为WS-12在水性介质中提供约为200μM(0.0058%)溶解度的赋形剂,该水性介质与对人(例如,人眼)的施用(例如,局部施用)相容。对几种增溶剂进行了评估,包括PEG 400(聚乙二醇400)、KOLLIDON 30(聚乙烯吡咯烷酮)、丙二醇、TWEEN 80(聚氧乙烯(20)失水山梨醇单油酸酯)、
表3.WS-12在本公开的眼用药物组合物中的溶解度。
对于眼睛局部施用的局部眼用途径而言,pH和渗透浓度是眼用药物组合物的关键性质。为了生理上的舒适,选择接近人泪液pH的约7的pH。使用磷酸盐缓冲剂维持pH 7。为了施用过程中的舒适性,加入NaCl使给定的制剂等渗,其渗透浓度与人泪液相似(约300mOsm/kg)。
如本文所述,本公开的眼用药物组合物进一步包含粘度调节剂。在一些实施方案中,本文提供的眼用药物组合物比水更黏稠,粘度大于1.0cP。因此,本公开的眼用药物组合物可具有约2cP、约3cP或约4cP或甚至更高的粘度。在一些实施方案中,本公开的眼用药物组合物的粘度小于约5cP或小于约4cP,例如约3cP。
本公开的眼用药物组合物的物理化学和生物学性质
溶解度:用于下述研究的WS-12浓度(0.0014%和0.003%w/v)低于WS-12的饱和极限。因此,沉淀不是问题。
颗粒物:作为药品规格的一部分,对颗粒物进行控制,且控制措施与药典方法一致。
渗透浓度:本公开的眼用药物组合物的渗透浓度范围为约270至约340mOsm/kg。在特定的实施方案中,渗透浓度为约300mOsm/kg。氯化钠用作渗透调节剂。
研究
研究背景:本文公开的研究检测了包含TRPM8激动剂WS-12的本公开的眼用药物组合物治疗、改善或预防干眼症,以及与之相关的体征或症状的功效。
TRPM8(瞬时受体电位M型)受体是冷敏感温度感受器,在泪膜动态平衡中发挥重要作用(Eguchi等人,Biomed.Res.Int.2017;Craig等人,The Ocular Surface 2017,15,276-283)。这些受体位于眼睑和角膜上,检测与眼表泪液蒸发相关的角膜温度下降。
进行了一项大型(n=369)多中心、载体对照、双盲、随机的2b期研究,以评估本公开的两种眼用药物组合物的安全性和有效性,其中一种组合物具有浓度为0.0014%w/v的WS-12,另一种组合物具有浓度为0.003%w/v的WS-12。
将受试者纳入研究的标准:
a.男性或女性,筛查访视时年龄在30岁或以上
b.在过去6个月内有干眼症史
c.在筛查访视前2个月内使用和/或希望使用人工泪液治疗干眼症。
d.在筛查和基线访视时,基于眼部不适评分(ODS)-VAS和Global SANDE问卷的干眼症症状
e.在筛查和基线访视时,Schirmer测试评分均≥2且<10mm/5min。
f.基于经修改的NEI分级方案(0-20),角膜荧光素染色总评分≥2且≤15,在筛查访视时无一区域评分>3。
g.在筛查和基线访视时,双眼的BCVA均为20/200(0.70logMar)或更好。
h.良好的一般健康状况和眼部健康状况,由研究人员在筛查访视时使用病史、眼科检查、血液化学和血液学、尿液分析和生命体征确定。
i.能够作出经签署的知情同意,包括遵守知情同意书(ICF)和本方案中列出的要求和限制。
j.经研究人员评估,能够并愿意遵守研究指示,并可能完成所有必要的研究访视。
因此,在本文提供的方法的一些实施方案中,受试者具有一个或多个上述确定的纳入标准。
将受试者排除在研究范围之外的标准:研究人员认为,任何一只眼睛的任何眼科疾病或病症(DED除外)的历史或存在可能会干扰研究结果的解释或受试者的安全性。
a.筛查访视前一(1)年内的眼部手术史。
b.筛查访视前1年内任一眼睑有泪小点或泪小管塞,或在研究期间任何时间预期进行栓塞植入或封闭。
c.在筛查访视前七(7)天内使用或在研究期间计划使用隐形眼镜。
d.在筛查访视前14天内定期使用或在研究期间计划使用眼睑清洁。
e.在筛查访视前三十(30)天内使用或在研究期间预期使用除了人工泪液之外的任何局部眼用药物治疗DED,眼用皮质类固醇或NSAID、抗青光眼药物、眼睛美白、局部抗生素、局部抗组胺药、肥大细胞稳定剂或其他OTC或营养补充剂。
f.在基线访视前<90天或研究期间剂量发生变化时开始使用全身性皮质类固醇。允许非眼部局部使用皮质类固醇(包括鼻吸入器)。
g.已知对研究干预或研究诊断试剂过敏或敏感。
h.筛查或基线访视时妊娠试验阳性,当前正在母乳喂养或在研究期间计划怀孕。有生育潜力的妇女未使用医学上可接受的计划生育方式。
i.研究人员认为,受试者有条件或身处于可能使受试者面临重大风险或可能混淆研究结果的情况。
因此,在本文提供的方法的一些实施方案中,受试者不具有一个或多个上述排除标准。
受试者处置:共选择369名受试者进行随机分组。大多数受试者(>积极治疗组的94%)在第84天完成了研究。
表4.基于施用的制剂和研究中止的受试者分类。
导致中止的不良事件包括:
(a)使用部位灼伤(施用WS-12 0.0014%w/v制剂的2例和施用WS-12 0.003%w/v制剂的1例;
(b)使用部位刺痛(施用WS-12 0.003%w/v制剂的1例);
(c)眼睑水肿(施用WS-12 0.0014%w/v制剂的1例);
(d)上皮缺损(载体中的1例);和
(e)呼吸衰竭(载体中的1例)。
表5.研究受试者的基线人口统计
研究描述:所进行的有关于本公开的眼用药物组合物的研究是一项多中心、载体对照、双盲、随机研究。加入研究的所有受试者均患有干眼病。本研究包括筛查和基线访视,以确定资格,随后在第14天(第3次访视)、第28天(第4次访视)和第84天(第5次访视/退出研究)进行疗效评估。所有研究访视均对安全性进行了评估。所有受试者均在筛查、基线、第28天和第84天的访视中暴露于受控不利环境(CAE)终点。只有符合纳入/排除标准的受试者在每个试验点内以1:1:1的比例被纳入研究并随机分组,以接受安慰剂(例如,不含WS-12的制剂1)、WS-12 0.0014%或WS-12 0.003%,每日施用两次,每次每只眼睛一滴,共84天。本研究的目的是与在患有干眼症的受试者中每日施用两次的载体相比,评价本公开的局部眼用药物组合物的施用的安全性、耐受性和有效性。研究的时间表见下表6。
表6
本公开的眼用药物组合物对干眼病症状的影响:下表7列出了根据上述研究的描述向受试者施用眼用药物组合物对与干眼病相关的下列症状的影响:
(a)眼部不适评分(ODS-VAS);
(b)SANDE评分;
(c)眼干燥(EDS-VAS)。
表7
研究结果表明,通过施用治疗有效量的本公开的眼用药物组合物,干眼病的症状得到改善。
图1清楚地表明,在治疗的第84天,对于本公开的0.003%w/vWS-12眼用药物组合物,受试者报告了与其各自基线访视时相比的-20.6的眼部不适的变化,以及与同期报告的载体BID相比报告了-13.36的降低。应当注意,分数的降低代表改善,例如症状的减轻。
图2清楚地表明,施用本公开的0.003%w/v或0.0014%w/vWS-12眼用药物组合物84天的受试者的Global SANDE评分与基线访视时从受试者处获得的评分(其在向受试者施用本公开的眼用药物组合物之前自然产生)相比,分别降低了17.2和12.9。
图3是显示在施用本公开的眼用药物组合物的受试者中观察到的眼干燥症状VAS评分(EDS-VAS)与施用这种药物组合物前观察到的眼干燥相比的变化的柱状图。图3清楚地表明,在施用本公开的0.003%w/v WS-12眼用药物组合物后报告的受试者眼干燥与在其各自基线访视中报告的受试者眼干燥相比降低了17.1,其中仅接受载体的受试者在同一时间段内报告的眼干燥仅降低了10.8。
本公开的眼用药物组合物对干眼病症状的影响:如上所述,在本公开的研究中评估的干眼病症状为:
(a)Schirmer评分(未麻醉);
(b)结膜泛红;和
(c)总眼表染色。
表8
未麻醉Schirmer评分:图4的数据清楚地表明,使用本文公开的0.0014%w/v或0.003%w/v WS-12眼用药物组合物进行治疗导致Schirmer评分增加,相对于仅施用载体的受试者的评分,这意味着受试者的泪液产生增加。图5进一步证实了这一观察结果。图5显示,与仅施用载体的受试者相比,施用眼用药物组合物的受试者的统计显著数量达到Schirmer评分提高≥10mm的终点。
结膜泛红:众所周知,干眼症患者可能会出现结膜泛红。根据以下等级(可使用半(0.5)单位增量)对结膜泛红进行分级:无0=正常,无血管舒张;微量1=微量的睫状体或结膜血管舒张;轻度2=广泛的睫状体血管舒张;中度3=广泛的睫状体和轻微的水平结膜血管舒张;重度4=广泛的睫状体。在基线访视和研究的第14、28和84天进行测量。图6清楚地显示,与仅施用载体的受试者相比,接受本公开的0.003%w/v WS-12眼用药物组合物的受试者表现出结膜泛红的下降。
眼表染色:眼表染色是观察眼表损伤的一种方法。图7中显示的数据清楚地表明,向受试者施用本公开的眼用药物组合物导致了眼表损伤的减少,而在仅施用载体的研究受试者中,眼表损伤的实际恶化几乎没有表现出改善。
本公开的眼用药物组合物的总体安全性:总体而言,本公开的眼用药物组合物被良好耐受。没有严重的治疗中出现的不良事件(TEAE)被认为与本公开的眼用药物组合物相关。此外,几乎没有TEAE导致研究中止,且大多数TEAE本质上是眼部的。表9是关于总体安全性的总结。
表9
眼部治疗中出现的不良事件:如上所述,大多数TEAE本质上是眼部的。表10列出了观察到的眼部TEAE类型及其各自的频率。
表10
/>
非眼部治疗中出现的不良效应:如上所述,大多数TEAE是眼部相关的。但有些与眼部无关。表11列出了与眼部无关的TEAE及其各自的发生频率。所有组中非眼部治疗中出现的不良事件的比例相似,但无显著发现。此外,没有任何系统性不良事件被认为与本公开的眼用药物组合物有可能相关或相关。
表11
总结:在本研究中,369名干眼症受试者被随机分为以下3种治疗方法之一:
(a)本公开的0.0014%w/v WS-12眼用药物组合物(制剂2);
(b)本公开的0.003%w/v WS-12眼用药物组合物(制剂1);和
(c)载体(无WS-12的制剂1或制剂2)。
所获得的数据表明,使用本公开的眼用药物组合物,特别是使用本公开的0.003%w/v WS-12眼用药物组合物,在多个预先指定的症状和体征终点均显示出统计上显著的疗效。对其具有统计上显著的疗效的干眼疾病或病症的症状:
(a)眼部不适;
(b)SANDE;和
(c)眼干燥。
被证明对其具有统计上显著的疗效的干眼疾病或病症的体征:
(a)泪液产生;
(b)结膜泛红;和
(c)眼表染色。
进一步观察到,在研究开始后14天内观察到本公开的眼用药物组合物的疗效,并且在研究的3个月期间,干眼症的症状和体征被证明持续改善。早在第一次给药后(第1天)就证明了体征疗效。在第14天证明了症状和体征疗效。
此外,从研究中获得的数据表明,本公开的眼用药物组合物是安全的、被良好耐受的,并且所有眼部不良事件的大多数(大约95%)被评定为轻度,并且由于不良事件,施用本公开的0.003%w/v WS-12眼用药物组合物的受试者中不到2%的受试者中止参与研究。此外,本公开的眼用药物组合物未导致系统性或严重不良事件。
本公开的眼用药物组合物的储存
本公开的眼用药物组合物可储存在由聚合物(包括一种或多种聚烯烃)制成的单位剂量或多剂量容器中。在一些实施方案中,多剂量容器包括具有用于多剂量无防腐剂(MDPF)应用的设计的容器。WS-12是一种化学稳定的分子,通常不容易被典型的药物应激源(例如酸、碱、过氧化物、热、光)降解。在本公开的眼用组合物中,WS-12是物理不稳定的,因为它与容纳它的聚烯烃容器相互作用。吸着过程降低了滴眼剂中WS-12的有效浓度。
人们发现当药物组合物在升高的温(例如40℃)下与聚烯烃接触储存时,聚烯烃的结晶度与吸收到聚烯烃中的WS-12的量之间存在反向关系。通过用DSC测定聚烯烃的熔融温度来测量结晶度,较高的熔融温度表示较高的结晶度。表12显示,高熔点聚烯烃(如HDPE和PP)产生WS-12的最低百分比损失,而低熔点聚烯烃(如LDPE5)显示了WS-12的最大损失。
表12.与储存在聚烯烃容器中的WS-12浓度的百分比损失相关的各种聚烯烃的熔融温度。
表12中的LDPE 1、LDPE 2、LDPE 3、LDPE 4和LDPE 5对应于来自不同供应商的LDPE。通过差示扫描量热法(DSC)实验确定了聚烯烃的熔点值。聚烯烃的密度由制造商的产品数据表提供。
用于眼用组合物的单位剂量容器可使用吹灌封(BFS)技术生产。该技术涉及容器成型、产品填充和密封的连续操作。单位剂量容器很小,通常具有灵活性,使患者能够轻松挤出滴眼剂。低密度聚乙烯(LDPE)是一种在BFS中常用的聚烯烃,因为由它制成的容器通常是手动易弯的。发现LDPE对WS-12的吸着依赖于温度,较高的温度会导致WS-12通过吸附、吸收或两者兼有的方式从溶液中损失更多。因此,装有眼用组合物的LDPE BFS容器必须在5℃下储存,以尽量减少WS-12从溶液中流失到容器中。
本文所述的“固化”技术或工艺利用了WS-12吸收到LDPE中的温度依赖性,以产生在25℃下储存时稳定的产品。在一些实施方案中,固化技术包括以下步骤:(a)生产填充有本文提供的眼用药物组合物的BFS容器;(b)在第一温度(例如40℃)下存储已填充的BFS容器,驱动WS-12进入LDPE容器,目的是用WS-12使容器壁饱和;以及(c)随后将BFS容器储存在第二温度(例如25℃)下,从而阻止WS-12由于上述饱和过程进一步损失至容器壁。
图8显示了在40℃下生产并固化1、2、3、4、7、8、9和10天,随后在25℃下长期储存的BFS单元中WS-12含量的趋势。将固化单元中WS-12的损失与未经历固化的单元进行比较,即它们仅存储在25℃(99A长期25℃追踪)。每一行的第一个数据点代表固化期(例如,存储的第一温度)后BFS制品中WS-12的含量。随着40℃固化时间从1天增加到10天,损失至LDPE的WS-12的量增加。与未固化单元相比,固化单元在25℃下的后续储存导致WS-12向LDPE的损失(例如,吸着)速率较慢。在40℃下固化10天后(黑色圆圈),在25℃下储存的BFS单元中WS-12的含量在140天内保持不变。
不受理论限制,上述固化技术可以用WS-12使BFS容器壁饱和,使得在25℃长期储存期间不会发生进一步损失。在固化期间损失至容器壁的WS-12的量可以通过向眼用组合物中添加过量的WS-12来补偿,使得固化期后WS-12的浓度为标签上声称浓度的100%。该策略提高了WS-12物理稳定的药物组合物在可挤压的LDPE BFS容器中的可行性,该容器可在室温下储存。该策略可适用于任何类型的LDPE,无论LDPE的来源如何。
在冷藏条件下(例如,在或低于约4℃)储存可能会降低聚烯烃容器的吸着性能,但对于需要使用本文提供的组合物的个人,这种储存条件并非在其居住的所有情况下均可行。因此,本文提供的组合物和工艺满足了对这种有用组合物的货架保质储存的需求。
本公开的范围不限于在此描述的具体实施例。事实上,根据前述描述和附图,除本文所述之外,对本公开的各种修改对于本领域技术人员是显而易见的。这种修改旨在落入所附权利要求的范围内。
- 一种用于治疗抑郁症的中药组合物及其药物组合和用途
- 一种药物组合物及其提取方法、药物制剂、用途
- 分离的重组溶瘤痘病毒、药物组合物及其在治疗肿瘤和/或癌症的药物中的用途
- 一种苯酚衍生物和依托咪酯的药物组合物、药物制剂及其用途
- 一种含蜂胶提取物的治疗老年痴呆的药物组合物及其制备方法和用途
- 眼用药物组合物、眼用药盒及其医药用途
- 虎眼万年青提取物及其制备方法、药物组合物以及用途
