一种紫杉醇口服剂型及其制备方法与应用
文献发布时间:2023-06-19 09:24:30
技术领域
本公开属于制药领域,具体提供一种紫杉醇口服剂型及其制备方法与应用。
背景技术
这里的陈述仅提供与本公开有关的背景信息,而不必然构成现有技术。
紫杉醇(Paclitaxel PTX)别名红豆杉醇,最初是从短叶红豆杉(Taxusbrevifolia)的树皮中分离而得,是1992年由美国食品药品管理局(FDA)批准进入市场的一种新型抗微管药。紫杉醇是一种广谱抗癌药物,在临床上已经广泛用于卵巢癌、乳腺癌、头颈癌和肺癌的治疗,其主要作用机制为促进细胞微管聚合,抑制微管解聚,导致细胞纺锤体失去正常功能,使细胞周期停滞于G2/M期,有丝分裂停止。由于紫杉醇难溶于水,现行的制剂配方中是以无水乙醇和聚氧乙烯蓖麻油(1:1)作为助溶载体,会导致病人出现严重的过敏反应和肾毒性等不良反应,从而限制了该剂型的临床应用。
为提高紫杉醇在水中的溶解度,减少毒副作用的发生,并提高紫杉醇的抗肿瘤活性,国内外学者对紫杉醇的不同载药体系、制剂剂型及临床用药方式等进行了广泛的研究。国内已上市的紫杉醇的创新剂型有脂质体紫杉醇、白蛋白紫杉醇等,显著降低了传统剂型的副作用,为癌症患者带来更多选择。白蛋白紫杉醇于2005年经美国FDA批准上市,可以在不增加毒副作用的基础上增加紫杉醇疗效,但白蛋白紫杉醇整体价格比传统剂型要高,且在摄入量增高时存在神经毒性等不良反应以及有感染血液传播疾病的风险而限制其的临床应用。脂质体紫杉醇于2010年批准应用于我国临床肿瘤治疗,可以提高紫杉醇的作用效果,但发明人发现,脂质体紫杉醇存在包封率低、紫杉醇易泄露、诱导机体产生补体反应等问题,限制了其在临床上的应用。而上述紫杉醇给药体系口服给药,均难达到理想的抗肿瘤效果。
南极磷虾(Antarctic krill)是一种生活在南极洲水域的磷虾,以微小的浮游植物作为食物,是地球上目前资源量最大的单种生物之一,具有巨大的开发和利用潜力。南极磷虾油是由南极海域野生南极磷虾提炼而成,含有大量的磷脂、ω-3(EPA、DHA)多不饱和脂肪酸、虾青素,还含有维生素A、D、E,动物类黄酮素、甲壳素及微量元素等活性物质,安全无毒副作用。
发明内容
针对现有技术中脂质体紫杉醇存在包封率低、紫杉醇易泄露、诱导机体产生补体反应等问题,限制了其在临床上的应用,且紫杉醇给药体系口服给药,难达到理想的抗肿瘤效果的问题。
本公开一个或一些实施方式中,提供一种紫杉醇口服剂型,包括紫杉醇与南极磷虾油。
本公开一个或一些实施方式中,提供一种紫杉醇口服剂型的制备方法,包括如下步骤:所述紫杉醇的乙醇溶液为8-11mg/mL,优选为10mg/mL;进一步优选的,紫杉醇的质量为100mg,无水乙醇的体积为10mL,紫杉醇的乙醇溶液浓度为10mg/mL。
本公开一个或一些实施方式中,提供上述紫杉醇口服剂型或上述紫杉醇口服剂型的制备方法制得的产品在制备治疗肿瘤药物中的应用。
本公开一个或一些实施方式中,提供上述紫杉醇口服剂型或上述紫杉醇口服剂型的制备方法制得的产品在制备治疗卵巢癌药物中的应用。
本公开一个或一些实施方式中,提供上述紫杉醇口服剂型或上述紫杉醇口服剂型的制备方法制得的产品在制备治疗卵巢癌肿瘤药物中的应用。
上述技术方案中的一个或一些技术方案具有如下优点或有益效果:
1)本公开将紫杉醇直接与南极磷虾原油混合制备,制备方法简单,且从实验结果来看,本申请紫杉醇与南极磷虾原油混合的效果较好,一方面体现在紫杉醇可以很好的在南极磷虾原油中溶解,两体系混合性能较好,另一方面体现在南极磷虾油可以最大程度的发挥紫杉醇的药效价值,尤其在抗卵巢癌肿瘤方面,有着很好的治疗效果。
2)本公开还将南极磷虾油与混合油体系进行了对比,结果发现,混合油体系中紫杉醇虽然溶解效果较好,但药效较差,可见南极磷虾油与紫杉醇之间存在配伍关系。
附图说明
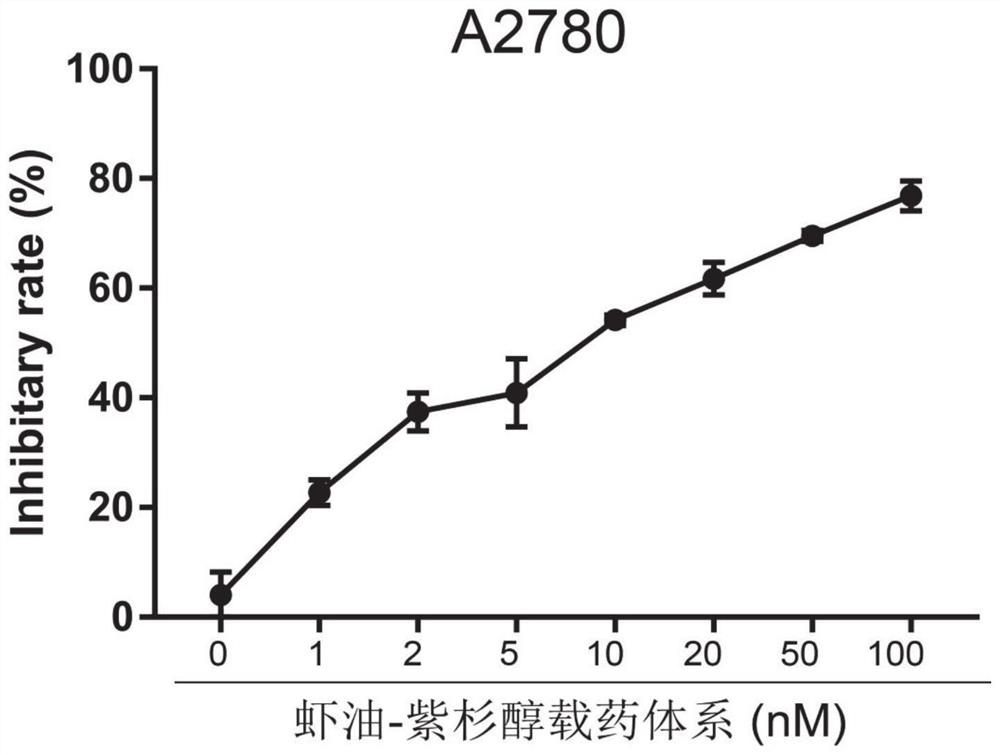
图1为实施例2中南极磷虾油-紫杉醇药物体系对A2780细胞的抑制率曲线。
图2为实施例2中南极磷虾油-紫杉醇药物体系对SKOV3细胞的抑制率曲线。
图3为实施例2中南极磷虾油-紫杉醇药物体系对A2780细胞细胞周期的作用。***P<0.001。
图4为实施例2中南极磷虾油-紫杉醇药物体系对SKOV3细胞细胞周期的作用。***P<0.001。
图5为实施例3中南极磷虾油-紫杉醇药物体系对SKOV3荷瘤小鼠肿瘤重量的影响。*P<0.05,**P<0.01。
具体实施方式
下面将对本公开实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本公开的一部分实施例,而不是全部实施例。基于本公开的实施例,本领域技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本公开保护的范围。
针对现有技术中脂质体紫杉醇存在包封率低、紫杉醇易泄露、诱导机体产生补体反应等问题,限制了其在临床上的应用,且紫杉醇给药体系口服给药,难达到理想的抗肿瘤效果的问题。
本发明目的是制备南极磷虾油和紫杉醇药物体系,旨在突破临床上紫杉醇现有剂型不良反应的限制,改变紫杉醇的剂型,使得之前仅能通过注射给药方式的紫杉醇改变为口服给药,进一步提高紫杉醇的生物利用度和抗肿瘤活性,大幅度降低其毒副作用,减少使用剂量,降低治疗费用,更有利于癌症的治疗。
本公开一个或一些实施方式中,提供一种紫杉醇口服剂型,包括紫杉醇与南极磷虾油。
优选的,所述紫杉醇分散于南极磷虾油中。具体可以将紫杉醇与南极磷虾油在液态时充分混合,二者相融,混合而成。但从理论上来说,紫杉醇与南极磷虾虾油有相互促进作用,若紫杉醇与南极磷虾虾油呈核壳状结构,只要粒径足够小,也能够制成口服剂型。
本公开一个或一些实施方式中,提供一种紫杉醇口服剂型的制备方法,包括如下步骤:将紫杉醇粉末加入无水乙醇中充分振荡溶解配置成紫杉醇的乙醇溶液;将紫杉醇的乙醇溶液加入到南极磷虾油原液中混匀,于恒温摇床上充分振荡,待乙醇完全挥发,即得。
乙醇的添加有利于紫杉醇与南极磷虾虾油充分混合,紫杉醇与南极磷虾由于是两种不同成分,混合后存在相界面,加入乙醇后,乙醇在混合挥发过程中,使紫杉醇与南极磷虾油界面相融,二者充分混合。值得注意的是,由于乙醇蒸发速率会影响紫杉醇与南极磷虾油的相界面,因此应当恒温蒸发,避免乙醇速率的变化造成相界面不均衡。
所述南极磷虾虾油市售或自行提取均可。
优选的,所述紫杉醇的乙醇溶液为8-11mg/mL,优选为10mg/mL;进一步优选的,紫杉醇的质量为100mg,无水乙醇的体积为10mL,紫杉醇的乙醇溶液浓度为10mg/mL。
无水乙醇的浓度与添加量应当适量,原因在于,若无水乙醇添加量过大,则紫杉醇与南极磷虾油界面相融度过大,紫杉醇药效变差,若无水乙醇添加量过小,则二者界面不相溶,难以达到口服制剂的效果。
优选的,南极磷虾油原液与与无水乙醇的体积比为1-2:1-2,优选为1:1;与上述情况相同,无水乙醇与南极磷虾油的比例也应当适量。
优选的,所述恒温摇床为30-40℃,优选为37℃。由于人体最适温度为37℃,通常37℃条件下最适合人体吸收,因此,选择37℃将无水乙醇与南极磷虾油搅拌,大大促进人体吸收率。
优选的,振荡时间为10-15小时,优选为12小时。
本公开一个或一些实施方式中,提供上述紫杉醇口服剂型或上述紫杉醇口服剂型的制备方法制得的产品在制备治疗肿瘤药物中的应用。
本公开一个或一些实施方式中,提供上述紫杉醇口服剂型或上述紫杉醇口服剂型的制备方法制得的产品在制备治疗卵巢癌药物中的应用。
本公开分别以A2780细胞、SKOV3细胞,即不同的人卵巢癌细胞进行试验,从试验结果来看,本公开所述的药物体系对人卵巢癌细胞抑制率良好,因此,南极磷虾油-紫杉醇药物体系对于卵巢癌的治疗机理在于,其为A2780细胞、SKOV3细胞抑制剂。
本公开一个或一些实施方式中,提供上述紫杉醇口服剂型或上述紫杉醇口服剂型的制备方法制得的产品在制备治疗卵巢癌肿瘤药物中的应用。
本公开进行了细胞周期性试验,从试验结果来看,本公开所述的药物体系可以使卵巢癌细胞阻滞于G2/M期,抑制细胞增殖,从而抑制卵巢癌细胞活性。
实施例1
本实施例提供一种紫杉醇口服剂型的制备方法,包括如下步骤:
将100mg紫杉醇粉末加入到10mL的无水乙醇中充分振荡溶解配置成10mg/mL的紫杉醇的乙醇溶液;将紫杉醇的乙醇溶液加入到10mL南极磷虾油原液中混匀,于37℃的恒温摇床上充分振荡12小时,待乙醇完全挥发,即可形成稳定的南极磷虾油-紫杉醇药物体系。
实验结果显示,制备成功的南极磷虾油-紫杉醇药物体系外观为清亮透明,与单独南极磷虾油类似,无沉淀析出,室温放置24小时,体系稳定,无明显沉淀析出。
对比例1
本实施例提供一种紫杉醇口服剂型的制备方法,与实施例1区别在于,将南极磷虾油替换为大豆磷脂。
实验结果显示,制备成功的大豆磷脂-紫杉醇药物体系中,可以看到成团状的紫杉醇悬浮于大豆磷脂中,无沉淀析出,室温放置24小时,体系稳定,无明显沉淀析出。
从对比例1与实施例1的对比中可以看出,采用大豆磷脂的方案紫杉醇溶解度较差,发明人认为原因可能在于,紫杉醇乙醇溶液与大豆磷脂的界面溶解度较差。
对比例2
本实施例提供一种紫杉醇口服剂型的制备方法,与实施例1区别在于,将南极磷虾油替换为大豆磷脂、胆固醇的混合物,并采用超声装置混匀。
实验结果显示,制备成功的混合油脂-紫杉醇药物体系外观为清亮透明,与单独混合油脂类似,无沉淀析出,室温放置24小时,体系稳定,无明显沉淀析出。
从对比例2与实施例1的对比中可以看出,复配后的混合油脂相溶解度较好,发明人认为原因可能在于,混合油脂相与紫杉醇乙醇溶液密度相似。
实施例2
本实施例提供南极磷虾油-紫杉醇药物体系体外细胞实验
(1)SRB体外细胞增殖实验
取对数生长期的卵巢癌细胞SKOV3接种于96孔板(约3000个细胞/孔)中,于5%CO2,37℃孵箱中孵育。24小时后,弃去各孔原有培养液,加入1,2,5,10,20,50,100nM的南极磷虾油-紫杉醇药物体系,对照组给予相同浓度的南极磷虾油,于孵箱中孵育3天。去除细胞培养上清,加入预冷的10%三氯乙酸于4℃中固定细胞1小时。去除固定液,小孔用蒸馏水清洗5次后,空气干燥。干燥后每孔加入100μL 0.4%的SRB溶液染色30分钟。去除染液,用1%的冰醋酸溶液清洗5次后,空气干燥。结合的SRB用Tris缓冲液(150μL,10mM)充分溶解,在酶联免疫检测仪中测定各组的OD值,计算药物对肿瘤细胞生长的抑制率。
如图1,2所示,实验结果显示,和单独给予南极磷虾油组相比,给予南极磷虾油-紫杉醇药物体系组的肿瘤细胞生长抑制率明显增加。
(2)细胞周期检测实验
对数生长期的卵巢癌细胞SKOV3接种于6孔板(约1×105个细胞/孔)中,于5%CO2,37℃孵箱中孵育。24小时后,分别加入20nM和50nM的南极磷虾油-紫杉醇药物体系和南极磷虾油原液,继续培养24小时。收集细胞,用PBS离心清洗细胞3次,将细胞重悬于-20℃预冷的70%乙醇溶液中2小时,PBS离心清洗2次。清洗后的细胞加入200μg/mL的RNase室温孵育30分钟,最后加入50μg/mL的PI溶液4℃孵育30分钟。处理后的细胞以标准程序于流式细胞仪中检测,分析处于不同细胞周期的细胞比例,从而评估南极磷虾油-紫杉醇药物体系抑制细胞增殖的作用机制。
如图3,4所示,实验结果显示,和单独给予南极磷虾油组相比,给予南极磷虾油-紫杉醇药物体系组的肿瘤细胞细胞周期停留在G2/M期细胞比例明显增加。
实施例3
本实施例提供南极磷虾油-紫杉醇药物体系体内抗肿瘤实验
取健康的BABL/C雌性裸鼠18只,随机平均分为3组,自由进食与饮水。小鼠腋下注射人源卵巢癌细胞SKOV3,构建人卵巢癌裸鼠模型。于造模后第2周,一组小鼠灌胃生理盐水,一组以0.2ml/只的剂量灌胃给予南极磷虾油,另一组以紫杉醇终浓度20mg/kg的剂量灌胃给予南极磷虾油-紫杉醇药物体系,同样该体系浓度调整为0.2ml/只的南极磷虾油剂量,每天给药一次,连续给药两周后,处死小鼠,比较三组荷瘤小鼠的瘤重,评价给药体系的抗肿瘤效应。
如图5所示,实验结果显示,生理盐水组平均瘤重0.5627g,南极磷虾油组平均瘤重0.5497g,南极磷虾油-紫杉醇药物体系组平均瘤重0.4554g,对比例1组平均瘤重0.5344g,对比例2组平均瘤重0.5438g。
与生理盐水组和单独给予南极磷虾油组相比,给予南极磷虾油-紫杉醇药物体系组的小鼠的卵巢癌肿瘤生长明显受到抑制。结果表明,南极磷虾油-紫杉醇药物体系具有显著的抗肿瘤活性。
以上所揭露的仅为本公开的优选实施例而已,当然不能以此来限定本公开之权利范围,因此依本公开申请专利范围所作的等同变化,仍属本公开所涵盖的范围。
- 一种紫杉醇口服剂型及其制备方法与应用
- 紫杉醇口服聚合物胶束及其制备方法与应用
