对CD3特异性的抗体及其用途
文献发布时间:2023-06-19 10:22:47
序列表
本申请经由EFS-Web电子申请且包括以.txt格式电子提交的序列表。该.txt文件含有标题为"PC72375-PRV2_SequenceListing_ST25_05132019.txt"的序列表,其在2019年5月13日创建且具有100 KB的大小。该.txt文件中含有的序列表是本说明书的一部分,并且以其整体通过引用并入本文。
发明领域
本发明涉及对CD3特异性的抗体和其抗原结合片段,以及其使用方法。本发明还涉及结合CD3和靶抗原的多特异性抗体,以及其使用方法。
发明背景
分化簇3 (CD3)是在T细胞上表达的与T细胞受体复合物(TCR)缔合的同二聚体或异二聚体抗原,且为T细胞活化所需。T细胞活化是复杂现象,其依赖于在反应性T细胞群体上表达的多种细胞表面分子的参与。功能性CD3由四条不同链ε、ζ、δ和γ中的两条的二聚体缔合形成。例如,抗原特异性T细胞受体(TCR)由二硫化物连接的异二聚体构成,其含有两个克隆性分布的整体的膜糖蛋白链阿尔法和贝他(α和β)或与低分子量不变蛋白的复合物(通常指定为CD3)非共价缔合的伽马和德尔塔(γ和δ)。CD3二聚体排列还包括γ/ε、δ/ε和ζ/ζ。
已显示针对CD3的抗体在T细胞上聚集CD3,由此以与加载肽的MHC分子接合TCR类似的方式引起T细胞活化。因此,CD3抗体可用于涉及T细胞活化的治疗性目的。
发明概述
本发明提供结合CD3的抗体以及包含一种或多种CD3抗体的组合物(诸如药物组合物)。根据本发明的此方面的抗体尤其可用于靶向表达CD3的T细胞并用于刺激T细胞活化,例如在T细胞介导的杀死有益或期望的情况下。本发明的CD3抗体可包括为多特异性抗体(例如双特异性抗体)的一部分,该多特异性抗体将CD3介导的T细胞活化引导至特定细胞类型,诸如肿瘤细胞或感染性病原体。
在一个方面,本发明提供了特异性结合CD3的抗体,其中所述抗体包含:(a) 重链可变(VH)区,其包含SEQ ID NO: 2、4、5、7、10、12或35中所示的VH序列的VH互补决定区1(VH CDR1)、VH互补决定区2 (VH CDR2)和VH互补决定区3 (VH CDR3);和/或(b) 轻链可变(VL)区,其包含SEQ ID NO: 1、3、6、8、9、11、34、87或89中所示的VL序列的VL互补决定区1(VL CDR1)、VL互补决定区2 (VL CDR2)和VL互补决定区3 (VL CDR3)。
在该方面的一个实施方案中,所述CD3抗体包含:(a) VH区,其包含(i) 包含SEQID NO: 13、14或15的序列的VH CDR1;(ii) 包含SEQ ID NO: 16、17、19、20、21、22、23或24的序列的VH CDR2;和(iii) 包含SEQ ID NO: 18或25的序列的VH CDR3;和/或(b) VL区,其包含(i) 包含SEQ ID NO: 26、29、30、32、91或92的序列的VL CDR1;(ii) 包含SEQ ID NO:27或31的序列的VL CDR2;和(iii) 包含SEQ ID NO: 28或33的序列的VL CDR3。
在一些这种实施方案中,本发明提供了抗体,其中:(a) VH区包含SEQ ID NO: 2、4、5、7、10、12或35的序列;和/或(b) VL区包含SEQ ID NO: 1、3、6、8、9、11、34、87或89的序列。
在其他实施方案中,所述抗体包含选自以下的VL/VH氨基酸序列对:SEQ ID NO: 1和2;SEQ ID NO: 3和2;SEQ ID NO: 3和4;SEQ ID NO: 3和5;SEQ ID NO: 6和7;SEQ IDNO: 8和7;SEQ ID NO: 6和4;SEQ ID NO: 8和4;SEQ ID NO: 9和10;SEQ ID NO: 9和7;SEQID NO: 11和12;SEQ ID NO: 34和35;SEQ ID NO: 9和4;SEQ ID NO: 87和4;和SEQ ID NO:89和4。
在前述各自的一些实施方案中,所述抗体选自:Fab、Fab片段、F(ab)
在一个具体实施方案中,所述抗体是双特异性抗体。在一些这种实施方案中,所述双特异性抗体特异性结合肿瘤抗原。
在一些实施方案中,本发明的抗体进一步包含人或人源化VH构架和人或人源化VL构架。在一些这种实施方案中,所述抗体是人源化抗体。
本发明进一步提供了药物组合物,其包含如本文进一步公开的本发明的CD3抗体和药学上可接受的载体。
在另一个方面,本发明提供了调节有此需要的受试者中的T细胞介导的免疫应答的方法,其包括向所述受试者施用有效量的如本文所公开的抗体或药物组合物,使得所述受试者中的免疫应答被调节。
在一个方面,本发明提供了抑制受试者中的肿瘤细胞的生长的方法,其包括以有效抑制肿瘤细胞的生长的量向受试者施用如本文所公开的双特异性抗体、三特异性抗体、多特异性抗体、双特异性异二聚双抗体或双特异性异二聚IgG。
在一些这种实施方案中,所述肿瘤细胞是癌细胞。在具体实施方案中,所述癌症选自:乳腺癌、卵巢癌、甲状腺癌、前列腺癌、宫颈癌、肺癌、膀胱癌、子宫内膜癌、头颈癌、睾丸癌、胶质母细胞瘤癌和消化系统的癌症。
在一个实施方案中,所述消化系统的癌症选自:食道癌、胃癌、小肠癌、结肠癌、直肠癌、肛门癌、肝癌、胆囊癌、阑尾癌、胆管癌和胰腺癌。
在一个实施方案中,本发明提供了抗体或包含此抗体的药物组合物,其用于疗法中。
在另一个实施方案中,本发明提供了本发明的抗体在制备用于疗法中的药物中的用途。在一些这种实施方案中,所述疗法包括活化细胞裂解性T细胞应答。
在一个方面,本发明提供了多核苷酸,其包含编码如本文所公开的抗体的核苷酸序列。在另一个方面,本发明提供了包含此多核苷酸的载体。
在又另一个方面,本发明提供了包含如本文所公开的载体的宿主细胞。在一些这种实施方案中,所述宿主细胞重组产生如本文所公开的抗体。在具体实施方案中,所述宿主细胞选自:细菌细胞系、哺乳动物细胞系、昆虫细胞系、酵母细胞系。在一个具体实施方案中,所述哺乳动物细胞系是CHO细胞系。
在一个方面,本发明提供了产生如本文所公开的抗体的方法,其包括:在导致产生如本文所公开的抗体的条件下培养宿主细胞,和从培养上清液纯化所述抗体。
在另一个方面,本发明提供了如本文所公开的CD3抗体、多核苷酸、载体或宿主细胞在制备用于治疗病症的药物中的用途。
在一个方面,本发明提供了抗体或药物组合物,其用于调节有此需要的受试者中的T细胞介导的免疫应答的方法中。在具体实施方案中,本发明提供了抗体或药物组合物,其用于抑制受试者中的肿瘤细胞的生长的方法中。
在另一个方面,本发明提供了用于治疗癌症的抗体或药物组合物,任选地,其中所述癌症选自:乳腺癌、卵巢癌、甲状腺癌、前列腺癌、宫颈癌、肺癌、膀胱癌、子宫内膜癌、头颈癌、睾丸癌、胶质母细胞瘤癌和消化系统的癌症。
在又另一个方面,本发明提供了用于治疗癌症的抗体或药物组合物,其中T细胞介导的免疫应答被调节或其中肿瘤细胞的生长被抑制。
其他实施方案将从对详述的综述变得显而易见。当本发明的方面或实施方案在马库什组或其他替代分组的方面进行描述时,本发明不仅涵盖作为整体列出的整个组,而且涵盖个别地该组的每个成员和主要组的所有可能的亚组,以及不存在一个或多个组成员的主要组。本发明还设想在请求保护的发明中的任何一个或多个组成员的明确排除。
图/附图的简要说明
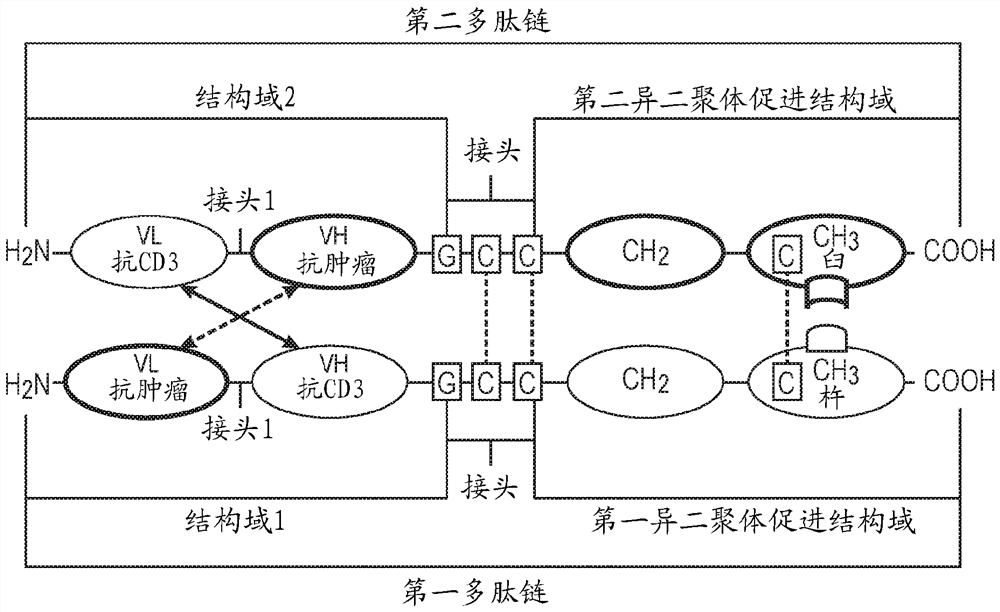
图1提供了具有第一异二聚体促进结构域和第二异二聚体促进结构域的双特异性抗体的架构的示意图,所述双特异性抗体包含经优化以经由“杵于臼中”缔合而缔合的Fc链。
图2描绘差示扫描量热法温度记录图的结果,其显示GUCY2c-H2B4和GUCY2c-2B5双特异性抗体随温度而变化的热容量。
图3描绘使用流式细胞术测定,GUCY2c-H2B4 (GUCY2c-0247)和GUCY2c-2B5(GUCY2c-0250)双特异性抗体与初始人T细胞的结合。
图4描绘使用细胞存活率数据,由GUCY2c-H2B4 (GUCY2c-0247)和GUCY2c-2B5(GUCY2c-0250)双特异性抗体介导的体外细胞毒性的结果。
图5描绘来自x射线晶体结构的H2B4 Fv区的势能面(PES)。这包括突出VH区、VH/VL界面和VL区的3个视图。图中指示具有过量正电荷的CDR用于参考。深黑色代表正电荷且白色代表负电荷。
图6描绘H2B4的Fv区的空间聚集倾向(SAP)表面。标记具有集中疏水性残基的区域。
图7描绘使用毛细管凝胶电泳图,含有CD3抗体结合结构域H2B4、2B5和2B5v6的双特异性抗体中的异质性。
图8描绘使用差示扫描量热法(DSC)温度记录图,GUCY2c-1608 (GUCY2c-2B5v6)双特异性抗体随温度而变化的热容量。
图9描绘GUCY2c-1608 (GUCY2c-2B5v6)双特异性抗体与初始T细胞的结合。
图10描绘由GUCY2c-1608 (GUCY2c-2B5v6)双特异性抗体介导的体外细胞毒性的细胞存活率数据。
图11A至11F描绘GUCY2c-1608 (GUCY2c-2B5v6)双特异性抗体的体外细胞因子释放测量值。双特异性抗体将初始人T细胞募集至表达GUCY2c的T84细胞以诱导体外细胞因子释放。基于Luminex的测定显示人IFN-γ (图11A)、IL10 (图11B)、IL2 (图11C)、IL4 (图11D)、IL6 (图11E)和TNF-α (图11F)的上调。
图12描绘GUCY2c-1608 (GUCY2c-2B5v6)双特异性抗体在过继性转移系统中的结肠直肠癌患者来源的异种移植物PDX-CRX-11201中的剂量依赖性肿瘤生长抑制。
图13描绘GUCY2C-1608 (GUCY2C-2B5v6)双特异性抗体在过继性转移系统中的结肠直肠癌细胞系异种移植物LS1034中的剂量依赖性肿瘤生长抑制。
图14A描绘细胞存活率数据的结果,其显示使用表达Flt3的MV4-11细胞,FLT3-2B5v6双特异性抗体在不同的效应物对靶标(E:T)比率下介导的体外细胞毒性。图14B描绘细胞存活率数据的结果,其显示使用表达Flt-3的EOL-1细胞,FLT3-2B5v6双特异性抗体在不同的效应物对靶标(E:T)比率下介导的体外细胞毒性。
图15描绘低亲和力2B5v6变体与表达CD3的Jurkat细胞的结合。
图16描绘概述研究结果的图表,其显示具有抗CD3变体的抗GUCY2C双特异性T细胞介导的细胞毒性。
详述
本文公开的本发明提供了特异性结合CD3 (例如人类CD3)的抗体,包括全长抗体或其抗原结合片段。本发明还提供了编码这些抗体的多核苷酸,包含这些抗体的组合物,以及制备和使用这些抗体的方法。本发明进一步提供了使用如本文所述的抗体治疗病症的方法。
除非另有指示,否则本发明的实践将采用分子生物学(包括重组技术)、微生物学、细胞生物学、生物化学和免疫学的常规技术,其在本领域的技术内。这种技术在文献中充分解释,所述文献诸如Molecular Cloning: A Laboratory Manual, 第二版 (Sambrook 等人, 1989) Cold Spring Harbor Press; Oligonucleotide Synthesis (M.J. Gait, 编,1984); Methods in Molecular Biology, Humana Press; Cell Biology: A LaboratoryNotebook (J.E. Cellis, 编, 1998) Academic Press; Animal Cell Culture (R.I.Freshney, 编, 1987); Introduction to Cell and Tissue Culture (J.P. Mather和P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: LaboratoryProcedures (A. Doyle, J.B. Griffiths, 和D.G. Newell, 编, 1993-1998) J. Wileyand Sons; Methods in Enzymology (Academic Press, Inc.); Handbook ofExperimental Immunology (D.M. Weir和C.C. Blackwell, 编); Gene TransferVectors for Mammalian Cells (J.M. Miller和M.P. Calos, 编, 1987); CurrentProtocols in Molecular Biology (F.M. Ausubel 等人, 编, 1987); PCR: ThePolymerase Chain Reaction, (Mullis 等人, 编, 1994); Current Protocols inImmunology (J.E. Coligan 等人, 编, 1991); Short Protocols in MolecularBiology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway和P. Travers,1997); Antibodies (P. Finch, 1997); Antibodies: a practical approach (D.Catty., 编, IRL Press, 1988-1989); Monoclonal antibodies: a practicalapproach (P. Shepherd和C. Dean, 编, Oxford University Press, 2000); Usingantibodies: a laboratory manual (E. Harlow和D. Lane (Cold Spring HarborLaboratory Press, 1999); The Antibodies (M. Zanetti和J.D. Capra, 编, HarwoodAcademic Publishers, 1995)。在一些情况下,具有通常理解含义的术语为清晰起见和/或为准备参考而定义于本文中,并在本文中包括这种定义不必解释为表示与本领域通常理解的定义具有实质性差异。
现在将以参考的方式使用以下定义和实例来详细描述本发明。本文提及的所有专利和公开(包括这种专利和公开中公开的所有序列)均明确地通过引用并入。
通常,除非另有定义,否则本文所用的所有本领域术语、符号和其他科学术语或术语学均意欲具有本发明所涉及的领域的技术人员通常理解的含义。例如,如本文的短语、诸如“A和/或B”中所用的术语“和/或”意欲包括A和B两者;A或B;A (单独);和B (单独)。同样,如在短语、诸如“A、B和/或C”中所用的术语“和/或”意欲涵盖以下实施方案中的每一者:A、B和C;A、B或C;A或C;A或B;B或C;A和C;A和B;B和C;A (单独);B (单独);和C (单独)。
如本文所用,除非上下文另外明确指示,否则单数形式“一个/种(a)”、“一个/种(an)”和“该(the)”包括其相应多个指示物。
如本文所用,数值范围包括定义该范围的数值。
术语“约”、“近似”等当在数值或范围的列表之前时独立地指该列表或范围中的每一个别值,如同该列表或范围中的每一个别值紧接在该术语之后一样。该术语意味着该术语所指的值与其相同、接近或类似。例如,在一些实施方案中,约或近似特定值可指示该值的99%、95%或90%的值。作为实例,“约100”的表述包括99和101和其之间的所有值(例如99.1、99.2、99.3、99.4、99.5等)。作为另一实例,如果温度为70℃,则“约”或“近似” 70℃可等于69℃、66℃或63℃。应理解,这些仅为实例。
如本文所用,核酸从左至右以5'至3'方向书写;氨基酸序列分别从左至右以氨基至羧基取向书写。对于本领域的定义和术语,实践者尤其是指Sambrook等人,1989和Ausubel FM等人,1993。应理解,本发明不限于所述的特定方法、方案和试剂,因为这些可变化。
术语“多肽”、“寡肽”、“肽”和“蛋白”在本文可互换使用,以指任何长度、优选地相对短(例如10-100个氨基酸)的氨基酸链。该链可以是线性或分支的,它可以包含修饰的氨基酸,和/或可以被非氨基酸中断。该术语还涵盖已天然地或通过干预修饰的氨基酸链;例如,二硫键形成、糖基化、脂化、乙酰化、磷酸化、或者任何其他操作或修饰,诸如与标记组分缀合。该定义内还包括的是例如含有一种或多种氨基酸类似物(包括例如非天然氨基酸等)以及本领域已知的其他修饰的多肽。应理解,多肽可以作为单链或缔合链存在。优选地,使用哺乳动物多肽(最初源自哺乳动物生物体的多肽),更优选地使用直接分泌至培养基中的那些。
“抗体”是免疫球蛋白分子,其能够通过位于免疫球蛋白分子的可变区中的至少一个抗原识别位点,特异性结合靶标、诸如碳水化合物、多核苷酸、脂质、多肽等。如本文所用,该术语涵盖多克隆抗体、单克隆抗体、嵌合抗体、双特异性抗体、双重-特异性抗体、双功能性抗体、三特异性抗体、多特异性抗体、双特异性异二聚双抗体、双特异性异二聚IgG、标记抗体、人源化抗体、人抗体以及其片段(诸如Fab、Fab'、F(ab')
术语“抗体”进一步包括包含由二硫键互连的四条多肽链(两条重链(H)和两条轻链(L))的免疫球蛋白分子,以及其多聚体(例如IgM)。每一重链包含重链可变区(在本文中缩写为HC VR或VH)和重链恒定区。抗体的“可变区”是指单独或组合的抗体轻链的可变区或抗体重链的可变区。重链恒定区包含三个结构域:CH1、CH2和CH3。CH1和CH2结构域由铰链区连结。每一轻链包含轻链可变区(在本文中缩写为LC VR或VL)和轻链恒定区。轻链恒定区包含一个结构域(CL1)。VH和VL区可进一步细分成超变区(称为互补决定区(CDR)),其散布有更保守的区(称为构架区(FR))。每一VH和VL由三个CDR和四个FR构成,所述三个CDR和四个FR从氨基末端至羧基末端按以下顺序排列:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。在本发明的不同实施方案中,CD3抗体(或其抗原结合部分)的FR可以与人种系序列相同,或者可以是天然或人工修饰的。氨基酸共有序列可以基于两个或更多个CDR的并排分析来定义。每条链中的CDR通过FR紧密保持在一起,并且与来自另一链的CDR一起,促成抗体的抗原结合位点的形成。
如本文所用的术语“抗原结合片段”、“抗体片段”或“抗原结合部分”是指抗体的保留特异性结合抗原的能力的一个或多个片段。涵盖在术语抗体的“抗原结合片段”内的结合片段的实例包括(i) 抗体重链可变结构域(VH)和/或抗体轻链可变结构域(VL),或源自全长抗体或抗体片段的VH/VL对(诸如VH结构域和/或VL结构域);(ii) Fab片段,即由VL、VH、CL和CH1结构域组成的单价片段;(iii) Fab’片段,其基本上是具有铰链区的一部分的Fab(例如Fundamental Immunology,Paul编辑,第3版,1993;(iv) F(ab')
如本文所用,抗体的“抗原结合片段”可以包含至少一个可变结构域。可变结构域可以具有任何大小或氨基酸组成,且通常将包含至少一个与一个或多个构架序列邻近或与其同框的CDR。如本文所用,“抗体的抗原结合片段”可以包含下文所列的彼此非共价缔合和/或与一个或多个单体VH或VL区非共价缔合(例如通过二硫键)的任一可变区和恒定结构域构型的同二聚体或异二聚体(或其他多聚体)。例如,可变区可以是二聚的且含有VH-VH、VH-VL或VL-VL二聚体。可以在本发明的抗体的抗原结合片段内发现的可变和恒定结构域的构型包括:VH-CH1;VH-CH2;VH-CH3;VH-CH1-CH2;VH-CH1-CH2-CH3;VH-CH2-CH3;VH-VL-CL、VH-VL-CH1、VH-VL-CH2;VH-CL;VL-CH1;VL-CH2;VL-CH3;VL-CH1-CH2;VL-CH1-CH2-CH3;VL-CH2-CH3;和VL-CL。可变区和恒定结构域可以彼此直接连接或可以通过完整或部分铰链或接头区连接。铰链区可以由至少2个(例如5个、10个、15个、20个、40个、60个或更多个)氨基酸组成,所述氨基酸在单一多肽分子中的邻近可变区和/或恒定结构域之间产生柔性或半柔性键联。
如本文所用,“结合结构域”包含多肽(例如抗体)的负责选择性结合目标分子(例如抗原、配体、受体、底物或抑制剂)的任一区域。示例性结合结构域包括抗体可变区、受体结合结构域、配体结合结构域和酶促结构域。
如本文所用,术语“人受体构架”是包含源自如下所定义的人免疫球蛋白构架或人共有构架的轻链可变(VL)构架或重链可变(VH)构架的氨基酸序列的构架。“源自”人免疫球蛋白构架或人共有构架的人受体构架可以包含其相同氨基酸序列,或其可以含有氨基酸序列修饰。在一些实施方案中,氨基酸修饰的数目为10或更少、9或更少、8或更少、7或更少、6或更少、5或更少、4或更少、3或更少或2或更少。在一些实施方案中,VL人受体构架的序列与VL人免疫球蛋白构架序列或人共有构架序列相同。
如本文所用,“亲和力成熟”抗体是指与不具有修饰的亲本抗体相比在一个或多个可变区(其包括CDR和FR)中具有一个或多个修饰的抗体,且其中这种修饰导致该抗体对抗原的亲和力提高。
如本文所用,术语“Fc区”、“Fc结构域”、“Fc链”或类似术语用于定义IgG重链的C末端区。IgG的Fc区包含两个恒定结构域,CH2和CH3。人IgG Fc区的CH2结构域通常根据EU索引的编号系统从氨基酸231延伸至氨基酸340,或根据Kabat的编号系统从氨基酸244延伸至氨基酸360。人IgG Fc区的CH3结构域通常根据EU索引的编号系统从氨基酸341延伸至447,或根据Kabat的编号系统从氨基酸361延伸至氨基酸478。人IgG Fc区的CH2结构域(也称为“Cγ2”结构域)由于其不与另一结构域密切配对而是独特的。反而,两条N-连接的支链碳水化合物链插入在完整天然IgG的两个CH2结构域之间。Fc区可以包含天然或变体Fc序列。尽管免疫球蛋白重链的Fc序列的边界可能改变,但人IgG重链Fc序列通常定义为从在约位置Cys226或约位置Pro230处的氨基酸残基至所述Fc序列的羧基末端的延伸段。除非在本文中另外指定,否则Fc区或恒定区中的氨基酸残基的编号根据也称为EU索引的EU编号系统,如Kabat等人,Sequences of Proteins of Immunological Interest,第5版,Public HealthService, National Institutes of Health, Bethesda, MD, 1991中所述。
在某些实施方案中,Fc链在紧邻木瓜蛋白酶裂解位点上游的铰链区中开始并在抗体的C末端处结束。因此,完整Fc链至少包含铰链结构域、CH2结构域和CH3结构域。在某些实施方案中,Fc链包含以下中的至少一者:铰链(例如上部、中部和/或下部铰链区)结构域、CH2结构域、CH3结构域、CH4结构域或其变体、部分或片段。在某些实施方案中,Fc结构域包含完整Fc链(即,铰链结构域、CH2结构域和CH3结构域)。在某些实施方案中,Fc链包含融合至CH3结构域(或其部分)的铰链结构域(或其部分)。在某些实施方案中,Fc链包含融合至CH3结构域(或其部分)的CH2结构域(或其部分)。在某些实施方案中,Fc链由CH3结构域或其部分组成。在某些实施方案中,Fc链由铰链结构域(或其部分)和CH3结构域(或其部分)组成。在某些实施方案中,Fc链由CH2结构域(或其部分)和CH3结构域组成。在某些实施方案中,Fc链由铰链结构域(或其部分)和CH2结构域(或其部分)组成。在某些实施方案中,Fc链缺乏CH2结构域的至少一部分(例如CH2结构域的全部或一部分)。本文中的Fc链通常是指包含免疫球蛋白重链的Fc链的全部或一部分的多肽。此Fc链包括但不限于包含整个CHI、铰链、CH2和/或CH3结构域的多肽以及仅包含例如铰链、CH2和CH3结构域的这种肽的片段。Fc链可源自任何物种的免疫球蛋白和/或任何亚型,包括但不限于人IgGl、IgG2、IgG3、IgG4、IgD、IgA、IgE或IgM抗体。Fc结构域涵盖天然Fc和Fc变体分子。与Fc变体和天然Fc一样,术语Fc链包括呈单体或多聚体形式的分子,无论其从全抗体消化还是通过其他方式产生。在一些实施方案中,Fc链包含通过二硫键保持在一起的两条重链的羧基末端部分。在某些实施方案中,Fc链由CH2结构域和CH3结构域组成。
如本领域中所使,“Fc受体”和“FcR”描述了结合抗体的Fc区的受体。优选的FcR是天然序列人FcR。此外,优选的FcR是这样的FcR,其结合IgG抗体(γ受体),并且包括FcγRI、FcγRII和FcγRIII亚类的受体,包括这些受体的等位基因变体和可变剪接形式。FcγRII受体包括FcγRIIA(“活化受体”)和FcγRIIB(“抑制受体”),其具有主要区别在于其胞质结构域的相似的氨基酸序列。FcR综述于:Ravetch和Kinet,Ann. Rev. Immunol.,9:457-92,1991;Capel等人,Immunomethods,4:25-34,1994;以及de Haas等人,J. Lab. Clin. Med,126:330-41,1995。“FcR”还包括新生儿受体FcRn,其负责母体IgG至胎儿的转移(Guyer等人,J. Immunol.,117:587,1976;以及Kim等人,J. Immunol.,24:249,1994)。
“天然序列Fc区”或“野生型Fc区”包含与自然界中发现的Fc区的氨基酸序列相同的氨基酸序列。“野生型”人IgG Fc意指在人群体内天然存在的氨基酸的序列。当然,正如Fc序列可在个体之间略有不同,可对野生型序列作出一种或多种改变且仍保持在本发明的范围内。例如,Fc区可含有与本发明不相关的额外改变,诸如在糖基化位点中的突变、包括非天然氨基酸或“杵于臼中(knobs-in-holes)”突变。
“变体Fc区”或“变体Fc链”包含这样的氨基酸序列,其凭借至少一个氨基酸修饰而不同于天然序列Fc区的氨基酸序列,但保留天然序列Fc区的至少一种效应子功能。在一些实施方案中,与天然序列Fc链或亲本多肽的Fc区相比,变体Fc链具有至少一个氨基酸取代,例如,天然序列Fc链或亲本多肽的Fc链中的约1至约10个氨基酸取代,且优选约1至约5个氨基酸取代。本文的变体Fc链将优选与天然序列Fc链和/或亲本多肽的Fc链具有至少约80%的序列同一性,且最优选与其具有至少约90%的序列同一性,更优选与其具有至少约95%、至少约96%、至少约97%、至少约98%、至少约99%的序列同一性。
如本文所用,术语“效应子功能”是指由抗体的Fc区(天然序列Fc链或氨基酸序列变体Fc链)引起的那些生物活性,且随抗体同种型而变化。抗体效应子功能的实例包括:C1q结合和补体依赖性细胞毒性;Fc受体结合;抗体依赖性细胞介导的细胞毒性(ADCC);吞噬作用;细胞表面受体(例如B细胞受体)的下调;和B细胞活化。这种效应子功能一般需要将Fc链与结合结构域(例如抗体可变区)组合,并且可以使用本领域已知的用于评估这种抗体效应子功能的各种测定来评价。效应子功能的示例性测量是通过Fcγ3和/或C1q结合。
抗体的效应子功能由Fc链中的序列决定;此链也是由某些类型的细胞上发现的Fc受体(FcR)识别的部分。
在一些实施方案中,Fc多肽包含野生型铰链序列的一部分或全部(通常在其N末端)。在一些实施方案中,Fc多肽不包含功能性或野生型铰链序列。
如本文所用的“铰链区”、“铰链序列”及其变型包括本领域已知的含义,其在例如Janeway等人, ImmunoBiology: the immune system in health and disease, ElsevierScience Ltd., NY (第4版, 1999); Bloom等人, Protein Science, 6:407-415, 1997;和Humphreys等人, J. Immunol. Methods, 209:193-202, 1997中举例说明。
如本文所用的“免疫球蛋白样铰链区”、“免疫球蛋白样铰链序列”及其变型是指免疫球蛋白样或抗体样分子(例如,免疫粘附素)的铰链区和铰链序列。在一些实施方案中,所述免疫球蛋白样铰链区可以来自或源自任何IgG1、IgG2、IgG3或IgG4亚型,或者IgA、IgE、IgD或IgM,包括其嵌合形式,例如嵌合IgG1/2铰链区。
在一些实施方案中,所述铰链区可以来自根据EU索引的编号系统从氨基酸216延伸至氨基酸230或根据Kabat的编号系统从氨基酸226延伸至氨基酸243的人IgG1亚型。在一些实施方案中,序列可以是EPKSCDKTHTCPPCP (SEQ ID NO: 63)。本领域技术人员对对应于IgG分子的各个结构域的确切氨基酸的理解可以不同。因此,上文概述的结构域的N末端或C末端可以延伸或缩短1、2、3、4、5、6、7、8、9或甚至10个氨基酸。
在一些实施方案中,所述铰链区可以突变一个或多个氨基酸。在一些实施方案中,所述铰链区可以被截短且仅含有全铰链区的一部分。在一些实施方案中,所述铰链区可以仅含有铰链区的最后5个氨基酸,其在本文中称为“下部铰链”区。在一些实施方案中,下部铰链区可以包含氨基酸CPPCP (SEQ ID NO: 64)或根据EU索引的编号系统的氨基酸226至氨基酸230或根据Kabat的编号系统的氨基酸239至氨基酸243。
如本文所用,术语“修饰”是指多肽序列中的氨基酸取代、插入和/或缺失、与蛋白化学连接的部分的改变或对蛋白(例如抗体)的功能的修饰。例如,修饰可以是抗体功能的改变或与蛋白连接的碳水化合物结构的改变。如本文所用,“氨基酸修饰”是指抗体中的一个或多个氨基酸残基的突变(取代)、插入(增加)或缺失。术语“氨基酸突变”表示至少一个现有氨基酸残基被另一不同氨基酸残基(例如替代氨基酸残基)取代。术语“氨基酸缺失”表示在氨基酸序列中的预定位置处去除至少一个氨基酸残基。例如,突变L234A表示,在抗体Fc区中的位置234处的氨基酸残基赖氨酸被氨基酸残基丙氨酸取代(用丙氨酸取代赖氨酸)(编号根据EU索引编号系统)。“天然氨基酸残基”表示来自由以下组成的组的氨基酸残基:丙氨酸(三字母代码:Ala,单字母代码:A)、精氨酸(Arg,R)、天冬酰胺(Asn,N)、天冬氨酸(Asp,D)、半胱氨酸(Cys,C)、谷氨酰胺(Gin,Q)、谷氨酸(Glu,E)、甘氨酸(Gly,G)、组氨酸(His,H)、异亮氨酸(Ile,I)、亮氨酸(Leu,L)、赖氨酸(Lys,K)、甲硫氨酸(Met,M)、苯丙氨酸(Phe,F)、脯氨酸(Pro,P)、丝氨酸(Ser,S)、苏氨酸(Thr,T)、色氨酸(Trp,W)、酪氨酸(Tyr,Y)和缬氨酸(Val,V)。
术语“药剂”在本文中用于表示生物大分子、从生物材料制得的提取物、生物大分子的混合物、化学化合物、化学化合物的混合物和/或化学化合物和生物大分子的混合物。术语“治疗剂”是指具有生物活性的药剂。
如本文所用,“单克隆抗体”是指从基本上同质的抗体群体获得的抗体,即,除了可以以少量存在的可能天然存在的突变之外,构成群体的各个抗体是相同的。单克隆抗体针对单个抗原位点是高度特异性的。此外,与通常包括针对不同决定簇(表位)的不同抗体的多克隆抗体制剂形成对比,每种单克隆抗体针对抗原上的单一决定簇。修饰语“单克隆的”指示如从基本上同质的抗体群体获得的抗体的特征,并且不应解释为要求通过任何特定方法的抗体生产。例如,待根据本发明使用的单克隆抗体可以通过首先由Kohler和Milstein,Nature 256:495,1975描述的杂交瘤方法来制备,或者可以通过诸如美国专利号4,816,567中所述的重组DNA方法来制备。单克隆抗体也可以从噬菌体文库中分离,所述噬菌体文库使用例如McCafferty等人,Nature 348:552-554,1990中描述的技术生成。
本发明的抗体可以是“人源化抗体”。如本文所用,“人源化”抗体是指非人(例如,小鼠、大鼠、兔、非人灵长类动物或其他哺乳动物)抗体的形式,其是嵌合免疫球蛋白、免疫球蛋白链或其片段(诸如Fv、Fab、Fab'、F(ab')
优选地,人源化抗体是人免疫球蛋白(受体抗体),其中来自受体的互补决定区(CDR)的残基被替换为具有期望的特异性、亲和力和能力的来自非人物种(供体抗体)、诸如小鼠、大鼠或兔的CDR的残基。在一些情况下,人免疫球蛋白的Fv构架区(FR)残基被替换为相应的非人残基。此外,人源化抗体可以包含这样的残基,其在受体抗体和输入的CDR或构架序列中均未发现,但被包括以进一步完善且优化抗体性能。通常,人源化抗体将包含至少一个,且通常为两个可变区的基本上全部,其中CDR区的全部或基本上全部对应于非人免疫球蛋白的那些,并且FR区的全部或基本上全部是人免疫球蛋白共有序列的那些。人源化抗体最佳地还将包含免疫球蛋白恒定区或结构域(Fc)的至少一部分,通常为人免疫球蛋白的那种。优选的是具有如WO 99/58572中所述修饰的Fc链的抗体。其他形式的人源化抗体具有一个或多个CDR (CDR L1、CDR L2、CDR L3、CDR H1、CDR H2或CDR H3),其相对于原始抗体改变,也被称为“源自”来自原始抗体的一个或多个CDR的一个或多个CDR。如本文所用的人源化意欲包括去免疫化抗体。
如本文所用,“人抗体”意指这样的抗体,其具有对应于由人产生的抗体的氨基酸序列的氨基酸序列、和/或已使用本领域技术人员已知或本文公开的用于制备人抗体的任何技术进行制备。因此,如本文所用的术语“人抗体”意欲包括具有源自人种系免疫球蛋白序列的可变区和恒定区的抗体。本发明的人抗体可以包括并非由人种系免疫球蛋白序列编码的氨基酸残基(例如通过体外随机诱变或位点特异性诱变或通过体内体细胞突变引入的突变),例如在CDR且具体而言CDR3中。人抗体的这个定义包括包含至少一个人重链多肽或至少一个人轻链多肽的抗体。一个这种实例是包含鼠轻链和人重链多肽的抗体。可以使用本领域已知的各种技术来产生人抗体。在一个实施方案中,人抗体选自噬菌体文库,其中该噬菌体文库表达人抗体(Vaughan等人,Nature Biotechnology,14:309-314,1996;Sheets等人,Proc. Natl. Acad. Sci.(USA)95:6157-6162,1998;Hoogenboom和Winter,J. Mol.Biol.,227:381,1991;Marks等人,J. Mol. Biol.,222:581,1991)。人抗体也可以通过动物的免疫来制备,人免疫球蛋白基因座已被转基因引入所述动物内代替内源基因座,例如其中内源免疫球蛋白基因已被部分或完全失活的小鼠。该方法描述于美国专利号5,545,807;5,545,806;5,569,825;5,625,126;5,633,425;和5,661,016。或者,可以通过使人B淋巴细胞永生化来制备人抗体,所述人B淋巴细胞产生针对靶抗原的抗体(这种B淋巴细胞可以从个体或cDNA的单细胞克隆中回收,或者可以已在体外进行免疫)。参见例如,Cole等人Monoclonal Antibodies and Cancer Therapy,Alan R. Liss,第77页,1985;Boerner等人,J. Immunol.,147(1):86-95,1991;和美国专利号5,750,373。
本发明的人抗体可以以与铰链异质性相关的至少两种形式存在。例如,免疫球蛋白分子包含近似150-160 kDa的稳定四链构建体,其中二聚体通过链间重链二硫键保持在一起。或者,二聚体不经由链间二硫键连接,且形成由共价偶联的轻链和重链构成的约75-80 kDa的分子(半抗体)。
如本文所用,术语“重组人抗体”意欲包括通过重组方式制备、表达、产生或分离的所有人抗体,诸如使用转染至宿主细胞中的重组表达载体表达的抗体(下文进一步描述)、从重组组合人抗体文库分离的抗体(下文进一步描述)、从人免疫球蛋白基因转基因的动物(例如小鼠)分离的抗体(参见,例如,Taylor等人(1992) Nucl. Acids Res. 20:6287-6295),或通过涉及将人免疫球蛋白基因序列剪接至其他DNA序列的任何其他方式制备、表达、产生或分离的抗体。这种重组人抗体具有源自人种系免疫球蛋白序列的可变区和恒定区。然而,在某些实施方案中,使这种重组人抗体经受体外诱变(或,当使用人Ig序列转基因的动物时,经受体内体细胞诱变),且因此重组抗体的VH和VL区的氨基酸序列是这样的序列,尽管源自人种系VH和VL序列且与其相关,但其可以不天然存在于人体内抗体种系库内。
本发明的抗体可以是“嵌合抗体”(其中一部分重链和/或轻链与源自特定物种或属于特定抗体类别或亚类的抗体中的相应序列相同或同源,而链的剩余部分与源自另一物种或属于另一抗体类别或亚类的抗体中的相应序列相同或同源的抗体),以及这种抗体的片段,条件是它们表现出期望的生物活性(美国专利4,816,567; 和Morrison等人, Proc.Natl. Acad. Sci. USA 81 :6851 -6855, 1984)。本文的目标嵌合抗体包括灵长类化抗体,其包含源自非人灵长类动物(例如,旧大陆猴、猿等)的可变区抗原结合序列和人恒定区序列。
“单价抗体”包含一个抗原结合位点/分子(例如IgG或Fab)。在一些情况下,单价抗体可以具有超过一个抗原结合位点,但结合位点来自不同的抗原。
“单特异性抗体”是指抗体或抗体制剂,其包含两个相同的抗原结合位点/分子(例如IgG),使得两个结合位点结合抗原上的相同表位。因此,它们在结合一个抗原分子时彼此竞争。该术语包括“单克隆抗体”或“单克隆抗体组合物”。自然界中发现的大多数抗体都是单特异性的。在一些情况下,单特异性抗体也可以是单价抗体(例如Fab)。
术语“突变负荷(mutation load)”、“突变负荷(mutational load)”、“突变负荷(mutation burden)”或“突变负荷(mutational burden)”在本文中可互换使用。肿瘤突变负荷是肿瘤基因组内突变数量的量度,其定义为肿瘤基因组的每一编码区的总突变数。肿瘤类型内的突变负荷存在极大差异,范围为仅几个至几千个突变(Alexandrov LB等人,Nature 2013;500(7463):415-421; Lawrence MS等人, Nature 2013;499:214–218;Vogelstein B等人, Science, 2013;339:1546–1558。
“原始氨基酸残基”是由侧链体积可小于或大于原始残基的“输入氨基酸”残基替代的残基。输入氨基酸残基可以是天然存在或非天然存在的氨基酸残基,但优选为前者。“天然存在”氨基酸残基是由遗传密码编码的那些残基。“非天然存在”氨基酸残基意指并非由遗传密码编码的残基,但其能够共价结合多肽链中的邻近氨基酸残基。非天然存在的氨基酸残基的实例是正亮氨酸、鸟氨酸、正缬氨酸、高丝氨酸和其他氨基酸残基类似物,诸如描述于例如Ellman等人, Meth. Enzym. 202:301-336 (1991)中的那些。在一些实施方案中,本发明的方法涉及替代至少一个原始氨基酸残基,但可替代多于一个原始残基。通常,不超过第一或第二多肽界面中的总残基可以包含经替代的原始氨基酸残基。
如本文关于抗体的使用的术语“竞争”意指第一抗体或其抗原结合片段(或部分)以与第二抗体或其抗原结合部分的结合足够相似的方式结合表位,使得与第二抗体不存在的情况下的第一抗体的结合相比,在第二抗体的存在下第一抗体与其同源表位的结合结果可检测地降低。其中在第一抗体的存在下第二抗体与其表位的结合也可检测地降低的替代方案可以但不必是这种情况。也就是说,第一抗体可以抑制第二抗体与其表位的结合,而该第二抗体不能抑制第一抗体与其相应表位的结合。然而,当每种抗体可检测地抑制另一种抗体与其同源表位或配体的结合时,无论是相同、更大还是更小程度,所述抗体被说成彼此“交叉竞争”结合其相应的表位。竞争抗体和交叉竞争抗体均由本发明涵盖。不管这种竞争或交叉竞争通过其发生的机制(例如,空间位阻、构象变化、或者与共同表位或其一部分的结合),基于本文提供的教导,技术人员将理解,这种竞争抗体和/或交叉竞争抗体被涵盖并且可以用于本文公开的方法中。
如本文所用,“抗体依赖性细胞介导的细胞毒性”或“ADCC”是指细胞介导的反应,其中表达Fc受体(FcR)的非特异性细胞毒性细胞(例如天然杀伤(NK)细胞、嗜中性粒细胞和巨噬细胞)识别在靶细胞上的结合抗体,并且随后引起靶细胞的裂解。可以使用体外ADCC测定,诸如美国专利号5,500,362或5,821,337中所述的那种,来评价目标分子的ADCC活性。用于这种测定的有用的效应细胞包括外周血单核细胞(PBMC)和NK细胞。可替代地或另外地,可以例如在动物模型、诸如Clynes等人, PNAS (USA), 95:652-656, 1998中公开的那种中,在体内评价目标分子的ADCC活性。
如本文所用,“补体依赖性细胞毒性”或“CDC”是指在补体的存在下的靶标裂解。补体活化途径通过补体系统的第一组分(C1q)与和同源抗原复合的分子(例如抗体)的结合来起始。为了评价补体活化,可以进行例如如Gazzano-Santoro等人, J. Immunol. Methods,202: 163, 1996中所述的CDC测定。
如本文所用,术语“免疫特异性结合”、“免疫特异性识别”、“特异性结合”、“特异性识别”和类似术语是指特异性结合抗原(例如表位或免疫复合物)且不特异性结合另一分子的分子(例如结合结构域)。特异性结合抗原的分子可以更低的亲和力结合其他肽或多肽,如通过本领域已知的测定法所测定,例如免疫测定法、BIACORE™或其他测定法。优选地,特异性结合抗原的分子不与其他蛋白交叉反应。
合适的“中等严格条件”包括在5 X SSC、0.5% SDS、1.0 mM EDTA(pH 8.0)的溶液中的预洗涤;在50℃-65℃、5 X SSC下杂交过夜;随后为在65℃下用含有0.1% SDS的2X、0.5X和0.2X SSC洗涤两次,各20分钟。
如本文所用,“高度严格条件”或“高严格性条件”是这样的条件,其:(1)采用低离子强度和高温用于洗涤,例如在50℃下0.015 M氯化钠/0.0015 M柠檬酸钠/0.1%十二烷基硫酸钠;(2)在杂交过程中采用变性剂,在42℃下,诸如甲酰胺,例如具有0.1%牛血清白蛋白的50%(v/v)甲酰胺/0.1% Ficoll/0.1%聚乙烯吡咯烷酮/具有750 mM氯化钠、75 mM柠檬酸钠的50 mM磷酸钠缓冲液pH 6.5;或(3)在42℃下采用50%甲酰胺、5 x SSC(0.75 M NaCl、0.075 M柠檬酸钠)、50 mM磷酸钠(pH 6.8)、0.1%焦磷酸钠、5 x Denhardt溶液、超声处理的鲑精DNA(50 µg/ml)、0.1% SDS和10%硫酸葡聚糖,伴随在42℃下在0.2 x SSC(氯化钠/柠檬酸钠)中和在55℃下50%甲酰胺中的洗涤,随后为在55℃下由含有EDTA的0.1 x SSC组成的高严格性洗涤。技术人员将认识到如何根据需要调节温度、离子强度等,以适应诸如探针长度等因素。
所述结合蛋白、结合结构域或CDR或抗体(如本文所广泛定义)可以根据Kabat、Chothia、Kabat和Chothia两者的积累、AbM、接触、North的定义和/或构象定义、或本领域众所周知的CDR测定的任何方法鉴定。参见,例如,Kabat等人,1991, Sequences of Proteinsof Immunological Interest,第5版(超变区);Chothia等人,Nature 342:877-883, 1989(结构环结构)。特定抗体中构成CDR的氨基酸残基的身份可使用本领域所众所周知的方法来确定。CDR的AbM定义是Kabat和Chothia之间的折衷并使用Oxford Molecular's AbM抗体建模软件(Accelrys®)。CDR的“接触”定义基于观察到的抗原接触,在MacCallum等人,J.Mol. Biol.,262:732-745,1996中阐述。CDR的“构象”定义基于对抗原结合具有焓贡献的残基(参见,例如,Makabe等人, J. Biol. Chem., 283:1156-1166, 2008)。North已使用不同的优选CDR定义集鉴定了规范CDR构象(North等人,J. Mol. Biol. 406: 228-256, 2011)。在本文中称为CDR的“构象定义”的另一种方法中,CDR的位置可以鉴定为对抗原结合做出焓贡献的残基(Makabe等人, J. Biol. Chem., 283:1156-1166, 2008)。另外其他CDR边界定义可能并不严格遵循上述方法之一,但仍将与Kabat CDR的至少一部分重叠,尽管根据特定的残基或残基组或甚至整个CDR不显著影响抗原结合的预测或实验发现,它们可以缩短或延长。如本文所用,CDR可以是指通过本领域已知的任何方法,包括方法的组合定义的CDR。本文使用的方法可以利用根据这些方法中的任一种定义的CDR。对于含有超过一个CDR的任何给定实施方案,可以根据Kabat、Chothia、延伸(Kabat和Chothia的组合)、North、延伸、AbM、接触和/或构象定义中的任一种来定义CDR(或抗体的其他残基)。
可变结构域中的残基根据Kabat来编号,其为用于所汇编抗体的重链可变区或轻链可变区的编号系统。参见,Kabat等人,Sequences of Proteins of ImmunologicalInterest,第5版,Public Health Service, National Institutes of Health,Bethesda, MD, 1991。使用该编号系统,实际线性氨基酸序列可含有较少或额外的对应于可变区的FR或CDR的缩短或其中的插入的氨基酸。例如,重链可变区可包括在H2的残基52后的单一氨基酸插入(根据Kabat的残基52a)和重链FR残基82后的插入残基(例如,根据Kabat的残基82a、82b和82c)。可通过将抗体序列的同源区与“标准”Kabat编号序列比对来确定给定抗体的残基的Kabat编号。可获得用于指定Kabat编号的各种算法。本文使用Abysis的2.3.3发行版(www.abysis.org)中执行的算法向可变区VL CDR1、VL CDR2、VL CDR3、VHCDR1、VH CDR2和VH CDR3指定Kabat编号。抗体中的具体氨基酸残基位置也可根据Kabat来编号。
如本文所用,术语“噬菌体展示文库”是指噬菌体群体,其各自含有重组框内融合至表面蛋白的外源cDNA。噬菌体在其表面上展示由cDNA编码的外源蛋白。在细菌宿主(通常大肠杆菌)中复制后,通过外源蛋白在噬菌体表面上的表达选择含有目标外源cDNA的噬菌体。
术语“表位”是指分子的能够在称为互补位的抗体的抗原结合区的一个或多个处由抗体识别、与抗体接触和/或由抗体结合的部分。单一抗原可具有多于一个表位。因此,不同抗体可结合抗原上的不同区域且可具有不同生物效应。表位经常由分子的化学活性表面分组(诸如氨基酸或糖侧链)组成,且具有特定三维结构特征以及特定电荷特征。如本文所用,表位可以是构象的或线性的。通过来自线性多肽链的不同区段的空间并置氨基酸产生构象表位。线性表位是由多肽链中的邻近氨基酸残基产生的表位。在某些实施方案中,表位可包括抗原上的糖、磷酰基或磺酰基的部分。
如本文所用的术语“抗原性表位”定义为如通过本领域众所周知的任一方法(例如通过常规免疫测定)所测定,抗体可特异性结合的多肽的一部分。“非线性表位”或“构象表位”包含抗原性蛋白内的非邻接多肽(或氨基酸),对该表位特异性的抗体与其结合。一旦确定抗原上的期望表位,可例如使用本文所述的技术生成针对该表位的抗体。
在关于抗体和蛋白或肽的相互作用使用时,术语“特异性结合”或“特异性地结合”是指依赖于蛋白上的特定结构(即,抗原决定簇或表位)的存在的相互作用;换言之,抗体识别且结合特定蛋白结构而非通常蛋白。例如,如果抗体对表位“A”特异性,则在含有标记的“A”和抗体的反应中存在含有表位A (或游离未标记的A)的蛋白将减少与抗体结合的标记的A的量。
在某些实施方案中,“特异性结合”意指例如抗体以约0.1 nM或更小、但更通常小于约1 μM的KD结合蛋白。在某些实施方案中,“特异性结合”意指抗体有时以至少约0.1 μM或更小、在其他时间以至少约0.01 μM或更小并在其他时间以至少约1 nM或更小的KD结合靶标。由于不同物种中的同源蛋白之间的序列同一性,特异性结合可包括识别多于一种物种中的蛋白(例如人蛋白或小鼠蛋白)的抗体。同样,由于不同蛋白的多肽序列的某些区内的同源性,特异性结合可包括识别多于一种蛋白的抗体。应理解,在某些实施方案中,特异性结合第一靶标的抗体或结合部分可特异性结合或可不特异性结合第二靶标。因此,“特异性结合”不一定需要(尽管其可包括)排他性结合,即结合单一靶标。因此,在一些实施方案中,抗体可特异性结合多于一种靶标。在某些实施方案中,抗体上的相同抗原结合位点可结合多种靶标。例如,在某些情况中,抗体可包含两个相同的抗原结合位点,其各自特异性结合两种或更多种蛋白上的相同表位。在某些替代实施方案中,抗体可以是多特异性的且包含至少两个具有不同特异性的抗原结合位点。通过非限制性实例的方式,双特异性抗体可包含一个识别一种蛋白(例如人CD3)上的表位的抗原结合位点且进一步包含识别第二蛋白上的不同表位的第二不同抗原结合位点。通常但不一定,对结合的提及意指特异性结合。
特异性结合抗原的抗体可以更低的亲和力结合其他肽或多肽,如通过本领域已知的测定法(例如免疫测定法、BIACORE®或其他测定法)所测定。优选地,特异性结合抗原的抗体不与其他蛋白交叉反应。
在关于抗体和蛋白或肽的相互作用使用时,术语“非特异性结合”或“背景结合”是指不依赖于特定结构的存在(即,抗体结合通常蛋白而非特定结构、诸如表位)的相互作用。
如本文所用的术语"k
如本文所用的术语"k
如本文所用的术语"K
如本文所用,术语“结合亲和力”通常是指分子(例如抗体)的单一结合位点和其结合配偶体(例如抗原)之间的非共价相互作用的总强度。除非另外指示,否则如本文所用,“结合亲和力”是指反映结合对的成员(例如,抗体和抗原)之间的1:1相互作用的固有结合亲和力。分子X对其配偶体Y的亲和力通常可由解离常数(KD)代表。分子X对其配偶体Y的亲和力通常可由解离常数(Kd)代表。例如,Kd可以是约200 nM、150 nM、100 nM、60 nM、50 nM、40 nM、30 nM、20 nM、10 nM、8 nM、6 nM、4 nM、2 nM、1 nM或更强。亲和力可通过本领域已知的常用方法(包括本文所述的那些)来测量。低亲和力抗体通常缓慢地结合抗原且往往易于解离,而高亲和力抗体通常较快结合抗原且往往较长时间保持结合。多种测量结合亲和力的方法是本领域已知的,其任一者均可用于本发明的目的。具体而言,术语“结合亲和力”意欲是指特定抗原-抗体相互作用的解离速率。K
除非另有指定,否则关于本发明的抗体(诸如抗体、片段或其衍生物),“生物活性的”、“生物活性”和“生物特征”意指具有结合生物分子的能力。
如本文所用,术语“核酸”和“核苷酸序列”包括DNA分子(例如cDNA或基因组DNA)、RNA分子(例如mRNA)、DNA和RNA分子的组合或杂合DNA/RNA分子和DNA或RNA分子的类似物。这种类似物可使用例如核苷酸类似物来生成,所述核苷酸类似物包括但不限于肌苷或三苯甲基化碱基。这种类似物也可以包含DNA或RNA分子,其包含赋予所述分子有益属性(诸如例如核酸酶抗性或增加跨细胞膜的能力)的修饰的主链。核酸或核苷酸序列可以是单链、双链,可以含有单链和双链部分两者,且可以含有三链部分,但优选为双链DNA。
本发明还包括编码本发明的抗体(包括抗体的多肽和结合区)的多核苷酸。可获得编码本发明的分子的多核苷酸,且通过本领域已知的任一方法确定多核苷酸的核苷酸序列。
编码本发明的抗体的多核苷酸可包括以下:仅变体的编码序列;变体的编码序列和额外编码序列(诸如功能性多肽或信号序列或分泌序列或前蛋白序列);抗体的编码序列和非编码序列(诸如内含子或抗体的编码序列5’和/或3’的非编码序列)。术语“编码抗体的多核苷酸”涵盖包括变体的额外编码序列的多核苷酸,且还涵盖包括额外编码和/或非编码序列的多核苷酸。本领域已知,可以从期望蛋白的氨基酸序列容易获得针对特定宿主细胞/表达系统优化的多核苷酸序列(参见GENEART
本发明的抗体可具有对多肽功能不具实质效应的额外的保守或非必需氨基酸取代。特定取代是否将被耐受(即不会不利地影响期望生物特性(诸如结合活性))可如Bowie,JU等人,Science 247: 1306-1310,1990或Padlan等人,FASEB J. 9: 133-139, 1995)中所述来确定。
如本文所用,“保守氨基酸取代”是其中氨基酸残基用具有类似侧链的氨基酸残基替代的取代。本领域中已定义具有类似侧链的氨基酸残基家族。这些家族包括具有以下侧链的氨基酸:碱性侧链(例如,赖氨酸、精氨酸、组氨酸)、酸性侧链(例如,天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如,天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如,甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β-支链侧链(例如,苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)。
如本文所用,“非必需”氨基酸残基是可与结合剂(例如抗体)的野生型序列不同且不消除或不基本上改变生物活性的残基,而“必需”氨基酸残基则导致此变化。在抗体中,必需氨基酸残基可以是特异性决定残基(SDR)。
如本文所用,术语“分离的”是指从其原始环境(例如,如果其为天然存在的则为天然环境)移取的材料。例如,活的动物中存在的天然存在的多核苷酸或多肽并非分离的,但自天然系统中的一些或所有共存材料分离的相同多核苷酸或多肽是分离的。此多核苷酸可以是载体的一部分,和/或此多核苷酸或多肽可以是组合物(例如混合物、溶液或悬浮液)的一部分或包含含有该多核苷酸或多肽的分离细胞或培养细胞,且由于该载体或组合物并非其天然环境的一部分而仍为分离的。例如,化学合成或在不同于多肽天然起源的细胞的细胞系统中合成的多肽将与其天然缔合组分“分离”。也可使用本领域众所周知的蛋白纯化技术通过分离使蛋白基本上不含天然缔合组分。
“分离的”或“纯化的”抗体基本上不含细胞材料或来自蛋白源自其的细胞或组织来源或培养基的其他污染性蛋白,或在化学合成时基本上不含化学前体或其他化学品。语言“基本上不含细胞材料”包括抗体制剂,其中多肽/蛋白从分离或重组产生该多肽/蛋白的细胞的细胞组分分离。因此,基本上不含细胞材料的抗体包括具有少于约50%、40%、30%、20%、10%、5%、2.5%或1% (以干重计)的污染性蛋白的抗体制剂。当重组产生抗体时,其也优选地基本上不含培养基,即培养基占蛋白制剂的体积的少于约50%、40%、30%、20%、10%、5%、2.5%或1%。当抗体通过化学合成产生时,其优选地基本上不含化学前体或其他化学品和试剂,即目标抗体从参与蛋白合成的化学前体或其他化学品分离。因此,这种抗体制剂除了目标抗体以外具有少于约50%、40%、30%、20%、10%、5%或1% (以干重计)的化学前体或化合物。在本发明的优选实施方案中,抗体经分离或纯化。出于本发明的目的,已从生物体的至少一种组分或从抗体在其中天然存在或天然产生的组织或细胞分离或移除的抗体是“分离的抗体”。
如本文所用的术语“回收”是指例如使用本领域众所周知的蛋白纯化技术通过分离使化学物质(诸如多肽)基本上不含天然缔合组分的工艺。
如本文所用,术语“复制子”是指在细胞内起自主多核苷酸复制单元作用的任何遗传元件,诸如质粒、染色体或病毒。
如本文所用,术语“可操作地连接”是指其中所述元件的关系允许其以预期方式发挥功能的情况。例如,“可操作地连接”至编码序列的控制序列的连接方式使得在合适或与该控制序列相容的条件下实现该编码序列的表达。通常,“可操作地连接”意指所连接的DNA序列是邻接的,并在分泌前导序列的情况下是邻接的且处于阅读相中。然而,增强子无需邻接。连接通过在便利限制位点处连接来完成。如果不存在这种位点,则根据常规实践使用合成的寡核苷酸衔接子或接头。
如本文所用,“载体”意指能够在宿主细胞中递送,并且优选表达一种或多种目标基因或序列的构建体。载体的实例包括但不限于病毒载体,裸露DNA或RNA表达载体,质粒,粘粒或噬菌体载体,与阳离子缩合剂缔合的DNA或RNA表达载体,包裹在脂质体中的DNA或RNA表达载体,以及某些真核细胞,诸如生产细胞。
如本文所用,术语“表达控制序列”或“控制序列”是指实现其所连接的编码序列的表达所必需的多核苷酸序列。这种控制序列的性质根据宿主生物体而不同。例如,在原核生物中,这种控制序列通常包括启动子、核糖体结合位点和终止子以及(在一些情况下)增强子。因此,术语“控制序列”意欲最少地包括其存在对于表达必需的所有元件,且也可包括其存在有利的额外元件,例如前导序列。
“宿主细胞”包括可以是或已为载体受体的个体细胞或细胞培养物,所述载体用于并入多核苷酸插入物。宿主细胞包括单一宿主细胞的子代,且子代可以由于天然、偶然或特意突变而未必与原始亲本细胞完全相同(在形态上或在基因组DNA互补物上)。宿主细胞包括在体内用本发明的多核苷酸转染的细胞。
如本文所用,“哺乳动物细胞”包括对源自哺乳动物的细胞的提及,所述哺乳动物包括人、大鼠、小鼠、豚鼠、黑猩猩或猕猴。所述细胞可在体内或体外培养。
如本文所用,术语“纯化的产物”是指已与产物通常所缔合的细胞成分分离和/或自可存在于目标样品中的其他细胞类型分离的产物制剂。
如本文所用,“基本上纯的”是指至少50%纯(即,不含污染物),更优选至少90%纯,更优选至少95%纯,又更优选至少98%纯,且最优选至少99%纯的材料。
如本文所用,术语“治疗(treat)”、“治疗(treating)”或“治疗(treatment)”是用于获得有益或期望临床结果的方法。出于本发明的目的,治疗定义为向受试者(例如患者)施用CD3抗体分子(例如单克隆抗体、双特异性抗体),或向来自受试者的分离组织或细胞施用(例如通过施加)并将其返回至所述受试者。CD3抗体分子可单独或与一种或多种药剂组合施用。治疗可以是治愈、愈合、缓和、缓解、改变、补救、改善、减轻、改善或影响病症、该病症的症状或患该病症(例如癌症)的倾向。
如本文所用,术语“受试者”意欲包括任何动物(例如哺乳动物),包括但不限于人、非人灵长类动物、啮齿动物等,其为特定治疗的受体。例如,受试者可以是具有癌症的患者(例如人患者或兽医学患者)。通常,术语“受试者(subject)”、“个体(individual)”和“患者”在关于人受试者时在本文中可互换使用。
除非另有注明,否则本发明的术语“非人动物”包括所有非人脊椎动物,例如非人哺乳动物和非哺乳动物,诸如非人灵长类动物、绵羊、狗、母牛、鸡、两栖动物、爬行动物、小鼠、大鼠、兔或山羊等。
如本文所用,术语“药学上可接受”是指由联邦政府或州政府管理机构批准(或可批准)或列于美国药典(U.S. Pharmacopeia)或其他公认药典中以用于动物(包括人)中的产物或化合物。
如本文所用,术语“药学上可接受的赋形剂、载体或佐剂”或“可接受的药物载体”是指可与本公开的至少一种抗体一起施用于受试者且不破坏抗体的活性的赋形剂、载体或佐剂。在与抗体一起以足以递送治疗效应的剂量施用时,赋形剂、载体或佐剂应当是无毒的。
如本文所用,术语“改善”意指与不施用本发明的抗体分子相比,一种或多种症状的减轻或改善。“改善”还包括症状的持续时间的缩短或减少。
如本文所用,术语“预防(prevent)”、“预防(preventing)”和“预防(prevention)”是指由于施用预防剂或治疗剂而预防受试者中的病症的一种或多种症状的复发或发作。
如本文所用,“有效量”、“治疗有效量”、“治疗足够量”或“有效剂量”是指治疗剂(例如CD3抗体,单独或作为多特异性抗体(例如双特异性)的一部分)在单剂量或多剂量施用于受试者后以超出不存在此治疗下所预期的水平有效或足以预防、愈合、改善、治疗或管控疾病、病症或副作用或降低疾病或病症的进展速率或延长治愈、缓和、减轻或改善具有如本文所述的病症的受试者的病况的量。该术语在其范围内还包括有效增强正常生理功能的量。有效量可以在施用一种或多种治疗剂的背景下考虑,并且如果与一种或多种其他药剂结合,可以达到或达到期望的结果,则单一试剂可以视为以有效量给予。
如本文所用,有效药剂能够靶向效应T细胞以诱导与疾病(诸如癌症、自身免疫疾病或感染性疾病)相关的细胞的T细胞介导的细胞毒性。本发明的治疗剂通过调节T细胞表面上的CD3抗原、具体而言CD3、更具体而言CD3ε引入T细胞介导的免疫应答。
关于癌症,治疗有效量是指治疗剂通过减缓、中断、停止或终止肿瘤或癌症的生长和/或转移而抑制其生长的量。
功效是治疗剂的活性的量度,其以产生给定强度的效应所需的量表示。与在低浓度下引发较小应答的较低功效的药剂相比,高度强效的药剂在低浓度下引发更大的应答。功效随亲和力和效力而变化。效力是指治疗剂在结合靶标配体后产生生物应答的能力和此应答的定量量级。如本文所用,术语“半最大有效浓度(EC
如本文所用,“组合疗法”或“与...组合”施用是指使用多于一种预防剂和/或治疗剂。术语“组合疗法”或“组合”的使用并不限制将预防剂和/或治疗剂施用于具有病症的受试者的顺序。换言之,组合疗法可以通过分开、依次或同时用治疗剂治疗来进行。在“依次施用”的情况下,第一施用的药剂可以在第二药剂施用或在受试者中变得具有活性时对受试者发挥一些生理效应。
如本文关于预防剂和/或治疗剂的施用所使用的术语“同时施用”是指施用药剂,使得个别药剂同时存在于受试者内。同时施用可通过配制于单一组合物中或于在相同时间或类似时间施用的分开组合物中的分子来实现。依次施用可以根据需要呈任何顺序。
术语“分化簇3”或“CD3”是指多聚蛋白复合物(历史上称为T3复合物),且由以下四条不同多肽链构成:作为三对二聚体(εγ、εδ、ζζ)组装且发挥功能的艾普斯龙(ε)、伽马(γ)、德尔塔(δ)和齐塔(ζ)。CD3复合物充当T细胞共受体,其与T细胞受体(TCR)非共价缔合(Smith-Garvin等人2009)并在T淋巴细胞中生成活化信号。CD3蛋白复合物是T细胞谱系的定义特征,因此CD3抗体可有效地用作T细胞标志物(Chetty和Gatter 1994)。众所周知,CD3抗体经由活化内源性淋巴介质产生来引发细胞毒性T细胞的生成,且能够选择性地杀死肿瘤靶标(Yun等人,Cancer Research, 49: 4770-4774 (1989))。
T细胞在人和动物中的细胞介导的免疫中起中心作用。特定抗原的识别和结合由T细胞的表面上表达的TCR介导。T细胞的TCR能够与结合主要组织相容性复合物(MHC)分子的免疫原性肽(表位)相互作用且呈现于靶细胞的表面上。TCR的特异性结合触发T细胞内部的信号级联,从而导致增殖且分化为成熟的效应T细胞。更具体地,T细胞表达能够诱导抗原特异性免疫应答的TCR复合物(Smith-Garvin等人,2009)。抗原是由能够刺激免疫应答的肿瘤细胞和病毒感染细胞表达的肽。细胞内表达的抗原结合I类主要组织相容性(I类MHC)分子且转运至表面,在此其暴露于T细胞。如果TCR与和抗原复合的I类MHC的结合亲和力是足够的,则将起始免疫突触的形成。经由免疫突触的信号传导经由形成ε/δ、δ/γ和ζ/ζ二聚体的CD3共受体介导。这些二聚体与TCR相关并在T淋巴细胞中产生活化信号。此信号传导级联引导T细胞介导的杀死表达抗原的细胞。细胞毒性通过颗粒酶B和穿孔蛋白从T细胞释放且转移至靶细胞来介导。
如本文所用,“活化T细胞抗原”是指在T淋巴细胞、具体地细胞毒性T淋巴细胞表面上表达的抗原决定簇,其能够在与抗原结合分子相互作用后诱导T细胞活化。具体地,抗原结合分子与活化T细胞抗原的相互作用可通过触发T细胞受体复合物的信号传导级联来诱导T细胞活化。在一个具体实施方案中,活化T细胞抗原是CD3、具体地CD3的ε亚单位(对于人序列,参见UniProt编号P07766 (130版)、NCBI RefSeq编号NP_000724.1、SEQ ID NO: 66)。通常,天然存在的等位基因变体具有与Genbank登录号:BAB71849.1中描述的蛋白至少95%、97%或99%同一性的氨基酸序列。
如本文所用的“T细胞活化”是指T淋巴细胞、具体地细胞毒性T淋巴细胞的一种或多种选自以下的细胞应答:增殖、分化、细胞因子分泌、细胞毒性效应分子释放、细胞毒性活性和活化标志物的表达。本发明的T细胞活化双特异性抗原结合分子能够诱导T细胞活化。适于测量T细胞活化的测定法是本文所述的领域中已知的。
如本文所用,“结合CD3的抗体”、“识别CD3的抗体”、“抗CD3抗体”或“CD3抗体”包括特异性识别单一CD3亚单位(例如ε、δ、γ或ζ)的抗体和其抗原结合片段,以及特异性识别两个CD3亚单位的二聚体复合物(例如γ/ε、δ/ε和ζ/ζ CD3二聚体)的抗体和其抗原结合片段。人CD3ε指示于Genbank登录号NM_000733中。本发明的抗体可结合可溶性CD3和/或细胞表面表达的CD3。可溶性CD3包括天然CD3蛋白以及缺少跨膜结构域或以其他方式不与细胞膜缔合的重组CD3蛋白变体(诸如例如,单体和二聚体CD3构建体)。
针对CD3的抗体能够在T淋巴细胞中产生活化信号。也可使用其他T细胞活化配体,包括但不限于 CD28、CD134、CD137和CD27。
本发明包括结合CD3的单臂抗体。如本文所用,“单臂抗体”意指包含单一抗体重链和单一抗体轻链的抗原结合分子。本发明的单臂抗体可包含如本文表1、2和3中所述的VL/VH或CDR氨基酸序列中的任一者。
本文公开的CD3抗体与所述抗体所源自的相应种系序列相比可在重链和轻链可变结构域的构架和/或CDR区中包含一个或多个氨基酸取代、插入和/或缺失。这种突变可通过将本文公开的氨基酸序列与可从例如公共抗体序列数据库获得的种系序列进行比较而容易地确定。本发明包括源自本文公开的任一氨基酸序列的抗体和其抗原结合片段,其中一个或多个构架和/或CDR区内的一个或多个氨基酸突变为该抗体所源自的种系序列的相应残基、或突变为另一人种系序列的相应残基、或突变为相应种系残基的保守氨基酸取代(这种序列变化在本文中统称为“种系突变”)。本领域普通技术人员以本文公开的重链和轻链可变区序列开始可容易地产生多种包含一个或多个个别种系突变或其组合的抗体和抗原结合片段。在某些实施方案中,VH和/或VL结构域内的所有构架和/或CDR残基均突变回至在抗体所源自的原始种系序列中发现的残基。在一些实施方案中,仅某些残基突变回至原始种系序列,例如仅在FR1的前8个氨基酸内或在FR4的最后8个氨基酸内发现的突变残基或仅在CDR1、CDR2或CDR3内发现的突变残基。在一些进一步实施方案中,构架和/或CDR残基中的一者或多者突变为不同种系序列(即,不同于抗体最初源自的种系序列的种系序列)的相应残基。
此外,本发明的抗体可含有构架和/或CDR区内的两个或更多个种系突变的任何组合,例如其中某些个别残基突变为特定种系序列的相应残基,而与原始种系序列不同的某些其他残基得以维持或突变为不同种系序列的相应残基。一旦获得,可容易地测试含有一个或多个种系突变的抗体的一种或多种期望特性,诸如改善的结合特异性、增加的结合亲和力、改善或增强的拮抗或激动性生物特性(根据具体情况)、降低的免疫原性等。本发明内涵盖以此通用方式获得的抗体。
本发明还包括包含具有一个或多个保守取代的本文公开的VH、VL和/或CDR氨基酸序列中的任一者的变体的CD3抗体。例如,本发明包括具有VH、VL和/或CDR氨基酸序列的CD3抗体,所述氨基酸序列相对于本文表1中所述的VH、VL和/或CDR氨基酸序列中的任一者具有例如 10个或更少、8个或更少、6个或更少、4个或更少等保守氨基酸取代。
如本文所用,术语“复合物”或“复合的”是指彼此经由不是肽键的键和/或力(例如范德华力、疏水力、亲水力)相互作用的两个或更多个分子的缔合。在一个实施方案中,复合物是异多聚的。应理解,如本文所用的术语“蛋白复合物”或“多肽复合物”包括具有与蛋白复合物中的蛋白缀合的非蛋白实体(例如包括但不限于化学分子、诸如毒素或检测剂)的复合物。
如本文所用,“CD3抗体”包括具有单一特异性的单价抗体,以及“双特异性抗体”、“双重特异性抗体”、“三特异性抗体”、“双功能抗体”、“异多聚体”、“异多聚复合物”、“双特异性异二聚双抗体”、“异多聚多肽”或双特异性异二聚IgG。在本发明的一些实施方案中,本发明的CD3抗体是人或人源化抗体。
如本文所用,“双特异性抗体”是包含至少第一多肽和第二多肽的分子,其中所述第二多肽在氨基酸序列中与第一多肽相差至少一个氨基酸残基。在一些情况下,双特异性抗体是具有两个不同重链区和轻链区的人工杂合抗体。优选地,双特异性抗体对至少两种不同配体、抗原或结合位点具有结合特异性。因此,双特异性抗体可以同时结合两种不同抗原。双特异性抗体的两个抗原结合位点结合可驻留于相同或不同蛋白靶标(例如肿瘤靶标)上的两个不同表位。
如本文所用,“双特异性抗体”的第一多肽链和第二多肽链包含至少一个抗体VL和一个抗体VH区或其片段,其中两个抗体结合结构域均包含在单一多肽链内且其中每一多肽链中的VL和VH区来自不同抗体。
双特异性抗体可源自全长抗体或抗体片段(例如F(ab')2双特异性抗体)。双抗体更充分地描述于例如 EP404,097;WO93/11161;和Hollinger等人,Proc. Natl. Acad.Sci. USA 90:6444-6448, 1993中。双特异性抗体是两个“交叉”sFv片段的异二聚体,其中两种抗体的VH和VL区存在于不同多肽链上。
如本文所用,术语“连接”、“融合”、“融合物”、“共价结合”、“共价偶联”和“基因融合”可互换使用。这些术语是指通过包括化学缀合或重组方式在内的任何方式将两个或更多个元件或组分连接在一起。如本文所用,术语“共价结合”意指指定部分彼此直接共价键合,或者经由一个或多个插入部分(诸如连接肽或部分)彼此间接共价接合。在一个优选实施方案中,部分是共价融合的。一种类型的共价键联是肽键。化学缀合的方法(例如使用异双官能交联剂)是本领域已知的。融合部分也可以是基因融合的。如本文所用,术语“基因融合”、“基因连接”或“基因融合”是指经由编码两种或更多种蛋白、多肽或片段的单一多核苷酸分子的基因表达,那些蛋白、多肽或其片段经由其个别肽主链的共线性、共价键联或连接。此遗传融合导致单一邻接基因序列的表达。优选的基因融合是框内的,即两个或更多个开放阅读框(ORF)以维持原始ORF的正确阅读框的方式融合以形成连续更长的ORF。因此,所得重组融合蛋白是含有两个或更多个对应于由原始ORF编码的多肽的蛋白区段(所述区段天然通常不会如此接合)的单一多肽。在此情况中,该单一多肽在处理期间裂解以产生包含两条多肽链的二聚体分子。
如本文所用,术语“连接(linked)”或“连接(links)”是指第一和第二氨基酸序列之间的直接肽键键联,或涉及第三氨基酸序列的键联,所述第三氨基酸序列肽键合至第一和第二氨基酸序列并键合在第一和第二氨基酸序列之间。例如,接头肽键合至一个氨基酸序列的C末端和另一氨基酸序列的N末端。
如本文所用,术语“接头”是指长度为两个或更多个氨基酸的氨基酸序列。接头可由中性极性或非极性氨基酸组成。接头的长度可以是例如 2至100个氨基酸,诸如长度在2和50个氨基酸之间,诸如长度为3个、5个、10个、15个、20个、25个、30个、35个、40个、45个或50个氨基酸。接头可以是“可裂解”的,例如通过自裂解、或酶促裂解或化学裂解。氨基酸序列中的裂解位点以及在这种位点处裂解的酶和化学品是本领域众所周知的且也描述于本文中。
如本文所用,术语“二硫键”或“半胱氨酸-半胱氨酸二硫键”是指两个半胱氨酸之间的共价相互作用,其中所述半胱氨酸的硫原子经氧化以形成二硫键。与氢键的1-2千卡/mol相比,二硫键的平均键能为约60千卡/mol。在本发明的背景下,形成二硫键的半胱氨酸在单链抗体的构架区内并用于稳定抗体的构象。可例如通过定点诱变引入半胱氨酸残基,使得可在分子内产生稳定二硫键。
“杵于臼中名称”类似于“突起和腔”名称,且可互换使用。
“突起”或“杵”是指至少一个以下氨基酸侧链:从第一多肽的界面伸出,且因此可定位于邻近界面(即第二多肽的界面)中的补偿性腔中以稳定异二聚体,且由此例如使异二聚体形成优于同二聚体形成。突起可存在于原始界面中或可以合成引入(例如通过改变编码界面的核酸)。通常,编码第一多肽的界面的核酸经改变以编码突起。为实现此目的,用编码至少一个侧链体积大于原始氨基酸残基的“输入”氨基酸残基的核酸替代编码第一多肽的界面中的至少一个“原始”氨基酸残基的核酸。替代的原始残基数的上限是第一多肽的界面中的总残基数。用于形成突起的某些输入残基通常是天然存在的氨基酸残基且优选选自精氨酸(R)、苯丙氨酸(F)、酪氨酸(Y)和色氨酸(W)。
突起或杵“可定位”于腔或臼中,这意味着分别在第一多肽和第二多肽的界面上的突起和腔的空间位置和突起和腔的大小使得突起可在不显著扰乱第一多肽和第二多肽在界面处的正常缔合的情况下位于腔中。由于突起、诸如苯丙氨酸(F)、酪氨酸(Y)和色氨酸(W)通常不从界面的轴垂直延伸,突起与相应腔的比对依赖于基于三维结构(诸如通过X射线结晶学或核磁共振(NMR)获得的结构)对突起/腔对建模。这可使用本领域公认的技术来实现。
“腔”或“臼”是指至少一个氨基酸侧链,其从第二多肽的界面凹进且因此容纳第一多肽的邻近界面上的相应突起。腔可存在于原始界面中或可以合成引入(例如通过改变编码该界面的核酸)。通常,改变编码第二多肽的界面的核酸以编码腔。为实现此目的,用编码至少一个侧链体积小于原始氨基酸残基的“输入”氨基酸残基的DNA替代编码第二多肽的界面中的至少一个“原始”氨基酸残基的核酸。替代的原始残基数的上限是第二多肽的界面中的总残基数。用于形成腔的某些输入残基通常是天然存在的氨基酸残基且优选选自丙氨酸(A)、丝氨酸(S)、苏氨酸(T)和缬氨酸(V)。
如本文所用的“靶抗原”、“靶细胞抗原”、“肿瘤抗原”或“肿瘤特异性抗原”是指在靶细胞(例如肿瘤中的细胞(诸如癌细胞)或肿瘤基质的细胞)的表面上呈现的抗原决定簇。
如本文所用,术语“癌症”或“癌性”是指或描述哺乳动物中的生理病况,其特征通常在于不受调控的细胞生长、源自细胞的异常不受控生长的赘生物或肿瘤。在一些方面,癌症是指没有转移的恶性原发性肿瘤,其仍然为局部的。在其他方面,癌症是指恶性肿瘤,其已侵袭且破坏相邻身体结构且扩散至远处部位。在一些方面,癌症与特定癌症抗原相关。癌症的实例包括但不限于以下部位的癌症:口腔和咽、消化系统(例如食道、胃、小肠、结肠、直肠、肝、胆囊、胆管和胰腺)、呼吸系统(例如喉、肺和支气管,包括非小细胞肺癌)、骨和关节(例如骨转移)、软组织、皮肤(例如黑色素瘤)、乳房、生殖系统(例如子宫颈、子宫体、卵巢、阴户、阴道、前列腺和睾丸)、泌尿系统(例如膀胱、肾、肾盂和输尿管)、眼睛和眼眶、脑和神经系统(例如神经胶质瘤)、头颈部或内分泌系统(例如甲状腺)。癌症也可以是淋巴瘤(例如霍奇金氏病(Hodgkin's disease)和非霍奇金氏淋巴瘤)、多发性骨髓瘤或白血病(例如急性淋巴细胞性白血病、慢性淋巴细胞性白血病、急性骨髓性白血病、慢性骨髓性白血病等)。在某些实施方案中,消化系统的癌症是食道、胃、小肠、结肠、直肠、肝、胆囊、胆管和胰腺的癌症。
关于癌症,治疗在以下中的任何一者或多者中是有用的:(a) 治疗、预防或改善与受试者中的与恶性细胞相关的病况(例如胃肠相关的癌症,诸如结肠直肠癌(CRC))的一种或多种症状;(b) 抑制具有表达肿瘤抗原的恶性肿瘤的受试者中的肿瘤生长或进展;(c)抑制具有一种或多种表达肿瘤抗原的恶性细胞的受试者中的表达肿瘤抗原的癌症(恶性)细胞的转移;(d) 诱导表达肿瘤抗原的肿瘤的消退(例如长期消退);(e)在表达肿瘤抗原的恶性细胞中发挥细胞毒性活性;(f) 增加具有肿瘤抗原相关的病症的受试者的无进展存活;(g) 增加具有肿瘤抗原相关的病症的受试者的总体存活;(h)在具有肿瘤抗原相关的病症的受试者中减少使用额外化学治疗剂或细胞毒性剂;(i) 降低具有肿瘤抗原相关的病症的受试者中的肿瘤负荷;或(j) 阻断肿瘤抗原与其他尚未鉴定的因子的相互作用。尽管不希望受理论束缚,但据信治疗在体外或体内抑制、消融或杀死细胞或以其他方式降低细胞(包括异常细胞)介导病症(例如如本文所述的病症(诸如癌症))的能力。
如本文所用,术语“恶性细胞”或“恶性病”是指侵袭性和/或能够经历转移的肿瘤或肿瘤细胞,即癌细胞。
尽管可在本发明的实践或测试中使用与本文所述的那些类似或等效的任何材料和方法,但现在描述优选材料和方法。
已描述用于产生抗体的各种技术,其包括用于制备单克隆抗体的传统杂交瘤方法、用于制备抗体(包括嵌合抗体,例如人源化抗体)的重组技术、在转基因动物中的抗体产生和最近描述的用于制备“全人”抗体的噬菌体展示技术。下文简要描述这些技术。
针对目标抗原的多克隆抗体通常可在动物中通过多次皮下(sc)或腹膜内(ip)注射抗原和佐剂来产生。使用双官能试剂或衍生剂,例如,马来酰亚胺基苯甲酰基磺基琥珀酰亚胺酯(通过半胱氨酸残基缀合)或N-羟基琥珀酰亚胺(通过赖氨酸残基),抗原(或含有靶氨基酸序列的片段)可以与蛋白(所述蛋白在待免疫的物种中是免疫原性的,例如血清白蛋白、牛甲状腺球蛋白或大豆胰蛋白酶抑制剂)缀合。针对免疫原性缀合物或衍生物免疫动物,且数周后通过在多个部位皮下注射对动物加强免疫。7至14天后,抽取动物血液且测定血清的抗体滴度。对动物加强免疫,直至达到滴度平台期。优选地,用相同抗原的缀合物(但缀合至不同蛋白和/或通过不同交联试剂)对动物加强免疫。缀合物也可在重组细胞培养物中作为蛋白融合物制备。此外,使用聚集剂(诸如明矾)来增强免疫应答。
单克隆抗体可使用首先由Kohler和Milstein,Nature 256:495, 1975描述的杂交瘤方法从基本上均质的抗体群体获得或可通过重组DNA方法(Cabilly等人,美国专利号4,816,567)来制得。在杂交瘤方法中,如上文所述对小鼠或其他适当宿主动物实施免疫以引发产生或能够产生将特异性地结合用于免疫的蛋白的抗体的淋巴细胞。或者,可在体外对淋巴细胞实施免疫。然后使用合适融合剂(诸如聚乙二醇)使淋巴细胞与骨髓瘤细胞融合以形成杂交瘤细胞(Goding, Monoclonal Antibodies: Principles and Practice,第59-103页(Academic Press, 1986)。将因此制备的杂交瘤细胞接种于优选含有一种或多种抑制未融合的亲本骨髓瘤细胞的生长或存活的物质的合适培养基中且使其在其中生长。另外,杂交瘤细胞可在体内作为动物中的腹水肿瘤生长。通过常规免疫球蛋白纯化程序将由亚克隆分泌的单克隆抗体与培养基、腹水或血清合适地分离,所述纯化程序诸如例如蛋白A-Sepharose、羟基磷灰石层析、凝胶电泳、透析或亲和层析。
抗体、抗体的抗原结合片段或任一抗体构建体的表达可在适当原核或真核宿主细胞(如CHO细胞、NSO细胞、SP2/0细胞、HEK293细胞、COS细胞、PER.C6细胞、酵母或大肠杆菌细胞)中进行,且从所述细胞(细胞培养上清液、调节的细胞培养上清液、细胞裂解物或澄清批量物)回收和收获分泌的抗体。用于产生抗体的通用方法是现有技术众所周知的且描述于例如以下综述文章中:Makrides, S.C., Protein Expr. Purif. 17:183-202, 1999;Geisse, S., 等人, Protein Expr. Purif. 8:271-282, 1986; Kaufman, R.J., MoI.Biotechnol. 16:151-160, 2000; Werner, R.G., Drug Res. 48:870-880, 1998。在一个具体实施方案中,细胞培养物是哺乳动物细胞培养物,例如中国仓鼠卵巢(CHO)细胞培养物。
在一个实施方案中,抗体可以从天然产生的来源回收或分离。在一些这种实施方案中,分离或回收的抗体可通过使用本领域已知的常规层析方法经受额外纯化步骤。具体而言,预期纯化方法包括但不限于亲和层析(例如蛋白A亲和层析)、离子交换层析(例如阴离子交换层析或阳离子交换层析)、疏水性相互作用层析、羟磷灰石层析、凝胶过滤层析和/或透析。在那些中,优选的纯化方法是使用蛋白A层析。亲和配体连接的基质最经常为琼脂糖,但可使用其他基质。
本领域也已知用于抗体纯化的其他技术,诸如离子交换柱上的分级分离、乙醇沉淀、反相高压层析、乙醇沉淀、反相HPLC、二氧化硅上的层析、肝素Sepharose™上的层析、阴离子或阳离子交换树脂(诸如多聚天冬氨酸柱)上的层析、层析聚焦、使用SDS-PAGE的电泳和硫酸铵沉淀。以上纯化方法列表在本质上仅为示例性的,且不意欲为限制性列举。
或者,可产生转基因动物(例如小鼠),所述转基因动物在免疫后能够在不存在内源性免疫球蛋白产生的情况下产生完整人抗体库。例如,已描述在嵌合和种系突变小鼠中抗体重链连接区(J.sub.H)基因的纯合缺失导致内源性抗体产生的完全抑制。将人种系免疫球蛋白基因阵列转入这种种系突变小鼠中将在抗原攻击后导致人抗体的产生。参见,例如,Jakobovits等人,Proc. Natl. Acad. Sci. USA 90:2551-255;1993 和Jakobovits等人, Nature 362:255-258, 1993)。
在一些实施方案中,本发明的抗体可经人源化,其保留针对抗原的高亲和力和其他有利生物特性。用于使非人抗体人源化的方法是本领域众所周知的。人源化可基本上遵循Winter和合作者的方法(Jones等人, Nature 321:522-525, 1986; Riechmann等人,Nature 332:323-327, 1988; Verhoeyen等人, Science 239:1534-1536, 1988),通过用啮齿动物CDR或CDR序列取代人抗体的相应序列来进行。因此,这种人源化抗体是嵌合抗体(Cabilly,同上),其中基本上少于一个完整人可变结构域已由来自非人类物种的相应序列取代。实际上,人源化抗体通常为人抗体,其中一些CDR残基和可能一些FR残基由来自啮齿动物抗体中类似位点的残基取代。重要的是,抗体被人源化,其保留对抗原的高亲和力和其他有利生物特性。为实现此目标,根据优选方法,通过使用亲本和人源化序列的三维模型分析亲本序列和各种概念性人源化产物的工艺来制备人源化抗体。三维免疫球蛋白模型是本领域技术人员熟悉的。可使用计算机程序,所述计算机程序举例说明且展示所选候选免疫球蛋白序列的可能的三维构象结构。观察这些展示内容允许分析残基在候选免疫球蛋白序列的发挥功能中的可能作用,即分析影响候选免疫球蛋白结合其抗原的能力的残基。以此方式,可以从共有和输入序列选择FR残基且合并,使得实现期望抗体特性,诸如对靶抗原的亲和力增加。关于进一步细节,参见1992年12月23日公开的WO92/22653。
也可使用本领域已知的各种噬菌体展示方法来生成本发明的抗体。在噬菌体展示方法中,功能性抗体结构域展示于携带编码其的多核苷酸序列的噬菌体颗粒的表面上。在具体方面,可利用此噬菌体以展示从库或组合抗体文库(例如人或鼠)表达的抗原结合结构域(诸如Fab和Fv或二硫键稳定的Fv)。可用抗原(例如使用标记的抗原或结合或捕获至固体表面或珠粒的抗原)选择或鉴定表达结合目标抗原的抗原结合结构域的噬菌体。这些方法中使用的噬菌体通常是丝状噬菌体,包括fd和M13。抗原结合结构域表达为与噬菌体基因III或基因VIII蛋白重组融合的蛋白。可用于制备本发明的免疫球蛋白或其片段的噬菌体展示方法的实例包括Brinkmann等人,"Phage Display Of Disulfide-Stabilized FvFragments," J. Immunol. Methods, 182:41-50, 1995中所公开的那些。
多种IgG同种型和其结构域的功能特性是本领域众所周知的。IgG1、IgG2、IgG3和IgG4的氨基酸序列是本领域已知的。用于本发明的方法中的来自特定IgG同种型的两个或更多个结构域的选择和/或组合可基于亲本同种型的任何已知参数(包括对FcγR的亲和力)。例如,使用来自表现出对FcγRIIB有限结合或无结合的IgG同种型(例如IgG2或IgG4)的区或结构域可尤其用于其中期望工程改造双特异性抗体以使与活化受体的结合最大化且使与抑制性受体的结合最小化的情况。类似地,使用来自已知优先结合C1q或FcγRIIIA的IgG同种型(例如IgG3)的Fc链或结构域可与本领域已知增强抗体依赖性细胞介导的细胞毒性(ADCC)和/或补体依赖性细胞毒性(CDC)的Fc氨基酸修饰组合以工程改造双特异性抗体,使得效应子功能活性(例如补体活化或ADCC)最大化。以类似方式,可在IgG同种型的Fc链或结构域中进行突变,其最小化或消除Fc链的效应子功能。
在发现过程期间,抗体的生成和表征可阐明关于期望表位的信息。根据此信息,则可针对与相同表位的结合竞争性地筛选抗体。实现此目的的方法是进行竞争和交叉竞争研究以寻找彼此竞争或交叉竞争的抗体(例如竞争结合抗原的抗体)。一种方法是鉴定抗体结合的表位,或“表位定位”。存在本领域已知用于作图且表征蛋白上的表位的位置的许多方法,包括解析抗体-抗原复合物的晶体结构、竞争性测定、基因片段表达测定和基于合成肽的测定,如例如Harlow和Lane,Using Antibodies,a Laboratory Manual,Cold SpringHarbor Laboratory Press,Cold Spring Harbor,N.Y.,1999的第11章中所述。在一个额外实例中,表位作图可以用于测定抗体结合的序列。表位作图从各种来源商购可得,例如,Pepscan Systems(Edelhertweg 15,8219 PH Lelystad,荷兰)。在一个额外实例中,可以进行抗原结合结构域的诱变、结构域交换实验和丙氨酸分区诱变,以鉴定对于表位结合需要、足够和/或必需的残基。结合亲和力和抗原结合结构域相互作用的解离速率可通过竞争性结合测定来测定。竞争性结合测定的一个实例是放射免疫测定,其包括孵育标记的抗原且检测与标记的抗原结合的分子。本发明的分子对抗原的亲和力和结合解离速率可通过Scatchard分析从饱和数据确定。
本发明的抗体对抗原的亲和力和结合特性可首先使用本领域已知用于抗原结合结构域的体外测定(基于生物化学或免疫的测定)来测定,所述体外测定包括但不限于酶联免疫吸附测定(ELISA)测定法、表面等离振子共振(SPR)测定法、生物层干涉量度学或免疫沉淀测定法。本发明的分子在体内模型(诸如本文所述和公开的那些)中可具有与基于体外的测定中的那些类似的结合特性。然而,本发明并不排除在基于体外的测定中不表现出期望表型、但在体内表现出期望表型的本发明的分子。
一旦已获得编码本发明的分子(即,结合结构域)的核酸序列,就可使用本领域众所周知的技术通过重组DNA技术来产生用于产生所述分子的载体。
编码本发明的抗体结合结构域的多核苷酸可包括可操作地连接至抗体编码序列的表达控制多核苷酸序列,包括本领域已知的天然缔合或异源启动子区。表达控制序列可以是能够转化或转染真核宿主细胞的载体中的真核启动子系统,但也可使用原核宿主的控制序列。一旦载体已并入适当宿主细胞系中,使宿主细胞在适于表达核苷酸序列的条件下繁殖,且根据需要用于收集且纯化抗体。真核细胞系包括CHO细胞系、各种COS细胞系、HeLa细胞、骨髓瘤细胞系、转化的B细胞或人胚肾细胞系。
在一些实施方案中,编码本发明的抗体的DNA使用常规程序(例如,通过使用能够特异性结合编码鼠抗体的重链和轻链的基因的寡核苷酸探针)分离且测序。本发明的杂交瘤细胞充当这种DNA的优选来源。一旦分离,就可以将DNA置于表达载体中,然后将所述表达载体转染至否则不产生免疫球蛋白蛋白的宿主细胞(诸如猿猴COS细胞、CHO细胞或骨髓瘤细胞)内,以获得在重组宿主细胞中的单克隆抗体合成。还可以例如通过用人重链和轻链恒定结构域的编码序列代替同源鼠序列来修饰DNA (Morrison等人,Proc. Nat. Acad. Sci.81:6851,1984)。以该方式,制备具有本文的抗抗原单克隆抗体的结合特异性的嵌合抗体。
在一个方面,本发明提供了特异性结合CD3 (例如全长人CD3 ε亚单位(例如登录号NP_000724或SEQ ID NO: 66))的试剂。
在某些实施方案中,CD3抗体特异性结合人CD3。
本发明的示例性CD3抗体列于本文的表1、2和3中。表1示出VH区和VL区的氨基酸序列标识符。在一些实施方案中,提供了具有如表1中列出的部分轻链序列中的任一者和/或如表1中列出的部分重链序列中的任一者的抗体。
表 1
在表1中,加下划线的序列是根据Kabat的CDR序列,且呈粗体的序列是根据Chothia的CDR序列。
本发明提供了针对CD3的抗体的CDR部分(包括Chothia、Kabat CDR和CDR接触区)。用于鉴定VH和VL氨基酸序列内的CDR的方法和技术是本领域众所周知的,且可用于鉴定本文公开的指定VH和/或VL氨基酸序列内的CDR。可用于鉴定CDR的边界的示例性惯例包括例如 Kabat定义、Chothia定义和AbM定义。一般而言,Kabat定义基于序列可变性,Chothia定义基于结构环区的位置,且AbM定义是Kabat和Chothia方法之间的折衷。参见,例如,Kabat,"Sequences of Proteins of Immunological Interest," National Institutes ofHealth, Bethesda, Md. (1991 ); Al-Lazikani等人, J. Mol. Biol. 273:927-948(1997); 和Martin等人, Proc. Natl. Acad. Sci. USA 86:9268-9272 (1989)。也可使用公共数据库来鉴定抗体内的CDR序列。应理解,在一些实施方案中,CDR可以是Kabat和Chothia CDR的组合(也称为“组合的CR”或“延伸的CDR”)。在一些实施方案中,CDR是KabatCDR。在一些进一步实施方案中,CDR是Chothia CDR。换言之,在具有超过一个CDR的实施方案中,CDR可以是Kabat、Chothia、组合CDR或其组合中的任一种。表2和3提供了本文提供的CDR序列的实例。
在一个实施方案中,本发明提供了包含表1中所列的氨基酸序列或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的其基本上类似序列的抗体。
在一些这种实施方案中,本发明提供了包含VL区的抗体,所述VL区包含表1中所列的任一VL区氨基酸序列的氨基酸序列或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的其基本上类似序列。
在一些其他这种实施方案中,本发明提供了包含VH区的抗体,所述VH区包含表1中所列的任一VH区氨基酸序列的氨基酸序列或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的其基本上类似序列。
在一个实施方案中,提供了特异性结合CD3的抗体,其中所述抗体包含:(a) 重链可变(VH)区,其包含SEQ ID NO: 2、4、5、7、10、12或35中所示的VH序列的VH互补决定区1(VH CDR1)、VH互补决定区2 (VH CDR2)和VH互补决定区3 (VH CDR3);和/或(b) 轻链可变(VL)区,其包含SEQ ID NO: 1、3、6、8、9、11、34、87或89中所示的VL序列的VL互补决定区1(VL CDR1)、VL互补决定区2 (VL CDR2)和VL互补决定区3 (VL CDR3)。
在一个实施方案中,本发明提供了包含六个CDR的集合(即,VL CDR1、VL CDR2、VLCDR3、VH CDR1、VH CDR2、VH CDR3)的抗体,所述CDR含于如由表1中所列的任一示例性CD3抗体所定义的VL/VH氨基酸序列对内。
在具体实施方案中,本发明提供了包含VL CDR1、VL CDR2、VL CDR3、VH CDR1、VHCDR2或VH CDR3氨基酸序列集合的抗体,该氨基酸序列集合含于选自以下的VL/VH氨基酸序列对内:SEQ ID NO:1和2 (例如,2B5-0001 (2B5));SEQ ID NO:3和2 (2B5-0002);SEQ IDNO:3和4 (例如,2B5-0006 (2B5v6));SEQ ID NO:3和5 (例如,2B5-0009);SEQ ID NO:6和7(例如,2B5-0517);SEQ ID NO:8和7 (例如,2B5-0522); SEQ ID NO:6和4 (例如,2B5-0533);SEQ ID NO:8和4 (例如,2B5-0538);SEQ ID NO:9和10 (例如,2B5-0598);SEQ IDNO:9和7 (例如,2B5-0623);SEQ ID NO:11和12 (例如,2B5-0707);SEQ ID NO:34和35 (例如,2B5-0003);SEQ ID NO:85和2 (例如,H2B4);SEQ ID NO:9和4 (例如,2B5-1038);SEQID NO:87和4 (例如,2B5-1039);和SEQ ID NO:89和4 (例如,2B5-1040)。
表2示出示例性CD3抗体的VH CDR1、VH CDR2和VH CDR3区。
表 2
在一个实施方案中,本发明提供了包含VH CDR1的抗体,所述VH CDR1包含表2中所列的任一VH CDR1氨基酸序列的氨基酸序列或具有至少90%、至少95%、至少98%或至少99%序列同一性的其基本上类似序列。
在另一个实施方案中,本发明提供了包含VH CDR2的抗体,所述VH CDR2包含表2中所列的任一VH CDR2氨基酸序列的氨基酸序列或具有至少90%、至少95%、至少98%或至少99%序列同一性的其基本上类似序列。
在又另一个实施方案中,本发明提供了包含VH CDR3的抗体,所述VH CDR3包含表2中所列的任一VH CDR3氨基酸序列的氨基酸序列或具有至少90%、至少95%、至少98%或至少99%序列同一性的其基本上类似序列。
表3示出示例性CD3抗体的VL CDR1、VL CDR2和VL CDR3。
表 3
在一个实施方案中,本发明提供了包含VL CDR1的抗体,所述VL CDR1包含表3中所列的任一VL CDR1氨基酸序列的氨基酸序列或具有至少90%、至少95%、至少98%或至少99%序列同一性的其基本上类似序列。
在另一个实施方案中,本发明提供了包含VL CDR2的抗体,所述VL CDR2包含表3中所列的任一VL CDR2氨基酸序列的氨基酸序列或具有至少90%、至少95%、至少98%或至少99%序列同一性的其基本上类似序列。
在又另一个实施方案中,本发明提供了包含VL CDR3的抗体,所述VL CDR3包含表3中所列的任一VL CDR3氨基酸序列的氨基酸序列或具有至少90%、至少95%、至少98%或至少99%序列同一性的其基本上类似序列。
在一些实施方案中,提供了特异性结合CD3的抗体,其中所述抗体包含:(a) 重链(HC)可变(VH)区,其包含具有选自SEQ ID NO: 2、4、5、7、10、12和35的氨基酸序列的VH的VH互补决定区1 (CDR1)、VH互补决定区2 (VH CDR2)和VH互补决定区3 (VH CDR3);和/或(b)轻链(LC)可变(VL)区,其包含具有选自SEQ ID NO: 1、3、6、8、9、11、34、87和89的氨基酸序列的VL的VL互补决定区1 (VL CDR1)、VL互补决定区2 (VL CDR2)和VL互补决定区3 (VLCDR3)。
在具体实施方案中,所述抗体包含:(a) VH区,其包含(i) 包含SEQ ID NO: 13、14或15的序列的VH CDR1;(ii) 包含SEQ ID NO: 16、17、19、20、21、22、23或24的序列的VHCDR2;和(iii) 包含SEQ ID NO: 18或25的序列的VH CDR3;和/或(b) VL区,其包含(i) 包含SEQ ID NO: 26、29、30、32、91或92的序列的VL CDR1;(ii) 包含SEQ ID NO: 27或31的序列的VL CDR2;和(iii) 包含SEQ ID NO: 28或33的序列的VL CDR3。
在某些实施方案中,本发明提供了结合CD3并且与如本文所述的抗体竞争的抗体,包括2B5-0001 (2B5)、2B5-0002、2B5-0006 (2B5v6)、2B5-0009、2B5-0517、2B5-0522、2B5-0533、2B5-0538、2B5-0598、2B5-0623、2B5-0707、2B5-0003、2B5-1038、2B5-1039和2B5-1040。
在一些实施方案中,本发明还提供了基于CDR接触区的CD3抗体的CDR部分。CDR接触区是使抗体具有对于抗原的特异性的抗体区域。通常,CDR接触区包括在CDR和Vernier区中的残基位置,其受约束以便维持适当的环结构用于抗体结合特异性抗原。参见例如,Makabe等人,J. Biol. Chem.,283:1156-1166,2007。CDR接触区的测定完全在本领域的技术内。
本文提供的某些CD3抗体可由多于一种名称来指代。例如,2B5-0001可称为2B5或h2B5;且2B5-0006可称为2B5v6或h2B5v6。表4显示抗体的形式和存在于如本文所公开的抗体中的CD3抗体区。
表 4
如本文所述的抗体与CD3(诸如人CD3ε(例如SEQ ID NO:40)的结合亲和力(K
在一个方面,本发明提供了抗体或药物组合物,其用于调节有此需要的受试者中的T细胞介导的免疫应答的方法中。在具体实施方案中,本发明提供了抗体或药物组合物,其用于抑制受试者中的肿瘤细胞的生长的方法中。
在另一个方面,本发明提供了用于治疗癌症的抗体或药物组合物,任选地,其中所述癌症选自:乳腺癌、卵巢癌、甲状腺癌、前列腺癌、宫颈癌、肺癌、膀胱癌、子宫内膜癌、头颈癌、睾丸癌、胶质母细胞瘤癌和消化系统的癌症。
在又另一个方面,本发明提供了用于治疗癌症的抗体或药物组合物,其中T细胞介导的免疫应答被调节或其中肿瘤细胞的生长被抑制。
本发明还提供了编码CD3抗体或其部分的核酸分子。例如,本发明提供了编码表1中所列的任一VH或VL氨基酸序列或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的其基本上类似序列的核酸分子。
本发明还提供了编码表2中所列的任一VH CDR1、VH CDR2或VH CDR3氨基酸序列或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的其基本上类似序列的核酸分子。
本发明还提供了编码表3中所列的任一VL CDR1、VL CDR2或VL CDR3氨基酸序列或与其具有至少90%、至少95%、至少98%或至少99%序列同一性的其基本上类似序列的核酸分子。
本发明还提供了编码HC VR的核酸分子,其中所述VH包含三个CDR(即,VH CDR1、VHCDR2或VH CDR3)的集合,其中所述VH CDR1、VH CDR2和VH CDR3氨基酸序列集合如由表2中所列的任一示例性CD3抗体所定义。
本发明还提供了编码LC VR的核酸分子,其中所述VL包含三个CDR(即,VL CDR1、VLCDR2或VL CDR3)的集合,其中所述VL CDR1、VL CDR2和VL CDR3氨基酸序列集合如由表3中所列的任一示例性CD3抗体所定义。
本发明还提供了编码VH和VL两者的核酸分子,其中所述VH包含表1中所列的任一VH氨基酸序列的氨基酸序列,且其中所述VL包含表1中所列的任一VL氨基酸序列的氨基酸序列。
本发明还提供了能够表达包含CD3抗体的重链或轻链可变区的多肽的重组表达载体。例如,本发明包括包含上文所提及的任一核酸分子(即,编码表1中所示的任一VH和VL的核酸分子和/或如表2或3中所示的CDR序列)的重组表达载体。本发明的范围内还包括其中已引入这种载体的宿主细胞,以及通过使所述宿主细胞在允许产生抗体或抗体片段的条件下培养和回收如此产生的所述抗体和抗体片段的产生所述抗体或其部分方法。
在某些实施方案中,多核苷酸包含编码如表4中所列的以下抗体的重链和/或轻链可变区的序列:2B5-0001 (2B5)、2B5-0002、2B5-0006 (2B5v6)、2B5-0009、2B5-0517、2B5-0522、2B5-0533、2B5-0538、2B5-0598、2B5-0623、2B5-0707、2B5-0003、2B5-1038、2B5-1039或2B5-1040。
可以将编码目标抗体的序列维持在宿主细胞中的载体中,且然后可以将该宿主细胞扩增且冷冻用于未来使用。载体(包括表达载体)和宿主细胞在本文中进一步描述。
与任何这种序列互补的多核苷酸也由本发明涵盖。在一个方面,本发明提供了制备本文所述的任一多核苷酸的方法。多核苷酸可以是单链(编码或反义)或双链的,并且可以是DNA(基因组、cDNA或合成的)或RNA分子。RNA分子包括HnRNA分子,其含有内含子且以一对一方式对应于DNA分子;和mRNA分子,其不含内含子。额外的编码序列或非编码序列可以但不必存在于本发明的多核苷酸内,并且多核苷酸可以但不必与其他分子和/或支持材料连接。
多核苷酸可以包含天然序列(即,编码抗体或其一部分的内源序列),或可以包含这种序列的变体。多核苷酸变体含有一个或多个取代、添加、缺失和/或插入,使得相对于天然免疫反应性分子,编码多肽的免疫反应性并不减小。一般可以如本文所述评价对编码多肽的免疫反应性的作用。变体优选表现出与编码天然抗体或其一部分的多核苷酸序列至少约70%的同一性,更优选至少约80%的同一性,又更优选至少约90%的同一性,且最优选至少约95%的同一性。
可以使用化学合成、重组方法或PCR获得本发明的多核苷酸。化学多核苷酸合成的方法是本领域众所周知的,并且无需在本文中详细描述。本领域技术人员可以使用本文提供的序列和商业DNA合成仪,以产生期望的DNA序列。
为了使用重组方法制备多核苷酸,可以将包含期望序列的多核苷酸插入合适的载体内,并且进而可以将该载体引入合适的宿主细胞内用于复制和扩增,如本文进一步讨论的。可以通过本领域已知的任何手段,将多核苷酸插入宿主细胞内。通过直接摄取、内吞、转染、F-接合或电穿孔,通过引入外源多核苷酸来转化细胞。一旦引入,外源多核苷酸就可以作为非整合载体(诸如质粒)维持在细胞内、或整合到宿主细胞基因组内。如此扩增的多核苷酸可以通过本领域众所周知的方法从宿主细胞中分离。参见例如,Sambrook等人,1989。
或者,PCR允许DNA序列的复制。PCR技术是本领域众所周知的,并且在美国专利号4,683,195、4,800,159、4,754,065和4,683,202以及PCR: The Polymerase ChainReaction,Mullis等人编辑,Birkauswer Press,Boston,1994中描述。
通过使用在适当载体中的分离的DNA,并且将其插入适当的宿主细胞内,可以获得RNA。当细胞复制并且DNA被转录成RNA时,然后可以使用本领域技术人员众所周知的方法,例如如Sambrook等人,1989,同上中所述分离RNA。
合适的克隆载体可以根据标准技术构建,或者可以选自本领域中可获得的大量克隆载体。尽管选择的克隆载体可以根据预期使用的宿主细胞而变化,但有用的克隆载体将通常具有自我复制的能力,可能具有用于特定限制性核酸内切酶的单一靶标,和/或可能携带关于可以用于选择含有该载体的克隆中的标记物的基因。合适的实例包括质粒和细菌病毒,例如pUC18、pUC19、Bluescript(例如pBS SK+)及其衍生物、mp18、mp19、pBR322、pMB9、ColE1、pCR1、RP4、噬菌体DNA以及穿梭载体、诸如pSA3和pAT28。这些和许多其他克隆载体可从商业供应商、诸如BioRad、Strategene和Invitrogen获得。
表达载体通常是可复制的多核苷酸构建体,其含有根据本发明的多核苷酸。暗示表达载体必须可作为附加体或作为染色体DNA的整合部分在宿主细胞中复制。合适的表达载体包括但不限于质粒,病毒载体,包括腺病毒、腺相关病毒、逆转录病毒、粘粒和PCT公开号WO 87/04462中公开的表达载体。载体组分通常可以包括但不限于下述中的一种或多种:信号序列;复制起点;一种或多种标记基因;合适的转录控制元件(诸如启动子、增强子和终止子)。为了表达(即翻译),通常还需要一种或多种翻译控制元件,诸如核糖体结合位点、翻译起始位点和终止密码子。
含有目标多核苷酸的载体可以通过许多适当手段中的任一种引入宿主细胞内,所述手段包括电穿孔,采用氯化钙、氯化铷、磷酸钙、DEAE-葡聚糖或其他物质的转染;微粒轰击;脂转染;以及感染(例如,当载体是感染性病原体,诸如牛痘病毒时)。引入载体或多核苷酸的选择将经常取决于宿主细胞的特征。
本发明还提供了包含本文所述的任何多核苷酸的宿主细胞。能够过表达异源DNA的任何宿主细胞都可以用于分离编码目标抗体、多肽或蛋白的基因的目的。哺乳动物宿主细胞的非限制性实例包括但不限于COS、HeLa和CHO细胞。还参见PCT公开号WO 87/04462。合适的非哺乳动物宿主细胞包括原核生物(诸如大肠杆菌或枯草芽孢杆菌(
本发明还涵盖本发明的抗体的scFv。单链可变区片段通过经由使用短的连接肽连接轻链和/或重链可变区来制得(Bird等人, Science 242:423-426, 1988)。连接肽的实例包含SEQ ID NO: 65的序列。在一个实施方案中,连接肽桥接一个可变区的羧基末端和另一可变区的氨基末端之间的近似3.5 nm。已设计并使用其他序列的接头(Bird等人, Science242:423-426, 1988)。接头应当是短的、柔性多肽且优选包含少于约20个氨基酸残基。进而可针对额外功能来修饰接头,诸如连接药物或连接至固体载体。单链变体可以重组或合成产生。为了合成产生scFv,可使用自动化合成仪。为了重组产生scFv,可将含有编码scFv的多核苷酸的合适质粒引入合适宿主细胞中,所述宿主细胞为真核(诸如酵母、植物、昆虫或哺乳动物细胞)或原核(诸如大肠杆菌)。可通过常规操纵(诸如连接多核苷酸)来制得编码目标scFv的多核苷酸。可使用本领域已知的标准蛋白纯化技术来分离所得scFv。
在一个方面,提供了编码本文公开的部分轻链序列中的任一者和/或部分重链序列中的任一者的多核苷酸序列。编码本发明的抗体的VH区和VL区的示例性CD3多核苷酸列于表5中。
表 5
在一个方面,本发明了提供包含本发明的任一多核苷酸的组合物(诸如药物组合物)。在一些实施方案中,该组合物可包含表5中所示的任一多核苷酸。在具体实施方案中,该组合物包含含有编码本文所述的任一抗体的多核苷酸(例如表5中所示的任一多核苷酸)的表达载体。
本发明也涵盖与任何这种序列互补的多核苷酸。多核苷酸可以是单链(编码或反义)或双链的,并且可以是DNA(基因组、cDNA或合成的)或RNA分子。RNA分子包括成熟和不成熟mRNA,诸如前体mRNA(前-mRNA)或核内异质mRNA (hnRNA)和成熟mRNA。额外的编码序列或非编码序列可以但不必存在于本发明的多核苷酸内,并且多核苷酸可以但不必与其他分子和/或支持材料连接。
多核苷酸可以包含天然序列(即,编码抗体或其一部分的内源序列),或可以包含这种序列的变体。多核苷酸变体含有一个或多个取代、添加、缺失和/或插入,使得相对于天然免疫反应性分子,编码多肽的免疫反应性并不减小。通常可以如本文所述评价对编码多肽的免疫反应性的作用。变体优选表现出与编码天然抗体或其一部分的多核苷酸序列至少约70%的同一性,更优选至少约80%的同一性,又更优选至少约90%的同一性,且最优选至少约95%的同一性。
如果当如下所述就最大对应进行比对时,两个序列中的核苷酸或氨基酸序列是相同的,则两个多核苷酸或多肽序列被说成是“相同的”。通常通过在比较窗上比较序列以鉴定且比较序列相似性的局部区域,来进行两个序列之间的比较。如本文所用的“比较窗”是指至少约20个,通常为30至约75个、或40至约50个邻接位置的区段,其中在两个序列进行最佳比对后,可以将序列与具有相同数目的邻接位置的参考序列进行比较。
使用缺省参数,使用Lasergene生物信息学软件套件(DNASTAR,Inc.,Madison,WI)中的Megalign程序,可以进行用于比较的序列的最佳比对。优选地,通过在至少20个位置的比较窗上比较两个最佳比对的序列来确定“序列同一性的百分比”,其中比较窗中的多核苷酸或多肽序列的部分可以包含与参考序列(其不包含添加或缺失)相比20百分比或更少,通常为5至15百分比,或10至12百分比的添加或缺失(即,缺口),用于两个序列的最佳比对。百分比通过以下进行计算:测定在其处相同的核酸碱基或氨基酸残基在两个序列中出现的位置数目,以得到匹配位置数目,将匹配位置数目除以参考序列中的位置总数目(即窗口大小),并且将结果乘以100,以得到序列同一性的百分比。
变体也可以或可替代地与天然基因或者其一部分或互补体基本上同源。这种多核苷酸变体能够在中等严格条件下与编码天然抗体的天然存在的DNA序列(或互补序列)杂交。
本领域普通技术人员将理解,由于遗传密码的简并性,存在编码如本文所述的多肽的许多核苷酸序列。这些多核苷酸中的一些与任何天然基因的核苷酸序列具有最低的同源性。然而,本发明特别考虑了由于密码子使用中的差异而变化的多核苷酸。进一步地,包含本文提供的多核苷酸序列的基因的等位基因在本发明的范围内。等位基因是由于一种或多种突变(诸如核苷酸的缺失、添加和/或取代)而改变的内源基因。所得的mRNA和蛋白可以但不必具有改变的结构或功能。可以使用标准技术(诸如杂交、扩增和/或数据库序列比较)鉴定等位基因。
在一个方面,本发明提供了制备本文所述的任一多核苷酸的方法。例如,可以使用化学合成、重组方法或PCR获得本发明的多核苷酸。化学多核苷酸合成的方法是本领域众所周知的,并且无需在本文中详细描述。本领域技术人员可以使用本文提供的序列和商业DNA合成仪,以产生期望的DNA序列。
为了使用重组方法制备多核苷酸,可以将包含期望序列的多核苷酸插入合适的载体内,并且进而可以将该载体引入合适的宿主细胞内用于复制和扩增,如本文进一步讨论的。可以通过本领域已知的任何手段,将多核苷酸插入宿主细胞内。通过直接摄取、内吞、转染、F-交配或电穿孔,通过引入外源多核苷酸来转化细胞。一旦引入,外源多核苷酸就可以作为非整合载体(诸如质粒)维持在细胞内、或整合到宿主细胞基因组内。如此扩增的多核苷酸可以通过本领域众所周知的方法从宿主细胞中分离(例如,Sambrook等人,1989)。
或者,PCR允许DNA序列的复制。PCR技术是本领域众所周知的,并且在美国专利号4,683,195、4,800,159、4,754,065和4,683,202,以及PCR: The Polymerase ChainReaction,Mullis等人编辑,Birkauswer Press,Boston,1994中描述。
通过使用在适当载体中的分离的DNA,并且将其插入合适的宿主细胞内,可以获得RNA。当细胞复制并且DNA被转录成RNA时,然后可以使用本领域技术人员众所周知的方法,例如如Sambrook等人,1989,同上中所述分离RNA。
合适的克隆载体可以根据标准技术构建,或者可以选自本领域中可获得的大量克隆载体。尽管选择的克隆载体可以根据预期使用的宿主细胞而变化,但有用的克隆载体通常具有自我复制的能力,可能具有用于特定限制性核酸内切酶的单一靶标,和/或可能携带关于可以用于选择含有该载体的克隆中的标记物的基因。合适的实例包括质粒和细菌病毒,例如pUC18、pUC19、Bluescript(例如pBS SK+)及其衍生物、mp18、mp19、pBR322、pMB9、ColE1、pCR1、RP4、噬菌体DNA以及穿梭载体、诸如pSA3和pAT28。这些和许多其他克隆载体可从商业供应商、诸如BioRad、Strategene和Invitrogen获得。
表达载体通常是可复制的多核苷酸构建体,其含有根据本发明的多核苷酸。暗示表达载体必须可作为附加体或作为染色体DNA的整合部分在宿主细胞中复制。合适的表达载体包括但不限于质粒,病毒载体,包括腺病毒、腺相关病毒、逆转录病毒、粘粒和PCT公开号WO87/04462中公开的表达载体。载体组分通常可以包括但不限于下述中的一种或多种:信号序列;复制起点;一种或多种标记基因;合适的转录控制元件(诸如启动子、增强子和终止子)。为了表达(即翻译),通常还需要一种或多种翻译控制元件,诸如核糖体结合位点、翻译起始位点和终止密码子。
含有目标多核苷酸的载体可以通过许多适当手段中的任一种引入宿主细胞内,所述手段包括电穿孔,采用氯化钙、氯化铷、磷酸钙、DEAE-葡聚糖或其他物质的转染;微粒轰击;脂转染;以及感染(例如,当载体是感染性病原体,诸如牛痘病毒时)。引入载体或多核苷酸的选择将经常取决于宿主细胞的特征。
能够过表达异源DNA的任何宿主细胞都可以用于分离编码目标抗体、多肽或蛋白的基因的目的。哺乳动物宿主细胞的非限制性实例包括但不限于COS、HeLa和CHO细胞。还参见PCT公开号WO87/04462。合适的非哺乳动物宿主细胞包括原核生物(诸如大肠杆菌或枯草芽孢杆菌(
在一个方面,CD3抗体分子将具有对CD3的亲和力,例如如通过直接结合或竞争结合测定在皮摩尔至微摩尔亲和力范围内、优选地在皮摩尔至低纳摩尔范围内所测量。
可以使用本文公开的序列制备双特异性抗体。用于制备双特异性抗体的方法是本领域已知的(参见例如,Suresh等人,Methods in Enzymology 121:210,1986)。传统上,双特异性抗体的重组产生基于两个免疫球蛋白重链-轻链对的共表达,其中两条重链具有不同的特异性(Millstein和Cuello,Nature 305,537-539,1983)。
在另一个实施方案中,如本文所述的抗体包含全长人抗体,其中异二聚蛋白的抗体可变区能够通过特异性结合位于人免疫效应细胞上的效应抗原(例如CD3抗原)而募集人免疫效应细胞的活性,且其中异二聚蛋白的第二抗体可变区能够特异性结合靶抗原。在一些实施方案中,人抗体具有IgG1、IgG2、IgG3或IgG4同种型。在一些实施方案中,异二聚蛋白包含免疫惰性Fc链。
人免疫效应细胞可以是本领域已知的任何各种免疫效应细胞。例如,免疫效应细胞可以是人淋巴样细胞谱系的成员,包括但不限于T细胞(例如,细胞毒性T细胞)、B细胞和天然杀伤(NK)细胞。免疫效应细胞还可以是例如但不限于人髓样谱系的成员,包括但不限于单核细胞、嗜中性粒细胞和树突状细胞。这种免疫效应细胞可以在通过结合效应抗原而活化后对靶细胞具有细胞毒性或凋亡作用或者具有其他期望的作用。
效应抗原是在人免疫效应细胞上表达的抗原(例如蛋白或多肽)。可以被异源二聚蛋白(例如,异源二聚体抗体或双特异性抗体)结合的效应抗原的实例包括但不限于人CD3、CD16、NKG2D、NKp46、CD2、CD28、CD25、CD64和CD89。
靶细胞可以是对于人天然的或外来的细胞。在天然靶细胞中,该细胞可能已被转化为恶性细胞或经病理修饰(例如,被病毒、疟原虫或细菌感染的天然靶细胞)。在外来靶细胞中,该细胞是侵入病原体,诸如细菌、疟原虫或病毒。
在一些实施方案中,可用于本发明中的抗体是Fab、Fab片段、F(ab)
在一些实施方案中,如本文所述的CD3抗体是单克隆抗体。例如,所述CD3抗体是人源化单克隆抗体或嵌合单克隆抗体。
本发明涵盖包含Fc链或结构域或其部分的抗体。在一些实施方案中,Fc链或其部分包含IgG1、IgG2、IgG3或IgG4的Fc链的一个或多个恒定结构域(例如CH2或CH3结构域)。在另一个实施方案中,本发明涵盖包含Fc链或其部分的分子,其中所述Fc链或其部分相对于相当的野生型Fc链或其部分包含至少一个氨基酸修饰(例如取代)。变体Fc区是本领域众所周知的,且主要用于改变包含变体Fc区的抗体的表型,如在本领域众所周知的任一结合活性或效应子功能测定(例如ELISA、SPR分析或ADCC)中所测定。这种变体Fc链或其部分可延长本发明的包含Fc链或其部分的双特异性抗体表现出的血浆半衰期和稳定性。在另一个实施方案中,本发明涵盖本领域已知的任一Fc变体的用途。
在一个实施方案中,对Fc链的氨基酸进行一种或多种修饰以降低Fc链的亲和力和亲合力,且由此降低本发明的双特异性抗体对一种或多种FcγR受体的亲和力和亲合力。在一个具体实施方案中,本发明涵盖包含变体Fc链或其部分的双特异性抗体,其中所述变体Fc链相对于野生型Fc链包含至少一个氨基酸修饰,所述变体Fc区仅结合一种FcγR,其中所述FcγR是FcγRIIIA。在另一个具体实施方案中,本发明涵盖包含变体Fc链或其部分的双特异性抗体,其中所述变体Fc链相对于野生型(WT) Fc链包含至少一个氨基酸修饰,所述变体Fc区仅结合一种FcγR,其中所述FcγR是FcγRIIA。在另一个具体实施方案中,本发明涵盖包含变体Fc链或其部分的双特异性抗体,其中所述变体Fc链相对于野生型Fc链包含至少一个氨基酸修饰,所述变体Fc链仅结合一种FcγR,其中所述FcγR是FcγRIIB。在另一个实施方案中,本发明涵盖包含变体Fc链的分子,其中相对于不包含Fc链或包含野生型Fc链的分子,所述变体赋予或介导降低的ADCC活性(或其他效应子功能)和/或增加的与FcγRIIB(CD32B)的结合,如使用本领域技术人员已知且本文所述的方法所测量。
本发明还涵盖包含来自两种或更多种IgG同种型的结构域或区域的Fc区的用途。如本领域已知,Fc区的氨基酸修饰可显著地影响Fc介导的效应子功能和/或结合活性。然而,当在所选IgG同种型的背景下实施时,可进一步改进和/或操纵功能特征的这些改变。类似地,通过一种或多种氨基酸修饰可操纵同种型Fc的天然特征。多种IgG同种型(即,IgG1、IgG2、IgG3和IgG4)由于其铰链和/或Fc区的氨基酸序列差异而表现出不同的物理和功能特性,包括血清半衰期、补体结合、FcγR结合亲和力和效应子功能活性(例如ADCC、CDC)。
在一个实施方案中,氨基酸修饰和IgG Fc区基于其相应单独的结合和/或效应子功能活性独立地选择,以工程改造具有期望特征的双特异性抗体。在一个具体实施方案中,已如本文所述或本领域在IgG1的背景下已知分开地测定氨基酸修饰和IgG铰链/Fc区的结合和/或效应子功能活性。在一个实施方案中,氨基酸修饰和IgG铰链/Fc区展示类似的功能性,例如在双特异性抗体或其他含Fc的分子(例如和免疫球蛋白)的背景下,降低ADCC活性(或其他效应子功能)和/或增加与FcγRIIB的结合。在另一个实施方案中,本发明涵盖变体Fc区,其包含本领域已知的氨基酸修饰的组合和表现出新型特性的所选IgG区,在如本文所述独立地测定修饰和/或区域时,所述特性无法检测到。
测定抗体与CD3的结合亲和力的一种方法是通过测量所述抗体的单功能Fab片段的结合亲和力。为了获得单功能性Fab片段,抗体(例如IgG)可以用木瓜蛋白酶裂解或重组表达。抗体的CD3 Fab片段的亲和力可以通过表面等离振子共振(Biacore™3000™表面等离振子共振(SPR)系统,Biacore™,INC,Piscataway NJ)进行测定,所述表面等离振子共振配备有预固定的链霉抗生物素蛋白传感器芯片(SA)或抗小鼠Fc或抗人Fc,其使用HBS-EP运行缓冲液(0.01M HEPES,pH 7.4,0.15 M NaCl,3 mM EDTA,0.005% v/v表面活性剂P20)。生物素化或Fc融合人CD3可以稀释到HBS-EP缓冲液中至小于0.5 μg/mL的浓度,并且使用可变的接触时间跨越各个芯片通道注射,以达到两个范围的抗原密度:用于详细的动力学研究的50-200个反应单位(RU)、或用于筛选测定的800-1,000 RU。再生研究已显示,在25% v/v乙醇中的25 mM NaOH有效地去除结合的Fab,同时对于超过200次注射保持芯片上的CD3的活性。通常,将纯化的Fab样品的系列稀释物(跨越0.1-10x估计K
如本文所述的抗体可以通过本领域已知的任何方法来制备。对于杂交瘤细胞系的产生,宿主动物的免疫途径和时间表通常与对于抗体刺激和产生建立的和常规的技术一致,如本文进一步所述。用于产生人和小鼠抗体的一般技术是本领域已知的和/或在本文中描述。
考虑可以操纵任何哺乳动物受试者、包括人或来自其的抗体产生细胞,以充当用于产生哺乳动物包括人和杂交瘤细胞系的基础。通常,用一定量的免疫原,对宿主动物进行腹膜内、肌内、经口、皮下、足底内和/或皮内接种,包括如本文所述的。
使用Kohler,B.和Milstein,C.,Nature 256:495-497,1975的一般体细胞杂交技术,或如通过Buck,D. W.等人,In Vitro,18:377-381,1982修饰的,可以从淋巴细胞和永生化骨髓瘤细胞制备杂交瘤。可用的骨髓瘤系,包括但不限于X63-Ag8.653和来自SalkInstitute,Cell Distribution Center,San Diego,Calif.,USA的那些,可以用于杂交中。通常,该技术涉及使用融合剂、诸如聚乙二醇、或通过本领域技术人员众所周知的电学手段,使骨髓瘤细胞和淋巴样细胞融合。融合后,将细胞与融合介质分开,并且在选择性生长培养基(诸如次黄嘌呤-氨基蝶呤-胸苷(HAT)培养基)中生长,以消除未杂交的亲本细胞。本文所述的补充或未补充血清的任何培养基都可以用于培养分泌单克隆抗体的杂交瘤。作为细胞融合技术的另一种替代方案,EBV永生化B细胞可以用于产生本发明的单克隆抗体。需要时,将杂交瘤扩增并亚克隆,并且通过常规免疫测定程序(例如,放射免疫测定、酶免疫测定或荧光免疫测定)测定上清液的抗免疫原活性。
可以用作抗体来源的杂交瘤涵盖产生对CD3或其部分特异性的单克隆抗体的亲本杂交瘤的所有衍生物,后代细胞。
产生这种抗体的杂交瘤可以使用已知程序在体外或体内生长。如果需要,可以通过常规的免疫球蛋白纯化程序,诸如硫酸铵沉淀、凝胶电泳、透析、层析和超滤,从培养基或体液分离单克隆抗体。例如,通过使制剂在由附着至固相的免疫原制成的吸附剂上运行,并且从免疫原洗脱或释放期望的抗体,可以去除不期望的活性(如果存在的话)。使用双官能试剂或衍生剂,例如,马来酰亚胺基苯甲酰基磺基琥珀酰亚胺酯(通过半胱氨酸残基缀合)、N-羟基琥珀酰亚胺(通过赖氨酸残基)、戊二醛、琥珀酸酐、SOCl
如果需要,可以对目标抗体进行测序,且然后可以将多核苷酸序列克隆到载体内用于表达或繁殖。可以将编码目标抗体的序列维持在宿主细胞中的载体中,且然后可以将该宿主细胞扩增且冷冻用于未来使用。细胞培养中的重组单克隆抗体的产生可以通过本领域已知的手段通过从B细胞克隆抗体基因来进行。参见例如Tiller等人,J. Immunol.Methods 329,112,2008;美国专利号7,314,622。
在一个替代方案中,多核苷酸序列可以用于遗传操作,以人源化抗体或改善抗体的亲和力或其他特征。例如,如果抗体用于人的临床试验和治疗中,则恒定区可以被工程改造为更接近地类似人恒定区,以避免免疫应答。可能期望遗传操纵抗体序列,以获得对CD3的更大亲和力和更大疗效。
在一些实施方案中,所述抗体具有修饰的恒定区,其去除或减少Fcγ受体结合。例如,Fc可以是含有突变D265的人IgG2,其中氨基酸残基参考野生型IgG2序列进行编号。因此,在一些实施方案中,恒定区具有修饰的恒定区,所述修饰的恒定区具有SEQ ID NO:80中所示的序列。在一些实施方案中,抗体具有修饰的恒定区,所述修饰的恒定区具有SEQ IDNO: 81中所示的序列。
存在使单克隆抗体人源化的四个一般步骤。这些步骤是:(1)测定起始抗体轻链和重链可变区的核苷酸和预测的氨基酸序列,(2)设计人源化抗体,即决定在人源化过程期间使用哪个抗体构架区,(3)实际人源化方法/技术,以及(4)人源化抗体的转染和表达。参见例如,美国专利号4,816,567;5,807,715;5,866,692;6,331,415;5,530,101;5,693,761;5,693,762;5,585,089;和6,180,370。
已描述了包含源自非人免疫球蛋白的抗原结合位点的许多人源化抗体分子,包括具有与人恒定区融合的啮齿动物或修饰的啮齿动物V区及其相关CDR的嵌合抗体。参见例如,Winter等人Nature 349:293-299,1991,Lobuglio等人Proc. Nat. Acad. Sci. USA86:4220-4224,1989,Shaw等人J Immunol. 138:4534-4538,1987,以及Brown等人CancerRes. 47:3577-3583,1987。其他参考文献描述了在与适当的人抗体恒定区融合之前,将啮齿动物CDR移植到人支持构架区(FR)内。参见例如,Riechmann等人Nature 332:323-327,1988,Verhoeyen等人Science 239:1534-1536,1988,以及Jones等人Nature 321:522-525,1986。另一参考文献描述了由重组工程改造的啮齿动物构架区支持的啮齿动物CDR。参见例如欧洲公开号EP0519596。这些“人源化”分子被设计为使针对啮齿动物抗人抗体分子的不需要的免疫应答最小化,其限制了那些部分在人受体中的治疗应用的持续时间和有效性。例如,可以对抗体恒定区进行工程改造,使得它是免疫学惰性的(例如,不触发补体裂解)。参见例如PCT申请号PCT/GB99/01441;英国申请号9809951.8。也可以利用的人源化抗体的其他方法由Daugherty等人,Nucl. Acids Res. 19:2471-2476,1991,以及在美国专利号6,180,377;6,054,297;5,997,867;5,866,692;6,210,671;和6,350,861;以及PCT公开号WO01/27160中公开。
上文讨论的与人源化抗体相关的一般原理也适用于定制抗体,例如用于在其他哺乳动物(例如人、非人灵长类动物、鼠、驴、绵羊、兔、山羊、豚鼠、骆驼、马或鸡)中使用。进一步地,可以组合本文所述的人源化抗体的一个或多个方面,例如CDR移植、构架突变和CDR突变。
在一个变型中,可以通过使用商购可得的小鼠获得全人抗体,所述小鼠已工程改造为表达特定人免疫球蛋白蛋白。设计为产生更期望的(例如,全人抗体)或更稳固的免疫应答的转基因动物也可以用于生成人源化或人抗体。这种技术的实例是来自Abgenix,Inc.(Fremont,CA)的Xenomouse™以及来自Medarex,Inc.(Princeton,NJ)的HuMAb-Mouse®和TC Mouse™。
在一个替代方案中,抗体可以使用本领域已知的任何方法来重组制备且表达。在另一个替代方案中,抗体可以通过噬菌体展示技术来重组制备。参见例如,美国专利号5,565,332;5,580,717;5,733,743;和6,265,150;以及Winter等人,Annu. Rev. Immunol.12:433-455,1994。或者,噬菌体展示技术(McCafferty等人,Nature 348:552-553,1990)可以用于从来自未免疫供体的免疫球蛋白可变(V)结构域基因库,在体外产生人抗体和抗体片段。根据这种技术,将抗体V结构域基因框内克隆到丝状噬菌体、诸如M13或fd的主要或次要外壳蛋白基因内,并且作为功能性抗体片段展示在噬菌体颗粒的表面上。因为丝状颗粒含有噬菌体基因组的单链DNA拷贝,所以基于抗体的功能特性的选择还导致选择编码表现出那些特性的抗体的基因。因此,噬菌体模拟B细胞的一些特性。噬菌体展示可以以各种形式进行;关于综述,参见例如Johnson,Kevin S.和Chiswell,David J.,Current Opinionin Structural Biology 3:564-571,1993。V基因区段的几种来源可以用于噬菌体展示。Clackson等人,Nature 352:624-628,1991,从源自免疫小鼠的脾的V基因的小型随机组合文库分离广泛多样的抗噁唑酮抗体。基本上遵循由Mark等人,J. Mol. Biol. 222:581-597,1991,或Griffith等人,EMBO J. 12:725-734,1993所述的技术,可以构建来自未免疫的人供体的V基因库,并且可以分离针对广泛多样的抗原(包括自身抗原)的抗体。在天然免疫应答中,抗体基因以高速率积累突变(体细胞超突变)。引入的一些变化将赋予更高的亲和力,并且展示高亲和力的表面免疫球蛋白的B细胞在随后的抗原攻击期间被优先复制且分化。这种天然过程可以通过采用称为“链改组”的技术来模拟(Marks等人,Bio/Technol.10:779-783,1992)。在这种方法中,通过用从未免疫的供体获得的V结构域基因的天然存在的变体库(库)依次地替换重链和轻链V区基因,可以改善通过噬菌体展示获得的“一级”人抗体的亲和力。这种技术允许产生亲和力在pM-nM范围内的抗体和抗体片段。用于制备非常大的噬菌体抗体库(也称为“母文库(the mother-of-all libraries)”)的策略已由Waterhouse等人,Nucl. Acids Res. 21:2265-2266,1993描述。基因改组还可以用于从啮齿动物抗体衍生人抗体,其中所述人抗体具有与起始啮齿动物抗体相似的亲和力和特异性。根据也称为“表位印迹”的这种方法,将通过噬菌体展示技术获得的啮齿动物抗体的重链或轻链V结构域基因替换为人V结构域基因库,产生啮齿动物-人嵌合体。在抗原上的选择导致分离能够恢复功能性抗原结合位点的人可变区,即,表位支配(标记)配偶体的选择。当重复该过程以便替换剩余的啮齿动物V结构域时,获得人抗体(参见PCT公开号WO93/06213)。与啮齿动物抗体通过CDR移植的传统人源化不同,这种技术提供了完全人抗体,其没有啮齿动物起源的构架或CDR残基。
抗体可以通过以下进行重组制备:首先从宿主动物分离抗体和抗体产生细胞,获得基因序列,并且使用基因序列以在宿主细胞(例如,CHO细胞)中重组表达抗体。可以采用的另一种方法是在植物(例如烟草)或转基因乳中表达抗体序列。已公开了用于在植物或乳中重组表达抗体的方法。参见例如,Peeters等人Vaccine 19:2756,2001;Lonberg,N.和D.Huszar Int. Rev. Immunol 13:65,1995;以及Pollock等人,J Immunol Methods 231:147,1999。用于制备抗体的衍生物例如人源化的、单链等的方法是本领域已知的。
免疫测定和流式细胞术分选技术,诸如荧光活化细胞分选(FACS),也可以用于分离对于CD3或目标抗原特异性的抗体。
如本文所述的抗体可以与许多不同的固相支持物或载体结合。这种支持物可以是活性的和/或惰性的。众所周知的支持物包括聚丙烯、聚苯乙烯、聚乙烯、葡聚糖、尼龙、淀粉酶、玻璃、天然和改性纤维素、聚丙烯酰胺、琼脂糖和磁体。为了本发明的目的,支持物的性质可以是可溶的或不溶的。本领域技术人员将知道用于结合抗体的其他合适的支持物,或将能够使用常规实验来确定这些。在一些实施方案中,所述支持物包含靶向心肌的部分。
编码单克隆抗体的DNA使用常规程序(例如,通过使用能够特异性结合编码单克隆抗体的重链和轻链的基因的寡核苷酸探针)容易地分离且测序。杂交瘤细胞充当这种DNA的优选来源。一旦分离,就可以将DNA置于表达载体(诸如PCT公开号WO87/04462中公开的表达载体)内,然后将所述表达载体转染到否则不产生免疫球蛋白蛋白的宿主细胞(诸如大肠杆菌细胞、猿猴COS细胞、CHO细胞或骨髓瘤细胞)内,以获得在重组宿主细胞中的单克隆抗体合成。参见例如PCT公开号WO87/04462。还可以例如通过用人重链和轻链恒定区的编码序列代替同源鼠序列(Morrison等人,Proc. Nat. Acad. Sci. 81:6851,1984),或通过将免疫球蛋白编码序列与非免疫球蛋白多肽的编码序列的全部或部分共价接合,来修饰DNA。以该方式,制备具有本文的单克隆抗体的结合特异性的“嵌合”或“杂合”抗体。
可以使用本领域已知的方法来鉴定或表征如本文所述的CD3或其他抗原抗体,由此检测和/或测量抗原表达水平。在一些实施方案中,通过使候选剂与CD3一起孵育,并且监测结合和/或CD3表达水平的伴随减少,来鉴定CD3抗体。结合测定可以用纯化的CD3多肽,或者天然表达或经转染以表达CD3多肽的细胞进行。在一个实施方案中,结合测定是竞争性结合测定,其中评估候选抗体与已知的CD3抗体竞争CD3结合的能力。该测定可以以各种形式,包括ELISA形式进行。
在初步鉴定后,候选CD3或其他抗原抗体的活性可以通过已知用于测试靶向生物活性的生物测定进一步确认且完善。或者,生物测定可以用于直接筛选候选物。实施例中详细描述了用于鉴定且表征抗体的一些方法。
可以使用本领域众所周知的方法表征CD3或其他抗原抗体。例如,一种方法是鉴定它与之结合的表位或“表位作图”。本领域中存在已知用于作图且表征蛋白上的表位的位置的许多方法,包括解析抗体-抗原复合物的晶体结构、竞争性测定、基因片段表达测定和基于合成肽的测定,如例如Harlow和Lane,Using Antibodies,a Laboratory Manual,ColdSpring Harbor Laboratory Press,Cold Spring Harbor,New York,1999的第11章中所述。在另一个实例中,表位作图可以用于测定抗体结合的序列。表位作图从各种来源商购可得,例如,Pepscan Systems(Edelhertweg 15,8219 PH Lelystad,荷兰)。该表位可以是线性表位,即包含在单个氨基酸段中,或由氨基酸的三维相互作用形成的构象表位,所述氨基酸可以不一定包含在单个段中。可以分离或合成(例如,重组地)不同长度(例如,至少4-6个氨基酸长)的肽,并且用于与CD3或其他抗原抗体的结合测定。在另一个实例中,通过使用源自CD3或其他抗原序列的重叠肽,并且测定通过CD3或其他抗原抗体的结合,可以在系统筛选中测定CD3或其他抗原抗体与之结合的表位。根据基因片段表达测定,编码CD3或其他抗原的开放读码框被随机地或通过特定的遗传构建片段化,并且测定表达的CD3或其他抗原的片段与待测试抗体的反应性。基因片段可以例如通过PCR产生,且然后在放射性氨基酸的存在下,在体外转录并翻译成蛋白。然后通过免疫沉淀和凝胶电泳测定抗体与放射性标记的CD3或其他抗原片段的结合。某些表位也可以通过使用在噬菌体颗粒的表面上展示的随机肽序列的大型文库(噬菌体文库)来鉴定。或者,可以在简单的结合测定中测试限定的重叠肽片段文库与测试抗体的结合。在一个额外实例中,可以进行抗原结合结构域的诱变、结构域交换实验和丙氨酸分区诱变,以鉴定对于表位结合需要、足够和/或必需的残基。例如,可以使用突变型CD3或其他抗原进行结构域交换实验,其中CD3或其他抗原蛋白的各种片段已被替换(交换)为来自另一个物种(例如小鼠)的抗原的序列、或紧密相关但抗原性不同的蛋白(例如,Trop-1)。通过评价抗体与突变型CD3或其他抗原的结合,可以评价特定CD3或其他抗原片段对抗体结合的重要性。
可以用于表征CD3或其他抗原抗体的又另一种方法是使用具有其他抗体的竞争测定,所述其他抗体已知结合相同抗原,即CD3或其他抗原上的各种片段,以测定CD3或其他抗原抗体是否分别结合与其他抗体相同的表位。竞争测定是本领域技术人员众所周知的。
表达载体可以用于指导CD3或其他抗原抗体的表达。本领域技术人员熟悉表达载体的施用,以获得外源蛋白在体内的表达。参见例如,美国专利号6,436,908;6,413,942;和6,376,471。表达载体的施用包括局部或全身施用,包括注射、经口施用、粒子枪或插入导管的施用,以及局部施用。在另一个实施方案中,将表达载体直接施用于交感干或神经节,或施用到冠状动脉、心房、心室或心包膜内。
也可以使用含有表达载体或亚基因组多核苷酸的治疗组合物的靶向递送。受体介导的DNA递送技术在例如以下中描述:Findeis等人,Trends Biotechnol.,11:202,1993;Chiou等人,Gene Therapeutics: Methods And Applications Of Direct GeneTransfer,J.A. Wolff,编辑,1994;Wu等人,J. Biol. Chem.,263:621,1988;Wu等人,J.Biol. Chem.,269:542,1994;Zenke等人,Proc. Natl. Acad. Sci. USA,87:3655,1990;以及Wu等人,J. Biol. Chem.,266:338,1991。含有多核苷酸的治疗组合物以约100 ng至约200 mg DNA的范围施用,用于基因治疗方案中的局部施用。约500 ng至约50 mg、约1 μg至约2 mg、约5 μg至约500 μg、以及约20 µg至约100 µg DNA的浓度范围也可以在基因治疗方案期间使用。可以使用基因递送媒介物来递送治疗性多核苷酸和多肽。基因递送媒介物可以具有病毒或非病毒起源(通常参见,Jolly,Cancer Gene Therapy,1:51,1994;Kimura,Human Gene Therapy,5:845,1994;Connelly,Human Gene Therapy,1:185,1995;以及Kaplitt,Nature Genetics,6:148,1994)。可以使用内源性哺乳动物启动子或异源启动子来诱导这种编码序列的表达。编码序列的表达可以是组成型的或调控的。
用于递送期望的多核苷酸和在期望的细胞中表达的基于病毒的载体是本领域众所周知的。示例性的基于病毒的媒介物包括但不限于重组逆转录病毒(参见例如,PCT公开号WO90/07936;WO94/03622;WO93/25698;WO93/25234;WO93/11230;WO93/10218;WO91/02805;美国专利号5,219,740和4,777,127;GB专利号2,200,651;和EP专利号EP0 345242)、基于甲病毒的载体(例如辛德毕斯病毒载体、塞姆利基森林病毒(ATCC VR-67;ATCCVR-1247)、罗斯河病毒(ATCC VR-373;ATCC VR-1246)和委内瑞拉马脑炎病毒(ATCC VR-923;ATCC VR-1250;ATCC VR 1249;ATCC VR-532))、以及腺相关病毒(AAV)载体(参见例如PCT公开号WO94/12649,WO93/03769;WO93/19191;WO94/28938;WO95/11984和WO95/00655)。也可以采用如Curiel,Hum. Gene Ther.,3:147,1992中所述的,与杀死的腺病毒连接的DNA的施用。
也可以采用非病毒递送媒介物和方法,包括但不限于与单独的杀死的腺病毒连接或未连接的聚阳离子缩合DNA(参见例如,Curiel,Hum. Gene Ther.,3:147,1992);配体连接的DNA(参见例如,Wu,J. Biol. Chem.,264:16985,1989);真核细胞递送媒介物细胞(参见例如,美国专利号5,814,482;PCT公开号WO95/07994;WO96/17072;WO95/30763;和WO97/42338)和核酸电荷中和或与细胞膜融合。也可以采用裸露DNA。示例性的裸露DNA引入方法在PCT公开号WO90/11092和美国专利号5,580,859中描述。可以充当基因传递媒介物的脂质体在美国专利号5,422,120;PCT公开号WO95/13796;WO94/23697;WO91/14445;和欧洲公开EP 0524968中描述。额外的方法在Philip,Mol. Cell Biol.,14:2411,1994以及Woffendin,Proc. Natl. Acad. Sci.,91:1581,1994中描述。
在一些实施方案中,本发明涵盖组合物,包括这样的药物组合物,所述组合物包含如本文所述或通过所述方法制备且具有本文所述的特征的本发明的抗体。如本文所用,药物组合物可以包含结合肿瘤抗原的一种或多种抗体、结合CD3和肿瘤抗原的一种或多种双特异性抗体和/或包含编码一种或多种这些抗体的序列的一种或多种多核苷酸。这些组合物可以进一步包含合适的赋形剂,诸如药学上可接受的赋形剂,包括缓冲剂,其是本领域众所周知的。
在一个实施方案中,本发明特征在于组合物,其为CD3抗体和第二治疗剂的组合。在一个实施方案中,所述第二治疗剂是有利地与CD3抗体组合的任一药剂。可有利地与CD3抗体组合的示例性药剂包括但不限于结合和/或活化CD3信号传导的其他药剂(包括其他抗体或其抗原结合片段等)和/或不直接结合CD3但仍然活化或刺激免疫细胞活化的药剂。本发明进一步包括额外组合疗法和涉及本发明的CD3抗体的共制剂。本发明还提供了制备这些抗体中的任一种的方法。本发明的抗体可以通过本领域已知的程序(包括从头蛋白合成和重组表达编码结合蛋白的核酸)进行制备。期望的核酸序列可通过重组方法(例如期望多核苷酸的早前制备变体的PCR诱变)或通过固相DNA合成来产生。通常使用重组表达方法。在一个方面,本发明提供了包含编码CD3 VH和/或VL的序列的多核苷酸。由于遗传密码的简并性,因此多个核酸序列编码每一免疫球蛋白氨基酸序列,且本发明包括编码本文所述的结合蛋白的所有核酸。
嵌合或杂交抗体也可以使用合成蛋白化学的已知方法在体外制备,所述方法包括涉及交联剂的那些。例如,可以使用二硫化物交换反应或通过形成硫醚键来构建免疫毒素。用于该目的的合适试剂的实例包括亚氨基硫醇盐和甲基-4-巯基丁酰亚胺酯(methyl-4-mercaptobutyrimidate)。
在重组人源化抗体中,可以修饰Fcγ部分以避免与Fcγ受体以及补体和免疫系统的相互作用。制备这种抗体的技术在PCT公开WO99/58572中描述。例如,如果抗体用于人中的临床试验和治疗,则恒定区可以被工程改造以更类似于人类恒定区以避免免疫应答。参见,例如,美国专利号5,997,867和5,866,692。
与抗体从中衍生的相应的种系序列相比,如本文所公开的CD3抗体可在重链和轻链可变结构域的构架和/或CDR区域中包含一个或多个氨基酸取代、插入和/或缺失。通过将本文公开的氨基酸序列与可从例如公共抗体序列数据库获得的种系序列进行比较,可以容易地确定这种突变。本发明包括衍生自本文公开的氨基酸序列的任一种的抗体及其抗原结合片段,其中一个或多个构架和/或CDR区域内的一个或多个氨基酸被突变为抗体从中衍生的种系序列的一种或多种相应的残基,或另一种人种系序列的一种或多种相应的残基,或一种或多种相应的种系残基的保守氨基酸取代(这种序列改变在本文中统称为“种系突变”)。从本文公开的重链和轻链可变区序列开始,本领域普通技术人员可以容易地产生包含一种或多种个别种系突变或其组合的多种抗体和抗原结合片段。在某些实施方案中,VH和/或VL结构域内的所有构架和/或CDR残基均突变回抗体从中衍生的原始种系序列中发现的残基。在一些实施方案中,仅某些残基突变回原始种系序列,例如,仅在FR1的最初8个氨基酸内或在FR4的最后8个氨基酸内发现的突变的残基,或仅在CDR1、CDR2或CDR3内发现的突变的残基。在一些进一步实施方案中,一个或多个构架和/或CDR残基被突变为不同种系序列(即,不同于抗体最初从中衍生的种系序列的种系序列)的一种或多种相应的残基。
此外,本发明的抗体可以在构架和/或CDR区域内包含两个或更多个种系突变的任何组合,例如,其中某些个别残基突变为特定种系序列的相应残基,而某些其他不同于原始种系序列的残基被维持或被突变为不同种系序列的相应残基。一旦获得,就可容易地测试含有一个或多个种系突变的抗体和抗原结合片段的一种或多种所期望的性质,诸如,提高的结合特异性、增加的结合亲和力、改善的或增强的拮抗性或激动性生物性质(视情况而定)、降低的免疫原性等。以这种一般方式获得的抗体和抗原结合片段包括在本发明内。
本发明还包括CD3抗体,其包含具有一个或多个保守取代的本文公开的HC VR、LCVR和/或CDR氨基酸序列中任一种的变体。例如,本发明包括CD3抗体,其具有相对于HC VR、LC VR和/或CDR氨基酸序列的任一种具有例如10个或更少、8个或更少、6个或更少、4个或更少等的保守氨基酸取代的HC VR、LC VR和/或CDR氨基酸序列,如本文所公开的。
因此,本发明涵盖对本发明的抗体和多肽的修饰,如本文所述的变体,包括不显著影响其性质的功能上等价的抗体,以及具有增强或降低的活性和/或亲和力的变体。例如,可以使氨基酸序列突变,以获得对肿瘤抗原和/或CD3具有所期望的结合亲和力的抗体。多肽的修饰是本领域中的常规实践,且无需在本文中详细描述。修饰的多肽的实例包括具有氨基酸残基的保守取代,不显著地有害地改变功能活性或成熟(增强)多肽对于其配体的亲和力的氨基酸的一种或多种缺失或添加,或化学类似物的使用的多肽。
氨基酸序列插入包括长度从一个残基到含有一百个或更多个残基的多肽的氨基和/或羧基末端融合,以及单个或多个氨基酸残基的序列内插入。末端插入的实例包括具有N-末端甲硫氨酰残基的抗体或与表位标签融合的抗体。抗体分子的其他插入变体包括酶或增加抗体在血液循环中的半衰期的多肽与抗体的N-或C-末端的融合。
取代变体使抗体分子中的至少一个氨基酸残基被去除,并且使不同的残基在其位置插入。对于取代诱变最感兴趣的位点包括高变区,但也预期了FR改变。保守取代显示在表6中的“保守取代”标题下。如果这种取代导致生物活性的改变,则可以引入在表6中命名为“示例性取代”、或如下文关于氨基酸类别进一步描述的更显著改变,并且筛选产物。
表6
抗体的生物性质的显著修改通过选择取代来完成,所述取代在其维持下述的作用中显著不同:(a)取代区域中的多肽主链结构,例如,作为片层或螺旋构象,(b)分子在靶位点处的电荷或疏水性,或(c)侧链的体积。天然存在的氨基酸残基基于共同的侧链性质分成组:
(1)非极性的:正亮氨酸、Met、Ala、Val、Leu、Ile;
(2)无电荷的极性的:Cys、Ser、Thr、Asn、Gln;
(3)酸性的(带负电的):Asp、Glu;
(4)碱性的(带正电的):Lys、Arg;
(5)影响链取向的残基:Gly、Pro;和
(6)芳族的:Trp、Tyr、Phe、His。
通过将这些类别之一的成员换成另一个类别来制备非保守取代。
一般还可以用丝氨酸取代不与维持抗体的正确构象有关的任何半胱氨酸残基,以改善分子的氧化稳定性并防止异常的交联。相反,可以将一个或多个半胱氨酸键添加到抗体中,以改善其稳定性,特别是当抗体是抗体片段、诸如Fv片段时。
氨基酸修饰可以从改变或修饰一个或多个氨基酸到区域(例如可变区)的完全重新设计。可变区中的变化可以改变结合亲和力和/或特异性。在一些实施方案中,在CDR结构域内进行不多于一到五个保守氨基酸取代。在一些实施方案中,在CDR结构域内进行不多于一到三个保守氨基酸取代。在又其他的实施方案中,CDR结构域是VH CDR3和/或VL CDR3。
修饰还包括糖基化和非糖基化的多肽,以及具有其他翻译后修饰的多肽,如例如,用不同糖的糖基化、乙酰化和磷酸化。抗体在其恒定区中的保守位置处被糖基化(Jefferis和Lund, Chem. Immunol. 65:111-128, 1997;Wright和Morrison, TibTECH 15:26-32,1997)。免疫球蛋白的寡糖侧链影响蛋白的功能(Boyd等人, Mol. Immunol. 32:1311-1318, 1996;Wittwe和Howard, Biochem. 29:4175-4180, 1990),以及糖蛋白的部分之间的分子内相互作用,其可以影响构象并呈现糖蛋白的三维表面(Jefferis和Lund, 上文;Wyss和Wagner, Current Opin. Biotech. 7:409-416, 1996)。寡糖还可以用来基于特定的识别结构将给定的糖蛋白靶向至某些分子。还已报道抗体的糖基化影响抗体依赖性细胞毒作用(ADCC)。特别地,报道具有四环素调节的β(1,4)-N-乙酰葡糖胺转移酶III(GnTIII)(催化等分GlcNAc的形成的糖基转移酶)表达的CHO细胞具有改善的ADCC活性(Umana等人,Mature Biotech. 17:176-180, 1999)。
抗体的糖基化一般是N联或O联的。N联是指碳水化合物部分附着至天冬酰胺残基的侧链。三肽序列天冬酰胺-X-丝氨酸、天冬酰胺-X-苏氨酸和天冬酰胺-X-半胱氨酸(其中X是除了脯氨酸以外的任何氨基酸)是用于碳水化合物部分酶促附着至天冬酰胺侧链的识别序列。因此,多肽中的这些三肽序列中任一种的存在产生潜在的糖基化位点。O联糖基化是指糖N-乙酰半乳糖胺、半乳糖或木糖之一与羟基氨基酸的附着,所述羟基氨基酸最通常为丝氨酸或苏氨酸,尽管也可以使用5-羟脯氨酸或5-羟赖氨酸。
通过改变氨基酸序列,使得其含有上述三肽序列中的一种或多种(对于N联糖基化位点),方便地完成糖基化位点至抗体的添加。也可以通过向原始抗体的序列中添加或取代为一个或多个丝氨酸或苏氨酸残基来进行改变(对于O联糖基化位点)。
也可以在不改变作为基础的核苷酸序列的情况下改变抗体的糖基化模式。糖基化主要取决于用于表达抗体的宿主细胞。由于用于表达作为潜在治疗剂的重组糖蛋白例如抗体的细胞类型很少是天然细胞,所以可以预期抗体的糖基化模式的变化(参见,例如,Hse等人, J. Biol. Chem. 272:9062-9070, 1997)。
除宿主细胞的选择之外,在抗体的重组生产过程中影响糖基化的因素还包括生长模式、培养基配方、培养密度、加氧、pH、纯化方案等等。已提出了各种方法以改变在特定宿主生物中实现的糖基化模式,包括引入或过表达与寡糖生产有关的某些酶(美国专利号5,047,335;5,510,261和5,278,299)。例如,使用内切糖苷酶H(Endo H)、N-糖苷酶F、内切糖苷酶F1、内切糖苷酶F2、内切糖苷酶F3,可以从糖蛋白中酶促去除糖基化或某些类型的糖基化。另外,重组宿主细胞可以被基因工程改造,以在加工某些类型的多糖中是缺陷的。这些技术和类似技术是本领域众所周知的。
其他修饰方法包括使用本领域已知的偶联技术,包括,但不限于,酶促手段、氧化取代和螯合。修饰可以用于例如标记的附着用于免疫测定。修饰的多肽使用本领域已确立的程序制备,并且可以使用本领域已知的标准测定进行筛选,其中一些在下文和实施例中进行描述。
在本发明的一些实施方案中,抗体包含修饰的恒定区,诸如这样的恒定区,其对人Fcγ受体具有增加的亲和力,是免疫学惰性或部分惰性的,例如,不触发补体介导的裂解,不刺激依赖抗体的细胞介导的细胞毒性(ADCC),或不活化巨噬细胞;或在以下任何一种或多种中具有降低的活性(与未修饰的抗体相比):触发补体介导的裂解、刺激依赖抗体的细胞介导的细胞毒性(ADCC)或活化小胶质细胞。恒定区的不同修饰可用于实现效应子功能的最佳水平和/或组合。参见,例如,Morgan等人, Immunology 86:319-324, 1995;Lund等人,J. Immunology 157:4963-9 157:4963-4969, 1996;Idusogie等人, J. Immunology 164:4178-4184, 2000;Tao等人, J. Immunology 143: 2595-2601, 1989;和Jefferis等人,Immunological Reviews 163:59-76, 1998。在一些实施方案中,恒定区如Eur. J.Immunol., 29:2613-2624, 1999;PCT申请号PCT/GB99/01441;和/或英国申请号9809951.8中所述进行修饰。在又其他的实施方案中,恒定区被针对N-联糖基化进行脱糖基化(aglycosylated)。在一些实施方案中,通过突变恒定区中作为N-糖基化识别序列的一部分的糖基化的氨基酸残基或侧翼残基,将恒定区针对N-联糖基化进行脱糖基化。例如,N-糖基化位点N297可以突变为A、Q、K或H。参见,Tao等人, J. Immunology 143: 2595-2601,1989;和Jefferis等人, Immunological Reviews 163:59-76, 1998。在一些实施方案中,恒定区被针对N-联糖基化脱糖基化。恒定区可被酶促地(例如通过酶肽-N糖苷酶(PNGase)去除碳水化合物),或通过在糖基化缺陷的宿主细胞中表达来针对N联糖基化进行脱糖基化。
其他抗体修饰包括已如PCT公开号WO99/58572中所述进行修饰的抗体。除针对靶分子的结合结构域以外,这些抗体还包含效应子结构域,其具有与人免疫球蛋白重链的恒定区的全部或部分基本上同源的氨基酸序列。这些抗体能够在不触发显著的补体依赖性裂解或细胞介导的靶标破坏的情况下结合靶分子。在一些实施方案中,效应子结构域能够特异性结合FcRn和/或FcγRIIb。这些一般基于衍生自两种或更多种人免疫球蛋白重链CH2结构域的嵌合结构域。以该方式修饰的抗体特别适合用于长期抗体疗法中,以避免炎症及对常规抗体疗法的其他不利反应。
本发明包括亲和力成熟的实施方案。例如,亲和力成熟的抗体可以通过本领域已知的程序产生(Marks等人, Bio/Technology, 10:779-783, 1992;Barbas等人, ProcNat. Acad. Sci, USA 91:3809-3813, 1994;Schier等人, Gene, 169:147-155, 1995;Yelton等人, J. Immunol., 155:1994-2004, 1995;Jackson等人, J. Immunol., 154(7):3310-9, 1995,Hawkins等人, J. Mol. Biol., 226:889-896, 1992;和PCT公开号WO2004/058184)。
下述方法可以用于调节抗体的亲和力和表征CDR。表征抗体的CDR和/或改变(例如改善)多肽例如抗体的结合亲和力的一种方式称为“文库扫描诱变”。通常,文库扫描诱变如下所述运行。使用本领域公认的方法,用两种或更多种(例如3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20种)氨基酸置换CDR中的一个或多个氨基酸位置。这产生小的克隆文库(在一些实施方案中,对于所分析的每个氨基酸位置一个克隆),所述克隆各自具有两个或更多个成员的复杂度(如果在每个位置处取代两种或更多种氨基酸的话)。通常,文库还包括包含天然(未取代的)氨基酸的克隆。对来自每个文库的少量克隆,例如,约20-80个克隆(取决于文库的复杂度),进行与靶多肽(或其他结合靶)的结合亲和力的筛选,并且鉴定具有增加的结合、相同的结合、降低的结合或无结合的候选物。用于测定结合亲和力的方法是本领域众所周知的。可以使用BIACORE™表面等离振子共振分析来测定结合亲和力,所述分析检测结合亲和力的约2倍或更大的差异。当起始抗体已经以相对高的亲和力(例如约10 nM或更低的K
结合亲和力可以使用Kinexa Biocensor、闪烁亲近测定、ELISA、ORIGEN免疫测定(IGEN)、荧光猝灭、荧光转移和/或酵母展示来测定。结合亲和力也可以使用合适的生物测定进行筛选。
在一些实施方案中,使用本领域公认的诱变方法(其中的一些在本文中描述),用所有20种天然氨基酸置换(在一些实施方案中,一次一个)CDR中的每个氨基酸位置。这产生了小的克隆文库(在一些实施方案中,对于所分析的每个氨基酸位置一个克隆),所述克隆各自具有20个成员的复杂度(如果在每个位置处取代所有20种氨基酸的话)。
在一些实施方案中,待筛选的文库包含在两个或更多个位置中的取代,所述位置可以在相同的CDR中或者在两个或更多个CDRs中。因此,文库可以包含在一个CDR中的两个或更多个位置处的取代。文库可以包含在两个或更多个CDRs中的两个或更多个位置处的取代。文库可以包含在3、4、5个或更多个位置中的取代,所述位置在两个、三个、四个、五个或六个CDRs中发现。可以使用低冗余密码子来制备取代。参见,例如,Balint等人, Gene 137(1):109-18, 1993的表2。
可以对具有改善结合的候选物进行测序,从而鉴定导致改善的亲和力的CDR取代突变体(也称为“改善的”取代)。还可以对结合的候选物进行测序,从而鉴定保持结合的CDR取代。
可以进行多轮筛选。例如,具有改善结合的候选物(所述候选物各自包含在一个或多个CDR的一个或多个位置处的氨基酸取代)也可用于设计第二文库,所述第二文库至少含有在每个改善的CDR位置(即,CDR中的氨基酸位置,在所述位置处取代突变体显示改善的结合)处的原始和取代的氨基酸。该文库的制备和筛选或选择在下文进一步讨论。
由于具有改善的结合、相同的结合、降低的结合或无结合的克隆的频率还提供了与每个氨基酸位置对于抗体-抗原复合体的稳定性的重要性有关的信息,文库扫描诱变还提供了用于表征CDR的手段。例如,如果在改变为所有20种氨基酸时CDR的位置保持结合,则所述位置被鉴定为不太可能是抗原结合所需要的。相反,如果CDR的位置仅在小百分比的取代中保持结合,则所述位置被鉴定为对CDR功能重要的位置。因此,文库扫描诱变方法产生了关于CDRs中可以被改变为许多不同氨基酸(包括所有20种氨基酸)的位置,以及CDR中不能被改变或只能被改变为几个氨基酸的位置的信息。
具有改善亲和力的候选物可以在第二文库中组合,所述第二文库包括改善的氨基酸、在该位置处的原始氨基酸,并且可以进一步包括在该位置处的另外取代,取决于所需或者使用所需筛选或选择方法允许的文库的复杂性。另外,需要时,可以将相邻氨基酸位置随机化为至少两个或更多个氨基酸。相邻氨基酸的随机化可以允许突变型CDR中的另外构象灵活性,其进而可以允许或促进大量改善突变的引入。该文库还可以包含在第一轮筛选中未表现出改善亲和力的位置处的取代。
使用本领域已知的任何方法,在第二文库中筛选或选择具有改善的和/或改变的结合亲和力的文库成员,包括使用BIACORE™表面等离振子共振分析的筛选,以及使用本领域已知的用于选择的任何方法的选择,所述方法包括噬菌体展示、酵母展示和核糖体展示。
用于分离抗体和制备抗体的技术如下。然而,将理解的是,所述抗体可以使用本领域已知的技术由其他多肽形成或并入其他多肽。例如,可以从由被认为具有多肽mRNA并以可检测的水平表达其的组织制备的cDNA文库分离编码目标多肽(例如,配体、受体或酶)的核酸。用进行设计以鉴定目标基因或由其编码的蛋白的探针(例如抗体或约20-80个碱基的寡核苷酸)筛选文库。可以使用如Sambrook等人, Molecular Cloning: A LaboratoryManual(New York: Cold Spring Harbor Laboratory Press, 1989)的第10-12章中所述的标准程序,进行用选择的探针对cDNA或基因组文库的筛选。
在一个方面,提供治疗受试者中的自身免疫性病症的方法,其包括向有此需要的受试者施用有效量的包含如本文所述的抗体的组合物。
如本文所用,自身免疫性病症包括但不限于炎性肠病、全身性红斑狼疮、类风湿性关节炎、糖尿病(I型)、多发性硬化、艾迪森氏病(Addison’s disease)、乳糜泻、皮肌炎、格雷氏病(Graves’ disease)、桥本氏甲状腺炎(hashimoto’s thyroiditis)、桥本氏脑病变、重症肌无力、反应性关节炎、舍格伦综合征(Sjogren syndrome)、特应性过敏症、特应性皮炎、自身免疫性肠病变、自身免疫性肝炎、自身免疫性淋巴细胞增生性综合征、自身免疫性外周神经病变、自身免疫性胰腺炎、自身免疫性多内分泌综合征、自身免疫性孕酮性皮炎、自身免疫性荨麻疹、自身免疫性葡萄膜炎、白塞氏病(Behcet’s disease)、卡斯特莱曼病(Castleman’s disease)、冷凝集素病、克罗恩氏病(Crohn’s disease)、皮肌炎、嗜酸性筋膜炎、胃肠类天疱疮、古德帕斯彻氏综合征(Goodpasture’s syndrome)、格林-巴利综合征(Guillain-Barré syndrome)、化脓性汗腺炎、嗜睡病、寻常天疱疮、多肌炎、复发性多软骨炎、风湿热、横贯性脊髓炎、溃疡性结肠炎、未分化的结缔组织病、血管炎和韦格纳氏肉芽肿(Wegener’s granulomatosis)。
本发明的CD3抗体可对一种靶标多肽的不同表位特异性或可含有对多于一种靶标多肽特异性的抗原结合结构域。参见,例如,Tutt等人, 1991, J. Immunol. 147:60-69;Kufer等人, 2004, Trends Biotechnol. 22:238-244。本发明的CD3抗体可连接至另一功能性分子(例如另一肽或蛋白)或与其一起共表达。例如,抗体或其片段可在功能上连接(例如通过化学偶联、遗传融合、非共价缔合或其他方式)至一个或多个其他分子实体(例如另一抗体或抗体片段)以产生具有第二结合特异性的多特异性抗体。
在一个方面,本发明的抗体是多特异性抗体。在具体实施方案中,CD3抗体是特异性结合人CD3的双特异性抗体。在一些这种实施方案中,双特异性抗体进一步特异性结合肿瘤抗原。在另一此实施方案中,本发明的双特异性抗体同时靶向T细胞(CD3)和肿瘤细胞,且成功地引导且活化T细胞对表达肿瘤抗原的肿瘤细胞的细胞毒性。
在前述各自的进一步实施方案中,结合CD3的双特异性抗体的特征在于以下特性中的任一种或多种:(a) 治疗、预防、改善受试者中与表达特定肿瘤抗原的恶性细胞相关的病况(例如B细胞相关的癌症,例如多发性骨髓瘤)的一种或多种症状;(b) 抑制受试者(其具有表达特定肿瘤抗原的恶性肿瘤)的肿瘤生长或进展;(c) 抑制受试者(其具有表达肿瘤抗原的一种或多种恶性细胞)中表达特定肿瘤抗原的癌症(恶性)细胞的转移;(d) 诱导表达肿瘤抗原的肿瘤的消退(例如长期消退);(e)在表达肿瘤抗原的恶性细胞中发挥细胞毒性活性;(f) 延长具有肿瘤相关病症的受试者的无进展存活;(g) 延长具有肿瘤相关病症的受试者的总体存活;(h)在具有肿瘤相关病症的受试者中减少使用额外化学治疗或细胞毒性剂;(i) 降低具有肿瘤相关病症的受试者中的肿瘤负荷;或(j) 阻断肿瘤抗原与其他尚未鉴定的因子的相互作用。
如本文所用,本发明的双特异性抗体是指两条或更多条多肽链的复合物,每条多肽链包含至少一个抗体VL区和一个抗体VH区或其片段,其中每条多肽链中的VL和VH区均来自不同的抗体。在特定方面,双特异性抗体包括含有VL和VH区两者的多肽链的二聚体或四聚体。构成多聚体蛋白的各条多肽链可以通过链间二硫键与多聚体的至少一个其他肽共价连接。
在一些这种实施方案中,本发明的双特异性抗体包含第一多肽链上的第一异二聚体促进结构域和第二多肽链上的第二异二聚体促进结构域(图1)。综上所述,所述第一和第二异二聚体促进结构域驱动异二聚化和/或稳定双特异性抗体(例如通过互补性异二聚体促进结构域上杵和臼的相互作用)和/或用于稳定双特异性抗体。在一些实施方案中,所述第一异二聚体促进结构域和所述第二异二聚体促进结构域各自包含CH2结构域和CH3结构域,其中所述CH2结构域各自和/或所述CH3结构域各自的氨基酸序列被修饰以驱动异二聚化和/或稳定双特异性抗体。
在一些实施方案中,所述第一异二聚体促进结构域可包含Fc链,所述Fc链具有经修饰以包含杵(突起)或臼(腔)的CH2和/或CH3结构域。在一些这种实施方案中,CH2结构域和/或CH3结构域的氨基酸序列包含至少一个氨基酸修饰,其中:(a)第一异二聚体促进结构域的CH3结构域形成杵(knob);和(b)第二异二聚体促进结构域的CH3结构域形成臼(hole)。在另一个这种实施方案中,第一异二聚体促进结构域的CH3结构域包含突变Y349C和/或T366W;且第二异二聚体促进结构域的CH3结构域包含突变S354C、T366S、L368A和/或Y407V(根据EU索引(EU index)编号)。
在一个实施方案中,如果第二异二聚体促进结构域包含经修饰以包含臼(腔)的CH2和/或CH3结构域,则第一异二聚体促进结构域可包含经修饰以包含含有SEQ ID NO: 78的序列的杵(突起)的CH2和/或CH3结构域。在另一个实施方案中,如果第二异二聚体促进结构域包含经修饰以包含杵(突起)的CH2和/或CH3结构域,则第一异二聚体促进结构域可包含含有SEQ ID NO: 79的序列的臼(腔)。
双特异性抗体的每条多肽链包含VL区和VH区,其可以通过包含甘氨酸和丝氨酸残基的甘氨酸-丝氨酸接头(接头1或接头2)共价连接,使得抗体结合结构域被约束免于自组装。此外,每条多肽链都包含异二聚化结构域,其促进多条多肽链的异二聚化和/或稳定化并降低不同多肽链的同二聚化的可能性。异二聚化结构域可以位于多肽链的N-末端或C-末端。异二聚化结构域可以包含长度为1、2、3、4、5、6或更多个氨基酸残基的半胱氨酸接头(接头3)。两条多肽链的相互作用可产生两个VL/VH配对,从而形成两个表位结合结构域,即,二价分子。VH或VL区都既不约束在多肽链内的任何位置,即,被限制在氨基末端或羧基末端,也不以它们彼此的相对位置限制所述区域,即,VL区可以在VH区N-末端,且反之亦然。唯一的限制是可获得互补的多肽链以形成功能性双特异性抗体。在VL和VH区源自对不同抗原特异的抗体的场合,功能性双特异性抗体的形成需要两条不同多肽链的相互作用,即,异二聚体的形成。相反,在两条不同的多肽链自由相互作用的情况下,例如,在重组表达系统中,一条包含VLA和VHB(A为第一表位,且B为第二表位),且另一条包含VLB和VHA,可以形成两个不同的结合位点:VLA-VHA和VLB-VHB。对于所有双特异性抗体多肽链对,两条链的错排或错结合是一种可能性,例如,VL-VL或VH-VH区的相互作用。然而,使用本领域已知的或本文例示的任何基于亲和力的方法,例如,亲和层析,基于正确二聚化的结合位点的免疫特异性,容易地管控功能性双特异性抗体的纯化。
在一个实施方案中,双特异性抗体的多肽链可包含各种接头和肽。接头和肽可以为0、1、2、3、4、5、6、7、8、9个或更多个氨基酸。
在一些实施方案中,结构域1通过半胱氨酸接头共价结合至第一异二聚体促进结构域,并且结构域2通过半胱氨酸接头共价结合至第二异二聚体促进结构域。半胱氨酸接头各自包括至少一个半胱氨酸残基,以允许分子内二硫键键合。在前述每一种的进一步的实施方案中,半胱氨酸接头(接头3)包含至少五个氨基酸。
在一些实施方案中,第一多肽链通过至少一个二硫键共价结合至第二多肽链。在一些这种实施方案中,在第一多肽链的接头3和第二多肽链的接头3之间形成至少一个二硫键。在另一个这种实施方案中,在第一异二聚体促进结构域和第二异二聚体促进结构域之间形成至少一个二硫键。在具体实施方案中,每个二硫键都通过连接两个半胱氨酸残基形成。在本发明的一个方面,如图1中所示的双特异性抗体包含第一多肽链和第二多肽链。在一些这种实施方案中,接头3可包含具有SEQ ID NO: 64的序列的截短人IgG1下部铰链区,其在下部铰链区前面具有至少一个甘氨酸残基。
本发明的双特异性抗体可以同时结合两个单独且不同的表位。在某些实施方案中,至少一个表位结合部位对于在免疫效应细胞上表达的例如在T淋巴细胞上表达的CD3决定簇是特异性的。在一个实施方案中,双特异性抗体分子结合效应细胞决定簇并且还活化效应细胞。
在一个方面,本发明提供第一多肽链和第二多肽链。在一个实施方案中,第一多肽链包含如SEQ ID NO: 36所示的氨基酸序列。在另一个实施方案中,第二多肽链包含如SEQID NO: 37或38中的一个或多个所示的氨基酸序列(表7)。在一个优选实施方案中,第一多肽链包含如SEQ ID NO: 36所示的氨基酸序列;且第二多肽链包含如SEQ ID NO: 37或38所示的氨基酸序列。在一个实施方案中,第二多肽链是待经由界面与第一多肽链缔合的任一多肽。表7显示GUCY2c-H2B4和GUCY2c-2B5双特异性抗体的第一多肽链和第二多肽链的序列。
表7
在具体实施方案中,本发明的双特异性抗体(a)结合人肿瘤抗原的胞外结构域;(b)显示30分钟至100天的延长的血清和肿瘤半衰期;和/或(c)在有增加的肿瘤表达水平或增加的受体密度水平的情况下,显示0.0001 nM至100 nM的较低EC
在一个实施方案中,表位结合结构域能够结合肿瘤相关抗原,所述肿瘤相关抗原与乳腺癌、卵巢癌、甲状腺癌、前列腺癌、宫颈癌、肺癌(包括但不限于非小细胞肺癌和小细胞肺癌)、膀胱癌、子宫内膜癌、头颈癌、睾丸癌、胶质母细胞瘤和消化系统癌症相关。消化系统的癌症包括但不限于食道、胃、小肠、结肠、直肠、肛门、肝、胆囊、阑尾、胆管和胰的癌症。在具体实施方案中,疗法活化细胞裂解性T细胞应答。
使用标准引物指导的PCR诱变,修饰人IgG1的Fc链以引入突变L234A、L235A和G237A(SEQ ID NO:82,根据EU索引编号),以消除(oblate)归因于与FcγRIII结合的效应子功能,从而提供了效应子功能无效表型(Canfield等人, J. Exp. Med (1991) 173: 1483-1491;Shields等人, J. Biol. Chem. (2001) 276:6591-604)。
杵于臼中是本领域中已知的用于工程改造抗体重链同二聚体以用于异二聚化的有效设计策略。在该方法中,通过在IgG1的Fc链的一条链中用较大的氨基酸置换小的氨基酸,例如,Y349C和T366W(根据EU索引编号),获得了‘杵’变体。对‘杵’进行设计以插入通过用较小的残基置换大的残基例如S354C、T366S、L368A和Y407V(根据EU索引编号)产生的Fc链互补链的CH3结构域的‘臼’中。
在一些实施方案中,引入互补突变以得到所得的Fc链的异二聚体化,使得每条Fc链将携带一组突变,对于杵(或突起)Fc链的Y349C和T366W(SEQ ID NO:78),或对于臼(或腔)Fc链的S354C、T366S、L368A和Y407V(SEQ ID NO:79),如表8中所提供的。当共转染到合适的哺乳动物宿主中时,编码氨基酸序列(例如SEQ ID NO:78和79)的DNA产生Fc结构域,其以具有与一条臼(或腔)Fc链缔合的一条杵(或突起)Fc链的双特异性抗体为主。
表8
本发明的CD3-肿瘤抗原双特异性抗体是在热稳定性研究中针对聚集稳定的,且是靶向人CD3和肿瘤抗原两者的有效的双特异性抗体-Fc融合物。杵于臼中Fc结构域允许在CHO细胞中改善的表达和改善的纯化,从而导致所期望的异二聚体的高纯度。Fc结构域内工程改造的突变取消了FcγR结合,因此潜在地避免了ADCC介导的T细胞耗竭。进一步地,如差示扫描量热法(DSC)所示的,将Fc结构域并入双特异性抗体中增强了分子的稳定性。
如果可以将双特异性抗体工程改造以包含至少一个半胱氨酸残基,其可以与本发明的另一条多肽链上的对应物半胱氨酸残基相互作用以形成链间二硫键。链间二硫键可用于稳定双特异性抗体,从而改善在重组系统中的表达和回收,从而结果产生稳定和一致的制剂,以及改善分离和/或纯化的产物在体内的稳定性。一个或多个半胱氨酸残基可以作为单个氨基酸或作为较大氨基酸序列例如铰链区的一部分引入多肽链的任何部分中。在具体方面,至少一个半胱氨酸残基被工程改造以出现在多肽链的C-末端。
本发明涵盖用于治疗、预防或管理受试者中的癌症的方法和组合物,包括向所述受试者施用治疗有效量的根据本发明工程改造的抗体,所述分子进一步结合癌症抗原。本发明的抗体对于预防、抑制、减少原发肿瘤的生长和/或消退以及癌细胞的转移特别有用。尽管不意图受特定作用机制的约束,但是本发明的抗体可以介导效应子功能,其可以导致肿瘤清除、肿瘤减少或其组合。
在一个方面,本发明提供了使用本发明的CD3抗体刺激T细胞活化的治疗性治疗方法,其中所述治疗性方法包括向有此需要的受试者施用治疗有效量的包含本发明的抗体的药物组合物。所治疗的病症是通过刺激CD3活性或信号传导而改善、缓解、抑制或预防的任一疾病或病况。在具体实施方案中,本发明提供了双特异性抗原结合分子,例如结合CD3和靶抗原的双特异性抗体。
在一个方面,本发明提供了抑制肿瘤生长的方法,其包括使所述肿瘤与有效量的结合CD3的抗体接触,所述抗体包括本文所述的那些抗体中的每一种。
在另一个方面,本发明提供了抑制受试者中的肿瘤生长的方法,其包括向所述受试者施用治疗有效量的结合CD3的抗体,包括本文所述的那些抗体中的每一种。
在另一个方面,本发明提供了调节受试者中的血管生成的方法,其包括向所述受试者施用治疗有效量的结合CD3的抗体,包括本文所述的那些抗体中的每一种。
在另一个方面,本发明提供了降低受试者中的肿瘤的致瘤性的方法,其包括向所述受试者施用治疗有效量的结合CD3的抗体,包括本文所述的那些抗体中的每一种。
在一个方面,本发明提供了用于治疗受试者中与肿瘤抗原表达有关的病况的方法。因此,本发明提供了通过工程改造双特异性抗体以免疫特异性识别肿瘤抗原和T细胞上的CD3抗原来治疗与肿瘤抗原相关的病况的方法。已经根据本发明工程改造的双特异性抗体可用于预防或治疗癌症,这是因为它们凭借CD3抗体诱导的活化杀伤T细胞具有细胞毒性活性。
在一个具体实施方案中,本发明提供了治疗癌症的方法。在具体实施方案中,所述癌症是乳腺癌、卵巢癌、甲状腺癌、前列腺癌、宫颈癌、肺癌(包括但不限于非小细胞肺癌和小细胞肺癌)、膀胱癌、子宫内膜癌、头颈癌、睾丸癌、胶质母细胞瘤癌或消化系统的癌症。在某些实施方案中,所述消化系统的癌症选自食道、胃、小肠、结肠、直肠、肛门、肝、胆囊、阑尾、胆管和胰的癌症。
在一个方面,本发明提供了如本文所公开的抗体、双特异性抗体或药物组合物,其用于疗法中。在一个具体实施方案中,本发明还提供了用于治疗本文所定义的癌症的方法中的CD3双特异性抗体。在具体实施方案中,疗法活化细胞裂解性T细胞应答。
本发明进一步提供了如本文所公开的抗体或双特异性抗体,其用于制备用于疗法中的药物。在一些实施方案中,所述疗法是癌症的治疗。在一些实施方案中,所述癌症选自乳腺癌、卵巢癌、甲状腺癌、前列腺癌、宫颈癌、肺癌(包括但不限于非小细胞肺癌和小细胞肺癌)、膀胱癌、子宫内膜癌、头颈癌、睾丸癌、胶质母细胞瘤癌或消化系统的癌症。在某些实施方案中,所述消化系统的癌症选自食道、胃、小肠、结肠、直肠、肛门、肝、胆囊、阑尾、胆管和胰的癌症。
在一个方面,本发明提供了编码如本文所公开的抗体或双特异性抗体的多核苷酸。在另一个实施方案中,本发明提供了包含如本文所公开的多核苷酸的载体。在又另一个实施方案中,本发明提供了包含如本文所公开的载体的宿主细胞。在一些这种实施方案中,宿主细胞重组产生如本文所公开的抗体或双特异性抗体。在具体实施方案中,宿主细胞选自细菌细胞系、哺乳动物细胞系、昆虫细胞系、酵母细胞系和体外无细胞蛋白合成系统。在具体实施方案中,哺乳动物细胞系是CHO细胞系。
在一个方面,提供了治疗有此需要的受试者中的癌症的方法,包括:a)提供如本文所述的双特异性抗体,和b)向所述受试者施用所述双特异性抗体。
在一些实施方案中,提供的是抑制具有表达肿瘤抗原的恶性细胞的受试者中的肿瘤生长或进展的方法,其包括向有此需要的受试者施用有效量的包含如本文所述的抗体的组合物。在一些实施方案中,提供的是抑制受试者中的表达肿瘤抗原的细胞转移的方法,其包括向有此需要的受试者施用有效量的包含如本文所述的抗体的组合物。在一些实施方案中,提供的是诱导受试者中的恶性细胞中的肿瘤消退的方法,其包括向有此需要的受试者施用有效量的包含如本文所述的抗体的组合物。
在具体的方面,相对于在没有本发明的抗体或双特异性抗体的情况下的癌细胞的生长,本发明的抗体将癌细胞的生长抑制或降低至少99%、至少95%、至少90%、至少85%、至少80%、至少75%、至少70%、至少60%、至少50%、至少45%、至少40%、至少45%、至少35%、至少30%、至少25%、至少20%或至少10%。
在具体的方面,抗体杀伤细胞或抑制或减少癌细胞的生长比在没有本发明的抗体或双特异性抗体的情况下好至少5%、至少10%、至少20%、至少25%、至少30%、至少35%、至少40%、至少45%、至少50%、至少60%、至少70%、至少75%、至少80%、至少85%、至少90%、至少95%或至少100%。
在一个方面,本发明提供了用于治疗有此需要的受试者中与肿瘤抗原表达有关的病况(例如,癌症)的有效量的包含如本文所述的双特异性抗体的组合物(例如,药物组合物)。
在另一个方面,本发明提供了如本文所述的抗体,其用于治疗有此需要的受试者中的与肿瘤抗原表达相关的病况(例如癌症)。在一些实施方案中,提供了如本文所述的抗体,其用于抑制具有表达肿瘤抗原的恶性细胞的受试者中的肿瘤生长或进展。在一些实施方案中,提供了如本文所述的抗体,其用于抑制有此需要的受试者中的表达肿瘤抗原的恶性细胞的转移。在一些实施方案中,提供了如本文所述的抗体,其用于在具有表达肿瘤抗原的恶性细胞的受试者中诱导肿瘤消退。
在另一个方面,本发明提供了如本文所述的抗体在制备用于治疗与肿瘤抗原表达有关的病况(例如,癌症)的药物中的用途。在一些实施方案中,提供了如本文所述的抗体在制备用于抑制肿瘤生长或进展的药物中的用途。在一些实施方案中,提供了如本文所述的抗体在制备用于抑制表达肿瘤抗原的恶性细胞的转移的药物中的用途。在一些实施方案中,提供了如本文所述的抗体在制备用于诱导肿瘤消退的药物中的用途。
在一些实施方案中,本文所述的方法进一步包括用另外的形式的疗法治疗受试者的步骤。在一些实施方案中,另外的形式的疗法是另外的抗癌疗法,包括,但不限于,化学疗法、辐射、外科手术、激素疗法和/或另外的免疫治疗。
本发明进一步涵盖将本发明的分子与本领域技术人员已知的用于治疗或预防癌症的其他疗法组合施用,所述其他疗法包括但不限于,当前的标准和实验化学疗法、生物疗法、免疫疗法、放射疗法或外科手术。在一些方面,本发明的分子可以与治疗或预防有效量的一种或多种本领域技术人员已知用于治疗和/或预防癌症的药剂、治疗性抗体或其他药剂组合施用。
因此,用于治疗癌症的方法包括向有此需要的受试者施用与化学治疗剂组合的有效量的本发明的多特异性抗体(例如,双特异性抗体)。这种组合治疗可以单独地、依次地或同时施用。
本文提供的剂量的量和施用频率由术语治疗有效和预防有效涵盖。取决于所施用的具体治疗剂或预防剂,癌症的严重性和类型,施用途径以及受试者的年龄、体重、反应和过去的医疗史,剂量和频率进一步可以根据特异于每个受试者的因素而不同。本领域技术人员通过考虑这种因素并通过遵循例如文献中报道的以及Physician's Desk Reference(第56版, 2002)中推荐的剂量可以选择合适的方案。
因此,除将T细胞重新定向至肿瘤特异性抗原以外,双特异性T细胞接合分子也可用于将其他诊断性或治疗性化合物携带至在其表面上表达肿瘤的细胞。因此,双特异性T细胞接合分子可直接或间接(例如经由接头)连接至药物,使得其将直接递送至荷肿瘤的细胞。治疗剂包括诸如以下的化合物:核酸、蛋白、肽、氨基酸或衍生物、糖蛋白、放射性同位素、脂质、碳水化合物或重组病毒。治疗性和诊断性核酸部分包括反义核酸、用于与单一或双链体DNA共价交联的衍生化寡核苷酸和形成三链体的寡核苷酸。
本发明进一步提供了组合物,其包含治疗有效量的本文公开的抗体和药学上可接受的载体。
本发明的抗体可以是用于施用的药物组合物的形式,其被配制以适合于所选择的施用模式,以及药学上可接受的稀释剂或赋形剂,例如缓冲剂、表面活性剂、防腐剂、增溶剂、等渗剂、稳定剂、载体等。Remington's Pharmaceutical Sciences, Mack PublishingCo., Easton Pa., 第18版, 1995提供了专业人员通常已知的配制技术纲要。
这些药物组合物可以通过本领域已知的实现治疗癌症的一般预期目的的任何方式来施用。施用途径可以是肠胃外的,在本文中被定义为是指施用模式,包括但不限于静脉内、肌内、腹膜内、皮下和关节内注射和输注。根据本发明的分子(例如,抗体、药物组合物)的施用方式和给药取决于所要斗争的疾病的类型,在适当的场合的其病期,所要控制的抗原,并存的治疗的种类(如果有的话),治疗的频率,所期望的效果的特性,以及还有受试者的体重、年龄、健康状况膳食和性别。因此,实际采用的剂量方案可以大不相同,且因此可以偏离本文陈述的剂量方案。
本发明抗体的抗体的各种制剂可以用于施用。在一些实施方案中,抗体可以纯净地施用。在一些实施方案中,抗体和药学上可接受的赋形剂可以处于各种制剂中。药学上可接受的赋形剂是本领域中已知的,并且是相对惰性的物质,其便于药理学上有效的物质的施用。例如,赋形剂可以赋予形状或稠度,或充当稀释剂。合适的赋形剂包括但不限于稳定剂、润湿剂和乳化剂、用于改变摩尔渗透压浓度的盐、包囊剂、缓冲剂和皮肤穿透增强剂。赋形剂以及用于肠胃外和非肠胃外药物递送的制剂在Remington, The Science andPractice of Pharmacy 第21版. Mack Publishing, 2005中陈述。
在一些实施方案中,将这些药剂配制用于通过注射施用(例如,腹膜内、静脉内、皮下、肌内等)。因此,这些药剂可以与药学上可接受的媒介物组合,例如盐水、林格液、葡萄糖溶液等。特定的剂量方案,即,剂量、时机和重复,将取决于特定的个体以及所述个体的医疗史。
如本文所述的抗体可以使用任何合适的方法来施用,包括通过注射(例如,腹膜内、静脉内、皮下、肌内等)来施用。如本文所述的,抗体例如单克隆抗体或双特异性抗体也可通过吸入施用。通常,对于本发明的抗体的施用,剂量取决于所治疗的宿主和特定的施用模式。在一个实施方案中,本发明的抗体的剂量范围将为约0.001 µg/kg体重至约20,000 µg/kg体重。当正治疗患者时,术语“体重”可适用。当正处理分离的细胞时,如本文所用的“体重”是指“总细胞体重”。术语“总体重”可以用于适用于分离的细胞和患者治疗两者。在本申请中,所有浓度和治疗水平均表示为“体重”或简称为“kg”,也被认为包括类似的“总细胞体重”和“总体重”浓度。然而,本领域普通技术人员将认识到多种剂量范围的实用性,例如,0.01 µg/kg体重至20,000 µg/kg体重、0.02 µg/kg体重至15,000 µg/kg体重、0.03 µg/kg体重至10,000 µg/kg体重、0.04 µg/kg体重至5,000 µg/kg体重、0.05 µg/kg体重至2,500µg/kg体重、0.06 µg/kg体重至1,000 µg/kg体重、0.07 µg/kg体重至500 µg/kg体重、0.08µg/kg体重至400 µg/kg体重、0.09 µg/kg体重至200 µg/kg体重或0.1 µg/kg体重至100 µg/kg体重。进一步地,本领域技术人员将认识到多种不同剂量水平将是有用的,例如,0.0001 µg/kg、0.0002 µg/kg、0.0003 µg/kg、0.0004 µg/kg、0.005 µg/kg、0.0007 µg/kg、0.001 µg/kg、0.1 µg/kg、1.0 µg/kg、1.5 µg/kg、2.0 µg/kg、5.0 µg/kg、10.0 µg/kg、15.0µg/kg、30.0 µg/kg、50 µg/kg、75 µg/kg、80 µg/kg、90 µg/kg、100 µg/kg、120 µg/kg、140µg/kg、150 µg/kg、160 µg/kg、180 µg/kg、200 µg/kg、225 µg/kg、250 µg/kg、275 µg/kg、300 µg/kg、325 µg/kg、350 µg/kg、375 µg/kg、400 µg/kg、450 µg/kg、500 µg/kg、550 µg/kg、600 µg/kg、700 µg/kg、750 µg/kg、800 µg/kg、900 µg/kg、1 µg/kg、5 µg/kg、10 µg/kg、12 µg/kg、15 mg/kg、20 mg/kg和/或30 mg/kg。所有这些剂量都是示例性的,并且这些点之间的任何剂量也预期在本发明中是有用的。以上剂量范围或剂量水平的任一种均可用于本发明的抗体。对于几天或更长期间的重复施用,取决于病况,持续治疗直到出现所期望的症状抑制为止或直到实现足够的治疗水平为止,例如,以抑制或延迟肿瘤生长/进展或癌细胞的转移。
取决于专业人员希望实现的药物代谢动力学衰减的模式,其他剂量方案也可能是有用的。在一个实施方案中,本发明的抗体以初始引发剂量继之以更高和/或连续的、基本上恒定的剂量施用。在一些实施方案中,预期每周一次至四次给药。在一些实施方案中,预期每月一次或每隔一个月或每三个月一次给药。通过常规技术和测定容易监控该疗法的进展。给药方案可以随着时间的过去变化。
对本发明的目的,抗体的适当剂量将取决于所使用的抗体或其组合物,待治疗的症状的类型和严重性,药剂是否是为了治疗目的施用的,以前的疗法,患者的临床史和对试剂的反应,患者对施用的药剂的清除率以及主治医生的判断。通常,医生将施用抗体,直到达到实现期望的结果的剂量为止。剂量和/或频率可在治疗过程期间变化。诸如半衰期的经验考虑通常将有助于剂量的确定。例如,可以使用与人免疫系统相容的抗体,例如人源化抗体或全人抗体,以延长抗体的半衰期并防止抗体被宿主免疫系统攻击。施用的频率可以在疗法过程期间确定和调节,并且通常但不必定基于症状的治疗和/或抑制和/或改善和/或延迟,例如,肿瘤生长抑制或延迟等。或者,抗体的持续连续释放制剂可能是合适的。用于实现持续释放的各种制剂和设备是本领域已知的。
在一个实施方案中,可以在已经给予抗体的一次或多次施用的个体中根据经验地确定抗体的剂量。向个体给予递增剂量的抗体。为了评估疗效,可以跟踪所述疾病的指示物。
在某些实施方案中,抗体的施用导致选自以下的至少一种作用:肿瘤生长的抑制,肿瘤消退,肿瘤大小的减小,肿瘤细胞数目的减小,肿瘤生长的延迟,远位效应(abscopaleffect),肿瘤转移的抑制,随着时间的过去转移病灶的减少,减少的化学治疗剂或细胞毒剂的使用,肿瘤负荷(tumor burden)的减少,无进展存活的增加,总存活的增加,完全应答,部分应答和稳定的疾病。
取决于例如接受者的生理状况,施用的目的是治疗性的还是预防性的,以及熟练的专业人员已知的其他因素,根据本发明方法的抗体的施用可以是连续的或间歇的。抗体的施用可以在预选的时间段内是基本上连续的,或者可以是一系列彼此隔开的剂量。
在一些实施方案中,可以存在多于一种抗体。可以存在至少一种、至少两种、至少三种、至少四种、至少五种不同或更多种抗体。通常,那些抗体可以具有不有害地相互影响的互补的活性。例如,可以使用一种或多种以下抗体:针对CD3上的一个表位的第一CD3抗体和针对CD3上的不同表位的第二CD3抗体。
在一些实施方案中,本公开的抗体可尤其用于肠胃外施用,例如静脉内施用或施用至体腔或器官的腔中。
通过将具有所期望的纯度的抗体与任选的药学上可接受的载体、赋形剂或稳定剂(Remington, The Science and Practice of Pharmacy 第21版. Mack Publishing,2005)混合,以冻干制剂或水溶液的形式来制备根据本发明使用的抗体的治疗制剂用于储存。可接受的载体、赋形剂或稳定剂在所使用的剂量和浓度对接受者无毒,且可以包括缓冲剂,例如磷酸盐、柠檬酸盐和其他有机酸;盐,例如氯化钠;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(例如氯化十八烷基二甲基苄基铵;氯化己烷双铵;苯扎氯铵,苄索氯铵;酚,丁醇或苄醇;对羟基苯甲酸烷基酯,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(小于约10个残基)多肽;蛋白,例如血清清蛋白、明胶或免疫球蛋白;亲水聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,如EDTA;糖,如蔗糖、甘露糖醇、海藻糖或山梨糖醇;成盐平衡离子,例如钠;金属络合物(例如,Zn-蛋白络合物);和/或非离子型表面活性剂,例如TWEEN
含有抗体的脂质体通过本领域已知的方法制备,例如在Epstein等人, Proc.Natl. Acad. Sci. USA 82:3688, 1985;Hwang等人, Proc. Natl Acad. Sci. USA 77:4030, 1980;和美国专利号4,485,045和4,544,545中所述的。具有增长的循环时间的脂质体在美国专利号5,013,556中公开。特别有用的脂质体可以通过反相蒸发方法用包含磷脂酰胆碱、胆固醇和PEG-衍生的磷脂酰乙醇胺(PEG-PE)的脂质组合物产生。脂质体通过具有确定的孔径大小的过滤器挤出以产生具有所期望的直径的脂质体。
活性成分也可以被包载在例如通过团聚技术或通过界面聚合制备的微胶囊(例如,分别为羟甲基纤维素或明胶-微胶囊和聚-(甲基丙烯酸甲酯)微胶囊)中,胶体药物递送系统(例如脂质体、清蛋白小球体、微乳状液、纳米颗粒和纳米胶囊(nanocapsules))或粗滴乳状液中。这种技术在Remington, The Science and Practice of Pharmacy 第21版.Mack Publishing, 2005中公开。
可以制备缓释制剂。缓释制剂的合适实例包括含有抗体的固体疏水聚合物的半透性基质,所述基质为定型物品的形式,例如,膜或微胶囊。缓释基质的实例包括聚酯,水凝胶(例如,聚(甲基丙烯酸-2-羟乙酯)或聚(乙烯醇)),聚交酯(美国专利号3,773,919),L-谷氨酸和L-谷氨酸7-乙酯的共聚物,非降解性乙烯乙酸乙烯酯,可降解的乳酸-乙醇酸共聚物,例如LUPRON DEPOT
待用于体内施用的制剂必须是无菌的。这容易通过例如通过过滤除菌膜的过滤来达到。通常将治疗性抗体(例如,CD3抗体)组合物放置入具有无菌出入口的容器中,例如,具有可通过皮下注射针刺穿的塞子的静脉内溶液袋或小瓶。
根据本发明的组合物可以是单位剂量形式,例如片剂,丸剂,胶囊,粉末,颗粒,溶液或悬浮液,或栓剂,用于口服、肠胃外或直肠施用,或通过吸入或吹入法施用。
为了制备固体组合物例如片剂,将主要活性成分与药学载体(例如,常规的制片成分例如玉米淀粉、乳糖、蔗糖、山梨糖醇、滑石、硬脂酸、硬脂酸镁、磷酸二钙或树胶,和其他药学稀释剂,例如,水)混合,以形成含有本发明的化合物或其无毒性的药学上可接受的盐的均匀混合物的固体预配制(preformulation)组合物。当将这些预配制组合物称为均匀的时,其意指将活性成分均匀地分散在整个组合物中,使得可以容易地将组合物细分为同等有效的单位剂量形式,例如片剂、丸剂和胶囊。然后将该固体预配制组合物细分为含有0.1至约500 mg的本发明的活性成分的上述类型的单位剂量形式。可以将新型组合物的片剂或丸剂包衣或以其他方式复合以提供给予延长的作用的优点的剂量形式。例如,片剂或丸剂可包含内部剂量和外部剂量组分,后者为在前者上面的外皮的形式。这两种组分可以被肠溶层(enteric layer)分开,所述肠溶层用来抵抗胃中的分解并允许内部组分完整地进入十二指肠或延迟释放。多种材料可用于这种肠溶层或包衣,这种材料包括许多聚合酸(polymeric acid)以及聚合酸与诸如紫胶、鲸蜡醇和乙酸纤维素的材料的混合物。
合适的表面活性剂特别地包括非离子型试剂,例如聚氧乙烯脱水山梨糖醇(例如,Tween
本发明范围内的组合物包括其中抗体以有效实现用于治疗癌症所期望的医学效果的量存在的所有组合物。尽管从一个患者到另一个患者的个体需要可能不同,但是所有组分的有效量的最佳范围的确定在具有普通技术的临床医师的能力范围内。
这种组合物的实例以及如何配制也在较早的部分和下文中进行了描述。在一些实施方案中,组合物包含一种或多种抗体。在一些实施方案中,所述抗体是人抗体、人源化抗体或嵌合抗体。在一些实施方案中,所述抗体包含能够触发所期望的免疫应答(例如抗体介导的裂解或ADCC)的恒定区。在一些实施方案中,所述抗体包含不会触发不需要的或不期望的免疫应答(例如抗体介导的裂解或ADCC)的恒定区。
应理解组合物可以包含多于一种抗体,诸如识别CD3或CD3和肿瘤抗原的不同表位的CD3抗体的混合物。其他示例性组合物包含多于一种抗体,其识别一种或多种相同的表位,或不同种类的抗体,或其结合CD3和肿瘤抗原(例如,人CD3)的不同表位。
在一些实施方案中,所述抗体可以与一种或多种额外治疗剂的施用组合施用。这些包括,但不限于,施用生物治疗剂和/或化学治疗剂,例如但不限于,疫苗,基于CAR-T细胞的疗法,放射疗法,细胞因子疗法,CD3双特异性抗体,其他免疫抑制途径的抑制剂,血管发生的抑制剂,T细胞活化剂,代谢途径的抑制剂,mTOR抑制剂,腺苷途径的抑制剂,酪氨酸激酶抑制剂,包括但不限于Inlyta,ALK抑制剂和舒尼替尼(sunitinib),BRAF抑制剂,表观遗传修饰因子,IDO1抑制剂,JAK抑制剂,STAT抑制剂,细胞周期蛋白依赖性激酶抑制剂、生物治疗剂(包括但不限于针对VEGF、VEGFR、EGFR、Her2/neu、其他生长因子受体、CD40、CD-40L、CTLA-4、OX-40、4-1BB、TIGIT和ICOS的抗体)、免疫原性剂(例如,减毒癌细胞、肿瘤抗原、抗原呈递细胞如用肿瘤衍生的抗原或核酸冲击的树突细胞、免疫刺激细胞因子(例如,IL-2、IFNα2、GM-CSF)和用编码免疫刺激细胞因子(例如但不限于GM-CSF)的基因转染的细胞)。
生物治疗剂的实例包括治疗性抗体、免疫调节剂和治疗性免疫细胞。
治疗性抗体可能具有针对多种不同的抗原的特异性。例如,治疗性抗体可以针对肿瘤相关抗原,使得抗体与抗原的结合促进表达所述抗原的细胞的死亡。在其他实例中,治疗性抗体可以针对免疫细胞上的抗原(例如,PD-1),使得所述抗体的结合防止表达所述抗原的细胞的活性的下调(且从而促进表达所述抗原的细胞的活性)。在一些情况下,治疗性抗体可能通过多种不同的机制起作用(例如,其在与表达抗原的细胞接触时既可以i)促进表达抗原的细胞死亡,又可以ii)防止抗原引起免疫细胞活性的下调)。
治疗性抗体可以针对例如如下列举的抗原。对于一些抗原,下面还包括针对所述抗原的示例性抗体(在抗原后的括号/括弧中)。如下的抗原在本文中也可称为“靶抗原”等。本文中用于治疗性抗体的靶抗原包括,例如:4-1BB(例如,乌托鲁单抗(utomilumab));5T4;A33;α-叶酸受体1(例如,mirvetuximab soravtansine);Alk-1;BCMA [例如PF-06863135(参见US9969809)];BTN1A1(例如,参见WO2018222689);CA-125(例如阿巴伏单抗(abagovomab));碳酸酐酶(Carboanhydrase)IX;CCR2;CCR4(例如莫加珠单抗(mogamulizumab));CCR5(例如乐利单抗(leronlimab));CCR8;CD3 [例如博纳吐单抗(blinatumomab)(CD3/CD19双特异性),PF-06671008(CD3/P-钙黏着蛋白双特异性),PF-06863135(CD3/BCMA双特异性),PF-07062119 (CD3/GUCY2c双特异性)],CD19(例如博纳吐单抗,MOR208);CD20(例如替伊莫单抗(ibritumomab tiuxetan)、阿托珠单抗(obinutuzumab)、奥法木单抗(ofatumumab)、利妥昔单抗(rituximab)、乌妥昔单抗(ublituximab));CD22(奥英妥珠单抗(inotuzumab ozogamicin)、帕舒托-莫塞妥莫单抗(moxetumomab pasudotox));CD25;CD28;CD30(例如维布妥昔单抗(brentuximabvedotin));CD33(例如吉妥珠单抗奥唑米星(gemtuzumab ozogamicin));CD38(例如达雷木单抗(daratumumab)、 伊沙妥昔单抗(isatuximab)),CD40;CD-40L;CD44v6;CD47;CD52(例如阿伦单抗(alemtuzumab));CD63;CD79(例如泊洛妥珠单抗(polatuzumab vedotin));CD80;CD123;CD276/B7-H3(例如omburtamab);CDH17;CEA;ClhCG;CTLA-4(例如伊匹单抗(ipilimumab)、替西木单抗(tremelimumab)),CXCR4;桥粒芯蛋白4;DLL3(例如rovalpituzumab tesirine);DLL4;E-钙黏着蛋白;EDA;EDB;EFNA4;EGFR(例如西妥昔单抗(cetuximab)、玛汀-迪妥昔珠单抗(depatuxizumab mafodotin)、耐昔妥珠单抗(necitumumab)、帕尼单抗(panitumumab));EGFRvIII;内皮唾液酸蛋白;EpCAM(例如莫度奥妥珠单抗(oportuzumab monatox));FAP;胎儿乙酰胆碱受体;FLT3(例如,参见WO2018/220584);GD2(例如地努图希单抗(dinutuximab),3F8);GD3;GITR;GloboH;GM1;GM2;GUCY2C(例如PF-07062119);HER2/neu [例如margetuximab、帕妥珠单抗(pertuzumab)、曲妥珠单抗(trastuzumab);恩美曲妥珠单抗(ado-trastuzumab emtansine)、曲妥珠单抗duocarmazine(trastuzumab duocarmazine)、PF-06804103(参见US8828401)];HER3;HER4;ICOS;IL-10;ITG-AvB6;LAG-3(例如瑞拉利单抗 (relatlimab));Lewis-Y;LG;Ly-6;M-CSF[例如PD-0360324(参见US7326414)];MCSP;间皮素(mesothelin);MUC1;MUC2;MUC3;MUC4;MUC5AC;MUC5B;MUC7;MUC16;刻缺蛋白(Notch)1;刻缺蛋白3;柄蛋白(Nectin)-4(例如维汀-恩弗妥单抗 (enfortumab vedotin));OX40 [例如PF-04518600(参见US7960515)];P-钙黏着蛋白(P-Cadherein)[例如PF-06671008(参见WO2016/001810)];PCDHB2;PD-1 [例如BCD-100、卡瑞利珠单抗(camrelizumab)、西米普利单抗(cemiplimab)、杰诺单抗(genolimzumab)(CBT-501)、MEDI0680(CBT-501)、纳武单抗(nivolumab)、派姆单抗(pembrolizumab)、RN888(参见WO2016/092419)、信迪利单抗(sintilimab)、斯巴达珠单抗(spartalizumab)、STI-A1110、替雷利珠单抗(tislelizumab)、TSR-042];PD-L1(例如阿特朱单抗(atezolizumab)、德瓦鲁单抗(durvalumab)、BMS-936559(MDX-1105)或LY3300054);PDGFRA(例如奥拉单抗(olaratumab));浆细胞抗原;PolySA;PSCA;PSMA;PTK7 [例如PF-06647020(参见US9409995)];Ror1;SAS;SCRx6;SLAMF7(例如埃罗妥珠单抗(elotuzumab));SHH;SIRPa(例如ED9、Effi-DEM);STEAP;TGF-β;TIGIT;TIM-3;TMPRSS3;TNF-α前体;TROP-2(例如戈维替康-沙西妥珠单抗(sacituzumab govitecan));TSPAN8;VEGF(例如贝伐珠单抗(bevacizumab)、溴珠单抗(brolucizumab));VEGFR1(例如雷珠单抗(ranibizumab));VEGFR2(例如雷莫芦单抗(ramucirumab)、雷珠单抗));Wue-1。
治疗性抗体可以具有任何合适的形式。例如,治疗性抗体可以具有本文别处所述的任何形式。在一些实施方案中,治疗性抗体可以是裸抗体。在一些实施方案中,治疗性抗体可以与药物/药剂连接(也称为“抗体-药物缀合物”(ADC))。在一些实施方案中,可以将针对特定抗原的治疗性抗体并入多特异性抗体(例如双特异性抗体)中。
在一些实施方案中,针对抗原的抗体可以与药物/药剂缀合。连接的抗体-药物分子也称为“抗体-药物缀合物”(ADC)。药物/药剂可以直接地或通过接头间接地与抗体连接。最常见的是,有毒药物与抗体相连,使得ADC与相应抗原的结合促进表达所述抗原的细胞的杀伤。例如,与有毒药物连接的ADCs对于靶向肿瘤相关抗原特别有用,以促进表达肿瘤相关抗原的肿瘤细胞的杀伤。在其他实施方案中,可以与抗体连接的药剂可以是例如免疫调节剂(例如,以调节在ADC附近的免疫细胞的活性)、成像剂(例如,以促进受试者或来自受试者的生物样品中的ADC的成像)或增加抗体血清半衰期或生物活性的药剂。
在各种出版物中已经描述了将细胞毒剂或其他治疗剂与抗体缀合的方法。例如,可以通过赖氨酸侧链胺或通过由还原链间二硫键活化的半胱氨酸巯基对抗体进行化学修饰以用于使缀合反应发生。参见,例如,Tanaka等人, FEBS Letters 579:2092-2096, 2005和Gentle等人, Bioconjugate Chem. 15:658-663, 2004。还已经描述了用于以确定的化学计量的特定药物缀合的在抗体的特定位点工程改造的反应性半胱氨酸残基。参见,例如,Junutula等人, Nature Biotechnology, 26:925-932, 2008。在国际申请WO2012/059882和WO2015015448中也描述了在有转谷氨酰胺酶和胺(例如,包含或附着至活性胺的细胞毒剂)的情况下使用酰基供体含谷氨酰胺的标签或通过多肽工程改造而使其处于活性状态(即,作为酰基供体形成共价键的能力)的内源性谷氨酰胺的缀合。在一些实施方案中,ADC可以具有在出于所有目的在此通过引用并入的WO2016166629中提供的ADCs的任何特点或特征。
可以以ADC形式与抗体连接的药物/药剂可以包括例如细胞毒剂、免疫调节剂、成像剂、治疗性蛋白、生物聚合物或寡核苷酸。
可以并入ADC的示例性细胞毒剂包括蒽环类、澳瑞他汀(auristatin)、多拉司他汀(dolastatin)、康普瑞汀(combretastatin)、倍癌霉素(duocarmycin)、吡咯并苯并二氮杂䓬二聚体、吲哚啉-苯并二氮杂䓬二聚体、烯二炔(enediyne)、格尔德霉素、美登素、嘌呤霉素、紫杉烷、长春花生物碱、喜树碱、tubulysin、哈米特林(hemiasterlin)、spliceostatin、pladienolide及其立体异构体、等构物、类似物或衍生物。
可以并入ADC的示例性免疫调节剂包括更昔洛韦(gancyclovier)、依那西普(etanercept)、他克莫司(tacrolimus)、西罗莫司、voclosporin、环孢菌素、雷帕霉素、环磷酰胺、硫唑嘌呤(azathioprine)、霉酚酸酯(mycophenolgate mofetil)、氨甲蝶呤(methotrextrate)、糖皮质激素及其类似物、细胞因子、干细胞生长因子、淋巴毒素、肿瘤坏死因子(TNF)、造血因子、白介素(例如,白介素-1(IL-1)、IL-2、IL-3、IL-6、IL-10、IL-12、IL-18和IL-21)、集落刺激因子(例如,粒细胞集落刺激因子(G-CSF)和粒细胞巨噬细胞集落刺激因子(GM-CSF))、干扰素(例如,干扰素-α、-β和-γ)、称为“S 1因子”的干细胞生长因子、促红细胞生成素和血小板生成素或其组合。
ADC中可包括的示例性成像剂包括荧光素、罗丹明、镧系元素磷光体及其衍生物,或与螯合剂结合的放射性同位素。荧光团的实例包括,但不限于,异硫氰酸荧光素(FITC)(例如,5-FITC)、荧光素亚磷酰胺(FAM)(例如5-FAM)、伊红、羧基荧光素、赤藓红、AlexaFluor.RTM.(例如,Alexa 350、405、430、488、500、514、532、546、555、568、594、610、633、647、660、680、700或750)、羧基四甲基罗丹明(TAMRA)(例如,5,-TAMRA)、四甲基罗丹明(TMR)和磺基罗丹明(SR)(例如,SR101)。螯合剂的实例包括,但不限于,1,4,7,10-四氮杂环十二烷-N,N',N'',N'''-四乙酸(DOTA)、1,4,7-三氮杂环壬烷-1,4,7-三乙酸(NOTA)、1,4,7-三氮杂环壬烷、1-戊二酸-4,7-乙酸(去铁胺)、二亚乙基三胺五乙酸(DTPA)和1,2-双(邻氨基苯氧基)乙烷-N,N,N',N'-四乙酸)(BAPTA)。
ADC中可包括的示例性治疗性蛋白包括毒素、激素、酶和生长因子。
可并入ADC中的示例性生物相容性聚合物包括水溶性聚合物,例如聚乙二醇(PEG)或其衍生物,和含兼性离子的生物相容性聚合物(例如,含磷酸胆碱的聚合物)。
可并入ADC中的示例性生物相容性聚合物包括反义寡核苷酸。
在一些实施方案中,可以将本文提供的针对抗原的抗体并入双特异性抗体分子中。双特异性抗体是对至少两种不同抗原具有结合特异性的单克隆抗体。
在一些实施方案中,双特异性抗体包含第一抗体可变结构域和第二抗体可变结构域,其中所述第一抗体可变结构域能够通过特异性结合如本文所提供的CD3而募集人类免疫效应细胞的活性,且其中所述第二抗体可变结构域能够特异性结合靶抗原。在一些实施方案中,抗体具有IgG1、IgG2、IgG3或IgG4同种型。在一些实施方案中,抗体包含免疫惰性Fc区。在一些实施方案中,抗体是人抗体或人源化抗体。
靶抗原通常在患病状况中的靶细胞(例如癌细胞)上表达。双特异性抗体中尤其感兴趣的靶抗原的实例包括但不限于 BCMA、EpCAM (上皮细胞黏着分子)、CCR5 (5型趋化因子受体)、CD19、HER (人表皮生长因子受体)-2/neu、HER-3、HER-4、EGFR (表皮生长因子受体)、PSMA、CEA、MUC-1 (黏蛋白)、MUC2、MUC3、MUC4、MUC5AC、MUC5B、MUC7、CIhCG、Lewis-Y、CD20、CD33、CD30、神经节苷酯GD3、9-O-乙酰基-GD3、GM2、Globo H、岩藻糖基GM1、Poly SA、GD2、碳酸酐酶IX (MN/CA IX)、CD44v6、Shh (Sonic Hedgehog)、Wue-1、浆细胞抗原、(膜结合) IgE、MCSP (黑色素瘤硫酸软骨素蛋白多糖)、CCR8、TNF-α前体、STEAP、间皮素、A33抗原、PSCA (前列腺干细胞抗原)、Ly-6;桥粒芯糖蛋白4、E-钙黏着蛋白新表位、胎儿乙酰胆碱受体、CD25、CA19-9标志物、CA-125标志物和MIS (Muellerian抑制性物质(MuellerianInhibitory Substance)) II型受体、sTn (唾液酸化Tn抗原;TAG-72)、FAP (成纤维细胞活化抗原)、内皮唾液酸蛋白、EGFRvIII、LG、SAS、PD-L1、CD47、SIRPa和CD63。
在一些实施方案中,双特异性抗体包含全长人抗体,其中所述双特异性抗体的第一抗体可变结构域能够通过特异性结合CD3募集人免疫效应细胞的活性,且其中异二聚体蛋白的第二抗体可变结构域能够特异性结合靶抗原(例如CD20、EpCAM或P-钙黏着蛋白)。
用于制备双特异性抗体的方法是本领域已知的(参见例如,Suresh等人,Methodsin Enzymology 121:210,1986)。传统上,双特异性抗体的重组生产基于两个免疫球蛋白重链-轻链对的共表达,其中两条重链具有不同的特异性(Millstein和Cuello,Nature 305,537-539,1983)。
根据制备双特异性抗体的一种方法,将具有期望结合特异性(抗体-抗原组合位点)的抗体可变结构域与免疫球蛋白恒定区序列融合。融合物优选具有免疫球蛋白重链恒定区,其包含铰链、CH2和CH3区的至少一部分。优选具有在融合物的至少一个中存在的第一重链恒定区(CH1),其含有轻链结合所必需的位点。将编码免疫球蛋白重链融合物和(如果需要的话)免疫球蛋白轻链的DNA插入分开的表达载体内,并且共转染到合适的宿主生物内。当在构建中使用的不相等比率的三条多肽链提供最佳产率时,这在实施方案中提供了调节三个多肽片段的相互比例的极大灵活性。然而,当至少两条多肽链以相等比率的表达导致高产率时,或当比率没有特别意义时,能够在一个表达载体中插入关于两条或所有三条多肽链的编码序列。
在一种方法中,双特异性抗体由在一个臂中具有第一结合特异性的杂合免疫球蛋白重链、以及在另一个臂中的杂合免疫球蛋白重链-轻链对(提供第二结合特异性)构成。在双特异性分子的仅一半中具有免疫球蛋白轻链的这种不对称结构,促进期望的双特异性化合物与不需要的免疫球蛋白链组合的分开。这种方法在PCT公开号WO 94/04690中描述。
在另一种方法中,双特异性抗体由一个臂中的第一铰链区中的氨基酸修饰构成,并且第一铰链区中的取代/置换的氨基酸具有与另一个臂中的第二铰链区中的相应氨基酸相反的电荷。这种方法在国际专利申请号PCT/US2011/036419(WO2011/143545)中描述。
在另一种方法中,通过改变或工程改造第一免疫球蛋白样Fc区和第二免疫球蛋白样Fc区(例如,铰链区和/或CH3区)之间的界面,增强了期望的异源多聚体或异源二聚体蛋白(例如,双特异性抗体)的形成。在这种方法中,双特异性抗体可以由CH3区构成,其中CH3区包含一起相互作用以形成CH3界面的第一CH3多肽和第二CH3多肽,其中CH3界面内的一个或多个氨基酸使同源二聚体形成失稳,且在静电上没有不利于同源二聚体形成。这种方法在国际专利申请号PCT/US2011/036419(WO2011/143545)中描述。
在另一种方法中,在转谷氨酰胺酶的存在下,使用对于在一个臂中针对表位(例如BCMA)的抗体工程改造的含有谷氨酰胺的肽标签、以及对于在另一个臂中针对第二表位的第二抗体工程改造的另一种肽标签(例如,含有Lys的肽标签或反应性内源Lys),可以生成双特异性抗体。这种方法在国际专利申请号PCT/IB2011/054899(WO2012/059882)中描述。
在一些实施方案中,双特异性抗体的第一和第二抗体可变结构域包含在各位置处的氨基酸修饰,其中双特异性抗体的第一和第二抗体可变结构域包含人IgG2的铰链区中位置223、225和228处的氨基酸修饰(例如(C223E或C223R)、(E225R)和(P228E或P228R))和CH3区中位置409或368处的氨基酸修饰(例如K409R或L368E (EU编号方案))。
在一些实施方案中,双特异性抗体的第一和第二抗体可变结构域包含人IgG1的铰链区中位置221和228处的氨基酸修饰(例如(D221R或D221E)和(P228R或P228E))和CH3区中位置409或368处的氨基酸修饰(例如K409R或L368E (EU编号方案))。
在一些实施方案中,双特异性抗体的第一和第二抗体可变结构域包含人IgG4的铰链区中位置228处的氨基酸修饰(例如(P228E或P228R))和CH3区中位置409或368处的氨基酸修饰(例如R409或L368E (EU编号方案))。
在一些实施方案中,双特异性抗体可具有WO2016166629中提供的任一双特异性抗体的特征或特性中的任一种,其出于所有目的在此通过引用并入。
免疫调节剂包括可以刺激受试者中的免疫应答的多种不同分子类型,例如模式识别受体(PRR)激动剂、免疫刺激细胞因子和癌症疫苗。
模式识别受体(PRRs)是由免疫系统的细胞表达的且识别与病原体和/或细胞损伤或死亡相关的多种分子的受体。PRRs与先天免疫应答和适应性免疫免疫应答两者都有关。PRR激动剂可用于刺激受试者中的免疫应答。存在多种类别的PRR分子,包括toll-样受体(TLRs)、RIG-I-样受体(RLRs)、核苷酸结合寡聚化结构域(NOD)-样受体(NLRs)、C-型凝集素受体(CLRs)以及干扰素基因刺激物(STING)蛋白。
术语“TLR”和“toll-样受体”是指任何toll-样受体。toll-样受体是与活化免疫应答有关的受体。TLRs识别例如在微生物中表达的病原体相关性分子模式(PAMPs),以及从死亡或垂死细胞释放的内源损伤相关性分子模式(DAMPs)。
活化TLRs(且从而活化免疫应答)的分子在本文中被称为“TLR激动剂”。TLR激动剂可包括例如小分子(例如具有低于约1000道尔顿的分子量的有机分子)以及大分子(例如寡核苷酸和蛋白)。一些TLR激动剂是对单个类型的TLR(例如 TLR3或TLR9)特异性的,而一些TLR激动剂则活化两种或更多种类型的TLR(例如TLR7和TLR8两者)。
本文提供的示例性TLR激动剂包括TLR2、TLR3、TLR4、TLR5、TLR6、TLR7、TLR8和TLR9的激动剂。
示例性小分子TLR激动剂包括在例如美国专利号4,689,338;4,929,624;5,266,575;5,268,376;5,346,905;5,352,784;5,389,640;5,446,153;5,482,936;5,756,747;6,110,929;6,194,425;6,331,539;6,376,669;6,451,810;6,525,064;6,541,485;6,545,016;6,545,017;6,573,273;6,656,938;6,660,735;6,660,747;6,664,260;6,664,264;6,664,265;6,667,312;6,670,372;6,677,347;6,677,348;6,677,349;6,683,088;6,756,382;6,797,718;6,818,650;和7,7091,214;美国专利公开号2004/0091491、2004/0176367和2006/0100229;和国际公开号WO 2005/18551、WO 2005/18556、WO 2005/20999、WO 2005/032484、WO 2005/048933、WO 2005/048945、WO 2005/051317、WO 2005/051324、WO 2005/066169、WO 2005/066170、WO 2005/066172、WO 2005/076783、WO 2005/079195、WO 2005/094531、WO 2005/123079、WO 2005/123080、WO 2006/009826、WO 2006/009832、WO 2006/026760、WO 2006/028451、WO 2006/028545、WO 2006/028962、WO 2006/029115、WO 2006/038923、WO 2006/065280、WO 2006/074003、WO 2006/083440、WO 2006/086449、WO 2006/091394、WO 2006/086633、WO 2006/086634、WO 2006/091567、WO 2006/091568、WO 2006/091647、WO 2006/093514和WO 2006/098852中公开的那些。
小分子TLR激动剂的额外实例包括某些嘌呤衍生物(例如美国专利号6,376,501和6,028,076中描述的那些)、某些咪唑并喹啉酰胺(imidazoquinoline amide)衍生物(例如美国专利号6,069,149中描述的那些)、某些咪唑并吡啶衍生物(例如美国专利号6,518,265中描述的那些)、某些苯并咪唑衍生物(例如美国专利号6,387,938中描述的那些)、与五元含氮杂环稠合的4-氨基嘧啶的某些衍生物(例如美国专利号6,376,501;6,028,076和6,329,381;以及WO 02/08905中描述的腺嘌呤衍生物)和某些3-β-D-呋喃核糖基噻唑并[4,5-d]嘧啶衍生物(例如在美国公开号2003/0199461中描述的那些)以及某些小分子免疫强化剂化合物,例如在美国专利公开号2005/0136065中描述的那些。
示例性的大分子TLR激动剂包括寡核苷酸序列。一些TLR激动剂寡核苷酸序列含有胞嘧啶-鸟嘌呤二核苷酸(CpG),并描述于例如美国专利号6,194,388;6,207,646;6,239,116;6,339,068;和6,406,705中。一些含CpG的寡核苷酸可包括合成的免疫调节结构基序,如例如在美国专利号6,426,334和6,476,000中描述的那些。其他TLR激动剂核苷酸序列缺乏CpG序列,并且例如在国际专利公开号WO 00/75304中描述。更其他的TLR激动剂核苷酸序列包括富含鸟苷和尿苷的单链RNA(ssRNA),如例如在Heil等人, Science, vol. 303, pp.1526-1529, 2004年3月5日中描述的那些。
其他TLR激动剂包括生物分子,例如氨烷基氨基葡糖苷磷酸(AGPs),并且在例如美国专利号6,113,918;6,303,347;6,525,028;和6,649,172中描述。
TLR激动剂还包括灭活的病原体或其级分,其可以活化多种不同类型的TLR受体。示例性的病原体衍生的TLR激动剂包括BCG、奥布分枝杆菌(mycobacterium obuense)提取物、Talimogene laherparepvec(T-Vec)(衍生自HSV-1)和Pexa-Vec(衍生自痘苗病毒)。
在一些实施方案中,TLR激动剂可以是特异性结合TLR的激动剂抗体。
下面提供了各种TLRs以及TLR激动剂的简要说明。在下面对于特定TLR的TLR激动剂的列表不应解释为表示给定的TLR激动剂必定仅活化该TLR(例如,某些分子可以活化多种类型的TLR,或甚至多种类别的PRR)。例如,下面作为示例性TLR4激动剂提供的一些分子也可以是TLR5激动剂。
术语“TLR1”和“toll-样受体1”是指任何形式的TLR1受体,以及保留至少一部分TLR1活性的变体、同种型和物种同源物。除非有不同的说明,例如通过具体参考人TLR1,否则TLR1包括所有哺乳动物物种的天然序列TLR1,例如,人、猴和小鼠。在UniProt条目号Q15399下提供了一种示例性人TLR1。
如本文所用的“TLR1激动剂”意指结合TLR1后(1)刺激或活化TLR1,(2)增强、增加、促进、诱导或延长TLR1的活性、功能或存在,或(3)增强、增加、促进或诱导TLR1的表达的任何分子。在本发明的治疗方法、药物和用途的任何一种中有用的TLR1激动剂包括,例如,结合TLR1的细菌脂蛋白及其衍生物。
在本发明的治疗方法、药物和用途中有用的TLR1激动剂的实例包括例如细菌脂蛋白及其衍生物,例如SPM-105(衍生自高压灭菌的分枝杆菌)、OM-174(脂质A衍生物)、OmpS1(来自伤寒沙门氏菌(Salmonella typhi)的孔蛋白)、OmpS1(来自伤寒沙门氏菌的孔蛋白)、OspA(来自布氏疏螺旋体(Borrelia burgdorferi))、MALP-2(支原体巨噬细胞活化脂肽-2kD)、STF(可溶性结核因子)、CU-T12-9、Diprovocim和衍生自细胞壁组分的脂肽,例如PAM2CSK4、PAM3CSK4和PAM3Cys。
TLR1可以与TLR2形成异二聚体,且因此,许多TLR1激动剂也是TLR2激动剂。
术语“TLR2”和“toll-样受体2”是指任何形式的TLR2受体,以及保留至少一部分TLR2活性的变体、同种型和物种同源物。除非有不同的说明,例如通过具体参考人TLR2,否则TLR2包括所有哺乳动物物种的天然序列TLR2,例如,人、猴和小鼠。在UniProt条目号O60603下提供了一种示例性人TLR2。
如本文所用的“TLR2激动剂”意指结合TLR2后(1)刺激或活化TLR2,(2)增强、增加、促进、诱导或延长TLR2的活性、功能或存在,或(3)增强、增加、促进或诱导TLR2的表达的任何分子。在本发明的治疗方法、药物和用途的任何一种中有用的TLR2激动剂包括,例如,结合TLR2的细菌脂蛋白及其衍生物。
在本发明的治疗方法、药物和用途中有用的TLR2激动剂的实例包括例如细菌脂蛋白(例如二酰化脂蛋白)及其衍生物,例如SPM-105(衍生自高压灭菌的分枝杆菌)、OM-174(脂质A衍生物)、OmpS1(来自伤寒沙门氏菌的孔蛋白)、OmpS1(来自伤寒沙门氏菌的孔蛋白)、OspA(来自布氏疏螺旋体)、MALP-2(支原体巨噬细胞活化脂肽-2kD)、STF(可溶性结核因子)、CU-T12-9、Diprovocim、Amplivant和衍生自细胞壁组分的脂肽,例如PAM2CSK4、PAM3CSK4和PAM3Cys。
TLR2可以与TLR1或TLR6形成异二聚体,且因此,许多TLR2激动剂也是TLR1或TLR6激动剂。
术语“TLR3”和“toll-样受体3”是指任何形式的TLR3受体,以及保留至少一部分TLR3活性的变体、同种型和物种同源物。除非有不同的说明,例如通过具体参考人TLR3,否则TLR3包括所有哺乳动物物种的天然序列TLR3,例如,人、猴和小鼠。在UniProt条目号O15455下提供了一种示例性人TLR3。
如本文所用的“TLR3激动剂”意指结合TLR3后(1)刺激或活化TLR3,(2)增强、增加、促进、诱导或延长TLR3的活性、功能或存在,或(3)增强、增加、促进或诱导TLR3的表达的任何分子。在本发明的治疗方法、药物和用途的任何一种中有用的TLR3激动剂包括,例如,结合TLR3的核酸配体。
在本发明的治疗方法、药物和用途中有用的TLR3激动剂的实例包括TLR3配体,例如合成的dsRNA、聚肌胞苷酸[“poly(I:C)”](可从例如InvivoGen以高分子量(HMW)和低分子量(LMW)制剂获得)、聚腺尿苷酸(polyadenylic-polyuridylic acid)[“poly(A:U)”](可从例如InvivoGen获得)、polyICLC(参见Levy等人, Journal of Infectious Diseases,vol. 132, no. 4, pp. 434-439, 1975)、安普利近(Ampligen)(参见Jasani等人,Vaccine, vol. 27, no. 25-26, pp. 3401-3404, 2009)、Hiltonol、Rintatolimod和RGC100(参见Naumann等人, Clinical and Developmental Immunology, vol. 2013, 文章ID 283649)。
术语“TLR4”和“toll-样受体4”是指任何形式的TLR4受体,以及保留至少一部分TLR4活性的变体、同种型和物种同源物。除非有不同的说明,例如通过具体参考人TLR4,否则TLR4包括所有哺乳动物物种的天然序列TLR4,例如,人、猴和小鼠。在UniProt条目号O00206下提供了一种示例性人TLR4。
如本文所用的“TLR4激动剂”意指结合TLR4后(1)刺激或活化TLR4,(2)增强、增加、促进、诱导或延长TLR4的活性、功能或存在,或(3)增强、增加、促进或诱导TLR4的表达的任何分子。在本发明的治疗方法、药物和用途的任何一种中有用的TLR4激动剂包括,例如,结合TLR4的细菌脂多糖(LPS)及其衍生物。
在本发明的治疗方法、药物和用途中有用的TLR4激动剂的实例包括,例如,细菌脂多糖(LPS)及其衍生物,例如B:0111(Sigma)、单磷酰脂质A(MPLA)、3DMPL(3-O-脱酰MPL)、GLA-AQ、G100、AS15、ASO2、GSK1572932A(GlaxoSmithKline,英国)。
术语“TLR5”和“toll-样受体5”是指任何形式的TLR5受体,以及保留至少一部分TLR5活性的变体、同种型和物种同源物。除非有不同的说明,例如通过具体参考人TLR5,否则TLR5包括所有哺乳动物物种的天然序列TLR5,例如,人、猴和小鼠。在UniProt条目号O60602下提供了一种示例性人TLR5。
如本文所用的“TLR5激动剂”意指结合TLR5后(1)刺激或活化TLR5,(2)增强、增加、促进、诱导或延长TLR5的活性、功能或存在,或(3)增强、增加、促进或诱导TLR5的表达的任何分子。在本发明的治疗方法、药物和用途的任何一种中有用的TLR5激动剂包括,例如,结合TLR5的细菌鞭毛蛋白及其衍生物。
在本发明的治疗方法、药物和用途中有用的TLR5激动剂的实例包括,例如,从枯草芽孢杆菌(B. subtilis)纯化的细菌鞭毛蛋白、从铜绿假单胞菌(P. aeruginosa)纯化的鞭毛蛋白、从鼠伤寒沙门氏菌(S. typhimurium)纯化的鞭毛蛋白和重组鞭毛蛋白(全部可从InvivoGen获得)、entolimod(CBLB502;药理学最优化的鞭毛蛋白衍生物)。
术语“TLR6”和“toll-样受体6”是指任何形式的TLR6受体,以及保留至少一部分TLR6活性的变体、同种型和物种同源物。除非有不同的说明,例如通过具体参考人TLR6,否则TLR6包括所有哺乳动物物种的天然序列TLR6,例如,人、猴和小鼠。在UniProt条目号Q9Y2C9下提供了一种示例性人TLR6。
如本文所用的“TLR6激动剂”意指结合TLR6后(1)刺激或活化TLR6,(2)增强、增加、促进、诱导或延长TLR6的活性、功能或存在,或(3)增强、增加、促进或诱导TLR6的表达的任何分子。在本发明的治疗方法、药物和用途的任何一种中有用的TLR6激动剂包括,例如,结合TLR6的细菌脂肽及其衍生物。
在本发明的治疗方法、药物和用途中有用的TLR6激动剂的实例包括,例如,上文提供的许多TLR2激动剂,这是因为TLR2和TLR6可以形成异二聚体。TLR6也可以与TLR4形成异二聚体,并且TLR6激动剂可以包括上文提供的各种TLR4激动剂。
术语“TLR7”和“toll-样受体7”是指任何形式的TLR7受体,以及保留至少一部分TLR7活性的变体、同种型和物种同源物。除非有不同的说明,例如通过具体参考人TLR7,否则TLR7包括所有哺乳动物物种的天然序列TLR7,例如,人、猴和小鼠。在UniProt条目号Q9NYK1下提供了一种示例性人TLR7。
如本文所用的“TLR7激动剂”意指结合TLR7后(1)刺激或活化TLR7,(2)增强、增加、促进、诱导或延长TLR7的活性、功能或存在,或(3)增强、增加、促进或诱导TLR7的表达的任何分子。在本发明的治疗方法、药物和用途的任何一种中有用的TLR7激动剂包括,例如,结合TLR7的核酸配体。
在本发明的治疗方法、药物和用途中有用的TLR7激动剂的实例包括重组单链(“ss”)RNA,咪唑并喹啉化合物如咪喹莫特(R837),嘎德莫特(gardiquimod)和瑞喹莫德(resiquimod)(R848);罗唑利宾(7-烯丙基-7,8-二氢-8-氧代鸟苷)和相关化合物;7-硫杂-8-氧代鸟苷,7-脱氮鸟苷和相关的鸟苷类似物;ANA975(Anadys Pharmaceuticals)和相关化合物;SM-360320(Sumimoto);3M-01,3M-03,3M-852和3M-S-34240(3MPharmaceuticals);GSK2245035(GlaxoSmithKline;8-氧腺嘌呤分子),AZD8848(AstraZeneca;8-氧腺嘌呤分子),MEDI9197(Medimmune;以前是3M-052),ssRNA40,和腺苷类似物,例如UC-1V150(Jin等人, Bioorganic Medicinal Chem Lett (2006) 16:4559-4563,化合物4)。许多TLR7激动剂也是TLR8激动剂。
术语“TLR8”和“toll-样受体8”是指任何形式的TLR8受体,以及保留至少一部分TLR8活性的变体、同种型和物种同源物。除非有不同的说明,例如通过具体参考人TLR8,否则TLR8包括所有哺乳动物物种的天然序列TLR8,例如,人、猴和小鼠。在UniProt条目号Q9NR97下提供了一种示例性人TLR8。
如本文所用的“TLR8激动剂”意指结合TLR8后(1)刺激或活化TLR8,(2)增强、增加、促进、诱导或延长TLR8的活性、功能或存在,或(3)增强、增加、促进或诱导TLR8的表达的任何分子。在本发明的治疗方法、药物和用途的任何一种中有用的TLR8激动剂包括,例如,结合TLR8的核酸配体。
在本发明的治疗方法、药物和用途中有用的TLR8激动剂的实例包括重组单链ssRNA,咪喹莫特(R837),嘎德莫特,瑞喹莫德(R848),3M-01,3M-03,3M-852和3M-S-34240(3M Pharmaceuticals);GSK2245035(GlaxoSmithKline;8-氧腺嘌呤分子),AZD8848(AstraZeneca;8-氧腺嘌呤分子),MEDI9197(Medimmune;以前是3M-052),Poly-G10,Motolimod和上文提供的各种TLR7激动剂(如以前所指出的,许多TLR7激动剂也是TLR8激动剂)。
术语“TLR9”和“toll-样受体9”是指任何形式的TLR9受体,以及保留至少一部分TLR9活性的变体、同种型和物种同源物。除非有不同的说明,例如通过具体参考人TLR9,否则TLR9包括所有哺乳动物物种的天然序列TLR9,例如,人、猴和小鼠。在UniProt条目号Q9NR96下提供了一种示例性人TLR9。
如本文所用的“TLR9激动剂”意指结合TLR9后(1)刺激或活化TLR9,(2)增强、增加、促进、诱导或延长TLR9的活性、功能或存在,或(3)增强、增加、促进或诱导TLR9的表达的任何分子。在本发明的治疗方法、药物和用途的任何一种中有用的TLR9激动剂包括,例如,结合TLR9的核酸配体。
在本发明的治疗方法、药物和用途中有用的TLR9激动剂的实例包括未甲基化的含CpG的DNA,免疫刺激寡脱氧核苷酸(ODN),例如含CpG的ODN,例如CpG24555、CpG10103、CpG7909(PF-3512676/阿托莫德(agatolimod))、CpG1018、AZD1419、ODN2216、MGN1703、SD-101、1018ISS和CMP-001。TLR9激动剂还包括含有合成的胞嘧啶-磷酸-2'-脱氧-7-脱氮鸟苷二核苷酸(CpR)的核苷酸序列(Hybridon, Inc.)、dSLIM-30L1和免疫球蛋白-DNA复合物。示例性的TLR9激动剂公开于WO2003/015711、WO2004/016805、WO2009/022215、PCT/US95/01570、PCT/US97/19791和美国专利号8552165、6194388和6239116中,其出于所有目的在此通过引用并入。
RLRs包括检测例如dsRNAs的各种胞质PRRs。RLRs的实例包括,例如,视黄酸诱导型基因I(RIG-I)、黑色素瘤分化相关基因5(MDA-5)和遗传学与生理学实验室2(Laboratoryof Genetics and Physiology 2)(LGP2)。
如本文所用的“RLR激动剂”意指结合RLR后(1)刺激或活化RLR,(2)增强、增加、促进、诱导或延长RLR的活性、功能或存在,或(3)增强、增加、促进或诱导RLR的表达的任何分子。在本发明的治疗方法、药物和用途的任何一种中有用的RLR激动剂包括,例如,结合RLRs的核酸及其衍生物和特异性结合RLRs的激动性(agonistic)单克隆抗体(mAb)。
在本发明的治疗方法、药物和用途中有用的RLRs激动剂的实例包括,例如,具有未加帽的5'三磷酸的短双链RNA(RIG-I激动剂);poly I:C(MDA-5激动剂)和BO-112(MDA-A激动剂)。
NLRs包括检测例如损伤相关性分子模式(DAMP)分子的各种PRRs。NLRs包括亚家族NLRA-A、NLRB-B、NLRC-C和NLRP-P。NLRs的实例包括例如NOD1、NOD2、NAIP、NLRC4和NLRP3。
如本文所用的“NLR激动剂”意指结合NLR后(1)刺激或活化NLR,(2)增强、增加、促进、诱导或延长NLR的活性、功能或存在,或(3)增强、增加、促进或诱导NLR的表达的任何分子。在本发明的治疗方法、药物和用途的任何一种中有用的NLR激动剂包括,例如,结合NLRs的DAMPs及其衍生物和特异性结合NLRs的激动性单克隆抗体(mAb)。
在本发明的治疗方法、药物和用途中有用的NLR激动剂的实例包括,例如,脂质体胞壁酰三肽/米伐木肽(mifamurtide)(NOD2激动剂)。
CLRs包括检测例如碳水化合物和糖蛋白的各种PRRs。CLRs包括跨膜CLRs和分泌型CLRs两者。CLRs的实例包括例如DEC-205/CD205、巨噬细胞甘露糖受体(MMR)、Dectin-1、Dectin-2、mincle、DC-SIGN、DNGR-1和甘露糖结合凝集素(MBL)。
如本文所用的“CLR激动剂”意指结合CLR后(1)刺激或活化CLR,(2)增强、增加、促进、诱导或延长CLR的活性、功能或存在,或(3)增强、增加、促进或诱导CLR的表达的任何分子。在本发明的治疗方法、药物和用途的任何一种中有用的CLR激动剂包括,例如,结合CLRs的碳水化合物及其衍生物和特异性结合CLRs的激动性单克隆抗体(mAb)。
在本发明的治疗方法、药物和用途中有用的CLR激动剂的实例包括,例如MD-级分(来自叶状奇果菌(Grifola frondosa)的纯化的可溶性β-葡聚糖提取物)和imprime PGG(衍生自酵母的β1,3/1,6-葡聚糖PAMP)。
STING蛋白在1型干扰素信号传导中既作为胞质DNA传感物又作为衔接蛋白起作用。术语“STING”和“干扰素基因的刺激物”是指任何形式的STING蛋白,以及保留至少一部分STING活性的变体、同种型和物种同源物。除非有不同的说明,例如通过具体参考人STING,否则STING包括所有哺乳动物物种的天然序列STING,例如,人、猴和小鼠。在UniProt条目号Q86WV6下提供了一种示例性人TLR9。STING也称为TMEM173。
如本文所用的“STING激动剂”意指结合TLR9后(1)刺激或活化STING,(2)增强、增加、促进、诱导或延长STING的活性、功能或存在,或(3)增强、增加、促进或诱导STING的表达的任何分子。在本发明的治疗方法、药物和用途的任何一种中有用的STING激动剂包括,例如,结合STING的核酸配体。
在本发明的治疗方法、药物和用途中有用的STING激动剂的实例包括各种免疫刺激核酸,例如合成的双链DNA,环二-GMP,环GMP-AMP(cGAMP),合成的环二核苷酸(CDN),例如MK-1454和ADU-S100(MIW815),以及小分子,例如P0-424。
其他PRRs包括,例如,依赖于DNA的IFN-调节因子活化剂(DNA-dependentActivator of IFN-regulatory factors)(DAI)和黑色素瘤缺乏因子2(Absent inMelanoma 2)(AIM2)。
免疫刺激细胞因子包括各种刺激免疫应答的信号传导蛋白,例如干扰素、白介素和造血生长因子。
示例性的免疫刺激细胞因子包括GM-CSF、G-CSF、IFN-α、IFN-γ;IL-2(例如地尼白介素(denileukin difitox))、IL-6、IL-7、IL-11、IL-12、IL-15、IL-18、IL-21和TNF-α。
免疫刺激细胞因子可以具有任何合适的形式。在一些实施方案中,免疫刺激细胞因子可以是野生型细胞因子的重组形式。在一些实施方案中,免疫刺激细胞因子可以是与相应的野生型细胞因子相比具有一个或多个氨基酸改变的突变蛋白。在一些实施方案中,可以将免疫刺激细胞因子并入含有细胞因子和至少一种其他功能蛋白(例如抗体)的嵌合蛋白中。在一些实施方案中,免疫刺激细胞因子可以共价连接至药物/药剂(例如,如本文别处作为可能的ADC组分所述的任何药物/药剂)。
癌症疫苗包括含有肿瘤相关抗原(或可用于在受试者中产生肿瘤相关抗原)且因此可用于在受试者中引起将针对含有肿瘤相关抗原的肿瘤细胞的免疫应答的各种组合物。
可以包括在癌症疫苗中的实例材料包括减毒癌性细胞,肿瘤抗原,抗原呈递细胞例如用肿瘤衍生的抗原或编码肿瘤相关抗原的核酸冲击的树突细胞。在一些实施方案中,可以用患者自己的癌细胞制备癌症疫苗。在一些实施方案中,癌症疫苗可以用不来自患者自身癌细胞的生物材料制备。
癌症疫苗包括,例如,西普鲁塞-T(sipuleucel-T)和talimogene laherparepvec(T-VEC)。
免疫细胞疗法包括用能够靶向癌细胞的免疫细胞治疗患者。免疫细胞疗法包括,例如,肿瘤浸润淋巴细胞(TILs)和嵌合抗原受体T细胞(CAR-T细胞)。
化学治疗剂的实例包括烷化剂,例如噻替哌和环磷酰胺;烷基磺酸盐,例如白消安、二丙胺磺酯和哌泊舒凡;氮丙啶,例如苯佐替派(benzodopa)、卡波醌、美妥替哌(meturedopa)和乌瑞替哌(uredopa);乙烯亚胺和甲基蜜胺(methylamelamines),包括六甲密胺、曲他胺、三乙撑磷酰胺(trietylenephosphoramide)、乙胺硫磷和三羟甲密胺(trimethylolomelamine);多聚乙酰(acetogenins)(尤其是布拉它辛(bullatacin)和布拉它辛酮(bullatacinone));喜树碱(包括合成类似物拓扑替康);苔藓虫素;卡利他汀(callystatin);CC-1065(包括其阿多来新、卡折来新(carzelesin)和比折来新(bizelesin)合成类似物);cryptophycins(特别是cryptophycin 1和cryptophycin 8);多拉司他汀(dolastatin);倍癌霉素(包括合成类似物,KW-2189和CBI-TMI);软珊瑚醇(eleutherobin);水鬼蕉碱(pancratistatin);匍枝珊瑚醇(sarcodictyin);海绵抑制素(spongistatin);氮芥,如苯丁酸氮芥、萘氮芥、氯磷酰胺(cholophosphamide)、雌莫司汀、异环磷酰胺、氮芥(mechlorethamine)、盐酸氧化氮芥(mechlorethamine oxidehydrochloride)、美法仑、新氮芥、苯芥胆甾醇、松龙苯芥、三芥环磷酰胺、尿嘧啶氮芥;亚硝基脲(nitrosureas),如卡莫司汀、氯脲菌素、福泰氮芥、洛莫氮芥、尼莫司汀、雷诺氮芥;抗生素,如烯二炔(enediyne)抗生素(例如,加利车霉素,尤其是加利车霉素γ1I和加利车霉素phiI1,参见,例如,Agnew, Chem. Intl. Ed. Engl., 33:183-186(1994);达内霉素(dynemicin),包括达内霉素A;双膦酸盐(bisphosphonates),如骨膦;埃斯波霉素;以及新制癌菌素发色团和相关的色蛋白烯二炔抗生素发色团(chromomophores))、阿克拉霉素、放线菌素、安曲霉素(authramycin)、偶氮丝氨酸、博来霉素、放线菌素C(cactinomycin)、卡拉比星(carabicin)、卡米诺霉素(caminomycin)、嗜癌霉素、色霉素、更生霉素、柔红霉素、二乙氧醋酰阿霉素、6-重氮基-5-氧-L-正亮氨酸、阿霉素(包括吗啉代-阿霉素、氰基吗啉代-阿霉素、2-吡咯啉基-阿霉素(2-pyrrolino-doxorubicin)和脱氧阿霉素)、聚乙二醇化脂质体阿霉素、表柔比星、去羟阿霉素、伊达比星、麻西罗霉素、丝裂霉素如丝裂霉素C、霉酚酸、诺加拉霉素、橄榄霉素、培来霉素、泼非霉素(potfiromycin)、嘌呤霉素、三铁阿霉素、罗多比星(rodorubicin)、链黑霉素、链脲霉素、杀结核菌素、羟氨苯丁酰亮氨酸、新制癌菌素、佐柔比星;抗代谢物,如氨甲蝶呤和5-氟尿嘧啶(5-FU);叶酸类似物,如二甲叶酸、氨甲蝶呤、蝶酰三谷氨酸、曲美沙特;嘌呤类似物,如氟达拉滨、6-巯基嘌呤、硫唑鸟嘌呤、硫鸟嘌呤;嘧啶类似物,如环胞苷、氮杂胞苷、6-氮尿苷、卡莫氟、阿糖胞苷、双脱氧尿苷、多西氟尿啶、依诺他宾、氟尿苷;雄激素,如卡鲁睾酮、羟甲雄酮丙酸酯、环硫雄醇、甲环硫甾烷、睾内酯;抗肾上腺素药(anti-adrenals),如氨鲁米特、米托坦、曲洛司坦;叶酸补充剂,如亚叶酸(frolinic acid);醋葡醛内酯;醛磷酰胺糖苷(aldophosphamide glycoside);氨基乙酰丙酸;恩尿嘧啶(eniluracil);安吖啶;阿莫司汀(bestrabucil);必桑郡;依达曲沙(edatraxate);地磷酰胺(defofamine);地美可辛;地吖醌;依氟鸟氨酸(elformithine);醋酸羟哔咔唑;埃博霉素;环氧甘醚;硝酸镓;羟基脲;香菇多糖;氯尼达明;美登木素生物碱,如美登素和美坦西醇;丙米腙;米托蒽醌;蒙匹胺醇;二胺硝吖啶;喷司他丁;苯来美特;吡柔比星;洛索蒽醌(losoxantrone);鬼臼酸;2-乙酰肼(2-ethylhydrazide);甲基苄肼;丙亚胺;根霉素;西索菲兰;螺锗;细交链孢菌酮酸;三亚胺醌;2,2',2''-三氯三乙胺;单端孢菌毒素(尤其是T-2毒素、verracurin A、杆孢菌素A和蛇形菌素(anguidine));乌来糖;长春地辛;达卡巴嗪;甘露氮芥;二溴甘露醇;二溴去羟卫矛醇;哌泊溴烷;gacytosine;阿糖胞苷(“Ara-C”);环磷酰胺;噻替哌;紫杉烷类(taxoids),例如,紫杉醇和多西他赛(doxetaxel);苯丁酸氮芥;吉西他滨;6-硫鸟嘌呤;巯基嘌呤;氨甲蝶呤;铂类似物,如顺铂和卡铂;长春碱;铂;依托泊苷(VP-16);异环磷酰胺;米托蒽醌;长春新碱;长春烯碱;能减瘤;替尼泊苷;依达曲沙;柔红霉素;氨基蝶呤;希罗达;伊本膦酸钠;CPT-11;拓扑异构酶抑制剂RFS 2000;二氟甲基鸟氨酸(DMFO);类视黄醇(retinoids ),如视黄酸;卡培他滨;和上述任何一种的药学上可接受的盐、酸或衍生物。还包括用于调节或抑制对肿瘤的激素作用的抗激素剂,例如抗雌激素和选择性雌激素受体调节剂(SERMs),包括,例如,他莫昔芬、雷洛昔芬、屈洛西芬、4-羟基他莫昔芬、曲奥昔芬、那洛西芬、LY117018、奥那斯酮和托瑞米芬(Fareston);抑制酶芳化酶的芳化酶抑制剂,其调节肾上腺中的雌激素生产,例如,4(5)-咪唑、氨鲁米特、醋酸甲地孕酮、依西美坦、福美坦、法倔唑、伏罗唑、来曲唑和阿那曲唑;和抗雄激素物质,如氟他胺、尼鲁米特、比卡鲁胺、利普安和性瑞林;KRAS抑制剂;MCT4抑制剂;MAT2a抑制剂;酪氨酸激酶抑制剂,例如舒尼替尼(sunitinib)、阿昔替尼(axitinib);alk/c-Met/ROS抑制剂,例如克唑替尼(crizotinib)、劳拉替尼(lorlatinib);mTOR抑制剂,例如替西罗莫司(temsirolimus)、gedatolisib;src/abl抑制剂,例如博舒替尼(bosutinib);细胞周期蛋白依赖性激酶(CDK)抑制剂,例如帕博西尼(palbociclib)、PF-06873600;erb抑制剂,例如达克替尼(dacomitinib);PARP抑制剂,例如他拉唑帕尼(talazoparib);SMO抑制剂,例如格拉吉布(glasdegib)、PF-5274857;EGFR T790M抑制剂,例如PF-06747775;EZH2抑制剂,例如PF-06821497;PRMT5抑制剂,例如PF-06939999;TGFRβr1抑制剂,例如PF-06952229;和上述任何一种的药学上可接受的盐、酸或衍生物。在具体实施方案中,这种额外的治疗剂是贝伐单抗、西妥昔单抗(cetuximab)、西罗莫司、帕尼单抗、5-氟尿嘧啶(5-FU)、卡培他滨、替沃扎尼、伊立替康、奥沙利铂、顺铂、三氟尿苷、替吡嘧啶、甲酰四氢叶酸、吉西他滨、瑞戈非尼(regorafinib)或盐酸厄洛替尼。
在一些实施方案中,抗体与一种或多种靶向免疫限制点调节剂或共刺激剂的其他治疗剂一起使用,所述其他治疗剂如例如但不限于,靶向CTLA-4、LAG-3、B7-H3、B7-H4、B7-DC (PD-L2)、B7-H5、B7-H6、B7-H8、B7-H2、B7-1、B7-2、ICOS、ICOS-L、TIGIT、CD2、CD47、CD80、CD86、CD48、CD58、CD226、CD155、CD112、LAIR1、2B4、BTLA、CD160、TIM1、TIM-3、TIM4、VISTA(PD-H1)、OX40、OX40L、GITR、GITRL、CD70、CD27、4-1BB、4-BBL、DR3、TL1A、CD40、CD40L、CD30、CD30L、LIGHT、HVEM、SLAM (SLAMF1、CD150)、SLAMF2 (CD48)、SLAMF3 (CD229)、SLAMF4(2B4、CD244)、SLAMF5 (CD84)、SLAMF6 (NTB-A)、SLAMCF7 (CS1)、SLAMF8 (BLAME)、SLAMF9(CD2F)、CD28、CEACAM1 (CD66a)、CEACAM3、CEACAM4、CEACAM5、CEACAM6、CEACAM7、CEACAM8、CEACAM1-3AS CEACAM3C2、CEACAM1-15、PSG1-11、CEACAM1-4C1、CEACAM1-4S、CEACAM1-4L、IDO、TDO、CCR2、CD39–CD73–腺苷途径(A2AR)、BTKs、TIKs、CXCR2、CXCR4、CCR4、CCR8、CCR5、CSF-1或先天免疫应答调节剂的药剂。
在一些实施方案中,抗体与例如下述一起使用:抗-CTLA-4拮抗剂抗体,如例如伊匹单抗;抗-LAG-3拮抗剂抗体,例如BMS-986016和IMP701;抗-TIM-3拮抗剂抗体;抗-B7-H3拮抗剂抗体,如例如MGA271;抗-VISTA拮抗剂抗体;抗-TIGIT拮抗剂抗体;抗体;抗-CD80抗体;抗-CD86抗体;抗-B7-H4拮抗剂抗体;抗-ICOS激动剂抗体;抗-CD28激动剂抗体;先天免疫应答调节剂(例如TLRs、KIR、NKG2A)和IDO抑制剂。
在一些实施方案中,抗体与OX40激动剂如例如抗- OX-40激动剂抗体一起使用。在一些实施方案中,抗体与GITR激动剂如例如抗-GITR激动剂抗体如例如但不限于TRX518一起使用。在一些实施方案中,抗体与IDO抑制剂一起使用。在一些实施方案中,抗体与细胞因子治疗(如例如但不限于IL-15、CSF-1、MCSF-1等)一起使用。
在一些实施方案中,抗体与一种或多种其他治疗性抗体(如例如但不限于靶向CD19、CD22、CD40、CD52或CCR4的抗体)一起使用。
在某些实施方案中,抗体组合物包含至少一种额外的药剂,例如贝伐单抗、西妥昔单抗(cetuximb)、西罗莫司、帕尼单抗、5-氟尿嘧啶(5-FU)、卡培他滨、替沃扎尼、伊立替康、奥沙利铂、顺铂、三氟尿苷、替吡嘧啶、甲酰四氢叶酸(leucovorin)、吉西他滨和盐酸厄洛替尼。
在一些实施方案中,所述抗体疗法可以与其他试剂治疗共同施用或在其他试剂治疗之前或之后按从数分钟到数周的间隔依次地施用。在其他试剂和/或蛋白或多核苷酸单独施用的实施方案中,人们将通常确保相当长的时间段不在每次递送之间期满,使得所述药剂和本发明的组合物将仍然能够对受试者发生有利的联合作用。在这种情况下,预期人们可以在彼此约12-24小时内,并且更优选在彼此约6-12小时内施用两种用药程式。然而,在一些情况下,可能期望将用于施用的时间段显著延长,在这方面几天(2、3、4、5、6或7)至几周(1、2、3、4、5、6、7或8)在各次施用之间过去。
在一些实施方案中,将本发明的抗体与进一步包括选自下述的传统疗法的治疗方案组合:外科手术、放射疗法、化学疗法、靶向疗法、免疫疗法、激素疗法、血管发生抑制和姑息护理(palliative care)。
本发明中使用的组合物可以以冻干制剂或水溶液的形式进一步包含药学上可接受的载体、赋形剂或稳定剂(Remington: The Science and practice of Pharmacy 第21版, 2005, Lippincott Williams and Wilkins, Ed. K. E. Hoover)。可接受的载体、赋形剂或稳定剂在所述剂量和浓度对接受者无毒,且可以包括缓冲剂,例如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(例如氯化十八烷基二甲基苄基铵;氯化己烷双铵;苯扎氯铵,苄索氯铵;酚,丁醇或苄醇;对羟基苯甲酸烷基酯,例如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇和间甲酚);低分子量(小于约10个残基)多肽;蛋白,例如血清清蛋白、明胶或免疫球蛋白;亲水聚合物,例如聚乙烯吡咯烷酮;氨基酸,例如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或葡聚糖;螯合剂,如EDTA;糖,如蔗糖、甘露糖醇、海藻糖或山梨糖醇;成盐平衡离子,例如钠;金属络合物(例如,Zn-蛋白络合物);和/或非离子型表面活性剂,例如TWEEN™、PLURONICS™或聚乙二醇(PEG)。本文进一步描述了药学上可接受的赋形剂。
在一个方面,本发明提供了产生如本文所公开的抗体的方法,其包括:在导致产生如本文所公开的抗体的条件下培养宿主细胞,和从所述培养物纯化所述抗体或所述双特异性抗体。
在另一个方面,本发明提供了如本文所公开的抗体、药物组合物、多核苷酸、载体或宿主细胞在制备用于检测、诊断和/或治疗肿瘤抗原有关病症的药物中的用途。
在一个方面,例如出于诊断目的,本发明的CD3抗体可用于检测和/或测量样品中的CD3或表达CD3的细胞。例如,CD3抗体可用于诊断特征在于CD3的异常表达(例如过表达、表达不足、缺乏表达等)的病况或疾病。用于CD3的示例性诊断测定可包括例如使从受试者获得的样品与本发明的CD3抗体接触,其中所述CD3抗体标记有可检测的标记物或报告分子。或者,未标记的CD3抗体可与自身可检测地标记的二级抗体组合用于诊断性应用中。可检测的标记物或报告分子可以是放射性同位素,例如
在另一个方面,提供了检测、诊断和/或监测与肿瘤抗原表达相关的病况的方法。例如,如本文所述的多特异性抗体可用可检测部分(例如成像剂和酶-底物标记物)进行标记。如本文所述的抗体也可用于体内诊断测定(例如体内成像(例如,PET或SPECT))或染色试剂。
本发明的另一个方面是试剂盒,其包括如上文所公开的抗体和用于根据本文所述的本发明的任何方法进行使用的说明书。通常,这些说明书包括用于上述治疗性处理的抗体的施用的描述。该试剂盒包括本文公开的任何药物组合物。药物组合物和其他试剂可以以任何方便的形式存在于试剂盒中,如例如以溶液或粉末形式。
在另一个方面,试剂盒在一个或多个容器中进一步包括一种或多种可用于治疗癌症的其他预防或治疗剂。在一个实施方案中,所述其他预防或治疗剂是化学治疗剂。在其他方面,所述预防或治疗剂是生物或激素治疗剂(therapeutic)。
本发明的药物组合物、预防剂或治疗剂的几个方面在人中使用前优选在体外、在细胞培养系统和在动物模型生物(例如啮齿动物模型系统)中进行所期望的治疗活性的测试。
本发明的预防和/或治疗方案的毒性和功效可以通过在细胞培养物或实验动物中的标准药学程序来确定,例如,用于确定LD
进一步地,本领域技术人员已知的任何测定都可用于评价本文公开的用于治疗或预防癌症的疗法或组合疗法的预防和/或治疗效用。
与如本文所述的双特异性抗体的使用有关的说明书通常包括关于用于预期治疗的剂量、给药方案和施用途径的信息。容器可以是单位剂量、散装包装(例如多剂量包装)或亚单位剂量。本发明的试剂盒中供应的说明书通常是在标签或包装插页(例如,试剂盒中包括的纸张)上的书面说明书,但机器可读的说明书(例如,磁盘或光学存储盘上携带的说明)也是可接受的。
本发明的试剂盒在合适的包装中。合适的包装包括但不限于用于每种药物组合物和其他包括的试剂(例如,缓冲剂、平衡的盐溶液等,用于向受试者施用药物组合物)的小瓶,安瓿,管,瓶,广口瓶,软包装(例如密封的聚酯薄膜或塑料袋)等等。还考虑的是用于与特定装置例如吸入器、鼻腔施用装置(例如雾化器)或输注装置例如微型泵组合使用的包装。试剂盒可以具有无菌进入口(例如,容器可以是具有可被皮下注射针刺穿的塞子的静脉内溶液袋或小瓶)。容器也可以具有无菌进入口(例如,容器可以是具有可被皮下注射针刺穿的塞子的静脉内溶液袋或小瓶)。组合物中的至少一种活性剂是抗体。容器可以进一步包含第二药物活性剂。
通常,试剂盒包括容器和在容器上或与容器相关的标签或包装插页。
本发明的代表性材料于2018年2月13日保藏于美国典型培养物保藏中心(ATCC),10801 University Boulevard,Manassas,Va. 20110-2209,USA。具有ATCC检索号PTA-124943的载体GUCY2C-1608链A(VH-臼SEQ ID NO: 94)包含编码双特异性抗体GUCY2C-1608的VH-臼链的DNA插入片段,其包含编码CD3抗体轻链可变区(SEQ ID NO: 3)的多核苷酸(SEQ ID NO: 70);且具有ATCC检索号PTA-124944的GUCY2C-1608链B(VL-杵SEQ ID NO:93)包含编码双特异性抗体GUCY2C-1608的VL-杵链的DNA插入片段,其包含编码CD3抗体重链可变区(SEQ ID NO: 4)的多核苷酸(SEQ ID NO: 71)。
保藏根据国际承认用于专利程序目的的微生物保藏布达佩斯条约及其实施细则(Budapest Treaty on the International Recognition of the Deposit ofMicroorganisms for the Purpose of Patent Procedure and Regulationsthereunder)(布达佩斯条约)的规定进行。这确保保藏物的活培养物从保藏日起维持30年。保藏根据布达佩斯条约条款通过ATCC可获得,并且遵守Pfizer,Inc.和ATCC之间的协议,所述协议确保在相关的美国专利发布时、或者在向公众公开任何美国或外国专利申请时(以先到者为准),保藏物培养物的后代对公众的永久且不受限制的可用性,并且确保根据35U.S.C. 部分122和根据其制定的局长规则(包括37 C.F.R. 部分1.14,其中特别提及886OG 638),后代对由美国专利商标局局长授权的人的可用性。
本申请的受让人已同意,如果在合适的条件下培养时,所保藏材料的培养物可能死亡、丢失或破坏,则将在通知后迅速将材料替换为相同的另一份。保藏材料的可得性不应解释为违反任何政府当局根据其专利法授予的权利来实践发明的许可。
用于实施本发明的具体方面的下述实施例仅提供用于说明目的,并不预期以任何方式限制本发明的范围。
实施例1
可溶性CD3ed的生成
使用标准分子生物学、蛋白表达和纯化技术生成称为CD3ed的蛋白,其代表经由短的接头(SEQ ID NO: 39)串联融合的CD3 ε和δ亚单位的细胞外结构域。使用PEI作为转染剂,将携带编码表9中所示氨基酸(SEQ ID NO: 40)的基因的质粒瞬时转染于20 L培养体积中的HEK293细胞中。在37C下孵育7天后,将20 L收获物与50 ml His60树脂(用PBS平衡)分批结合过夜。然后,结合的树脂用PBS洗涤,随后用含有10 mM 咪唑的PBS缓冲液(10-15 CV)洗涤。洗涤后,用含有200 mM咪唑的磷酸盐缓冲液洗脱蛋白。然后通过SDS凝胶分析洗脱物级分。将含有纯蛋白的级分合并在一起,并使用3 kDa Amicon ultra centricon浓缩。在浓缩时将5%甘油维持在样品中以保持蛋白稳定。将His60合并物进一步加载至大小排阻Superdex200柱上。通过SDS-PAGE分析含有CD3 ε/δ异二聚体的级分,并将相关级分合并并进行0.22 µm过滤。表9显示串联融合并用作所有优化工作的抗原的CD3 ε/δ亚单位的序列。
表9
实施例2
CD3抗体H2B4的构架优化
先导CD3e (CD3 ε)抗体H2B4当以双特异性双抗体-Fc形式使用时表现出较低的热稳定性。为了改善稳定性,将轻链构架从VK4变为VK1 (DPK9),同时将重链构架保留为VH3(DP54)。将VL CDR1 (SEQ ID NO: 26)、VL CDR2 (SEQ ID NO: 27)和VL CDR3 (SEQ ID NO:28)移植至DPK9构架上,且与携带CDR (即VH CDR1 (SEQ ID NO: 13)、VH CDR2 (SEQ IDNO: 16)和VH CDR3 (SEQ ID NO: 18))的重链组合表达。除了将CDR移植至构架中以外,还测试某些回复突变。在重链和轻链构架两者中引入的回复突变显示于表10中,其中指示进行回复突变的残基编号。
合成含有人受体构架(对于重链为VH3且对于轻链为VK1)以及相关CDR供体序列的cDNA。将合成的cDNA产物亚克隆且与哺乳动物表达载体中重链的人IgG1恒定区和轻链的人κ框内融合。为了与H2B4抗体区分,在下文中将这些变体称为2B5,且所有优化的分子将称为2B5和其变体。分析所有2B5突变体与具有CD3e的内源性表达的Jurkat细胞的竞争结合。
进行竞争FACS以检查人源化2B5是否在细胞表面上维持其结合表位。在竞争FACS实验之前,将嵌合cH2B4生物素化。通过直接结合使用FACS来测定生物素化cH2B4与Jurkat细胞的结合的EC50,且被测定为0.8 nM。对于竞争FACS,将3倍连续稀释的抗体变体与代表EC50浓度的恒定量的生物素-cH2B4和1.0+E05个细胞/孔的Jurkat细胞混合。将混合物在冰上孵育1小时,随后用FACS缓冲液洗涤3次。将二级抗体(即PE (藻红蛋白)缀合的链霉抗生物素蛋白(PE-SA))添加至细胞并在冰上孵育30分钟。然后通过FACS在FACS CANTO™ (BDBiosciences)上分析中值荧光强度(MFI)。Y轴计算:%最大结合= [MFI (连续稀释的Ab孔)- MFI (二级PE-SA)] /[MFI最大值(仅具有生物素-cH2B4的Jurkat细胞)- MFI (二级PE-SA)]。表10显示当在CD3抗体H2B4中引入突变以优化构架时,竞争结合的IC
表10
实施例3
使用H2B4和2B5序列生成且表征双特异性双抗体-Fc分子
使用本领域已知的标准表达和纯化技术,使用CD3抗体2B5或H2B4 (表2和3)和呈图1 (示意图)中所示的构型之一的GUCY2c抗体序列生成双特异性双抗体-Fc分子。使用差示扫描量热法测试所得双特异性抗体(表7;SEQ.ID.NO.36-38)的稳定性。
实施例4
使用差示扫描量热法评价双特异性抗体的稳定性
将蛋白以400 µl的体积在磷酸盐缓冲盐水(PBS)溶液中稀释至0.6 mg/ml。PBS用作参考室中的缓冲液空白。PBS含有137 mM NaCl、2.7 mM KCl、8.1 mM Na2HPO4和1.47 mMKH2PO4,pH 7.2。用自动进样器(Malvern Instruments Ltd, Malvern, 英国)将样品分配到MicroCal VP-Capillary DSC的样品盘中。将样品在10℃平衡5分钟,且然后以每小时100℃的速度扫描最多到110℃。选择了16秒的过滤时段。将原始数据进行基线校正,并将蛋白浓度进行归一化。使用Origin软件7.0 (OriginLab Corporation, Northampton, MA)以用适当的转换数将数据拟合到MN2-State模型。如图2中所举例说明,与双特异性GUCY2c-H2B4相比,双特异性GUCY2c-2B5显示5℃改善的第一熔融转变。此指示含有2B5的双特异性抗体表现出更好的稳定性。
使用FACS采用本领域已知的标准程序检查两种双特异性抗体与T细胞的结合,且如图3中所示,两种双特异性抗体均显示类似的与T细胞的结合,指示在H2B4转化为2B5后结合得以保留。
还在细胞毒性测定中测试H2B4和2B5双特异性抗体两者以评价T细胞再定向活性。如图4中所示,两种双特异性抗体均显示类似的细胞毒性,指示2B5保留与H2B4相同的活性。
实施例5
2B5的基于结构的合理诱变
CD3抗体H2B4结合结构域显示多反应性(如通过与DNA和胰岛素的结合所评价),显示自缔合倾向(如通过高AC-SINS得分所指示)且当在CHO宿主细胞中表达时在CDR-H2中的R53位置处具有剪切倾向。为了降低多反应性,对自缔合倾向和CDRH2中的剪切、2B5的CDR中的突变进行工程改造以在维持结合亲和力和稳定性的同时减少这些不利因素。出于此努力,使用CD3抗体H2B4 x射线晶体结构进行所有预测,该晶体结构在与代表结合表位且源自CD3 ε亚单位的N末端的肽的复合物中获得。本领域中众所周知,过量正电荷和/或疏水性可在多反应性中起主要作用。使用Discovery Studio 4.0
为了确定用于诱变的合适位置,使用Discovery Studio和FoldX进行亲和力变化和稳定性变化两者的突变的计算预测。耐受突变是对于Discovery Studio和FoldX方法两者不预测ΔΔG >1千卡/mol的那些。从这些预测,鉴定一组预测将对结合和稳定性具有最小影响同时仍破坏变化区片的残基。另外,我们倾向于亲水性突变,在可能的情况下不增加疏水性表面。CD3抗体2B5中引入以优化生物物理性质的可能CDR突变的列表显示于表11中。此包括经预测在每一位置耐受且降低多反应性和剪切的突变。
表11
另外,还设计一组多重突变(组合)用于重链和轻链。这些包括用于重链的R52Q/R52bQ/R53Q、R52Q/R52bQ/R53Q/R96Q、R52bQ/R53Q/R96Q和R52Q/R52bQ/R96Q和用于轻链的R29Q/K30Q/R54L/V27eE、R29Q_R54L_V27eE、R29Q_K30Q_R54L。
实施例6
突变体的表征
使用本领域众所周知的标准表达和纯化技术生成所有作为IgG分子的突变体,且测试与CD3ed的结合、多反应性(结合DNA和胰岛素)和AC-SINS。
结合测定以评价变体
设计Octet测定且运行以检查10 ug/ml可溶性人CD3ed抗原(SEQ ID NO: 40)的结合和解离速率两者。使用抗人IgG尖端捕获10 ug/ml浓度的抗CD3抗体持续120 s,随后为PBS中的基线持续30 s,然后浸入10 ug/ml浓度的可溶性人CD3ed抗原中持续120 s,且最后于其中解离300 s。检查传感图以确定抗原是否结合抗体,并使用Octet软件来计算kd (1/s)和kd误差。26个合理突变保留与hCD3ed抗原的结合。然后使用Biacore分析,通过SPR检查26种仍结合抗原的CD3抗体变体的与可溶性CD3的结合动力学。在抗人Fc上捕获CD3抗体,并在捕获的抗体上注射0 nM、3.7 nM、11.1 nM、33.3 nM和100 nM浓度的可溶性CD3抗原以测定结合的动力学。23种CD3抗体以与CDR移植的亲本抗体类似的亲和力结合可溶性CD3抗原。
DNA和胰岛素ELISA以测量多反应性
将384-孔ELISA平板(Nunc Maxisorp)在4℃用PBS pH 7.5中的DNA(10µg/ml)(Sigma-Aldrich, D1626)和胰岛素(5µg/ml)(Sigma-Aldrich, I9278-5mL)包被过夜。在PerkinElmer Janus Automated Workstation液体处理机器人上实施从Tiller等人(17)中描述的测定修改的ELISA。将孔用水洗涤,在室温用50 µl的多反应性ELISA缓冲液(PEB;含有0.05% Tween-20、1 mM EDTA的PBS)封闭1小时,并用水冲洗3次。将在25 µl中连续稀释的mAbs一式四份添加到孔中,并在室温孵育1小时。将平板用水洗涤3次,并向每个孔添加25µl的10ng/ml与辣根过氧化物酶(Jackson ImmunoResearch, 109-035-008)缀合的山羊抗人IgG (Face片段特异性)。将平板在室温孵育1小时,用80 µl的水洗涤3次,并向每个孔添加25 µl的TMB底物(Sigma Aldrich, T-0440)。在近似7分钟后,通过向每个孔添加25 µl的0.18M正磷酸终止反应,并在450nm处读取吸光度。DNA和胰岛素结合得分计算为10 µg/ml的抗体的ELISA信号与含有缓冲液替代一抗的孔的信号的比率。小于8的得分视为理想的且代表低多反应性。
AC-SINS测定以测量自缔合倾向
AC-SINS (Affinity Capture Self-interaction Nanoparticle Spectroscopy)测定在Perkin-Elmer Janus液体处理机器人上以384-孔形式标准化。用80%山羊抗人Fc(Jackson ImmunoResearch Laboratories, Inc. # 109-005-098)和20%非特异性山羊多克隆抗体(Jackson ImmunoResearch Laboratories, Inc. # 005-000-003)的混合物包被20 nm金纳米颗粒(Ted Pella, Inc., #15705),所述混合物被缓冲液更换至20 mM乙酸钠pH 4.3中并稀释至0.4 mg/ml。在室温孵育一小时后,用硫醇化的聚乙二醇(2 kD)封闭金纳米颗粒上未被占的位点。然后使用针筒式过滤器将包被的纳米颗粒浓缩10倍,并将10 µl添加到100 µl的PBS pH 7.2中的0.05 mg/ml的mAb中。将包被的纳米颗粒与目标抗体在96-孔聚丙烯平板中孵育2小时,且然后转移至384-孔聚苯乙烯平板,并在Tecan M1000分光光度计上读取。以2 nm的增量从450-650读取吸光度,并使用Microsoft Excel宏(macro)以鉴定最大吸光度、平滑数据并使用二阶多项式拟合数据。从抗体样品的平滑的最大吸光度减去平均空白(仅PBS缓冲液)的平滑的最大吸光度,以确定抗体AC-SINS得分。小于8的得分视为理想的且代表低自缔合程度。
对呈双抗体-Fc双特异性形式的先导CD3抗体2B5变体的评价
对来自结合测定、AC-SINS和多反应性的数据的综合性分析有助于将结合变体缩小至5种,使用抗肿瘤序列并使用本领域所众所周知的标准克隆策略将所述5种结合变体重新格式化为双特异性双抗体-Fc分子。使用本领域众所周知的标准技术瞬时表达并纯化这些双特异性抗体。测试所得双特异性抗体与jurkat细胞的结合、使用T细胞重新靶向测定测试体外细胞毒性、测试多反应性、使用DSC和AC-SINS测试热稳定性。在所有5种双特异性抗体中,仅一种携带CD3抗体2B5变体2B5v6的双特异性抗体显示强效结合,且因此显示强效细胞毒性。此变体还显示降低的多反应性,如通过DNA和胰岛素结合以及AC-SINS得分所评价。与H2B4双特异性抗体大于8的得分相比,2B5v6双特异性抗体的得分小于8。基于这些结果,选择2B5v6作为先导优化的2B5变体用于进一步分析。
实施例7
对CDR-H2中剪切的评价
当双特异性抗体在CHO细胞中而非在HEK293细胞中表达时,在CD3抗体(H2B4和2B5)中观察到在位置R53的VH CDR2 (SEQ ID NO: 16)中的剪切。为了化解此不利因素的风险且确保产品在制造规模上的更好均质性,应注意如先前实施例中所述选择剪切区中的突变以及其他突变以化解其他不利因素的风险。为了评价剪切,简单地,使用阴性对照抗体可变结构域序列和CD3抗体2B5或CD3抗体H2B4或CD3抗体2B5v6生成双抗体-Fc双特异性抗体。所有双特异性双抗体-Fc分子均使用本领域众所周知的表达和纯化工艺的类似示意图来制备。使用标准程序生成CHO SSI细胞系。将编码双特异性抗体的两条链克隆到含有双重启动子和用于单位点整合(SSI)(Zhang, L. 等人Biotechnology Progress. 2015; 31: 1645-1656)到CHO细胞基因组中的重组位点的哺乳动物表达载体pRY19-GA-Q中。用含有目标基因的pRY19载体经由电穿孔将所得的质粒转染到CHO-K1 SV 10e9个细胞中,随后为使用潮霉素-B和更昔洛韦的正和负选择压力。这些CHO合并物经历3周的恢复期。当观察到的活力超过90%时,产生用于将来工作的细胞库。然后,使确立的CHO-合并物在1L规模的CD-CHO培养基(ThermoFisher Scientific, Waltham, MA)中经受12-天的分批补料平台表达过程。在蛋白A柱上捕获第12天培养收获物并在低pH下洗脱。立即将proA合并物中和至pH 8.1。使用本领域众所周知的标准方案使用毛细管凝胶电泳(cGE)评价所得纯蛋白。如表12和图7中所示,2B5双特异性抗体与H2B4相比显示降低得多的剪切,且2B5v6显示无剪切而H2B4显示显著增加的剪切或片段化。表12显示了显示CD3-GUCY2c双特异性抗体的片段化的毛细管凝胶电泳的结果。POI%指示目标峰。
表12
实施例8
GUCY2c-2B5v6双特异性抗体:使用CD3抗体2B5v6的嵌合CD3-GUCY2c双特异性抗体的表达和纯化
使用ExpiFectamine™ 293转染试剂盒(Life Technologies)将互补的构建体对(每条链12.5 µg)共转染到25 mL对数期培养物中,所述培养物含有1百万个细胞/ml HEK293细胞。转染后24小时,添加ExpiFectamine转染增强剂(ExpiFectamine TransfectionEnhancer),且使细胞在收获前生长另外4-5天。然后收集用过的培养物,离心以去除细胞碎片,然后通过20 µm过滤器。
然后使用A蛋白亲和层析纯化含有GUCY2c T细胞双特异性抗体的澄清的条件培养基。使用液体输送装置(Tecan)将样品加载到预装有MabSelect SuRe蛋白A树脂(GEHealthcare)的0.45 mL微柱(Repligen)上。将结合的蛋白用PBS pH7.2洗涤,然后用20 mM柠檬酸,150 mM氯化钠pH 3.5洗脱,并用2M tris,pH 8.0中和。然后根据制造商的方法,使用G25 Sephadex滴注柱(drip columns)(GE Healthcare)将样品脱盐至PBS pH 7.2。遵循制造商的方案,在Aglient 1200 HPLC上使用具有Mab HTP柱的分析型大小排阻层析(TOSOH)分析纯化的蛋白的纯度。通过使用显微分光光度计(Trinean)在OD280 nm处测量来测定浓度。
使用差示扫描量热法评价双特异性抗体的稳定性
将蛋白以400 µl的体积在磷酸盐缓冲盐水(PBS)溶液中稀释至0.6 mg/ml。PBS用作参考室中的缓冲液空白。PBS含有137 mM NaCl、2.7 mM KCl、8.1 mM Na2HPO4和1.47 mMKH2PO4,pH 7.2。使用自动进样器(Malvern Instruments Ltd, Malvern, 英国)将样品分配到MicroCal VP-Capillary DSC的样品盘中。将样品在10℃平衡5分钟,且然后以每小时100℃的速度扫描最多到110℃。选择了16秒的过滤时段。将原始数据进行基线校正,并将蛋白浓度进行归一化。使用Origin软件7.0(OriginLab Corporation, Northampton, MA)以用适当的转换数将数据拟合到MN2-State模型。如图8中所示,GUCY2c-2B5v6双特异性抗体显示优异的热稳定性,其中T
与初始T细胞的结合
使用BD LSRII Fortessa分析仪,使用本领域已知的标准流式细胞术方法,滴定纯化的CD3双特异性抗体与从新鲜人外周血单核细胞(PBMC)纯化的初始人T细胞上的人CD3的细胞表面结合。如图9中所示,GUCY2c-2B5v6双特异性抗体非常好地结合T细胞,其中结合EC50为35.44 nM。
双特异性介导的T细胞活性评价
使用Histopaque-177 (Sigma)从健康供体血液分离人PBMC。使用来自Stem CellTechnologies的T细胞富集试剂盒从PBMC分离初始T细胞(负向选择T细胞)。将用荧光素酶表达构建体转染的表达GUCY2c的T84人肿瘤细胞用GUCY2c双特异性抗体或阴性对照CD3双特异性抗体的连续稀释液以及T细胞进行处理。效应细胞对靶细胞的比率(E:T)为10:1或5:1。使T细胞和肿瘤细胞在37℃下孵育48小时,随后使用neolite试剂(Perkin Elmer)测量荧光素酶信号。使用四参数非线性回归分析在Graphpad PRISM中计算EC50值。靶标阴性HCT116或HT29细胞不显示任何GUCY2c双特异性介导的细胞毒性。如图10中所示,GUCY2c-2B5v6双特异性在T细胞重新靶向测定中显示强效细胞毒性。
将T84细胞用T细胞(E:T比率为5:1)和不同剂量的GUCY2c-1608 (GUCY2c-2B5v6)进行处理。在不同时间点(24 h、48 h、96 h)收集上清液,并使用多重Lumninex测定根据制造商的指南进行分析并用xPONENT软件在Luminex 200上读取。测量的细胞因子为人IFN-γ、IL10、IL2、IL4、IL6、TNF-α。图11显示在GUCY2c-1608活化T细胞后,(11A)IFN-γ、(11B)IL10、(11C)IL2、(11D)IL4、(11E)IL6、(11F)TNF-α细胞因子的上调。
对GUCY2c-2B5v6双特异性介导的活性的体内评估
使用过继性转移模型进行体内效力研究。将肿瘤细胞系/患者来源的异种移植物片段植入NSG小鼠中且分期至近似200 mm
实施例9
FLT3-CD3双特异性抗体和使用优化的CD3抗体(2B5v6)的FLT3-2B5v6双特异性IgG的生成和细胞毒性
将人FLT3抗体(xFLT3)和人CD3抗体(2B5v6)分别表达为在一个臂上具有EEEE且在另一个臂上具有RRRR的工程改造的人IgG2dA_D265A,用于在人IgG2的铰链区中的位置223、225和228(例如(C223E或C223R)、(E225E或E225R)和(P228E或P228R))处以及在CH3区中的位置409或368处(例如K409R或L368E(EU编号方案))的双特异性交换。所述抗体也具有在位置265(EU编号方案)处从D到A的突变。
使用蛋白A树脂分开地纯化个别抗体臂。然后在2 mM还原型谷胱甘肽存在的情况下,将1 mg/mL纯化的xFLT3抗体与1 mg/mL纯化的2B5v6抗体进行交换。在37℃下实施交换反应16小时。然后将2 mM氧化型谷胱甘肽添加至蛋白,并将混合物在37℃下孵育30 min。然后将混合物1:5稀释至不含NaCl的20 mM MES pH 5.4缓冲液中。将稀释的样品加载至MonoS离子交换柱上并用20 mM MES pH 5.4 25 mM NaCl缓冲液洗涤。接下来用20 mM MES pH5.4缓冲液中的0-500 mM NaCl梯度洗脱双特异性抗体xFLT3-2B5v6。最后,将双特异性抗体透析至磷酸盐缓冲盐水(PBS)中以用于基于细胞的测定。对于细胞毒性测定,使未受刺激的人T细胞和表达荧光素酶的靶细胞(Eol-1或MV411)在96孔U形底板中在200 μl RPMI + 10%FBS中以确定比率进行共孵育。将xFLT3-2B5v6双特异性抗体在PBS中连续稀释且添加至各孔。24小时后,将100 μl细胞悬浮液与100 μl One-GLO试剂在96孔白壁板中混合,并在Envision光度计上测量发光。使用以下公式确定细胞毒性值:
%细胞毒性 = [1- (RLU样品)/RLU仅靶细胞)] × 100RLU:相对光单位
如图14A和图14B中所示,当在表达较高拷贝的FLT3 (EOL-1)和较低拷贝(MV4-11)的两种细胞上进行测试时,含有优化的CD3抗体(2B5v6)的xFLT3-2B5v6双特异性抗体似乎在呈替代双特异性IgG形式时非常强效。
表13显示FLT3 (EOL-1)的轻链和重链以及2B5v6双特异性抗体的轻链和重链的序列。
表 13
实施例10
2B5v6双特异性抗体的T细胞表位
分析优化的克隆2B5v6的潜在T细胞表位,期望使免疫原性的可能性去风险化。使用用于计算机芯片上预测潜在T细胞表位的Epivax工具进行此分析。此工具预测9-聚体框架肽结合8种不同HLA等位基因中的任一种的数量。命中被定义为Z得分在前5%中的那些且强命中在前1%中。命中至4个或更多个等位基因或1个强命中被视为预测的t细胞表位。基于这些标准,鉴定CDRH2中的3个预测非种系T细胞表位、CDRL1中的2个预测种系表位和L2中的1个预测种系表位(表15)。除了个别肽的得分以外,序列的总体风险可由总命中数或T-regitope调整的Epivax得分来定义,所述得分已经优化以与临床ADA的盛行率相关。此处对于这些预测值,得分越低,ADA的预期风险越小。此处VH结构域具有70个命中且得分为-42.82,VL结构域具有60个命中且得分为-23.79。
为了降低免疫原性风险,鉴定在去除命中和理想地预测的t细胞表位的同时将降低此克隆的总体得分的突变。考虑CDR-L1、CDR-L2和CDR-H2中的任何可能的单一突变体变化以鉴定将降低命中、减少总体t-regitope调整的EpiMatrix得分且去除T细胞表位的突变。由于这些潜在突变也可影响结合和稳定性,因此需要注意考虑上述的预测的稳定性和亲和力数据以及鉴定耐受的突变。表14A、14B和14C显示经设计以降低2B5v6的免疫原性风险的突变。另外,预测如SEQ ID NO 44-47、51-57、60和62中所示的突变减少T细胞表位的数量。
表14A
表14B
表14C
表15显示具有T细胞表位且引起潜在免疫原性风险的CD3抗体(2B5v6)可变结构域的区。
表15
使用标准瞬时HEK293表达生成所有作为单价IgG抗体的突变体,随后使用蛋白A柱进行纯化。使用FACS测试所得克隆与表达CD3的Jurkat细胞的结合和使用如上文实施例7中所述的AC-SINS测试自缔合可能性。如表16中所示,选择5种具有改善epivax得分和减少的T细胞表位且保留与CD3的亲和力的分子以向前进行且以双抗体-Fc形式来测试。将具有改善epivax得分的2B5v6变体与亲本2B5v6进行比较。结果显示相当的与表达CD3的Jurkat细胞的结合和AC-SINS得分。
表16
在所测试的突变体中,几种突变体表现出与2B5v6相比较低的与Jurkat细胞的结合。在这些突变体中,将所有T细胞表位均消除且epivax得分改善的突变体向前进行以生成其中GUCY2c抗体作为其他结合结构域的双抗体-Fc双特异性分子。表17显示epivax得分,且图15显示这些突变体与jurkat细胞的结合降低。低亲和力CD3抗体2B5v6变体显示改善的epivax得分。
表17
实施例11
三种抗-CD3变体在GUCY2C-CD3双特异性抗体中显示改善的亲和力和细胞毒性
使用上文所述的标准克隆、表达和纯化技术,将衍生自2B5v6的三种抗-CD3变体2B5-1038(SEQ ID NO:4和9)、2B5-1039(SEQ ID NO:4和87)和2B5-1040(SEQ ID NO:4和89)以图1中所示的构型之一重新格式化为与抗肿瘤GUCY2c抗体序列配对的双特异性双抗体-Fc分子。使用T-细胞重新靶向(retargeting)测定测试表18中所示的所得的双特异性抗体的体外细胞毒性,且使用表面等离振子共振(SPR)测定测试结合亲和力,且通过AC-SINs测试非特异性。通过用于潜在的T-细胞表位的计算机芯片上预测的Epivax Tool评价免疫原性风险。完整的质谱学数据表明,所有双特异性抗体均具有正确的配对,并且均为100%异二聚体。表18表明,所有三种双特异性抗体(1)与和抗-CD3 2B5v6配对的对照双特异性GUCY2C-1608相比,在体外细胞毒性测定中的效力为约2-倍(图6);(2)具有通过SPR的对重组人CD3的结合亲和力,其与细胞毒性活性一致;(3)具有相比于对照提高的免疫原性得分;和(4)AC-SINs得分维持与对照双特异性GUCY2C-1608相同。这些结果表明,具有不同CD3变体的抗GUCY2c双特异性抗体募集初始人T细胞以在T84肿瘤细胞中诱导细胞杀死(图16)。与对照双特异性GUCY2C-1608相比,衍生自2B5v6的三种抗CD3变体表明近似2倍强效的活性。
表18
双特异性抗体的序列示于表19中。
表 19
- 抗CD3抗体、可活化抗CD3抗体、多特异性抗CD3抗体、多特异性可活化抗CD3抗体及其使用方法
- 包含抗间皮素抗体、抗CD3抗体或抗EGFR抗体的融合蛋白、包含所述融合蛋白的双特异性或三特异性抗体,及其用途
