条件培养基、冻干粉及制备方法和应用
文献发布时间:2023-06-19 10:44:55
技术领域
本申请属于干细胞技术领域,尤其是涉及一种基于人脂肪间充质干细胞条件培养基的冻干粉及其抗氧化衰老作用。
背景技术
衰老伴随着多个器官结构与功能的逐渐丧失。皮肤是人体最大的器官,皮肤的衰老是机体衰老最直观的表现,其主要特征是皮肤干燥粗糙、弹性减弱、松弛、皱纹加深等。随着生活水平的不断提高,人们比以往更加注重皮肤及身体的保养,因此开发新的抗皮肤衰老治疗手段具有重要的研究意义和较好的临床应用前景。
皮肤老化是一个复杂的过程,包括内源性老化和外源性老化。内源性老化即年龄增长等因素引起的自然衰老;外源性老化是指外界环境刺激引起的皮肤衰老,包括紫外线辐射、烟雾和常见污染物(参见Tobin D J.Introduction to SKIN aging[J].Journal ofTissue Viability,2016,26(1):37-46.),其中紫外线辐射是外源性老化的主要因素,也被称为光老化。事实上,高达80%-90%的面部衰老是慢性紫外线辐射导致形成,紫外辐射被认为是对皮肤伤害最严重的损伤因素。
皮肤衰老主要是由于皮肤真皮层中细胞外基质的改变,在真皮层中,I型胶原蛋白含量会减少,同时胶原蛋白和弹性蛋白纤维将出现紊乱及碎片化现象。皮肤成纤维细胞是皮肤真皮中的主要细胞类型,负责调节细胞外基质、胶原蛋白产生和伤口愈合,在维持皮肤正常结构和功能中起重要作用。
关于皮肤老化机制的学说较多,包括染色体遗传学说、基因调控学说、代谢失调学说和自由基学说等,当下被研究者认可度较髙、并广泛开展研究的是氧化应激(自由基)学说。皮肤接受过多的紫外线照射后,皮肤组织细胞会产生氧化应激,诱导产生过量的活性氧簇(ROS),ROS不仅直接损害线粒体导致能量产生不足,还直接损伤细胞内多种生物大分子,减少抗氧化酶的含量,从而破坏细胞内的抗氧化系统,进而引起细胞炎症、细胞凋亡等导致皮肤衰老的内因。
干细胞(Stem Cell)是一种具有自我更新能力和分化潜能的功能细胞,干细胞疗法为多种难治性重大疾病提供了新的解决策略。间充质干细胞是一种来源于发育早期的中胚层和神经外胚层的多能成体干细胞,脂肪间充质干细胞来源于脂肪组织,是继骨髓间充质干细胞之后在干细胞领域展开广泛研究的一类成体干细胞,其来源丰富、易提取,是理想的种子细胞,在临床治疗中使用成体干细胞,特别是自体来源间充质干细胞及其条件培养基,既可避免伦理因素的限制,也较好的规避了潜在的干细胞多向分化潜能带来的致瘤性风险(参见Gruenloh W,Kambal A,Sondergaard C,et al.Characterization and In VivoTesting of Mesenchymal Stem Cells Derived from Human Embryonic Stem Cells[J].Tissue Engineering Part A,2011,17(11-12):1517.和Herberts C A,Kwa M S,HermsenH P.Risk factors in the development of stem cell therapy[J].Journal ofTranslational Medicine,2011,9(1):29.)。其在生长过程中能够向培养液中分泌大量的生物活性物质,这些生物活性物质会改善其他细胞的生长状态和生理功能,具有免疫调节能力、抗炎能力以及调节增殖等生物活性。
随着蛋白质组学技术不断发展,这些生物活性物质的成分逐渐被阐明。Engel等研究表明干细胞的旁分泌物包括生长因子、血管生成因子、激素、细胞因子、细胞外基质蛋白、细胞外基质蛋白酶和一些遗传物质(如双链DNA、mRNA等)(参见Stem Cell Secretome andParacrine Activity[M].2016.)。Pawitan等通过实验发现干细胞条件培养基的主要成分有:生长因子(如血管内皮生长因子、血小板衍生生长因子、碱性成纤维细胞生长因子等)、白细胞介素、细胞外基质蛋白和组织重塑酶等(参见Prospect of stem cell conditionedmedium in regenerative medicine[J].Biomed Research International,2014(4):965849.)。
近年来,许多研究人员利用间充质干细胞的旁分泌功能,开始采用间充质干细胞来源的条件培养基代替干细胞自身,研发新的治疗手段。Ding等研究表明人脂肪间充质干细胞分泌的肝细胞生长因子和碱性成纤维细胞生长因子可通过激活SIRT1/FOXO1信号通路改善自然衰老过程中的卵巢功能(HGF and BFGF Secretion by Human Adipose-DerivedStem Cells Improves Ovarian Function During Natural Aging via Activation ofthe SIRT1/FOXO1 Signaling Pathway[J].Cellular Physiology&Biochemistry,2018,1316-32.)。Kwon等发现间充质干细胞条件培养基能显著降低小鼠皮肤基质金属蛋白酶1表达并增加前胶原合成,促进无毛小鼠皮肤损伤修复和皱纹消失(参见Conditioned mediumfrom human bone marrow-derived mesenchymal stem cells promotes skinmoisturization and effacement of wrinkles in UVB-irradiated SKH-1hairlessmice[J].)。Cooper等人发现ADSCs-CM能够促进人皮肤成纤维细胞的迁移和缺血性伤口愈合(参见Human Adipose-Derived Stem Cell Conditioned Media and ExosomesContaining MALAT1 Promote Human Dermal Fibroblast Migration and IschemicWound Healing[J].Adv Wound Care(New Rochelle),2018,7(9):299-308.)。
条件培养基中起到作用的细胞活性因子为多种可溶性蛋白质,为了使条件培养基能够较长时间贮存,并保持条件培养基中这些因子的活性,可以考虑采用冷冻干燥技术制备条件培养基的冻干粉,冷冻干燥目前是蛋白质保存的标准。但是在冷冻贮藏和冷冻干燥的过程中仍会引起部分蛋白质变性,因此在冷冻干燥过程中一般要加入糖类作为冻干保护剂防止由于蛋白质表面的单层水分子破坏而引起蛋白质的变性。
关于糖类的生物保护作用机理仍在研究和探讨中,目前普遍公认的有三种假说,分别为水替代假说,玻璃态假说和优先排阻假说。Espinosa等人研究发现,在有或没有保护基质的冷冻干燥脱水系统中,酶活性以及蛋白质的稳定性具有较大的差异(参见Stabilityof Enzymes and Proteins in Dried Glassy Systems:Effect of Simulated SunlightConditions[J].Biotechnology Progress,2010,20(4):1220-4.)。
不同糖类的保护作用也有差异,此外保护添加剂的比例以及条件培养基使用时的稀释比例等因素对生物活性物质的也会产生不同程度的影响。
随着我国社会人口老龄化现象日趋明显,医学抗衰老领域有着广阔的应用前景。医学上认为衰老(细胞衰老)是一个不可逆的过程,目前市场上常规的药物治疗只能实现短时短效的改善细胞老化的表象,无法从根本上解决细胞衰老及凋亡的问题。而利用间充质干细胞的旁分泌作用制备抗衰老抗氧化药物,成为目前干细胞治疗领域一种新型的治疗手段,通过干细胞在增殖过程中分泌的大量生物活性物质,促进机体细胞的代谢更新和增殖活力,从而延缓细胞的衰老。
开发出脂肪来源的间充质干细胞条件培养基及其标准化制备方案,以及获取高效、低成本、稳定性好的具有抗氧化及抗衰老能力的条件培养基冻干粉,是本领域急需解决的问题,同时对医学美容的产业化发展也具有极大意义。
发明内容
为解决现有技术存在的问题,本发明提供了一种新的无血清细胞培养体系,以及人脂肪来源的间充质干细胞条件培养基的标准化制备方案,同时筛选出冻干保护添加剂的最佳比例和条件培养基的最佳稀释比例,在综合高效、节约成本的基础上,探究其在细胞水平和在体水平的抗氧化及抗衰老能力。
具体的,第一方面,本发明提供了一种人脂肪间充质干细胞条件培养基的制备方法,包括以下步骤:
(S1)从新鲜的人脂肪组织中分离人脂肪间充质干细胞,并进行传代培养;
(S2)取传代培养中的P3~P6代人脂肪间充质干细胞用含有FBS的DMEM/F12培养基培养至细胞生长融合度为60%~80%,优选地,融合度为70%,然后改换成LonzaUltraCULTURE无血清培养基继续培养;
(S3)培养结束后,收集培养基上清液,并对上清液进行离心、过滤,得到的滤液即为人脂肪间充质干细胞条件培养基。
优选地,步骤(S1)所述分离人脂肪间充质干细胞,包括:将取下的新鲜人脂肪组织用含青霉素和链霉素的PBS溶液浸泡并清洗,取下脂肪层组织,加入胶原酶震荡消化,加入PBS溶液终止消化,然后离心处理(优选500×g离心10min),弃上两层,留下层脂肪细胞;
优选地,所述传代培养包括,将分离得到的下层脂肪细胞用PBS溶液重悬,然后用200~300目细胞筛过滤,离心处理(优选350×g离心5min),加入完全培养基重悬,接种至培养瓶传代培养,此时细胞代次记为P0;优选地,48h后,更换新培养基,之后每3天更换一次培养液,直至细胞平铺并长至细胞融合度达到80%-90%时,采用完全培养基进行正常传代培养;更优选地,所述完全培养基为含有10%FBS的DMEM培养基。
进一步的,所述步骤(S3)为培养48h后,收集上清液,在0~4℃,150~200×g条件下离心10~20min,优选地200×g条件下离心15min,弃沉淀,上清液用0.22μm的过滤膜过滤,得到的滤液即为人脂肪间充质干细胞条件培养基。
本发明第二方面还提供了一种人脂肪间充质干细胞条件培养基,所述人脂肪间充质干细胞条件培养基由本发明前述方法制备得到。
本发明三方面还提供了一种条件培养基冻干粉的制备方法,包括以下步骤:
取本发明所述方法制备的人脂肪间充质干细胞条件培养基,任选的加入糖类,进行低温速冻,然后真空冷冻干燥至粉末状,得到条件培养基冻干粉;
优选地,所述低温速冻是指迅速置于-80℃进行冷冻;优选地的速冻8~12h。
进一步,优选地,所述糖类为单糖、低聚糖或多糖中的一种或多种;更优选地所述糖类为甘露醇或海藻糖。
进一步的,所述糖类加入到所述人脂肪间充质条件培养基后的浓度为0%~10%(w/v);优选0%~5%(w/v),更优选1.25%~2.5%(w/v)。
在本发明的另一个优选实施方式中,提供了一种人脂肪间充质干细胞条件培养基(ADSC-CM)冻干粉的制备方法,包括取本发明所述方法制备的人脂肪间充质干细胞条件培养基,加入糖类,优选二塘,更优选甘露醇或海藻糖,得到混合液,其中糖类浓度0%~10%(w/v);优选0%~5%(w/v),更优选1.25%~2.5%(w/v);然后将混合液分装到在西林瓶中,例如每瓶含有2mL,并迅速置于-80℃超低温进行速冻8~12h;最后真空冷冻干燥至粉末状,即为所述ADSC-CM冻干粉,优选地的将得到ADSC-CM冻干粉密封并贮藏于-80℃。
在本发明的第四方面,还提供了一种条件培养基冻干粉,其由本发明所述方法制备。
此外,在本发明的第五方面,还提供了一种本发明所述方法制备的条件培养基冻干粉在制备皮肤修复、抗皮肤衰老、修复皮肤氧化应激损伤,和/或修复皮肤紫外线损伤的产品中的应用,所述产品包括药物、护肤品或化妆品;优选地,所述条件培养基冻干粉在使用时用DMEM培养基对其进行溶解,使终体积浓度为12.5%~100%(v/v),更优选地,使终体积浓度为12.5%(v/v),或25%(v/v),或50%(v/v)。
在本发明的第六方面还提供了一种组合物,其包含本发明所述的条件培养基冻干粉。
本发明所述的Lonza UltraCULTURE无血清培养基(LONZA UltraCULTURE Serum-free Medium)是一种营养成分完全的通用型的无血清培养基;培养基中加入了重组人胰岛素,牛转铁蛋白和牛血清蛋白纯化混合物。
本发明中所述的ADSC-CM冻干粉中糖类浓度,是指人脂肪间充质条件培养基中加入的糖的重量与所述的人脂肪间充质条件培养基的体积之比,例如向10ml人脂肪间充质条件培养基中加入0.125g所述糖类,则糖类的浓度为1.25%(w/v)。
首先,本发明提供的方法,通过添加冻干保护剂将含有大量干细胞分泌物质的条件培养基冷冻干燥成固体粉末,稳定细胞因子性质,使其能发挥最大的功效;特别是添加海藻糖除了能够作为冻干保护剂,保护条件培养基中细胞因子的活性,同时海藻糖本身具有抗氧化作用,延缓细胞衰老。
其次,本发明建立了人脂肪来源的间充质干细胞和人真皮成纤维细胞的制备及传代培养的方法。本发明提供的培养基能显著提高间充质干细胞的贴壁性能和增殖速率,同时保持间充质干细胞的干性特征,成分明确,安全性高。
第三,本发明还提供了一种新的无血清培养基作为基础制备间充质干细胞条件培养基,回避了常用的胎牛血清作为添加物,避免了引入异种蛋白及动物源性病原微生物的可能,该Lonza UltraCulture培养基为药用级别,已通过美国FDA备案,相比于其他常用的DMEM,成分更安全。
第四,本发明提供的条件培养基冻干粉能够有效的修复过氧化氢诱导的成纤维细胞的衰老及氧化应激反应,并且修复UV光线诱导的小鼠真皮中胶原纤维和弹性纤维损伤。解决了现有技术中细胞冷冻技术存在的细胞毒副效应、异源血清可能导致过敏和排斥反应、冷冻后干细胞中的活性成分不能完好保留等问题。
附图说明
下面结合附图和实施例对本申请的技术方案进一步说明。
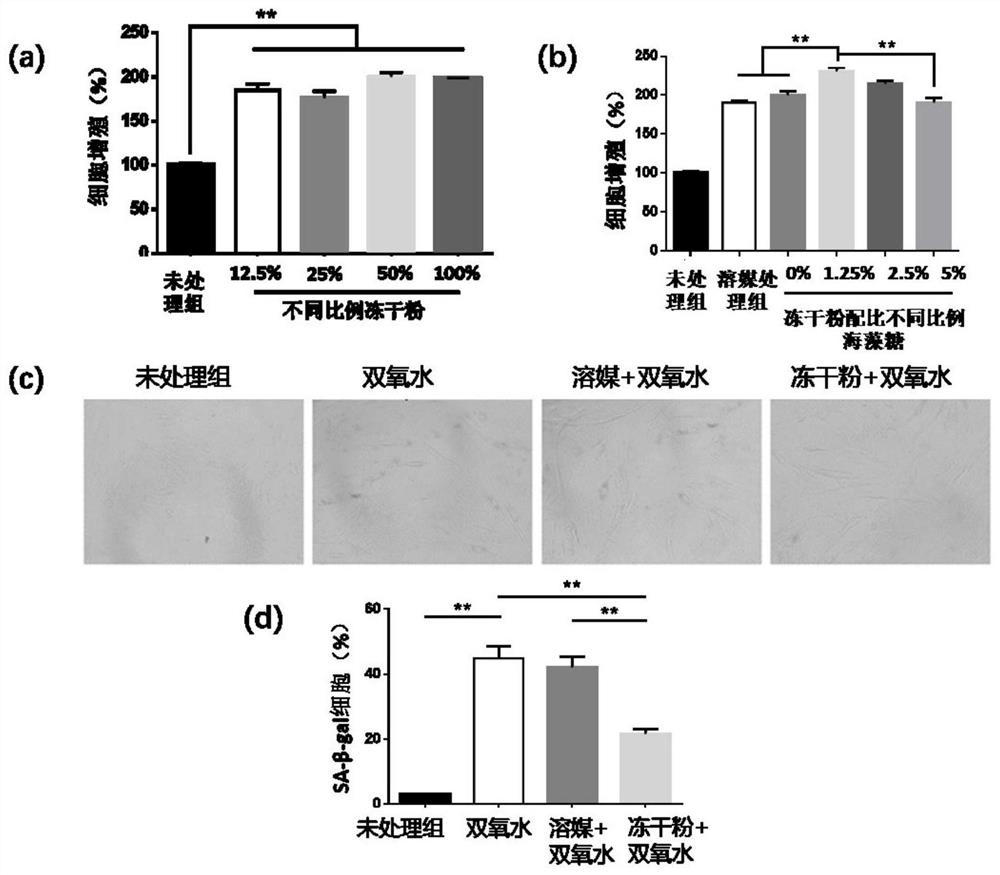
图1显示ADSCs-CM冻干粉对成纤维细胞增殖活性的影响;
其中图1(a)表示用DMEM培养基对海藻糖浓度为1.25%(w/v)的ADSC-CM冻干粉进行溶解,使终体积浓度分别为0%(未处理组)、12.5%、25%、50%、100%(v/v)时对成纤维细胞增殖活性的影响图,其中纵坐标为细胞增殖率(%),横坐标表示ADSC-CM冻干粉的浓度;
图1(b)表示海藻糖浓度分别为0%、1.25%、2.5%、5%(w/v)的ADSCs-CM冻干粉对成纤维细胞增殖活性的影响图,其中ADSCs-CM冻干粉用DMEM培养基稀释成终体积浓度为50%(v/v);其中纵坐标为细胞增殖率(%),横坐标表示含有不同比例海藻糖的ADSC-CM冻干粉。
图1(c)和图1(d)为人皮肤成纤维细胞β-半乳糖苷酶染色(10×)及其量化;
其中未处理组为对照组,双氧水组为用200μM H
溶媒+双氧水组为使用Lonza无血清培养基,即冻干粉所用溶媒处理双氧水作用后的细胞,结果表明溶媒组对双氧水作用后衰老阳性细胞率没有明显变化;
冻干粉加双氧水组表示使用ADSCs-CM冻干粉处理双氧水作用后的细胞;试验结果表明使用ADSCs-CM冻干粉进行培养的阳性细胞率显著下降。
图1(d)量化结果表明,双氧水处理组衰老阳性细胞数量为44.90±3.84%;溶媒继续培养后的阳性细胞率没有明显变化,为42.00±3.29%;而使用ADSCs-CM冻干粉进行培养的阳性细胞率显著下降至21.57±1.60%。
图2为ADSCs-CM冻干粉修复双氧水诱导的人皮肤成纤维细胞的氧化应激损伤的效果图;
图2(a)为DHE荧光探针法测定各组成纤维细胞内ROS含量(10×);
图2(b)显示各组ROS阳性细胞百分比;
图2(c)显示各组细胞内SOD含量,其中scale bar:20μm,n=3,**P<0.01。
图2(a)和图2(b)显示双氧水处理组ROS水平显着升高;经H
图2(c)显示,双氧水处理组细胞中SOD活性明显降低;双氧水诱导后,使用溶媒培养的成纤维细胞内SOD活性没有明显变化,而使用ADSCs-CM冻干粉进行培养的成纤维细胞内SOD活性显著增高。
图3为ADSCs-CM冻干粉对紫外线损伤的修复作用评价效果图;
其中,图3(a)为裸鼠皮肤组织Masson三色染色结果;
图3(b)为Masson染色结果ImageJ量化;
图3(c)为裸鼠皮肤组织弹力纤维染色结果;(scale bar:200μm or 5μm,n=3,**P<0.01)。
图4为ADSCs-CM冻干粉注射后对裸鼠的安全性评价结果;
其中,图4(a)显示各组实验小鼠的器官HE染色图片;
图4(b)显示4周注射的过程中,各组小鼠的体重变化。
具体实施方式
以下结合具体实施例对本发明的技术方案及有益效果做进一步阐释和说明。应当理解的是,此处所描述的具体实施例仅仅为了解释本发明,并不限定于本发明。实施例中所用到的各种常用试剂,均为市售产品。
实施例1、人脂肪间充质干细胞的制备及传代培养
(1)将取下的人源新鲜脂肪组织浸泡于含青霉素和链霉素(100U/mL)的PBS中,用75%乙醇消毒样品袋后转入超净台;
(2)取出脂肪组织置于10cm培养皿中,用含青霉素和链霉素(100U/mL)的PBS清洗三遍;
(3)用剪刀及镊子将脂肪组织剪成小块,并在解剖显微镜下去除血管及结缔组织;
(4)将分离的脂肪组织块转入50毫升离心管中,加入胶原酶,37℃震荡消化30min(震荡速度不能让组织块沉底);
(5)加入等体积的PBS终止消化,500×g离心10min,
(6)离心后的悬液分为三层,吸弃上两层液体,留下层细胞;
(7)加入PBS重悬细胞,用300目细胞筛过滤较大组织块;
(8)350×g离心5min,用含有10%FBS的DMEM培养基重悬细胞后接种至培养瓶,于37℃、5%的CO2培养箱中培养,此时细胞代次记为P0。
(9)48小时后,弃掉含漂浮细胞的旧培养基,换新培养基。
(10)每3天更换一次培养液,直至细胞平铺并长至细胞融合度达到80%-90%时,采用含有10%FBS的DMEM培养基进行正常传代培养。
实施例2、人真皮成纤维细胞的制备及传代培养
(1)将手术切下的人源新鲜包皮浸泡于含青霉素和链霉素(100U/mL)的PBS中,用75%乙醇消毒样品袋后移入超净台内;
(2)取出皮片置于10cm培养皿中用含青霉素和链霉素(100U/mL)的PBS漂洗两次,洗去残留的杂质和血迹后,更换新鲜含有1%双抗+PBS中继续浸泡30min;
(3)用剪刀及镊子剔除皮下脂肪、结缔组织等后,将皮片剪成1cm×1cm大小,朝上分开贴于10cm培养皿底,;
(4)加入适量终浓度为2mg/mL的dispaseⅡ酶溶液,4℃冰箱消化过夜
(5)于超净台内分离表皮和真皮,用PBS将真皮片清洗两次后,将真皮剪碎置于T25培养瓶中,于培养箱内培养2h,
(6)之后加入含青霉素和链霉素(100U/ml)的完全培养基继续培养,
(7)每三天换液一次,待细胞贴壁,此时细胞代次记为P0。
(8)待真皮成纤维细胞融合度达到80%-90%时,采用含有10%FBS的DMEM培养基进行正常传代培养。
其中,本实施例步骤(1)中所使用的人源的新鲜包皮是来源于与实施例1同一个人的包皮组织,通过包皮环切手术,获取。
实施例3、人脂肪间充质干细胞条件培养基的制备
(1)取传代至第3-6代的人脂肪间充质干细胞接种于10cm培养皿中,采用含有10%FBS的DMEM/F12培养基正常培养至细胞生长融合度为70%;
(2)吸弃原有含血清培养基,改换成Lonza UltraCULTURE无血清培养基,并置于37℃、含5%CO2的细胞培养箱中培养;
(2)继续培养48h后,收集细胞上清液至50mL离心管。
(3)在4℃,200×g条件下离心15min,弃沉淀。
(4)取上清液用0.22μm的过滤膜进行过滤,所得滤液即为所述的脂肪间充质干细胞条件培养基。
实施例4、条件培养基冻干粉(ADSCs-CM冻干粉)的制备
(1)取4份实施例3制备的条件培养基各10mL,分别加入不同质量的海藻糖(0g、0.125g、0.25g、0.5g)作为冻干保护剂,充分混匀溶解,使海藻糖终浓度分别为0%、1.25%、2.5%、5%(w/v);
(2)分别将混合液分装在西林瓶中,每瓶含有2mL,并迅速置于-80℃超低温冰箱进行速冻过夜;
(3)真空冷冻干燥至粉末状,密封并贮藏于-80℃,即为含有不同含量的海藻糖的人脂肪间充质干细胞条件培养基冻干粉(ADSC-CM冻干粉)。
使用时按照不同比例用DMEM培养基对ADSC-CM冻干粉进行溶解,使终体积浓度分别为12.5%、25%、50%、100%(v/v)。
以下结合具体试验对本发明所述的人脂肪间充质干细胞条件培养基冻干粉(ADSC-CM)对成纤维细胞衰老及抗氧化应激效果进行检测。
根据实验结果以及成本节约原则,如无特别说明,以下试验例中所用ADSCs-CM冻干粉是采用本发明方法制备的以添加1.25%(w/v)海藻糖作为保护剂,并用DMEM培养基稀释至ADSC-CM冻干粉最终浓度为50%(v/v)作为后试验的工作浓度;所述“溶媒”是指LonzaUltraCULTURE无血清培养基;所用溶剂、培养基等均可通过市购获得,如无特别说明,均按照产品说明书使用。
试验例1、ADSCs-CM冻干粉对成纤维细胞的抗衰老作用验证
利用cck-8比较用不同稀释比例的ADSCs-CM冻干粉以及添加不同海藻糖比例的ADSCs-CM冻干粉对成纤维细胞增殖活性的影响。
根据实验结果以及成本节约原则,用DMEM培养基对海藻糖浓度为1.25%(w/v)的ADSCs-CM冻干粉进行溶解,使终体积ADSCs-CM冻干粉的浓度分别为0%(未处理组)、12.5%、25%、50%、100%(v/v),然后分别检测其对成纤维细胞增殖活性的影响,试验结果如图1(a)所示;
用DMEM培养基对海藻糖含量分别为0%、1.25%、2.5%、5%(w/v)的ADSCs-CM冻干粉进行溶解,使得最终的稀释后ADSCs-CM冻干粉浓度为50%(v/v),然后分别检测其对成纤维细胞增殖活性的影响,试验结果如图1(b)所示。
结果表明,本发明提供的ADSCs-CM冻干粉能够有效的提高成纤维细胞的增殖活性。
构建H
结果如图如1(c)所示;染色结果及量化结果显示,与未处理组相比,双氧水处理组衰老阳性细胞数量显着增加(44.90±3.84%),使用冻干粉溶媒继续培养后的阳性细胞率没有明显变化(42.00±3.29%);而使用ADSCs-CM冻干粉进行培养的阳性细胞率显著下降(21.57±1.60%)(如图1(d))。
试验例2:ADSCs-CM冻干粉修复H
使用ROS特异性荧光探针Dihydroethidium确定ROS的生成。试验步骤:按上述实验分组(未处理组、双氧水、溶媒+双氧水及冻干粉+双氧水)处理成纤维细胞24h后,吸弃培养液,PBS洗一遍,加入4%PFA室温固定15min,吸出固定液,PBS洗三次,每次3min,用PBS将超氧化物阴离子荧光探针(DHE)稀释至工作浓度2μM,每孔加入500μL,避光孵育45min,吸弃溶液,用PBS清洗3次后,用荧光显微镜观察红色荧光百分比,拍照,并随机选取5个视野计数,计算细胞荧光阳性率,以此表示细胞内ROS含量。如图2(a)和图2(b)所示,结果表明,双氧水处理组ROS水平显着升高;经H
另外,采用羟胺法对成纤维细胞内的SOD含量进行测定,试验步骤:按上述实验分组(未处理组、双氧水、溶媒+双氧水及冻干粉+双氧水)处理成纤维细胞24h,PBS清洗后用胰酶将细胞消化并离心,取下层细胞PBS重悬,采用探头超声将细胞进行破碎(工作2s,停2s,超声3min),3000r/min离心10min,取上层清液按试剂盒说明书进行测定,计算公式:总SOD活力(U/mL)=(对照OD值-测定OD值)/对照OD值×(反应液总体积/取样量(ml)),如图2(c)结果显示,H
试验例3:ADSCs-CM冻干粉对紫外线损伤的修复作用评价
裸鼠制备皮肤损伤模型,模拟自然条件下紫外线等应激损伤,进行背部皮肤紫外线照射四周后制备紫外线损伤模型。
皮下注射生理盐水(溶媒组)或ADSCs-CM冻干粉溶液(冻干粉组),按实验计划进行4周后取皮肤组织进行抗衰老相关指标的检测。
通过皮肤切片的组织化学染色(Masson三色染色和Weigert氏弹力纤维染色)结果显示,溶媒组真皮胶原纤维层较薄,胶原纤维(深色部分)稀疏、松散、断裂,几乎没有延续的胶原纤维,断裂的胶原纤维成点片状(如图3(a)),弹力纤维(深色部分)增粗且稀疏,呈现松散、断裂的状态(如图3(c));而注射冻干粉组的皮肤组织胶原纤维层相对较厚,胶原纤维排列连续且均匀(如图3(a)),密度显著高于溶媒组,弹力纤维纤细、连续,且较溶媒组数量增多(图如3(c)),图3(b)显示了溶媒组合冻干粉组的Masson染色结果ImageJ量化图。
试验例4:ADSCs-CM冻干粉的安全性评价试验
本实验在缺乏免疫系统的裸鼠上进行。采用UVB-313灯管安装于自制的紫外线辐射箱中,作为辐射光源。待光源稳定后,将相应组别裸鼠固定于辐射箱中进行照射,根据参考文献(参见Effects of ginseng saponins isolated from red ginseng onultraviolet B-induced skin aging in hairless mice-ScienceDirect[J].EuropeanJournal of Pharmacology,2009,602(1):148-156.),MED为75mJ/cm
溶媒组:按照上述剂量给予紫外线照射,每周4次,共4周。在每只裸鼠背部相同位置标记上、下两个注射位点,皮下注射生理盐水,每个点注射100μl,隔日一次,连续4周。
冻干粉:按照上述剂量给予紫外线照射,每周4次,共4周。在每只裸鼠背部相同位置标记上、下两个注射位点,部皮下注射ADSC-CM冻干粉稀释液,每个点注射100μl,隔日一次,连续4周。所有动物每周称重记录。
注射ADSCs-CM冻干粉三个月后裸鼠处死,分别取各重要脏器进行HE染色并评价安全性。通过各组实验小鼠的器官HE染色图片(如图4(a))可以看到,与正常裸鼠相比,分别给予溶媒或冻干粉溶液注射的两组裸鼠各器官均无明显炎症、坏死或癌变现象。4周注射的过程中,各组小鼠的体重保持稳定(如图4(b))。表明ADSCs-CM冻干粉无体内系统性毒性,安全性较高,无致瘤风险。
以上述依据本申请的理想实施例为启示,通过上述的说明内容,相关工作人员完全可以在不偏离本项申请技术思想的范围内,进行多样的变更以及修改。本项申请的技术性范围并不局限于说明书上的内容,必须要根据权利要求范围来确定其技术性范围。
