用于制备治疗上皮细胞癌的医药组合物及其用途
文献发布时间:2023-06-19 11:03:41
技术领域
本发明是关于一种小孢子灵芝免疫调节蛋白与钥孔虫戚血蓝蛋白用于制备治疗上皮细胞癌的医药组合物及用途。
背景技术
癌症是人类健康的一大威胁,根据卫生署公布的资料,癌症已连续三十六年蝉联国人第一大死因。由此可见,癌症对人类健康的威胁已达不容忽视的程度。在所有的癌症种类中,约有80%以上的癌症属于上皮细胞癌,其特征为上皮组织的不正常肿块,起因于过度地细胞分裂。癌症细胞不具有正常细胞生长的限制,会不正常地侵入其他细胞的范围。基本上,身体任何有上皮组织的器官都可能罹患上皮细胞癌,较常见的有肺癌、乳癌、口腔癌、食道癌、胃癌、大肠癌、肝癌、子宫颈癌、膀胱癌、胰脏癌或皮肤癌。
传统癌症治疗的种类包括化学治疗、手术治疗、放射线治疗、贺尔蒙疗法、生物制剂疗法、标靶治疗以及结合前述治疗方法的疗法。然而,许多肿瘤对传统方法具有抗性。近年来已进行治疗癌症的免疫疗法的研究,该方法经由在远离肿瘤的部位投予疫苗组合物来使患者产生全身性肿瘤特异性主动免疫反应。目前已提出多种类型疫苗,包括含有分离的肿瘤相关抗原的疫苗。
虽然目前已鉴别出许多肿瘤相关抗原且已研究许多这些抗原作为基于蛋白质或基于DNA的疫苗用于治疗或预防癌症,但迄今大部分尚处于临床试验阶段且尚未产生治疗性产品。另外,开发癌症疫苗的挑战之一在于癌症抗原通常来源于自身且因此具有不良的免疫原性,这是因为免疫系统经自身调节而不识别自身蛋白质。因此,现仍亟需一种可增强癌症疫苗的免疫原性或治疗效果的方法。
因此,提供一种医药组合物及其制备用途,能够使免疫细胞产生针对肿瘤细胞的特异性主动免疫反应,且可增强医药组合物的免疫原性及治疗效果,确实是一个重要课题。
发明内容
有鉴于上述课题,本发明的目的为提供一种能够使免疫细胞产生针对肿瘤细胞的特异性主动免疫反应,且可增强免疫原性及治疗效果的医药组合物及其制备用途。
为达上述目的,根据本发明的一种医药组合物,包括小孢子灵芝免疫调节蛋白(GMI,ganoderma microsporum immunomodulatory protein)以及钥孔虫戚血蓝蛋白(KLH,Keyhole limpet hemocyanin)。
为达上述目的,本发明另提供一种小孢子灵芝免疫调节蛋白(GMI)与钥孔虫戚血蓝蛋白(KLH)用于制备治疗上皮细胞癌的医药组合物的用途,其中医药组合物包括小孢子灵芝免疫调节蛋白以及钥孔虫戚血蓝蛋白。
在一个实施例中,小孢子灵芝免疫调节蛋白的剂量在5微克/毫升至200微克/毫升之间。
在一个实施例中,钥孔虫戚血蓝蛋白的剂量在10微克/毫升至200微克/毫升之间。
在一个实施例中,小孢子灵芝免疫调节蛋白与钥孔虫戚血蓝蛋白的重量比例在20:1至1:40之间。
在一个实施例中,医药组合物更包括植物性凝血球素(PHA,phytohemagglutinin)。
在一个实施例中,植物性凝血球素的剂量在1微克/毫升至20微克/毫升之间。
在一个实施例中,小孢子灵芝免疫调节蛋白与植物性凝血球素的重量比例在200:1至1:4之间。
在一个实施例中,钥孔虫戚血蓝蛋白与植物性凝血球素的重量比例在200:1至1:2之间。
在一个实施例中,医药组合物的剂型为锭剂、胶囊、乳剂、分散剂、悬浮剂、溶液剂、糖浆剂、颗粒剂、经皮贴剂、凝胶剂、粉剂、霜剂、膏剂、栓剂或喷雾剂。
在一个实施例中,上皮细胞癌为肺癌、乳癌、口腔癌、食道癌、胃癌、大肠癌、肝癌、子宫颈癌、膀胱癌、胰脏癌或皮肤癌。
在一个实施例中,上皮细胞癌为肺癌、乳癌、胰脏癌或膀胱癌。
承上所述,本发明的一种医药组合物及其制备用途,能够使免疫细胞产生针对肿瘤细胞的特异性主动免疫反应,且可增强医药组合物的免疫原性及治疗效果。
附图说明
图1A为以本发明医药组合物、PHA、KLH及GMI处理人类周边血液单核细胞(PBMC)的研究结果,其为以光学显微镜进行观察的细胞照片。
图1B及图1C为以本发明医药组合物、PHA、KLH及GMI处理人类周边血液单核细胞(PBMC)的流式细胞仪分析结果。图1B为以流式细胞仪分析7-AAD、CFSE荧光强度的细胞分布图,以此分布图可计算出各个组别的细胞毒杀率。图1C为根据图1B以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率。
图2A及图2B为以本发明医药组合物、PHA、KLH及GMI处理人类肺癌细胞株(A549细胞)的研究结果,其为以光学显微镜进行观察的细胞照片。
图2C至图2F为以本发明医药组合物、PHA、KLH及GMI处理肺癌细胞株(A549细胞)的流式细胞仪分析结果。图2C、图2D为以流式细胞仪分析7-AAD、CFSE荧光强度的细胞分布图,以此分布图可计算出各个组别的细胞毒杀率。图2E为根据图2C以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率。图2F为根据图2D以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率。
图3A及图3B为以本发明医药组合物、PHA、KLH及GMI处理人类乳腺癌细胞株(MDA-MB-231细胞)的研究结果,其为以光学显微镜进行观察的细胞照片。
图3C至图3F为以本发明医药组合物、PHA、KLH及GMI处理人类乳腺癌细胞株(MDA-MB-231细胞)的流式细胞仪分析结果。图3C、图3D为以流式细胞仪分析7-AAD、CFSE荧光强度的细胞分布图,以此分布图可计算出各个组别的细胞毒杀率。图3E为根据图3C以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率。图3F为根据图3D以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率。
图4A及图4B为以本发明医药组合物、PHA、KLH及GMI处理人类膀胱癌细胞株(T24细胞)的研究结果,其为以光学显微镜进行观察的细胞照片。
图4C至图4F为以本发明医药组合物、PHA、KLH及GMI处理人类膀胱癌细胞株(T24细胞)的流式细胞仪分析结果。图4C、图4D为以流式细胞仪分析7-AAD、CFSE荧光强度的细胞分布图,以此分布图可计算出各个组别的细胞毒杀率。图4E为根据图4C以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率。图4F为根据图4D以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率。
图5A及图5B为以本发明医药组合物、PHA、KLH及GMI处理人类胰脏癌细胞株(BxPC-3细胞)的研究结果,其为以光学显微镜进行观察的细胞照片。
图5C至图5F为以本发明医药组合物、PHA、KLH及GMI处理人类胰脏癌细胞株(BxPC-3细胞)的流式细胞仪分析结果。图5C、图5D为以流式细胞仪分析7-AAD、CFSE荧光强度的细胞分布图,以此分布图可计算出各个组别的细胞毒杀率。图5E为根据图5C以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率。图5F为根据图5D以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率。
具体实施方式
以下将参照相关附图,说明根据本发明所提供的各种实施例,其中相同的元件将以相同的参照符号加以说明。
需先说明的是,以下提供了本发明的多个实施例,虽然每个实施例都代表在某种可能的情况下本发明所公开公开的元件的一种组合,但本发明仍应包括其所公开公开的元件的所有可能的组合。因此,如果一个实施例包括元件A、B及C,而第二个实施例包括元件B及D,即使未明确公开公开,本发明应理解为仍包括A、B、C和/或D的其他种类的任意组合。
而在下述的某些实施例中,其中描述了用于表示成分的量、特性(例如浓度、反应条件等等)的数值,其应理解为在一些情况下被用语「大约」加以修饰。因此,在某些实施例中,本说明书及所附的权利要求中所记载的数值参数是近似值,其可根据特定实施例所试图获得的所需特性而改变。在某些实施例中,应根据所记载的有效位数的数字及应用一般的数值简化技术来解释数值参数。然而,即便在某些实施例中,其数值范围及数值参数是近似值,但在具体实验例中所提出的数值则是尽可能地精确记载。在本文中所记载的数值可能包含某些误差,其是由于统计各个量测值而产生的标准偏差所导致。
除非本文另有规定,本文所提出的所有数值范围应解释为包含它们的端点,而开放式范围应解释为包含商业上可实施的数值。同样地,除非本文另有规定,所有的数值列表应被认为包含其中间的数值。也就是说,本文所提及的数值范围仅旨在作为一一指称各个落在该范围内的单独数值的简写方法。除非另有说明,在范围内的每个单独数值全被并为本说明书公开公开的一部分,如同其在本文中一一被指称。
本文所公开公开的替代元件或实施例的群组不应解释为本发明的限制。每个群组成员可被单独地提及和要求保护,或者以与该群组内其他成员或本文中其他元件任意结合的方式被提及和要求保护。基于便利性和/或专利性的理由,群组中的一个或多个成员可以并入在群组中或自群组中删除。当发生任何前述的并入或删除的情况时,说明书应被视为包括修改后的群组,从而满足所附的权利要求中使用的所有马库西式群组的书面说明要件。而说明书中的任何语词即便未见于申请专利范围中,但仍不应解释为实施本发明的必要元素。
如本文所使用的,术语“小孢子灵芝免疫调节蛋白”、“GMI(ganodermamicrosporum immunomodulatory protein)”是指如TW I414307说明书中公开的小孢子灵芝免疫调节蛋白,其是由小孢子灵芝选殖出的免疫调节蛋白或其重组蛋白,该蛋白具有免疫调节剂的功效。
如本文所使用的,术语“钥孔虫戚血蓝蛋白”、“KLH(Keyhole limpethemocyanin)”是在巨型钥孔虫戚(Megathura crenulata)的血淋巴中发现的大的、多次单元的、携氧的金属蛋白。KLH是在分子量约400kDa(例如KLH单体)至约8000kDa(例如KLH二十聚体)的凝聚体中由分子量约350,000至约390,000的次单元组成的异质醣基化蛋白。KLH次单元的每个区域都含有两个共同结合单个氧分子的铜原子。当氧与血蓝蛋白结合时,分子呈现独特的透明乳白蓝色。KLH具有强烈的免疫原性,但不会对人类产生不良的免疫反应。KLH通过一系列步骤从巨型钥孔虫戚的血淋巴中纯化,前述步骤通常包括硫酸铵沉淀和透析,并且可以涉及层析纯化以获得最高纯度。在某些实施例中,KLH纯化还可以包括内毒素移除,但此步骤是非必要的,因为当被注射用于产生抗体时,内毒素可以充当佐剂。在某些实施例中,KLH单体单元聚集成总分子量约4,000kDa至8,000kDa的巨型多聚体(十聚体或二十聚体)。在某些实施例中,较高的KLH多聚体具有约8~10百万的分子量,具有约92~107S的沉降系数。
如本文所使用的,术语“植物性凝血球素”、“PHA(phytohemagglutinin)”是指源自植物的一类能凝集细胞和沉淀单糖或多糖复合物的非免疫来源的非酶蛋白质。由于其对于单糖或多糖复合物特异性结合的能力,使得其在如信息传递、免疫反应、植物防御等诸多信息传递过程中均具有重要作用。同时植物凝集素具有细胞凝集、抗病毒、抗真菌及诱导细胞凋亡或自噬等多种能力。
如本文所使用的,术语“医药组合物”是指本发明的小孢子灵芝免疫调节蛋白(GMI)、钥孔虫戚血蓝蛋白(KLH)和/或与其它化学组分(如医药上可接受的载体、稳定剂、稀释剂、分散剂、悬浮剂、增稠剂和/或赋形剂)的混合物。该医药组合物有助于将小孢子灵芝免疫调节蛋白、钥孔虫戚血蓝蛋白施用于生物体。
用于本发明方法的医药组合物可能适合下列施用途径:鼻腔、吸入、口服、直肠、阴道、胸膜、腹膜、非肠胃道、局部、经皮、肺部、鼻内、口腔、眼部、硬膜外、鞘内、静脉内或其他施用途径。在本发明的方法中有用的组合物,可以直接施用于哺乳动物。其他本发明的制剂包括投射的纳米颗粒(projected nanoparticles)、微球体(microspheres)、脂质体制剂(liposomal preparations)、涂布颗粒(coated particles),聚合物的缀合物(polymerconjugates)及基于免疫学的制剂。
施用途径对于本领域技术人员而言是显而易见的,并取决于许多因素,包括所治疗疾病的类型及严重程度,所治疗的家畜或人类患者的类型及年龄等。
本文所述的医药组合物的制剂,可以通过药理学及药剂学领域所知的或今后所开发的任何方法来制备。一般来说,这样的制备方法包括以下步骤:使活性成分与载体或一种或多种的其他辅助成分结合,接着—如果需要或可行的话—将产品形成或包装成预计的单剂量或多剂量的单元。
如本文所使用的,“单位剂量”是包含有预定量活性成分的医药组合物的离散量(discrete amount)。活性成分的剂量,通常等于会施用于个体的活性成分的剂量,或为该剂量的适当分数(convenient fraction),例如该剂量的一半或三分之一。单位剂量的剂型,可以是用在每日单次给药的剂型,或者是用在每日多次给药(例如,每天约1至4次,或更多次)中一次给药的剂型。当以每日多次的方式来给药时,每次给药的单位剂量剂型可以相同或不同。
如本说明书所使用的,术语“医药上可接受的”是指一种材料,例如载体或稀释剂,该材料可用于本发明的医药组合物,且使该医药组合物可保有其生物活性或性质且相对无毒。即该材料可以施用于个体,但不会引起不希望的生物效应或与医药组合物所含的任何成分以有害的方式相互作用。
在本说明书中所使用的“医药上可接受的载体”包括盐类、材料、组成物或载体,例如填充剂、稀释剂、赋形剂或包封材料,其可让本发明的医药组合物携带或运输到个体体内,使医药组合物发挥其预期的功能。典型地,该医药组合物从一个器官或身体的一部分被携带或运输到另一个器官或身体的另一部分。每种盐类或载体必须是与调配物的其他成分(包括可用于本发明的医药组合物)相容且对受试者无害。可用作载体的材料的实例包括:糖(例如乳糖、葡萄糖及蔗糖)、淀粉(例如玉米淀粉及马铃薯淀粉)、纤维素及其衍生物(例如钠羧甲基纤维素、乙基纤维素及醋酸纤维素)、粉状黄蓍胶、麦芽、明胶、滑石、赋形剂(例如可可脂及栓剂蜡)、油(例如花生油、棉籽油、红花子油、芝麻油、橄榄油、玉米油及大豆油)、二醇类(例如丙二醇)、多元醇(例如甘油、山梨醇、甘露醇及聚乙二醇)、酯类(例如油酸乙酯及月桂酸乙酯)、琼脂、缓冲剂(例如氢氧化镁及氢氧化铝)、表面活性剂、海藻酸、无热原水(pyrogen-free water)、等渗盐水、林格氏溶液(Ringer’s solution)、乙醇、磷酸盐缓冲溶液,以及其他医药调配物中使用的无毒相容物质。
在某些实施例中,可以使用一种或多种医药上可接受的赋形剂或载体来配制本发明的医药组合物。在某些实施例中,本发明的医药组合物包含治疗有效剂量的GMI、KLH、和/或PHA、和/或医药上可接受的载体。医药上可接受的载体是有用的,包含但不限于甘油、水、盐水、乙醇、重组人类白蛋白(如
制剂可以与常规赋形剂(即,适用于本领域已知的口服、非肠胃道的、鼻内,吸入、静脉内、皮下,经肠道(transdermal enteral)或任何其他适合的施用模式)的医药上可接受的有机或无机载体物质混合使用。医药制剂可以经过灭菌处理,并且如果需要的话,可以与辅助剂混合,例如润滑剂、防腐剂、稳定剂、润湿剂、乳化剂、影响渗透压缓冲液的盐类、着色剂、调味剂,和/或赋予香气的物质等。如果需要,还可以将其与其它活性剂(例如其他镇痛剂、抗焦虑剂或安眠剂)进行组合。如本文所使用的,“额外的成分”包括但不限于一种或多种可以用作医药载体的成分。
本发明的医药组合物可以包含占组合物总重量约0.005%至2.0%的防腐剂,防腐剂在暴露于环境污染物的情况下用于防止腐败。根据本发明,有用的防腐剂实例包括但不限于选自于苯甲醇、山梨酸、对羟苯甲酸酯类、咪唑烷基脲(imidurea)及其组合所组成的群组。
本发明的医药组合物的剂型例如但不限于锭剂、胶囊、乳剂、分散剂、悬浮剂、溶液剂、糖浆剂、颗粒剂、经皮贴剂、凝胶剂、粉剂、霜剂、膏剂、栓剂或喷雾剂。
本发明医药制剂的粉剂及颗粒剂,可以使用已知方法制备。该制剂可以直接施用于个体,例如用于形成锭剂、胶囊、或通过向其中加入水性或油性载体来制备水性或油性悬浮液或溶液。这些制剂中的每一种均可进一步包含一种或多种分散剂或润湿剂、悬浮剂、离子型及非离子型表面活性剂,以及防腐剂。这些制剂中还可以包括额外的赋形剂,例如填充剂及甜味剂、调味剂或着色剂。
悬浮剂可以使用常规方法制备,以使活性成分悬浮在水性或油性载体中。水性载体包括例如水及等渗盐水。油性载体包括例如杏仁油、油性酯、乙醇,植物油(例如花生油、橄榄油、芝麻油或椰子油)、分馏的植物油,及矿物油(例如液体石蜡)。液体悬浮液可进一步包含一种或多种额外的成分,包括但不限于悬浮剂、分散剂或润湿剂、乳化剂、缓和剂、防腐剂、缓冲剂、盐类、调味剂、着色剂及甜味剂。油性悬浮液可以进一步包含增稠剂。已知的悬浮剂包括但不限于山梨醇糖浆、氢化食用脂肪、海藻酸钠、聚乙烯吡咯烷酮、黄蓍胶、阿拉伯胶,及纤维素衍生物(如羧甲基纤维素钠、甲基纤维素、羟丙基甲基纤维素)。已知的分散剂或湿润剂包括但不限于天然存在的磷脂如卵磷脂、烯化氧与下列物质的缩合产物:脂肪酸、长链脂肪醇、衍生自脂肪酸及己糖醇的部分酯类、或衍生自脂肪酸及己糖醇酐(hexitolanhydride)的部分酯类(例如聚乙二醇硬脂酸酯、十七烷乙烯氧基鲸蜡醇(heptadecaethyleneoxycetanol)、聚氧乙烯山梨糖醇单油酸酯,及聚氧乙烯山梨糖醇酐单油酸酯)。已知的乳化剂包括但不限于卵磷脂、阿拉伯胶及离子或非离子表面活性剂。已知的防腐剂包括但不限于甲基、乙基或正丙基对羟基苯甲酸盐、抗坏血酸及山梨酸。已知的甜味剂包括例如甘油、丙二醇,山梨醇、蔗糖及糖精。
活性成分在水性或油性溶剂中的液态溶液,可以用与液态悬浮液基本上相同的方式制备,主要区别在于活性成分是溶解而非悬浮在溶剂中。如本文所使用的,“油性”液体是一种包括含碳液态分子的液体,并且表现出比水小的极性。本发明医药组合物的液态溶液,可以包含每种与液态悬浮液描述相关的成分。应该理解的是,悬浮剂不一定有助于活性成分在溶剂中的溶解。水性溶剂包括例如水及等渗盐水。油性溶剂包括例如杏仁油、油性酯、乙醇,植物油(例如花生油、橄榄油、芝麻油或椰子油)、分馏的植物油,及矿物油(例如液体石蜡)。
本发明的医药组合物也可以以水包油乳剂或油包水乳剂的形式来制备、包装或销售。油相可以是植物油(如橄榄油或花生油)、矿物油(如液体石蜡),或其组合。组合物可以进一步包含一种或多种乳化剂,例如天然存在的树胶(例如阿拉伯胶或黄蓍胶)、天然存在的磷脂(例如大豆或卵磷脂)、由脂肪酸与己糖醇酐组合得到的酯类或部分酯类,例如山梨糖醇酐单油酸酯及该部分酯类与环氧乙烷的缩合产物(如聚氧乙烯山梨糖醇酐单油酸酯)。这些乳剂还可以包含额外的成分,包括例如甜味剂或调味剂。
以化学组合物来浸渍或涂布材料的方法是本领域已知的,并且包括但不限于将化学组合物沉积或结合到表面上的方法、在合成中将化学组合物结合到材料结构中的方法(即例如用生理上可降解的材料)、以及将水性或油性溶液或悬浮液吸收到吸收材料中的方法,有或无后续的干燥。如本领域技术人员已知用于混合组分的方法,包括物理研磨、在固体及悬浮液制剂中使用颗粒、以及在经皮贴片中混合。
如本说明书所使用的,术语“治/处理”、“治疗”及“治疗方法”是指通过向个体施用药剂或医药组合物,来降低个体所经历疾病或病症症状的频率或严重程度。
如本说明书所使用的,术语“个体”、“受试个体”、“受试者”、“患者”可以是人类或非人类哺乳动物。非人类哺乳动物包括例如家畜和宠物,例如羊、牛、猪、犬科动物、猫科动物和鼠类哺乳动物。优选地,个体是人类。
如本文所使用的,术语“癌症”包括任何恶性肿瘤,包括但不限于癌(carcinoma)、肉瘤(sarcoma)。癌症起因于细胞不受控制和/或异常分裂,然后侵入并破坏周围组织。如本文所使用的,“增生”和“增殖”是指进行有丝分裂的细胞。如本文所使用的,“转移”是指恶性肿瘤远离其起源区域。癌细胞可以通过血流、通过淋巴系统、穿过体腔或其任何组合而转移。
术语“癌”是指恶性新生长,其倾向于渗入周围组织的上皮细胞并且引起转移。
术语“癌症疫苗”是指一种疫苗,其会刺激免疫系统以对抗癌症,或对抗有助于癌症发展的介质。有两种广泛类型的癌症疫苗:预防性癌症疫苗,其旨在避免癌症在健康受试者中发展;和治疗性癌症疫苗,其旨在通过加强身体对抗癌症的天然防御,来治疗现有的癌症(Lollini et al.,Nature Reviews Cancer,2006;6(3):204–216)。如本文所使用的,术语“癌症疫苗”应被解释为包括预防性和治疗性癌症疫苗。
范围:在本发明全文中,各个实施例可以以范围的形式呈现。应该理解的是,范围形式的描述仅仅是为了方便及简洁,不应该被解释为对本发明范围的限制。因此,范围的描述应被视为是具体公开了所有可能的子范围以及该范围内的单一数值。例如,从1到5的范围的描述应该被视为具有特定公开的子范围,例如1到3、1到4、1到5、2到4、2到5、3到5等,以及在该范围内的单一及部分数字,例如1、2、2.5、3、4及5。无论何种大小的范围均适用。
在本实施例中所使用的小孢子灵芝免疫调节蛋白(GMI)(如TW I414307说明书中公开的小孢子灵芝免疫调节蛋白),其具有抑制肿瘤细胞生长的效果。其主要可以通过上皮细胞生长因子受体(EGFR)信号传导途径,来制止由上皮细胞生长因子所诱发的肿瘤细胞生长,进而制止癌症转移(metastasis)及浸润(infiltration)。
根据本发明的一种医药组合物,其包括小孢子灵芝免疫调节蛋白(GMI)以及钥孔虫戚血蓝蛋白(KLH)。
在本实施例中,小孢子灵芝免疫调节蛋白的剂量在5微克/毫升至200微克/毫升之间。优选的,小孢子灵芝免疫调节蛋白的剂量可以是5微克/毫升、10微克/毫升、15微克/毫升、20微克/毫升、25微克/毫升、30微克/毫升、35微克/毫升、40微克/毫升、45微克/毫升、50微克/毫升、55微克/毫升、60微克/毫升、65微克/毫升、70微克/毫升、75微克/毫升、80微克/毫升、85微克/毫升、90微克/毫升、95微克/毫升、100微克/毫升、105微克/毫升、110微克/毫升、115微克/毫升、120微克/毫升、125微克/毫升、130微克/毫升、135微克/毫升、140微克/毫升、145微克/毫升、150微克/毫升、155微克/毫升、160微克/毫升、165微克/毫升、170微克/毫升、175微克/毫升、180微克/毫升、185微克/毫升、190微克/毫升、195微克/毫升、200微克/毫升或前述任两个数值之间所涵盖的任意数值及范围。当然,小孢子灵芝免疫调节蛋白的剂量可能会随配合的处理上的载体、投予路径或有需要的个体及其生理状况的不同而有所变化。
在本实施例中,钥孔虫戚血蓝蛋白的剂量在10微克/毫升至200微克/毫升之间。优选的,钥孔虫戚血蓝蛋白的剂量可以是10微克/毫升、15微克/毫升、20微克/毫升、25微克/毫升、30微克/毫升、35微克/毫升、40微克/毫升、45微克/毫升、50微克/毫升、55微克/毫升、60微克/毫升、65微克/毫升、70微克/毫升、75微克/毫升、80微克/毫升、85微克/毫升、90微克/毫升、95微克/毫升、100微克/毫升、105微克/毫升、110微克/毫升、115微克/毫升、120微克/毫升、125微克/毫升、130微克/毫升、135微克/毫升、140微克/毫升、145微克/毫升、150微克/毫升、155微克/毫升、160微克/毫升、165微克/毫升、170微克/毫升、175微克/毫升、180微克/毫升、185微克/毫升、190微克/毫升、195微克/毫升、200微克/毫升或前述任两个数值之间所涵盖的任意数值及范围。当然,钥孔虫戚血蓝蛋白的剂量可能会随配合的处理上的小孢子灵芝免疫调节蛋白、载体、投予路径或有需要的个体及其生理状况的不同而有所变化。
在本实施例中,小孢子灵芝免疫调节蛋白与钥孔虫戚血蓝蛋白的重量比例在20:1至1:40之间。优选的,小孢子灵芝免疫调节蛋白与钥孔虫戚血蓝蛋白的重量比例可以是20:1、19:1、18:1、17:1、16:1、15:1、14:1、13:1、12:1、11:1、10:1、9:1、8:1、7:1、6:1、5:1、4:1、3:1、2:1、1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:11、1:12、1:13、1:14、1:15、1:16、1:17、1:18、1:19、1:20、1:21、1:22、1:23、1:24、1:25、1:26、1:27、1:28、1:29、1:30、1:31、1:32、1:33、1:34、1:35、1:36、1:37、1:38、1:39、1:40或前述任两个比例之间所涵盖的任意数值及范围。当然,小孢子灵芝免疫调节蛋白与钥孔虫戚血蓝蛋白的重量比例可能会随配合的处理上的载体、投予路径或有需要的个体及其生理状况的不同而有所变化。
在本实施例中,医药组合物还可包括植物性凝血球素(PHA,phytohemagglutinin)。
在本实施例中,植物性凝血球素的剂量在1微克/毫升至20微克/毫升之间。优选的,植物性凝血球素的剂量可以是1微克/毫升、2微克/毫升、3微克/毫升、4微克/毫升、5微克/毫升、6微克/毫升、7微克/毫升、8微克/毫升、9微克/毫升、10微克/毫升、11微克/毫升、12微克/毫升、13微克/毫升、14微克/毫升、15微克/毫升、16微克/毫升、17微克/毫升、18微克/毫升、19微克/毫升、20微克/毫升或前述任两个数值之间所涵盖的任意数值及范围。当然,植物性凝血球素的剂量可能会随配合的处理上的小孢子灵芝免疫调节蛋白、载体、投予路径或有需要的个体及其生理状况的不同而有所变化。
在本实施例中,小孢子灵芝免疫调节蛋白与植物性凝血球素的重量比例在200:1至1:4之间。优选的,小孢子灵芝免疫调节蛋白与植物性凝血球素的重量比例可以是200:1、195:1、190:1、185:1、180:1、175:1、170:1、165:1、160:1、155:1、150:1、145:1、140:1、135:1、130:1、125:1、120:1、115:1、110:1、105:1、100:1、95:1、90:1、85:1、80:1、75:1、70:1、65:1、60:1、55:1、50:1、45:1、40:1、35:1、30:1、25:1、20:1、15:1、10:1、5:1、4:1、3:1、2:1、1:1、1:2、1:3、1:4或前述任两个比例之间所涵盖的任意数值及范围。当然,小孢子灵芝免疫调节蛋白与植物性凝血球素的重量比例可能会随配合的处理上的载体、投予路径或有需要的个体及其生理状况的不同而有所变化。
在本实施例中,钥孔虫戚血蓝蛋白与植物性凝血球素的重量比例在200:1至1:2之间。优选的,钥孔虫戚血蓝蛋白与植物性凝血球素的重量比例可以是200:1、195:1、190:1、185:1、180:1、175:1、170:1、165:1、160:1、155:1、150:1、145:1、140:1、135:1、130:1、125:1、120:1、115:1、110:1、105:1、100:1、95:1、90:1、85:1、80:1、75:1、70:1、65:1、60:1、55:1、50:1、45:1、40:1、35:1、30:1、25:1、20:1、15:1、10:1、5:1、4:1、3:1、2:1、1:1、1:2或前述任两个比例之间所涵盖的任意数值及范围。当然,钥孔虫戚血蓝蛋白与植物性凝血球素的重量比例可能会随配合的处理上的载体、投予路径或有需要的个体及其生理状况的不同而有所变化。
在本实施例中,医药组合物的剂型例如但不限于为锭剂、胶囊、乳剂、分散剂、悬浮剂、溶液剂、糖浆剂、颗粒剂、经皮贴剂、凝胶剂、粉剂、霜剂、膏剂、栓剂或喷雾剂。优选的,医药组合物的剂型可以是分散剂、悬浮剂或溶液剂。
本发明另提供一种小孢子灵芝免疫调节蛋白(GMI)与钥孔虫戚血蓝蛋白(KLH)用于制备治疗上皮细胞癌的医药组合物的用途,其中医药组合物包括小孢子灵芝免疫调节蛋白以及钥孔虫戚血蓝蛋白。另外,本发明再提供一种用于治疗罹患上皮细胞癌的患者的方法,包括提供医药组合物,医药组合物包括小孢子灵芝免疫调节蛋白以及钥孔虫戚血蓝蛋白。医药组合物的剂量、载体的种类、剂型及其他性质与前述说明的医药组合物大致相同,可参考前述,在此不再赘述。
在本实施例中,上皮细胞癌例如但不限于为肺癌、乳癌、口腔癌、食道癌、胃癌、大肠癌、肝癌、子宫颈癌、膀胱癌、胰脏癌或皮肤癌。优选的,上皮细胞癌可以是肺癌、乳癌、胰脏癌或膀胱癌。
承上所述,根据本发明的医药组合物及其制备用途,能够达到治疗上皮细胞癌的功效。
以下实验例用来说明本发明的用途及医药组合物,对于上皮细胞癌的治疗效果,提供了显著的功效。
材料与方法
细胞株:肺癌细胞株A549(购自ATCC),参照Cooper JR.等人,于PLoS One.2016Oct28;11(10):e0164438中所述的培养方法,在37℃/5%CO
人类周边血液单核细胞(PBMC)细胞:取自捐赠者的全血样品,以Ficoll进行离心来分离出PBMC细胞,并加入冷冻保存培养基进行冷冻保存,于后续实验时再解冻使用。以Ficoll分离PBMC及冷冻保存的方法为本领域通常知识者根据熟知实验方法可完成,在此不赘述。其中,Ficoll购自GE Healthcare。
流式细胞仪试剂配置:使用7-AAD/CFSE Cell-Mediated Cytotoxicity AssayKit(购自ImmunoChemistry Technologies LLC.,Cat:#969),先将10×Assay Buffer稀释为1×Assay Buffer备用(将4毫升的10×Assay Buffer加入36毫升的灭菌水中)。接着,将CFSE(原管)以200微升的DMSO回溶后,以1×Assay Buffer进行1:125稀释以配置20×CFSE染剂(8uL CFSE+992uL 1×Assay Buffer);将7-AAD(原管)以260微升的DMSO回溶后,以1×Assay Buffer进行1:10稀释以配置21×7-AAD染剂(40uL 7-AAD+360uL 1×AssayBuffer)。
处理组别配置:(1)1毫升细胞培养基(对照组)、(2)1毫升细胞培养基混合有10微克或20微克的PHA,以配制PHA浓度为10微克/毫升(低剂量PHA组)或20微克/毫升的组别(高剂量PHA组)、(3)1毫升细胞培养基混合有100微克或200微克的KLH,以配制KLH浓度为100微克/毫升(低剂量KLH组)或200微克/毫升的组别(高剂量KLH组)、(4)1毫升细胞培养基混合有20微克或200微克的GMI,以配制GMI浓度为20微克/毫升(低剂量GMI组)或200微克/毫升的组别(高剂量GMI组)、(5)1毫升细胞培养基混合有10微克或20微克的PHA、100微克或200微克的KLH及20微克或200微克的GMI,以配制PHA浓度为10微克/毫升、KLH浓度为100微克/毫升且GMI浓度为20微克/毫升的组别(低剂量医药组合物组)或PHA浓度为20微克/毫升、KLH浓度为200微克/毫升且GMI浓度为200微克/毫升的组别(高剂量医药组合物组)。其中,PHA购自SIGMA-ALDRICH,Cat:L8902;KLH
实验例一:GMI、KLH、PHA及医药组合物对于PBMC细胞的影响
将PBMC以1×10
拍照后,将细胞收集至微量离心管中,在4℃下进行7-AAD染色10分钟。随后,以流式细胞仪进行分析(BD Accuri C6),设定FL-1channel(绿色荧光)以检测细胞内是否有CFSE的荧光;FL-3channel(红色荧光)以检测细胞内是否有7-AAD的荧光。流式细胞仪分析的结果如图1B所示,横轴为CFSE的荧光强度、纵轴为7-AAD的荧光强度,因PBMC细胞仅以7-AAD染色,因此未检测到CFSE荧光。AAD
请参照图1C,与对照组相比,仅低剂量与高剂量的PHA组(图中标示为PHA组-1、PHA组-2)、低剂量GMI组(图中标示为GMI组-1)与低剂量医药组合物组(图中标示为医药组合物组-1),会造成少部分PBMC毒杀情形,而其他各组对PBMC的毒杀情况影响不大。根据图1A至图1C的结果可得知,PHA、KLH、GMI及医药组合物的处理,对于PBMC的存活率影响不大,且会增加PBMC的免疫反应。
实验例二:PHA、KLH、GMI及医药组合物对于A549细胞(肺癌细胞)的影响
将A549细胞以1×10
接着,将A549细胞分成2种处理组别,其一为A549细胞处理组(不与PBMC共同培养);其二为A549+PBMC处理组(A549与PBMC共同培养,以模拟肿瘤在生物体内的环境)。
关于A549细胞处理组:
根据不同组别依次加入(1)0.3毫升细胞培养基(对照组)、(2)0.3毫升混合有PHA的细胞培养基(PHA组)、(3)0.3毫升混合有KLH的细胞培养基(KLH组)、(4)0.3毫升混合有GMI的细胞培养基(GMI组)、(5)0.3毫升混合有PHA、KLH及GMI的细胞培养基(医药组合物组),置于37℃/5%CO
拍照后,将0.3mL DPBS收集至微量离心管中,在每个孔中加入200uL Accutase
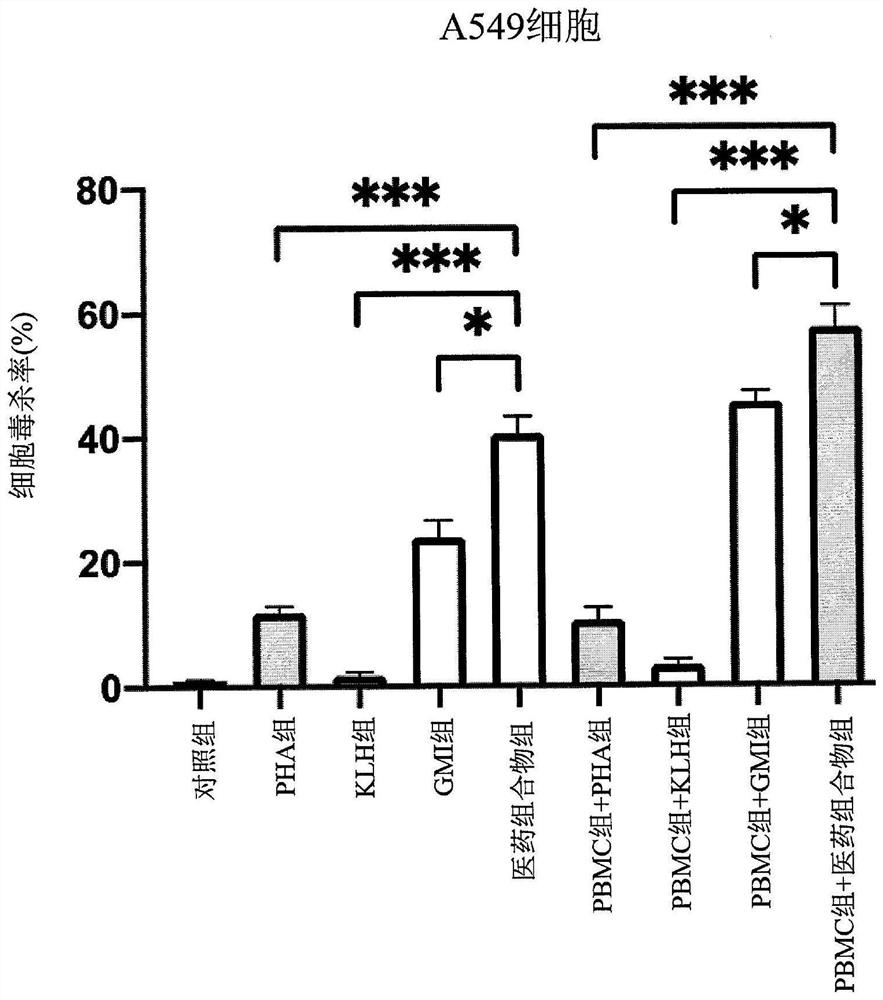
请参照图2C至图2F,在图2C及图2E中,PHA组为10微克/毫升的PHA、KLH组为100微克/毫升的KLH、GMI组为20微克/毫升GMI、医药组合物组为10微克/毫升的PHA+100微克/毫升的KLH+20微克/毫升GMI。在图2D及图2F中,PHA组为20微克/毫升的PHA、KLH组为200微克/毫升的KLH、GMI组为200微克/毫升GMI、医药组合物组为20微克/毫升的PHA+200微克/毫升的KLH+200微克/毫升GMI。在图2C中,以流式细胞仪进行一组重复实验所得到的对照组、PHA组、KLH组、GMI组及医药组合物组的细胞毒杀率分别为0.9%、4.6%、1.0%、8.1%及17.4%。如图2E所示,在低剂量的处理下,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组对肺癌细胞有部分毒杀作用,KLH组对肺癌细胞的毒杀效果不大;GMI组对肺癌细胞的毒杀效果较好,而医药组合物组对肺癌细胞的毒杀效果相较于GMI组更为显著,显示医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于A549细胞的毒杀现象更明显且具有显著差异,让肺癌细胞死亡的现象更显著,使得治疗肺癌的效果更好。另外,在图2D高剂量组别中,以流式细胞仪进行一组重复实验所得到的对照组、PHA组、KLH组、GMI组及医药组合物组的细胞毒杀率分别为0.9%、13.8%、1.4%、29.3%及39.5%。由图2F的结果所示,在高剂量的处理下,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组对肺癌细胞有部分毒杀作用,KLH组对肺癌细胞毒杀效果不大;GMI组对肺癌细胞的毒杀效果较好,而医药组合物组对肺癌细胞的毒杀效果相较于GMI组更为显著,显示医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于A549细胞的毒杀现象更明显且具有显著差异,让肺癌细胞死亡的现象更显著,使得治疗肺癌的效果更好。与图2E的低剂量组别处理的结果相比,图2F高剂量组别的结果显示,当医药组合物组的剂量提高时,其造成肺癌细胞死亡的现象更显著。在图2E及图2F中,*表示两组之间进行比较,P<0.05;**表示两组之间进行比较,P<0.01;***表示两组之间进行比较,P<0.001;每个实验都进行了三组独立试验,误差杠表示平均值标准误差(standarderror of the mean,SEM)。
关于A549+PBMC处理组:
将PBMC以1×10
拍照后,将0.3mL DPBS收集至微量离心管中,在每个孔中加入200uL Accutase
请再参照图2C至图2F,在图2C中(图中显示为PBMC+PHA组、PBMC+KLH组、PBMC+GMI组、PBMC+医药组合物组),为在有PBMC的处理状况下,同时给予低剂量的处理,以流式细胞仪进行一组重复实验所得到的对照组、PBMC+PHA组、PBMC+KLH组、PBMC+GMI组及PBMC+医药组合物组的细胞毒杀率分别为0.9%、4.7%、2.7%、18.6%及22.5%。如图2E所示,在有PBMC的处理状况下,同时给予低剂量的处理,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组对肺癌细胞有部分毒杀作用,KLH组对肺癌细胞的毒杀效果不大;GMI组对肺癌细胞的毒杀效果较好,而医药组合物组对肺癌细胞的毒杀效果相较于GMI组更为显著,显示在有PBMC的情况下,医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于A549细胞的毒杀现象更明显且具有显著差异,让肺癌细胞死亡的现象更显著,使得治疗肺癌的效果更好。另外,在图2D中(图中显示为PBMC+PHA组、PBMC+KLH组、PBMC+GMI组、PBMC+医药组合物组),为在有PBMC的处理状况下,同时给予高剂量的处理,以流式细胞仪进行一组重复实验所得到的对照组、PBMC+PHA组、PBMC+KLH组、PBMC+GMI组及PBMC+医药组合物组的细胞毒杀率分别为0.9%、13.9%、4.7%、48.6%及55%。由图2F的结果所示,在有PBMC的处理状况下,同时给予高剂量的处理,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组对肺癌细胞有部分毒杀作用,KLH组对肺癌细胞毒杀效果不大;GMI组对肺癌细胞的毒杀效果较好,而医药组合物组造成肺癌细胞毒杀现象相较于GMI组更为显著,显示医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于A549细胞的毒杀现象更明显且具有显著差异,让肺癌细胞死亡的现象更显著,使得治疗肺癌的效果更好。在有PBMC的情况下,与图2E的低剂量组别处理的结果相比,图2F高剂量组别的结果显示,当医药组合物组的剂量提高时,其造成肺癌细胞死亡的现象更显著。
本发明的医药组合物对于A549的细胞毒杀具有协同作用:
两种以上药物对生物活性的效应,具有三种不同作用:(1)协同作用(synergism);(2)加成作用(additive effect)和(3)拮抗作用(antagonism)。根据Chou TC等人于Quantitative analysis of dose-effect relationships:the combined effects ofmultiple drugs or enzyme inhibitors,Adv Enzyme Regul,Vol.22,1984,pp.27-55的文献及Liang Zhao等人于AuEvaluation of Combination Chemotherapy:Integration ofNonlinear Regression,Curve Shift,Isobologram,and Combination Index Analysis,Clinical Cancer Research,Vol.10,2004,pp.7994-8004的文献所提出的药物联用指数(combination index,CI),可用来分析评估两种药物间的相互作用,其评估的计算公式为:CI=C
在本实验例中,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果如图2E及图2F所示,对照组A549细胞毒杀率为0.97%,若单独使用10微克/毫升PHA、100微克/毫升KLH或20微克/毫升GMI,其对A549细胞毒杀率分别是5.23%、2.3%及9.23%。在医药组合物组(10微克/毫升的PHA+100微克/毫升的KLH+20微克/毫升GMI)的部分,其对A549细胞的毒杀率则为17.28%。另外单独使用20微克/毫升PHA、200微克/毫升KLH或200微克/毫升GMI,其对A549细胞毒杀率分别是11.83%、1.7%及23.83%。在医药组合物组(20微克/毫升的PHA+200微克/毫升的KLH+200微克/毫升GMI)的部分,其对A549细胞的毒杀率则为40.53%。利用这些数值分别计算出PHA、KLH及GMI的细胞毒杀线性方程式。以低剂量医药组合物组(10微克/毫升的PHA+100微克/毫升的KLH+20微克/毫升GMI)对A549细胞的毒杀率则为17.28%为例,将17.28%分别代入PHA、KLH及GMI的线性方程式y值中,分别得到IC
实验例三:PHA、KLH、GMI及医药组合物对于MDA-MB-231细胞(人类乳腺癌细胞)的影响
本实验例的MDA-MB-231细胞的实验方法,与实验例二相同,差异仅在于以MDA-MB-231细胞取代A549细胞,进行相同的实验,故在此不再重复赘述实验的细节流程。
关于MDA-MB-231细胞处理组的实验结果:
请参照图3A及图3B,图3A及图3B为以本发明医药组合物、PHA、KLH及GMI处理人类乳腺癌细胞株(MDA-MB-231细胞)的研究结果,其为以光学显微镜进行观察的细胞照片。图3A为低剂量处理的组别,图3B为高剂量处理的组别。在图3A中,PHA组为10微克/毫升的PHA、KLH组为100微克/毫升的KLH、GMI组为20微克/毫升GMI、医药组合物组为10微克/毫升的PHA+100微克/毫升的KLH+20微克/毫升GMI。在图3B中,PHA组为20微克/毫升的PHA、KLH组为200微克/毫升的KLH、GMI组为200微克/毫升GMI、医药组合物组为20微克/毫升的PHA+200微克/毫升的KLH+200微克/毫升GMI。从显微镜观察的结果显示,无论是高剂量或低剂量,PHA组及KLH组相较于对照组而言,贴附的细胞数量变化不大,也就是说,这2个处理对于MDA-MB-231细胞毒杀效果不大。而GMI组及医药组合物组相较于对照组而言,贴附的细胞数量明显变少,显示这2个处理对于MDA-MB-231细胞具有毒杀效果。
请参照图3C至图3F,在图3C及图3E中,PHA组为10微克/毫升的PHA、KLH组为100微克/毫升的KLH、GMI组为20微克/毫升GMI、医药组合物组为10微克/毫升的PHA+100微克/毫升的KLH+20微克/毫升GMI。在图3D及图3F中,PHA组为20微克/毫升的PHA、KLH组为200微克/毫升的KLH、GMI组为200微克/毫升GMI、医药组合物组为20微克/毫升的PHA+200微克/毫升的KLH+200微克/毫升GMI。如图3C所示,以流式细胞仪进行一组重复实验所得到的对照组、PHA组、KLH组、GMI组及医药组合物组的细胞毒杀率分别为1.8%、5.4%、2.8%、44.7%及54.5%。如图3E所示,在低剂量的处理下,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组及KLH组对乳腺癌细胞的毒杀效果不大;GMI组对乳腺癌细胞的毒杀效果较好,而医药组合物组对乳腺癌细胞的毒杀效果相较于GMI组更为显著,显示医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于MDA-MB-231细胞的毒杀现象更明显且具有显著差异,让乳腺癌细胞死亡的现象更显著,使得治疗乳腺癌的效果更好。另外,在图3D高剂量组别中,以流式细胞仪进行一组重复实验所得到的对照组、PHA组、KLH组、GMI组及医药组合物组的细胞毒杀率分别为1.8%、14.7%、3.0%、40.8%及55.7%。由图3F的结果所示,在高剂量的处理下,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组对乳腺癌细胞有部分毒杀作用,KLH组对乳腺癌细胞毒杀效果不大;GMI组对乳腺癌细胞的毒杀效果较好,而医药组合物组对乳腺癌细胞的毒杀效果相较于GMI组更为显著,显示医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于MDA-MB-231细胞的毒杀现象更明显且具有显著差异,让乳腺癌细胞死亡的现象更显著,使得治疗乳腺癌的效果更好。与图3E的低剂量组别处理的结果相比,图3F高剂量组别的结果显示,当医药组合物组的剂量提高时,其造成乳腺癌细胞死亡的现象更显著。在图3E及图3F中,*表示两组之间进行比较,P<0.05;***表示两组之间进行比较,P<0.001;每个实验都进行了三组独立试验,误差杠表示平均值标准误差。
关于MDA-MB-231+PBMC处理组的实验结果:
请再参照图3A及图3B中,有加入PBMC的组别(图中显示为PBMC+PHA组、PBMC+KLH组、PBMC+GMI组、PBMC+医药组合物组)。从显微镜观察的结果显示,无论是高剂量或低剂量,PBMC+PHA组及PBMC+KLH组相较于对照组而言,其贴附的细胞数量变化不大,也就是说,这2个处理对于MDA-MB-231细胞毒杀效果不大。而PBMC+GMI组及PBMC+医药组合物组相较于对照组而言,其贴附的细胞数量明显变少,显示这2个处理对于MDA-MB-231细胞具有毒杀效果。
请再参照图3C至图3F,在图3C中(图中显示为PBMC+PHA组、PBMC+KLH组、PBMC+GMI组、PBMC+医药组合物组),为在有PBMC的处理状况下,同时给予低剂量的处理,以流式细胞仪进行一组重复实验所得到的对照组、PBMC+PHA组、PBMC+KLH组、PBMC+GMI组及PBMC+医药组合物组的细胞毒杀率分别为1.8%、32.4%、4.4%、64.4%及73.0%。如图3E所示,在有PBMC的处理状况下,同时给予低剂量的处理,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组对乳腺癌细胞有部分毒杀作用,KLH组对乳腺癌细胞的毒杀效果不大;GMI组对乳腺癌细胞的毒杀效果较好,而医药组合物组对乳腺癌细胞的毒杀效果相较于GMI组更为显著,显示在有PBMC的情况下,医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于MDA-MB-231细胞的毒杀现象更明显且具有显著差异,让乳腺癌细胞死亡的现象更显著,使得治疗乳腺癌的效果更好。另外,在图3D中(图中显示为PBMC+PHA组、PBMC+KLH组、PBMC+GMI组、PBMC+医药组合物组),为在有PBMC的处理状况下,同时给予高剂量的处理,以流式细胞仪进行一组重复实验所得到的对照组、PBMC+PHA组、PBMC+KLH组、PBMC+GMI组及PBMC+医药组合物组的细胞毒杀率分别为1.8%、48.5%、4.3%、59.0%及64.7%。由图3F的结果所示,在有PBMC的处理状况下,同时给予高剂量的处理,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组对乳腺癌细胞有部分毒杀作用,KLH组对乳腺癌细胞毒杀效果不大;GMI组对乳腺癌细胞的毒杀效果较好,而医药组合物组造成乳腺癌细胞毒杀现象相较于GMI组更为显著,显示医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于MDA-MB-231细胞的毒杀现象更明显且具有显著差异,让乳腺癌细胞死亡的现象更显著,使得治疗乳腺癌的效果更好。
本发明的医药组合物对于MDA-MB-231的细胞毒杀具有协同作用:
在本实验例中,在没有PBMC的情况下,低剂量医药组合物组CI值=0.21;在有PBMC的情况下,低剂量医药组合物组CI值=0.45,结果都<1,显示无论是在无或有PBMC的情况下,相较于单独使用PHA、KLH或GMI,低剂量的医药组合物组毒杀MDA-MB-231细胞都具有协同作用。
实验例四:PHA、KLH、GMI及医药组合物对于T24细胞(人类膀胱癌细胞)的影响
本实验例的T24细胞的实验方法,与实验例二相同,差异仅在于以T24细胞取代A549细胞,进行相同的实验,故在此不再重复赘述实验的细节流程。
关于T24细胞处理组的实验结果:
请参照图4A及图4B,图4A及图4B为以本发明医药组合物、PHA、KLH及GMI处理人类膀胱癌细胞株(T24细胞)的研究结果,其为以光学显微镜进行观察的细胞照片。图4A为低剂量处理的组别,图4B为高剂量处理的组别。在图4A中,PHA组为10微克/毫升的PHA、KLH组为100微克/毫升的KLH、GMI组为20微克/毫升GMI、医药组合物组为10微克/毫升的PHA+100微克/毫升的KLH+20微克/毫升GMI。在图4B中,PHA组为20微克/毫升的PHA、KLH组为200微克/毫升的KLH、GMI组为200微克/毫升GMI、医药组合物组为20微克/毫升的PHA+200微克/毫升的KLH+200微克/毫升GMI。从显微镜观察的结果显示,无论是高剂量或低剂量,PHA组及KLH组相较于对照组而言,贴附的细胞数量变化不大,也就是说,这2个处理对于T24细胞毒杀效果不大。而GMI组及医药组合物组相较于对照组而言,贴附的细胞数量明显变少,显示这2个处理对于T24细胞具有毒杀效果。
请参照图4C至图4F,在图4C及图4E中,PHA组为10微克/毫升的PHA、KLH组为100微克/毫升的KLH、GMI组为20微克/毫升GMI、医药组合物组为10微克/毫升的PHA+100微克/毫升的KLH+20微克/毫升GMI。在图4D及图4F中,PHA组为20微克/毫升的PHA、KLH组为200微克/毫升的KLH、GMI组为200微克/毫升GMI、医药组合物组为20微克/毫升的PHA+200微克/毫升的KLH+200微克/毫升GMI。如图4C所示,以流式细胞仪进行一组重复实验所得到的对照组、PHA组、KLH组、GMI组及医药组合物组的细胞毒杀率分别为3.1%、22.1%、2.8%、50.2%及66.9%。如图4E所示,在低剂量的处理下,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组对膀胱癌细胞有部分毒杀作用,KLH组对膀胱癌细胞的毒杀效果不大;GMI组对膀胱癌细胞的毒杀效果较好,而医药组合物组对膀胱癌细胞的毒杀效果相较于GMI组更为显著,显示医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于T24细胞的毒杀现象更明显且具有显著差异,让膀胱癌细胞死亡的现象更显著,使得治疗膀胱癌的效果更好。另外,在图4D高剂量组别中,以流式细胞仪进行一组重复实验所得到的对照组、PHA组、KLH组、GMI组及医药组合物组的细胞毒杀率分别为3.1%、39.4%、5.9%、61.9%及75.5%。由图4F的结果所示,在高剂量的处理下,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组对膀胱癌细胞有部分毒杀作用,KLH组对膀胱癌细胞毒杀效果不大;GMI组对膀胱癌细胞的毒杀效果较好,而医药组合物组对膀胱癌细胞的毒杀效果相较于GMI组更为显著,显示医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于T24细胞的毒杀现象更明显且具有显著差异,让膀胱癌细胞死亡的现象更显著,使得治疗膀胱癌的效果更好。与图4E的低剂量组别处理的结果相比,图4F高剂量组别的结果显示,当医药组合物组的剂量提高时,其造成膀胱癌细胞死亡的现象更显著。在图4E及图4F中,*表示两组之间进行比较,P<0.05;**表示两组之间进行比较,P<0.01;***表示两组之间进行比较,P<0.001;每个实验都进行了三组独立试验,误差杠表示平均值标准误差。
关于T24+PBMC处理组的实验结果:
请再参照图4A及图4B中,有加入PBMC的组别(图中显示为PBMC+PHA组、PBMC+KLH组、PBMC+GMI组、PBMC+医药组合物组)。从显微镜观察的结果显示,无论是高剂量或低剂量,PBMC+PHA组及PBMC+KLH组相较于对照组而言,其贴附的细胞数量变化不大,也就是说,这2个处理对于T24细胞毒杀效果不大。而PBMC+GMI组及PBMC+医药组合物组相较于对照组而言,其贴附的细胞数量明显变少,显示这2个处理对于T24细胞具有毒杀效果。
请再参照图4C至图4F,在图4C中(图中显示为PBMC+PHA组、PBMC+KLH组、PBMC+GMI组、PBMC+医药组合物组),为在有PBMC的处理状况下,同时给予低剂量的处理,以流式细胞仪进行一组重复实验所得到的对照组、PBMC+PHA组、PBMC+KLH组、PBMC+GMI组及PBMC+医药组合物组的细胞毒杀率分别为3.1%、28%、5.0%、62.3%及68.5%。如图4E所示,在有PBMC的处理状况下,同时给予低剂量的处理,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组对膀胱癌细胞有部分毒杀作用,KLH组对膀胱癌细胞的毒杀效果不大;GMI组对膀胱癌细胞的毒杀效果较好,而医药组合物组对膀胱癌细胞的毒杀效果相较于GMI组更为显著,显示在有PBMC的情况下,医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于T24细胞的毒杀现象更明显且具有显著差异,让膀胱癌细胞死亡的现象更显著,使得治疗膀胱癌的效果更好。另外,在图4D中(图中显示为PBMC+PHA组、PBMC+KLH组、PBMC+GMI组、PBMC+医药组合物组),为在有PBMC的处理状况下,同时给予高剂量的处理,以流式细胞仪进行一组重复实验所得到的对照组、PBMC+PHA组、PBMC+KLH组、PBMC+GMI组及PBMC+医药组合物组的细胞毒杀率分别为3.1%、40.9%、6.9%、80.8%及84.0%。由图4F的结果所示,在有PBMC的处理状况下,同时给予高剂量的处理,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组对膀胱癌细胞有部分毒杀作用,KLH组对膀胱癌细胞毒杀效果不大;GMI组对膀胱癌细胞的毒杀效果较好,而医药组合物组造成膀胱癌细胞毒杀现象相较于GMI组更为显著,显示医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于T24细胞的毒杀现象更明显且具有显著差异,让膀胱癌细胞死亡的现象更显著,使得治疗膀胱癌的效果更好。在有PBMC的情况下,与图4E的低剂量组别处理的结果相比,图4F高剂量组别的结果显示,当医药组合物组的剂量提高时,其造成膀胱癌细胞死亡的现象更显著。
本发明的医药组合物对于T24的细胞毒杀具有协同作用:
在本实验例中,在没有PBMC的情况下,低剂量医药组合物组CI值=0.53;在有PBMC的情况下,低剂量医药组合物组CI值=0.56,结果都<1,显示无论是在无或有PBMC的情况下,相较于单独使用PHA、KLH或GMI,低剂量的医药组合物组毒杀T24细胞都具有协同作用。
实验例五:PHA、KLH、GMI及医药组合物对于BxPC-3细胞(人类胰脏癌细胞)的影响
本实验例的BxPC-3细胞的实验方法,与实验例二相同,差异仅在于以BxPC-3细胞取代A549细胞,进行相同的实验,故在此不再重复赘述实验的细节流程。
关于BxPC-3细胞处理组的实验结果:
请参照图5A及图5B,图5A及图5B为以本发明医药组合物、PHA、KLH及GMI处理人类胰脏癌细胞株(BxPC-3细胞)的研究结果,其为以光学显微镜进行观察的细胞照片。图5为低剂量处理的组别,图5B为高剂量处理的组别。在图5A中,PHA组为10微克/毫升的PHA、KLH组为100微克/毫升的KLH、GMI组为20微克/毫升GMI、医药组合物组为10微克/毫升的PHA+100微克/毫升的KLH+20微克/毫升GMI。在图5B中,PHA组为20微克/毫升的PHA、KLH组为200微克/毫升的KLH、GMI组为200微克/毫升GMI、医药组合物组为20微克/毫升的PHA+200微克/毫升的KLH+200微克/毫升GMI。从显微镜观察的结果显示,无论是高剂量或低剂量,PHA组及KLH组相较于对照组而言,贴附的细胞数量变化不大,也就是说,这2个处理对于BxPC-3细胞毒杀效果不大。而GMI组及医药组合物组相较于对照组而言,贴附的细胞数量明显变少,显示这2个处理对于BxPC-3细胞具有毒杀效果。
请参照图5C至图5F,在图5C及图5E中,PHA组为10微克/毫升的PHA、KLH组为100微克/毫升的KLH、GMI组为20微克/毫升GMI、医药组合物组为10微克/毫升的PHA+100微克/毫升的KLH+20微克/毫升GMI。在图5D及图5F中,PHA组为20微克/毫升的PHA、KLH组为200微克/毫升的KLH、GMI组为200微克/毫升GMI、医药组合物组为20微克/毫升的PHA+200微克/毫升的KLH+200微克/毫升GMI。如图5C所示,以流式细胞仪进行一组重复实验所得到的对照组、PHA组、KLH组、GMI组及医药组合物组的细胞毒杀率分别为7.0%、7.9%、5.2%、14.3%及25%。如图5E所示,在低剂量的处理下,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组及KLH组对胰脏癌细胞的毒杀效果不大;GMI组对胰脏癌细胞的毒杀效果较好,而医药组合物组对胰脏癌细胞的毒杀效果相较于GMI组更为显著,显示医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于BxPC-3细胞的毒杀现象更明显且具有显著差异,让胰脏癌细胞死亡的现象更显著,使得治疗胰脏癌的效果更好。另外,在图5D高剂量组别中,以流式细胞仪进行一组重复实验所得到的对照组、PHA组、KLH组、GMI组及医药组合物组的细胞毒杀率分别为7.0%、12.5%、6.3%、47.2%及60.9%。由图5F的结果所示,在高剂量的处理下,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组对胰脏癌细胞有部分毒杀作用,KLH组对胰脏癌细胞毒杀效果不大;GMI组对胰脏癌细胞的毒杀效果较好,而医药组合物组对胰脏癌细胞的毒杀效果相较于GMI组更为显著,显示医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于BxPC-3细胞的毒杀现象更明显且具有显著差异,让胰脏癌细胞死亡的现象更显著,使得治疗胰脏癌的效果更好。与图5E的低剂量组别处理的结果相比,图5F高剂量组别的结果显示,当医药组合物组的剂量提高时,其造成胰脏癌细胞死亡的现象更显著。在图5E及图5F中,*表示两组之间进行比较,P<0.05;**表示两组之间进行比较,P<0.01;***表示两组之间进行比较,P<0.001;每个实验都进行了三组独立试验,误差杠表示平均值标准误差。
关于BxPC-3+PBMC处理组的实验结果:
请再参照图5A及图5B中,有加入PBMC的组别(图中显示为PBMC+PHA组、PBMC+KLH组、PBMC+GMI组、PBMC+医药组合物组)。从显微镜观察的结果显示,无论是高剂量或低剂量,PBMC+PHA组及PBMC+KLH组相较于对照组而言,其贴附的细胞数量变化不大,也就是说,这2个处理对于BxPC-3细胞毒杀效果不大。而PBMC+GMI组及PBMC+医药组合物组相较于对照组而言,其贴附的细胞数量明显变少,显示这2个处理对于BxPC-3细胞具有毒杀效果。
请再参照图5C至图5F,在图5C中(图中显示为PBMC+PHA组、PBMC+KLH组、PBMC+GMI组、PBMC+医药组合物组),为在有PBMC的处理状况下,同时给予低剂量的处理,以流式细胞仪进行一组重复实验所得到的对照组、PBMC+PHA组、PBMC+KLH组、PBMC+GMI组及PBMC+医药组合物组的细胞毒杀率分别为7.0%、29.4%、7.5%、50.4%及56.7%。如图5E所示,在有PBMC的处理状况下,同时给予低剂量的处理,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组对胰脏癌细胞有部分毒杀作用,KLH组对胰脏癌细胞的毒杀效果不大;GMI组对胰脏癌细胞的毒杀效果较好,而医药组合物组对胰脏癌细胞的毒杀效果相较于GMI组更为显著,显示在有PBMC的情况下,医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于BxPC-3细胞的毒杀现象更明显且具有显著差异,让胰脏癌细胞死亡的现象更显著,使得治疗胰脏癌的效果更好。另外,在图5D中(图中显示为PBMC+PHA组、PBMC+KLH组、PBMC+GMI组、PBMC+医药组合物组),为在有PBMC的处理状况下,同时给予高剂量的处理,以流式细胞仪进行一组重复实验所得到的对照组、PBMC+PHA组、PBMC+KLH组、PBMC+GMI组及PBMC+医药组合物组的细胞毒杀率分别为7.0%、50%、19.5%、51.4%及59.5%。由图5F的结果所示,在有PBMC的处理状况下,同时给予高剂量的处理,以流式细胞仪进行三组重复实验而统计获得的细胞毒杀率结果显示,PHA组对胰脏癌细胞有部分毒杀作用,KLH组对胰脏癌细胞毒杀效果不大;GMI组对胰脏癌细胞的毒杀效果较好,而医药组合物组造成胰脏癌细胞毒杀现象相较于GMI组更为显著,显示医药组合物组(PHA+KLH+GMI)与单独以PHA、KLH、GMI处理的组别相比,对于BxPC-3细胞的毒杀现象更明显且具有显著差异,让胰脏癌细胞死亡的现象更显著,使得治疗胰脏癌的效果更好。在有PBMC的情况下,与图5E的低剂量组别处理的结果相比,图5F高剂量组别的结果显示,当医药组合物组的剂量提高时,其造成胰脏癌细胞死亡的现象更显著。
本发明的医药组合物对于BxPC-3的细胞毒杀具有协同作用:
在本实验例中,在没有PBMC的情况下,低剂量医药组合物组CI值=0.45、高剂量医药组合物组CI值=0.9;在有PBMC的情况下,低剂量医药组合物组CI值=0.52,结果都<1,显示在无PBMC的情况下,相较于单独使用PHA、KLH或GMI,低剂量及高剂量的医药组合物组毒杀BxPC-3细胞都具有协同作用,而在有PBMC的情况下,相较于单独使用PHA、KLH或GMI,低剂量的医药组合物组毒杀BxPC-3细胞具有协同作用。
根据实验例一的结果显示,本发明实施例的医药组合物中的GMI及PHA,可以增加免疫细胞(PBMC)的免疫反应且不影响其细胞存活率。根据实验例二的结果显示,本发明实施例的医药组合物会造成人类肺癌细胞(A549)明显死亡,细胞死亡的现象相较于单独以PHA、KLH、GMI处理的组别来说更为显著,且具有协同作用;另外,随着医药组合物浓度的提高,造成肺癌细胞死亡的现象越显著;再者,医药组合物可增进免疫细胞的免疫反应,以提高其对于肿瘤细胞的毒杀效果。根据实验例三的结果显示,本发明实施例的医药组合物会造成乳腺癌细胞(MDA-MB-231)明显死亡,细胞死亡的现象相较于单独以PHA、KLH、GMI处理的组别来说更为显著,且具有协同作用;另外,随着医药组合物浓度的提高,造成乳腺癌细胞死亡的现象越显著;再者,医药组合物可增进免疫细胞的免疫反应,以提高其对于肿瘤细胞的毒杀效果。根据实验例四的结果显示,本发明实施例的医药组合物会造成膀胱癌细胞(T24)明显死亡,且细胞死亡的现象相较于单独以PHA、KLH、GMI处理的组别来说更为显著,且具有协同作用;另外,随着医药组合物浓度的提高,造成膀胱癌细胞死亡的现象越显著;再者,医药组合物可增进免疫细胞的免疫反应,以提高其对于肿瘤细胞的毒杀效果。根据实验例五的结果显示,本发明实施例的医药组合物会造成胰脏癌细胞(BxPC-3)明显死亡,且细胞死亡的现象相较于单独以PHA、KLH、GMI处理的组别来说更为显著,且具有协同作用;另外,随着医药组合物浓度的提高,造成胰脏癌细胞死亡的现象越显著;再者,医药组合物可增进免疫细胞的免疫反应,以提高其对于肿瘤细胞的毒杀效果。特别地,上述实验例仅用以说明,而非对本发明的限制。
从上述细胞培养试验的数据可用于配制一个范围的剂量用于人体,该医药组合物的剂量优选地在一个范围的循环浓度内,该范围的循环浓度包括ED50且毒性极低或没有毒性,对于人体的治疗有效剂量可以在该范围内变化,取决于所用的剂型和使用的投药途径。对于本发明的方法中使用的医药组合物来说,可以从细胞培养试验估计治疗有效剂量。
综上所述,本发明的医药组合物及其制备用途,能够有效地促进免疫细胞针对肿瘤细胞的特异性主动免疫反应,进而提高医药组合物针对肿瘤细胞的毒杀率,使得肿瘤细胞的存活率下降,达到治疗肿瘤的效果。
以上所述仅是举例性的,而不是限制性的。任何未脱离本发明的精神与范畴而对其进行的等效修改或变更,均应包含在权利要求书的范围内。
- 用于制备治疗上皮细胞癌的医药组合物及其用途
- 一种医药组合物在用于制备治疗皮肤痒的医药组合物中的用途
